-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Celiakia - častá príčina „idiopatickej osteoporózy“ premenopauzálnych a včasne postmenopauzálnych žien
Celiac disease – a frequent cause of „idiopathic osteoporosis“ in premenopausal and early postmenopausal women
Introduction:
Celiac disease (CD) is an autoimmune disease with a wide variety of clinical symptoms. Osteopathy is its possible manifestation in adulthood.Objective:
Verify the assumption, in view of contradictory literary data concerning serological screening for CD in osteoporosis, that the screened group could be women with idiopathic osteoporosis diagnosed in premenopause or within 5 years from its onset.Patient sample and results:
We examined 52 patients with idiopathic osteoporosis detected by a DXA test of LS or the femur in premenopause or within the maximum of 5 years after menopause for the presence of antibodies against gliadins IgA, IgG, endomyzium IgA and transglutaminase IgG. In the case of positive results for any of the antibodies, we also performed gastrofibroscopy and duodenal biopsy. The positivity of antibodies was detected in 21 patients (40.8 %). In 15 (28.8 %) patients, i.e. after the exclusion of Marsh I in 10 patients (19.8 %), histopathology was positive for CD. Significantly higher levels of iPTH (p < 0.001) were detected in patients with CD. We did not find any statistically significant differences in other monitored parameters, i.e. in BMI, S-Ca, S-P, proteins, albumins, immunoglobins IgG, IgA, IgM, dUCa. The differences in the occurrence of prevalent fracture (33.4 or 19.8 %), autoimmune thyreoiditis (20 % or 5.4 %), anemia (33 % or 16.2 %) and dyspepsia (40 % or 24.3 %) were not significant.Conclusion:
The above results confirm the need for serological screening for CD in premenopausal and early postmenopausal patients with „idiopathic osteoporosis“.Key words:
celiac disease – idiopathic osteoporosis – serological screening
Autoři: Ľ. Kubincová 1; J. Payer 2; Z. Killinger 2; I. Mačugová 3; K. Beráková 4
Působiště autorů: Osteologická ambulancia Interného oddelenia, NsP Žilina, Slovenská republika, prednosta prim. MUDr. Vladimír Spišák 1; V. interná klinika Lekárskej fakulty UK a FNsP Bratislava-Ružinov, Slovenská republika, prednosta prof. MUDr. Juraj Payer, CSc. 2; Gastrocentrum NsP Žilina, Slovenská republika, prednosta prim. MUDr. Peter Haupt 3; Patologicko-anatomické oddelenie NsP Čadca, Slovenská republika, prednostka prim. MUDr. Katarína Beráková 4
Vyšlo v časopise: Vnitř Lék 2007; 53(12): 1296-1302
Kategorie: Původní práce
Souhrn
Úvod:
Celiakia (CS) je autoimunitné ochorenie s pestrou škálou klinických prejavov. Možnou manifestáciou v dospelosti je osteopatia.Cieľ:
Vzhľadom k rozporuplným literárnym údajom o sérologickom skríningu CS pri osteoporóze overiť predpoklad, že by skrínovanou skupinou mohli byť ženy s idiopatickou osteoporózou diagnostikovanou v premenopauze, resp. do 5 rokov od jej nástupu.Súbor a výsledky:
Vyšetrili sme 52 pacientiek s idiopatickou osteoporózou dokázanou DXA vyšetrením LS chrbtice, resp. femuru v premenopauze alebo maximálne 5 rokov po menopauze na prítomnosť autoprotilátok proti gliadínom IgA, IgG, endomýziu IgA a transglutamináze IgG. V prípade pozitivity ktorejkoľvek protilátky sme doplnili gastrofibroskopické vyšetrenie s biopsiou duodena. Pozitivitu protilátok sme dokázali u 21 pacientiek (40,8 %). U 15 (28,8 %), resp. po vylúčení nálezu Marsh I u 10 (19,8 %), bol prítomný histopatologický nález potvrdzujúci CS. U pacientiek s CS sme zistili signifikantne vyššie hladiny iPTH (p < 0,001). Nezistili sme štatisticky signifikantné rozdiely v ostatných sledovaných parametroch: BMI, S-Ca, S-P, bielkoviny, albumíny, imunoglobulíny IgG, IgA, IgM, dUCa. Rozdiely vo výskyte prevalentnej zlomeniny (33,4, resp. 19,8 %), autoimúnnej tyreoiditídy (20, resp. 5,4 %), anémie (33, resp. 16,2 %) a dyspepsie (40, resp. 24,3 %) neboli signifikantné.Záver:
Uvedené výsledky potvrdzujú potrebu sérologického skríningu CS u premenopauzálnych a včasne postmenopauzálnych pacientiek s „idiopatickou osteoporózou“.Kľúčové slová:
celiakia - idiopatická osteoporóza - sérologický skríningÚvod
Céliakia (CS), donedávna ochorenie detského veku, predstavuje modelové autoimúnné ochorenie tenkého čreva, ktorého výsledkom je atrofia sliznice navodená reakciou organizmu na prítomnosť lepku v potrave. V dospelosti sú jej prejavy veľmi často extraintestinálne - atypické. Možným prejavom CS je metabolická osteopatia [1-5].
Marsh definuje CS ako primárny malabsorpčný syndróm s rôznym stupňom atrofie sliznice tenkého čreva, ktorá sa plne upraví pri bezlepkovej diéte a po zavedení lepku do diéty dochádza opäť k popísaným klinickým a histologickým zmenám. V 90. rokoch 20. storočia sa potvrdilo, že znovuzavedenie lepku do diéty nie je pre diagnózu CS u chorých s dokázanou atrofiou sliznice čreva, prítomnosťou protilátok a klinickými prejavmi nutné [1-3]. Definitívna diagnóza a klasifikácia je histopatologická (tab. 1) [6]. Klasifikácia bioptického nálezu podľa Marsha-Oberhubera má byť urobená u každého bioptického vyšetrenia tenkého čreva [6,7].
Tab. 1. Marshova histopatologická klasifikácia malabsorpčného syndrómu [6,7,10]. ![Marshova histopatologická klasifikácia malabsorpčného syndrómu [6,7,10].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/a539e11fce2c21ef165b80d8cfc5d796.jpg)
IEL – intraepitelová lymfocytóza, EC – enterocyty Pre mnohotvárnosť foriem a stupňa klinickej manifestácie ostáva CS často nediagnostikovaná. Diagnostikujeme pravdepodobne menej ako 10 % chorých [2]. Hovoríme o fenoméne plávajúceho ľadovca (tab. 2).
Tab. 2. CS – fenomén ľadovca [3,10,11,15]. ![CS – fenomén ľadovca [3,10,11,15].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/7ff824ba46a2c4e6d73f3aa04c207a85.jpg)
RA – rodinná anamnéza, γ/δ IEL – intarepitelová lymfocytóza Pred rokom 1990, keď diagnóza vychádzala len z biopsie duodena, resp. enterobiopsie bez selekcie na základe prítomnosti protilátok, predpokladali sme 0,05% prevalenciu v Európe. Zavedenie sérologických testov, objasnenie etiopatogenézy a poznanie vysokej penetrancie v postihnutých rodinách zmenilo pôvodné predpoklady. Dnes je odhad skutočnej prevalencie CS vo všeobecnej populácii 0,3 - 1 %, podľa niektorých až okolo 2 % [1,3-5].
K diagnostikovaniu CS u pacientov s osteoporózou, ale aj inými atypickými príznakmi, tak dochádzalo v prítomnosti klasického klinického obrazu. Dokladom sú aj u nás publikované kazuistiky [8,9].
Patogenéza poškodenia kosti pri CS je multifaktoriálna. Úlohu zohrávajú systémové i lokálne mechanizmy. Porucha resorpcie v čreve vedie k malabsorpcii kalcia (Ca) a poklesu sérových hladín Ca do subnormálnych hodnôt s následným rozvojom sekundárnej hyperparatyreózy [12,13]. Obmedzenie prísunu Ca v diéte pri často súčasne prítomnom deficite laktázy tiež vedie k hypersekrécii parathormónu (PTH) ako odpovede na hypokalcémiu. PTH indukuje rezorpciu kosti a zvýšenie aktivity 1-α-hydroxylázy, ktorá konvertuje 25-OH D vitamín na 1,25-(OH)2 vitamín D, čo umožňuje zvýšenie črevnej rezorpcie. Tento transport je v zápalom poškodenej črevnej sliznici s následnou atrofiou neefektívny. Skúmanie sérových markerov kostnej remodelácie ukazuje, že osteopatia pri CS je charakterizovaná zvýšením markerov kostnej resorpcie aj novotvorby. Resorpcia je pritom rýchlejšia ako novotvorba, čo vyúsťuje do zvýšenej straty kosti. Za akceleráciu kostného obratu je zodpovedné zvýšenie PTH. Osteopatia pri CS je charakterizovaná vysokoobratovou osteoporózou [14]. Novšie sa venuje pozornosť aj lokálnym mechanizmom poškodenia, keď prozápalové cytokíny Il-1, Il -6 a TNFα, ktorých produkcia bola dokázaná v zápalom postihnutej sliznici čreva a zvýšené hladiny boli nájdené aj v sére celiatikov, zohrávajú úlohu v aktivácii kostných buniek [16]. Iné pozorovanie dokazovalo prítomnosť kosť-špecifických protilátok u pacientov s CS [17]. Predpokladáme výraznejší obraz metabolickej osteopatie u pacientov so symptomatickou malabsorpciou, ale možno ju nájsť aj u pacientov asymptomatických.
Cieľ práce
Upozorniť na výskyt oligosymptomatických foriem CS u pacientiek s „idiopatickou“ osteoporózou a pokúsiť sa zodpovedať otázku vhodnosti, resp. výťažnosti skríningu protilátok využívaných v diagnostike CS u týchto pacientiek.
Charakteristika súboru
Do súboru sme zaradili pacientky už liečené v osteologickej ambulancii, ale i novodiagnostikované spĺňajúce inklúzne a exklúzne kritériá uvedené v tab. 3. To nám dovoľovalo predpokladať vyšší podiel pacientiek s CS.
Tab. 3. Inklúzne a exklúzne kritériá sledovaného súboru. 
Základné charakteristiky súboru sú uvedené v tab. 4.
Tab. 4. Charakteristika súboru. 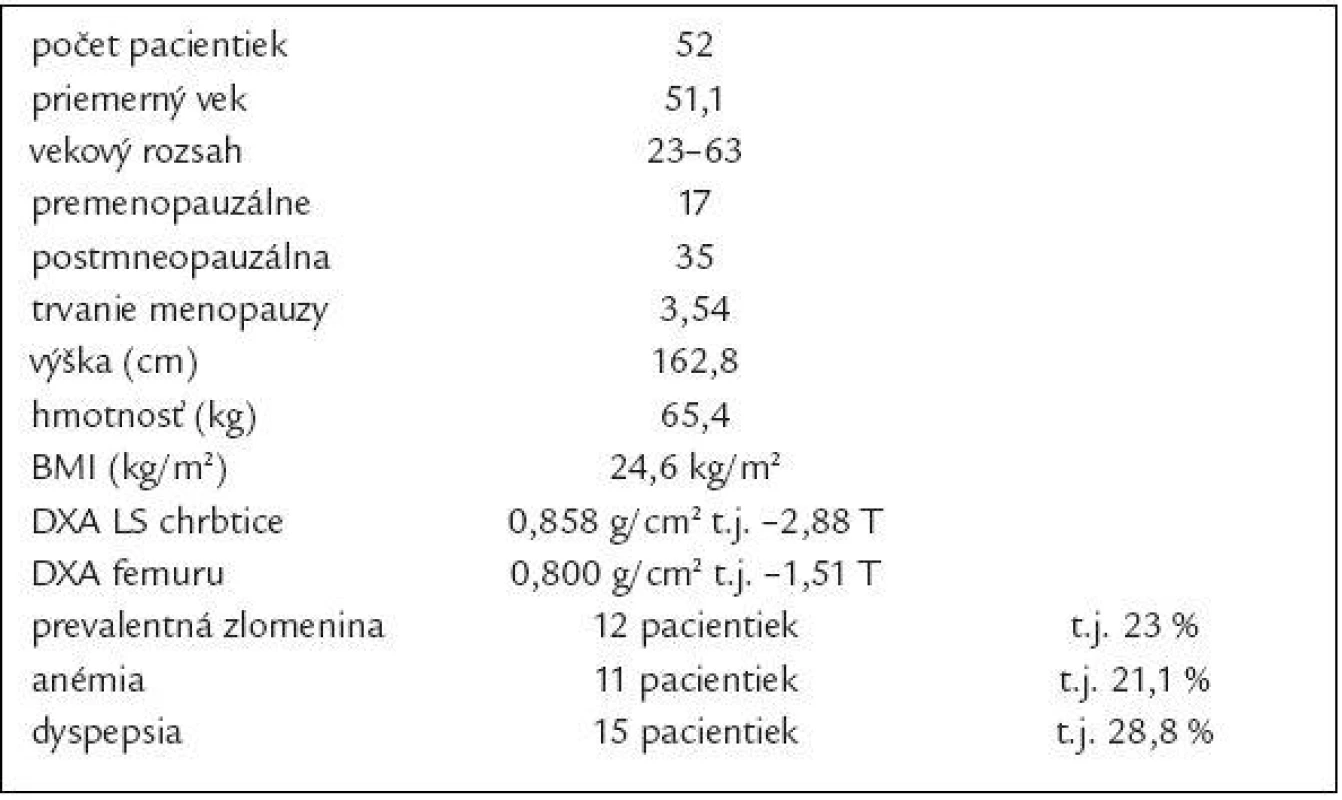
Metodika
Meranie kostnej denzity
Osteoporózu sme diagnostikovali denzitometrickým vyšetrením na prístroji LUNAR DPX na základe kritérií WHO v oblasti LS chrbtice a proximálneho femuru.
Stanovenie protilátok
Antigliadínové protilátky sme vyšetrovali v triede IgA a IgG (AGA IgA, AGA IgG), protilátky proti endomýziu v triede IgA (AEA), protilátky proti transglutamináze IgG (ATG IgG). AGA boli stanovované ELISA metódou laboratórnym testom firmy Biogema, v.d. Košice, ELISA-ANTI-GLIADIN-2-A,G. Na vyšetrenie ATG a AEA boli použité testy firmy Bindingsite, LtD, Birmingham, UK - pre ATG TRANSGLUTAMINASABINDSIME HUMAN ANTITISSUE TRANSGLUTAMIN IGG EIA KIT, pre AEA MONKEY OESOPHAGUS IFA KIT. Pre stanovenie AEA bol použitý imunofixačný test, pre ATG opäť ELISA metóda. V sledovanom časovom období nebolo vždy možné stanovenie všetkých protilátok. Naše laboratórne možnosti neumožňovali vyšetrenie humánnych ATG IgA, všeobecne dnes považovaných za najšpecifickejšie, využívali sme stanovenie v literatúre alternatívne doporučovaných AEA. Po zachytení pozitivity ktorejkoľvek z uvedených protilátok bolo indikované bioptické vyšetrenie. Po potvrdení CS a zavedení bezlepkoej diety bolo už vyšetrenie protilátok indikované len ako kontrola dodržiavania diéty. Pri negatívnom náleze boli postupne doplnené všetky uvádzané autoprotilátky.
Prehľad citlivosti a predikčných hodnôt pre jednotlivé protilátky uvádza tab. 5.
Tab. 5. Hodnoty citlivosti, špecificity, pozitívnej a negatívnej predikačnej hodnoty sérových protilátok [15]. ![Hodnoty citlivosti, špecificity, pozitívnej a negatívnej predikačnej hodnoty sérových protilátok [15].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/0ecba8fdcb4c832cb811a51fd8f55cd9.jpg)
AGA – antigliadinové protilátky, AEA – antiendomyziálne protilátky, AtTGA – protilátky proti transglutamináze, PPH – pozitívna prediktívna hodnota, NPH – negatívna prediktívna hodnota Bioptické vyšetrenie
Odoberali sa 4 bioptické vzorky z duodena. Boli fixované vo formole 24 hod a zaliate do parafínu. Následne sa farbili v jednej časti hematoxylínom-eozínom, kde sa potom hodnotili morfologické charakteristiky materiálu (t.j. zápal, architektonika, druh), v druhej časti sa preparát farbil metódou PAS na posúdenie deplécie hlienotvorby a štruktúry mikrovilóznej vrstvy. V prípade nepriekaznosti biopsie duodena sme pacientke navrhli enterobioptické vyšetrenie s histochemickým vyšetrením. Pre histochemické vyšetrenie sa materiál odoberá do suchého ľadu. Preparát sa bez predchádzajúcej fixácie farbí podľa príslušného enzýmu (sacharáza, threaláza, laktáza, diaminopeptidáza, GGT, alkalická a kyslá fosfatáza). Hodnotí sa výpadok aktivity enzýmov.
Vzorky hodnotil patológ zaoberajúci sa danou problematikou. V prípade nálezu gastritídy s Helicobacter pylori sme opakovali vyšetrenie po eradikačnej liečbe k vylúčeniu asociovanej duodenitídy.
Laboratórne parametre
Keďže ide o sčasti retrospektívne hodnotenie (po zavedení vyšetrovania protilátok boli vyšetrované aj už liečené pacientky), hodnotili sme nasledujúce biochemické parametre: v sére - Ca, P, alkalickú fosfatázu, gamaglutamyltranspeptidázu, celkové proteíny, albumín, imunoglobulíny G, A, M, v moči - kalciúriu, teda parametre boli štandardne vyšetrované u pacientiek pri stanovení diagnózy osteoporózy pred započatím liečby. Tieto parametre boli stanovované štandardnými metodikami na analyzátore OLYMPUS AU 2700. Hodnoty iPTH boli stanovované chemiluminiscenčne na analyzátore ARCHITECT 2000 SR.
Štatistické metódy
Na štatistické porovnanie jednotlivých charakteristík súboru sme použili Studentov t-test, pri početnosti χ2 test.
Výsledky
Pozitivita aspoň jednej protilátky (AGA IgG, AGA IgA, ATG a AEA) sa vyskytla u 21 pacientiek, t.j.40,8 % celého súboru. Gastrofibroskopia bola doplnená u 20 pacientiek s pozitivitou aspoň jednej protilátky, 1 pacientka s pozitivitou AEA vyšetrenie odmietla.
U 15, t.j. 28,8 %, resp. pri vylúčení nálezov Marsh I u 10, t.j. 19,2 % pacientiek histologický nález svedčil pre diagnózu CS.
U 13 pacientiek prítomnosť ochorenia potvrdila biopsia duodena. U 2 potvrdzujúcim vyšetrením bola enterobiopsia. Rozdelenie pacientiek podľa histopatologického nálezu uvádza tab. 6.
Tab. 6. Histopatologické nálezy pacientiek s pozitivitou autoprotilátok. 
Vylúčenie CS u pacientiek s pozitivitou protilátok a negatívnou histológiou nemožno považovať za definitívne. V sledovanom súbore sme nehodnotili koreláciu medzi výskytom jednotlivých autoprotilátok a histopatologickým nálezom, t.j. stupňom postihnutia.
Jednotlivé morfometrické a denzitometrické charakteristiky pre pacientky s CS a bez CS sú zhrnuté v tab. 7, biochemické nálezy v tab. 8.
Tab. 7. Charakteristiky pacientiek s CS a bez CS. 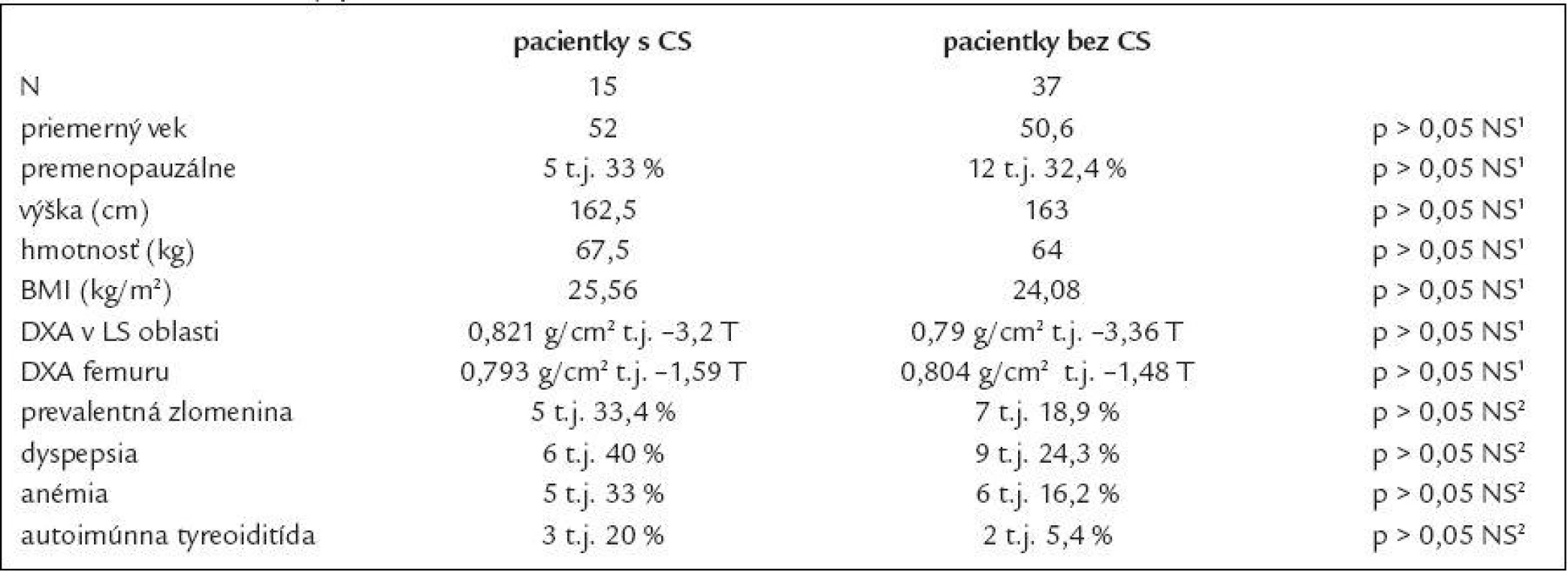
1 Studentov t-test, 2χ2 test Tab. 8. Výsledky biochemických vyšetrení. 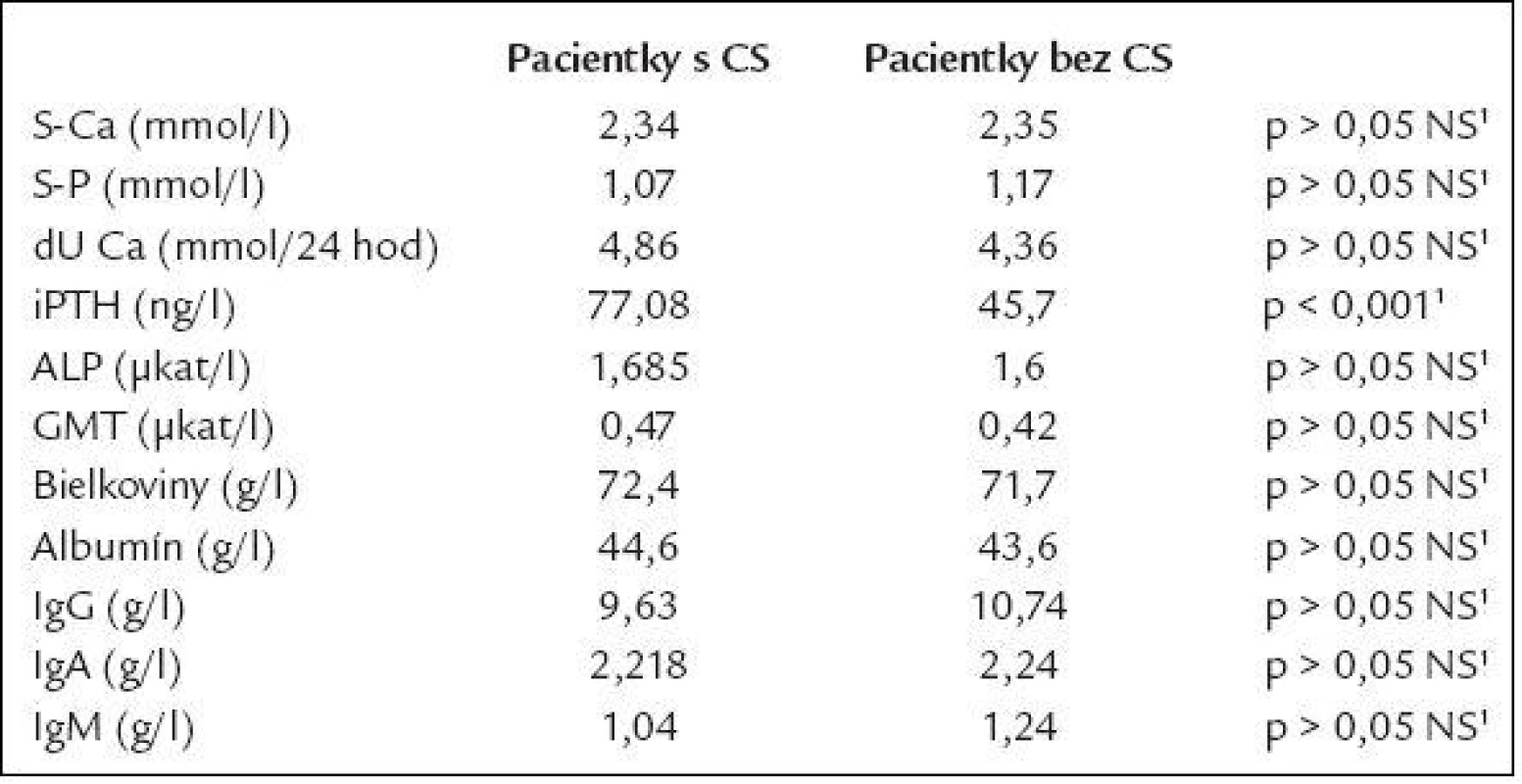
1 Studentov t-test Diskusia
Keďže bezlepková diéta u pacientov s CS zavedená v detstve má preventívny efekt na ireverzibilné aj reverzibilné poškodenie kosti, nedoporučuje sa vyšetrenie kostnej denzity u pacientov s CS diagnostikovanou v detstve s dobrou compliance diéty [19]. Neskorá terapia môže zmierniť len reverzibilné kostné poškodenie, preto je u dospelých a dospievajúcich indikované vyšetrenie kostnej denzity v čase diagnózy CS k odhaleniu možnej osteoporózy či osteopénie [16].
Podľa niektorých autorov sa osteopatia objavuje až u polovice celiatikov diagnostikovaných v dospelosti, ale rovnako ako pri údajoch o prevalencii samotného ochorenia aj tu sa názory líšia a aj o tomto doporučení existuje polemika [14]. Britskí autori polemizujú so svojim doporučením skríningu osteopatie u celiatikov pre nevyjasnený vzťah CS k riziku fraktúr ako aj pomerne nízkeho výskytu osteoporózy v súbore 43 novodiagnostikovaných celiatikov (osteoporózu potvrdili u 7 % na krčku femuru, resp. u 14 % na LS chrbtici) [20]. McFarlane dokázal pokles BMD u 7 % žien a až 50 % mužov na bezlepkovej diéte. Nálezy pozitívne korelovali s príjmom Ca, BMI, a trvaním menopauzy [21].
Napriek tomu, je dnes platné doporučenie skríningu osteoporózy u pacientov s CS. V otázke skríningu CS u pacientov s osteoporózou neexistuje zhoda ani všeobecne platné doporučenie. Dostupné dáta o prevalencii CS u pacientov s osteoporózou sú limitované a kontroverzné.
Vančíkova et al porovnávala výskyt sérologickej pozitivity CS v skupine zdravých darcov krvi a v niektorých vysokorizikových populáciách. Za vysokorizkových považovala aj pacientov s osteoporózou. Skríning bol dvojstupňový. Najprv stanovili AGA IgA, AGA IgG a ATG, v druhom kroku pri pozitivite niektorej protilátky stanovili AEA. V oboch krokoch bola potvrdená pozitivita u 0,45 % zdravých darcov krvi, ale až u 0,98 % pacientov s osteoporózou a 2,7 % pacientov s autoimúnnymi chorobami [22].
Iné porovnanie všeobecnej populácie a pacientov s osteopatiou predstavuje práca Sandersa, ktorý najskôr stanovil pomocou denzitometrie BMD, pričom súčasne vyšetril kvantitatívne imunoglobulíny IgA, AGA IgA, TGM a EMA, u pacientov s deficitom IgA aj AGA IgG. Osteoporózu dokázal u 243, osteopeniu u 431 probandov. Sérologický skríning bol pozitívny u 13, u 12 bola biopticky verifikovaná CS. Spomedzi chorých s CS 5 malo osteoporózu, 5 osteopéniu a 2 normálne BMD. Prevalencia CS bola v celom súbore 1,2 %, v časti pacientov s osteoporózou 1,4 % a u probandov s normálnou denzitou 0,7 % [23].
O skríning CS u pacientov s osteoporózou sa pokúsili Lindh, Nuti a Gokhale. Ich výsledky sú rozdielne v závislosti od veku, diagnostiky osteoporózy a vyšetrovaných protilátok (tab. 9) [24-26].
Tab. 9. Porovnanie skríningu CS u osteoporotických pacientov (24–26). 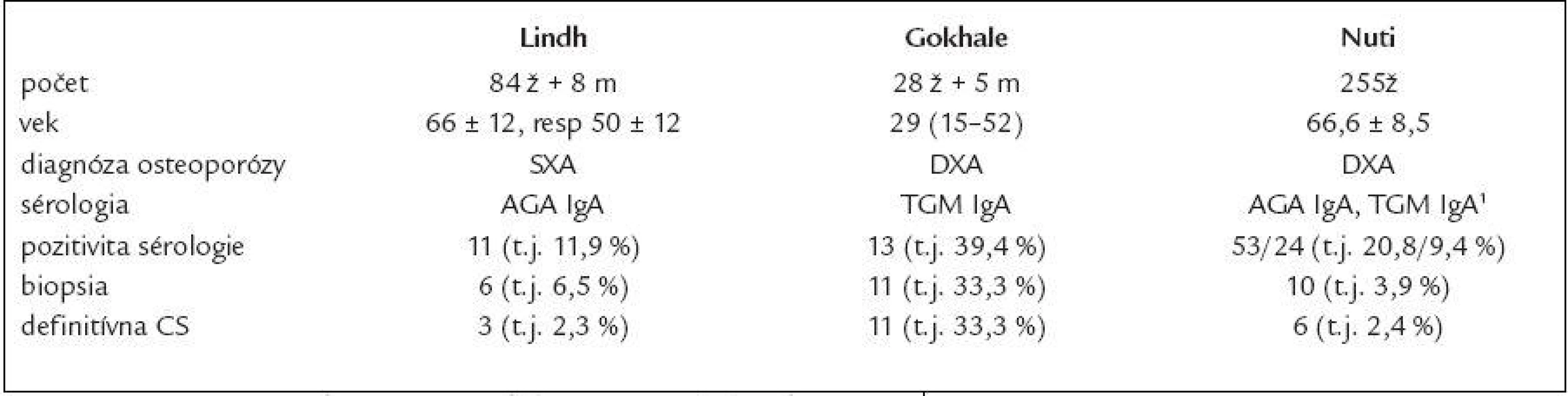
ž – ženy, m – muži, SXA – denzitometria predlaktia, DXA – celotelová denzitometria 1 dvojstupňový skríning pri pozitivite AGA IgA, druhý stupeň TGM IgA Keďže dosiaľ publikované práce neviedli k optimistickým záverom týkajúcim sa skríningu CS u pacientov s osteoporózou bez ďalších selekčných kritérií, pokúsili sme sa zodpovedať otázku, či incidencia ochorenia u chorých s osteoporózou, spĺňajúcich aj iné selekčné kritériá, stanovené tak, aby bola záchytnosť ochorenia čo najvyššia, by odôvodňovala skríning CS u týchto chorých.
V prezentovanom súbore premenopauzálnych a perimenopauzálnych žien s „idiopatickou“ osteoporózou predstavovala prevalencia ochorenia viac ako desaťnásobok predpokladu pre bežnú populáciu (asi 2 - 3 %) - 19,23 % ak berieme do úvahy len pacientky s histopatologickým nálezom Marsh II a III, resp. až 28 %, po pripočítaní nálezov Marsh I.
I keď v prípade nálezu Marsh I je prípustné sledovanie pacienta bez zavedenia bezlepkovej diéty, boli pacientky tohto súboru vzhľadom na prítomnosť pozitivity niektorej z uvádzaných autoprotilátok, osteopatie ako prejavu ochorenia, rovnako ako aj iných klinických korelátov v anamnéze (dyspepsia nevysvetlená inak, sideropenická anémia) diagnosticky uzatvárané ako CS a bola im doporučená bezlepková diéta. Tento postup pacientkám umožnil preskripciu bezlepkových potravín. Keďže je v prípade CS známa liečba bez vedľajších nežiadúcich účinkov, považovali sme spolu s gastroenterológom len sledovanie symptomatickej pacientky za eticky sporné.
Možným diferenciačným kritériom je aj HLA typizácia, keď neprítomnosť predilekčne sa vyskytujúcich haplotypov HLA DQ2 (až 98 % európskych pacientov), DQ8, B8, DR 3, DR 5, DR 7, DR 4 spochybňuje diagnózu CS. Pozitívny nález môže prispieť k diagnostike latentných foriem [8]. Túto možnosť sme nemali.
Paradoxne vyšší BMI u pacientiek s CS nebol štatisticky signifikantný. Napriek očakávaniu sme BMI vyšší ako 30 zaznamenali aj u 2 pacientiek s nálezom Marsh III. Vysvetlením je pravdepodobne vyšší podiel atypických foriem ochorenia v takto selektovanej populácii - pacienti osteologickej ambulancie - bez klasického obrazu malabsorpcie, keďže k diagnostike typických foriem ochorenia dochádza v mladšom veku a primárne sú títo pacienti odosielaní od praktického lekára pre črevnú symptomatológiu priamo k gastroenterológovi. Pomaly prebiehajúce ochorenie je predpokladom rozvoja adaptačných zmien nedovoľujúcich kachektizáciu pacientiek.
V súlade s teoretickými predpokladmi sú štatisticky signifikantne vyššie hodnoty iPTH, s chýbaním hyperkalciémie a hyperkalciúrie (sklon k hypokalciémii by pravdepodobne bolo možné dokázať pri hodnotení ionizovaného kalcia, ktoré sme ale v danom čase štandardne u pacientiek nevyšetrovali) potvrdzujúce rozvoj sekundárnej hyperparatyreózy. Rozvoj sekundárnej hyperparatyreózy je jedným z vedúcich patomechanizmov rozvoja osteopatie u pacientov s CS. A naopak, práve osteopatia môže byť klinickou manifestáciou hyperparatyreózy. Pokles hodnôt iPTH po zdiagnostikovaní celiakie a zavedení diéty tiež podporuje túto teóriu, avšak toto sledovanie ešte nemôžeme uzavrieť a nie je predmetom tejto práce. Vzhľadom k takýmto skúsenostiam neboli v čase stanovenia izolovane zvýšeného iPTH bez elevácie kalcémie a kalciurie lokalizačné vyšetrenia (USG a scintigrafia príštitných teliesok) u pacientiek indikované.
Zaznamenali sme tiež rozdiely v hladinách imunoglobulínov, vyšší výskyt prevalentnej zlomeniny, združených autoimúnnych ochorení, dypsepsie a sideropenickej anémie u pacientiek s CS. Tieto rozdiely však neboli štatisticky signifikantné.
Dôležitým anamnestickým údajom je výskyt asociovaných autoimúnnych ochorení v osobnej anamnéze. Patria k nim diabetes mellitus typ 1, autoimunna tyreoiditída, autoimúnna hepatitída, sklerotizujúca cholangoiditída, primárna biliárna cirhóza, systémový lupus erytematodes, Sjögrenov syndróm, polymyozitida, intersticiálna pľúcna fibróza, idiopaticka pľúcna hemosideróza, lymfocytárna eneterokolitída, kolagénova a mikroskopicka kolitída [3].
Iným dôvodom skríningu CS môže byť zhoršovanie sa DXA nálezu napriek špecifickej liečbe s dobrou compliance pacientky.
Dôvodom skríningu CS vysokorizikových skupín je vysoká penetrancia u prvostupňových príbuzných, fakt, že ide o prekancerózu lymfómu tenkého čreva, ako aj literárne uvádzaný vyšší výskyt malignít [12].
Zdá sa, že z hľadiska častosti výskytu CS rizikovou skupinou sú aj premenopauzálne a perimenopauzálne pacientky s „idopatickou“ osteoporózou.
Záver
Uvedené výsledky potvrdzujú potrebu sérologického skríningu CS u vybranej skupiny pacientov s osteoporózou, v našom prípade premenopauzálnych a včasne postmenopauzálnych žien. Keďže v čase, keď súbor vznikal, nebolo dostupné vždy vyšetrenie všetkých autoprotilátok súčasne, nekladie si práca za cieľ výber najvhodnejšej skríningovej protilátky, resp. protilátok. Všeobecne doporučované je stanovenie ATG resp. AEA v triede IgA, u pacientov s deficitom IgA potom ATG IgG resp. AGA IgG [1]. Jednoznačným imperatívom skríningu CS by mala byť prítomnosť nejasnej sekundárnej hyperparatyreózy a podporujúcimi faktormi by mala byť prítomnosť iného autoimúnneho ochorenia, sideropenickej anémie, resp. dyspepsie v anamnéze. Obligátnou súčasťou anamnézy pacientky s osteoporózou by mala byť otázka výskytu CS u prvostupňových príbuzných.
MUDr. Ľudmila Kubincová
www.nspza.sk
e-mail: kubincova.l@pobox.sk
Doručeno do redakce: 27. 7. 2007
Přijato po recenzi: 16. 9. 2007
Zdroje
1. Pekárková B. Celiakia. In: Jurgoš L, Kužela L, Hrušovský Š et al. Gastroenterologia. Bratislava: VEDA 2006: 335-343.
2. Lukáš M. Celiakie - glutenová enteropatie. Vnitř Lék 2003; 49 : 449-451.
3. Frič P. Celiakální sprue (aktuální přehled). Vnitř Lék 2003; 49 : 465-473.
4. Prokopová L. Celiakie - závažné onemocnění. Vnitř Lék 2003; 49 : 474-481.
5. Frič P. Komplikace celiakální sprue. Čes Slov Gastroent Hepatol 2001; 55 : 26-30.
6. Marsh MN, Crowe PT Morphology of the mucosal lesion in gluten sensitivity. Baillerie’s Clin Gastroenterol 1995; 9 : 273-293.
7. Oberhuber G, Grandtisch G, Vogelsang H. The histopathology of coeliac disease. Eur J Gastroenterol Hepatol 1999; 11 : 1185-1194.
8. Ciferská H, Horák P, Tichý M. Kostní choroba u glutenové enteropatie manifestované v pozdním věku - 2 kazuistiky. Osteologický bulletin 2006; 11 : 91-94.
9. Killinger Z, Payer J jr, Huorka M et al. Kostné zmeny u pacientky s asymptomatickou coeliakiou. Osteologický bulletin 1997; 2 : 55-57.
10. Lukáš Z. Histopatologie a diferenciální diagnostika celiakální sprue. Čes Slov Patol 2004; 40 : 3-6.
11. Fasano A, Catassi C. Curent approaches to diagnosis and therapy of celiac disease: an avolving spectrum. Gastroenterology 2001; 120 : 636-651.
12. Plotkin GR, Isselbacher KJ. Secondary dissaccharidase deficiency in adult coeliac disease (nontropical sprue) and other malabsorption states. N Engl J Med 1964; 271 : 1033-1037.
13. Di Stefano M, Veneto TG, Malservisi S et al. Lactose malabsorption and intolerance and peak bone mass. Gastroenterology 2002; 122 : 1793-1799.
14. Corazza GR, Di Stefano M, Maurino E et al. Bones in coeliac disease: diagnosis and treatment. Best Pract Res Clin Gastroenterol 2005; 19 : 453-465.
15. Frič P. Celiakie. In: Bureš J et al. Gastroenterologie. Praha: Triton 2006 : 219-238.
16. Goldring SR. Mechanisms of pathologic bone loss. Calcif Tissue Int 2003; 73 : 97-100.
17. Sugai E, Chernavsky A, Pedreira S et al. Bone-specific antiobodies in sera from patients with coeliac disease: characterization and implications in osteoporosis. J Clin Immunol 2002; 22 : 353-362.
18. Maki M, Colin P. Coeliac disease. Lancet 1997; 349 : 1755-1759.
19. Lewis NR, Scott BB. Should patients with coeliac disease ave their bone mineral density measured? Eur J Gastroenterol Hepatol 2005; 17 : 1065-1070.
20. Thomason K, West J, Logan RFA et al. Fracture exprience of patients with celiac disease: a population based survey. Gut 2003; 52 : 518-522.
21. McFarlane XA, Bhalla AK, Reeves DE et al. Osteoporosis in treated adult coeliac disease. Gut 1995; 36 : 710-714.
22. Vančíková Z, Chlumecký V, Sokol D et al. The serologic screening for celiac disease in general population (Blood donors) and in some high-risk groups of adults (patients with autoimmune diseases, osteoporosis and infertility) in Czech Republic. Preliminary Report. Folia Microbiol 2004; 47 : 753-758.
23. Sanders DS, Patel D, Khan FB et al. Case finding for Adult Celiac Disease in Patients with Reduced Bone Density. Dig Dis Sci 2005; 50 : 587-592.
24. Lindh E, Ljunghall K, Larsson K et al. Screening antibodies against gliadin in patients with osteoporosis. J Intern Med 1992; 231 : 403-406.
25. Nuti R, Martini G, Valenti R et al. Prevalence of undiagnosed coeliac syndrome in osteoporotic women. J Intern Med 2001; 250 : 361-366.
26. Gokhale YA, Sawant PD, Chodankar CM et al. Celiac Disease in Osteoporotic Indians. JAPI 2003; 51 : 579-583.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Dobutamínová záťažová echokardiografia vs SPECT pri diagnostikovaní ischemickej choroby srdcaČlánek Waldenströmova makroglobulinemie - klinické projevy a diferenciální diagnostika a prognóza nemociČlánek II. interní klinika Lékařské fakulty MU a FN u sv. Anny v Brně oslavuje 60. výročí svého vznikuČlánek XI. kongres o ateroskleróze
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2007 Číslo 12- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Vztah mezi osteoporózou a celiakií - editorial
- Celiakie a osteoporóza - je vazba natolik těsná, že vyžaduje akci? - editorial
- Srovnání zátěžové echokardiografie a SPECT myokardiální perfuze - editorial
- Recidivující arytmie po katetrové ablaci původně paroxyzmální fibrilace síní a výsledky opakované ablace
- Bakteriální infekce ve vztahu ke vzniku a průběhu varikózního krvácení
- Stresová odezva prolaktinu u nemocných se systémovým lupus erythematodes (SLE), revmatoidní artritidou (RA) a u zdravých kontrol
- Léčba hyperglykemie u kriticky nemocných pacientů: srovnání standardního protokolu a počítačového algoritmu
- Příčiny akutního krvácení do horního trávicího traktu u pacientů s jaterní cirhózou
- Vliv etiologie syndromu diabetické nohy na lokalizaci defektů
- Sledování funkčních poruch mikrocirkulace laser dopplerem u pacientů s chronickou žilní nedostatečností třídy 2 dle CEAP klasifikace před a po operaci varixů
- Celiakia - častá príčina „idiopatickej osteoporózy“ premenopauzálnych a včasne postmenopauzálnych žien
- Dobutamínová záťažová echokardiografia vs SPECT pri diagnostikovaní ischemickej choroby srdca
- Diabetes mellitus a mikroalbuminurie
- Dnešný pohľad na riziká umelej pľúcnej ventilácie
- Waldenströmova makroglobulinemie - klinické projevy a diferenciální diagnostika a prognóza nemoci
- II. interní klinika Lékařské fakulty MU a FN u sv. Anny v Brně oslavuje 60. výročí svého vzniku
- O ztrátách a nálezech s odstupem
- XI. kongres o ateroskleróze
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Dnešný pohľad na riziká umelej pľúcnej ventilácie
- Recidivující arytmie po katetrové ablaci původně paroxyzmální fibrilace síní a výsledky opakované ablace
- Waldenströmova makroglobulinemie - klinické projevy a diferenciální diagnostika a prognóza nemoci
- Diabetes mellitus a mikroalbuminurie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



