-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Současné možnosti zobrazení magnetickou rezonancí v kardiologii
Current Use of Magnetic Resonance Imaging in Cardiology
Magnetic resonance is a modern imaging technique that is characterized by high resolution and variable tomographic slices. The development of magnetic resonance technology in last decade led to the expansion of this method in many fields of medicine. In cardiology, the imaging is focused on the heart, aorta, pulmonary, coronary and renal arteries. Dynamic imaging is used for the evaluation of the kinetics and the function of the ventricles. Static imaging serves for the assessment of the myocardial wall in patients with cardiomyopathies and coronary artery disease. The quality of static imaging can improve paramagnetic contrast agent that increasingly accumulates in areas of acute necrosis, fibrosis or infiltration of the myocardium. Magnetic resonance can also diagnose intracardiac tumors and thrombi, valvular heart disease and pericardial disorders. Despite of wide spectrum of diagnostic applications, the clinical use of magnetic resonance imaging is reduced by limited availability and high cost of the examination.
Key words:
magnetic resonance imaging - cardiology
Autori: M. Solař 1; J. Žižka 2; L. Klzo 2; J. Ceral 1
Pôsobisko autorov: I. interní klinika Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Jan Vojáček, DrSc. 1; Radiologická klinika Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Pavel Eliáš, CSc. 2
Vyšlo v časopise: Vnitř Lék 2008; 54(2): 183-190
Kategória: Přehledný referát
Súhrn
Magnetická rezonance je moderní zobrazovací metodou, která umožňuje zobrazení s vysokou přesností v libovolných tomografických vrstvách. Technologický rozvoj v posledních letech umožnil rozšíření této vyšetřovací techniky v řadě medicínských oborů včetně kardiologie. Kromě vyšetření myokardu zahrnují kardiologické indikace zobrazení magnetickou rezonancí vyšetření aorty, plicnice, koronárních a renálních arterií. Dynamické zobrazení lze využít pro hodnocení kinetiky a funkce srdečních oddílů. Statická zobrazení slouží hlavně k posouzení struktury stěny myokardu u nemocných s kardiomyopatiemi a ischemickou chorobou srdeční. Výtěžnost statického zobrazení může být zvýšena podáním paramagnetické kontrastní látky, která se signifikantně více vychytává v oblastech patologicky změněného myokardu. Tímto způsobem je možné zobrazit akutní nekrózu, fibrózu i zánětlivou infiltraci myokardu. Magnetická rezonance dále umožňuje diagnostiku intrakardiálních tumorů a trombů, chlopenních vad a onemocnění perikardu. Přes rozsáhlé možnosti zobrazení, které přináší magnetická rezonance, je širší klinické využití této metody limitováno omezenou dostupností a vysokou cenou vyšetření.
Klíčová slova:
magnetická rezonance - kardiologieÚvod
Magnetická rezonance (MRI) patří mezi moderní zobrazovací metody používané v biomedicíně. Vyšetřovanou oblast lze pomocí této techniky zobrazit s vysokou přesností v libovolných rovinách (vrstvách). Princip MRI je založen na chování jader atomů vodíku v statickém a proměnném magnetickém poli [15]. V závislosti na použitém typu zobrazení (sekvencích) odpovídá výsledný obraz vlastnostem vodíkových jader v jednotlivých tkáních, proudění krve nebo přítomnosti paramagnetické kontrastní látky.
Rozvoj MRI technologie v posledních letech přinesl výrazné rozšíření možností vyšetření v řadě oborů. Zkvalitnění a zrychlení MR zobrazení spolu s EKG synchronizací umožňují širší využití této vyšetřovací techniky i v kardiologii [37]. Přes současný výrazný pokrok zůstávají absolutními kontraindikacemi vyšetření přítomnost MR nekompatibilních elektronických implantátů a feromagnetických klipů použitých při operacích intrakraniálních aneuryzmat. K relativním kontraindikacím se řadí klaustrofobie a recentní implantace kovového materiálu.
Techniky MR zobrazení myokardu
Z pohledu z internisty a kardiologa, respektive specialisty indikujícího a využívajícího výsledků MRI, lze techniky zobrazení myokardu zjednodušeně rozdělit do 4 skupin: dynamické zobrazení, statické zobrazení, MR angiografie a funkční MRI s využitím fázového kontrastu. Identifikaci jednotlivých fází srdečního cyklu umožňuje kontinuální záznam EKG (EKG-synchronizace). Výsledný obraz vzniká z dat získaných během několika srdečních cyklů za krátkého zadržení dechu. Nepravidelnosti R-R intervalů při arytmiích vedou ke vzniku zobrazovacích artefaktů.
Z pohledu klinika je dynamická MRI (cardiac cine) obdobou echokardiografie. Zobrazení v libovolných anatomických vrstvách dává velmi přesnou a ucelenou představu o srdeční anatomii a funkci. Toto zobrazení umožňuje přesně hodnotit kinetiku myokardu, plochy chlopenních ústí a lze je použít i k orientačnímu hodnocení proudění krve v srdečních dutinách. Dynamická MRI může překonat limitace ultrazvukového vyšetření dané závislostí na akustických oknech a omezeným zobrazením srdečního hrotu. Běžné MRI sekvence však zatím neumožňují zobrazení v reálném čase a nedosahují rozlišovací schopnosti srovnatelné s echokardiografií. Dynamická MRI tak není vhodná pro hodnocení vlajících útvarů či diskrétních patologií a anomálií (např. patentní foramen ovale).
Statické zobrazení myokardu se používá k hodnocení struktury a perfuze myokardu. Akvizice dat je obvykle cílena na konec diastoly, během níž je nejnižší riziko pohybových artefaktů daných pohybem srdce během srdečního cyklu. Volba způsobu zobrazení závisí na klinické indikaci, resp. typu onemocnění. Zatímco T1 vážené zobrazení slouží ke zvýraznění tukové tkáně, T2 vážené zobrazení umožňuje identifikovat lokální zvýšení obsahu vody v myokardu, čímž je možno zobrazit otok tkáně (akutní nekróza, zánětlivé infiltrace).
Výtěžnost statického zobrazení může být zvýšena podáním paramagnetické kontrastní látky obsahující gadolinium, která se vychytává v oblastech patologicky změněného myokardu.
MR angiografii (MRA) lze použít ke zobrazení prakticky všech cév. Extrakraniální MRA se provádějí s pomocí paramagnetické kontrastní látky.
Funkční MRI (fMRI) je obdobou dopplerovské ultrasonografie a umožňuje měření rychlosti proudění v cévách a na chlopenních ústích. Tuto techniku lze použít také k měření hemodynamických parametrů (hodnocení srdečního výdeje, zkratů, chlopenních vad apod).
Indikace vyšetření zobrazením magnetickou rezonancí z pohledu kardiologa
Hodnocení funkce a masy myokardu
Předpokladem pro hodnocení masy myokardu a objemů srdečních dutin je volba takových MRI sekvencí, které poskytují přesné zobrazení endokardu a epikardu. Série dynamických zobrazení v krátké ose (od srdeční baze k hrotu) pak umožňuje přesný výpočet objemů srdečních komor v jakékoli fázi srdečního cyklu. Tento způsob určení ejekční frakce je charakterizován vysokou reprodukovatelností při hodnocení funkce obou komor [13,14]. Pro přesné měření ejekční frakce je MRI vhodná zejména u nemocných s patologicky změněným myokardem [4], protože abnormální tvar levé komory není zohledněn v aproximacích, které používají pro výpočet ejekční frakce jiné zobrazovací metody (echokardiografie, kontrastní ventrikulografie).
Vysoká přesnost MRI v měření masy myokardu a objemů srdečních dutin je dnes využitelná hlavně v experimentu. Zatímco u většiny nemocných v běžné klinické praxi postačuje pro stanovení rozměrů a funkce srdečních oddílů echokardiografie, MRI je vhodná u malého procenta nemocných, kteří nejsou dobře vyšetřitelní ultrazvukem
Ischemická choroba srdeční
Použití MRI u ischemické choroby srdeční (ICHS) zahrnuje diagnostiku infarktu, viability a ischemie myokardu.
Diagnostika infarktu myokardu
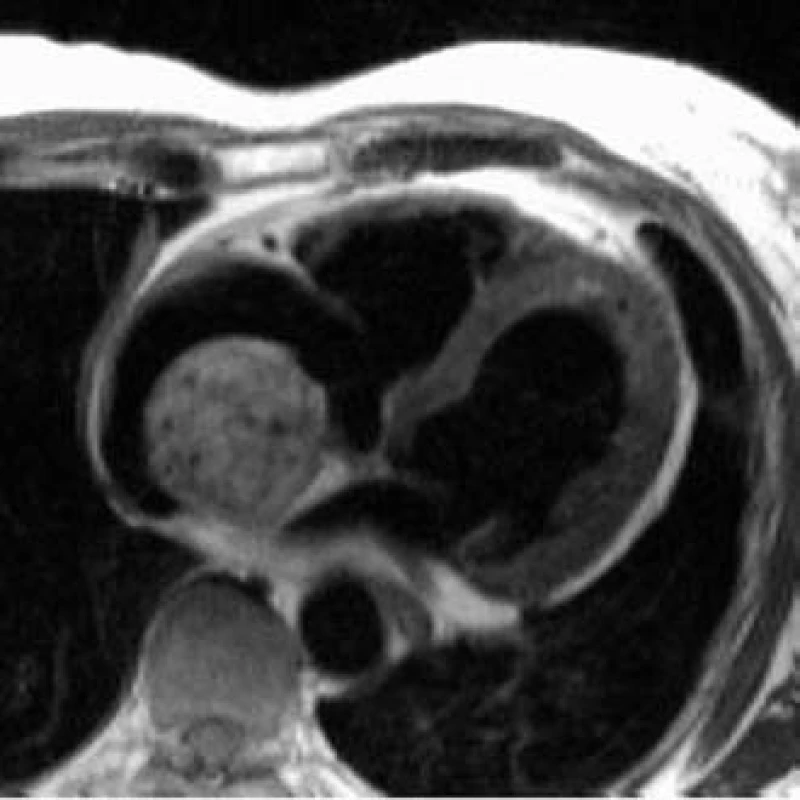
MRI diagnostika infarktu myokardu je založena na kumulaci paramagnetické kontrastní látky v oblastech akutní nekrózy i fibrózní jizvy. Během 10-15 min po intravenózním podání se kontrastní látka vychytá v oblasti infarktového ložiska, kde přetrvává ve zvýšené koncentraci desítky minut (obr. 1).
Obr. 1. Infarkt myokardu s trombem. Subendokardiální kumulace gadoliniové paramagnetické kontrastní látky (bíle) v oblasti septa a hrotu odpovídá jizvě po infarktu myokardu. V hrotu je trombus. 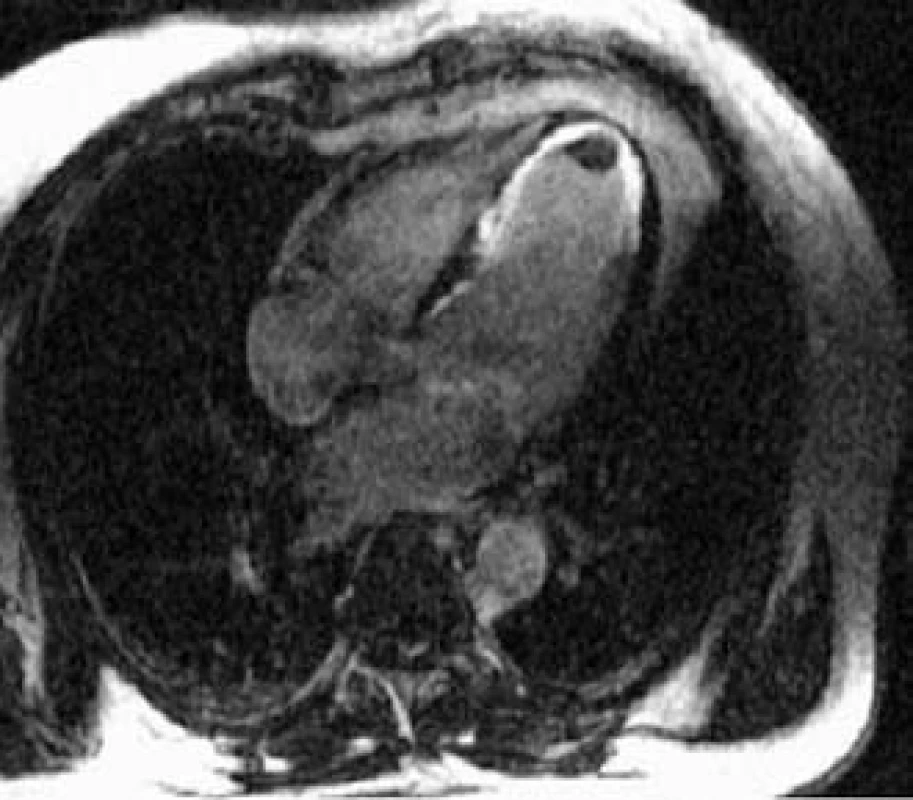
Předpokládaným mechanizmem kumulace kontrastní látky je v případě akutní nekrózy intracelulární difuze způsobená porušenou integritou buněčných membrán. Zvýšená kumulace v oblastech chronicky fibrózně změněného myokardu je vysvětlována jak rozdílnou farmakokinetikou, tak rozdíly objemů intra - a extracelulárního prostoru ve fibrózně změněném a normálním myokardu [27].
Vyšetření jsou prováděna technikou „inversion-recovery“. Při tomto typu zobrazení jsou struktury kumulující kontrastní látku světle šedé až bílé, zatímco normální myokard zůstává tmavý (nulováním signálu ze svalu). Pro infarktová ložiska je typická subendokardiální až transmurální kumulace kontrastní látky. Kumulace paramagnetické kontrastní látky v ložisku infarktu myokardu přesně odpovídá rozsahu nekrotické tkáně zobrazené při histologickém vyšetření [16,21]. U rozsáhlejších akutních lézí dochází k pomalejšímu průniku kontrastní látky do centrální části infarktu. Tento jev je vysvětlován poruchou mikrocirkulace v centrální části nekrózy (no-reflow). Při MR zobrazení jsou tyto oblasti charakterizovány nízkým signálem (tmavě).
Praktické využití MRI v diagnostice infarktu myokardu je omezeno hlavně na nemocné s nejasnou systolickou dysfunkcí levé komory a normálním nebo nediagnostickým koronarografickým nálezem. Podle studie Kwonga [26] může postkontrastní MRI sloužit k prognostické stratifikaci u nemocných s ICHS bez anamnézy prodělané myokardiální léze. Bylo pozorováno, že průkaz klinicky němých infarktů je spojen s vyšším rizikem srdečních příhod v budoucnu.
K odlišení akutního a chronického infarktu myokardu lze použít T2 vážené zobrazení, které nespecificky ukazuje edém spojený s akutním tkáňovým poškozením [48]. Tento postup může být využit pro diagnostiku infarktu myokardu u nemocných po kardiopulmonální resuscitaci, u nichž je výpovědní hodnota kardiomarkerů snížena v důsledku prodělané oběhové zástavy a zevní srdeční masáže. Bylo pozorováno, že edém tkáně při akutním infarktu myokardu narůstá během prvních 5 dní [49] a je patrný i po 12 dnech od ischemického inzultu [54].
Určení viability myokardu
Viabilitu myokardu lze s pomocí MRI hodnotit 2 základními způsoby. Zátěžová dynamická MRI je založena na průkazu kontraktilní rezervy myokardu vyvolané inotropní stimulací. Výpovědní hodnota tohoto vyšetření odpovídá zátěžové echokardiografii [3]. Postkontrastní MR zobrazení hodnotí viabilitu myokardu na základě transmurálního rozsahu kontrastem zvýrazněné (ireverzibilně změněné) tkáně. Byla pozorována nepřímá závislost transmurálního rozsahu neviabilní (jizevnatě přeměněné, kontrastem zvýrazněné) tkáně na zlepšení systolické funkce levé komory po revaskularizaci [21]. Stejně tak byla popsána závislost rozsahu kontrastem zvýrazněné tkáně na zlepšení kinetiky levé komory u nemocných s akutním infarktem myokardu [12]. Při srovnání hodnocení viability postkontrastní MRI a pozitronovou emisní tomografií bylo MR zobrazení charakterizováno vysokou senzitivitou i specificitou [24].
Průkaz ischemie myokardu
Ischemii myokardu můžeme hodnotit pomocí zátěží indukované změny kinetiky levé komory nebo zobrazením perfuze myokardu s využitím paramagnetické kontrastní látky. Při farmakologické zátěži dobutaminem se změny kinetiky levé komory hodnotí dynamickým MRI záznamem. Ve srovnání s ultrazvukovým vyšetřením se zdá být tento způsob diagnostiky ischemie přesnější [34].
Při hodnocení perfuze je myokard zobrazován bezprostředně po intravenózním podání paramagnetické kontrastní látky [20]. Série statických zobrazení v krátkých časových intervalech umožňuje hodnotit průtok krve, resp. kontrastní látky, myokardem. Normálně perfundovaná tkáň se při tomto typu zobrazení jeví jako světle šedá, zatímco ischemický a ireverzibilně změněný myokard zůstávají při podání kontrastní látky tmavé. Zátěž simulovaná podáním adenozinu umožní přesnější diagnostiku významných stenóz koronárního řečiště. Odlišení ischemie od ireverzibilních změn (akutní nekróza nebo fibrózní jizva) poskytuje následné postkontrastní zobrazení.
V diagnostice ischemie myokardu koresponduje MR zobrazení perfuze s výsledky metod nukleární medicíny [42]. Podle nedávno publikované studie zátěžová perfuzní MRI dobře určuje prognózu nemocných vyšetřovaných pro bolesti na hrudi [18]. U jedinců s negativním troponinem I a normální perfuzí dle MRI nebyly během ročního sledování pozorovány projevy koronárního onemocnění. MRI detekovaná porucha perfuze byla naopak spojena s nepříznivou prognózou ve smyslu klinické manifestace ICHS.
Kardiomyopatie
V diagnostice a klinickém sledování kardiopatií lze využít dynamické i statické MR zobrazení. Statické zobrazení může být provedeno nativně nebo po podání paramagnetické kontrastní látky, která se signifikantně více vychytává v oblastech fibrózy a patologické infiltrace myokardu.
MRI je zobrazovací metodou volby v diagnostice arytmogenní kardiomyopatie pravé komory [7]. K velkým diagnostickým kriteriím patří průkaz fibrózně tukové degenerace myokardu (obr. 2) při T1 váženém i postkontrastním zobrazení a výrazná dysfunkce a dilatace pravé komory s aneuryzmaty patrná na dynamickém MRI záznamu.
Obr. 2. Arytmogenní kardiomyopatie pravé komory. Tuková degenerace myokardu baze pravé komory (světle šedě při T1 váženém zobrazení). 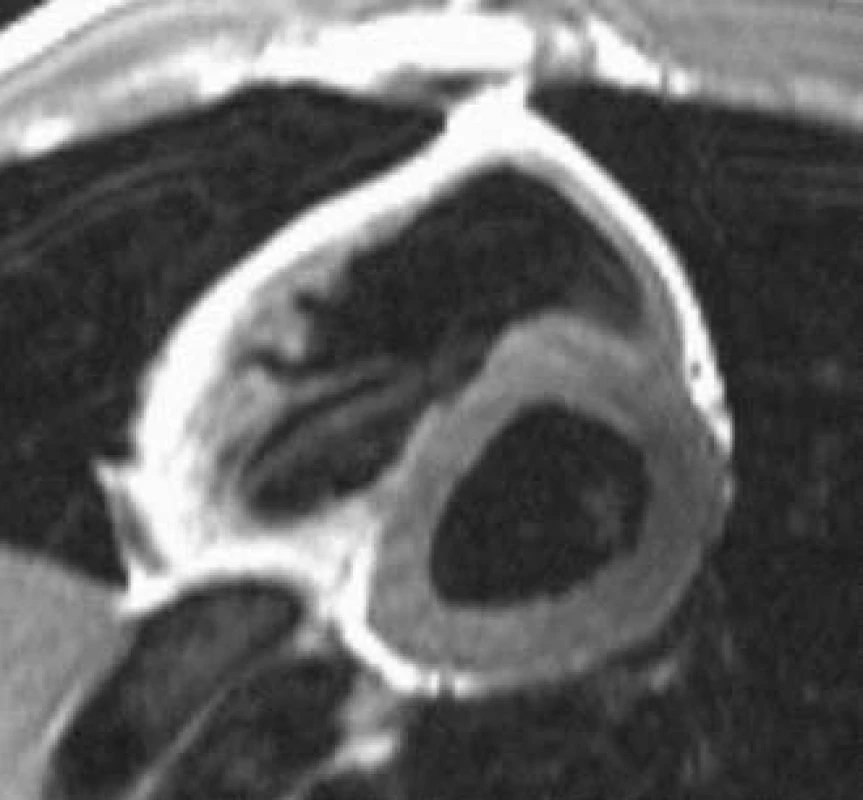
Postkontrastní MR zobrazení lze použít u nemocných se systolickou dysfunkcí levé komory k odlišení dilatované kardiomyopatie od levokomorové dysfunkce při ICHS. U velké většiny nemocných se systolickou dysfunkcí při ICHS je na postkontrastních MRI obrazech pozorována subendokardiální nebo transmurální kumulace kontrastní látky [30]. U dilatované (neischemické) kardiomyopatie se obvykle kontrastní látka v myokardu buď vůbec nekumuluje, nebo vytváří hlavně intramyokardiální depozita. Jen u malého počtu nemocných s dilatovanou kardiomyopatií je kumulace kontrastní látky subendokardiální, tj. shodná jako u ICHS.
Absence subendokardiální kumulace kontrastní látky v terénu nejasné systolické dysfunkce levé komory tak může svědčit proti přítomnosti závažného koronárního onemocnění. Není však známo, nakolik je tento nález specifický a zda je možné na jeho základě stanovit diagnózu dilatované kardiomyopatie bez provedení diagnostické koronarografie.
Intramyokardiální kumulace kontrastní látky u nemocných s dilatovanou kardiomyopatií může být ukazatelem nepříznivé prognózy [2], ale není jisté, zda tento nález ovlivní léčebnou strategii.
MRI umožňuje posoudit lokalizaci a rozsah funkční hypertrofie myokardu u hypertrofické kardiomyopatie. MRI může přispět k diagnostice apikální formy tohoto onemocnění, protože ultrazvukové vyšetření je pro zobrazení srdečního hrotu méně přesné [31]. Postkontrastní MRI zobrazení umožňuje zhodnocení přítomnosti intramyokardiální fibrózy, která se jeví být nepříznivým rizikovým faktorem dlouhodobé prognózy. Rozsah kumulace kontrastní látky odpovídá riziku náhlého úmrtí, dilatace levé komory a rozvoje srdečního selhání [32].
Kumulace kontrastní látky v laterální stěně myokardu může pomoci v diagnostice Fabryho onemocnění [33], které patří mezi méně časté příčiny patologické hypertrofie myokardu. MRI je možné použít také pro zobrazení srdečního postižení u systémových onemocnění, jakými jsou amyloidóza a sarkoidóza. Pro amyloidózu je typické ztluštění stěn všech srdečních oddílů, u části nemocných dochází v důsledku infiltrace intersticia ke kumulaci paramagnetické kontrastní látky v myokardu při postkontrastním MR zobrazení (obr. 3) [38]. Pozdní kumulace kontrastní látky byla pozorována také u srdeční formy sarkoidózy, při níž odráží subakutní zánětlivou infiltraci nebo chronické fibrózní změny. Tento obraz však není pro diagnózu sarkoidózy specifický a normální MRI nález nevylučuje toto onemocnění [45].
Obr. 3. Srdeční amyloidóza. Intramyokardiální (subendokardiální) kumulace kontrastní látky s maximem oblasti septa, spodní a zadní stěny (šedě) u nemocného se srdeční formou amyloidózy. 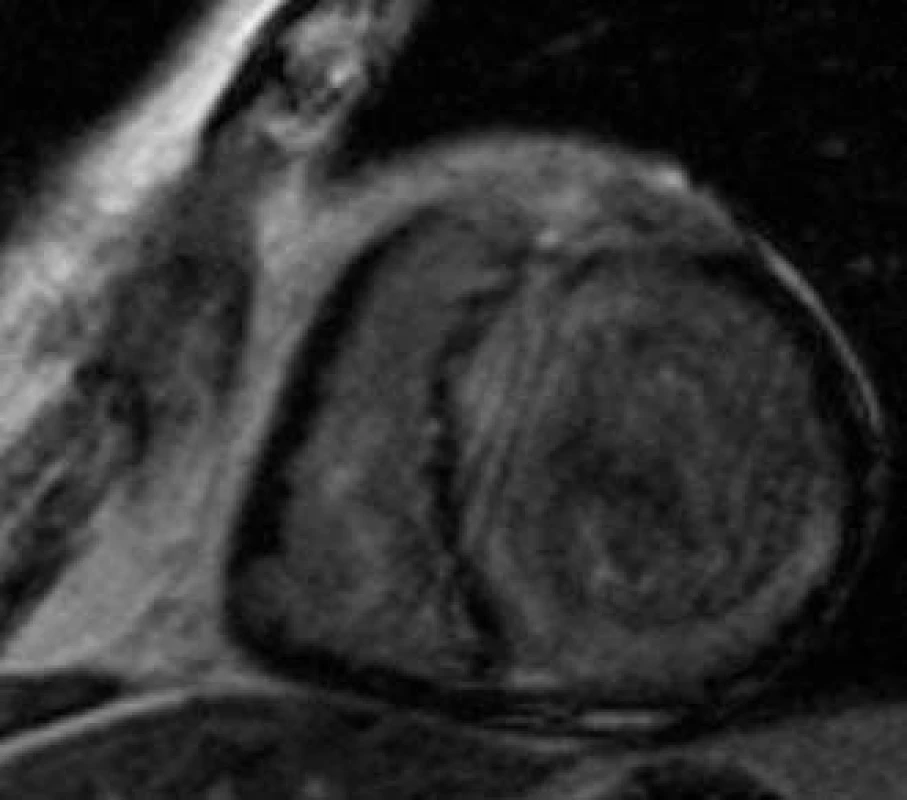
Klinická diagnóza akutní myokarditidy může být velmi obtížná. Bioptická verifikace onemocnění je nejistá, protože zánětlivá infiltrace mívá často ložiskový charakter. Ke stanovení diagnózy nebo k cílení biopsie může přispět MRI. Kombinace T2 váženého a postkontrastního zobrazení dokáže identifikovat otok tkáně i abnormality intersticia myokardu způsobené buněčnou infiltrací [11]. Tento obraz je však nekonstantní a pokud je přítomen, může být lokalizován kdekoli ve stěně myokardu.
Chlopenní vady
Při hodnocení chlopenních vad využívá MRI stejné principy jako echokardiografie. V klinické praxi může být MR zobrazení provedeno v případech, kde není echokardiografické vyšetření přínosné nebo tam, kde je diskrepance mezi ultrazvukovým a katetrizačním nálezem. Omezené časoprostorové rozlišení MRI neumožňuje kvalitní zobrazení zdravých, resp. jemných a vysoce mobilních chlopní. MRI dále není vhodná k hodnocení diskrétních chlopenních patologií, jakými jsou např. vegetace. Patologicky změněné (tuhé a méně pohyblivé) chlopně se s pomocí MRI zobrazují lépe, i když kalcifikace a turbulentní proudění mohou být zdrojem artefaktů.
Orientační hodnocení nedomykavosti chlopní umožňují dynamické MRI sekvence gradientního echa. Přesnou kvantifikaci chlopenních insuficiencí je však nutné provést na základě hemodynamických měření. Regurgitační objemy/frakce mohou být vypočítány porovnáním tepových objemů levé a pravé komory. Při kombinovaném postižení chlopní lze pro výpočty použít i tepové objemy získané výpočtem z měření toku v plicnici a aortě [43]. Při hodnocení mitrální insuficience je tento způsob měření srovnatelný s dopplerovskou echokardiografií [23].
Regurgitační objem při aortální insuficienci lze stanovit měřením retrográdního proudění v aortě metodou fMR. Tento postup je charakterizován vysokou reprodukovatelností a může být přesnější než dopplerovské měření [10].
MRI hodnocení chlopenních stenóz může být prováděno jak přímým zobrazením plochy ústí (obr. 4), tak výpočtem z rovnice kontinuity na základě měření rychlostí toků. Přímá planimetrie vyžaduje pečlivou volbu vrstvy zobrazení s ohledem na pohyb chlopenního anulu během srdečního cyklu. Přesné stanovení maximální rychlosti proudění při fMR závisí na určení roviny měření, která by měla být kolmá ke směru hlavního jetu, což může být někdy velmi obtížné.
Obr. 4. Aortální stenóza. Planimetrie aortálního ústí u nemocného s významnou aortální stenózou. 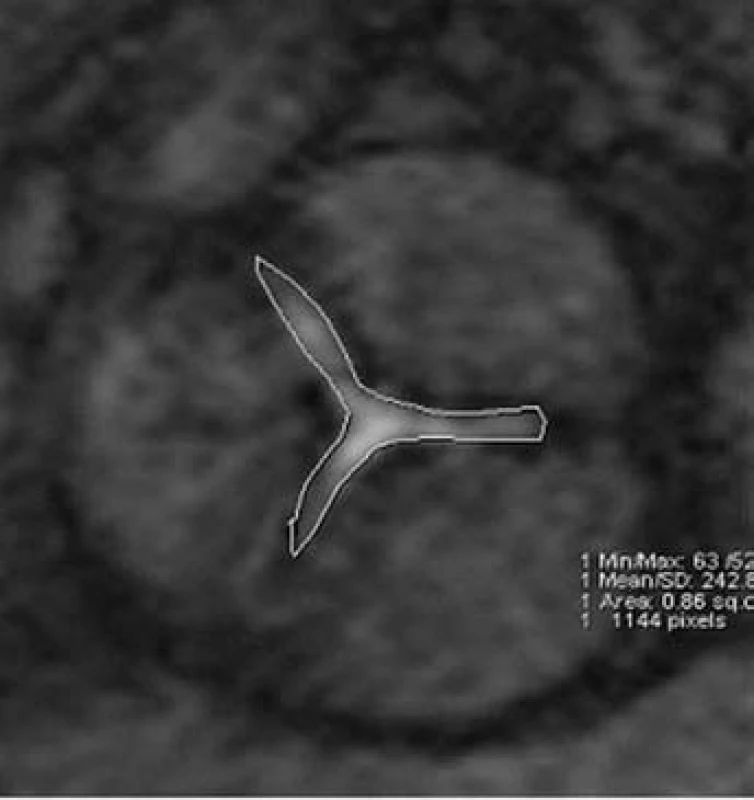
Nejvíce zkušeností je s hodnocením aortálního ústí [28]. MRI planimetrie je charakterizována vysokou reprodukovatelností a získané hodnoty velmi dobře odpovídají jícnové echokardiografii [25]. Díky nižšímu výskytu artefaktů způsobených kalcifikacemi umožňuje MRI kvalitní zobrazení u naprosté většiny vyšetřovaných nemocných. Při srovnání MRI planimetrie se srdeční katetrizací bylo opakovaně pozorováno mírné nadhodnocení plochy ústí MR zobrazením [28]. Tato diskrepance však dle našich pozorování obvykle nehraje roli v určení závažnosti stenózy, resp. neovlivňuje klinickou indikaci náhrady chlopně. Závažnost zúžení aortální chlopně lze určit i výpočtem na základě měření rychlostí toků na chlopni a ve výtokovém traktu levé komory [5]. Tato metoda je však z praktického hlediska náročnější a nepřináší kvalitnější informaci ve srovnání s planimetrií.
MR zobrazení aortální chlopně může mít velký klinický význam hlavně v případech, kdy je podezření na významnou stenózu s nízkým gradientem při sníženém tepovém výdeji. Ultrazvukové vyšetření nemusí být v těchto případech přesné a srdeční katetrizace je zatížena rizikem kardioembolizmu při průchodu katétru patologicky změněnou chlopní [36].
Pomocí MRI lze určit i závažnost mitrální stenózy [9]. Tato vada je však obvykle dobře hodnotitelná echokardiograficky a nelze předpokládat, že by MRI v této indikaci nalezla v budoucnu širší uplatnění.
Vrozené vývojové vady
MRI je vhodnou technikou pro diagnostiku a klinické sledování vrozených srdečních vad. Zobrazení myokardu v libovolných tomografických vrstvách umožňuje přesně hodnotit anatomii srdečních oddílů i souvisejících cév [40], což je důležité zejména u nemocných s komplexními vadami [19], kteří nemusí být vždy dobře vyšetřitelní ultrazvukem. V indikovaných případech je možné pomocí funkční MRI měřit hemodynamické parametry včetně zkratové cirkulace [17]. Takto získané informace mohou hrát důležitou roli jak v diagnostice, tak v indikaci korektivních kardiochirurgických výkonů. Absence ionizujícího záření a vysoká reprodukovatelnost MR zobrazení umožňují použití této techniky v dlouhodobém sledování.
Intrakardiální tumory a tromby
MRI patří spolu s echokardiografií k základním zobrazovacím metodám v diagnostice srdečních tumorů a trombů. Ve velké většině případů může MRI určit přesnou lokalizaci a rozsah patologického útvaru, což je důležitý údaj při indikaci kardiochirurgického výkonu.
Určení tkáňové MRI charakteristiky tumoru může přispět v diferenciální diagnostice [44]. Vysokou intenzitu signálu při T1 váženém zobrazení pozorujeme u tumorů s vysokým obsahem tuku, hemoragií a cyst s vysokým obsahem proteinu. Nízká intenzita signálu při T1 váženém zobrazení bývá u cévních malformací a kalcifikací. Cévní tumory (hemangiomy, angiosarkomy) se opacifikují krátce po podání kontrastní látky, pozdní kumulace je typická pro maligní tumory, myxomy a hemangiomy. Cysty a tromby paramagnetickou kontrastní látku nekumulují. Variabilní histologická struktura (myxoidní matrix, cysty, hemoragie, kalcifikace) odpovídá různorodému MRI obrazu myxomů, které patří mezi nejčastější srdeční tumory (obr. 5).
V diagnostice levokomorových trombů v terénu systolické dysfunkce při ICHS je MRI podstatně přesnější než echokardiografie [47]. Postkontrastní MR zobrazení umožní přesné odlišení kontrastní látkou zvýrazněného infarktového ložiska od trombu, který kontrastní látku nekumuluje (obr. 1).
Onemocnění perikardu
K diagnostice perikardiálního výpotku téměř vždy postačuje echokardiografie. MRI může pomoci jen v ojedinělých případech, v nichž není možné pomocí ultrazvuku dobře zhodnotit anatomickou lokalizaci parakardiální tekutinové kolekce. Příkladem toho jsou perikardiální cysty, které bývají uložené v pravém kostofrenickém úhlu. MRI charakter signálu dovoluje někdy odhadnout charakter perikardiálního výpotku.
Konstriktivní perikarditida je vzácné a často obtížně rozpoznatelné onemocnění. I když echokardiografie se srdeční katetrizací jsou diagnostické metody volby, MRI může být cenným pomocným zobrazením (ztluštění perikardu, abnormální pohyb mezikomorového septa) [29]. V hodnocení tloušťky perikardu je MRI spolu s CT přesnější než echokardiografie, avšak MRI na rozdíl od CT nedokáže zobrazit kalcifikace.
MRI má význam také v diagnostice perikardiálních tumorů, kdy může přispět k hodnocení rozsahu onemocnění a v některých případech i k určení charakteru tkáně. Tumorózní nodularity opacifikující se po podání kontrastní látky jsou typické pro metastatické postižení.
MR angiografie v kardiologii
Kardiologické indikace MRA zahrnují vyšetření aorty, plicnice a renálních tepen. Vyšetření ostatních cév patří spíše do angiologie a neurologie.
Ve zobrazení aorty i plicnice zůstává MRI alternativní metodou k CT vyšetření. MR zobrazení může být preferováno v případě relativních nebo absolutních kontraindikací kontrastního RTG vyšetření.
MRI vyšetření aorty umožňuje zobrazení aneuryzmat, trombů i vředů [37]. V diagnostice disekce aorty je MRI přesnou metodou, která umožňuje současné zobrazení aorty, perikardu a aortální chlopně [6]. Ve srovnání s CT však MRI neumožňuje hodnocení kalcifikací a obvykle nepřináší zásadně nové informace. Výjimkou snad může být průkaz periaortální zánětlivé infiltrace u mykotických aneuryzmat, které bývají patrné při postkontastním T1 váženém MR zobrazení [1].
Při zobrazení plicního řečiště s ohledem na přítomnost plicní embolizace je stále metodou volby CT angiografie. MR zobrazení vyžaduje dlouhé zadržení dechu, což může být problém u nemocných se závažnou plicní embolií.
Role MR angiografie v diagnostice renovaskulárního postižení není zatím zcela jasná. Dostupná data se liší: Na jedné straně je řada menších studií popisujících vysokou přesnost MRI [50]. Na straně druhé jsou výsledky velké multicentrické studie, během níž byla pozorována nízká senzitivita i specificita MRI v diagnostice závažných stenóz renálních tepen, což lze však vysvětlit rozdílnými přístrojovými parametry na jednotlivých pracovištích a obecně nízkým prostorovým rozlišením používaným v této studii [51]. Dle našich zkušeností lze MRA použít pouze k vyloučení renovaskulárního postižení. Problémem zůstává kvantifikace stenotického postižení a hodnocení periferie renální cirkulace.
Při vyšetření koronárních tepen lze pomocí MRI kvalitně zobrazit pouze proximální úseky [22], běžně užívané MRI tomografy zatím neumožňují kvalitní zobrazení periferie. MRI koronarografie je tak přínosná pouze u nemocných s podezřením na anomálii koronárního řečiště [53]. Pro neinvazivní průkaz aterosklerotického postižení koronárního řečiště nabízí v současné době přesnější výsledky multidetektorová počítačová tomografie [41].
Zobrazení plicních žil
Zvláštní indikací MR angiografie je 3D zobrazení levé síně a plicních žil (obr. 6), která umožňuje posoudit anatomii plicních žil před elektrofyziologickou ablací u nemocných s fibrilací síní. Znalost přesné morfologie levé síně usnadňuje provádění elektroanatomického mapování a rozhodování o optimálním způsobu ablace ústí plicních žil [52].
Obr. 6. MRI trojrozměrná rekonstrukce vústění plicních žil do levé síně. 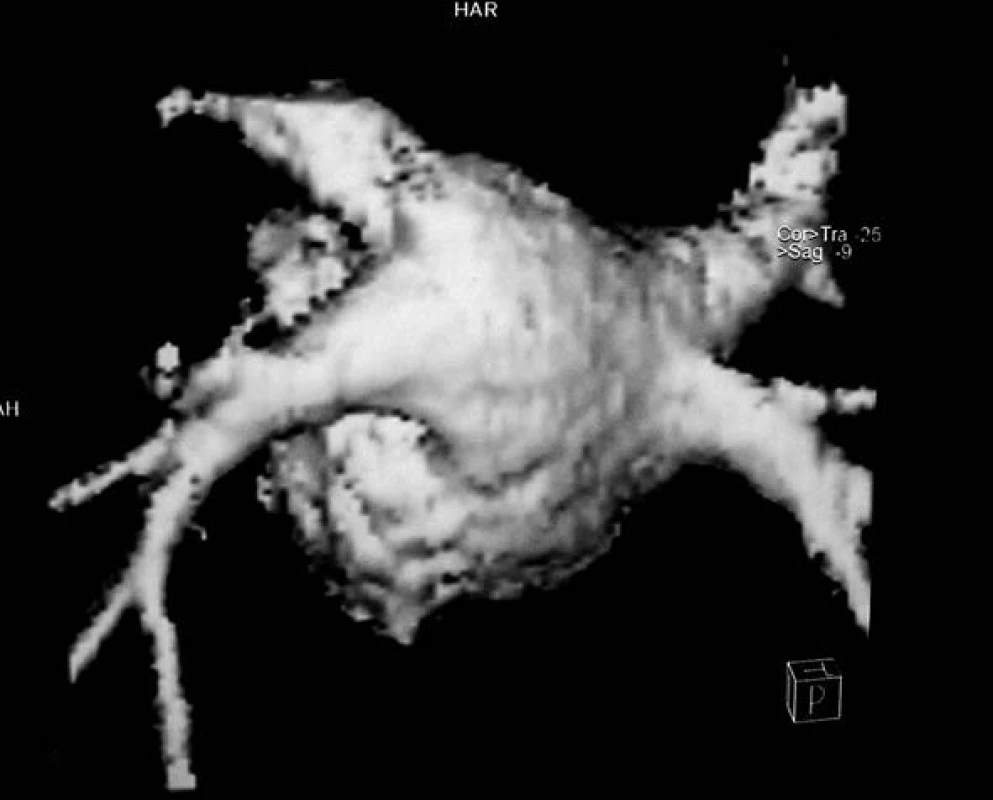
Trendy do budoucna
Vývoj MRI technologie směřuje ke zvýšení časoprostorového rozlišení a zkrácení doby vyšetření, včetně možnosti zobrazení v reálném čase a bez nutnosti zadržení dechu. Současně probíhá vývoj nových diagnostických farmak.
Nejmodernější MRI tomografy dnes umožňují provedení trojrozměrných rekonstrukcí, které mohou být použity např. k přesnému zobrazení arytmogenního substrátu před ablační léčnou u nemocných s komorovými arytmiemi [8]. MRI v reálném čase může být v budoucnu použita pro navigaci při invazivních výkonech. V experimentu bylo popsáno využití této techniky při katetrizačních výkonech a operacích na uzavřeném srdci [39]. Fibrin specifická paramagnetická kontrastní látka usnadňuje MRI detekci trombů v experimentálním modelu [46]. Pro nemocné s implantabilními systémy pro kardiostimulaci a léčbu arytmií jsou hledány bezpečné způsoby MR zobrazení [35]. Nové MRI kompatibilní typy kardiostimulátorů jsou v současnosti klinicky testovány (EnRhythm® MRI).
Závěr
Rozvoj MRI technologie v posledních letech přináší rozšířené možností zobrazení v kardiologii. Vysoká reprodukovatelnost, dobrá rozlišovací schopnost, absence ionizujícího záření spolu s možností hodnotit strukturu i funkci srdečního svalu patří mezi hlavní výhody této vyšetřovací techniky. Vzhledem k omezené dostupnosti a vysoké ceně MRI je v klinické praxi nutno velmi vážit indikace tohoto vyšetření. U většiny kardiologických nemocných postačují pro klinické rozhodování běžně dostupné neinvazivní vyšetřovací metody. MR zobrazení by mělo být indikováno pouze tam, kde jsou výsledky ostatních vyšetření nejasné a kde informace získaná z MRI může pomoci v rozhodování o dalším terapeutickém postupu.
Za jasné indikace MRI srdce lze v současné době považovat podezření na arytmogenní kardiomyopatii pravé komory nebo anomálii koronárního řečiště. MRI je alternativou echokardiografie při posuzování kinetiky srdečních oddílů, hodnocení chlopenních vad a zobrazení intrakardiálních trombů. S ohledem na vysoké náklady spojené s MRI a dostupná data není jisté, zda je toto zobrazení opravdu přínosné i v dalších indikacích.
MUDr. Miroslav Solař, Ph.D.
www.fnhk.cz
e-mail: solarmir@seznam.cz
Doručeno do redakce: 1. 10 2007
Přijato po recenzi: 2. 11. 2007
Zdroje
1. Anbarasu A, Harris PL, McWilliams RG. The role of gadolinium-enhanced MR imaging in the preoperative evaluation of inflammatory abdominal aortic aneurysm. Eur Radiol 2002; 12(Suppl 3): S192-S195.
2. Assomull RG, Prasad SK, Lyne J et al. Cardiovascular magnetic resonance, fibrosis, and prognosis in dilated cardiomyopathy. J Am Coll Cardiol 2006; 48 : 1977-1985.
3. Baer FM, Voth E, LaRosee K et al. Comparison of dobutamine transesophageal echocardiography and dobutamine magnetic resonance imaging for detection of residual myocardial viability. Am J Cardiol 1996; 78 : 415-419.
4. Bellenger NG, Burgess MI, Ray SG et al. Comparison of left ventricular ejection fraction and volumes in heart failure by echocardiography, radionuclide ventriculography and cardiovascular magnetic resonance; are they interchangeable? Eur Heart J 2000; 21 : 1387-1396.
5. Caruthers SD, Lin SJ, Brown P et al. Practical Value of Cardiac Magnetic Resonance Imaging for Clinical Quantification of Aortic Valve Stenosis: Comparison With Echocardiography. Circulation 2003; 108 : 2236-2243.
6. Cesare ED, Giordano AV, Cerone G et al. Comparative evaluation of TEE, conventional MRI and contrast-enhanced 3D breath-hold MRA in the post-operative follow-up of dissecting aneurysms. Int J Card Imaging 2000; 16 : 135-147.
7. Corrado D, Fontaine G, Marcus FI et al. Arrhythmogenic right ventricular dysplasia/cardiomyopathy: need for an international registry. Study Group on Arrhythmogenic Right Ventricular Dysplasia/Cardiomyopathy of the Working Groups on Myocardial and Pericardial Disease and Arrhythmias of the European Society of Cardiology and of the Scientific Council on Cardiomyopathies of the World Heart Federation. Circulation 2000; 101: E101-E106.
8. Dickfeld T. Magnetic Resonance Imaging and radiofrequency ablations. Herzschrittmacherther Elektrophysiol 2007; 18 : 147-156.
9. Djavidani B, Debl K, Lenhart M et al. Planimetry of mitral valve stenosis by magnetic resonance imaging. J Am Coll Cardiol 2005; 45 : 2048-2053.
10. Dulce MC, Mostbeck GH, O’Sullivan M et al. Severity of aortic regurgitation: interstudy reproducibility of measurements with velocity-encoded cine MR imaging. Radiology 1992; 185 : 235-240.
11. Fenster BE, Chan FP, Valentine HA et al. Images in cardiovascular medicine. Cardiac magnetic resonance imaging for myocarditis: effective use in medical decision making. Circulation 2006; 113: e842-e843.
12. Gerber BL, Garot J, Bluemke DA et al. Accuracy of contrast-enhanced magnetic resonance imaging in predicting improvement of regional myocardial function in patients after acute myocardial infarction. Circulation 2002; 106 : 1083-1089.
13. Grothues F, Smith GC, Moon JC et al. Comparison of interstudy reproducibility of cardiovascular magnetic resonance with two-dimensional echocardiography in normal subjects and in patients with heart failure or left ventricular hypertrophy. Am J Cardiol 2002; 90 : 29-34.
14. Grothues F, Moon JC, Bellenger N et al. Interstudy reproducibility of right ventricular volumes, function, and mass with cardiovascular magnetic resonance. Am Heart J 2004; 147 : 218-223.
15. Hendrick RE. The AAPM/RSNA physics tutorial for residents. Basic physics of MR imaging: an introduction. Radiographics 1994; 14 : 829-846.
16. Herborn CU, Watkins DM, Runge VM et al. Renal arteries: comparison of steady-state free precession MR angiography and contrast-enhanced MR angiography. Radiology 2006; 239 : 263-268.
17. Hundley WG, Li HF, Lange RA et al. Assessment of left-to-right intracardiac shunting by velocity-encoded, phase-difference magnetic resonance imaging. A comparison with oximetric and indicator dilution techniques. Circulation 1995; 91 : 2955-2960.
18. Ingkanisorn WP, Kwong RY, Bohme NS et al. Prognosis of negative adenosine stress magnetic resonance in patients presenting to an emergency department with chest pain. J Am Coll Cardiol 2006; 47 : 1427-1432.
19. Kersting-Sommerhoff BA, Diethelm L, Stanger P et al. Evaluation of complex congenital ventricular anomalies with magnetic resonance imaging. Am Heart J 1990; 120 : 133-142.
20. Kim HW, Klem I, Kim RJ Detection of myocardial ischemia by stress perfusion cardiovascular magnetic resonance. Cardiol Clin 2007; 25 : 57-70.
21. Kim RJ, Wu E, Rafael A et al. The use of contrast-enhanced magnetic resonance imaging to identify reversible myocardial dysfunction. N Engl J Med 2000; 343 : 1445-1453.
22. Kim WY, Danias PG, Stuber M et al. Coronary magnetic resonance angiography for the detection of coronary stenoses. N Engl J Med 2001; 345 : 1863-1869.
23. Kizilbash AM, Hundley WG, Willett DL et al. Comparison of quantitative Doppler with magnetic resonance imaging for assessment of the severity of mitral regurgitation. Am J Cardiol 1998; 81 : 792-795.
24. Klein C, Nekolla SG, Bengel FM et al. Assessment of myocardial viability with contrast-enhanced magnetic resonance imaging: comparison with positron emission tomography. Circulation 2002; 105 : 162-167.
25. Kupfahl C, Honold M, Meinhardt G et al. Evaluation of aortic stenosis by cardiovascular magnetic resonance imaging: comparison with established routine clinical techniques. Heart 2004; 90 : 893-901.
26. Kwong RY, Chan AK, Brown KA et al. Impact of unrecognized myocardial scar detected by cardiac magnetic resonance imaging on event-free survival in patients presenting with signs or symptoms of coronary artery disease. Circulation 2006; 113 : 2733-2743.
27. Mahrholdt H, Wagner A, Judd RM et al. Assessment of myocardial viability by cardiovascular magnetic resonance imaging. Eur Heart J 2002; 23 : 602-619.
28. Malyar NM, Schlosser T, Buck T et al. Using cardiac magnetic resonance tomography for assessment of aortic valve area in aortic valve stenosis. Herz 2006; 31 : 650-657.
29. Masui T, Finck S, Higgins CB. Constrictive pericarditis and restrictive cardiomyopathy: evaluation with MR imaging. Radiology 1992; 182 : 369-373.
30. McCrohon JA, Moon JC, Prasad SK et al. Differentiation of heart failure related to dilated cardiomyopathy and coronary artery disease using gadolinium-enhanced cardiovascular magnetic resonance. Circulation 2003; 108 : 54-59.
31. Moon JC, Fisher NG, McKenna WJ et al. Detection of apical hypertrophic cardiomyopathy by cardiovascular magnetic resonance in patients with non-diagnostic echocardiography. Heart 2004; 90 : 645-649.
32. Moon JC, McKenna WJ, McCrohon JA et al. Toward clinical risk assessment in hypertrophic cardiomyopathy with gadolinium cardiovascular magnetic resonance. J Am Coll Cardiol 2003; 41 : 1561-1567.
33. Moon JC, Sachdev B, Elkington AG et al. Gadolinium enhanced cardiovascular magnetic resonance in Anderson-Fabry disease. Evidence for a disease specific abnormality of the myocardial interstitium. Eur Heart J 2003; 24 : 2151-2155.
34. Nagel E, Lehmkuhl HB, Bocksch W et al. Noninvasive diagnosis of ischemia-induced wall motion abnormalities with the use of high-dose dobutamine stress MRI: comparison with dobutamine stress echocardiography. Circulation 1999; 99 : 763-770.
35. Nazarian S, Roguin A, Zviman MM et al. Clinical utility and safety of a protocol for noncardiac and cardiac magnetic resonance imaging of patients with permanent pacemakers and implantable-cardioverter defibrillators at 1.5 tesla. Circulation 2006; 114 : 1277-1284.
36. Omran H, Schmidt H, Hackenbroch M et al. Silent and apparent cerebral embolism after retrograde catheterisation of the aortic valve in valvular stenosis: a prospective, randomised study. Lancet 2003; 361 : 1241-1246.
37. Pennell DJ, Sechtem UP, Higgins CB et al. Clinical indications for cardiovascular magnetic resonance (CMR): Consensus Panel report. Eur Heart J 2004; 25 : 1940-1965.
38. Perugini E, Rapezzi C, Piva T et al. Non-invasive evaluation of the myocardial substrate of cardiac amyloidosis by gadolinium cardiac magnetic resonance. Heart 2006; 92 : 343-349.
39. Raman VK, Lederman RJ. Interventional cardiovascular magnetic resonance imaging. Trends Cardiovasc Med 2007; 17 : 196-202.
40. Sahn DJ, Vick GW 3rd. Review of new techniques in echocardiography and magnetic resonance imaging as applied to patients with congenital heart disease. Heart 2001; 86(Suppl 2): II41-II53.
41. Schuijf JD, Bax JJ, Shaw LJ et al. Meta-analysis of comparative diagnostic performance of magnetic resonance imaging and multislice computed tomography for noninvasive coronary angiography. Am Heart J 2006; 151 : 404-411.
42. Schwitter J, Nanz D, Kneifel S et al. Assessment of myocardial perfusion in coronary artery disease by magnetic resonance: a comparison with positron emission tomography and coronary angiography. Circulation 2001; 103 : 2230-2235.
43. Sechtem U, Pflugfelder PW, Cassidy MM et al. Mitral or aortic regurgitation: quantification of regurgitant volumes with cine MR imaging. Radiology 1988; 167 : 425-430.
44. Semelka RC, Shoenut JP, Wilson ME et al. Cardiac masses: signal intensity features on spin-echo, gradient-echo, gadolinium-enhanced spin-echo, and TurboFLASH images. J Magn Reson Imaging 1992; 2 : 415-420.
45. Shimada T, Shimada K, Sakane T et al. Diagnosis of cardiac sarcoidosis and evaluation of the effects of steroid therapy by gadolinium-DTPA-enhanced magnetic resonance imaging. Am J Med 2001; 110 : 520-527.
46. Spuentrup E, Katoh M, Buecker A et al. Molecular MR imaging of human thrombi in a swine model of pulmonary embolism using a fibrin-specific contrast agent. Invest Radiol 2007; 42 : 586-595.
47. Srichai MB, Junor C, Rodriguez LL et al. Clinical, imaging, and pathological characteristics of left ventricular thrombus: a comparison of contrast-enhanced magnetic resonance imaging, transthoracic echocardiography, and transesophageal echocardiography with surgical or pathological validation. Am Heart J 2006; 152 : 75-84.
48. Stork A, Muellerleile K, Bansmann PM et al. Value of T2-weighted, first-pass and delayed enhancement, and cine CMR to differentiate between acute and chronic myocardial infarction. Eur Radiol 2007; 17 : 610-617.
49. Takahashi N, Inoue T, Oka T et al. Diagnostic use of T2-weighted inversion-recovery magnetic resonance imaging in acute coronary syndromes compared with 99mTc-Pyrophosphate, 123I-BMIPP and 201TlCl single photon emission computed tomography. Circ J 2004; 68 : 1023-1029.
50. Vasbinder GB, Nelemans PJ, Kessels AG et al. Diagnostic tests for renal artery stenosis in patients suspected of having renovascular hypertension: a meta-analysis. Ann Intern Med 2001; 135 : 401-411.
51. Vasbinder GB, Nelemans PJ, Kessels AG et al. Accuracy of computed tomographic angiography and magnetic resonance angiography for diagnosing renal artery stenosis. Ann Intern Med 2004; 141 : 674-682.
52. Vonken EP, Velthuis BK, Wittkampf FH et al. Contrast-enhanced MRA and 3D visualization of pulmonary venous anatomy to assist radiofrequency catheter ablation. J Cardiovasc Magn Reson 2003; 5 : 545-551.
53. Welker M, Salanitri J, Deshpande VS et al. Coronary artery anomalies diagnosed by magnetic resonance angiography. Australas Radiol 2006; 50 : 114-121.
54. Wisenberg G, Prato FS, Carroll SE et al. Serial nuclear magnetic resonance imaging of acute myocardial infarction with and without reperfusion. Am Heart J 1998; 115 : 510-518.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Z odborné literatury
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2008 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Monitorace 24hodinového krevního tlaku - editorial
- Může mít význam stanovení hladin natriuretických peptidů u nemocných bez zjevného srdečního selhání? - editorial
- Invazivní aspergilóza: je čas na optimismus?- editorial
- Je dyslipidemie rizikovým faktorem pro nemocné léčené antiretrovirovými léky? - editorial
- Infekce tepenných rekonstrukcí - editorial
- Sledování protinádorové buněčné imunitní odpovědi u nemocných s renálním karcinomem, porucha proliferace T-lymfocytů
- Stanovení hodnot 24hodinového ambulantního monitorování krevního tlaku odpovídajících kazuálnímu tlaku 130/80 mm Hg
- Faktory se vztahem k hodnotám NT-proBNP u hemodynamicky stabilních pacientů s normální systolickou funkcí levé komory
- Invazivní aspergilové infekce u hematoonkologických nemocných: význam jednotlivých diagnostických metod, léčebných postupů a nástin finanční náročnosti léčby
- Dyslipidemie indukovaná antiretrovirovými léčivy
- Infekce tepenných rekonstrukcí: praktický pohled
- Současné možnosti zobrazení magnetickou rezonancí v kardiologii
- Význam endokanabinoidního systému v regulaci energetické rovnováhy
- Odporúčania pre diagnostiku a liečbu periférneho artériového ochorenia končatín (PAO)
- Každý den u nás umírá zbytečně nejméně 60 osob!
- Kvantifikace pravo-levého zkratu u pacientky s mnohočetnými plicními arteriovenózní malformacemi v rámci hemoragické hereditární teleangiektázie pomocí celotělové scintigrafie s 99mTc-makroagregatem humánního sérového albuminu: kazuistika
- Z odborné literatury
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Odporúčania pre diagnostiku a liečbu periférneho artériového ochorenia končatín (PAO)
- Kvantifikace pravo-levého zkratu u pacientky s mnohočetnými plicními arteriovenózní malformacemi v rámci hemoragické hereditární teleangiektázie pomocí celotělové scintigrafie s 99mTc-makroagregatem humánního sérového albuminu: kazuistika
- Sledování protinádorové buněčné imunitní odpovědi u nemocných s renálním karcinomem, porucha proliferace T-lymfocytů
- Faktory se vztahem k hodnotám NT-proBNP u hemodynamicky stabilních pacientů s normální systolickou funkcí levé komory
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy