-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Dyslipidemie indukovaná antiretrovirovými léčivy
Dyslipidaemia inducted by antiretroviral agents
The clinical course of HIV/AIDS has been substantially modified by up-to date therapy in the recent years. The progress of the disorder has changed – today it is a chronic disease of many years course. Already in 1997 and 1998 it turned out that adverse metabolic changes which significantly affect the subsequent progress of the disease were produced by long-term HAART (highly active antiretroviral therapy). Gradually, more and more anthropometric, metabolic and coagulation changes are detected, closely resembling the changes seen in the metabolic syndrome, well known from cardiology and internal medicine - dyslipoproteinaemia, insulin resistance, abdominal obesity and so on. A combination of these disorders is clinically significant due to their role in the development of atherosclerosis and their, by no means negligible, involvement in the onset of ischaemic heart disease. In view of the much lower average age of HIV - positive individuals the earlier mentioned complications should be expected in much lower age categories than with HIV - negative individuals. Plasma lipid fractions (total cholesterol, triglycerides, LDL-cholesterol, HDL-cholesterol, apoA-I, apoB, LDL/HDL, apoA-I/apoB) have been investigated in 69 HIV infected subjects and the changes of these parameteres in the course of progression of HIV/AIDS due to cumulative time of exposure to HAART were explored. Significant increase of the level of proatherogenic plasma lipid fractions with tendency to develop at time course was found. These disturbances are observed in the course of very good immunological stabilization and viral suppression. No unambiguous data and results of long term studies are available, that would confirm the increase of cardiovascular risk in HIV infected subjects. Nevertheless, this increase is required and anticipated.
Key words:
HIV - HAART - dyslipidaemia - cardiovascular risk
Autoři: S. Snopková 1; K. Povolná 1; P. Husa 1; Jiří Jarkovský 2
; T. Pavlík 2
Působiště autorů: Klinika infekčních chorob Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Petr Husa, CSc. 1; Institut biostatistiky a analýz Masarykovy univerzity Brno, ředitel doc. RNDr. Ladislav Dušek, Ph. D. 2
Vyšlo v časopise: Vnitř Lék 2008; 54(2): 169-177
Kategorie: Původní práce
Souhrn
Současná terapie podstatně modifikovala dosavadní klinický vývoj onemocnění HIV/AIDS, ze kterého se stala typicky chronická choroba s mnohaletým průběhem. Již v letech 1997 a 1998 se ukázalo, že dlouhodobější užívání vysoce aktivní antiretrovirové terapie (HAART), navozuje nežádoucí metabolické změny. Postupně se detekuje stále více a více antropometrických, metabolických a koagulačních změn, které jsou velmi podobné změnám, se kterými se setkáváme u metabolického syndromu, jak je znám z kardiologie a vnitřního lékařství - dyslipoproteinemie, inzulinová rezistence, abdominální obezita atd. Klinický význam kombinace těchto poruch spočívá v jejich roli při rozvoji předčasné aterosklerózy a podstatnou měrou se podílí na vzniku ischemické choroby srdeční. S ohledem na mnohem nižší průměrný věk HIV-pozitivních jedinců by se zmíněné komplikace daly očekávat v podstatně nižší věkové kategorii, než u HIV-negativních. Pro relativně krátký časový interval nejsou v současné době k dispozici jednoznačná data ani výsledky dlouhodobých prospektivních studií, které by přesvědčivě potvrzovaly zvýšení kardiovaskulárního rizika u HIV-pozitivních pacientů, které se ale předpokládá a očekává. U souboru 69 HIV-pozitivních jedinců byly analyzovány hodnoty jednotlivých frakcí krevních lipidů (celkový cholesterol, triglyceridy, LDL-cholesterol, HDL-cholesterol, apoA-I, apoB, LDL/HDL, apoA-I/apoB) a změny těchto parametrů, ke kterým dochází v průběhu progrese onemocnění HIV/AIDS v závislosti na délce užívání HAART. U sledovaného souboru byla zjištěna statisticky významná elevace proaterogenních frakcí lipidového spektra s trendem k dalšímu zvyšování těchto hodnot v čase. K výše uvedeným změnám lipidového profilu dochází při současné velmi dobré imunologické stabilizaci a virové supresi hodnocené absolutním počtem CD4+ lymfocytů/µl plazmy a počtem HIV-1 RNA kopií/ml plazmy.
Klíčová slova:
HIV - HAART - dyslipidemie - kardiovaskulární rizikoÚvod
Poprvé byl syndrom získaného imunodeficitu (Acquired Immunodeficiency Syndrome - AIDS) rozpoznán jako nová klinická jednotka v roce 1981. Už 2 roky po ohlášení nové choroby byl identifikován její původce, nový lidský retrovirus. V roce 1986 na návrh Mezinárodní komise pro nomenklaturu virů byl označen jako virus lidského imunodeficitu (Human Immunodeficiency Virus - HIV).
V pouhém následném desetiletí se AIDS stal pandemií, postihující miliony mužů, žen a dětí všech kontinentů. Během 20 let pandemie dosáhla nebývalého rozsahu a její konečné dimenze nelze ani dnes ještě dost dobře odhadnout [1]. Předpokládá se, že v současnosti žije na celém světě více než 100 milionů nositelů viru HIV [2].
Obrovská exploze nové pandemie vedla velmi naléhavě k potřebě účinných léků. Dramatický vývoj antiretrovirových chemoterapeutik je ojedinělý v historii medicíny. Na základě poznání základních cest replikace HIV v napadené buňce bylo vyvinuto několika typů léčiv [3]. V dnešní době jsou v léčebné praxi onemocnění HIV/AIDS k dispozici léčiva 4 skupin - nukleosidové/nukleotidové inhibitory reverzní transkriptázy (NRTI), nenukleosidové inhibitory reverzní transkriptázy (NNTRI), proteázové inhibitory (PI) a inhibitory fúze (FI).
Na Celosvětové konferenci o AIDS ve Vancouveru v červnu roku 1996 se poprvé objevil termín vysoce aktivní antiretrovirová terapie (highly active antiretroviral therapy - HAART). HAART znamená, že v aktuálním léčebném režimu pacienta se kombinují nejméně 3 virostatika s antiretrovirovou aktivitou nejméně ze 2 různých skupin [4]. Z hlediska moderní farmakoterapie je dvojkombinace či monoterapie za standardních podmínek způsob léčby již neakceptovatelný.
Od roku 1996, kdy byla do terapie HIV/AIDS zavedena HAART, se modifikoval průběh i charakter tohoto onemocnění. Z původně jednoznačně fatální nemoci vznikla chronická choroba s mnohaletým průběhem. Onemocnění se stalo onemocněním nevyléčitelným, ale léčitelným. Již 1 rok po zavedení HAART významně klesla mortalita, dramaticky se snížil počet pacientů, kteří přešli do nejrozvinutější fáze onemocnění, významně se snížila incidence smrtelných oportunních infekcí. Kombinovanými terapeutickými režimy se podařilo snížit virovou replikaci na nedetekovatelnou hodnotu, měřenou počtem HIV-1 RNA kopií/ml krevní plazmy. Tato významná virová suprese a imunologická stabilizace zabraňuje rychlé destrukci imunitního systému a progresi onemocnění. Ve svém konečném důsledku vede k podstatnému prodloužení kvalitního života pacientů o mnoho let.
Nicméně v souvislosti s HAART se objevil zcela nový typ nežádoucích účinků léčiv, který spočívá v rozvoji metabolických změn a poruch, do této doby neznámých a nebo se vyskytujících ve zcela jiných souvislostech [5-13].
Krátce po zavedení HAART se u pacientů užívajících různé režimy kombinací antiretrovirových léčiv začaly objevovat zprávy o výskytu řady antropometrických, metabolických i koagulačních změn, které jsou u všeobecné populace spojeny s metabolickým syndromem a zvýšeným kardiovaskulárním (KV) rizikem - redistribuce tuku a jeho akumulace ve viscerální oblasti, hypertenze, poruchy glukózového metabolizmu a vznik diabetu 2. typu, změny hladiny inhibitoru aktivátoru plazminogenu (PAI-1), zvýšené koncentrace solubilních adhezivních molekul (které jsou považovány za potenciální biomarkery aktivity buněk endotelu), vysoké hladiny krevních lipidů a další [14-20].
Vzhledem k celoživotní nezbytnosti užívání antiretrovirových léčiv, a tím předpokládané mnohaleté expozici jejich účinkům, včetně nežádoucích, je velmi pravděpodobné, že tyto změny by mohly vést ke zvýšenému KV riziku i u HIV-pozitivních [21-25]. S ohledem na mnohem nižší průměrný věk HIV-pozitivních jedinců by se klinické manifestace zmíněných komplikací daly očekávat v podstatně nižší věkové kategorii, než je tomu u všeobecné populace [26].
Moderní farmakoterapie užívá kombinaci virostatik teprve 10 let. Nejsou proto k dispozici rozsáhlejší klinické studie, které by dlouhodobě komplexně sledovaly tyto změny u HIV-pozitivních. Stejně tak nejsou k dispozici ani jednoznačné výsledky adekvátních prospektivních studií, zkoumající změnu KV rizika u těchto pacientů. Většina současných informací je proto stále spíše na úrovni předpokladů a hypotéz.
Soubor nemocných a metodika
V souboru HIV-pozitivních pacientů byly analyzovány hodnoty jednotlivých frakcí krevních lipidů. Bylo zjišťováno, k jakým změnám těchto frakcí dochází v průběhu progrese onemocnění HIV/AIDS v závislosti na délce užívání HAART a jaké jsou trendy vývoje parametrů lipidového spektra u pacientů užívajících HAART v horizontu několika let.
Do souboru bylo zařazeno 69 pacientů, kteří byli postupně sledováni v AIDS centru FN Brno (graf 1). Z celkového počtu 69 bylo 17 žen a 52 mužů. S délkou sledování kratší než 1 rok bylo 26 % pacientů. Tento fakt může do určité míry snižovat relevanci některých výsledků, zejména těch, při nichž je soubor dále rozdělen do několika kategorií.
Graf 1. Celkový počet dispenzarizovaných pacientů v AIDS centru Kliniky infekčních chorob FN Brno v jednotlivých letech. 
V rámci pravidelných ambulantních kontrol nebo během hospitalizace byly sledovány mimo jiné hodnoty celkového cholesterolu, triglyceridů, LDL-cholesterolu, HDL-cholesterolu, apolipoproteinu A-I (apoA-I), apolipoproteinu B (apoB), poměru LDL/HDL a poměru apoA-I/apoB. Krevní lipidy byly stanoveny enzymovou reakcí s oxidační kopulací, výsledný produkt fotometricky. LDL-cholesterol byl stanoven výpočtem s dodržením omezení výpočtu hladinou triglyceridů. Lipoproteiny byly stanoveny imunoturbidimetricky.
Pravidelně byly sledovány také základní imunologické parametry - absolutní počet CD4+ lymfocytů/μl plazmy a počet HIV-1 RNA kopií/ml plazmy (virová nálož, viral load - VL).
Statistické a grafické zpracování souboru bylo provedeno v softwaru STATISTICA 7.0 for Windows a SPSS 12.0.1. for Windows. Vzhledem k různým délkám sledování jednotlivých pacientů byla použita agregace hodnot parametrů lipidového metabolizmu v rámci pacientů s popisem průměru, mediánu a počtu platných čísel. Pro testování rozdílu v hodnotách sledovaných parametrů mezi 2 skupinami pacientů byl použit Mannův-Whitneyův neparametrický test.
Výsledky
V tab. 1 jsou uvedeny kromě průměrných hodnot a mediánů sledovaných parametrů také p-hodnoty, které ukazují, u kterých parametrů lze prokázat statisticky významný rozdíl mezi hodnotami pacientů bez HAART (bez antiretrovirové léčby) a s HAART. Průměrné hodnoty těchto parametrů jsou znázorněny v grafu 2. Je patrné, že u pacientů užívajících HAART dochází na 5% hladině významnosti ke statisticky významné elevaci celkového cholesterolu, triglyceridů, LDL-cholesterolu, apoB a LDL/HDL.
Tab. 1. Hodnoty parametrů lipidového metabolizmu u pacientů bez vysoce aktivní antiretrovirové terapie (HAART) a s HAART. 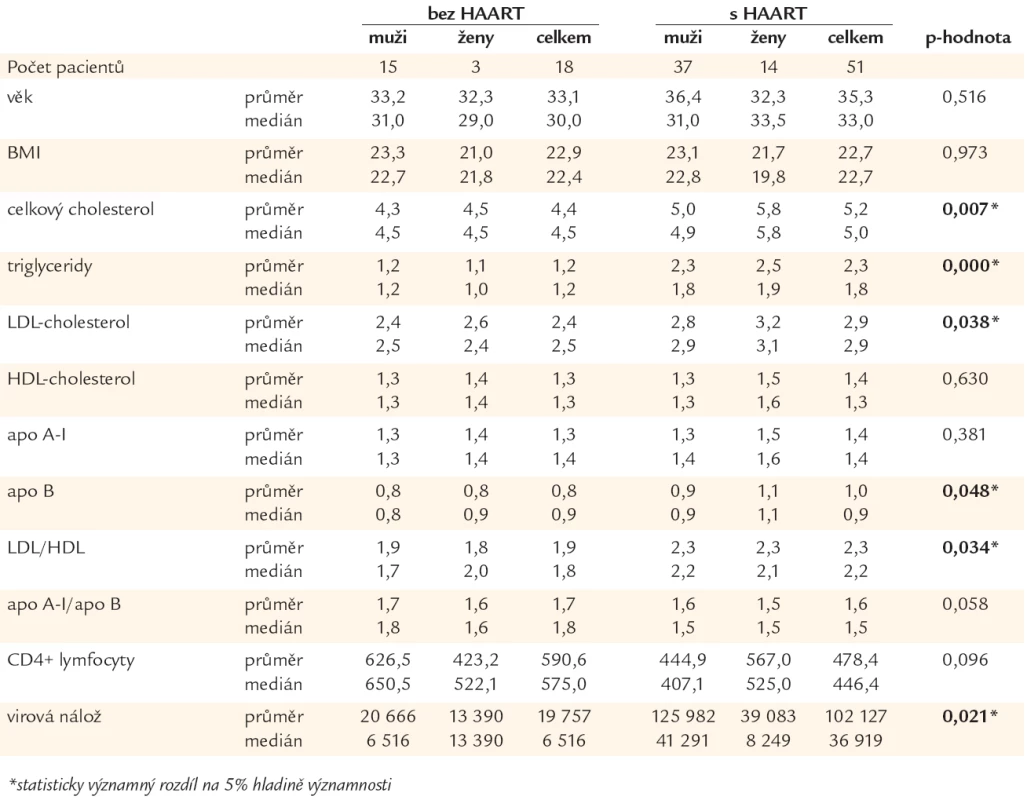
Graf 2. Průměrné hodnoty parametrů lipidového metabolizmu, u nichž dochází ke statisticky významnému rozdílu při srovnání pacientů bez vysoce aktivní antiretrovirové terapie (HAART) a s HAART. 
V analyzovaném souboru byl sledován vývoj jednotlivých parametrů lipidového spektra u pacientů užívajících HAART v čase. Hodnoty pro delší časová období (zejména 5 a více let) jsou z důvodu menšího počtu pacientů s odpovídající délkou sledování podloženy menším počtem validních čísel, což může znamenat jejich menší přesnost. Proto je také uveden počet platných čísel (N), z nichž jsou tyto charakteristiky vypočítány.
Jak ukazuje tab. 2, lze pozorovat tendenci ke kontinuálnímu zvyšování hodnoty celkového cholesterolu, triglyceridů, LDL-cholesterolu, apoB a LDL/HDL a poklesu poměru apoA-I/apoB v závislosti na délce léčby. Parametry HDL-cholesterol a apoA-I jsou bez podstatných změn.
Tab. 2. Hodnoty parametrů lipidového metabolizmu při vysoce aktivní antiretrovirové terapie (HAART) v čase (mmol/l). 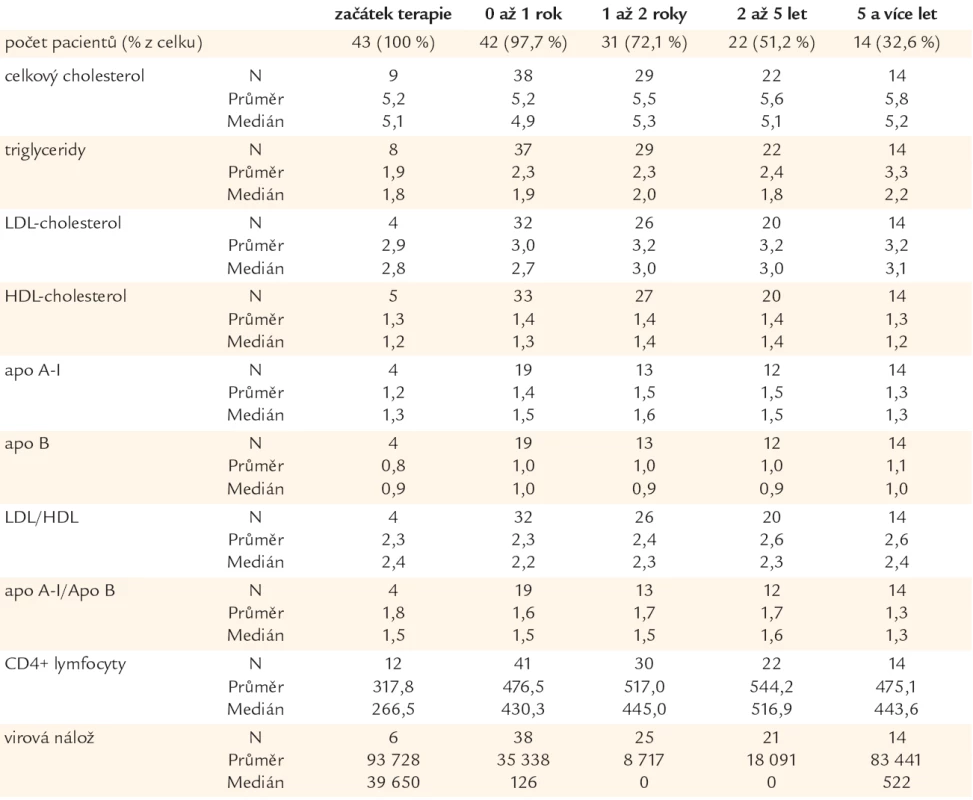
Průměrná hodnota i medián absolutního počtu CD4+ lymfocytů/μl plazmy je nejnižší v době zahájení terapie. Odpovídá to skutečnosti, že indikací k zahájení HAART je postupně progredující imunodeficit, který se mimo jiné projevuje i poklesem absolutního počtu CD4+ lymfocytů/μl plazmy. Po nasazení HAART se regeneruje imunitní systém, což se projeví následným vzestupem této hodnoty. Na velmi solidní úrovni potom imunita zůstává řadu let, jak dokumentuje tab. 2. Průměrná hodnota absolutního počtu CD4+ lymfocytů 475,1 buněk/μl plazmy po 5 a více letech léčby představuje velmi solidní hodnotu spojenou s dobrými imunologickými funkcemi.
Počet HIV-1 RNA kopií/ml plazmy je nejvyšší na začátku terapie. Koresponduje to s tím, že VL je rovněž jedním z faktorů, indikujících zahájení léčby. Po nasazení HAART virová nálož klesá až na úroveň detekovatelnosti a intenzivní virová suprese přetrvává řadu let. Obě hodnoty základních imunologických parametrů, to je hodnota absolutního počtu CD4+ lymfocytů i hodnota virové nálože jsou důkazem vynikající imunologické stabilizace a suprese HIV infekce i po pěti a více letech léčby HIV/AIDS.
V další části byl zjišťován celkový trend vývoje mediánu a variability jednotlivých parametrů lipidového spektra.
U trendu vývoje celkového cholesterolu (graf 3) dochází ke kontinuálnímu zvyšování mediánu i celkové variability směrem k vyšším hodnotám.
Graf 3. Trend vývoje celkového cholesterolu (mmol/l). 
U triglyceridů (graf 4) a LDL-cholesterolu (graf 5) se jedná o skokový nárůst variability směrem k extrémním hodnotám po nasazení HAART. Variabilita se v dalším časovém vývoji již nemění. V závislosti na délce léčby dochází ke kontinuálnímu posunu mediánu obou parametrů do vyšších poloh.
Graf 4. Trend vývoje triglyceridů (mmol/l). 
Graf 5. Trend vývoje LDL-cholesterolu (mmol/l). 
Hodnoty HDL-cholesterolu (graf 6) zůstávají při časovém vývoji bez podstatných změn.
Graf 6. Trend vývoje HDL-cholesterolu (mmol/l). 
U trendu vývoje poměru LDL/HDL (graf 7) byl zaznamenán nápadnější nárůst variability za 0,5 - 1 rok po zahájení léčby HAART. Poloha mediánu se zvyšovala poměrně kontinuálně v čase.
U parametru apoA-I (graf 8) byl do jisté míry naznačen trend ke snižování variability v závislosti na délce léčby. Trend vývoje apoB (graf 9) naznačoval v časovém horizontu zvyšování polohy mediánu a po 3 a více letech byl zjištěn nápadně velký nárůst variability směrem k extrémním hodnotám. Trend vývoje apoA-I/apoB (graf 10) naznačoval pokles mediánu a patrně i snižování variability.
Graf 8. Trend vývoje apoA-I (g/l). 
Graf 9. Trend vývoje apoB (g/l). 
Graf 10. Trend vývoje apoA-I/apoB. 
Diskuse
Většina publikovaných prací, které sledovaly vliv HAART na jednotlivé složky lipidového spektra, sledovala pouze změny hladiny celkového cholesterolu a triglyceridů, ev. LDL-cholesterolu a HDL-cholesterolu. Výsledky těchto prací nelze zcela přesně srovnávat, protože používaly odlišná kritéria hodnocení. V neposlední řadě sledování byla krátkodobá a změny byly analyzovány obvykle jen u několik desítek pacientů. Naznačené trendy jsou ale obdobné. Většina závěrů deklaruje, že až u 75 % pacientů, léčených režimy HAART, dochází ke vzniku dyslipidemie [27,28].
Jednoznačnou závislost mezi koncentrací cholesterolu a výskytem ischemické choroby srdeční (ICHS) u všeobecné HIV-negativní populace prokázaly velké epidemiologické studie [29,30]. Podle trendu vývoje mediánu a variability celkového cholesterolu (graf 3) lze očekávat, že se bude tato hodnota s délkou léčby HAART kontinuálně stále zvyšovat.
Bylo prokázáno, že zvýšená koncentrace triglyceridů zvyšuje riziko ICHS u všeobecné populace bez ohledu na koncentraci LDL-cholesterolu i HDL-cholesterolu. V našem souboru byl evidentní zcela jasný skokový nárůst variability do extrémních hodnot již několik měsíců po nasazení HAART (graf 4).
Z velkých intervenčních studií u HIV-negativní populace, publikovaných v posledních letech, jasně vyplynulo, že pro míru KV rizika je nejpodstatnější hodnota LDL-cholesterolu (respektive koncentrace cholesterolu v LDL). Studie ukazují, že žádoucí jsou co nejnižší hodnoty LDL-cholesterolu. V souvislosti s kardiovaskulárním rizikem a rizikem ICHS se mluví, že „čím níže (se podaří ustálit hladinu LDL-cholesterolu), tím lépe“. Ve studii REVERSAL je prokazován významný benefit pro pacienty při poklesu LDL-cholesterolu na 2,0 mmol/l a ve studii PROVE-IT dokonce na hodnoty 1,6 mmol/l [31]. Zásadní vliv na nárůst hodnoty variability LDL-cholesterolu má nasazení HAART. Vliv léčby je rovněž zcela evidentní již za 6 měsíců od zahájení léčby (graf 5).
Framinghamská studie prokázala, že při jakékoli hladině LDL-cholesterolu znamená vysoká koncentrace HDL-cholesterolu (respektive koncentrace cholesterolu v HDL) nižší kardiovaskulární riziko u všeobecné populace. Snížená hladina HDL-cholesterolu byla proto zavedena jako nezávislý rizikový faktor ICHS [29]. Změnu hladiny HDL-cholesterolu jsme v našem souboru neprokázali (graf 6). Většina pacientů měla ve sledovaném intervalu velmi dobrý imunologický profil s relativně vysokou hodnotou absolutního počtu CD4+ lymfocytů a relativně nízkou VL (tab. 2). Uspokojivá hodnota základních imunologických parametrů byla spojena s relativně dobrou hodnotou HDL-cholesterolu.
Trend vývoje poměru LDL/HDL v čase odpovídá trendu vývoje celkového cholesterolu (graf 7).
Zvýšená koncentrace apoB a snížená koncentrace apoA-I jsou považovány za samostatné rizikové faktory ICHS a jejich stanovení může mít lepší předpovědní hodnotu než měření LDL - a HDL-cholesterolu [29]. ApoB a poměr apoA-I/apoB jsou dnes považovány za citlivější ukazatele KV rizika než koncentrace LDL-cholesterolu a non-HDL-cholesterolu i poměr celkového a HDL-cholesterolu, neboť jedna lipoproteinová částice obsahuje vždy jen jednu molekulu specifického apoproteinu, ale různé množství lipidů. Pro průběh aterosklerózy není nejdůležitější množství cholesterolu cirkulující v plazmě navázané na LDL, ale počet aterogenních částic zachycených v arteriální stěně [33]. Zvýšení apoB při normálním LDL-cholesterolu může signalizovat zvýšený podíl malých LDL3 v krvi s vysokým aterogenním potenciálem [29].
U parametru apoA-I jsme zjistili trend ke snižování variability a poklesu maximálních hodnot a zvyšování minimálních hodnot v závislosti na délce léčby (graf 8). Do jisté míry to koresponduje s vývojem hodnot apoB, které vykazují trend právě opačný (graf 9). V časovém horizontu se zvyšuje poloha mediánu apoB a po 3 a více letech byl zjištěn nápadně velký nárůst variability směrem k extrémním hodnotám. Trend vývoje obou hlavních apolipoproteinů by tak koreloval s trendem ke konstituci proaterogenního lipidového profilu.
U sledovaného souboru byla zjištěna statisticky významná elevace proatrogenních frakcí lipidového spektra s trendem k dalšímu zvyšování těchto hodnot v čase. K výše uvedeným změnám lipidového profilu dochází při současné velmi dobré imunologické stabilizaci a virové supresi hodnocené absolutním počtem CD4+ lymfocytů/μl plazmy a počtem HIV-1 RNA kopií/ml plazmy (tab. 1).
Zatím není přesně jasné, zda-li hluboký imunodeficit, který je typický pro pozdější rozvinutá stadia onemocnění HIV/AIDS, dokáže indukovat významnou proaterogenní reakci, neboť suficientní imunitní reakce hrají zásadní roli v současných teoriích aterogeneze.
Někteří autoři např. uvádějí, že i když LDL tvoří substrát pro glykaci a oxidaci, samy aterogenní nejsou. Imunochemickými metodami se však dají stanovit glykované LDL, oxidované LDL či pohotovost LDL k oxidaci. Se stupněm oxidace LDL koreluje i koncentrace protilátek proti oxidovaným LDL, které patří k určitému typu autoprotilátek [32]. Není jasné, do jaké míry může imunodeficit při HIV a jeho postupná progrese ovlivnit případnou schopnost glykace a oxidace LDL a tvorbu náležitého množství a kvality autoprotilátek proti oxidovaným LDL. Zdá se také, že solidní stav imunitních funkcí je spojen s relativně uspokojivou hodnotou HDL-cholesterolu. Na významnější pokles hodnoty HDL-cholesterolu mají zřejmě mnohem větší vliv těžká rozvinutá stadia HIV infekce s vysokým počtem HIV-1 RNA kopií/ml plazmy a dlouhodobý hluboký imunodeficit s nízkým absolutním počtem CD4+ lymfocytů/μl plazmy nežli vlastní HAART [34].
Kromě toho zejména nápadný nárůst variability u některých parametrů již krátce po nasazení HAART vede k předpokladu, že významná role v reakci organizmu na účinky HAART bude velmi pravděpodobně určena také genetickými faktory.
Závěr
Jednou ze stěžejních otázek současné strategie léčby onemocnění HIV/AIDS je možnost vzniku proaterogenního lipidového profilu a rizika akcelerace předčasné aterosklerózy u mladých HIV-pozitivních jedinců. Pro relativně krátký časový interval nejsou v současné době k dispozici ještě jednoznačná data ani výsledky studií, které by přesvědčivě potvrzovaly zvýšení KV rizika u HIV-pozitivních pacientů, které se ale do jisté míry předpokládá a očekává. Je otázkou sledování v příštích letech, zda-li toto bude potvrzeno a jestli případná míra zvýšení KV rizika po řadě let užívání HAART bude signifikantně převyšovat rizika z totálního selhání imunitního systému.
MUDr. Svatava Snopková, Ph.D.
www.fnbrno.cz
e-mail: svatava.snopkova@fnbrno.cz
Doručeno do redakce: 13. 8. 2007
Přijato po recenzi: 16. 11. 2007
Zdroje
1. Staňková M, Skokanová V. Problematika HIV/AIDS - ohlédnutí a perspektivy. Klin mikrobiol inf lék 2004; 10 : 56-60.
2. 2005 Report on the global AIDS epidemic. UNAIDS 2006.
3. Konvalinka J, Machala L. Terapie AIDS po dvaceti letech. Vesmír 2001; 6 : 332-340.
4. Hoffmann C, Rockstroh J, Kamps. S HIV Medicine 2006. 1st ed. Paris: Flying Publisher 2006.
5. Carpentier A, Patterson BW, Uffelman KD et al. Mechanism of highly active anti-retroviral therapy - induced hyperlipidemia in HIV-infected individuals. Atherosclerosis 2005; 178 : 165-172.
6. Barbaro G. Highly Active antiretroviral therapy and the cardiovascular system: the heart of the matter. Pharmacology 2003; 69 : 177-179.
7. Mary-Krause M, Cotte L, Simon A et al. Increased risk of myocardial infarction with duration of protease inhibitor therapy in HIV-infected men. AIDS 2003; 17 : 2479-2486.
8. Calza L, Manfredi R, Chiodo F. Statins and fibrates for the treatment of hyperlipidaemia in HIV-infected patients receiving HAART. AIDS 2003; 17 : 851-859.
9. Broedl UC, Maugeais C, Millar JS et al. Endothelial lipase promotes the catabolism of ApoB-containing lipoproteins. Circ Res 2004; 94 : 1554-1561.
10. Reeds DN, Mittendorfer B, Patterson BW et al. Alterations in lipid kinetics in men with HIV-dyslipidemia. Am J Physiol 2003; 285 : 490-497.
11. Lichtenstein KA, Delaney KM, Armon C et al. Incidence of and risk factors for lipoatrophy (abnormal fat loss) in ambulatory HIV-infected patients. J Acquir Immune Defic Syndr 2003; 32 : 48-56.
12. Calza L, Manfredi R, Colangeli V et al. Substitution of nevirapine or efavirenz for protease inhibitor versus lipid-lowering therapy for the management of dyslipidaemia. AIDS 2005; 19 : 1051-1058.
13. Herlihy OM, Barrow BA, Grant PJ et al. Hyperglycaemic siblings of Type II (non-insulin-dependent) diabetic patients have increased PAI-1, central obesity and insulin resistance compared with their paired normoglycaemic sibling. Diabetologia 2002; 45 : 635-641.
14. Hadigan C, Meigs JB, Corcoran C et al. Metabolic abnormalities and cardiovascular disease risk factors in adults with human immunodeficiency virus infection and lipodystrophy. Clin Infect Dis 2001; 32 : 130-139.
15. Addy CL, Gavrila A, Tsiodras S et al. Hypoadiponectinemia is associated with insulin resistance, hypertriglyceridemia and fat redistribution in human immunodeficiency virus-infected patients treated with highly active antiretroviral therapy. J Clin Endocrionol Metab 2003; 88 : 627-636.
16. Cotter BR. Endothelial dxsfunction in HIV infection. Curr HIV/AIDS Rep 2006; 3 : 126-131.
17. Mu H, Chai H, Lin PH et al. Current update on HIV-associated vascular disease and endothelial dysfunction. World J Surg 2007; 31 : 632-643.
18. Hurlimann D, Weber R, Enseleit F et al. HIV infection, antiretroviral therapy and endothelium. Herz 2005; 30 : 472-480.
19. Grinspoon SK. Metabolic syndrome and cardiovascular disease in patients with human immunodeficiency virus. Am J Med 2005; 118 : 23S-28S.
20. Barbaro G. Highly active antiretroviral therapy-associated metabolic syndrome: pathogenesis and cardiovascular risk. Am J Ther 2006; 13 : 248-260.
21. Balasubramanyam A, Sekhar RV, Jahoor F et al. Pathophysiology of dyslipidemia and increased cardiovascular risk in HIV lipodystrophy: a model of „systemic steatosis“. Curr Opin Lipidol 2004; 15 : 59-67.
22. Bartlett JG, Gallant JE. Medical management of HIV Infection 2004. Johns Hopkins University School of Medicine Baltimore, Health Publishing Business Group, 2004 : 93-98.
23. Nolan D. Metabolic complications associated with HIV protease inhibitor therapy. Drugs 2003; 63 : 2555-2574.
24. Perret B, Ferrand C, Bonnet E et al. Lipoprotein metabolism in HIV-positive patients. E J Med Res 2003; 8: Suppl. II: 6-7.
25. De Gaetano Donati K, Rabagliati R, Iacoviello L et al. HIV infection, HAART, and endothelial adhesion molecules: current perspectives. Lancet Infect Dis 2004; 4 : 213-222.
26. Shahmanesh M, Das S, Stolinski M et al. Antiretroviral treatment reduces very-low-density lipoprotein and intermediate-density lipoprotein apolipoprotein B fractional catabolic rate in Human Immunodeficiency Virus-infected patients with mild dyslipidemia. J Clin Endocrinol Metab 2005; 2 : 755-760.
27. Calza L, Manfredi R, Chiodo F. Statins and fibrates for the treatment of hyperlipidaemia in HIV-infected patients receiving HAART. AIDS 2003; 17 : 851-859.
28. The Writing Committee of the DAD Study Group. Cardio - and cerebrovascular events in HIV-infected persons. AIDS 2004; 13 : 1811-1817
29. Soška V. Poruchy metabolizmu lipidů - diagnostika a léčba. Praha: Grada Publishing 2001.
30. Soška V. Dyslipidemie u metabolického syndromu. Vnitř Lék 2005; 1 : 77-81.
31. Češka R. Jak dosáhnout cílových hodnot LDL-cholesterolu? Místo ezetimibu v moderní léčbě hypercholesterolemie. Cor Vasa 2004; 46 : 452-456.
32. Racek J et al. Klinická biochemie. Praha: Galén 2006.
33. Frohlich J, Vrablík M. Apolipoprotein B v diagnostice a léčbě dyslipidemií. KF 2006; 4 : 7-9.
34. Barbado G. Pathogenesis of HIV-associated heart disease. AIDS 2003; 17 : 12-20.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Z odborné literatury
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2008 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Monitorace 24hodinového krevního tlaku - editorial
- Může mít význam stanovení hladin natriuretických peptidů u nemocných bez zjevného srdečního selhání? - editorial
- Invazivní aspergilóza: je čas na optimismus?- editorial
- Je dyslipidemie rizikovým faktorem pro nemocné léčené antiretrovirovými léky? - editorial
- Infekce tepenných rekonstrukcí - editorial
- Sledování protinádorové buněčné imunitní odpovědi u nemocných s renálním karcinomem, porucha proliferace T-lymfocytů
- Stanovení hodnot 24hodinového ambulantního monitorování krevního tlaku odpovídajících kazuálnímu tlaku 130/80 mm Hg
- Faktory se vztahem k hodnotám NT-proBNP u hemodynamicky stabilních pacientů s normální systolickou funkcí levé komory
- Invazivní aspergilové infekce u hematoonkologických nemocných: význam jednotlivých diagnostických metod, léčebných postupů a nástin finanční náročnosti léčby
- Dyslipidemie indukovaná antiretrovirovými léčivy
- Infekce tepenných rekonstrukcí: praktický pohled
- Současné možnosti zobrazení magnetickou rezonancí v kardiologii
- Význam endokanabinoidního systému v regulaci energetické rovnováhy
- Odporúčania pre diagnostiku a liečbu periférneho artériového ochorenia končatín (PAO)
- Každý den u nás umírá zbytečně nejméně 60 osob!
- Kvantifikace pravo-levého zkratu u pacientky s mnohočetnými plicními arteriovenózní malformacemi v rámci hemoragické hereditární teleangiektázie pomocí celotělové scintigrafie s 99mTc-makroagregatem humánního sérového albuminu: kazuistika
- Z odborné literatury
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Odporúčania pre diagnostiku a liečbu periférneho artériového ochorenia končatín (PAO)
- Kvantifikace pravo-levého zkratu u pacientky s mnohočetnými plicními arteriovenózní malformacemi v rámci hemoragické hereditární teleangiektázie pomocí celotělové scintigrafie s 99mTc-makroagregatem humánního sérového albuminu: kazuistika
- Sledování protinádorové buněčné imunitní odpovědi u nemocných s renálním karcinomem, porucha proliferace T-lymfocytů
- Faktory se vztahem k hodnotám NT-proBNP u hemodynamicky stabilních pacientů s normální systolickou funkcí levé komory
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




