-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Infarkt myokardu, remodelace levé komory a buněčná terapie
Myocardial infarction, left ventricle remodelation and cellular therapy
The paper brings an overview of results of the most important and significant clinical studies dealing with the issues of bone marrow stem cell implantation in patients with acute myocardial infarction. On the world scale, research has been focused on this area for several years. Much hope is put primarily on the possibility to prevent the process of progressive remodelling of the left ventricle, the substitution of necrotic or fibrotic tissue and the resulting prevention of development and progression of heart failure. In the centre of attention are especially patients whose long‑term prognosis is often very poor in spite of progress in contemporary medicine.
Key words:
acute myocardial infarction – stem cells – remodelling of the left ventricle – bone marrow mononuclear cells – left ventricular ejection fraction
Autori: H. Skalická jr. 1; J. Horák 1; M. Aschermann 1; A. Linhart 1; T. Paleček 1; P. Kobylka 2
Pôsobisko autorov: II. interní klinika kardiologie a angiologie 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Aleš Linhart, DrSc. 1; Oddělení buněčné terapie Ústavu klinické a experimentální hematologie 1. lékařské fakulty UK a ÚHKT Praha, přednosta prof. MUDr. Pavel Klener, DrSc. 2
Vyšlo v časopise: Vnitř Lék 2009; 55(1): 37-44
Kategória: Přehledné referáty
Súhrn
V tomto sdělení je uveden přehled výsledků nejdůležitějších a nejvýznamnějších klinických studií zabývajících se problematikou implantace kmenových buněk kostní dřeně u nemocných s akutním infarktem myokardu. Celosvětově je výzkum na tuto oblast soustředěn již několik let. Naděje je vkládána především do možností zabránění procesu progresivní remodelace levé komory, nahrazení nekrotického či fibrotické tkáně, a tím odvrácení vzniku a rozvoje srdečního selhání. Středem pozornosti jsou především pacienti, jejichž dlouhodobá prognóza je dosud i přes pokroky v současné medicíně často velmi nepříznivá.
Klíčová slova:
akutní infarkt myokardu – kmenové buňky – remodelace levé komory – mononukleární buňky kostní dřeně – ejekční frakce levé komoryÚvod
Při akutním infarktu myokardu (AIM) dochází ke vzniku ireverzibilní ischemické nekrózy srdečního svalu, která je provázena ztrátou kontraktilních elementů, kardiomyocytů. Rozsah postižení je v prvé řadě závislý na velikosti povodí infarktové tepny, délce trvání ischemie a dále na přítomnosti kolaterální cirkulace, předchozího ischemického zatížení myokardu [1] a v nezanedbatelné míře i na podané léčbě. Bez terapeutického zásahu je u pacientů s AIM udávána mortalita kolem 30 % [2,3]. Díky rozvoji reperfuzní terapie, tj. trombolýzy [4] a perkutánní koronární angioplastiky [5,6], došlo v posledních 20 letech k poklesu hospitalizační mortality u AIM na 6–10 % [7]. Ani rychle navozená rekanalizace infarktové tepny ale nemusí vždy docílit záchrany myokardu [8]. Efekt je limitovaný možnou přítomností defektu na úrovni mikrocirkulace a časným nebo pozdním ischemicko‑reperfuzním poškozením [1,9,10]. Následná ztráta většího množství kontraktilních kardiomyocytů [11] má za následek rozvoj dlouhodobého procesu patologické remodelace levé komory (LK) [12,13]. Dochází k progresivní dilataci dutiny LK a ke změně její geometrie s postupným poklesem systolické funkce nad rámec akutního poškození při vlastním infarktu s výsledným rozvojem chronického srdečního selhání [12,14,15] (obr. 1).
Obr. 1. Patofyziologi remodelace levé komory po AIM s rozvojem srdečního selhání. Částečně upraveno podle [15]. ![Patofyziologi remodelace levé komory po AIM s rozvojem srdečního selhání. Částečně upraveno podle [15].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/a8538fec33135c027af6fc4afb6a1633.jpg)
Lze tedy říci, že současná strategie léčby AIM se zaměřuje především na snížení akutní ztráty myokardiálních buněk dosažením co nejčasnější a nejdokonalejší reperfuze myokardu [9]. Prozatím žádná konvenční léčba nebo klinicky používaná procedura neumožňuje nahradit nekrotický myokard nebo již zformovanou jizvu funkční kontraktilní tkání. Naději do této sféry vnesly v posledním desetiletí až první experimentální a klinické práce zabývající se aplikací kmenových buněk s regeneračním a reparačním potenciálem přímo do myokardu [16,17].
Kmenové buňky, typy, rozdělení
Kmenové buňky (KB) jsou definované jako nediferencované progenitorové buňky s vysokou mitotickou a proliferační aktivitou [18,19]. Mají schopnost sebeobnovy, klonogenicity [20] a multipotence v závislosti na prostředí a charakteru stimulačních a růstových faktorů [21]. Jejich základní rozdělení je velmi komplikované vzhledem k jejich heterogenitě [22,23]. Klinicky i experimentálně pro lepší orientaci a identifikaci vhodných buněk se zdá být nejpřehlednější dělení dle zdroje buněk (tab. 1). Vzhledem k tomu, že ve všech publikovaných studiích s KB je klíčovým momentem výběr typu implantovaných buněk [22], bylo hledáno i rozdělení, které by umožňovalo rychlou orientaci v problému a vycházelo z jejich dostupnosti, afinity k myokardu a endotelu cév a schopnosti mitotického dělení. Ott et al a Taylor et al [24,25] vycházeli z fyziologických a patofyziologických dějů, ztráty specifického typu elementů a nutnosti jejich náhrady (obr. 2). Popisují, že při plně rozvinutém srdečním selhání jsou pro zrestaurování myokardu vhodné buňky, které jsou schopné aktivovat kontraktilitu a myogenezu, tedy mezenchymální buňky [26–28] i skeletální myoblasty [25,29–31]. Recentně po AIM, pro zlepšení průběhu angiogenezy a zachránění hibernovaného myokardu [17,32–37], se jeví jako mnohem vhodnější podání kmenových buněk kostní dřeně, ke kterým jsou řazeny endotelové progenitorové buňky (EPCs), mononukleární buňky kostní dřeně (BMSCs) a multipotentní buňky.
Obr. 2. Hypotéza výběru kmenových buněk vzhledem k jejich diferenciační schopnosti. Upraveno podle [24,25]. ![Hypotéza výběru kmenových buněk vzhledem k jejich diferenciační schopnosti. Upraveno podle [24,25].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/595605df9613305b6c5dc4806e6b4263.png)
Z hlediska klinického použití je nejslibnější aplikace BMSCs [23]. Jedná se totiž o buňky relativně snadno dostupné, které lze získat v dostatečném množství trepanobiopsií ve směsných populacích (obr. 3). Z experimentálních studií také vyplývá jejich relativně dobrá schopnost diferenciace v kardiomyocyty a endotelové buňky, uspokojivá integrace v místě poškozeného myokardu a bezpečnost podání [22,23,38–42]. Potencují jak myokardiální regeneraci, tak neoangiogenezi [33,34,37,43,44].
Obr. 3. Ukázka odběru mononukleárních kmenových buněk z lopaty kosti kyčelní. 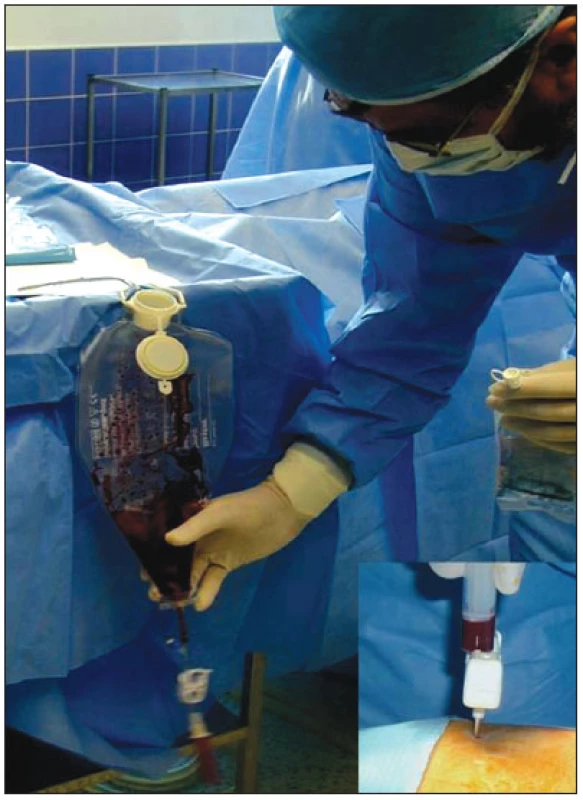
Mechanizmus účinku kmenových buněk
Součastný názor stran mechanizmu účinku KB není zcela jednotný, pravděpodobně se jedná o jejich multifaktoriální působení [21,45].
Jedna z hypotéz regenerace myokardu pomocí KB je založena na jejich schopnosti transdiferenciace na kardiomyocyty [21,46] a začlenění do syntitia s následným vytvořením plně funkční složky myokardu [47]. Velkou roli zde hraje nejenom samotný proces buněčné integrace, ale velmi pravděpodobně i neoangiogeneza [35–37] a především parakrinní stimulace tvorby různých typů růstových faktorů a cytokinů, které se následně podílí na parakrinní a autokrinní aktivaci intra - a intercelulárních dějů [48–51]. Po AIM je hlavním místem působení KB především oblast periinfarktové zóny [10], kde se podílí na inhibici rozvoje apoptózy [52–54], stimulaci diferenciace a migrace myocytů [55,56] (obr. 4).
Obr. 4. Pravděpodobné mechanizmy působení KB na zlepšení funkce levé komory. 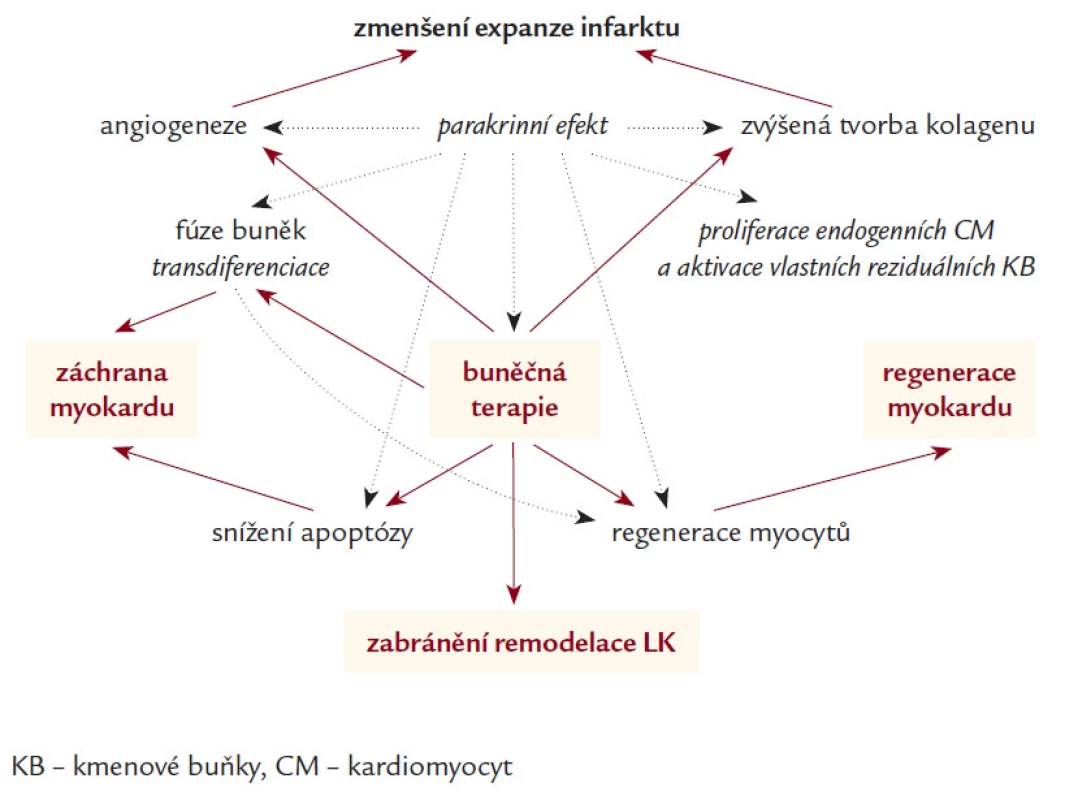
Metody aplikace kmenových buněk
Způsob, jakým jsou KB do myokardu implantovány, může hrát důležitou roli z hlediska jejich efektivity a ovlivnění myokardiální regenerace. V průběhu posledních let byla vyzkoušena řada různorodých metod aplikace.
Intrakoronární aplikace
Jedná se o metodu, kdy se KB aplikují katetrizační metodou, s využitím balónkového katétru typu „over the wire“, který je zaveden standardní technikou do koronární tepny. V místě původního uzávěru tepny při AIM je balónek naplněn na nízký tlak, při kterém je tepna již plně okludovaná. Luminem balónku jsou KB aplikovány za místo uzávěru tepny (obr. 5). Tato metoda byla použita pro svou relativní jednoduchost a minimální invazivitu ve velkém množství experimentálních i klinických studií [22,40–42,57–60]. Otázkou však je, zda takto aplikované KB jsou myokardem dostatečně vychytány. V řadě prací [61], z nichž nejvýznamnější je studie Meyera et al [62], bylo prokázáno pouhé 1–2% zachycení buněk v myokardu za 24 hod po podání. Nicméně pravděpodobně i toto malé množství buněk může hrát jistou roli v navození myokardiální regenerace a neoangiogenezi [33,37].
Obr. 5. Intrakoronární implantace kmenových buněk do ramus interventrikularis anterior (RIA) metodou „over the wire PCI“ katétrem s balónkem o průměru 3,5 mm. Aplikace 5 ml buněčného koncentrátu během 2minutové okluze tepny. 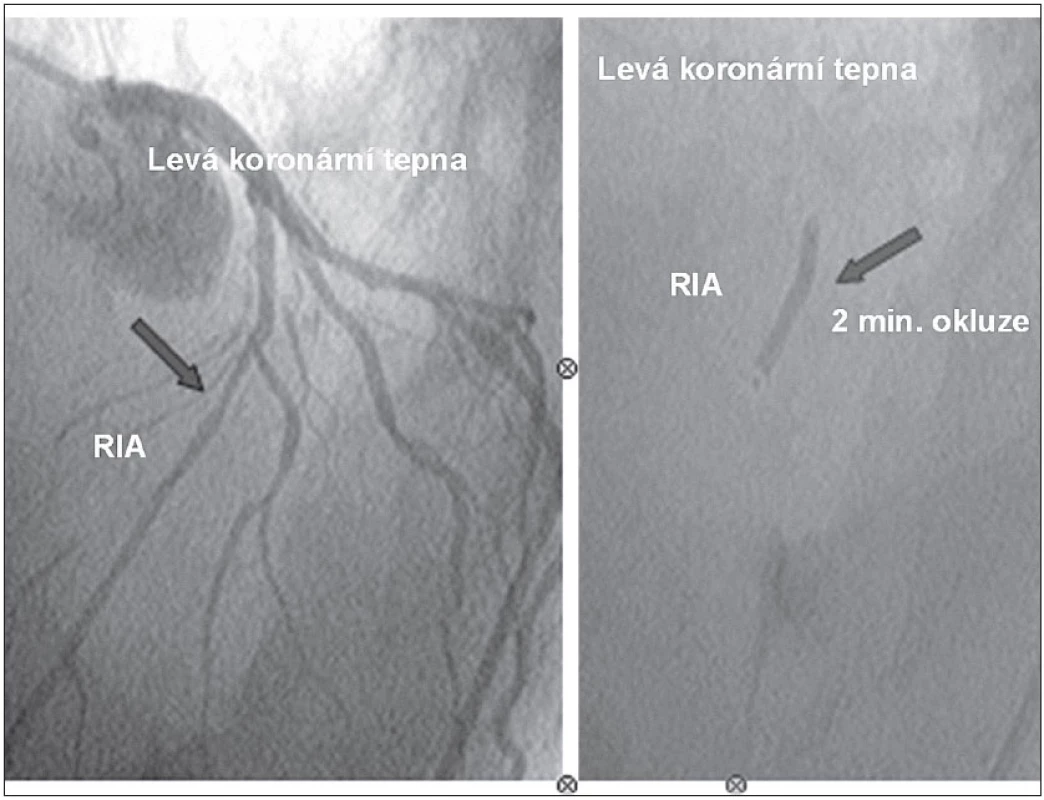
Přímá intramyokardiální aplikace chirurgickou cestou
Využívá se při kardiochirurgických výkonech [30,63–65]. Výhodou je přímá cesta aplikace do ischemicky postiženého místa a následná potenciace především myogeneze. Mezi nevýhody patří nízké množství aplikovaných buněk, potenciální arytmogenicita [66] a vlastní invazivita chirurgické intervence.
Přímá injekce katetrizační a transendokardiální technikou
Jedná se o transendomyokardiální injekci KB z dutiny LK nebo o intrakardiální injekci transvenózním přístupem s použitím tzv. NOGA techniky, která umožňuje lokalizované elektromechanické mapování infarktového ložiska. Kmenové buňky jsou implantovány do ischemických oblastí myokardu pomocí specifického Myostar katétru [67,68]. Nevýhodou je velká finanční nákladnost a specializované technické zázemí. V současnosti probíhá několik studií využívajících tento způsob aplikace, prozatím však nejsou k dispozici výsledky.
Množství aplikovaných kmenových buněk
Doposud nebylo jasné, jaký počet aplikovaných KB je pro ovlivnění funkce levé komory „ideální“. V publikovaných klinických studiích se počty aplikovaných buněk pohybují v řádu od 107 do 109 [22,38,41,69,70]. Závěr metaanalýzy, publikovaný v roce 2008 v srpnu v časopise European Heart Journal [23], upozorňuje, že skutečně existuje těsná vazba mezi množstvím podaných buněk a ovlivněním funkce levé komory. Studie, u kterých bylo podané množství aplikovaných kmenových buněk nad 108 [40,50,62,71,72], vykazovaly signifikantní zlepšení ejekční frakce a kinetiky levé komory. Pravděpodobně se jedná o vztah mezi špatnou endogenní mobilizací BMSCs po AIM v kombinaci s některými komorbiditami (diabetici, hypertonici a kuřáci) [73].
Experimentální a klinické studie
Zájem o využití KB v kardiologii vyvolala experimentální studie amerických autorů Orlic et al, publikovaná v časopise Natura v roce 2001 [16], která prokázala na myších modelech regeneraci postischemicky poškozeného myokardu po intrakoronární aplikaci KB o 53 % (obr. 6).
Obr. 6. Regenerace myokardiální fibrotické jizvy u myších modelů po podání KB. Převzato z [16] se svolením D. Orlica. ![Regenerace myokardiální fibrotické jizvy u myších modelů po podání KB. Převzato z [16] se svolením D. Orlica.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/1c106baa961938138fb8066dd5a4545d.jpg)
Toto zjištění představovalo převratnou změnu myšlení ve vědecké sféře a vedlo k rozmachu výzkumu v tomto směru. Následovalo množství dalších experimentálních prací [48,74–77] a časně se objevily i první malé, nerandomizované klinické práce, které experimentální pozorování částečně, ale ne zcela přesvědčivě potvrdily [21,78]. Již v počátcích však byla v oblasti implantace KB do myokardu řada nejasností a obav. Limitující byl především strach z dlouhodobých nežádoucích účinků léčby. Jistá skepse také souvisí s nedostatečnou znalostí všech patofyziologických dějů reparace, remodelace LK a s nejasným podkladem působení KB.
Klinických studií s KB bylo provedeno v posledních 10 letech již několik desítek. Jejich závěry jsou ovšem kontroverzní. Lze to demonstrovat již na výsledcích prvních pilotních studií. V práci publikované Avilésem et al [79], ve které byly 5 pacientům intrakoronárně aplikovány BMSCs 10–15 dní po AIM, bylo popsáno signifikantní zlepšení kontraktility a systolické funkce LK. Oproti tomu v prakticky současně publikované studii Stamma et al [80] nebyla efektivita KB na 6 pacientech přímou intramyokardiální cestou potvrzena. Jednalo se však o studie s rozdílným designem, ve kterých byly buňky aplikovány odlišným způsobem (intrakoronárně vs perioperačně) a bylo použito i rozdílné množství a typ KB. Další významnější studií byla TOPCARE-AMI [70] na 20 pacientech. 9 nemocným byly implantovány BMSCs, 11 nemocným pak EPCs z periferní krve, vždy za 4 dny po AIM. V odstupu 4–12 měsíců autoři zaznamenali signifikantní zlepšení globální systolické funkce LK, zmenšení postiženého infarktového ložiska a zlepšení viability myokardu. Efekt terapie byl přitom nezávislý na typu podaných buněk.
V průběhu následných let byly publikovány výsledky ještě řady dalších studií. Jednalo se již převážně o randomizované studie provedené na větším počtu pacientů s použitím implantace BMSCs odebraných z kostní dřeně recentně po AIM. Jejich primárním cílem bylo zlepšení funkce LK, popř. zmenšení infarktového ložiska a zlepšení myokardiální viability. Hodnocena byla i bezpečnost podání KB. Práce publikovaná roku 2004 Chenem et al [26] sledovala 69 nemocných po AIM primárně řešeném koronární angioplastikou. BMSCs jim byly aplikovány do 18 dnů po koronární angioplastice. Po šestiměsíčním sledování bylo zjištěno významné zmenšení infarktového ložiska a současně došlo ke zlepšení systolické funkce LK a k redukci jejího enddiastolického objemu. Německá studie BOOST [62] sledovala 60 pacientů. Primární šestiměsíční výsledky byly velmi nadějné a ukazovaly na signifikantní zlepšení funkce LK u skupiny pacientů, kterým byly intrakoronárně podány BMSCs [kontrola vs BMSCs – vzestup ejekční frakce (EF) +0,7 %/6,7 %]. Bohužel efekt nebyl trvalý, při kontrolním vyšetření po 18 měsících od implantace se rozdíl ve funkci komory v obou skupinách prakticky vyrovnal. Následovala belgická studie Janssense et al [59], publikovaná v roce 2006, v níž bylo zařazeno 67 pacientů po úspěšné angioplastice pro AIM. KB jim byly aplikovány intrakoronárně do 24 hod po AIM. S odstupem 4 měsíců nebyl zjištěn významný vzestup EF LK, došlo však k signifikantní redukci velikosti infarktového ložiska oproti kontrole (o 28 %).
V následné placebem kontrolované, dvojitě zaslepené studii REPAIR-AMI [81] byla hodnocena systolická funkce LK u 204 pacientů, kterým byly v odstupu 5 dnů od AIM intrakoronárně aplikovány BMSCs. Autoři prokázali mírný pozitivní efekt ve smyslu potenciace funkce LK (EF vzrostla +5,5 % u skupiny s KB vs kontrolní skupina +3 %). U skupiny pacientů s implantovanými buňkami bylo také pozorováno menší množství reinfarktů a rehospitalizací. Naproti tomu norská studie ASTAMI [41,82] velmi podobného designu, provedená na 100 pacientech, neprokázala příznivý vliv efektivity buněčné terapie. Je však nutno zdůraznit, že v této studii bylo nemocným aplikováno výrazně nižší množství KB než v jiných studiích.
Komplexní shrnutí nejdůležitějších klinických studií týkajících se implantace KB bylo publikováno v metaanalýze Abdela-Latifa et al [22] v roce 2007. Do hodnocení bylo zahrnuto celkem 18 studií (999 pacientů), z toho BMSCs – 15 studií, sEPC – 3 studie, mezenchymální buňky – 1 studie. Všechny studie byly placebem kontrolované, převážně randomizované, 13 studií bylo u nemocných po AIM a 5 u nemocných s chronickou ischemickou kardiomyopatií. Medián sledování nemocných byl 4 měsíce (3–18 měsíců). Bylo konstatováno, že existuje velká heterogenita doby implantace KB (1–81 dnů, medián 9,8 dní po AIM). Také počet implantovaných KB byl velmi rozdílný a pohyboval se v rozmezí 2 × 106 až 60 × 109, medián 80 × 106. Výsledky metaanalýzy naznačují, že implantace KB může vést ke zlepšení systolické funkce LK (+3,66 %/+5,4 %, p < 0,01), zmenšení infarktového ložiska (–5,49 %/–9,1 %, p < 0,03), zmenšení ESV (–4,8 ml/–8,2 ml, p < 0,06) a snížení endsystolického volumu LK (–4,8 ml/–8,2 ml, p < 0,06). Významná je skutečnost, že nebyly prokázány závažné nežádoucí účinky léčby. Závěrem této metaanalýzy bylo, že implantace KB je provázena zlepšením anatomických a hemodynamických parametrů LK srdeční u pacientů s AIM a chronickým srdečním selháním na podkladě ischemické choroby srdeční (tab. 2).
Závěr
Léčba KB u nemocných po AIM nabízí do budoucnosti naději pro nemocné, které nejsme schopni účinně léčit konvenčními metodami. Jedná se především o pacienty po velkém infarktu myokardu s těžkou systolickou dysfunkcí LK a o nemocné s chronickým srdečním selháním. V těchto případech se nabízí možnost použití KB, ať již jako primární terapeutickou metodu, tak např. v rámci přemostění období do srdeční transplantace.
Dosud provedené klinické práce s KB uvádějí ne zcela přesvědčivé důkazy o jejich efektivitě na zlepšení funkce LK a myokardiální perfuze. Jedná se však o práce s velkým rozptylem jednotlivých klíčových proměnných (typ a množství KB, typ a způsob implantace, načasování od AIM) vedoucím k obtížím ve srovnávání jednotlivých studií.
Vzhledem k řadě dosud nedořešených otázek mechanizmu účinku i nejednoznačnému průkazu klinické efektivity není ještě nyní možné tuto metodu standardně používat v klinické praxi. Před rozšířením do klinického užívání bude nutné dořešit řadu základních problémů, především dalším výzkumem v oblasti experimentální, se zaměřením na mechanizmy účinku KB a biologii reparačních procesů, zprostředkovaných KB myokardu tak, abychom mohli naše terapeutické snahy lépe cílit a potenciálně v této nové oblasti klinické medicíny efektivně využít.
Doručeno do redakce: 2. 8. 2008
Přijato po recenzi: 16. 9. 2008
MUDr. Hana Skalická
www.vfn.cz
e‑mail: skaldah@seznam.cz
Zdroje
1. Widimsky P. Reperfusion damage or no-reflow damage in primary coronary interventions in acute myocardial infarction? Eur Heart J 2002; 23 : 1076–1078.
2. Schomig A, Ndrepepa G, Mehilli J et al. Therapy-Dependent Influence of Time-to-Treatment Interval on Myocardial Salvage in Patients With Acute Myocardial Infarction Treated With Coronary Artery Stenting or Thrombolysis. Circulation 2003; 108 : 1084–1088.
3. Stone GW, Brodie BR, Griffin JJ et al. Prospective, multicenter study of the safety and feasibility of primary stenting in acute myocardial infarction: in‑hospital and 30-day results of the PAMI stent pilot trial. Primary Angioplasty in Myocardial Infarction Stent Pilot Trial Investigators. J Am Coll Cardiol 1998; 31 : 23–30.
4. Aschermann M, Horak J, Reznicek V et al. Fibrinolytic therapy in acute myocardial infarct. Čas Lék Čes 2003; 142 : 582–585.
5. Widimsky P, Gregor P, Dvorak J et al. The optimal diagnostic approach in myocardial infarct. Vnitř Lék 1993; 39 : 160–165.
6. Keeley EC, Boura JA, Grines CL. Primary angioplasty versus intravenous thrombolytic therapy for acute myocardial infarction: a quantitative review of 23 randomised trials. Lancet 2003; 361 : 13–20.
7. Lichtman JH, Spertus JA, Reid KJ et al. Acute Noncardiac Conditions and In-Hospital Mortality in Patients With Acute Myocardial Infarction. Circulation 2007; 116 : 1925–1930.
8. Poloczek M, Kala P, Neugebauer P et al. ST‑segment resolution as a simple tool for the assessment of successful primary coronary intervention at a microvascular level. Vnitř Lék 2004; 50 : 740–745.
9. Widimsky P, Zelizko M, Jansky P et al. The incidence, treatment strategies and outcomes of acute coronary syndromes in the „reperfusion network“ of different hospital types in the Czech Republic: results of the Czech evaluation of acute coronary syndromes in hospitalized patients (CZECH) registry. Int J Cardiol 2007; 119 : 212–219.
10. Braunwald E, Kloner RA. The stunned myocardium: prolonged, postischemic ventricular dysfunction. Circulation 1982; 66 : 1146–1149.
11. Pfeffer MA, Pfeffer JM, Fishbein MC et al. Myocardial infarct size and ventricular function in rats. Circ Res 1979; 44 : 503–512.
12. Bolognese L, Neskovic AN, Parodi G et al. Left Ventricular Remodeling After Primary Coronary Angioplasty: Patterns of Left Ventricular Dilation and Long‑Term Prognostic Implications. Circulation 2002; 106 : 2351–2357.
13. Krupicka J, Gregor P, Budesinsky T et al. Echocardiographic quantification of changes in left ventricular kinetics in patients during hospitalization for a first myocardial infarct and treated with direct angioplasty. Vnitř Lék 2002; 48 : 368–372.
14. Pfeffer MA, Braunwald E. Ventricular remodeling after myocardial infarction. Experimental observations and clinical implications. Circulation 1990; 81 : 1161–1172.
15. Opie LH, Commerford PJ, Gersh BJ et al. Controversies in ventricular remodelling. Lancet 2006; 367 : 356–367.
16. Orlic D, Kajstura J, Chimenti S et al. Bone marrow cells regenerate infarcted myocardium. Nature 2001; 410 : 701–705.
17. Jain M, DerSimonian H, Brenner DA et al. Cell therapy attenuates deleterious ventricular remodeling and improves cardiac performance after myocardial infarction. Circulation 2001; 103 : 1920–1927.
18. Gulati R, Simari RD. Cell therapy for acute myocardial infarction. Med Clin North Am 2007; 91 : 769–785.
19. Wollert KC. Cell therapy for acute myocardial infarction. Curr Opin Pharmacol 2008; 8 : 202–210.
20. Yoon YS, Wecker A, Heyd L et al. Clonally expanded novel multipotent stem cells from human bone marrow regenerate myocardium after myocardial infarction. J Clin Invest 2005; 115 : 326–338.
21. Badorff C, Brandes RP, Popp R et al. Transdifferentiation of blood-derived human adult endothelial progenitor cells into functionally active cardiomyocytes. Circulation 2003; 107 : 1024–1032.
22. Abdel-Latif A, Bolli R, Tleyjeh IM et al. Adult bone marrow-derived cells for cardiac repair: a systematic review and meta‑analysis. Arch Intern Med 2007; 167 : 989–997.
23. Martin‑Rendon E, Brunskill SJ, Hyde CJ et al. Autologous bone marrow stem cells to treat acute myocardial infarction: a systematic review. Eur Heart J 2008; 29 : 1807–1818.
24. Ott HC, Matthiesen TS, Brechtken J et al. The adult human heart as a source for stem cells: repair strategies with embryonic‑like progenitor cells. Nat Clin Pract 2007; 4 (Suppl 1): S27–S39.
25. Taylor DA, Atkins BZ, Hungspreugs P et al. Regenerating functional myocardium: Improved performance after skeletal myoblast transplantation. Nat Med 1998; 4 : 929–933.
26. Chen SL, Fang WW, Ye F et al. Effect on left ventricular function of intracoronary transplantation of autologous bone marrow mesenchymal stem cell in patients with acute myocardial infarction. Am J Cardiol 2004; 94 : 92–95.
27. Fukuda K, Fujita J. Mesenchymal, but not hematopoietic, stem cells can be mobilized and differentiate into cardiomyocytes after myocardial infarction in mice. Kidney Int 2005; 68 : 1940–1943.
28. Mangi AA, Noiseux N, Kong D et al. Mesenchymal stem cells modified with Akt prevent remodeling and restore performance of infarcted hearts. Nat Med 2003; 9 : 1195–1201.
29. Menasche P. Myoblast‑based cell transplantation. Heart Fail Rev 2003; 8 : 221–227.
30. Pagani FD, DerSimonian H, Zawadzka A et al. Autologous skeletal myoblasts transplanted to ischemia-damaged myocardium in humans. Histological analysis of cell survival and differentiation. J Am Coll Cardiol 2003; 41 : 879–888.
31. Siminiak T, Kalawski R, Fiszer D et al. Autologous skeletal myoblast transplantation for the treatment of postinfarction myocardial injury: phase I clinical study with 12 months of follow‑up. Am Heart J 2004; 148 : 531–537.
32. Kawamoto A, Gwon HC, Iwaguro H et al. Therapeutic potential of ex vivo expanded endothelial progenitor cells for myocardial ischemia. Circulation 2001; 103 : 634–637.
33. Kocher AA, Schuster MD, Szabolcs MJ et al. Neovascularization of ischemic myocardium by human bone-marrow-derived angioblasts prevents cardiomyocyte apoptosis, reduces remodeling and improves cardiac function. Nat Med 2001; 7 : 430–436.
34. Jackson KA, Majka SM, Wang H et al. Regeneration of ischemic cardiac muscle and vascular endothelium by adult stem cells. J Clin Invest 2001; 107 : 1395–1402.
35. Tse HF, Lau CP. Therapeutic angiogenesis with bone marrow-derived stem cells. J Cardiovasc Pharmacol Ther 2007; 12 : 89–97.
36. Kajstura J, Leri A, Bolli R et al. Endothelial progenitor cells: neovascularization or more? J Mol Cell Cardiol 2006; 40 : 1–8.
37. Itescu S, Kocher AA, Schuster MD. Myocardial neovascularization by adult bone marrow-derived angioblasts: strategies for improvement of cardiomyocyte function. Heart Fail Rev 2003; 8 : 253–258.
38. Bartunek J, Vanderheyden M, Wijns W et al. Bone-marrow-derived cells for cardiac stem cell therapy: safe or still under scrutiny? Nature clinical practice 2007; 4 (Suppl 1): S100–S105.
39. Bartunek J, Wijns W, Heyndrickx GR et al. Timing of intracoronary bone-marrow-derived stem cell transplantation after ST‑elevation myocardial infarction. Nat Clin Pract 2006; 3 (Suppl 1): S52–S56.
40. Schachinger V, Erbs S, Elsasser A et al. Intracoronary bone marrow-derived progenitor cells in acute myocardial infarction. N Engl J Med 2006; 355 : 1210–1221.
41. Lunde K, Solheim S, Aakhus S et al. Autologous stem cell transplantation in acute myocardial infarction: The ASTAMI randomized controlled trial. Intracoronary transplantation of autologous mononuclear bone marrow cells, study design and safety aspects. Scand Cardiovasc J 2005; 39 : 150–158.
42. Meluzin J, Janousek S, Mayer J et al. Three-, 6-, and 12-month results of autologous transplantation of mononuclear bone marrow cells in patients with acute myocardial infarction. Int J Cardiol 2007; 128 : 185–192.
43. Kamihata H, Matsubara H, Nishiue T et al. Implantation of bone marrow mononuclear cells into ischemic myocardium enhances collateral perfusion and regional function via side supply of angioblasts, angiogenic ligands, and cytokines. Circulation 2001; 104 : 1046–1052.
44. Assmus B, Schachinger V, Zeiher AM. Regenerative therapy in cardiology: how distant is it from reality? Internist (Berl) 2006; 47 : 1177–1182.
45. Fukuda K, Yuasa S. Stem cells as a source of regenerative cardiomyocytes. Circ Res 2006; 98 : 1002–1013.
46. Li CJ, Gao RL, Yang YJ et al. Autologous bone marrow mononuclear cells and peripheral endothelial progenitor cells differentiation in myocardial ischemia reperfusion injury region in swine. Zhonghua Xin Xue Guan Bing Za Zhi (Chinese Journal of Cardiovascular Diseases) 2007; 35 : 350–353.
47. Orlic D, Hill JM, Arai AE. Stem cells for myocardial regeneration. Circ Res 2002; 91 : 1092–1102.
48. Li Y, Fukuda N, Yokoyama S et al. Effects of G‑CSF on cardiac remodeling and arterial hyperplasia in rats. Eur J Pharmacol 2006; 549 : 98–106.
49. Pannitteri G, Petrucci E, Testa U. Coordinate release of angiogenic growth factors after acute myocardial infarction: evidence of a two‑wave production. J Cardiovasc Med (Hagerstown) 2006; 7 : 872–879.
50. Kang HJ, Lee HY, Na SH et al. Differential effect of intracoronary infusion of mobilized peripheral blood stem cells by granulocyte colony-stimulating factor on left ventricular function and remodeling in patients with acute myocardial infarction versus old myocardial infarction: the MAGIC Cell-3-DES randomized, controlled trial. Circulation 2006; 114 : 1145–1151.
51. Fazel S, Cimini M, Chen L et al. Cardioprotective c-kit+ cells are from the bone marrow and regulate the myocardial balance of angiogenic cytokines. J Clin Invest 2006; 116 : 1865–1877.
52. Antonio Abbate GGLB-ZAB. Pathophysiologic role of myocardial apoptosis in post‑infarction left ventricular remodeling. J Cell Physiol 2002; 193 : 145–153.
53. Kajstura J, Cheng W, Reiss K et al. Apoptotic and necrotic myocyte cell deaths are independent contributing variables of infarct size in rats. Lab Invest 1996; 74 : 86–107.
54. Baldi A, Abbate A, Bussani R et al. Apoptosis and post‑infarction left ventricular remodeling. J Mol Cell Cardiol 2002; 34 : 165–174.
55. Orlic D. Stem cell repair in ischemic heart disease: an experimental model. Int J Hematol 2002; 76 (Suppl 1): 144–145.
56. Arnesen H, Lunde K, Aakhus S et al. Cell therapy in myocardial infarction. Lancet 2007; 369 : 2142–2143.
57. Assmus B, Walter DH, Lehmann R et al. Intracoronary infusion of progenitor cells is not associated with aggravated restenosis development or atherosclerotic disease progression in patients with acute myocardial infarction. Eur Heart J 2006; 27 : 2989–2995.
58. Meluzin J, Mayer J, Groch L et al. Autologous transplantation of mononuclear bone marrow cells in patients with acute myocardial infarction: the effect of the dose of transplanted cells on myocardial function. Am Heart J 2006; 152 : 975.
59. Janssens S, Dubois C, Bogaert J et al. Autologous bone marrow-derived stem-cell transfer in patients with ST‑segment elevation myocardial infarction: double-blind, randomised controlled trial. Lancet 2006; 367 : 113–121.
60. Penicka M, Horak J, Kobylka P et al. Intracoronary injection of autologous bone marrow-derived mononuclear cells in patients with large anterior acute myocardial infarction: a prematurely terminated randomized study. J Am Coll Cardiol 2007; 49 : 2373–2374.
61. Penicka M, Widimsky P, Kobylka P et al. Images in cardiovascular medicine. Early tissue distribution of bone marrow mononuclear cells after transcoronary transplantation in a patient with acute myocardial infarction. Circulation 2005; 112: e63–e65.
62. Meyer GP, Wollert KC, Lotz J et al. Intracoronary bone marrow cell transfer after myocardial infarction: eighteen months‘ follow‑up data from the randomized, controlled BOOST (BOne marrOw transfer to enhance ST‑elevation infarct regeneration) trial. Circulation 2006; 113 : 1287–1294.
63. Menasche P, Hagege AA, Vilquin JT et al. Autologous skeletal myoblast transplantation for severe postinfarction left ventricular dysfunction. J Am Coll Cardiol 2003; 41 : 1078–1083.
64. Herreros J, Prosper F, Perez A et al. Autologous intramyocardial injection of cultured skeletal muscle-derived stem cells in patients with non‑acute myocardial infarction. Eur Heart J 2003; 24 : 2012–2020.
65. Siminiak T, Kalawski R, Fiszer D et al. Autologous transplantation of skeletal myoblasts in the treatment of postinfarction left heart dysfunction: three-month follow‑up. Kardiol Pol 2004; 60 (Suppl 1): I–71–I–76.
66. Villa A, Sanchez PL, Fernandez-Aviles F. Ventricular arrhythmias following intracoronary bone marrow stem cell transplantation. Europace 2007; 9 : 1222–1223.
67. Perin EC, Dohmann HF, Borojevic R et al. Improved exercise capacity and ischemia 6 and 12 months after transendocardial injection of autologous bone marrow mononuclear cells for ischemic cardiomyopathy. Circulation 2004; 110: II213–II218.
68. Tse HF, Thambar S, Kwong YL et al. Prospective randomized trial of direct endomyocardial implantation of bone marrow cells for treatment of severe coronary artery diseases (PROTECT-CAD trial). Eur Heart J 2007; 28 : 2998–3005.
69. Wollert KC, Meyer GP, Lotz J et al. Intracoronary autologous bone-marrow cell transfer after myocardial infarction: the BOOST randomised controlled clinical trial. Lancet 2004; 364 : 141–148.
70. Schachinger V, Assmus B, Britten MB et al. Transplantation of progenitor cells and regeneration enhancement in acute myocardial infarction: final one-year results of the TOPCARE-AMI Trial. J Am Coll Cardiol 2004; 44 : 1690–1699.
71. Huang RC, Yao K, Zou YZ et al. Long term follow‑up on emergent intracoronary autologous bone marrow mononuclear cell transplantation for acute inferior-wall myocardial infarction. Zhonghua Yi Xue Za Zhi 2006; 86 : 1107–1110.
72. Suarez de Lezo J, Herrera C, Pan M et al. Regenerative therapy in patients with a revascularized acute anterior myocardial infarction and depressed ventricular function. Rev Esp Cardiol 2007; 60 : 357–365.
73. Vasa M, Fichtlscherer S, Aicher A et al. Number and migratory activity of circulating endothelial progenitor cells inversely correlate with risk factors for coronary artery disease. Circ Res 2001; 89: E1–E7.
74. Kuethe F, Krack A, Fritzenwanger M et al. Treatment with granulocyte-colony stimulating factor in patients with acute myocardial infarction. Evidence for a stimulation of neovascularization and improvement of myocardial perfusion. Pharmazie 2006; 61 : 957–961.
75. Kurdi M, Booz GW. G‑CSF‑based stem cell therapy for the heart–unresolved issues part A: paracrine actions, mobilization, and delivery. Congest Heart Fail 2007; 13 : 221–227.
76. Yoshioka T, Ageyama N, Shibata H et al. Repair of infarcted myocardium mediated by transplanted bone marrow-derived CD34+ stem cells in a nonhuman primate model. Stem Cells 2005; 23 : 355–364.
77. Yin CQ, Chen JL, Wang YF et al. Autologus bone marrow-derived mesenchymal stem cells intracoronary delivery after acute myocardial infarction in miniature pig. Zhongguo Yi Xue Ke Xue Yuan Xue Bao 2005; 27 : 696–699.
78. Tse HF, Yiu KH, Lau CP. Bone marrow stem cell therapy for myocardial angiogenesis. Curr Vasc Pharmacol 2007; 5 : 103–112.
79. Aviles FF, San Roman JA, Garcia Frade J et al. Intracoronary stem cell transplantation in acute myocardial infarction. Rev Esp Cardiol 2004; 57 : 201–208.
80. Stamm C, Westphal B, Kleine HD et al. Autologous bone-marrow stem-cell transplantation for myocardial regeneration. Lancet 2003; 361 : 45–46.
81. Schachinger V, Erbs S, Elsasser A et al. Improved clinical outcome after intracoronary administration of bone-marrow-derived progenitor cells in acute myocardial infarction: final 1-year results of the REPAIR-AMI trial. Eur Heart J 2006; 27 : 2775–2783.
82. Lunde K, Solheim S, Aakhus S et al. Exercise capacity and quality of life after intracoronary injection of autologous mononuclear bone marrow cells in acute myocardial infarction: results from the Autologous Stem cell Transplantation in Acute Myocardial Infarction (ASTAMI) randomized controlled trial. Am Heart J 2007; 154 : 710–718.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2009 Číslo 1- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Incidence pankreatického karcinomu u osob s chronickou pankreatitidou
- Kardiovaskulární rehabilitace v současnosti
- Ovlivnění hemostázy při terapii náhradními roztoky
- Infarkt myokardu, remodelace levé komory a buněčná terapie
- Účinnost anti‑TNF‑α léčiv v běžné klinické praxi a náklady na tato léčiva
- Karcinom kůry nadledvin
- Karcinom kůry nadledvin – editorial
- Diagnostika a léčba akutního peripartálního život ohrožujícího krvácení – doporučený postup
- Koronární ektazie v kombinaci s nemocí tří tepen
- Poporodní krvácení – doporučené postupy diagnostiky a léčby – editorial
- Dopisy redakci
- Dopisy redakci
- Vítězové a poražení z New Orleans. Od rosuvastatinu k antioxidačním vitaminům – pár postřehů ze sjezdu AHA 2008
- 6. kongres Medzinárodnej spoločnosti histórie nefrológie, 2.– 4. októbra 2008, Taormina – Giardini Naxos (Taliansko)
- Recenze
- Léčba Waldenströmovy makroglobulinemie – zkušenosti jednoho pracoviště
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Karcinom kůry nadledvin
- Koronární ektazie v kombinaci s nemocí tří tepen
- Kardiovaskulární rehabilitace v současnosti
- Léčba Waldenströmovy makroglobulinemie – zkušenosti jednoho pracoviště
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy





