-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vymizení nefrotického syndromu a zlepšení funkce ledvin u nemocné s light chain deposition disease po vysokodávkované chemoterapii s autologní transplantací kmenových krvetvorných buněk. Popis případu a přehled literatury
Complete remission of nephrotic syndrome and improvement of renal function in a patient with light chain deposition disease following high dose chemotherapy with transplantation of autologous haematopoietic stem cells. A case study and review of literature
Light chain deposition disease (LCDD) damages most frequently kidneys, and less frequently other organs. The incidence of LCDD is lower than the incidence of AL-amyloidosis. Symmetric swelling of both legs was the first sign of nephrotic syndrome with renal insufficiency in our female patient. Renal biopsy specimen revealed the diagnosis of LCDD. Bone marrow biopsy contained 40% of plasma cells. Bone survey showed no osteolytic changes. These fi ndings confi rmed the diagnosis of multiple myeloma (MM) Durie Salmon stage IB with LCDD. The patient was initially treated with 4 cycles of VAD (vinkristine, adriamycine, dexamethasone) chemotherapy with no response. Followed collection of peripheral haematopoietic stem cells and later high dose chemotherapy with reduced dose of melphalan 140 mg/sqm and autologous peripheral haematopoietic stem cells transplantation. Melphalan dose was reduced because of renal insufficiency (serum creatinine 290 μmol/l) before application of conditioning regimen. High dose therapy was complicated by with deterioration of renal function, creatinine increased to 600 μmol/l. Worsening of renal function was most likely caused by nephrotoxicity of melphalan in nephrotic syndrome. This has been previously described in patients with AL-amyloidosis, and nephrotic syndrome who were treated with high dose melphalan. This phenomenon was entitled “post conditioning renal insufficiency”. Hypoalbuminemia hypoproteinemia and reduced intravascular volume and renal damage caused by amyloid deposits as well as probably, amorphous non-amyloid deposits of monoclonal immunoglobulin are likely to have contributed to nephrotoxicity of the high dose of melphalan. However, worsening of renal insufficiency was facilitated by the mucositis-associated sepsis. Follow-up examination one month after high dose chemotherapy showed complete remission, that was confirmed by further examinations. In the course of the first year after high dose chemotherapy renal function gradually improved and nephrotic syndrome completely disappeared (complete kidney remission). Proteinuria declined to 2–3 g/24 hours and glomerular filtration slowly improved. Three years after high dose chemotherapy the patient is still in complete remission of multiple myeloma and free of nephrotic syndrome, with slightly increased creatinine (160 μmol/l) that, nevertheless, has had an improving tendency over last 3 years. The present case study illustrates accomplishment of complete haematological remission with high dose chemotherapy followed by autologous haematopoietic stem cells transplantation despite complete resistance of the disease to the standard chemotherapy VAD in a patient with MM and LCDD. We draw the reader’s attention to the possibility of nephrotoxic effects of high dose melphalan (post conditioning renal insufficiency) in patients with nephrotic syndrome caused by light chain deposits as AL-amyloid or amorphous light chains deposits (LCDD)and we document the importance of plasma free light chain detection.
Key words:
light chain deposition disease – monoclonal gammapathy – multiple myeloma – renal insuficiency – nephrotic syndrome – high dose chemotherapy with autologous peripheral stem cell transplantation
Autori: Z. Adam 1; M. Krejčí 1; L. Pour 1; S. Štěpánková 2; Z. Čermáková 3; L. Voska 4; V. Teplan 5; A. Křivanová 1; R. Hájek 1; J. Mayer 1
Pôsobisko autorov: Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Jiří Vorlíček, CSc. 1; Interní hepatogastroenterologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Jan Lata, CSc. 2; Oddělení klinické biochemie FN Brno, pracoviště Bohunice, přednosta doc. MU Dr. Milan Dastych, CSc. 3; Pracoviště klinické a transplantační patologie IKEM Praha, přednostka prim. MU Dr. Eva Honsová, Ph. D. 4; Klinika nefrologie, Transplantcentrum IKEM Praha, přednosta prof. MU Dr. Vladimír Teplan, DrSc. 5
Vyšlo v časopise: Vnitř Lék 2009; 55(11): 1089-1096
Kategória: Kazuistiky
Súhrn
Depozita lehkých řetězců ve formě amorfních hmot (light chain deposition disease) poškozují nejčastěji ledviny, méně často jiné orgány. Onemocnění je podstatně vzácnější než AL - amyloidóza. První příznaky light chain deposition disease u naší nemocné byly symetrické otoky dolních končetin. Nemoc byla diagnostikována z biopsie ledvin, provedené až ve fázi rozvinutého nefrotického syndromu s retencí dusíkatých látek. V kostní dřeni bylo 40 % plazmocytů, nebyly však přítomny osteolytické změny skeletu, takže šlo o mnohočetný myelom klinického stadia IB dle Durieho a Salmona. Pacientka byla léčena iniciálně 4 cykly chemoterapie VAD (vinkristin, adriamycin a dexametazon). Po 4 cyklech však nebyla zřetelná žádné léčebná odpověď. Následoval sběr kmenových buněk krvetvorby z periferní krve a vysokodávkovaná chemoterapie, melfalan v redukované dávce 140 mg/ m2 při renální insuficienci (sérový kreatinin 290 μmol/ l). Průběh vysokodávkované chemoterapie komplikovalo prudké zhoršení funkce ledvin, vzestup kreatininu na 600 μmol/ l. Zhoršení funkcí ledvin bylo nejspíše způsobeno nefrotoxicitou použité dávky melfalanu. Tento jev byl popsán u pacientů s AL - amyloidózou s nefrotickým syndromem, kteří byli léčeni vysokými dávkami melfalanu. Byl pojmenován „postconditioning renal insuficiency“. Na nefrotoxicitě vysoké dávky melfalanu se zřejmě podílejí hypoalbuminemie, hypoproteinemie, snížený intravaskulární objem a poškození ledvin depozity monoklonálního imunoglobulinu ve formě amyloidu, ale zřejmě i ve formě amorfních neamyloidových depozit. Na prohloubení renální insuficience se však spolupodílel i septický stav při mukositidě. Při kontrolním vyšetření 1. měsíc po transplantaci byla zjištěna kompletní remise, které byla potvrzena dalšími vyšetřeními. V průběhu 1. roku po transplantaci se postupně zlepšovala funkce ledvin, vymizel nefrotický syndrom, odpad bílkoviny se snížil na 2 – 3 g/ 24 hod, glomerulární filtrace se postupně zlepšovala. Pacientka je nyní tři roky od stanovení diagnózy v kompletní remisi mnohočetného myelomu, bez nefrotického syndromu, s mírně zvýšeným kreatininem (160 μmol/ l), který však má v průběhu posledních tří let klesající tendenci. Uvedený popis dokumentuje dosažení kompletní hematologické remise vysokodávkovanou chemoterapií s autologní transplantací u pacientky s light chain deposition disease i při úplné rezistenci nemoci na klasickou chemoterapii VAD. Upozorňujeme na možnost nefrotoxicity vysoké dávky melfalanu (postconditioning renal insuficiency) u pacientů s nefrotickým syndromem způsobeným depozity lehkých řetězců, ať již ve formě AL - amyloidu, nebo ve formě amorfních lehkých řetězců, a dokumentujeme důležitost vyšetřování volných lehkých řetězců v plazmě.
Klíčová slova:
light chain deposition disease – monoklonální gamapatie – mnohočetný myelom – renální insuficience – nefrotický syndrom – vysokodávkovaná chemoterapie s autologní transplantací kmenových krvetvorných buněk získaných z periferní krveÚvod
V anglické literatuře existuje termín light chain deposition disease. Do češtiny jej překládáme jako „nemoc z ukládání lehkých řetězců“, přičemž budeme respektovat, že je tím míněna nemoc z ukládání lehkých řetězců v neamyloidové podobě. I AL-amyloidóza je patofyziologická nemoc z ukládání lehkých řetězců, nicméně anglická literatura pod pojmem light chain deposition disease v drtivé většině publikací označuje tímto termínem právě patologická depozita amorfních (neamyloidových, nefibrilárních) forem lehkých řetězců většinou typu κ. Je to velmi vzácné onemocnění.
První popis této nemoci zveřejnil Randall v roce 1976. Popsal histologický nález u dvou nemocných s terminálním renálním selháním. Morfologické vyšetření ledvin prokázalo granulární depozita, v nichž byly imunohistochemicky prokázány lehké řetězce imunoglobulinů. Granulární depozita však nevázala konžskou červeň, což znamenalo, že lehké řetězce nebyly uloženy ve formě amyloidu. U jednoho z těchto pacientů byl prokázán mnohočetný myelom, zatímco u druhého byla popisována idiopatická lobulární glomerulonefritida [1].
Podstatou light chain deposition disease je maligní (65%) či nemaligní plazmocelulární proliferace (35%), produkující monoklonální lehké řetězce imunoglobulinu [2]. Ten je s pomocí imunofixace detekovatelný u 94% nemocných, zřetelně dominují lehké řetězce κ [3–5]. Nicméně jsou popsány i případy, kdy jsou depozita lehkých řetězců κ diagnostikována morfologicky a přitom v moči a v krvi nebyl detekován monoklonální imunoglobulin metodou imunofixace [6,7].
Postižení ledvin je nejčastějším projevem light chain deposition disease. Symptomatická extrarenální depozita se vyskytují jen zřídka, byla prokázána v srdci (21%), v játrech (19%) a na periferních nervech (8%), ale i v CNS [8,9].
Vzhledem k vzácnosti tohoto typu poškození ledvin jsou klinické zkušenosti s jejich léčbou mnohem menší, než je tomu u poškození ledviny depozicí AL-amyloidu. Z dosavadních publikovaných zkušeností vyplývá, že klasická chemoterapie zde nebývá dostatečně účinná [2]. Vzhledem k úspěchům vysokodávkované chemoterapie u mnohočetného myelomu a také u AL-amyloidózy se terapeutické studie v posledních letech soustředily také na tuto léčebnou modalitu a dle nemnoha publikovaných malých souborů tento způsob léčby jeví velmi přínosným.
Cílem následujícího popisu případu je demonstrovat přínos vysokodávkované chemoterapie i v případě rezistence na klasickou chemoterapii a poukázat na možná rizika.
Popis případu
Z anamnézy
Mladá žena, narozená roku 1966, byla bez vážnější nemoci až roku 2005 (do 39 let věku). První příznaky, symetrické otoky obou dolních končetin do úrovně kolenou, zpozorovala v březnu roku 2005. Byla posílána od lékaře k lékaři, vždy v intervalu odpovídajícímu objednací době toho či onoho lékaře. Od dubna roku 2005 byla podána diuretika s částečným efektem. V září roku 2005 prokázalo laboratorní vyšetření proteinurii a zvýšené hodnoty kreatininu. Čekací doby u spádovaného nefrologa byly dle líčení nemocné 3 měsíce, a tak si pacientka domluvila přijetí na Kliniku nefrologie IKEM Praha. Na tomto pracovišti stanovili v lednu roku 2006 diagnózu –light chain deposition disease.
V době stanovení diagnózy měla již pacientka otoky dolních končetin do poloviny stehen, byla mírně anemická, koncentrace hemoglobinu byla 117g/l, leukocyty a trombocyty byly v normě. Celková bílkovina byla výrazně snížena na 41,2g/l, albumin na 15,6g/l, kreatinin dosahoval hodnoty 194 μmol/l, urea 6,5 mmol/l, cholesterol 8,8 mmol/l, triglyceridy 6,51 mmol/l. Proteinurie činila 3,78g/l, tj. 12,31g/24 hod. Glomerulární filtrace byla redukována na 0,52ml/s. Moč byla izostenurická o specifické váze 1 010. V močovém sedimentu byl zachycen jeden hyalinní válec, nebyla hematurie. Sonografie popsala normální strukturu ledvin. TK 140/90mmHg.
Biopsie ledviny
Renální punkce zastihla 20 glomerulů, z toho 2–3 zaniklé, ostatní zvětšené s akcentovaným lobulárním členěním trsu, se zmnožením mezangia, často nodulárního charakteru, PAS pozitivní. Celularita glomerulů byla normální nebo lehce zvýšená, bazální membrány byly nepravidelné nebo ztluštělé. V 5 glomerulech byla segmentální sklerotizace s adhezemi. Fokálně a segmentální byla lehká hyperemie trsu, bílkovinné průsaky bazální membrány hyalinní kapky v cytoplazmě podocytů.
Také aterioly měly segmentální bílkovinné transudáty. Arterie byly normální nebo měly lehce ztluštělou stěnu. V intersticiu byla mírná fibróza provázená lehkou zánětlivou infiltrací. Kanálky byly okrskovitě atrofické, jiné normální nebo lehce dilatované, s nečetnými hyalinními válci. Průkaz amyloidu (kongo, saturnová červeň) negativní.
Imunofluorescenční vyšetření prokázalo přítomnost IgG +/++, průkaz řetězců κ byl vysoce pozitivní (obr. 1 a 2).
Obr. 1. Biopsie ledviny, základní barvení hematoxylinem a eozinem (HE). 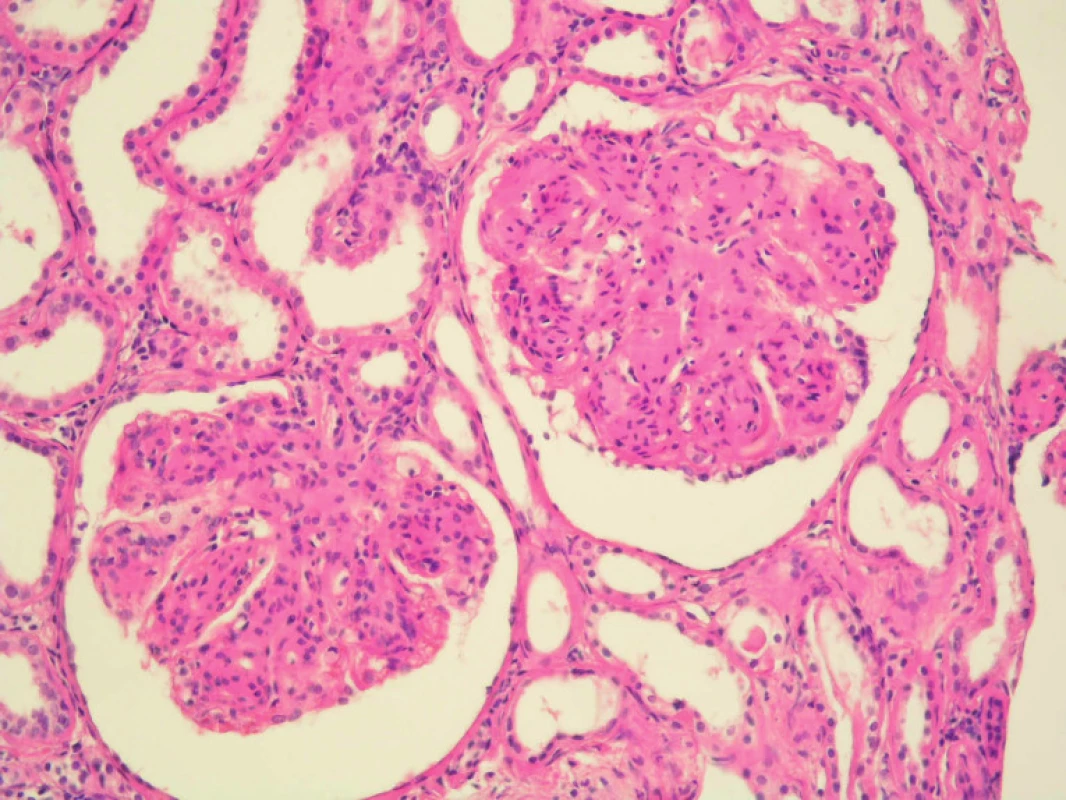
Obr. 2. Biopsie ledviny – imunofluoresenční průkaz depozit κ řetězců. 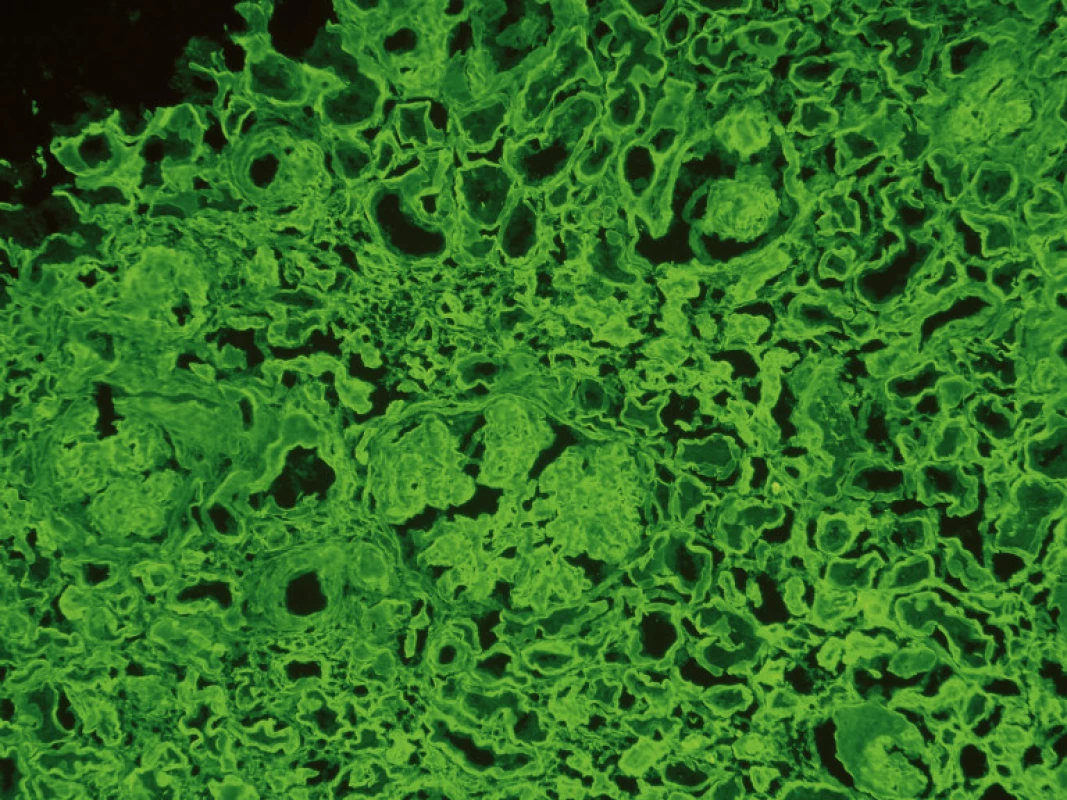
Závěr biopsie ledviny tedy zněl: nález odpovídá obrazu nemoci z ukládání monoklonálních imunoglobulinů nejspíše LCDD (light chain deposition disease), event. LHCDD (light and heavy chain deposition disease).
Z Kliniky nefrologie IKEM Praha byla pacientka propuštěna s diagnózou:
- nemoc lehkých řetězců dle renální biopsie
- nefrotický syndrom s proteinurií 12g/la chronické renální insuficience ve stadiu CKD 4 dle K-DOQI, sekundární hyperlipoproteinemie.
K dalšímu léčení byla pacientka předána na Interní hematoonkologickou kliniku LF MU a FN Brno.
Základní laboratorní a další vyšetření a stanovení diagnózy mnohočetného myelomu s light chain deposition disease
Krevní obraz: leukocyty 5,6 × 109/l, erytrocyty 3,71 × 1012/l, hemoglobin 111g/l, trombocyty 259 × 109/l.
Celková bílkovina 46g/l, albumin 27g/l, kreatinin 196 μmol/l, urea 6,9 mmol/l, CRP 1,6mg/l cholesterol 10,4 mmol/l, triglyceridy 2,97 mmol.
Elektroforéza séru: imunofixace negativní, monoklonální imunoglobulin v séru neprokázán.
V moči: celková bílkovina v koncentraci 9g/l, kompletní bílkovinné spektrum a přítomné volné κ řetězce.
Imunoglobuliny v séru kvantitativně: IgG 1,06g/l (fyziologické rozmezí 7–16g/l), IgM 0,34g/l (fyziologické rozmezí 0,40–2,30g/l) a IgA ,44g/l (fyziologické rozmezí 0,70–4,0g/l), beta2-mikroglobulin 5,16mg/l.
Speciální vyšetření volných řetězců imunoglobulinů:
- koncentrace volných κ řetězců v séru 1 290mg/l (fyziologické rozmezí 3,30–19,40mg/l).
- koncentrace volných λ řetězců v séru 13,70mg/l (fyziologické rozmezí 5,71–26,30mg/l).
- poměr koncentrací volných řetězců κ/ λ v séru byl 94,16 (fyziologické rozmezí 0,26–1,65).
Trepanobiopsie kostní dřeně v lednu roku 2006 prokázala 40% plazmocytů, které dominantně exprimovaly κ řetězce.
RTG vyšetření skeletu bez jednoznačných osteolytických ložisek. Kostní denzita bederních obratlů –1,2 až –1,8 SD, takže pouze osteopenie, osteoporóza nebyla prokázána.
Počet plazmocytů v kostní dřeni splnil velké kritérium dle Durieho a Salmona, byl prokázán monoklonální imunoglobulin (volné κ), byly sníženy polyklonální imunoglobuliny, a tak byla diagnóza uzavřena na základě uvedených kritérií jako mnohočetný myelom s poškozením ledvin, ale bez poškození skeletu a bez signifikantní anémie, takže klinické stadium IB.
Standardní chemoterapie a její vyhodnocení
Počátkem února roku 2006 byla zahájena léčba, pacientka do konce května roku 2006 absolvovala čtyři cykly chemoterapie VAD (vinkristin, adriamycin a dexametazon). Tuto léčbu tolerovala bez závažnějších komplikací.
Účinnost léčby jsme monitorovali sledováním odpadu volných lehkých řetězců v moči. Značně vysoká proteinurie však interferovala s jejich přesným stanovením. Dále jsme léčbu monitorovali sledováním koncentrací volných lehkých řetězců v séru a jejich poměru. Při vyhodnocování přínosu standardní chemoterapie VAD jsme museli konstatovat, že tato léčba nevedla ke zřetelné léčebné odpovědi.
Koncentrace lehkých řetězců κ byla v době podání vysokodávkované chemoterapie s autologní transplantací vyšší než při zahájení léčby.
Sběr kmenových krvetvorných buněk z periferní krve
V červnu roku 2006 byla podána stimulační chemoterapie, cyklofosfamid 2,5g/m2 a G CSF (Neupogen) v dávce 5 μg/kg a byl proveden sběr periferních kmenových buněk. V průběhu bylo sebráno 10,88 × 106/kg CD34 pozitivních buněk a 35,89 CFU GM × 104/kg a rozděleno do 4 vaků po 2,72 × 106/kg CD34/kg pozitivních buněk.
Vysokodávkovaná chemoterapie s autologní transplantací
V červenci roku 2006 (17. 7. 2006) podána vysokodávkovaná chemoterapie melfalan 140mg/m2 a ve 24hodinovém intervalu, pak provedena transplantace autologních kmenových krvetvorných buněk získaných z periferní krve. Počet neutrofilů přesáhl 12. den po transplantaci hodnotu 0,5 × 109/l, počet trombocytů přesáhl 22. den hodnotu 50 × 109/l.
Vysokodávkovaná chemoterapie byla komplikována těžkou mukositidou s nutností parenterální výživy a febrilní neutropenií se septickým stavem. Ve dnech následujících aplikace melfalanu došlo ke zhoršení funkce ledvin a vzestupu kreatininu z hodnoty 290 μmol/l před vysokodávkovanou chemoterapií na hodnoty kolem 600 μmol/l. Ztráty bílkoviny močí dosahovaly při zhoršení funkce ledvin v posttrasplantačním období až 27g/hod. Při první kontrole měsíc po transplantaci se snížila koncentrace kreatininu na 428 μmol/l.
Po vysokodávkované chemoterapii byl podáván ještě po dalších 6 měsíců nízkomolekulární heparin (hyperkoagulační stav související s nefrotickým syndromem) a pak byl vysazen.
Již při 1. kontrole měsíc po vysokodávkované chemoterapii byl zřetelný výrazný pokles koncentrace volných řetězců κ v séru.
Ostatní laboratorní parametry se upravovaly podstatně pomaleji v následujících měsících, jak uvádí tab. 1.
Tab. 1. Nejdůležitější laboratorní parametry před zahájením léčby a jejich změny po 4 cyklech (měsících) chemoterapie VAD, následované stimulační chemoterapií (cyklofosfamid 2,5 g/ m2) se sběrem kmenových krvetvorných buněk, v době podání vysokodávkované chemoterapie (melfalan 140 mg/ m2) a při následném sledování, kdy pacientka byla již bez specifické protimyelomové léčby. U odpadu celkové bílkoviny uvádíme někdy koncentraci v g/ l a někdy za g/ 24 h, cílem bylo vždy kvantifikovat odpad lehkých řetězců a celkové bílkoviny za 24 hod, ale v životě se nikdy nezdaří vše, co chceme. 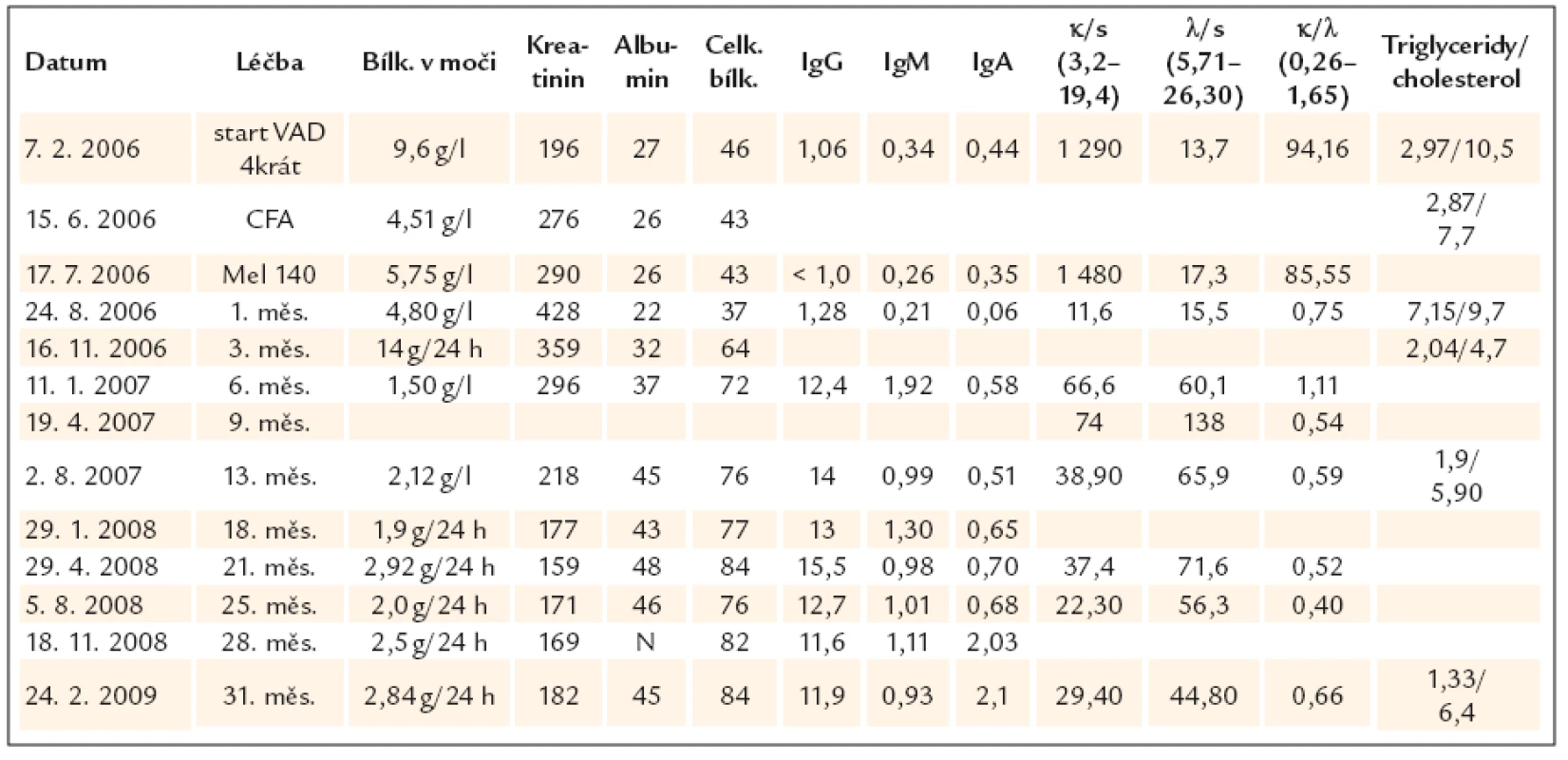
Počítány jsou měsíce po transplantaci Při poslední kontrole v únoru roku 2009 (tři roky od stanovení diagnózy a zahájení léčby) byla pacientka subjektivně bez potíží, klinicky normální nález.
Laboratorní hodnoty z února roku 2009: leukocyty 4,42 × 109/l, erytrocyty4,63 × 1012/l, hemoglobin 132g/l, trombocyty 160 × 109/l. Koncentrace polyklonálních imunoglobulinů se zvýšila, IgG je 11,86g/l, IgM 0,93g/l, IgA 2,10g/l, celková bílkovina v séru je 80g/l, albumin 45g/l.
Imunofixační elektroforéza: monoklonální Ig je v séru i v moči negativní, proteinurie činí 2,84g/24 hod, kreatinin je zvýšen na 182 μmol/l, urea 8,5 mmol/l.
Poslední kontrolní vyšetření kostní dřeně bylo provedeno v srpnu roku 2008 s normálním cytologickým nálezem 1,6% plazmocytů. Pacientka je 2,5 roku od ukončení léčby (3 roky od stanovení diagnózy) v kompletní remisi, kontrolní RTG neprokázalo žádné postižení skeletu. Funkce ledvin se stabilizovala na glomerulární filtrace 0,67ml/s (= CKD 3), vymizel nefrotický syndrom a proteinurie se ustálila na středně významné hodnotě 2–3g/24 hod. Postupná úprava těchto laboratorních hodnot trvala déle než jeden rok.
Diskuze
Light chain depositon disease je vzácná forma poškození ledvin, způsobená monoklonálními lehkými řetězci κ, které se ukládají v různých tkáních ve formě amorfních hmot, a poškozují tak jejich funkci. Nejčastěji jsou tato depozita nalézána v ledvině, vzácněji pak i v dalších tkáních a orgánech.
Klinicky se light chain deposition disease projeví progresivním selháním funkce ledvin. Proteinurie nad 1g/24 hod byla popsána u 84% pacientů a 40% nemocných mělo proteinurii odpovídající nefrotickému syndromu [2,3]. Do klinického obrazu mimo proteinurii patří také mikrohematurie a hypertenze. Retence dusíkatých látek bývá obvykle závažnější než v případě depozice amyloidových hmot v ledvině [2,12,13]. Podezřelé z této formy nefropatie jsou všechny formy renální insuficience u mnohočetného myelomu, u nichž dochází k rychlému zhoršování funkce ledvin.
U AL-amyloidózy jsou ukládány obvykle lehké řetězce λ ve formě fibrilárních depozit v predilekčních orgánech. Bylo zjištěno, že při přestavbě genů pro amyloidogenní lehké řetězce souvisí výsledný tkáňový tropizmus amyloidu s genem variabilní části lehkého řetězce, který byl použit při přestavbě genetické informace pro konkrétní amyloidogenní lehký řetězec. Podobný mechanizmus orgánového tropizmu se předpokládá i při light chain deposition disease.
Nejčastěji jsou amorfní depozita lehkých řetězců κ ukládána v ledvinách. Výsledné poškození ledviny však není jenom důsledkem mechanického tlaku depozit lehkých řetězců, ale také jejich reakce s mezangiálními buňkami. In vitro bylo prokázáno, že purifikované lehké řetězce od pacientů s touto nemocí inhibují mezangiální proliferaci, zvyšují produkci matrixových proteinů (kolagenu typu IV, lamininu, fibrinonectinu) a zvyšují produkci působku zvaného transforming growth factor β, který má zřejmě klíčovou roli v etiopatogenezi výše uvedených změn [14].
Diagnostikovat lze tuto jednotku pouze pomocí biopsie ledviny. V optické mikroskopii je charakteristická přítomnost mezangiálních uzlů, zesílení bazálních membrán glomerulárních kapilár a tubulů. Obraz nodulární sklerózy v základním barvení (H&E, PAS) je histologicky těžko odlišitelný od diabetické glomerulosklerózy. V zásadě u LCDD se noduly vyskytují difuzněji než u diabetické glomerulosklerózy. Histologický obraz LCDD je však velice variabilní a nepřítomnost mezangiálních uzlů nevylučuje toto onemocnění. Při nepřítomnosti nodulárních formací bývá fokální nebo difuzní mezangiální expanze někdy se zvýšenou buněčností [15–21]. Nedílnou součástí bioptického vyšetření je imunofluorescence, kterou lze prokázat depozici monoklonálního imunoglobulinu (monoklonální řetězce κ) v glomerulární bazální membráně, v mezangiu a v tubulární bazální membráně. V elektronmikroskopickém obraze lze znázornit depozita nefibrilárního materiálu ve zmíněných lokalizacích.
V případě mnohočetného myelomu při vyšším kvantu vylučovaných lehkých řetězců může být ledvina poškozována současně amorfními depozity lehkých řetězců a odlitkovými válci. Koexistence těchto dvou patofyziologických podkladů nefropatie byla popsána asi v 1/3 případů [8,22,23].
Výjimečně může být ledvina poškozena jak ukládáním lehkých řetězců v amorfní formě, tak i ve formě amyloidu [24,25].
Diferenciální diagnóza je velice široká. Zahrnuje diabetickou glomerulosklerózu, idiopatickou nodulární glomerulosklerózu, mebranoproliferativní glomerulonefritidu, amyloidózu.
Diagnostika těchto onemocnění vyžaduje nejen dobře vybavenou bioptickou laboratoř, ale i zkušené hodnotící nefropatology. Sporné případy by měly být konzultovány na referenčním nefropatologickém pracovišti.
Léčebné postupy jsou obdobné jako u mnohočetného myelomu. Léčebnouodpověď však klasická chemoterapie nedosahuje vždy. Heilmann ve skupině 19 pacientů léčených melfalanen a prednisonem pozoroval zmenšení proteinurie jen u 5 z 19. Pokles koncentrace monoklonálního imunoglobulinu, odpovídající parciální remisi, jen u 2 pacientů z 19 nemocných [2].
Pozzi popsal skupinu 19 nemocných, z nichž mělo 18 renální insuficienci a 16 nefrotický syndrom. Extrarenální depozita byla popsána u 12 vyšetřovaných osob (63%), nejčastěji v srdci, játrech a v periferních nervech. Pacienti byli léčeni steroidy a alkylačními cytostatiky. Hematologická léčebná odpověď a zlepšení funkce ledvin bylo dokumentováno pouze u 5 ze 16 hodnocených. Ale míra proteinurie se u žádného léčeného signifikantně nezmenšila [3]. Nevelký efekt klasické chemoterapie, podávané v případě light chain deposition disease při plazmocelulární proliferaci typu mnohočetného myelomu, ale i typu MGUS, popisují i další pracoviště [26]. A také u naší nemocné nedošlo po čtyřech cyklech klasické chemoterapie signifikantní hematologické ani renální léčebné odpovědi. Naopak v průběhu klasické chemoterapie se postupně zhoršovala filtrace a pomalu se zvyšovala hodnota kreatininu v séru.
Pro nevelké úspěchy klasické chemoterapie se pozornost v posledních letech u těchto nemocných soustředila na úlohu vysokodávkované chemoterapie s autologní transplantací. Vzhledem k vzácnosti této diagnózy nejsou ani zkušenosti s vysokodávkovanou chemoterapií v této indikaci tuze velké.
Intenzivní chemoterapie dosahuje vysoký počet hematologických léčebných odpovědí [27,28], ale vliv na funkci ledvin je méně jasný.
Největší publikovaná studie obsahuje 11 pacientů, všichni měli postižení ledvin a 4 vyžadovali dialýzu a 3 měli zjevný nefrotický syndrom. Vysokodávkovaná chemoterapie vedla u 6 ke kompletní remisi a k postupnému zlepšení funkce ledvin. Hodnota kreatininu se snížila o 1/2 u 4 nemocných a nefrotický syndrom vymizel u 3 nemocných [29]. Publikované zkušenosti s léčbou light chain deposition disease vysokodávkovanou chemoterapií s autologní transplantací [30–42] shrnujeme v tab. 2.
Tab. 2. Léčba light chain deposition disease vysokodávkovanou chemoterapií s autologní transplantací. Přehled publikovaných klinických studií. 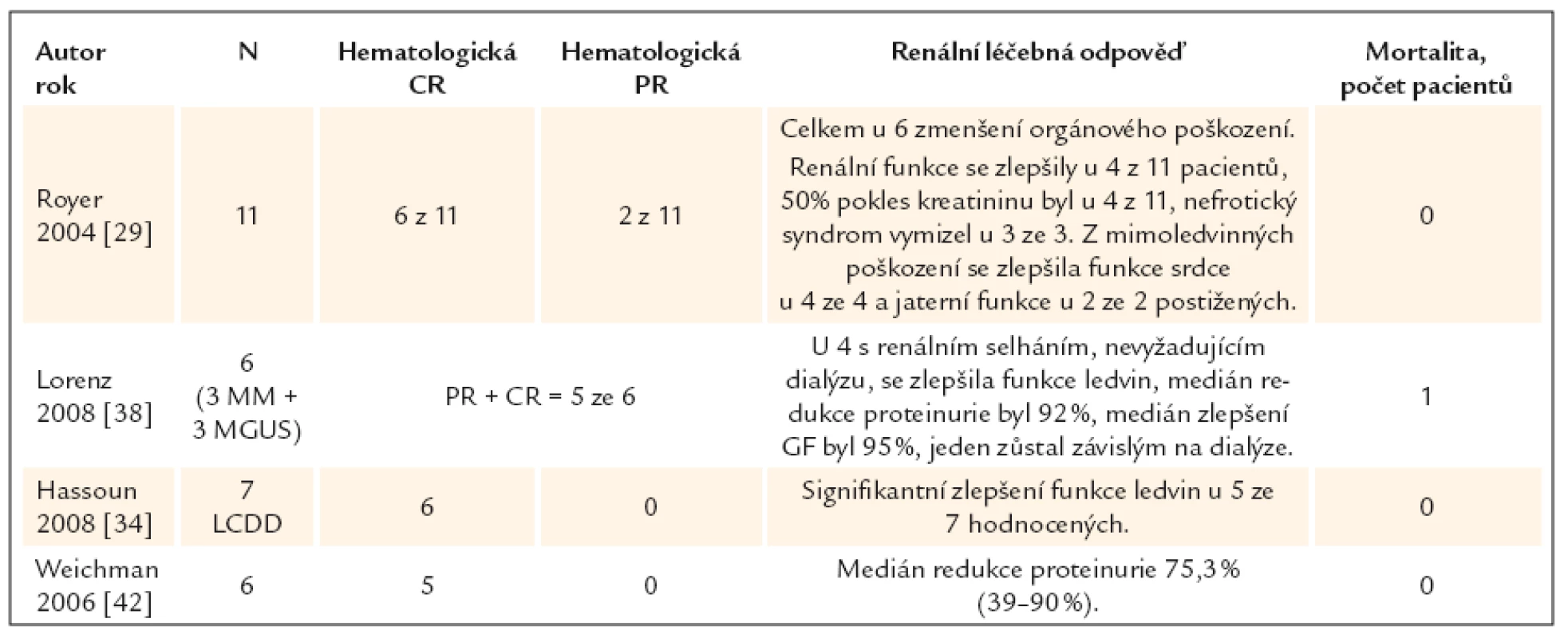
Hematologická CR – hematologická kompletní remise, hematologická PR – hematologická parciální remise, N – počet pacientů Data uvedená v tab. 2 samozřejmě nedovolují exaktní srovnání klasické a vysokodávkované chemoterapie, nicméně počet hematologických i ledvinných léčebných odpovědí je vyšší, než udávaly publikované soubory nemocných léčených klasickou chemoterapií.
Naše zkušenost koresponduje s těmito pozitivními zkušenostmi s vysokodávkovanou chemoterapií s autologní transplantací krvetvorné tkáně.
Po vysokodávkované chemoterapii velmi rychle poklesla koncentrace volných lehkých řetězců κ, jak uvádíme v tab. 1. V průběhu vysokodávkované chemoterapie však vznikla mukositida a febrilní neutropenie se septickým stavem a současně výrazně vzestoupil kreatinin. Zhoršení funkce ledvin v období těsně po vysokodávkované chemoterapii mělo nejspíše souvislost se septickým stavem a septickým šokem. Není známo, zda melfalan v uvedené dávce může mít přímý nefrotoxický účinek na ledviny s amorfními depozity amyloidu. V případě poškození ledvin depozity AL-amyloidu a vysokodávkované chemoterapie byla popsána „postconditioning renal insuficiency“ neboli zhoršení funkce ledvin po aplikace vysoké dávky melfalanu.
Vzestup kreatininu nejméně o 44 μmol/l(0,5mg/dl) byl zaznamenán u 19% z 80členného souboru pacientů s AL-amy-loidózou, kteří podstoupili vysokodávkovanou chemoterapii [43]. V další studii byl vzestup kreatininu (nejméně o 88 μmol/l) v potransplantačním období (melfalan 100–200mg/m2) zjištěn dokonce u 23% nemocných [44].Nepříznivými prognostickými faktory pro zhoršení funkce ledvin po vysokodávkované chemoterapii byl vyšší věk, hypalbuminemie, výrazná proteinurie a použití diuretik. Předpokládá se, že nefrotoxický vliv vysoké dávky melfalanu je v těchto případech způsoben:
- přítomností depozit monoklonálníhoimunoglobulinu v ledvině ve formě AL-amyloidu
- hypoproteinemií a hypalbuminemiía s tím souvisejícím zmenšením frakcemelfalanu vázaného na bílkoviny
- sníženým intravaskulárním objemem u nefrotického syndromu
Souhra těchto uvedených faktorů způsobuje zvýšenou senzitivitu ledvin k nežádoucím účinkům melfalanu [44].
Diagnóza AL-amyloidózy je podstatně častější než light chain deposition disease, a proto i klinických zkušeností je více. U pacientů s light chain deposition disease léčených vysokodávkovanou chemoterapií jsme sice v literatuře nenašli popsaný fenomén „postconditioning renal insuficiency“ v návaznosti na vysokou dávku melfalanu, nicméně nalezli jsme pouze zprávy o celkem 30 pacientech s light chain deposition disease, což je podstatně menší počet než transplantovaných pacientů s AL-amyoidózou.
Vysokodávkovaná chemoterapie u naší pacientky navodila kompletní remisi, včetně normalizace poměru κ/ λ řetězců. Funkce ledvin se však zlepšovaly velmi pozvolna. Poté, co byla zastavena zvýšená produkce nefrotoxických lehkých řetězců, začala postupně klesat proteinurie a zvyšovat se filtrace.
Nyní je pacientka tři roky od stanovení diagnózy a zahájení léčby stále v kompletní hematologické remisi a došlo k vymizení nefrotického syndromu.
Prognóza pacientů s light chain deposition disease závisí na maligním potenciálu transformovaných plazmatických buněk. Je pochopitelné, že prognóza je příznivější u osob, u nichž splňuje plazmocelulární klon kritéria monoklonální gamapatie nejistého významu (monoclonal gammopathy of undetermined significance – MGUS) než u osob, u nichž splňuje plazmocelulární klon kritéria mnohočetného myelomu. Celkové přežití pacientů s light chain deposition disease se uvádí kolem 49 měsíců, 31% nemocných však žije déle než 8 let [29].
Nepříznivými prognostickými faktory je souvislost s mnohočetným myelomem a vysoká hodnota kreatininu při stanovení diagnózy, vyšší věk, agresivní průběh myelomu a depozita lehkých řetězců i v dalších orgánech [2,45,46]. Nutno myslet i na další vzácné patologické stavy, které provází monoklonální imunoglobulin, jako je např. capillary leak syndrome [47]. V případě naší nemocné, jejíž nemoc nebyla senzitivní na klasickou chemoterapii, máme pro případ recidivy uschovány 3 štěpy krvetvorné tkáně pro další vysokodávkované chemoterapie a bylo by možné otestovat reakci této nemoci na nové účinné léky (thalidomid, bortezomib, lenalidomid).
Závěr
Uvedeným popisem případu upozorňujeme na formu poškození ledvin monoklonálním imunoglobulinem, které může způsobit kombinaci nefrotického syndromu a renálního selhání. Dokumentuje možnost dosáhnout kompletní remise vysokodávkovanou chemoterapií i v případné rezistenci na klasickou chemoterapii. V následujících měsících se postupně upravovala funkce ledvin a vymizel nefrotický syndrom.
Vysokodávkovaná chemoterapie však byla komplikována dočasným zhoršením funkce ledvin, je otázka, zda to bylo způsobeno septickým stavem anebo zda šlo o jev pozorovaný při vysokodávkované chemoterapii u pacientů s AL-amyloidózou zvaný „postconditioning renal insuficiency“.
Dále uvedené sdělení dokumentuje důležitost vyšetřování sérových koncentrací volných lehkých řetězců u těchto nemocných, které nejlépe odrážejí změny aktivity nemoci. Klasická elektroforéza neumožňuje totiž kvantifikovat volné lehké řetězce v séru. Jejich stanovení v moči při masivní proteinurii pomocí elektroforézy a denzitometrie je také problematické a mimo jiné koncentrace volných lehkých řetězců v moči je ovlivňována nejen produkcí lehkých řetězců plazmatickými buňkami, ale také hodnotou glomerulární filtrace. Snížení koncentrace volných lehkých řetězců v moči může tak odrážet jak redukci masy plazmatických buněk, tak redukci glomerulární filtrace. Sledování změn koncentrací volných řetězců κ a λ a jejich poměru tak nejlépe odráží aktivitu plazmocelulární proliferace, a tedy i účinnost léčby.
Tato práce vznikla a byla podporována v rámci projektu MŠMT: LC 06027 a VZ 0021622434.
prof. MUDr. Zdeněk Adam, CSc.
www.fnbrno.cz
e mail: z.adam@fnbrno.cz
Zdroje
1. Randall RE, Williamson WC jr, Mulinax F et al. Manifestation of systemic light chain deposition. Am J Med 1976; 60 : 293 – 299.
2. Heilman RL, Velosa JA, Holley KE et al. Long term follow up and response to chemotherapy in patients with light chain deposition disease. Am J Kidney Dis 1992; 20 : 34 – 41.
3. Pozzi C, Fogazzi GB, Banfi G et al. Renal disease and patient survival in light chain deposition disease. Clin Nephrol 1995; 43 : 281 – 287.
4. Cogné M, Preud’homme JL, Bauwens M. Structure of monoclonal kappa chain of the V kappa IV subgroup in the kidney and plasma cells in light chain deposition disease. J Clin Invest 1991; 87 : 2186 – 2190.
5. Wahner-Roedler DL, Kyle RA. Heavy chain diseases. Best Pract Res Clin Hematol 2005; 18 : 729 – 746.
6. van Ingen G, van Bronswijk H, Meijer CJ et al. Light chain deposition disease without detectable light chains in serum or urine. Report of a case and review of the literature. Neth J Med 1991; 39 : 142 – 147.
7. Sakakima M, Fujigaki Y, Tsuji T et al. High dose chemotherapy and stem cell support in a patient of light - and heavy‑chain deposition disease with abnormal marrow cell surface antigens and no monoclonal protein. Intern Med 2005; 44 : 970 – 974.
8. Steuhl KP, Knorr C, Rohrbach JM et al. Paraproteinemic corneal deposits in plasma cell myeloma. Am J Ophthalmol 1991; 111 : 312 – 318.
9. Pelletier G, Fabre M, Attali P et al. Light chain deposition disease presenting with hepatomegaly: an association with amyloid‑like fibrils. Postgrad Med J 1988; 64 : 804 – 808.
10. Kijner CH, Yousem SA. Systemic light chain deposition disease presenting as multiple pulmonary nodules. A case report and review of the literature. Am J Surg Pathol 1988; 12 : 405 – 413.
11. Girelli CM, Lodi G, Rocca F. Kappa light chain deposition of the liver. Eur J Gastroenterol Hepatol 1998; 10 : 429 – 430.
12. Wohl P, Chadimová M, Englis M et al. Light chain deposition disease as a cause of renal failure. Čas Lék Česk 1998; 137 : 721 – 724.
13. Merta M, Rysavá R, Zabka J et al. Kidney involvement in light‑chain deposition disease. Sb Lek 2002; 103 : 397 – 403.
14. Zhu L, Herrera GA, Murphy - Ullrich JE et al. Pathogenesis of glomerulosclerosis in light chain deposition disease. Role for transforming growth factor‑beta. Am J Pathol 1995; 147 : 375 – 385.
15. Preud’homme JL, Aucouturier P, Touchard G et al. Monoclonal immunoglobulin deposition disease (Randall type). Relationship with structural abnormalities of immunoglobulin chains. Kidney Int 1994; 46 : 965 – 972.
16. Venkataseshan VS, Faraggiana T, Hughson MD et al. Morphologic variants of light‑chain deposition disease in the kidney. Am J Nephrol 1988; 8 : 272 – 279.
17. Salant DJ, Sanchorawala V, D’Agati VD. A case of atypical light chain deposition disease – diagnosis and treatment. Clin J Am Soc Nephrol 2007; 2 : 858 – 867.
18. Baur A, Stäbler A, Lamerz R et al. Light chain deposition disease in multiple myeloma: MR imaging features correlated with histopathological findings. Skeletal Radiol 1998; 27 : 173 – 176.
19. Ferrario F, Rastaldi MP. Histopathological atlas of renal diseases: light chain deposition disease. J Nephrol 2005; 18 : 499 – 502.
20. Gokden N, Barlogie B, Liapis H. Morphologic heterogeneity of renal light‑chain deposition disease. Ultrastruct Pathol 2008; 32 : 17 – 24.
21. Joh K. Pathology of glomerular deposition diseases. Pathol Int 2007; 57 : 551 – 565.
22. Gu X, Herrera AG. Light chain mediated acute tubular interstitial nephritis: a poorly recognized pattern of renal disease in patients with plasma cell dyscrasia. Arch Pathol Lab Med 2006; 130 : 165 – 169.
23. Ganeval D, Noël LH, Preud’homme JL et al. Light chain deposition disease: Its relation with AL type amyloidosis. Kidney Int 1984; 26 : 1 – 9.
24. Hofmann‑Guilaine C, Nochy D, Jacquot C et al. Association light chain deposition disease (LCDD) and amyloidosis. One case. Pathol Res Pract 1985; 180 : 214 – 219.
25. Jacquot C, Saint - Andre JP, Touchard Get al. Association of systemic light‑chain deposition disease and amyloidosis: a report of three patients with renal involvement. Clin Nephrol 1985; 24 : 93 – 98.
26. Lin J, Markowitz GS, Valeri AM et al. Renal monoclonal immunoglobulin deposition disease. The disease spectrum. J Am Soc Nephrol 2001; 12 : 1482 – 1492.
27. Pozzi C, D’Amico M, Fogazzi GB et al. Light chain deposition disease with renal involvement: clinical characteristics and prognostic factor. Am J Kidney Dis 2003; 42 : 1154 – 1163.
28. Leung N, Lager DJ, Gertz MA et al. Long‑term outcome of renal transplantation in light‑chain deposition disease. Am J Kidney Dis 2004; 43 : 147 – 153.
29. Royer B, Arnulf B, Martinez F et al. High dose chemotherapy in light chain or light and heavy chain deposition disease. Kidney Int 2004; 65 : 642 – 648.
30. Barraclough KA, Dowling JP, Schwarer AP et al. Sequential autologous peripheral blood stem cell transplantation and kidney transplantation of light chain deposition disease. Nephrol Dial Transplant 2007; 22 : 1268 – 1269.
31. Brockhurst I, Harris KP, Chapman CS.Diagnosis and monitoring a case of light‑chain deposition disease in the kidney using a new, sensitive immunoassay. Nephrol Dial Transplant 2005; 20 : 1251 – 1253.
32. Firkin F, Hill PA, Dwyer K et al. Reversal of dialysis dependent renal failure in light chain deposition disease by autologous peripheral blood stem cell transplantation. Am J Kidney Dis 2004; 44 : 551 – 555.
33. Gertz MA, Lacy MQ, Lust JA et al. Phase II trial of high‑dose dexamethasone for untreated patients with primary systemic amyloidosis. Med Oncol 1999; 16 : 104 – 109.
34. Hassoun H, Flombaum C, D’Agati VD et al. High‑dose melphalan and auto - SCT in patients with monoclonal Ig deposition disease. Bone Marrow Transplant 2008; 42 : 405 – 412.
35. Kastritis E, Migkou M, Gavriatopoulou M et al. Treatment of light chain deposition disease with bortezomib and dexamethasone. Haematologica 2009; 94 : 300 – 302.
36. Kirkpatrick CJ, Curry A, Galle J et al. Systemic kappa light chain deposition and amyloidosis in multiple myeloma: novel morphological observations. Histopathology 1986; 10 : 1065 – 1076.
37. Lambotte O, Dürrbach A, Ammor M et al. Association of a POEMS syndrome and light chain deposit disease: first case report. Clin Nephrol 2001; 55 : 482 – 486.
38. Lorenz EC, Gertz MA, Fervenza FC et al. Long‑term outcome of autologous stem cell transplantation in light chain deposition disease. Nephrol Dial Transplant 2008; 23 : 2052 – 2057.
39. Pineda - Roman M, Tricot G. High‑dose therapy in patients with plasma cell dyscrasias and renal dysfunction. Contrib Nephrol 2007; 153 : 182 – 194.
40. Samanez C, Domingo A, Cibeira MT. Development of rapidly progressive liver light chain deposition under VAD chemotherapy in multiple myeloma. Eur J Haematol 2006; 76 : 83 – 85.
41. Sanchorawala V, Wright DG, Seldin DC et al. An overview of the use of high‑dose melphalan with autologous stem cell transplantation for the treatment of AL amyloidosis. Bone Marrow Transplant 2001; 28 : 637 – 642.
42. Weichman K, Dember LM, Prokaeva T et al. Clinical and molecular characteristics of patients with non‑amyloid light chain deposition disorders, and outcome following treatment with high dose melphalan and autologous stem cell transplantation. Bone Marrow Transplantatin 2006; 38 : 339 – 343.
43. Leung N, Slezak JM, Bertstralh EJ. Acute renal insufficiency after high dose melphalan in patients with primary systemic amyloidosis during stem cell transplantation. Am J Kidney Dis 2005; 45 : 102 – 111.
44. Comezo RL. Managing systemic light chain amyloidosis. J Natl Compr Canc Netw 2007; 5 : 179 – 187.
45. Bedossa P, Fabre M, Paraf F et al. Light chain deposition disease with liver dysfunction. Hum Pathol 1988; 19 : 1008 – 1014.
46. Bhargava P, Rushin JM, Rusnock EJ et al. Pulmonary light chain deposition disease. Report of five cases and review of literature. Am J Surg Pathol 2007; 31 : 267 – 276.
47. Popovic M, Tavcar R, Glavac D et al. Light chain deposition disease restricted to the brain: the first case report. Hum Pathol 2007; 38 : 179 – 184.
48. Doubek M, Brychtova Y, Tomiska M et al. Idiopathic systemic capillary leak syndrome misdiagnosed and treated as polycythemia vera. Acta Haematol 2005; 113 : 150 – 151.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2009 Číslo 11- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Výsledky léčby nemocných s esenciální trombocytemií a dalšími myeloproliferacemi provázenými trombocytemií – zpráva z registru pacientů léčených Thromboreductinem®
- Neuroprotekce po srdeční zástavě a časná poresuscitační péče – editorial
- Má tromboelastografie své místo v kardiochirurgii a kardiologii? – editorial
- Dlouhodobé sledování pacientů s diabetes mellitus 1. typu léčených inzulinem glargin
- Idiopatické střevní záněty – familiární a sporadická forma
- Sociální, ekonomické a psychické vlivy jako rizikové faktory kardiovaskulárních chorob
- Porovnání struktury a funkce nazální a bronchiální sliznice u nemocných s CHOPN (pilotní projekt ciliární studie)
- Endoskopická diagnostika a léčba pankreatobiliárních onemocnění u pacientů po resekci žaludku podle Billrotha II
- Neuroendokrinní tumory appendixu
- Karcinoid appendixu s pohárkovými buňkami
- Současné ochlazovací metody pro indukci mírné hypotermie po srdeční zástavě
- Môže tromboelastografia ovplyvniť manažment pacientov v kardiológii a kardiochirurgii?
- High‑sensitivity metody stanovení srdečních troponinů 2009: klinický potenciál, současná praxe a přínos, perspektiva
- Výsledky studie RE- LY slibují účinnější, bezpečnější a jednodušší prevenci embolických komplikací u nemocných s nevalvulární fibrilací síní
- Vymizení nefrotického syndromu a zlepšení funkce ledvin u nemocné s light chain deposition disease po vysokodávkované chemoterapii s autologní transplantací kmenových krvetvorných buněk. Popis případu a přehled literatury
- Rekurentní nesetrvalá komorová tachykardie v těhotenství
- Opakovaná lokální trombolýza u poranění a trombózy axilární a podklíčkové žíly
- Pavlišta D et al. Neinvazivní karcinomy prsu. Praha: Maxdorf 2008, 181 s. ISBN 978- 80-7345-173- 8
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Neuroendokrinní tumory appendixu
- Rekurentní nesetrvalá komorová tachykardie v těhotenství
- Endoskopická diagnostika a léčba pankreatobiliárních onemocnění u pacientů po resekci žaludku podle Billrotha II
- Opakovaná lokální trombolýza u poranění a trombózy axilární a podklíčkové žíly
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



