-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Autoimunitný polyglandulárny syndróm typ 2 asociovaný s autoimunitnou hypofyzitídou a coeliakiou
Autoimmune polyendocrine syndrome type 2 associated with autoimmune hypophysitis and coeliac disease
Autoimmune polyendocrine syndromes (APS) are organ ‑ specific autoimmune disorders affecting multiple endocrine glands; these are gradually destroyed by action of autoantibodies. Similarly to other autoimmune diseases, the presence of certain genetic predisposition is an essential prerequisite to the disease development; polymorphism of the main histocompatible system (HLA in humans) appears to play the most important role. APS are categorized into four types, based on what combination of endocrine glands is affected. APS type 1, characterised by hypoparathyreosis, mucocutaneous candidiasis and Addison’s disease, is frequently seen in childhood. For a more common APS type 2 to be diagnosed, Addison’s disease together with autoimmune thyroiditis (Schmidt’s syndrome) and/ or together with diabetes mellitus type I (Carpenter’s syndrome) must be present. The third type of autoimmune polyendocrine syndromes (APS type 3) involves the same disorder of endocrine glands as type 2 but usually without any defect of adrenal cortex. If the autoimmune endocrine gland disorder does not fulfil the criteria of APS 1 – 3, the disease may be categorized as autoimmune polyendocrine syndrome type 4. The authors present a case of 33 years old APS type 2 patient who, over 20 years, developed a wide range of autoimmune endocrinopathies, including endocrinopathies that are less common, such as adenohypophysitis, and are associated with other organ ‑ specific diseases (coeliac disease). The case is presented to demonstrate the fact that APS represent a dynamic process and that it is always important to keep in mind that, over time, a patient may develop other autoimmune diseases. To conclude, the authors emphasise the recommendation to test patients with monoglandular endocrinopathy for the presence of any secondary endocrine disorders.
Key words:
autoimmune polyendocrine syndrome – hypophysitis – diabetes mellitus – coeliac disease
Autori: K. Hrubišková 1; P. Jackuliak 1; P. Vaňuga 2; M. Pura 2; J. Payer 1
Pôsobisko autorov: V. interná klinika Lekárskej fakulty UK a FNsP Bratislava, Slovenská republika, prednosta prof. MU Dr. Juraj Payer, CSc. 2Endokrinologické oddelenie Národného endokrinologického a diabetologického ústavu n. o. Ľubochňa, Slovenská republika, prednosta prim 1
Vyšlo v časopise: Vnitř Lék 2010; 56(11): 1169-1176
Kategória: Kazuistiky
Súhrn
Autoimunitné polyglandulárne syndrómy (APS) sú orgánovo špecifické autoimunitné poruchy postihujúce viaceré endokrinné žľazy, ktoré sú postupne deštruované účinkom autoprotilátok. Podobne ako pri iných autoimunitných ochoreniach nevyhnutnou podmienkou rozvoja ochorenia je existencia určitej genetickej predispozície, pričom ako najdôležitejší genetický faktor sa javí polymorfizmus hlavného histokompatibilného systému (HLA u človeka). Na základe rôznej kombinácie postihnutia endokrinných žľiaz rozlišujeme 4 typy APS. V detskom veku je častý APS typ 1, charakterizovaný hypoparatyreózou, mukokutánnou kandidózou a Addisonovou chorobou. Častejším typom je APS typ 2, pre ktorého diagnózu je nevyhnutná prítomnosť Addisonovej choroby v asociácii s autoimunitnou tyreoiditídou (Schmidtov syndróm) a/ alebo v asociácii s diabetes mellitus 1. typu (Carpenterov syndróm). Tretí typ autoimunitných polyglandulárnych syndrómov (APS typ 3) predstavuje obdobné postihnutie endokrinných žliaz ako pri type 2, avšak nebýva postihnutá kôra nadobličiek. Ak autoimunitné postihnutie endokrinných žliaz nespĺňa kritériá APS 1 – 3, ochorenie môžeme priradiť k autoimunitnému polyglandulárnemu syndrómu typ 4. Autori demonštrujú prípad 33 - ročnej pacientky s APS 2. typu, u ktorej v priebehu 20 rokov prišlo k manifestácii širokého spektra aj menej často sa vyskytujúcich autoimunitných endokrinopatií ako adenohypofyzitída a súčasne asociovaných aj s inými orgánovo špecifickými ochoreniami (coeliakia). Na príklade uvedenej pacientky autori chcú demonštrovať, že APS je dynamický proces a vždy treba myslieť na to, že postupom času sa u pacientov môžu vyvinúť ďalšie autoimunitné ochorenia. Záverom autori zdôrazňujú význam odporúčaní testovania pacientov s monoglandulárnou endokrinopatiou na prítomnosť druhotného endokrinologického postihnutia.
Kľúčové slová:
autoimunný polyglandulárny syndróm – hypofyzitída – diabetes mellitus – coeliakiaÚvod
Autoimunitné polyglandulárne syndrómy (APS) sú ochorenia charakterizované združeným výskytom viacerých hypofunkčných (zriedkavejšie hyperfunkčných) porúch endokrinných žliaz. Zaraďujeme ich do veľkej skupiny orgánovo špecifických autoimunitných ochorení a príčinou ich vzniku je orgánovo alebo antigénovo špecifická tvorba autoprotilátok, ktoré spolu s infiltráciou endokrinných žliaz lymfocytmi vedú k postupnej deštrukcii tkaniva endokrinnej žľazy. Ochorenia sa môžu spájať aj s inými autoimunitnými chorobami, ako sú reumatoidná artritída, perniciózna anémia, vitiligo, Sjögrenov syndróm, myastenia gravis, coeliakia atď.
Prvý opis APS pochádza pravdepodobne z roku 1855, kedy Thomas Addison opísal prípad pacienta s pernicióznou anémiou, vitiligom a adrenálnou insuficienciou [1]. Od roku 1980 používame klasifikáciu APS na 4 typy podľa Neufelda a Blizzarda (tab. 1) [2].
Tab. 1. Klasifikácia APS podľa Neufelda a Blizzarda [2]. ![Klasifikácia APS podľa Neufelda a Blizzarda [2].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/dc5df8fd70959ff0d3a2b26396ceb210.jpeg)
Tab. 2. Klasifikácia APS typ 3 (Betterle 2001). 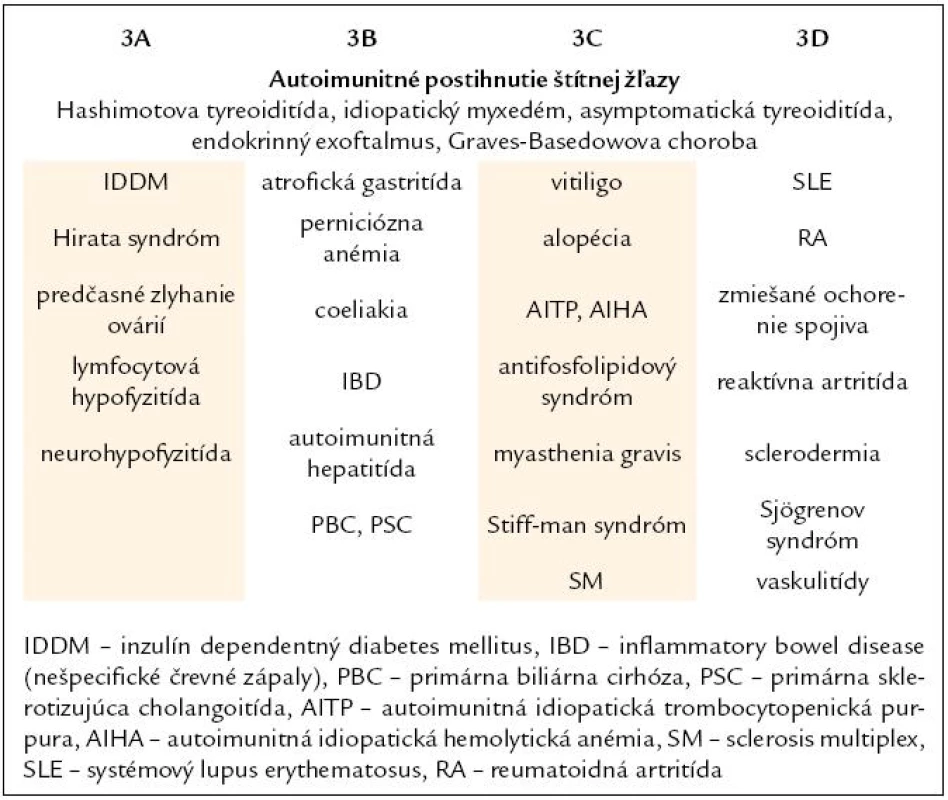
APS typ 1, známy aj ako Whitakerov syndróm alebo autoimmune polyendocrinopathy-candidiasis-ectodermal dystrophy (APECED), je charakterizovaný súčasným výskytom hypoparatyreózy, mukokutánnej kandidózy a Addisonovej choroby. Je to ochorenie detského veku a predstavuje model monogénového autoimunitného ochorenia. Podstatou je mutácia génu AIRE (autoimunitný regulátor), ktorý sa nachádza na 21. chromozóme a kóduje jadrový proteín zodpovedný za týmusovú expresiu antigénov vyskytujúcich sa na periférnych tkanivách. Pri absencii týmusovej expresie T-lymfocyty špecifické pre tieto antigény unikajú mechanizmu negatívnej selekcie v procese centrálnej tolerancie [3]. Do roku 2001 bolo známych 42 rôznych mutácií tohto génu, ale iba 4 z nich sa zdajú byť rozhodujúce [1]. Rôzny výskyt tohto zriedkavého ochorenia v niektorých populáciách je daný rozdielnou koncentráciou génu v danej populácii a výskyt kolíše od 1 : 9 000 (iránska židovská komunita) až ku 1 : 200 000 (severné Taliansko) [1]. Ochorenie sa dedí autozomálne recesívne, po stránke imunologickej je charakterizované deficienciou bunkovej imunity. Postihnutí pacienti nemajú schopnosť vyvinúť T bunkovú imunitnú odpoveď proti patogénom rodu Candida, zatiaľ čo protilátková odpoveď je zachovaná, čo ich ochraňuje pred rozvojom systémovej kandidózy. Klinicky sú najtypickejšie príznaky mukokutánnej kandidózy, ktorá je prvým klinickým prejavom ochorenia, nasledovaná hypoparatyreózou a nakoniec zlyhaním nadobličiek.
APS typ 2 je častejším typom a incidencia je 1,4 – 4,5 na 100 000 obyvateľov [4]. Ochorenie postihuje prevažne ženy v dospelom veku, u detí je veľmi zriedkavé. Priemerný vek manifestácie je 35 rokov. Podľa kritérií Neufelda a Blizzarda je pre diagnózu nevyhnutná prítomnosť Addisonovej choroby v asociácii s autoimunitnou tyreoiditídou (Schmidtov syndróm) a/ alebo v asociácii s diabetes mellitus 1. typu (Carpenterov syndróm). Dedičnosť je autozomálne dominantná. Autoimunitné postihnutie štítnej žľazy sa vyskytuje u 69 – 82 % pacientov, diabetes mellitus 1. typu má 30 – 52 % pacientov. Iba 11 % pacientov má kompletnú triádu – Addisonova choroba + autoimunitná tyreopatia + diabetes melllitus 1. typu [5]. Ak sa tyreopatia manifestuje pod obrazom Graves-Basedowovej choroby, táto sa objavuje väčšinou pred vznikom adrenálnej insuficiencie, zatiaľ čo chronická tyreoiditída vzniká súčasne alebo po vzniku Addisonovej choroby. Z ostatných asociovaných autoimunít sú najčastejšie vitiligo (4,5 – 11 %), chronická atrofická gastritída s/ bez pernicióznej anémie (4,5 – 11 %), hypergonadotropný hypogonadizmus (4 – 9 %). Menej často zaznamenávame výskyt autoimunitnej hepatitídy a alopécie. V menej ako 1 % prípadov sa popisuje súčasný výskyt autoimunitnej hypofyzitídy, reumatoidnej artritídy, myastenia gravis, Sjögrenovho syndrómu alebo trombocytopenickej purpury [5].
Tretí typ autoimunitných polyglandulárnych syndrómov (APS typ 3), kedysi známy aj pod označením tyreogastrický syndróm, predstavuje obdobné postihnutie endokrinných žliaz ako pri type 2, avšak nebýva postihnutá kôra nadobličiek. Jedná sa vlastne o autoimunitné postihnutie štítnej žľazy s jej rôznymi klinickými manifestáciami (Hashimotova tyreoiditída, Graves-Basedowova choroba, endokrinná oftalmopatia, pretibiálny myxedém) s inou autoimunitnou endokrinopatiou. Je to pravdepodobne najčastejší typ APS. Autoimunitné ochorenia štítnej žľazy sú najčastejšími autoimunitnými ochoreniami vôbec s výskytom 7 – 8 % v bežnej populácii (10 % u žien, 3 % u mužov).
Tab. 3. Autoantigény vyskytujúce sa u APS. 
Betterle v roku 2001 navrhol 4 podtypy APS 3 – typ 3A (asociácia tyreoiditídy s inými endokrinnými autoimunitnými ochoreniami), typ 3B (asociácia s gastrointestinálnymi autoimunitnými ochoreniami), typ 3C (asociácia s kožnými/ hemopoetickými/ neurologickými autoimunitnými ochoreniami) a typ 3D (asociácia s kolagenózami/ vaskulitídami) [1].
Ak autoimunitné postihnutie endokrinných žliaz nespĺňa kritériá APS 1 – 3, ochorenie môžeme priradiť k autoimunitnému polyglandulárnemu syndrómu typ 4 (napr. Addisonova choroba s hypogonadizmom, diabetes mellitus 1. typu s coeliakiou atď).
Tab. 4. Výsledky vyšetrenia autoprotilátok (kazuistika). 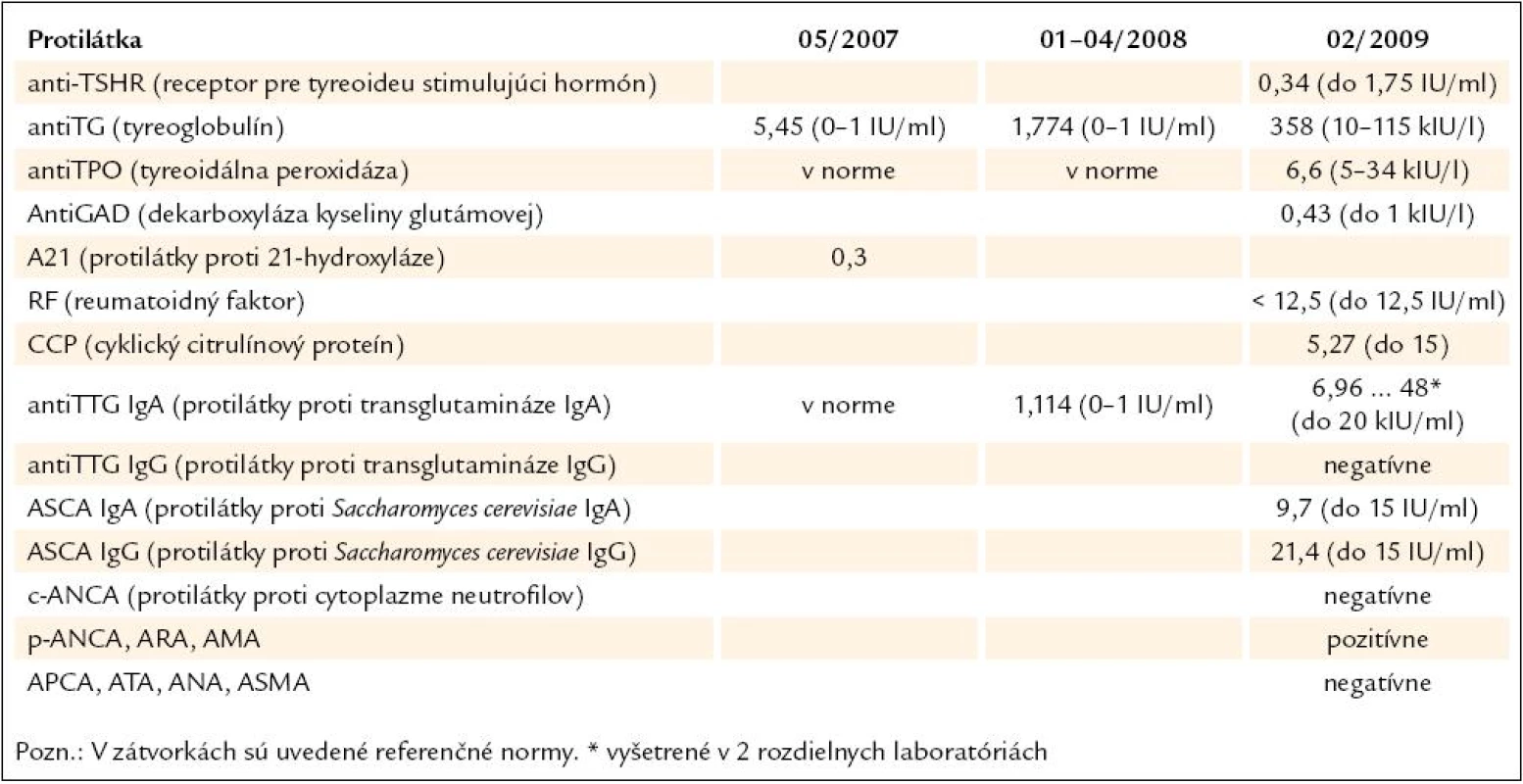
Patogenéza APS
Patogenéza autoimunitných polyglandulárnych syndrómov sa do dnešnej doby presne neobjasnila. Vyslovila sa hypotéza, že orgány, ktoré sa vyvíjajú z rovnakej embryonálnej zárodočnej vrstvy, exprimujú spoločný antigén špecifický pre túto zárodočnú vrstvu a že práve tieto antigény by mohli byť cieľom pôsobenia imunitnej odpovede pri APS. Podľa tejto teórie by APS typu 2 bol následkom pôsobenia autoimunitnej reakcie zameranej ako voči mezodermálnej (z nej sa vyvíja adrenálny kortex), tak voči endodermálnej (štítna žľaza, pankreas) zárodočnej vrstve [6].
Tak ako pri iných autoimunitných ochoreniach predpokladá sa, že nevyhnutnou podmienkou rozvoja ochorenia je existencia určitej genetickej predispozície, pričom ako najdôležitejší genetický faktor sa javí polymorfizmus hlavného histokompatibilného systému (HLA u človeka), zapojené sú aj genetické poruchy apoptotických génov (Fas/ FasL), polymorfizmus regulačných génov (CTLA-4, FoxP3) s následnou poruchou regulácie imunitnej odpovede, poruchy génov kódujúcich cytokíny (TNF, IL 10), čo sa môže prejaviť poruchou rovnováhy Th1 - vs Th2 lymfocytov. Pri viacerých autoimunitných ochoreniach sa v patogenéze uplatňuje porucha funkcie T regulačných lymfocytov (Treg). Prirodzené Treg sú bunky, ktoré sa vyvíjajú v týmuse pod vplyvom génu a proteínu FoxP3 a ich hlavnou úlohou je brániť rozvoju autoagresívnych procesov. Treg rozpoznávajú autoantigény s vysokou afinitiou a svoju aktivitu môžu prejaviť pri oveľa nižšej koncentrácii antigénu, ako je potrebné pre naivné bunky. Treg tlmia aktivitu iných lymfocytov – buď prostredníctvom priamej interakcie s efektorovou bunkou pri rozpoznávaní antigénu (CTLA-4 na Treg + CD80/ 86 na T-lymfocyte) alebo prostredníctvom stimulácie syntézy 2,3 - indolamindeaminázy, ktorá znižuje hladinu tryptofánu (nevyhnutný pre proliferáciu T-lymfocytov). Tak ako existujú HLA gény predisponujúce k určitému ochoreniu, nemožno zabúdať, že niektoré HLA molekuly majú naopak ochranný účinok. Jedná sa napr. o molekuly HLA DR2 a DQ6 v prípade autoimunitného diabetes mellitus, HLA DR3 pri pemphigus vulgaris a pod. U pacientov s APS 2. typu sa vyskytuje vo zvýšenej miere asociácia s HLA antigénmi II. triedy (DR3, DR4, DQ), typ 1 nemá jednoznačnú asociáciu s HLA antigénmi. Ak je jedinec s príslušnou genetickou výbavou vystavený spúšťaciemu faktoru, ktorý môže byť vonkajší (enviromentálny) alebo vnútorný, dochádza k tvorbe autoprotilátok proti vlastným antigénom a následnej postupnej deštrukcii tkaniva endokrinnej žľazy. Pre účasť genetických faktorov v patogenéze svedčí pomerne vysoká konkordancia výskytu ochorenia medzi jednovaječnými dvojčatami – pohybuje sa u rôznych ochorení medzi 25 a 70 %.
Najväčší podiel na spustení procesu autoimunity sa z vonkajších faktorov pripisuje infekciám, i keď žiadne autoimunitné ochorenie nie je späté s konkrétnym infekčným agens. Manifestácia autoimunitného ochorenia pritom môže nastať až roky po prebehnutej infekcii. Pri spustení procesu tvorby autoprotilátok sa uplatňujú viaceré mechanizmy, ktoré sa môžu navzájom aj kombinovať. Môže ísť o mechanizmus molekulového mimikry (niektoré mikrobiálne antigény majú podobnosť s určitými molekulami vlastného organizmu), expozíciu skrytým antigénom (infekciou sa odhalia antigény pôvodne sa nachádzajúce intracelulárne alebo na imunologicky privilegovaných miestach, pokračujúcim zápalom sa spektrum antigénov môže dokonca rozširovať – determinant spreading), tvorbu neoantigénov, stratu supresorovej funkcie imunitného systému, dysreguláciu cytokínovej siete a polyklonálnu aktiváciu lymfocytov bakteriálnym superantigénom, ktorý vyvolá tvorbu širokého spektra protilátok vrátane autoprotilátok.
Najdlhšie známym mechanizmom spustenia autoimunitných ochorení štítnej žľazy je interferónom indukovaná expresia HLA antigénov II. triedy na bunkách, na ktorých sa za fyziologických okolností tieto antigény nevyskytujú (v tomto prípade na tyreocytoch) a ktoré potom vedú k rozvoju autoimunitných reakcií. Spúšťacím faktorom abnormálnej expresie môže byť vírusová infekcia.
Autoantigény, proti ktorým sú namierené protilátky pri APS, možno rozdeliť do 3 skupín [7]: prvú skupinu tvoria povrchové receptory molekúl (TSH receptor, zložka glukózového transportného systému pankreatických buniek GLUT2, receptor pre inzulín, ACTH receptor, receptor pre gonadotropíny). Do druhej skupiny radíme intracelulárne sa vyskytujúce enzýmy, ako sú tyreoidálna peroxidáza, dekarboxyláza kyseliny glutámovej, 21 - a - hydroxyláza, 17 - α - hydroxyláza, H+/ K+ ATPáza. Ako autoantigén môžu samozrejme vystupovať aj samotné sekrečné produkty endokrinných žliaz, napr. tyreoglobulín, vnútorný faktor atď.
Pri postihnutí prištítnych teliesok vystupuje ako hlavný autoantigén calcium-sensitising receptor.
Pri postihnutí kôry nadobličiek je protilátková aktivita zameraná proti 17 - α - hydroxyláze, P450 - desmoláze, 21 - hydroxyláze (hlavný autoantigén) a 3β - hydroxy - steroidnej dehydrogenáze. Enzýmy 17 - α - hydroxyláza a 3β - hydroxy - steroidná dehydrogenáza sa exprimujú aj v gonádach a to môže vysvetľovať predčasné vyhasnutie ich funkcie pri APS.
Pri diabetes mellitus nachádzame protilátky proti inzulárnym bunkám (ICA), proti dekarboxyláze kyseliny glutámovej (antiGAD) a proti 51 - kDa antigénu Langerhansových ostrovčekov.
Postihnutie štítnej žľazy sa najčastejšie prejavuje ako Hashimotova tyreoiditída, pri ktorej sa vytvárajú protilátky proti tyreoglobulínu a mikrozomálnej peroxidáze. Výnimočne býva zachytená Graves - Basedowova choroba s tvorbou stimulujúcich IgG protilátok proti TSH receptorom.
Ako autoantigény pri postihnutí hypofýzy (vyskytuje sa v rámci APS 1, 2, 3) vystupujú štruktúry buniek produkujúcich hormóny (prolaktín produkujúce bunky, ACTH produkujúce bunky, GH produkujúce bunky) a 49 - kDa cytosolový pituitárny proteín, čo je ubikvitárne sa vyskytujúci glykolytický enzým enoláza. Autoprotilátky proti enoláze môžu skrížene reagovať aj s g izoformou tohto enzýmu (neurón špecifická enoláza), ktorý býva exprimovaný aj v placente, čím sa vysvetľuje často popisovaná asociácia výskytu lymfocytárnej hypofyzitídy a tehotenstva.
Zvýšené hladiny autoprotilátok nachádzame v krvi postihnutých pacientov už niekoľko rokov [8] pred rozvojom klinických príznakov hypofunkcie príslušnej endokrinnej žľazy, čo dáva do popredia ich význam ako dôležitého diagnostického a prognostického markera ochorenia. Po „skonzumovaní“ všetkých autoantigénov sa môžu autoprotilátky z krvi pacienta vytratiť a z endokrinných žliaz zostávajú len fibrózne zvyšky.
Tak ako pri iných autoimunitných ochoreniach rozlišujeme aj u APS tri štádiá priebehu ochorenia: v prvom dokážeme len prítomnosť autoprotilátok, bez známok funkčného poškodenia cieľového orgánu. V druhej fáze je už prítomná porucha funkcie dokázateľná však len príslušnými funkčnými testami a až v tretej fáze sú prítomné jednoznačné klinické prejavy ochorenia. Klinické prejavy sa objavujú po deštrukcii viac ako 90 % tkaniva príslušnej endokrinnej žľazy.
Kazuistika
Demonštrujeme prípad 33 - ročnej pa-cientky s APS 2. typu, u ktorej v prie-behu 20 rokov prišlo k manifestácii širokého spektra aj menej často sa vyskytujúcich autoimunitných endokrinopatií. Z rodinnej anamnézy vyzdvihujeme výskyt tyreotoxikózy u matky a starej matky, matka pacientky pre uvedenú diagnózu podstúpila strumektómiu. Dá sa predpokladať, že príčinou bolo autoimunitné ochorenie štítnej žľazy. Otec je sledovaný pre alergickú rinitídu. Jedná sa o pacientku z 2. rizikovej gravidity pre Rh inkompatibilitu. Ako prvé autoimunitné ochorenie sa vo veku 13 rokov (1989) diagnostikoval diabetes mellitus 1. typu, od roku 2007 je pacientka nastavená na liečbu inzulínovou pumpou, v súčasnosti pre labilné hodnoty glykémií zvažujeme zabezpečenie pacientky glukózovým senzorom. V roku 2005 bola u nej potvrdená diagnóza autoimunitnej tyreoiditídy typu 1B (Davies) s prechodom do hypotyreózy, nastavená bola na substitučnú liečbu tyreoidálnymi hormónmi. Pozitívne boli protilátky proti tyreogobulínu (5,45 IU/ ml, norma do 1 IU/ ml), anti-TPO protilátky (protilátky proti tyreoidálnej peroxidáze) boli v medziach referenčných hodnôt. Zvýšený titer protilátok proti tyreoglobulínu pretrváva až do dnešných dní. Pre hnačky a dyspeptický syndróm (anamnesticky asi 2,5 ročné trvanie obtiaží) podstúpila v roku 2007 enterobiopsiu, pri ktorej sa histologicky verifikovala coeliakia asociovaná s úplným deficitom aktivity laktázy, v čase stanovenia diagnózy histologické hodnotenie zodpovedalo obrazu deštruktívnej lézie, t.j. Marsh IIIb. Bola zavedená bezlepková strava, pri ktorej tráviace obtiaže úplne vymizli. Protilátky proti tkanivovej transglutamináze boli v tom čase ako i v neskoršom období pozitívne (v roku 2008 : 1,114 IU/ ml, norma do 1 IU/ ml, v roku 2009 : 48 kIU/ ml, norma do 20 kIU/ ml). V máji roku 2007 sa v rámci komplexného vyšetrenia pacientky s dvomi autoimunitnými endokrinopatiami (diabetes mellitus a tyreoiditída) realizovalo vyšetrenie kortizolového statusu, v krátkom 1 μg ACTH teste sa stanovila diagnóza adrenokortikálnej nedostatočnosti (predpokladaná autoimunitná adrenalitída). Pacientka bola nastavená na substitučnú liečbu hydrokortizonom. Titer protilátok proti 21 - hydroxyláze bol však paradoxne v norme (0,3 U/ ml, norma do 1 U/ ml). Hormonálne parametre hypofýzo-ovariálnej osi (LH zvýšený na 37,37, FSH zvýšený na 41,52, E2 v norme, progesterón zvýšený) spolu s anamnézou sekundárnej amenorey svedčili pre primárne ovariálne zlyhanie. Plánovaný funkčný test s gonadoliberínmi je vzhľadom na užívanie hormonálnej antikoncepcie znemožnený. V januári roku 2008 sa pri kontrolnom vyšetrení v NEDÚ Ľubochňa zistil pokles hladín ACTH, LH i FSH v sére (tab. 5) a vyslovilo sa podozrenie na autoimunitnú hypofyzitídu. V marci roku 2008 MR nález na hypofýze (mierne zväčšenie hypofýzy, drobný kalcifikát) podporil suponovanú diagnózu adenohypofyzitídy. Funkčnými testami (stimulačný test s postinzulínovou hypoglykémiou – júl roku 2008, TRH test – júl roku 2008, CRH test – apríl roku 2009, výsledky v tabuľkách) sa potvrdil centrálny hypokorticizmus, centrálna hypotyreóza a vylúčil sa hyposomatotropizmus ako ďalšia súčasť APS. V teste s kortikoliberínom sme síce dosiahli vzostup hladiny ACTH z nemerateľných hodnôt, ale hladina ACTH v 120. minúte nedosiahla ani polovičné hodnoty referenčného minima. V TRH teste vzostup TSH po stimulácii nebol dostatočný. V spolupráci s patológom sme plánovali vyšetrenie protilátok proti hypofýze metódou nepriamej imunofixácie, avšak problémom je nedostatok vhodného substrátu na vyšetrenie (rezy z hypofýzy). V roku 2008 sa diagnostikovala aj perzistujúca pereniálna alergická rinitída. Z ostatných diagnóz – pacientka je sledovaná pre artritický syndróm (s pozitivitou chlamýdiových protilátok) a pretrvávajúcu lymfocytózu v diferenciálnom krvnom obraze.
Tab. 5. Výsledky vyšetrení hormonálneho profilu (kazuistika). 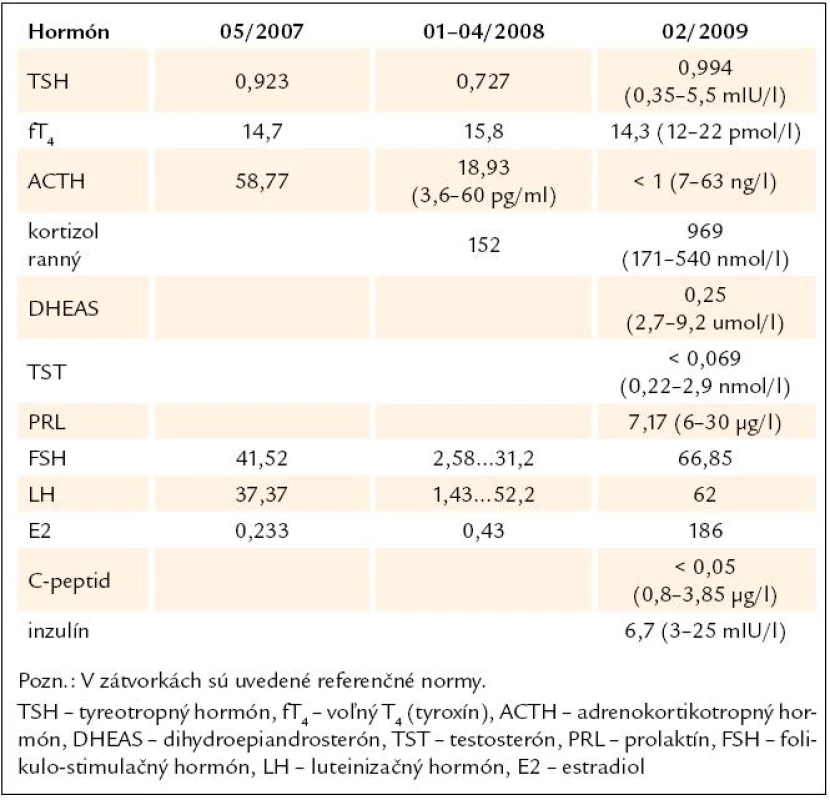
Pri imunologickom vyšetrení v profile bunkovej a protilátkovej imunity neboli prítomné laboratórne (ani klinické) prejavy imunodeficiencie, expresia CD znakov subpopulácií T-lymfocytov bola primeraná, absolútne počty celkových T-lymfocytov a subpopulácií T-lymfocytov boli zvýšené, čo možno vysvetliť i celkovo zvýšeným počtom lymfocytov v diferenciálnom krvnom obraze. Pomer pomocných (CD4+) a cytotoxických (CD8+) T-lymfocytov bol v norme. Vyšetrenie špecifických IgE protilátok proti bežným inhalačným alergénom potvrdilo polyvalentnú senzibilizáciu peľovými alergénmi, alergénmi hmyzu, roztočov a zvierat, titre sú však nízke, väčšinou tesne nad referenčnou hodnotou. Z nutričných alergénov dominujú kravské mlieko, kazeín, vaječný žĺtok, vaječný bielok a orechy. Našli sme aj zvýšené hladiny IgG proti Saccharomyces cervisiae (ASCA). Protilátky proti gliadínu sú negatívne vo všetkých vyšetrených triedach (IgA, IgG, IgE). Zo spektra autoprotilátok sme zachytili pozitivitu ARA (antiretikulínové protilátky), AMA (antimitochondriálne protilátky), pANCA (protilátky proti cytoplazme neutrofilov) a antiTG (protilátky proti tyreoglobulínu). HLA typizáciou sa potvrdil homozygotný stav v HLA DR3 a DQ2. V hormonálnom profile sú pri substitučnej liečbe normálne hladiny fT4 a TSH, hladina kortizolu je taktiež v referenčnom rozmedzí, ACTH je nízke až nemerateľné, C-peptid je taktiež v nemerateľnej hladine, hladina testosterónu a DHEAS sú nízke pri adrenálnej insuficiencii.
Tab. 6. Krátky 1 μg ACTH test (máj roku 2007). 
Diskusia
U pacientov s autoimunitnými endokrinnými ochoreniami často nachádzame haplotypy HLA DR3 - DQ2 alebo DR4 - DQ8. Približne 90 % pacientov s coeliakiou vlastní konfiguráciu HLA DR3 - DQ2 [9], ktorá je kódovaná alelami DQA1*0501 a DQB1*0201, pričom molekula HLA DQ2 slúži na prezentáciu peptidov gluténu antigén prezentujúcimi bunkami CD4+ lymfocytom. Súčasný výskyt endokrinologických autoimunít s coeliakiou sa teda môže vysvetliť zdieľaním spoločného genetického faktora v HLA regióne [9], mechanizmom molekulového mimikry, kedy gliadín alebo tkanivová transglutamináza aktivujú T-lymfocyty, ktoré môžu potom krížovo reagovať s niektorými vlastnými antigénmi. Rovnako príčinou môže byť modifikácia vlastných alebo externých antigénov tkanivovou transglutaminázou za vzniku neoantigénov [9]. Predpokladá sa, že pri asociácii coeliakie a iných autoimunitných ochorení autoreaktívne lymfocyty pochádzajú z lymfoidného tkaniva čreva a že tolerancia k vlastným antigénom a porušila práve v tejto populácii lymfocytov. Dôkazom by mohol byť fakt, že u pacientov s novodiagnostikovaným diabetes mellitus 1. typu sa našli lymfocyty reagujúce s antigénom GAD, ktoré vlastnili homingový receptor α4β7 integrín typický pre črevo [8]. Zvýšená črevná permeabilita u neliečenej coeliakie môže predisponovať k autoimunitným ochoreniam aj tým, že uľahčuje kontakt a vstup externých antigénov (potravinových, bakteriálnych, endotoxínov) do lamina propria sliznice a tým viesť k prelomeniu mechanizmov orálnej tolerancie.
Tab. 7. CRH test (apríl roku 2009). 
Tab. 8. Test s postinzulínovou hypoglykémiou (júl roku 2008). 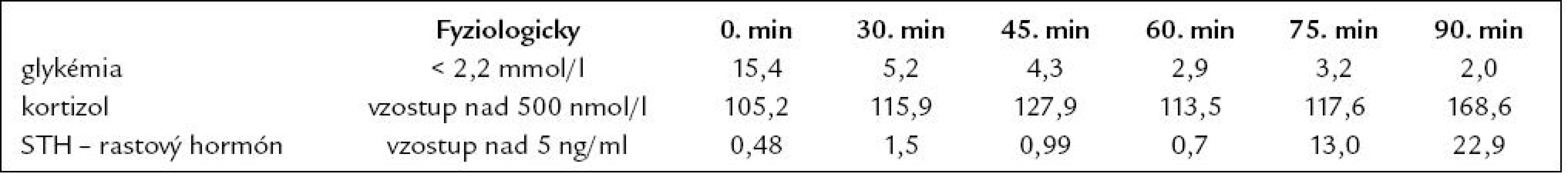
Autoimunintá hypofyzitída (v literatúre označovaná aj ako lymfocytová hypofyzitída) je mimoriadne zriedkavé ochorenie, do dnešnej doby sa v literatúre opísalo celkovo len 379 prípadov (prvý opis v roku 1962), predpokladaná incidencia je 1 na 9 miliónov za rok [10]. Podľa lokalizácie postihnutia rozlišujeme lymfocytovú adenohypofyzitídu (LAH), lymfocytovú infundibuloneurohypofyzitídu (LINH) a lymfocytovú panhypofyzitídu (LPH). LAH sa najčastejšie vyskytuje u žien v mladšom veku (pomer ženy : muži = 6 : 1, priemerný vek 35 ± 13 rokov), pričom výskyt výrazne narastá v súvislosti s tehotenstvom a postpartálnym obdobím. LINH a LPH sa manifestujú v neskoršom veku, LINH postihuje rovnako často mužov i ženy. Asociácia zvýšeného výskytu adenohypofyzitídy v tehotenstve sa vysvetľuje viacerými mechanizmami. Vplyvom estrogénov dochádza k hypertrofii a hyperplázii laktotrofov a mení sa typ krvného zásobenia hypofýzy v prospech systémovej cirkulácie v porovnaní s hypotalamo-hypofyzárnym portálnym obehom. Z toho možno vyvodiť, že zväčšená hypofýza poskytuje väčšie množstvo uvoľňovaných autoantigénov a súčasne je „dostupnejšia“ bunkám imunitného systému. Nemožno zabúdať ani na fakt, že tehotenstvo môže demaskovať už preexistujúcu pituitárnuinsuficienciu.
Tab. 9. TRH test (júl roku 2008). 
Zdá sa, že kľúčovú úlohu v patogenéze tohto ochorenia hrajú folikulovo-stelátové bunky, ktoré považujeme v oblasti adenohypofýzy za profesionálne bunky prezentujúce antigén [10]. V oblastiach s prebiehajúcim autoimunitným procesom bolo dokázané zmnoženie počtu, ale i veľkosti týchto buniek. Súčasne sa našiel zvýšený výskyt aktivovaných CD8+ T-lymfocytov, na bunkách hypofýzy sa aberantne exprimovali MHC glykoproteíny II. triedy a zvýšená bola expresia MHC molekúl triedy I. Makrofágy nachádzané v zápalovom ložisku exprimovali markery neskorej aktivácie [11]. Ako prvé autoantigény, proti ktorým je namierený autoimunitný proces v hypofýze, sa opísali 22 - kD proteín (neskôr identifikovaný ako rastový hormón) a 49-kD cytosolový pituitárny proteín, neskôr identifikovaný ako α-enoláza. Tento enzým sa koexprimuje aj v placente, čo je ďalší faktor vysvetľujúci asociáciu hypofyzitídy a gravidity. α-enoláza sa ukázala ako nevhodný marker na diagnostiku autoimunitnej hypofyzitídy, nakoľko protilátky proti nej sa našli približne v rovnakom počte u pacientov s autoimunitným postihnutím hypofýzy, ale aj u pacientov s adenómom hypofýzy neprodukujúcim hormóny [10].
Najnovšie autoantigény, ktoré sa využívajú v diagnostike autoimunitnej hypofyzitídy, sú pituitary gland specific factor 1a (PGSF1a – proteín so 128 aminokyselinami) a PGSF2. Anti PGSF1a protilátky a anti-PGSF2 protilátky sa u pacientov s hypofyzárnymi ochoreniami nikdy nevyskytujú súčasne, avšak pacienti s protilátkami proti rastovému hormónu majú buď anti-GFS1a, alebo anti-PGSF2 protilátky. Úloha týchto autoprotilátok v patogenéze hypofyzitídy sa ešte presne nepreskúmala, zdá sa však, že majú kľúčovú úlohu. Dôležitý je aj fakt, že tieto autoprotilátky sa nevyskytujú u pacientov s nefunkčným adenómom hypofýzy, môžu teda slúžiť aj ako dôležitý diferenciálno-diagnostický marker [12]. Rutinné stanovovanie protilátok proti hypofýze zatiaľ v bežnej klinickej praxi nie je možné. Ako prvá sa z hormonálnych porúch pri autoimunitnej hypofyzitíde manifestuje väčšinou ACTH deficiencia (vyskytuje sa v 65 % prípadov), neskôr je to deficit tyreotropného hormónu a gonadotropínov. Deficit rastového hormónu je veľmi vzácny. Pri postihnutí infundibula a neurohypofýzy sa rozvíja diabetes insipidus [13].
Záver
Demonštrovaný prípad autoimunitného polyglandulárneho syndrómu považujeme za zaujímavý z viacerých aspektov. Je prítomné široké spektrum endokrinných autoimunitných ochorení, vrátane niektorých raritne sa vyskytujúcich (adenohypofyzitída) a súčasne asociovaných aj s inými orgánovo špecifickými ochoreniami (coeliakia). Predpokladáme, že u našej pacientky sa primárne vyvinulo autoimunitné postihnutie periférnych endokrinných žliaz (štítna žľaza, nadobličky, ováriá) s ich insuficienciou, neskôr, keď prišlo k autoimunitnému zápalu hypofýzy, sa pridali aj príznaky centrálnej hypotyreózy a hypokorticizmu. Vyšetrené spektrum autoprotilátok nevylučuje, že postupom času sa u pacientky môžu vyvinúť aj ďalšie ochorenia, ako je autoimunitné postihnutie pečene (napr. primárna biliárna cirhóza, pre ktorú je typický nález AMA protilátok alebo autoimunitná hepatitída), prípadne artritický syndróm bude progredovať do reumatoidnej artritídy. Niektoré autoprotilátky sú už v sére negatívne, čo možno vysvetliť vymiznutím prezentovaných autoantigénov v priebehu viacerých rokov trvania ochorenia (antiGAD). Podľa autorov z Gutenbergovej Univerzitnej nemocnice v Mainzi by každý pacient s monoglandulárnou endokrinopatiou mal byť skríningovo vyšetrený každé 3 roky až do veku 75 rokov na prítomnosť druhotného endokrinologického postihnutia. V prípade záchytu patologických nálezov sa dopĺňa vyšetrenie autoprotilátok a vyšetrujú sa prvostupňoví príbuzní pacienta [14]. Taktiež autori z Endokrinologického ústavu v Prahe odporúčajú u každého diabetika 1. typu vyšetrovať pravidelne markery tyreoidálnej autoimunity [15].
MUDr. Katarína Hrubišková
www.fnspba.sk
e-mail: khrubiskova@yahoo.comDoručeno do redakce: 11. 4. 2010
Přijato po recenzi: 15. 5. 2010
Zdroje
1. Betterle C, Zanchetta R. Update on autoimmune polyendocrine syndromes (APS). Acta Biomed 2003; 74 : 9 – 33.
2. Neufeld M, Blizzard RM. Polyglandular autoimmune diseases. In: Pinchera A, Doniach D, Fenzi GF et al (eds). Symposium on autoimmune aspects of endocrine disorders. New York: Academic Press 1980 : 357 – 365.
3. Rioux JD, Abbas AK. Paths to understanding the genetic basis of autoimmune disease. Nature 2005; 435 : 584 – 589.
4. Muir A, She JX. Advances in the genetics and immunology of autoimmune polyglandular syndrome II/ III and their clinical applications. Ann Med Interne 1999; 150 : 301 – 312.
5. Majeroni BA, Patel P. Autoimmune polyglandular syndrome, type II. Am Fam Physician 2007; 75 : 667 – 670.
6. Betterle C, Dal Pra C, Mantero F et al. Autoimmune adrenal insufficiency and autoimmune polyendocrine syndromes: autoantibodies, autoantigens and their applicability in diagnosis and disease prediction. Endocr Rev 2002; 23 : 327 – 364.
7. Hrdá P, Šterzl I. Autoimunitní polyglandulární syndromy. Alergie 2001; 2 : 126 – 129.
8. Shoenfeld Y, Blank M, Abu ‑ Shakra M et al. The mosaic of autoimmunity: prediction, autoantibodies and therapy in autoimmune diseases – 2008. Isr Med Assoc J 2008; 10 : 13 – 19.
9. Collin P, Kaukinen K, Välimäki M et al. Endocrinological disorders and celiac disease. Endocr Rev 2002; 23 : 464 – 483.
10. Caturegli P, Newschaffer C, Olivi A et al. Autoimmune hypophysitis. Endocr Rev 2005; 26 : 599 – 614.
11. Gutenberg A, Buslei R, Fahlbusch R et al. Immunopathology of primary hypophysitis: implication for pathogenesis. Am J Surg Pathol 2005; 29 : 329 – 338.
12. Tanaka S, Tatsumi K, Kimura M et al. Detection of autoantibodies against the pituitary ‑ specific proteins in patients with lymphocytic hypophysitis. Eur J Endocrinol 2002; 147 : 767 – 775.
13. Šterzl I, Hrdá P. Imunoendokrinní onemocnění: lymfocytární hypofyzitida. Sanquuis 2008; 58 : 81 – 83.
14. Dittmar M, Kahaly GJ. Polyglandular autoimmune syndromes: immunogenetics and long‑term follow‑up. J Clin Endocrinol Metab 2003; 88 : 2983 – 2992.
15. Vondra K, Vrbíková J, Šterzl I. Tyreoidální autoimunita u dospělých diabetiků 1. typu. Vlastní zkušenosti z 11letého sledování. Vnitř Lék 2006; 52 : 864 – 872.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2010 Číslo 11- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Autoimunitný polyglandulárny syndróm
- Lymfomu podobný průběh agresivní multisystémové histiocytózy z Langerhansových buněk
- Jiný pohled na akutní krvácení do horního trávicího traktu u pacientů s jaterní cirhózou
- Stratifikace rizika pomocí zátěžového SPECT zobrazení myokardu v kombinaci se stanovením koronárního kalciového skóre u rizikových pacientů s diabetem a/ nebo ledvinným selháním
- Stanovenie progresie karcinómu prostaty využitím metodiky RT‑PCR
- Inhibitory angiotenzin konvertujícího enzymu a blokátory receptorů pro angiotenzin II v léčbě fibrilace síní
- Osteoporóza pri chronickej obštrukčnej chorobe pľúc
- Doporučený postup pro diagnostiku a léčbu chronické obstrukční plicní nemoci (CHOPN) – stabilní fáze
- Metastatické postihnutie srdca a perikardu – MR kazuistiky
- Difuzní plošná normolipemická xantomatóza a nekrobiotický xantogranulom, asociované s monoklonální gamapatií – přínos PET‑ CT pro stanovení rozsahu nemoci a zkušenosti s léčbou. Popis dvou případů a přehled literatury
- Autoimunitný polyglandulárny syndróm typ 2 asociovaný s autoimunitnou hypofyzitídou a coeliakiou
- Lymfomu podobný průběh agresivní multisystémové histiocytózy z Langerhansových buněk v dospělosti a přínos PET/ CT vyšetření při hodnocení difuzní metabolické aktivity v plicním parenchymu
- Centrální pravostranná hemiparéza jako dominující projev systémové vaskulitidy
- Profesor MU Dr. František Pór a profesor Dr. Med. Robert Klopstock, poslucháči Lekárskych fakúlt v Budapešti a v Prahe
- Pokroky ve výzkumu aterosklerózy
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Centrální pravostranná hemiparéza jako dominující projev systémové vaskulitidy
- Autoimunitný polyglandulárny syndróm typ 2 asociovaný s autoimunitnou hypofyzitídou a coeliakiou
- Lymfomu podobný průběh agresivní multisystémové histiocytózy z Langerhansových buněk v dospělosti a přínos PET/ CT vyšetření při hodnocení difuzní metabolické aktivity v plicním parenchymu
- Autoimunitný polyglandulárny syndróm
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



