-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Antitrombotická terapie v graviditě
Antithrombotic therapy in pregnancy
Despite the fact of low prevalence of maternal death, deep venous thrombosis remains one of the most serious complication in pregnancy and puerperium. Virchows triad – vascular stasis, hypercoagulability, and vascular trauma plays the main role in the pathogenesis of deep vein thrombosis in pregnancy. Low molecular weight heparins and unfractionated heparins are the best treatment option. The aim of the treatment is to be effective in extension of thrombus and prevention of the postthrombotic syndrome and pulmonary embolism. Management of pregnant women with increased risk of venous thromboembolism can be stratified by determining whether the prior episode VTE was unprovoked or associated with a transient risk factor and the presence or absence of an inherited thrombophilia.
Key words:
deep vein thrombosis – pulmonary embolism – pregnancy – thrombophilia – heparin
Autoři: M. Procházka 1; J. Procházková 2; L. Slavík 2
Působiště autorů: Porodnicko‑gynekologická klinika Lékařské fakulty UP a FN Olomouc, přednosta doc. MU Dr. Radovan Pilka, Ph. D., 2Hematoonkologická klinika Lékařské fakulty UP a FN Olomouc, přednosta prof. MU Dr. Karel Indrák, DrSc. 1
Vyšlo v časopise: Vnitř Lék 2010; 56(2): 130-137
Kategorie: Přehledné referáty
Souhrn
I přes pokles smrtelných případů je stále hluboká žilní trombóza jednou z nejzávažnějších komplikací v těhotenství a šestinedělí. V patogenezi žilní trombózy se i v těhotenství uplatňuje klasická Virchowova triáda charakterizovaná hyperkoagulací, žilní stázou a poškozením endotelu. V těhotenství je možno užít při prokázané hluboké flebotrombóze jak nefrakcionované hepariny, tak hepariny nízkomolekulární (LMWH). Účelem léčby je zabránit růstu trombu a prevence posttrombotického syndromu a plicní embolizace. Prevence recidivy žilní trombózy u skupiny žen s již prodělanou epizodou trombózy či embolie je poměrně složitá. Vyžaduje pečlivý odběr anamnézy, klinické i laboratorní vyšetření. Je nutno rozlišit skupinu s trombofilií a bez ní, klasifikovat těhotné podle vyvolávajících, resp. rizikových faktorů, které vedly k předchozí trombotické příhodě.
Klíčová slova:
hluboká žilní trombóza – plicní embolie – těhotenství – trombofilie – heparinTromboembolická nemoc v těhotenství
I přes pokles smrtelných případů je stále hluboká žilní trombóza jednou z nejzávažnějších komplikací v těhotenství a šestinedělí. Je udávána relativně nízká incidence – 1 případ na 1 000 – 2 000 těhotenství, což ale znamená v absolutních číslech 6 – 10násobné riziko vzniku této komplikace v období gravidity a puerperia oproti netěhotným ženám. V antepartálním období se vyskytuje přibližně se stejnou frekvencí ve všech trimestrech. Šestinedělí, i když s nižším výskytem trombóz oproti těhotenství, stále představuje 3 – 8násobné riziko vzniku hluboké žilní trombózy (HŽT). Naštěstí vzácná je plicní embolie (PE), která ve své fatální podobě postihuje 2,3 rodičky na 100 000 živě narozených dětí. Nediagnostikovaná či pozdě rozpoznaná hluboká žilní trombóza s sebou nese až 25% riziko vzniku PE a zhruba 15% riziko mateřské mortality, pokud zůstane neléčena. Na druhé straně správně a rychle diagnostikovaná a adekvátně léčená žilní trombóza představuje pouze 5% riziko vzniku PE a méně než 1% riziko vzniku smrtelných následků [1].
Patofyziologie žilní trombózy v graviditě
V patogenezi žilní trombózy se i v těhotenství uplatňuje klasická Virchowova triáda charakterizovaná hyperkoagu-lací, žilní stázou a poškozením endo-telu. Koncentrace jednotlivých koagulačních faktorů stoupají (fibrinogen, faktory VII, VIII a X), aktivita fibrinolytického systému je snížena (stoupá hladina inhibitorů aktivátoru plazminogenu I a II – PAI I a II), klesá hladina proteinu S atd. Další protrombotické faktory představují oblenění krevního toku v žilách způsobené tlakem zvětšující se dělohy, zvýšení adhezivity trombocytů a hypotonie cévní stěny žil končetin a pánve.
Těhotenství jako hyperkoagulační stav
Složitý koagulační a fibrinolytický systém je těhotenstvím ovlivněn prokoagulačně. Těhotenství je spojeno s 20 – 200% nárůstem hladin fibrinogenu a faktoru II, VII, VIII, X a XII, zatímco koncentrace faktoru V a IX zůstávají nezměněny.
Hladiny endogenních antikoagulancií naproti tomu stoupají jen minimálně (TFPI, α2 - makroglobulin), zůstávají na stejné úrovni (AT III, heparin II kofaktor, protein C), nebo se snižují (protein S). Navíc se 2 – 3násobně zvyšuje hladina funkčně aktivního PAI 1.
O to větší klinický význam mají v etio-patogenezi některých porodnických komplikací vrozené koagulopatie – trombofilie, které dále vychylují hemostatickou rovnováhu. Není tedy překvapující, že ženy s vrozenými koagulopatiemi mají vyšší riziko výskytu tromboembolické nemoci v graviditě. Tyto stavy mohou navíc indukovat tvorbu trombóz v uteroplacentárním a intervilózním prostoru, a tím vést k intrauterinní růstové retardaci a úmrtí plodu [2,3].
Vrozené trombofilní stavy: patofyziologie, genetika a vliv těhotenství
Rezistence na aktivovaný protein C (mutace faktoru V – Leidenská)
Jedná se o nejčastější vrozenou koagulopatii. Riziko tromboembolie v průběhu života je mezi nosiči 30 % a dále významně stoupá, pokud se přidruží jinézískané či vrozené koagulopatie. Je způsobena bodovou mutací faktoru V koa-gulační kaskády v místě, kde se váže protein C a poté jej štěpí a inaktivuje [3]. Mezi kavkazskou populací je mutace faktor V Leiden (faktor V 1691G/ A) nejčastější genetický defekt způsobující trombózu. Frekvence výskytu kolísá mezi 2 a 15 %. Heterozygotní forma mutace faktor V Leiden zvyšuje riziko trombózy 3 – 8krát, naproti tomu homozygotní postižení představuje až 80násobné riziko.
Faktor V Leiden se vyskytuje u 20 % pacientů s žilní trombózou a u více než poloviny probandů ve vybraných rodinách s trombofilií. To znamená, že představuje nejčastější genetickou abnormalitu u pacientů s trombózou [4,5].
Deficit antitrombinu
Deficit antitrombinu je nejzávažnější protrombotická porucha. Riziko rozvoje TEN v průběhu života je u nosičů 70 – 90 %. Antitrombin (AT) je polypeptid syntetizovaný v játrech. Mimo své inhibiční působení na trombin dokáže AT inaktivovat faktory Xa, IXa, VIIa a plazmin. Aktivace antitrombinu je až 40 000násobně zvýšena vazbou na heparin. Deficit AT je takřka ve všech případech způsoben některou z mnoha bodových mutací, delecí a inzercí a téměř vždy jsou dědičné autozomálně dominantně. Homozygotní forma je s největší pravděpodobností neslučitelná se životem. V rámci vrozených koagulopatií mají pacienti s deficitem antitrombinu největší riziko vzniku trombózy [2,6].
Deficit proteinů C a S
Proteiny C a S (PC a PS) jsou syntetizovány v hepatocytech. Cirkulující protein S se vyskytuje ve formě volné (40 %) a zbytek ve formě vázané na C4 vazebný protein. Prevalence deficitu PC a PS je 0,2 – 0,5, respektive 0,08 %, dědičnost je téměř vždy autozomálně dominantní. Riziko vzniku trombózy v průběhu života u obou deficitů je okolo 50 %. Riziko rozvoje trombózy v těhotenství u deficitu proteinu C je 3 – 10 %, v šestinedělí pak 7 – 19 %. Riziko u deficitu proteinu S je srovnatelné – v těhotenství 0 – 6 %, v šestinedělí 7 – 22 %. Rovněž riziko intrauterinního úmrtí je u deficitů PC a PS zvýšeno – OR = 2,3 (0,6 – 8,3), resp. 3,3 (1,0 – 11,3). V homozygotní formě mohou deficity proteinu C a S vyvolat u novorozenců rozsáhlé nekrózy a neonatální purpuru fulminans [7].
Hyperhomocysteinemie
Homocystein je odvozen od aminokyseliny methioninu. V plazmě je obsažen v koncentraci přibližně 5 – 16 μmol/ l. Vrozená hyperhomocysteinemie může být zapříčiněna řadou enzymatických defektů. Klinické projevy se mohou zvýraznit při deficitu vitaminů B6, B12 a kyseliny listové nebo při léčbě metotrexátem.
Lehké a střední formy vedou k urychlení aterosklerózy a k rozvoji tromboembolie. U plodů vyvolávají defekty neurální trubice a v těhotenství spontánní aborty [8,9].
Ostatní vrozené koagulační poruchy
Přibližně u 2 – 3 % populace byla popsána mutace genu kódujícího protrombin. Mutace v oblasti protrombinového genu v pozici 20210 G/ A bývá spojena se zvýšenou hladinou protrombinu a současně představuje zvýšené riziko vzniku trombózy. Výskyt mutace v bílé populaci kolísá okolo 2 % s mnoha geografickými variacemi, přičemž výskyt mutace je vyšší v jižní než v severní Evropě. To způsobuje značné rozdíly mezi pracemi udávajícími výskyt této mutace a relativní riziko spojené s touto mutací pro vznik trombózy. Mutace (protrombin G20210A) zvyšuje riziko vzniku trombózy 3 – 4násobně. Další méně časté trombofilie jsou dysfibrinogenemie a hyperfibrinogenemie. Dosud však máme pouze málo údajů o vztahu těchto poruch k těhotenství [10,11].
Antifosfolipidový syndrom (APS)
Antifosfolipidový syndrom bývá řazen mezi získané formy trombofilií. Je charakterizován přítomností venózních i arteriálních mikrocirkulačních trombóz, rekurentních předčasně ukončených těhotenství a trombocytopenie v přítomnosti antifosfolipidových protilátek. Antifosfolipidové protilátky jsou různorodou skupinou látek namířených proti makromolekulárním proteinům vázaným na negativně nabité fosfolipidové povrchy. Protrombotický účinek je dán jejich vazbou na trombocyty, které tím aktivuje. Ty začnou vylučovat TF, PAI 1 a jiné prokoagulační faktory. Dále dochází ke snížení antikoagulační aktivity vazbou protilátek na fosfolipidové povrchy, čímž dochází ke snížení aktivace inhibitorů koagulace, k poškození endotelu a expresi cytoadhezivních molekul – to vše vede k trombofilii.
Laboratorně nacházíme antifosfolipidové protilátky typu IgG nebo IgM ve středním nebo vysokém titru. Nález musí být prokázán 2krát v odstupu minimálně 6 týdnů. Dále prokazujeme lupus antikoagulans (LPA) – nejméně 2krát v odstupu 6 týdnů. Velmi často nás na přítomnost antifosfolipidových protilátek upozorní prodloužené aPTT [12 – 14].
Vyšetřování trombofilních stavů u žen
Trombofilní stavy tedy hrají velmi významnou roli v patogenezi hluboké žilní trombózy. U pacientek s prokázanou TEN, pozitivní rodinnou anamnézou či dalšími riziky je vyšetření základních trombofilií plně indikováno. Důvodem, proč vyšetřovat trombofilní stavy, je stanovení rizika vzniku trombotické příhody a míra rizika rekurence. Z těchto vyšetření vycházíme jak při navrhování optimální strategie prevence trombotické příhody, tak při stanovení délky léčby. Dalším důvodem pro laboratorní vyšetření je možnost upozornění příbuzných pacienta na riziko vrozeného dědičného stavu a potřebu prevence v rizikových situacích (těhotenství, antikoncepce, operace, imobilizace). Trombofilní stavy je indikováno vyšetřovat bezpodmínečně vždy při prodělané žilní trombóze před 40. – 50. rokem věku, nebo při nevyprovokované trombóze v jakémkoli věku. Vyšetření je také plně indikováno při rekurentní trombóze či trombóze na neobvyklém místě (cerebrální, mezenterická, portální nebo hepatální), při pozitivní rodinné anamnéze výskytu trombózy, při trombóze v těhotenství, při užívání hormonálních kontraceptiv nebo hormonální substituční léčby (HRT) a v neposlední řadě při nepředpokládané patologii ve screeningových laboratorních testech (např. prodlouženém aPTT). Primární vyšetření trombofilního stavu se provádí u pacientů bez antikoagulační terapie dikumariny nebo hepariny nejméně 10 dnů před odběrem, stejně tak je podmínkou, aby pacient v průběhu této doby neprodělal žádnou trombotickou příhodu.
V této fázi vyšetřujeme zejména: APC rezistenci (funkční test na bázi aPTT je zlatým standardem, slouží jak pro diagnostiku vrozené, tak získané APC rezistence, novější metody jsou specifičtější pro geneticky podmíněnou APC rezistenci), antitrombin, protein C(chromogenní stanovení) a protein S(imunostanovení), faktor VIII (klasické jednofázové koagulační vyšetření nebo chromogenní stanovení, které se vyznačuje vyšší linearitou), plazminogen (chromogenně) a faktor II (jednofázové koagulační vyšetření). Dále provádíme genetická vyšetření na přítomnost jednotlivých mutací (multiplex PCR, real time PCR).
Akutní vyšetření trombofilního stavu se provádí u pacientů s antikoagulační terapií dikumariny či hepariny nebo krátce po prodělané trombotické příhodě. Zde provádíme zejména vyšetření APC rezistence a genetická vyšetření. Některá vyšetření mohou být výrazně zkreslena i probíhajícím infektem či přítomným nádorovým onemocněním (F VIII). Hodnocení výsledků vyšetření trombofilních stavů patří zejména v těchto specifických situacích do rukou zkušeného odborníka. Klinický význam jednotlivých trombofilních markerů je shrnut v tab. 1.
Tab. 1. Klinicky významné trombofilní stavy. 
Vyšetřování asymptomatických rodinných příslušníků
Mutaci FV Leiden a protrombinu G20210A vyšetřujeme u přímých i asymptomatických příbuzných při zjištění homozygotní formy a při zjištění heterozygotní formy u příbuzných s anamnézou trombózy. U heterozygotní formy vyšetřujeme asymptomatické příslušníky rodin pouze v případě očekávání zvýšeného rizika (hormonální antikoncepce, gravidita, plánovaná operace zatížená vysokým rizikem TEN). Rodinné příslušníky bychom také měli vyšetřit u jedinců s homozygotní formou PAI 1 s anamnézou TEN.
Z pohledu laboratorní diagnostiky je v současné době třeba zaměřit se na praktické problémy vyšetřování trombofilních stavů – kdy vyšetřit trombofilní stav a jak jej interpretovat. To znamená, že veškeré nové genetické rizikové faktory trombofilie je třeba podrobit přísnému hodnocení jejich rizikovosti. V případě nízkého relativního rizika trombofilie je patrné, že nadále nebudou předmětem laboratorního vyšetřování. Z hlediska budoucnosti se dá předpokládat nástup globálních testů nové generace, které nám pomohou komplexně stanovit relativní riziko – ať už přechodné, nebo genetické.
Venostáza
Žilní stáza se objevuje na konci 1. trimestru a maxima dosahuje okolo 36. týdne gestace. Poškození cévního endotelu se objevuje častěji v etiologii arteriální trombózy. V porodnictví se uplatňuje při traumatech cév spojených s operativními vaginálními či abdominálními porody. Dřívější představy o maximálním výskytu trombóz mezi 28. a 32. týdnem těhotenství byly v současnosti vyvráceny. Při vzniku trombózy hrají nespornou roli také chronické změny vyvolané poškozením endotelu a přítomností insuficience žilních chlopní.
Cévní změny v těhotenství zahrnují také vazomotorickou nestabilitu, kongesci a proliferaci buněk endotelu. Velmi častým nálezem je také nález žilních varixů v graviditě. Varikozity zejména v oblasti vulvy, hemoroidálních žil a vena saphena se objevují až u 40 % těhotných žen. Charakteristický je rodinný výskyt a tendence ke zlepšení po porodu.
Poškození endotelu
Cévní stěna je integrovaný orgán, složený z endotelových buněk, buněk hladkého svalstva a z fibroblastů, funkčně svázaných komplexem autokrinních a parakrinních interakcí. Endotel zasahuje do četných fyziologických pochodů zahrnujících tvorbu primární i sekundární hemostatické zátky, kontrolu buněčného metabolizmu, regulaci vazomotoriky cév a udržování reologických vlastností krve. Vnitřní vrstvou přivrácenou k luminu cévy je intima, jejíž povrch je kryt jednou vrstvou endotelií. Endoteliální buňky (EB) obsahují na povrchu celou řadu receptorů pro nejrůznější substance (např. trombin, faktory IX, IXa, X, Xa, destičky aktivující faktor, angiotenzin II), které ovlivňují vazomotoriku cévy přímo či nepřímo ve spolupráci s dalšími hemostatickými mechanizmy. Endotelové buňky reagují na celou řadu hemodynamických signálů (pulzace, roztažení, proudění) a na signální molekuly, jako jsou cytokiny, bakteriální lipopolysacharidy, růstové faktory a trombin. Na základě těchto podnětů endotelové buňky mění spektrum a intenzitu tvorby a uvolňování molekul, kterými řídí hemokoagulaci a vazomotoriku. Při aktivaci endotelu dojde na jeho povrchu k expresi celé řady intracelulárních adhezivních molekul (E-selektin, P selektin, von Willebrandův faktor – vWf) a v některých případech i k jejich uvolnění do plazmy. Tyto substance ovlivňují adhezi leukocytů, trombocytů, modifikují zánětlivou reakci, cévní permeabilitu a proces fagocytózy. Von Willebrandův faktor je také třeba k adhezi destiček na poškozenou cévní stěnu a je též stabilizujícím proteinem pro faktor VIII. Na abluminální straně EB uvolňují tkáňový faktor, který spolu s faktorem VII spouští zevní hemokoagulační systém. Jiné produkty endotelových buněk inhibují hemokoagulaci – např. trombomodulin, který inaktivuje trombin, a heparansulfát, který aktivuje antitrombin. Endotelové buňky syntetizují tkáňový aktivátor plazminogenu (t-PA), který stimuluje fibrinolýzu, a také prostaglandin I2 (PGI2 neboli prostacyklin) a oxid dusnatý (NO neboli endothelium derived relaxing factor – EDRF); poslední dva mají silnou vazodilatační aktivitu. Působí na buňky hladké svaloviny v cévní stěně, a ovlivňují tak krevní průtok (bazální sekrece), dále inhibují agregaci destiček a adhezi leukocytů (luminální sekrece) [15 – 18].
Klinické projevy a diagnostika hluboké žilní trombózy v graviditě
Diagnóza hluboké žilní trombózy se musí v těhotenství opírat především o klinickou symptomatologii a klinický nález na predilekčních místech. Hlavní příznaky tvoří zarudnutí, bolestivost a teplejší kůže v místě trombózy, dále edém a napětí. Diagnostika na základě klinického obrazu je však zatížena poměrně velkým procentem chyb (až 30 %). Diagnóza čistě na základě kliniky je v těhotenství obtížná, protože příznaky jsou ovlivněny těhotenskými změnami. Tak mohou být např. považovány otoky dolních končetin za ortostatické edémy provázející těhotenství, nebo jsou bolesti v lýtku přičítány deficitu magnézia. Nicméně i v graviditě mezi typické projevy patří jednostranná bolest dolní končetiny, zvláště při došlápnutí, dorzální flexi nohy nebo palpaci v místě trombózy, subfebrilie nebo febrilie a meteorizmus. V této souvislosti je nutno upozornit na velmi významný a častý klinický příznak, který se vyskytuje právě u těhotných, a to je bolestivost v třísle. Často bývá zaměňována za příznak pyelonefritidy, předčasného porodu či svalové únavy. Přitom je často jediným klinickým příznakem trombózy pánevních žil. Téměř 90 % žilních trombóz u těhotných se objevuje na levé dolní končetině (obr. 1). U netěhotných je tento poměr vyrovnán (levá strana 55 %). Rozdíl je způsoben anatomickými změnami v graviditě a přeneseným tlakem pravé a. iliaca communis na levou ilickou žílu. Většina hlubokých žilních trombóz v těhotenství se odehrává v ileofemorální oblasti – 72 %, zatímco lýtkové žíly jsou postiženy pouze u 9 % pacientek, a to zejména dlouhodobě ležících [14,19].
Obr. 1. MR zobrazení trombózy hlubokého žilního systému levé dolní končetiny. 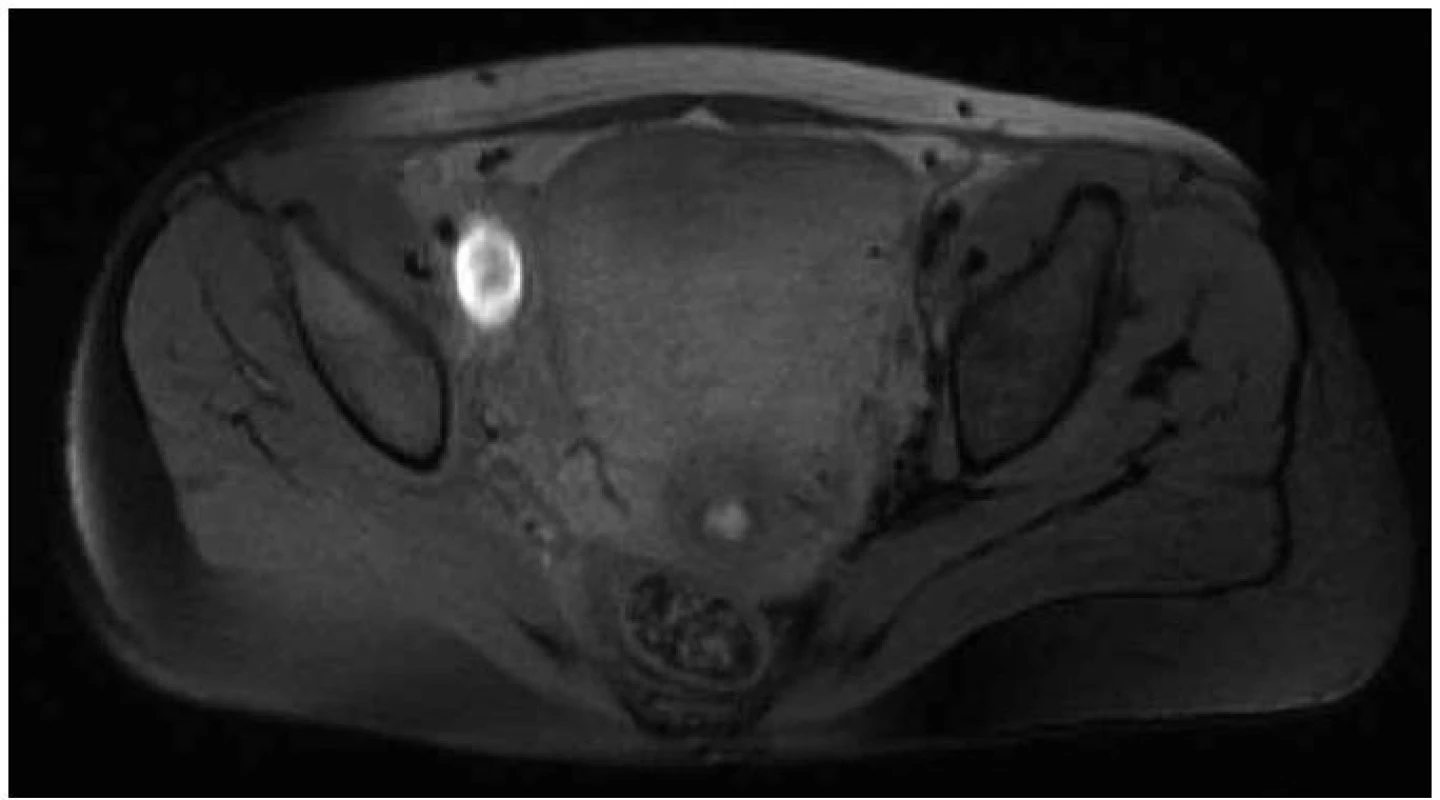
Laboratorní diagnostika hluboké žilní trombózy
Doposud neexistuje spolehlivý laboratorní test jednoznačně potvrzující diagnózu žilní trombózy. V těhotenství navíc dochází i při fyziologickém průběhu k vzestupu jak D-dimerů, tak fibrin degradačních produktů (FDP) v důsledku aktivace koagulace; pozitivita těchto markerů tedy ztrácí výpovědní hodnotu a pozitivní výsledek vždy vyžaduje pečlivou interpretaci. Přesto je možno konstatovat, že na základě novějších a přesnějších laboratorních metod (použití dvoumonoklonálních protilátek proti D-dimerům LIA metodou) v kombinaci s klinikou a zobrazovacími metodami představují zejména v iniciální fázi důležitý diagnostický test.
Zobrazovací vyšetřovací metody hluboké žilní trombózy
Hlavní pomocnou metodou v těhotenství je dopplerometrická sonografie sloužící k vyšetření průtoku cévami. Tato metoda umožňuje stanovit diagnózu trombózy s vysokou pravděpodobností, při použití kombinace B-obrazu a barevné duplexní sonografie se přesnost dále zvyšuje. Senzitivita a specificita ultrazvukového vyšetření je u případů proximálních trombóz dolních končetin téměř 100 %, o něco nižší záchyt je u případů izolované lýtkové trombózy (senzitivita 92,5 %, specificita 98,7 %). V B-obrazu potvrzuje trombózu snížená nebo chybějící stlačitelnost cévy a průkaz trombu.
Při diagnostických obtížích lze pro zhodnocení nálezu především na ilických žilách a dolní duté žíle využít magnetickou rezonanci (MRI), interpretace nálezů však vyžaduje značné zkušenosti. V rukou erudovaného rentgenologa však MRI představuje možnost trombózu nejen potvrdit či vyloučit, ale určit i její stáří. Velmi přínosná je MRI zejména v případech trombóz pánevních žil, kde je přesnější než ultrazvukové vyšetření [1,20].
Diagnostika plicní embolie
Podobně jako u HŽT jsou příznaky plicní embolie (PE) málo specifické. Hlavní symptomy – tachypnoe a tachykardie – jsou přítomné až u 90 % nemocných. Synkopa je vzácná, avšak její přítomnost upozorňuje na možnost masivní až potenciálně fatální embolie. Tradiční vyšetřovací postup u pacientů s PE zahrnuje EKG, Astrup, RTG hrudníku a echokardiografii. Abnormality EKG bývají přítomny u 70 – 90 % pacientek bez předchozího kardiopulmonálního onemocnění; tyto změny jsou však nespecifické a jejich absence nevylučuje PE. Podobně analýza krevních plynů má zvláště u těhotných omezenou výpovědní hodnotu. RTG obraz – pleurální efuze, infiltrát, atelektáza a elevovaná bránice – není specifický. Typický echokardiografický nález zahrnuje průkaz plicní hypertenze a dilatovanou a hypokinetickou pravou komoru s trikuspidální regurgitací nebo bez ní. Pro potvrzení plicní embolie je v ČR nejčastěji užíván ventilačně perfuzní sken nebo spirální angioCT plic.
Spirální CT představuje v současné době metodu volby v diagnostice PE v těhotenství. Senzitivita metody je velmi vysoká pro embolizaci větších cév, v případě drobnějších embolů v subsegmentálních či horizontálně uložených cévách (zejména v pravém středním plicním laloku) je však výpovědní hodnota omezená. Toto vyšetření je všaktaké velmi přínosné v diferenciální dia-gnostice jiných patologií, jako jsou pneumonie a plicní edém. Novější software a technické vybavení snižují riziko falešně negativního výsledku pod 5 %.
Velmi často diskutovanou otázkou je problematika radiační zátěže pro plod. Zejména v akutních případech může prodleva v provedení indikovaného vyšetření či zbytečné obavy o osud plodu způsobit nenapravitelnou škodu. Podle údajů ACOG není ionizační záření v dávce pod 5 radů spojeno s vyšším rizikem vzniku vývojových vad plodu či úmrtí plodu. Avšak expozice nad 1 rad mírně zvyšuje riziko vzniku leukemie v dětském věku (z 1 : 3 000 na 1 : 2 000). Radiační zátěž u RTG snímku plic je méně než 0,01 rad, plicní angiografie femorální žilou 0,22 – 0,37 rad, ventilační scan 0,019 rad, perfuzní scan 0,012 rad a spirální CT 0,013 rad. Tedy ani kombinace RTG, V/ P scanu a angiografie nepřesahuje hodnotu 0,5 rad. Vzhledem k extrémní citlivosti fetální tyreoideální tkáně je vhodná kontrola funkce štítné žlázy v neonatálním a kojeneckém období [21,22].
Léčba
V těhotenství je možno užít při prokázané hluboké flebotrombóze jak nefrakcionované hepariny, tak hepariny nízkomolekulární (LMWH). Účelem léčby je zabránit růstu trombu a prevence posttrombotického syndromu a plicní embolizace. Samotné rozpuštění trombu je zajištěno heparinem jen omezeně.
Z důvodu většího komfortu subkutánního podání pouze 2krát denně bez nutnosti každodenní monitorace účinnosti terapie jsou v našich podmínkách v současné době užívány především nízkomolekulární hepariny (LMWH). Dávkování se řídí váhou pacientky, výškou těhotenství, úprava je nutná při snížení renálních funkcí. Eventuální změnu dávky lze stanovit podle hladiny antiXa v krvi, terapeutické rozmezí se pohybuje podle různých autorů mezi 0,3 a 1,2 při měření za 4 hod po aplikaci. Při terapii heparinem, vzhledem k jeho farmakologickému účinku v organizmu, je nezbytné pravidelně kontrolovat a eventuálně substituovat antitrombin.
Dávkování nefrakcionovaného heparinu (UFH) jak v intravenózní, tak subkutánní formě se řídí podle aktivovaného parciálního tromboplastinového času (aPTT 2krát denně). Terapie by měla vést k prodloužení času 2 – 2,5násobně. V metaanalýze provedené na 355 těhotných neprokázal Ginsberg et al [21], až na jeden případ retroplacentárního hematomu, žádné závažné krvácení. V akutním stadiu je vhodná imobilizace pacientky, elevace a komprese postižené končetiny. Po ukončení podávání terapeutických dávek je nezbytná následná profylaxe nízkomolekulárním heparinem subkutánně až do porodu. V postpartální profylaxi je možno pokračovat LMWH, častěji pacientku převádíme na perorální antikoagulancia (warfarin). Při terapii warfarinem je možné kojení bez omezení, preparát přechází do mléka v minimálním množství. Délku antikoagulační terapie po porodu stanovujeme po vyhodnocení okolností vzniku trombózy, přítomnosti vrozených trombofilních stavů a dalších rizikových faktorů, minimálně však na dobu 2 – 3 měsíců.
Vedlejší a nežádoucí účinky terapie hepariny [21,22]: při použití obou typů heparinů můžeme pozorovat pálení v místě injekce (u UFH až v 80 %), někdy se vyskytují bolesti hlavy. Frekvence lokálních krvácivých projevů je u UFH i LMWH stejná. Při dlouhodobém používání zejména UFH se vyskytuje UFH heparinem indukovaná osteoporóza. Riziko vzniku této komplikace se popisuje při používání zhruba 15 000 IU/ den po dobu 6 měsíců, avšak i při kratším používání menších dávek může k lehčímu stupni osteopenie dojít. Udávaný výskyt této komplikace je u dlouhodobé medikace 2,2 %. Riziko vzniku je vyšší u kojících matek, kde byly popsány mnohočetné kompresivní zlomeniny obratlů. V případě těhotných a hlavně kojících matek se k efektu heparinu přidružuje deficit kalcia. U nízkomolekulárních heparinů je výskyt osteoporóz podstatně méně častý. Heparinem indukovaná trombocytopenie se při užití UFH vyskytuje u 1 – 2 % pacientů, při užití LMWH se vyskytuje velmi zřídka [23].
Filtry dolní duté žíly
Antikoagulační léčba může být u některých pacientek kontraindikovaná, neúčinná nebo může být doprovázena komplikacemi. Pro tyto pacientky je implantace filtru dolní duté žíly metodou volby. Závažnost HŽT a nebezpečí PE by měly být tak vysoké, aby prospěch z implantace kaválního filtru jednoznačně převážil nad možnými komplikacemi vyplývajícími z jeho zavedení. Zavedení filtru je v těhotenství indikováno především při krátkodobé kontraindikaci plné antikoagulační léčby, nejčastěji z důvodu porodu při čerstvé HŽT. Podmínkou je však i v tomto případě přetrvávající vysoké riziko PE závisející na závažnosti a rozsahu HŽT. Gravidita je jedna z mála indikací pro suprarenální uložení filtru vzhledem k tomu, že těhotná děloha komprimuje infrarenální porci dolní duté žíly a zde by umístění filtru mohlo indukovat její trombózu nebo poranění dělohy. Obvykle jsou však kavální filtry umísťovány infrarenálně pro teoretické riziko trombózy renálních žil a následné poruchy renálních funkcí v případě jejich suprarenálního umístění (obr. 2).
Obr. 2. Suprarenálně umístěný kavální filtr u pacientky těsně před porodem císařským řezem pro akutně vzniklou ileofemorální hlubokou žilní trombózu, kdy plná antikoagulační léčba byla kontraindikována. 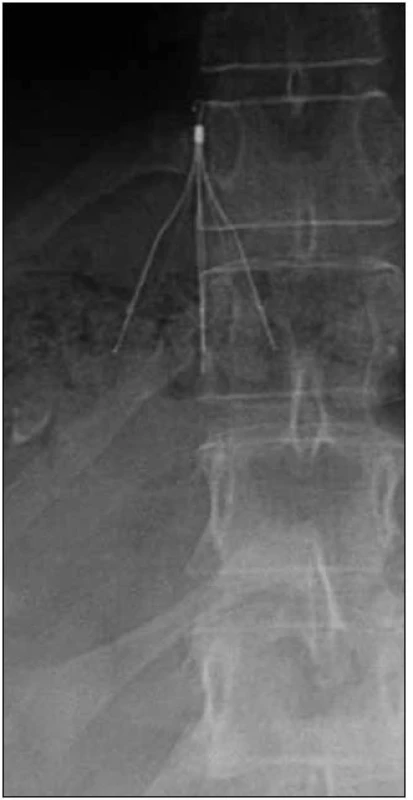
Odstranitelné filtry jsou takové, kterélze implantovat do dolní duté žíly jako potenciálně permanentní, ale po určitou dobu (obvykle 10 – 12 dnů) je lze perkutánní cestou speciálním instrumentáriem vyjmout [24].
Léčba a profylaxe v graviditě
Upraveno dle Antithrombotic and thrombolytic therapy – Executive Summary, American College of Chest Physicians Evidence-Based Clinical Practice Guideline (8th edition) a Doporučené postupy v perinatologii – Návrh antitrombotické profylaxe a péče o trombofilní stavy v gynekologii a porodnictví (M. Penka, T. Binder, V. Unzeitig, P. Dulíček)
Použití antagonistů vitaminu K v těhotenství
Ženy užívající dlouhodobě antagonisty vitaminu K (VKA) je nutno převést na nefrakcionovaný heparin (UFH) nebo nízkomolekulární heparin (LMWH – low molecular weight heparin). Jedná se zejména o ženy s mechanickou srdeční chlopenní náhradou. Podáváme adjustovanou dávku (úprava dávky se řídí podle hodnoty antiXA za 4 hod po vpichu, rozmezí 0,35 – 0,70 U/ ml) LMWH 2krát denně nebo UFH (aPTT 2krát vyšší než kontrolní) po celou dobu těhotenství. Alternativně lze pacientky po 13. týdnu převést zpět na VKA a po 36. týdnu převést opět na LMWH či UFH. Speciální pozornost zasluhují těhotné se starším typem chlopenní náhrady; zde je riziko trombotických komplikací velmi vysoké, doporučuje se spíše podání VKA. U těhotných s protetickou chlopní a vysokým rizikem tromboembolizmu se doporučují také nízké dávky ASA (75 – 100 mg/ den). Převod gravidních z VKA na LMWH by měl být uskutečněn ihned po stanovení gravidity. Kojící ženy na warfarinu nebo UFH mohou pokračovat v léčbě, podobně lze pokračovat v terapii i u žen s LMWH nebo r - hirudinem či danaparoidem.
V současné době je k prevenci a léčbě HŽT doporučeno používat spíše LMWH než UFH.
Problematika císařského řezu
Je nezbytné u každé rodičky podstupující císařský řez stanovit individuální riziko TEN a stanovit následnou strategii profylaxe. U žen bez dalších rizikových faktorů se nedoporučuje další tromboprofylaxe kromě časné mobilizace. U ženy se zvýšeným rizikem (tzn. minimálně jedním dalším rizikovým faktorem) se doporučuje podat profylaktické dávky LMWH nebo UFH nebo mechanická tromboprofylaxe (kompresivní punčochy nebo intermitentní pneumatická komprese) po porodu po dobu hospitalizace. U žen s vysokým rizikem TEN (2 a více rizikových faktorů) je doporučeno podání farmakologické profylaxe a mechanické prevence. U vybraných skupin s velmi vysokým rizikem se doporučuje prodloužená profylaxe (4 – 6 dnů i po propuštění do domácí péče).
Léčba hluboké žilní trombózy v těhotenství
Podáváme adjustovanou dávku LMWH 2krát denně s. c. nebo UFH (bolus i. v. a následně kontinuální infuze, kdy aPTT udržujeme v terapeutickém rozmezí, nebo s. c. terapie aPTT à 6 hod v terapeutickém rozmezí). Terapie těhotných s akutní HŽT by pak měla pokračovat po celou dobu gravidity a dále minimálně ještě 6 týdnů po porodu (celkem minimálně 6 měsíců). Před porodem (minimálně 24 hod) je nutná úprava – snížení – adjustované dávky.
Prevence recidivy hluboké žilní trombózy u těhotných
Situace u této skupiny je poměrně složitá a vyžaduje pečlivý odběr anamnézy, klinické i laboratorní vyšetření. Je nutno rozlišit skupinu s trombofilií a bez ní, klasifikovat těhotné podle vyvolávajících, resp. rizikových faktorů, které vedly k předchozí trombotické příhodě. Doporučení jednotlivých odborných skupin nejsou jednotná a připouští více postupů.
- Skupině těhotných, u kterých již rizikové faktory přítomné u předchozí trombózy pominuly (sádra, operace), je doporučováno antepartální sledování a postpartální antikoagulační profylaxe.
- Skupině, u které byla předchozí epizoda spojena s graviditou či hormonální (estrogenní) léčbou, je doporučeno sledování nebo antikoagulační proxylaxe během těhotenství (heparin v profylaktických nebo středních dávkách) a postpartální farmakologická profylaxe.
- Těhotným s idiopatickou příhodou TEN bez trombofilie a bez dlouhodobé antikoagulační léčby se doporučuje sledování nebo antikoagulační proxylaxe během těhotenství (heparin v profylaktických nebo středních dávkách) a postpartální farmakologická profylaxe.
- Těhotné s laboratorně potvrzenou méně významnou trombofilií a anamnézou jedné epizody HŽT, které nejsou na dlouhodobé antikoagulační léčbě, buď nastavujeme na střední či profylaktickou dávku LMWH či UFH, nebo klinicky sledujeme a antikoagulaci podáváme i postpartálně.
- Těhotné s vysoce rizikovou trombofilií (deficit antitrombinu, antifosfolipidový syndrom, Leidenská mutace v homozygotní formě, kombinovaná mutace – Leidenská + mutace protrombinu G20210A) s jednou epizodou HŽT bez trvalé antikoagulace nastavujeme na střední nebo profylaktickou dávku LMWH nebo UFH a postpartálně nasazujeme antikoagulaci.
- Těhotné po více epizodách HŽT by měly užívat profylaktické, střední nebo adjustované dávky LMWH nebo UFH a následně postpartální antikoagulaci.
- Těhotným na dlouhodobé antikoagulaci pro prodělanou HŽT podáváme adjustované dávky LMWH nebo UFH s následnou dlouhodobou postpartální antikoagulací.
- U všech těhotných po HŽT se doporučuje používat kompresivní punčochy ante - i postpartálně.
Riziko HŽT u žen s trombofilií bez předchozí trombotické příhody
Rutinní profylaxe se nedoporučuje, pouze klinické sledování a stanovení individuálního rizika. Výjimku tvoří ženy s potvrzeným deficitem antitrombinu, zde podáváme prevenci ante - i postpartálně. U ostatních typů trombofilie postupujeme individuálně, nezbytné je pečlivé klinické sledování, u kombinovaných typů a homozygotních forem lze volit profylaktické dávky LMWH či UFH.
Riziko těhotenských komplikací u žen s trombofilií, prevence a léčba
Celá řada studií je zaměřena na vztah mezi přítomností trombofilie a výskytem závažných komplikací těhotenství. Vzhledem k závažnosti těchto stavů probíhá rovněž intenzivní výzkum v oblasti trombotických komplikací fetoplacentárního řečiště. Příkladem postižení cév placentárního lůžka je akutní ateróza. Je charakterizována přítomností pěnových buněk, fibrinoidní nekrózy a perivaskulárního lymfocytárního infiltrátu. Léze bývá často nalézána u těhotných s preeklampsií, růstovou retardací plodu a také u předčasných porodů. Omezený průtok spirálními artériemi vede k infarzaci přilehlého okrsku placenty. Trombotické příhody jsou popisovány také ve fetální části oběhu. Histopatologicky zahrnují hemoragickou endovaskulitidu, obliterující endarteriitidu, fibromuskulární sklerotizaci a fibrinoidní vaskulopatii (obr. 3 a 4). Výsledkem je nález tzv. avaskulárních klků. Trombotizace intervilózního prostoru bývá při mikroskopickém vyšetření nalézána poměrně často a její výskyt stoupá směrem k termínu porodu. Současný stav našeho poznání vztahu trombofilních mutací k etiologii porodnických komplikací neumožňuje ve většině případů učinit jednoznačný závěr. Je však možno na základě dnešních poznatků vyvodit, že nejsilnější asociace je mezi přítomností trombofilií a pozdních potratů, dále rizikem vzniku preeklampsie a růstové retardace plodu.
Obr. 3. Fibrinoidní nekróza deciduy se subakutním infarktem v okolí – HE 40krát. 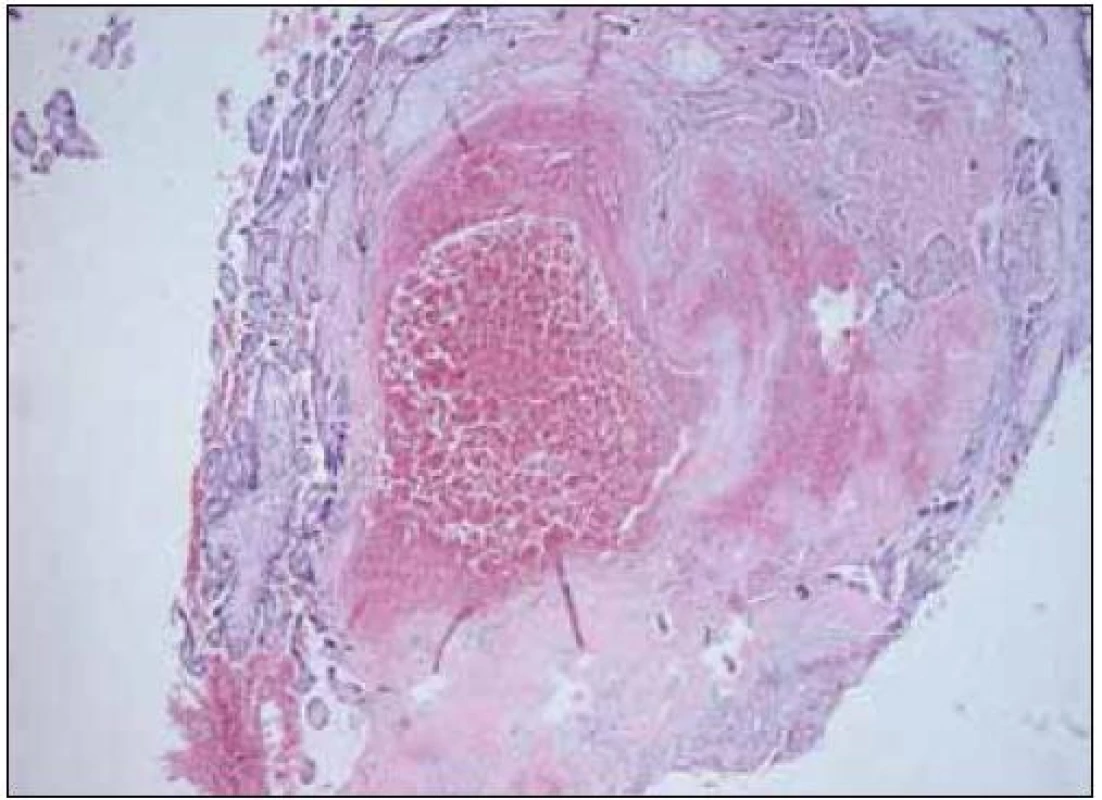
Obr. 4. Fibrinový trombus s akutní aterózou – HE 400krát. 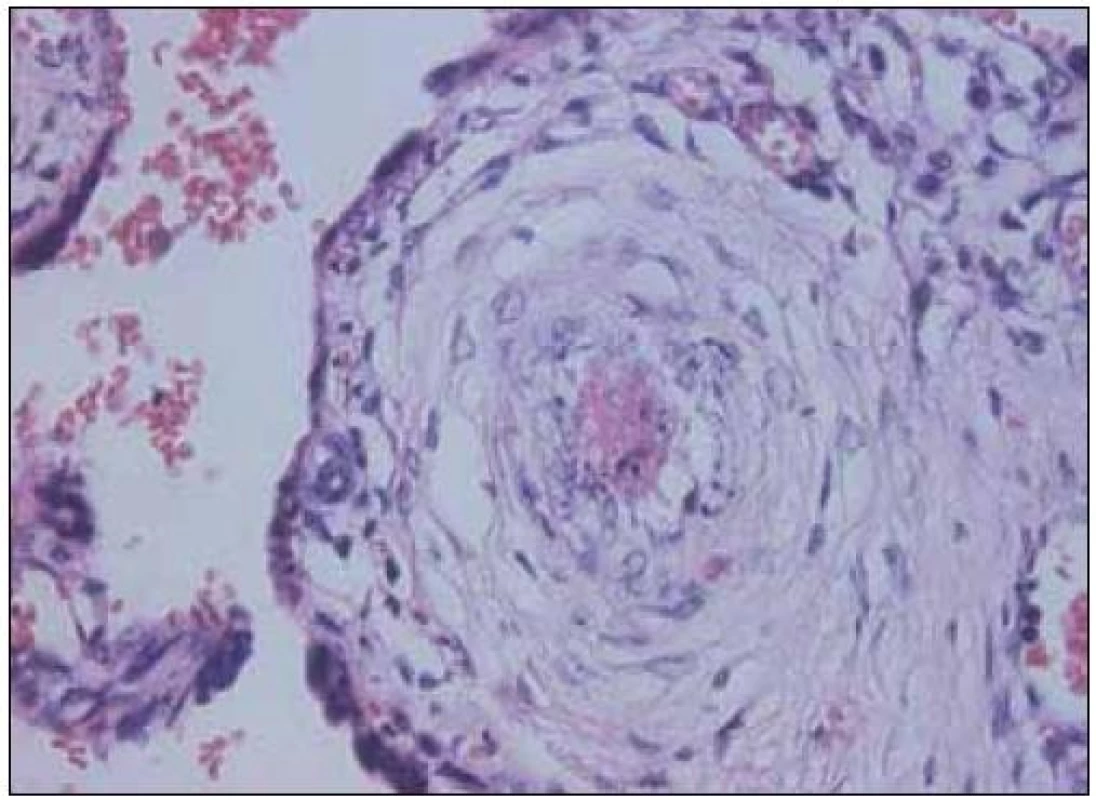
Ženám s opakovanými časnými potraty (3 nebo více) nebo nevysvětleným pozdním potratem, těžkou preeklampsií nebo růstovou retardací plodu se doporučuje screening antifosfolipidových protilátek. U žen, u kterých jsou antifosfolipidové protilátky potvrzeny a které prodělaly 3 časné konsekutivní potraty, se doporučuje podávat profylaktické nebo střední dávky LMWH nebo UFH. Alternativně lze také podat profylaktickou dávku LMWH a kyselinu acetylsalicylovou (ASA).
Ženy s předpokládaným vysokým rizikem rozvoje preeklampsie profitují z podávání nízkých dávek ASA (doporučení ACCP). Samotná anamnéza těžké preeklampsie v minulé graviditě však nepředstavuje indikaci k podávání profylaktických dávek LMWH.
Podpořeno grantem IGA NR 9282 - 3/ 2007 a NS10319 - 3/ 2009.
doc. MUDr. Martin Procházka, Ph.D.
www.fnol.cz
e-mail: martinprochazka@hotmail.comDoručeno do redakce: 9. 2. 2010
Otištěno s laskavým svolením šéfredaktorky časopisu Postgraduální medicína. Publikováno v Postgraduální medicína 2010; 121 : 201 – 207.
Zdroje
1. Pettker CM, Lockwood CJ. Pathophysiology and diagnosis of thromboembolic disorders in pregnancy. In: Queenan JT et al (eds). Management of High‑Risk Pregnancy, an evidence based approach. Oxford: Blackwell‑Publishing, 5th ed. 2007 : 133 – 141.
2. Dahlbäck B. Blood coagulation. Lancet 2000; 355 : 1627 – 1632.
3. Dahlbäck B. The protein C anticoagulant system: inherited defects as a basis for venous thrombosis. Thromb Res 1995; 77 : 1 – 43.
4. Dahlbäck B. Resistance to activate protein C, the Arg506 to Gln mutation in the factor V gene, and venous thrombosis. Functional tests and DNA – based assays, pros and cons (see comments). Thromb Haemost 1995; 73 : 739 – 742.
5. Dizzon - Townson DS, Nelson LM, Jang Het al. The incidence of the factor V Leiden mutation in an obstetric population and its relationship to deep venous thrombosis. Am J Obstet Gynecol 1997; 176 : 883 – 886.
6. Egeber O. Inherited antithrombin deficiency causing thrombophilia. Thromb Diath Haemorrh 1965; 13 : 516 – 530.
7. Lockwood CJ. Heritable coagulopathies in pregnancy. Obstet Gynecol Surv 1999; 54 : 754 – 765.
8. Gumulec J, Radina M, Kučerová M et al. Asociace hyperhocysteinemie, karence vitaminu B12, folátu a poruchy funkce ledvin: vlastní zkušenosti. Laboratorní hematologie, Hradec Králové: HK CREDIT 2000, 68 – 69.
9. Hyánek J, Hoffman R. Hyperhomocysteinémie a její diagnostický význam u cévních onemocnění. Praktická flebologie 1997; 2 : 61 – 71.
10. Penka M, Bulíková A, Žáčková D et al. Clinical Importance of Hyperfibrinogenemia in Hematologic Malignancies. Hematologica. J Hematol, Vol 84, EHA ‑ 4 Abstract Book, June 1999, 4th Congress of the EHA, Barcelona, Spain, 186 (PO ‑ 0788).
11. Poort SR, Rosendaal FR, Reitsma PH et al. A common genetic variation in the 3 - untranslated region of the prothrombin gene is associated with elevated plasma prothrombin levels and an increase in venous thrombosis. Blood 1996; 88 : 3698 – 3703.
12. Bulíková A, Penka M, Matýšková M et al. Antifosfolipidový syndrom v graviditě. 3. 3. 2000, VI. Pařízkův den, abstrakta, 18 – 20.
13. Andělová K, Šůla K, Velebil P. Význam screeningového vyšetření antikardiolipinových protilátek v těhotenství. Čes Gynek 1998; 63 : 446 – 449.
14. Kvasnička J. Patofyziologie žilní trombózy. Moderní gynekologie a porodnictví 2002; 11 : 323 – 329.
15. De Caterina R, Libby P. Endothelial Dysfunctions and Vascular Disease. Blackwell Publishing 2007, 3 – 25.
16. Hoffbrand AV, Catovsky D, Tuddenham EGD. Postgraduate Hematology. Blackwell Publishing 2005, 787 – 792.
17. Kvasnička J. Trombofilie a trombotické stavy v klinické praxi. Praha: Grada Publishing 2003, 40 – 65.
18. Assessment of Endothelial Dysfunction: Focus on Atherothrombotic Disease. Pathophysiol Haemost Thromb 2005; 34.
19. Fruhwirt J, Gutchi W, Amann G et al. Ergebnisse der chirurgischen Behandlung der schwangerschaftsassoziirten Beckenvenenthrombose. Z Geburtsh Neonat 1997; 201 : 91 – 94.
20. Rath W, Heilmann L. Gerinnungsstörungen in Gynäkologie und Geburtshilfe. Georg Thieme Verlag 1999 : 132 – 143.
21. Ginsberg JS, Hirsch J, Turner DC. Risk to the fetus of anticoagulation therapy during pregnancy. Thromb Haemost 1989; 61 : 197 – 203.
22. Greer IA. Thrombosis in pregnancy: maternal and fetal issues. Lancet 1999; 353 : 1258 – 1265.
23. Ludwig HH. Thrombolytic treatment during pregnancy. Thromb Haemost 1981; 46 : 438.
24. Procházková J. Diagnostika a léčba žilní trombózy v těhotenství. Medicína po promoci 2008; 9 : 35 – 37.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2010 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Nech brouka žít… Ať žije astma!
- Intermitentní hladovění v prevenci a léčbě chorob
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Výskyt reumatických manifestácií a orgánovo nešpecifickej autoimunity u chorých s autoimunitnou tyreopatiou
- Probiotika u akutní pankreatitidy – randomizovaná, placebem kontrolovaná, dvojitě slepá studie
- Rizika dlouhodobé antisekreční terapie
- Přímý inhibitor reninu aliskiren v léčbě kardiovaskulárních a renálních onemocnění
- Endokanabinoidní systém a ovlivnění trombogeneze
- Antitrombotická terapie v graviditě
- Centrální diabetes insipidus u dospělých osob – první příznak histiocytózy z Langerhansových buněk a Erdheimovy‑Chesterovy choroby. Popis tří případů a přehled literatury
- Kazuistika mladého pacienta s konstriktivní perikarditidou se subakutním průběhem
- Infikovaný myxom jako příčina akutní infekční endokarditidy
- Přehodnocení doporučení pro diagnostiku a léčbu hypertenze
- Jubileum Ing. Kataríny Derzsiovej
-
Riečanský I. Aterosklerotické choroby. Epidemiológia a prevencia z pohľadu klinickej praxe
Klener P., Klener jr. P. Nová protinádorová léčiva a léčebné strategie v onkologii - Výskyt revmatických manifestací a orgánově nespecifické autoimunity u nemocných s autoimunitní tyreopatií – editorial
- Několik poznámek k problematice infikovaného myxomu – editorial
- Analýza a srovnání souborů nositelů implantabilního kardioverteru- defibrilátoru v primární a sekundární prevenci
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Centrální diabetes insipidus u dospělých osob – první příznak histiocytózy z Langerhansových buněk a Erdheimovy‑Chesterovy choroby. Popis tří případů a přehled literatury
- Rizika dlouhodobé antisekreční terapie
- Kazuistika mladého pacienta s konstriktivní perikarditidou se subakutním průběhem
- Přímý inhibitor reninu aliskiren v léčbě kardiovaskulárních a renálních onemocnění
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



