-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Úspěšná léčba angiomatózy thalidomidem a interferonem α. Popis pěti případů a přehled léčby angiomatózy a proliferujících hemangiomů
Successful treatment of angiomatosis with thalidomide and interferon α. A description of five cases and overview of treatment of angiomatosis and proliferating hemangiomas
Our paper describes 5 patients with a vascular malformation – angiomatosis. In the first patient, a young man, angiomatosis affected the stomach, intestine, the area of mesenterium and retroperitoneum as well as mediastinum. Angiomatous mass had invaded pelvic bones and vertebrae. Treatment was initiated with interferon α in a maximum tolerated dose of 3 million units 3 times a week. Because of low efficacy of interferon α, thalidomide was added at a dose of 100 mg per day. Bone pain disappeared following a few applications of zoledronate administered in regular monthly intervals. After 3 years of concomitant administration of interferon α and thalidomide, we changed the regimen due to adverse effects and are administering thalidomide and interferon alternatively in 4-monthly intervals. Treatment has resulted in 50% reduction, according to imaging, of angiomatous mass, reduced intensity of disseminated intravascular coagulation and disappearance of clinical signs. The second was a case of multiple angiomatosis affecting the intestine only (multiple intestinal angiodysplasias) where we used thalidomide monotherapy. This treatment reduced blood losses and haemoglobin concentrations rose to normal levels. This male patient had consumed 120 transfusion units per year before the initiation of thalidomide. The third case was a slowly progressing vascular malformation of the face. This vascular malformation troubled its sufferer by spontaneous shortening that could not be resolved surgically because of its fragility. Two years of combined treatment with interferon α 6 million unites 3 times a week and thalidomide 100 mg daily led to a reduction and flattening of the malformation, paling of its colour and ceasing of spontaneous bleeding. This development enabled minor surgery – partial excision of this large vascular malformation. Histology examination confirmed that there was no evidence of new capillary formation. Histological examination thus confirmed efficacy of the treatment. The fourth case involved a patient with large vascular malformations affecting supraclavicular region of the neck and nape in whom radiotherapy was applied (54 Gy) leading to a reduction of the malformation mass by a at least 50%. The fifth is a case of an extensive periorbital lymphangioma that diminished following treatment with interferon α. These cases illustrate the benefits of combined treatment including thalidomide and interferon α in patients with multiple angiomatosis or large proliferating hemangioma (vascular malformation). If combined treatment with thalidomide and interferon α is not possible, it is beneficial to use thalidomide monotherapy. Radiotherapy is another alternative, although it is necessary to apply doses exceeding 50 Gy which may not be always possible.
Key words:
vascular malformation – angiomatosis – hemangiomatosis – hemangioma – angiodysplasia – lymphangioma – thalidomide – lenalidomide – interferon α – zoledronate – bevacizumab – antiangiogenic treatment – radiotherapy – monoclonal gammopathy
Autoři: Z. Adam 1; L. Pour 1; M. Krejčí 1; E. Pourová 2; O. Synek 2; L. Zahradová 1; M. Navrátil 1; M. Mechl 3; T. Nebeský 3; J. Neubauer 3; J. Feit 4; J. Vokurková 5; Z. Král 1; O. Bednařík 1; P. Šlampa 6
; H. Doležalová 6; R. Hájek 1; J. Mayer 1
Působiště autorů: Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Vorlíček, CSc. 1; Interní oddělení nemocnice Vyškov, přednosta prim. MUDr. Oldřich Synek 2; Radiologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Vlastimil A. Válek, CSc. 3; Ústav patologie Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta doc. MUDr. Josef Feit, CSc. 4; Klinika popálenin a rekonstrukční chirurgie Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Pavel Brychta, CSc. 5; Radioterapeutická klinika Lékařské fakulty MU a Masarykova onkologického ústavu Brno, přednosta prof. MUDr. Pavel Šlampa, CSc. 6
Vyšlo v časopise: Vnitř Lék 2010; 56(8): 810-823
Kategorie: Kazuistiky
Souhrn
V našem sdělení popisuje celkem 5 pacientů s cévními malformacemi – angiomatózou. V prvním případě mladého muže postihovala angiomatóza žaludek, střevo, oblast mezenteria i retroperitonea a také mediastinum. Angiomatózní masy invadovaly do kostí pánve a obratlů. Léčba byla zahájena interferonem α v maximální tolerovatelné dávce 3 miliony jednotek 3krát týdně. Pro malou účinnost interferonu α byl přidán thalidomid v dávce 100 mg denně. Bolesti v kostech při osteolýze způsobené angiomatózní infiltrací vymizely po několika aplikacích zoledronátu, který je aplikován v pravidelných měsíčních intervalech. Po 3 letech současného podávání interferonu αa thalidomidu jsme pro nežádoucí účinky přešli na střídání thalidomidu a interferonu α ve 4měsíčních intervalech. Výsledkem léčby je 50% zmenšení angiomatózních hmot dle zobrazovacích vyšetření, snížení intenzity diseminované intravaskulární koagulace a vymizení klinických příznaků. V druhém případě mnohočetné angiomatózy postihující pouze střevo (mnohočetných střevních angiodysplazií) jsme použili monoterapii thalidomidem. Tato léčba omezila krevní ztráty, takže koncentrace hemoglobinu vzestoupila na normální hodnoty. Před nasazením thalidomidu tento muž spotřeboval za rok 120 transfuzních jednotek. V třetím případě se jednalo o postupně progredující cévní malformaci obličeje. Tato cévní malformace svého nositele obtěžovala spontánním krácením, které pro fragilitu útvaru nebylo řešitelné operačně. Po dvou letech kombinované léčby interferon α 3krát 6 milionů jednotek týdně a thalidomid 100 mg denně došlo ke zmenšení, oploštění útvaru, vyblednutí jeho barvy a hlavně ustalo spontánní krvácení. Tato změna umožnila drobný chirurgický zákrok, excizi části této velké cévní malformace. Histologické vyšetření prokázalo absenci zřetelné novotvorby kapilár. Takže i histologické vyšetření potvrdilo účinnost léčby. Ve čtvrtém případě velké cévní malformace postihující nadklíčkovou oblast krku a šíje byla aplikována radioterapie (54 Gy), po které během jednoho roku po ozáření došlo ke zmenšení objemu ložiska minimálně o 50 %. V pátém případě se jednalo o rozsáhlý periorbitální lymfangiom, který se zmenšil při léčbě interferonem α. Uvedené případy dokumentují přínos kombinované léčby obsahující thalidomid a interferon α pro případy mnohočetné angiomatózy či velkého proliferujícího hemangiomu (cévní malformace). Pokud není možná kombinovaná léčba thalidomidem s interferonem α, je přínosné použít thalidomid v monoterapii. Radioterapie je další alternativa, je však zapotřebí použít dávky přesahující 50 Gy, což není ve všech lokalizacích možné.
Klíčová slova:
cévní malformace – angiomatóza – hemangiomatóza – hemangiom – angiodysplazie – lymfangiom – thalidomid – lenalidomid – interferon α – zoledronát – bevacizumab – antiangiogenní léčba – radioterapie – monoklonální gammapatieKlinické formy cévních neoplazií, hemangiomy a angiomatóza
Vaskulární neoplazie tvoří heterogenní skupinu cévních proliferací, skládajících se z endoteliálních buněk, hladké svaloviny a pericytů, které dohromady vytvářejí ložiska arteriálních, kapilárních, venózních nebo lymfatických cest. Jejich histologickou klasifikaci lze najít v učebnicích patologie [1].
Hemangiomy jsou časté v dětském věku, kdy mají tendenci ke spontánní regresi. V dospělosti nejsou výjimečným nálezem, jsou často diagnostikovány náhodně při vyšetřování orgánů či tkání metodou sonografie, CT či MR zobrazením. Většina hemangiomů diagnostikovaných v dospělosti je stabilní, dále se nezvětšuje a nezpůsobuje svému nositeli problémy.
Zcela výjimečně se však vyskytne hemangiom, který pomalu, ale jistě zvětšuje svůj objem a svým růstem činí svému nositeli potíže. Hemangiomy je možné dělit z více různých pohledů. Z pohledu vývoje lze rozlišovat:
- hemangiomy neprogredující (většina)
- hemangiomy progredující (výjimečné případy)
Pro hemangiomy, které se vyskytují v organizmu mnohočetně a obvykle mají tendenci k neustálému růstu, se používá termín angiomatóza (synonymem hemangiomatóza). Tyto vaskulární neoplazie jsou agresivnější než obvyklé solitární neproliferující hemangiomy. Angiomatóza je klinicko‑patologicko-anatomický termín pro velké, neohraničené a někdy i vícečetné hemangiomy, tvořící cévní tumory, které prorůstají orgány a tkáněmi a postupně progredují. V kapitole WHO klasifikace tumorů měkkých tkání nazvané „Hemangiomas and angiomatosis“ se uvádí, že dříve se pro tyto velké útvary používaly jako synonyma názvy vaskulární malformace (arteriovenózní či venózní malformace). Angiomatóza nesplňuje kritéria maligního tumoru, přesto může díky pomalé progresi, útlaku orgánů či krvácení způsobit smrt postiženého člověka.
Angiomatóza může postihovat celý organizmus, jak popisujeme v případě prvním, tak může postihovat třeba jen jeden systém, např. část trávicí trubice jak ve formě rozsáhlé angiomatózy, tak ve formě na střevní stěnu limitovaných angiodysplazií, jak popisujeme v případě třetím.
Cílem následujícího textu je:
- upozornit na možnost postižení skeletu angiomatózou, která může osteolytickými změnami připomínat mnohočetný myelom či jiné onemocnění vedoucí k osteolytické destrukci kostí
- upozornit na nejčastější formu angiomatózy – střevní angiodysplazie –, které se obvykle manifestují hyposideremickou anémií a krví ve stolici
- informovat o výsledcích naší léčby
- podat přehled publikovaných zkušeností s léčbou těchto vzácných chorob
Popisy případů
Popis případu mnohočetné angiomatózy postihující skelet, hrudní a břišní dutinu
S mnohočetnou angiomatózou jsme se poprvé setkali v roce 2005 u mladého muže, narozeného 1977. Podrobně jsme o příznacích a diagnostice referovali [2]. V tomto článku se soustředíme na hodnocení dlouhodobé léčby.
Potíže mladého muže se zintenzivňovaly v průběhu posledních 4 let před stanovením diagnózy. V době stanovení diagnózy (jaro roku 2005) měl silné bolesti v oblasti hrudní a bederní páteře a pánve, měl otoky nohou z hypoproteinemie, hypochromní hyposideremickou anémii (ztráty krve a plazmy angiomatózou zažívacího traktu).
Při CT zobrazení břišní dutiny a hrud-níku měl nejasnou měkkotkáňovou expanzi v oblasti retroperitonea a mezenteria a v oblasti mediastina (obr. 1–3). CT a MR vyšetření odhalilo vícečetná osteolytická projasnění v páteři a v pánvi (obr. 4, 5).
Obr. 1. CT vyšetření břicha po intravenózní aplikaci jodové kontrastní látky ze dne 9. 5. 2005 – před zahájením léčby. Šipka ukazuje na patologickou infiltraci v retroperitoneu, která je hypodenzní a postkontrastně se nesytí. 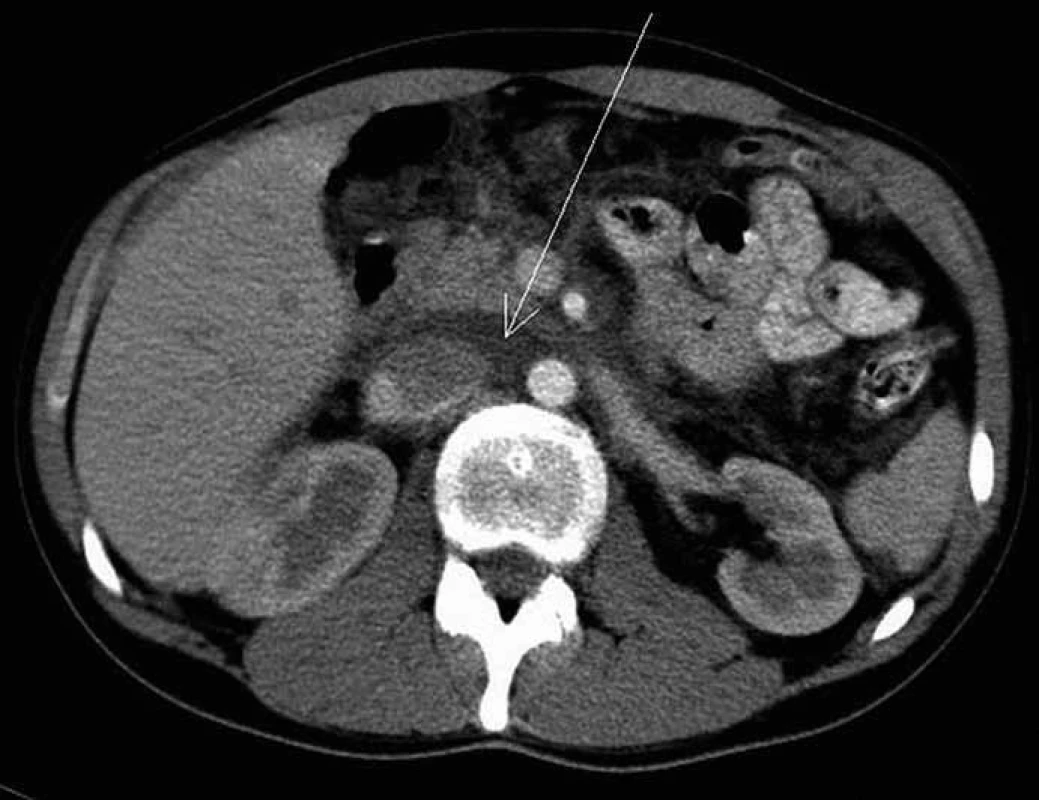
Obr. 2 a 3. CT vyšetření hrudníku po intravenózní aplikaci jodové kontrastní látky ze dne 6. 5. 2005 – před zahájením léčby – hypodenzní patologická infiltrace mediastina retrosternálně, paratracheálně a subkarinálně (šipky), která má stejné denzitní charakteristiky jako infiltrace v retroperitoneu. 
Obr. 4 a 5. MR vyšetření mediastina ze dne 26. 8. 2005, T1 vážený obraz v sagitální (obr. 4) a koronární (obr. 5) rovině – po zahájení léčby – patologická tkáň v předním mediastinu retrosternálně má v T1 smíšeně nízký signál a je jednoznačně ohraničena oproti okolnímu tuku (šipka). Oboustranná infiltrace paravertebrálně navazuje na obratlová těla, která mají abnormální strukturu (Th<sub>8</sub>, Th<sub>10</sub>, Th<sub>12</sub>), což je obraz hemangiomatózy postihující skelet i měkké tkáně. 
Diagnózu zcela objasnila probatorní laparotomie, která odhalila mnohočetné angiomatózní hmoty v celé dutiny břišní, v retroperitoneu, v oblasti střev i žaludku.
Histologické hodnocení drobného vzorku tkáně z žaludeční stěny prokázalo vaskulární proliferaci, postihující stěnu žaludku a přiléhající měkké tkáně. Ložisko bylo tvořeno spletí krevních cév různého charakteru a kalibru: cévy byly venózního nebo kapilárního typu, přítomny byly i kavernózní prostory, vše náhodně roztroušené. Ojediněle byly zřetelné také typické klastry malých cév, radiálně vycházejících z centrálně lokalizované větší žíly.
Stejná vaskulární proliferace byla zjištěna i v oblasti intertrabekulárních prostorů spongiózní kosti, získané biopsií lopaty levé kosti kyčelní. V této lokalizaci byla proliferace provázena sekundární myelofibrózou. V tříselné uzlině byla nalezena jako následek cirkulačních změn tzv. vaskulární transformace sinů, morfologicky neodlišitelná od angiomatózy.
Na základně zobrazovacích metod, operačního nálezu v dutině břišní a histologického hodnocení byla diagnóza uzavřena jako angiomatóza.
Léčba
Dne 23. června 2005 byla zahájena léčba interferonem a (Introna) a zoledronátem (Zometa). Interferon a byl zpočátku podáván v dávce 6 milionů jednotek 3krát týdně. Tato dávka však byla spojena s výraznými nežádoucími účinky, které nemocný nebyl schopen dlouhodobě tolerovat, a proto byly dávky interferonu α postupně sníženy na 3 miliony jednotek 3krát týdně. V této dávce toleroval interferon a dlouhodobě.
Zoledronát byl po celou dobu podáván ve standardní dávce 4 mg nitrožilní infuzí v intervalech 28 týdnů, bez jakýchkoliv průvodních nežádoucích projevů.
Ve 4. měsíci léčby (září roku 2005) se objevila život ohrožující hemateméza. Mladý muž byl přijat na jednotku intenzivní péče. Konzervativní léčba nevedla k zastavení krvácení, proto bylo přistoupeno k angiografii a embolizaci žaludeční tepny.
Vzhledem k malému účinku výše uvedené 4měsíční léčby interferonem α v dávce 3 miliony jednotek 3krát týdně jsme přidali do kombinace další antiangiogenní lék – thalidomid (Myrin) –v dávce 100 mg denně.
Výsledky léčby
Při opakovaném CT a MR vyšetření v letech 2005, 2006 a 2007 bylo konstatováno, že objem angiomatózní tkáně v oblasti mediastina a břišní dutiny po roční léčbě částečně regredoval, přibližně na 50 % původního rozsahu. V osovém skeletu došlo k částečné sklerotizaci osteolytických destrukcí. Při dalších zobrazovacích vyšetřeních v letech 2008 a 2009 již zůstávala ložiska angiomatózy bez dalších změn ve srovnání s jejich velikostí v roce 2006. Neboli po počáteční regresi velikosti angiomatózních útvarů po prvním roce léčby se při pokračování léčby ložiska již dále nezmenšovala, ale také nezvětšovala. Z hlediska rozsahu choroby lze stav hodnotit jako parciální remisi, zmenšení angiomatózních hmot o 50 % jejich původní velikosti spojené s úplným vymizením klinických příznaků angiomatózy.
Na velmi dobrý léčebný efekt bylo možné usuzovat také z vyšetření koagulace. Při zahájení léčby byly zřetelné známky diseminované intravaskulární koagulace (nízká koncentrace fibrinogenu, pohybující se v rozmezí 1,3–1,5 g/l, a vysoké hodnoty D‑dimerů, pohybující se mezi hodnotami 15–20 µg/l). Při úspěšné léčbě se intenzita diseminované intravaskulární koagulace zmenšila, takže došlo k vzestupu fibrinogenu na hodnotu nad 2,0 g/l a také poklesla hodnota D‑dimerů na hodnotu pod 10 µg/l, což je však stále ještě v pásmu zvýšených hodnot (tab. 1).
Nežádoucí účinky léčby
Dlouhodobá aplikace interferonu je však spojena s postupně narůstající únavou a nechutí k jídlu a s úbytkem hmotnosti. Léčba thalidomidem (Myrinem) je opět spojená s narůstající neuropatií. Takže po 3 letech téměř kontinuální léčby interferonem, zoledronátem a thalidomidem jsme ve 4. a 5. roce léčby museli přistoupit ke snížení intenzity léčby. Pacient střídá interferon α a thalidomid přibližně ve 4měsíčních intervalech. V této 4měsíční pauze poleví nežádoucí účinky předchozího léku, takže je možno se k němu opět navrátit.
Popis případu agresivně progredujícího hemangiomu v oblasti tváře
Muž, narozen roku 1970, se na naše pracoviště dostal v roce 2008, ve věku 38 let. Vyjma hemangiomu na tváři byl zcela zdráv. Pacient udává, že hemangiom na tváři se objevil mezi 5. a 8. rokem života a primární lokalizace byla omezená pouze na horní víčko vpravo a později se objevily první náznaky hemangiomu v oblasti horního rtu vpravo.
Hemangiom se však postupně zvětšoval směrem dolů na tvář a zaujal oba rty. Muž byl opakovaně ošetřován plastickými chirurgy a v předchozích letech podstoupil 2 parciální embolizace přívodných tepen.
V době návštěvy ambulance Interní hematoonkologické kliniky již postihovala malformace víčko, celou tvář a oba dolní rty, jak zobrazují obr. 6–9. Hemangiom byl červenofialové barvy. Někdy spontánně a často při slabém doteku krvácel, nejčastěji z oblasti horního rtu. Opakované krvácení z hemangiomu bylo důvodem, proč mladý muž často docházel na ambulanci plastické chirurgie, kde se chirurgové snažili zastavit krvácení opichy. Krvácení z nosu postiženého léčili ORL lékaři. Koagulační hodnoty byly však v normě.
Obr. 2. Angiomatóza obličeje, která postupně progredovala asi od 5 let. Tampon přichycený stehem řešil problém se spontánním krvácením. 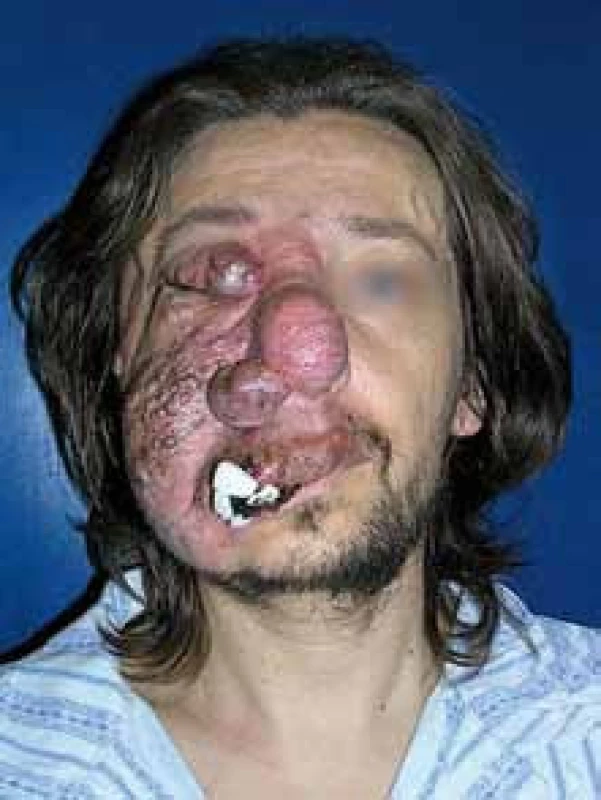
Obr. 3. Angiomatóza obličeje, pohled z boku, stav před léčbou. 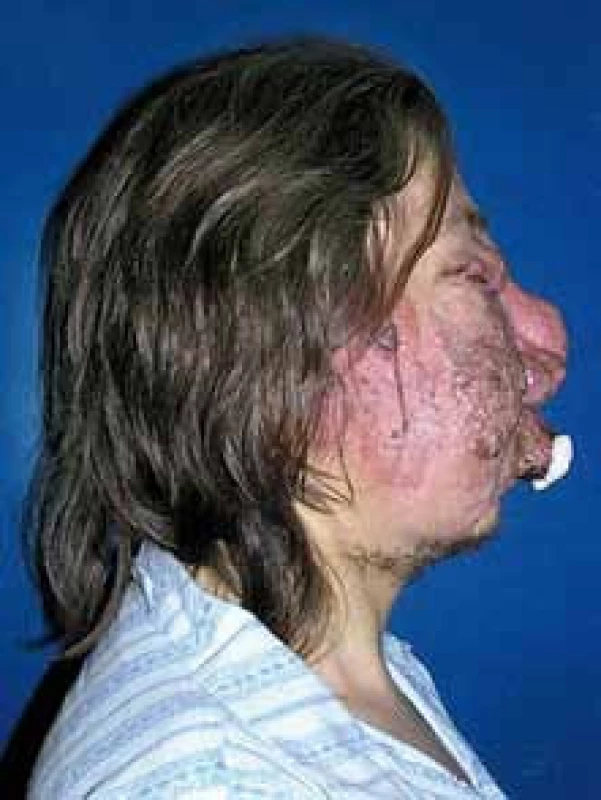
Obr. 8 a 9. MR zobrazení hlavy. T2 vážené obrazy, transverzální řezy. Vpravo rozsáhlá cévní malformace, která zasahuje od podkoží na hlavě přes oblast obličeje až pod dolní čelist. Patrný rozsáhlý artefakt z kovového materiálu za úhlem mandibuly vpravo. 
Operační léčba nebyla při křehkosti tohoto útvaru možná, a tak byl tento muž odeslán na naši ambulanci ke zvážení medikamentózní léčby.
Léčba
Od února roku 2008 byla zahájena léčba interferonem α (Introna) v počáteční dávce 3 miliony jednotek 3krát týdně. Tato dávka byla po 6 měsících při výjimečně dobré toleranci navýšena na 6 milionů jednotek 3krát týdně.
Asi měsíc po zahájení interferonové léčby byl přidán do kombinace thalidomid (Myrin) v celkové dávce 100 mg večer. Zoledronát jsme v tomto případě do kombinace nepoužili, protože při CT a MR zobrazení nebyla zřetelná osteolýza.
Výsledky léčby
Rozsah, plošná velikost hemangiomu se nezměnila. Změnila se však barva tohoto útvaru. Původní barva byla tmavě fialová. Při dlouhodobé léčbě se hemangiom stal světlejší a také celý útvar se stal plošším. Zásadním přínosem bylo, že přestalo spontánní krvácení a krvácení při minimálním traumatu tohoto útvaru (obr. 10).
Obr. 4. Angiomatóza obličeje – snímek v průběhu léčby po odstranění části hemangiomu u nosu. V důsledku léčby ustalo spontánní krvácení a krvácení při malém traumatu a to umožnilo první operační zákrok a histologické hodnocení. 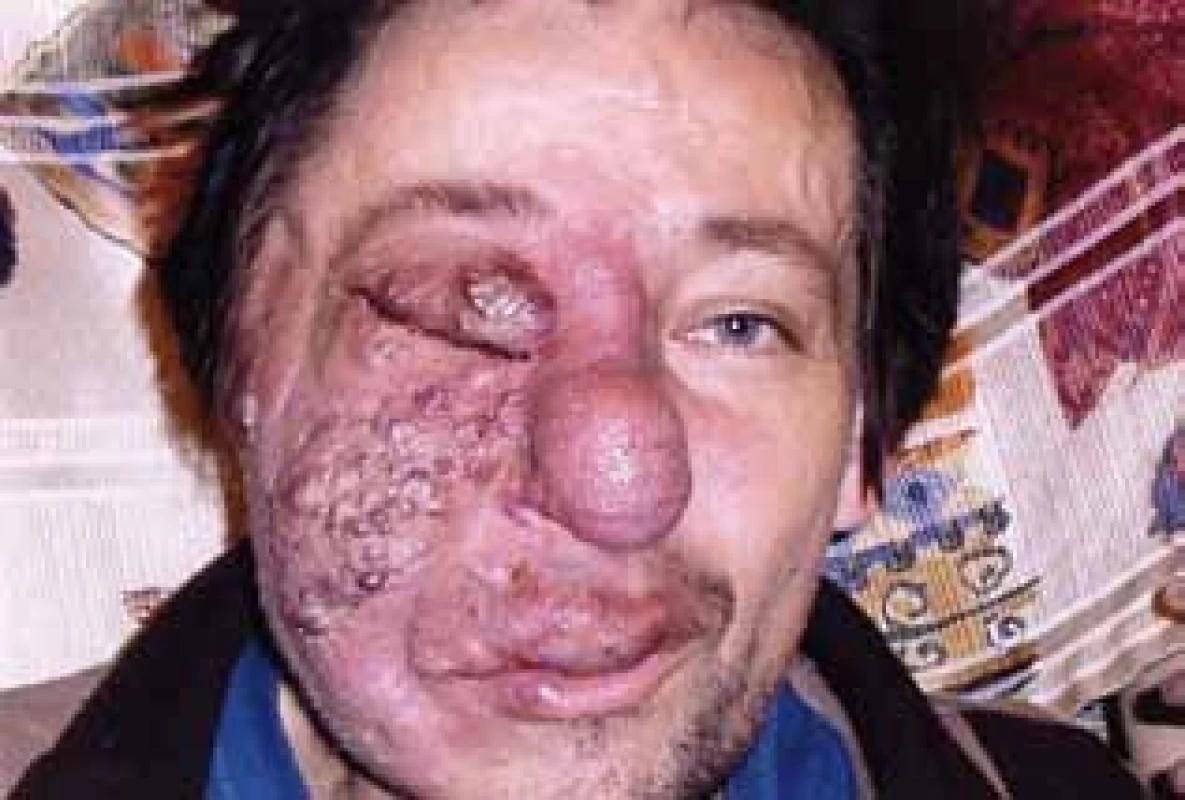
Vzhledem k těmto pozitivním změnám se operatérka rozhodla pro provedení drobného zákroku – úpravu malformace rtu a odeslání vzorku na histologii. Operace byla provedena v říjnu roku 2008, tedy 7 měsíců od zahájení léčby.
Patolog dodaný materiál hodnotí jako rozsáhlou cévní malformaci, skládající se z cév různých kalibrů, arteriálního i venózního typu. Proliferace kapilár byla ve vyšetřeném vzorku minimální. Absenci proliferace kapilár lze považovat také za průkaz pozitivního účinku léčby, zastavení další angiogeneze.
Nežádoucí účinky léčby
Subjektivní tolerance kombinované léčby interferonem α a thalidomidem (Myrinem) byla překvapivě excelentní. Fatigue, depresi či jiné subjektivní potíže a další nežádoucí účinky způsobované interferonem α tento muž neměl. Neměl ani potíže běžně způsobované thalidomidem – obstipaci, neuropatii, spavost, fatigue. Stejně tak laboratorní kontroly v průběhu této léčby neukázaly patologické změny. Krevní obraz po dobu léčby je stále ve fyziologických hodnotách a v biochemickém vyšetření nedošlo k žádným výchylkám v oblasti kyseliny močové, triglyceridů a hormonů štítné žlázy, jejichž hladinu může interferon a posouvat do patologických hodnot.
I v tomto případně byla kombinovaná léčba thalidomid a interferon úspěšná.
Popis případu mnohočetné angiomatózy (angiodysplazií) postihující trávicí trubici u muže s monoklonální gamapatií
U muže narozeného roku 1931 byla mírná anémie zjištěna již v roce 2002. Substituce však nebyla nutná.
V roce 2006 se však prohloubila anémie, proto se dostal na spádové interní oddělení. Při základním vyšetření byla zjištěna anémie, ale i monoklonální gamapatie. K upřesnění diagnózy monoklonální gamapatie byl v roce 2006 odeslán na myelomovou ambulanci našeho pracoviště. Při přešetření obvyklém při podezření na mnohočetný myelom jsme dospěli k závěru, že se jedná pouze o monoklonální gamapatii nejistého významu (Monoclonal Gammopathy of Unknown Significance – MGUS). Zobrazení PET‑CT bylo bez patologického nálezu, nebyla prokázána recidiva Grawitzova tumoru ani karcinomu prostaty. Oba tyto tumory byly léčeny v minulosti radikální operací.
Nicméně anémie byla v roce 2006 již klinicky závažná a vyžadovala substituci.
Vzhledem k tomu, že se jednalo o hypochromní anémii, provedli na Interním oddělení nemocnice Vyškov kompletní endoskopické vyšetření trávicího traktu. V žaludku byla nalezena antrální folikulární gastropatie, bez jednoznačného zdroje krvácení. Pro časté krvácení do stolice a nález černé stolice s průkazem natrávené krve (melény) byla opakovaně prováděna endoskopie trávicího traktu, včetně vyšetření enterální kapslí. Nález byl vždy podobný, bylo popsáno difuzní krvácení, na některých místech byly zřetelné angiektazie a angiodysplazie. Pokud to bylo možné, krvácivé angiektazie byly endoskopicky ošetřeny. Přes tyto opakované endoskopicky prováděné zákroky s cílem zastavit či omezit krevní ztráty zejména na horním úseku trávicího traktu krvácení neustále recidivovalo. Pro klinicky závažnou animizaci byly nutné četné transfuze. Od listopadu roku 2006 do listopadu roku 2008 bylo aplikováno celkem 120 jednotek erytrocytární masy. Intervaly mezi substitucí se postupně zkracovaly a v listopadu roku 2008 bylo nutné podávat průměrně 4 erytrocytární masy týdně.
Kontrolní vyšetření monoklonální gamapatie (MGUS) bylo na naši ambulanci provedeno v listopadu roku 2008. Při hodnocení kostní dřeně byla zřetelná těžká sideropenie bez zmnožení plazmocytů či jiné patologie. Stav byl i nadále hodnocen jako MGUS. Příčinou anémie bylo krvácení z angiodysplazií trávicího traktu. Uvedený endoskopický popis zcela koreloval s popisy mnohočetné angiomatózy trávicího traktu.
Léčba
Vzhledem k předchozím výborným zkušenostem s thalidomidem u prvního popisovaného pacienta a četným literárním údajům o přínosu thalidomidu v této indikaci jsme zahájili v listopadu roku 2008 léčbu thalidomidem v dávce 100 mg denně. Následný pokus o zvýšení dávky na 200 mg nebyl pacientem tolerován.
Výsledky léčby
Od listopadu roku 2008 do října roku 2009 pacient vyžadoval aplikaci pouze 4 erytrocytárních mas, 2krát v prosinci roku 2008, kdy zřejmě nebyl ještě efekt thalidomidu dostatečný, a 2krát v červnu roku 2009, kdy bylo též endoskopicky ošetřeno izolované ložisko krvácení v pyloru. Na kontrolním endoskopickém vyšetření nebyly krvácení ani angiodysplazie popsány: od prosince roku 2008 do června roku 2009 se hodnota hemoglobinu pohybovala mezi 90 a 108 g/l. Po krvácení z pyloru v červnu roku 2009 došlo k poklesu. Nicméně po ošetření a trvající léčbě thalidomidem hodnota hemoglobinu v červenci roku 2009 stoupla do normálního rozmezí a toto trvá. Pacient neguje melénu a pociťuje výrazné zvýšení duševní i fyzické výkonnosti.
Nežádoucí účinky léčby
Přechodné zvýšení thalidomidu na dávku 200 mg denně vedlo k výraznému zhoršení psoriázy, únavě a neutropenii II. stupně dle NCI (klasifikace nežádoucích účinků dle National Cancer Institute). Proto byla léčba redukována na 100 mg thalidomidu denně. Nyní trvá léčba rok, tolerance je uspokojivá, jediným nežádoucím účinkem je občasné zhoršení psoriázy, které je dermatologickou léčbou dobře ovlivnitelné. Subjektivně pacient hodnotí svůj stav výborně s ohromným zvýšením kvality života oproti stavu před léčbou.
Muž s monoklonální gamapatií a velkými lymfangiomy kolem očí
Muž s monoklonální gamapatií a nejasným nálezem kolem očí byl na naši ambulanci odeslán v roce 1998 ve věku 58 let (obr. 11). Bylo provedeno základní vyšetření a mnohočetný myelom nebyl potvrzen. Histologické vyšetření periokulárních změn potvrdilo lymfangiomatózu. U pacienta byla doporučena léčba interferonem α v místě bydliště. Při první kontrole bylo zřetelné mírné zmenšení. Dlouhodobou účinnost léčby u tohoto nemocného nemůžeme vyhodnotit, na další kontrolu k nám již nepřišel, chodil na kontroly jen v místě bydliště. Tímto případem a jeho zobrazením chceme jen obrazem ilustrovat, jak vypadá lymfangiomatóza.
Obr. 5. Lymfangiomatóza postihující obě oči. 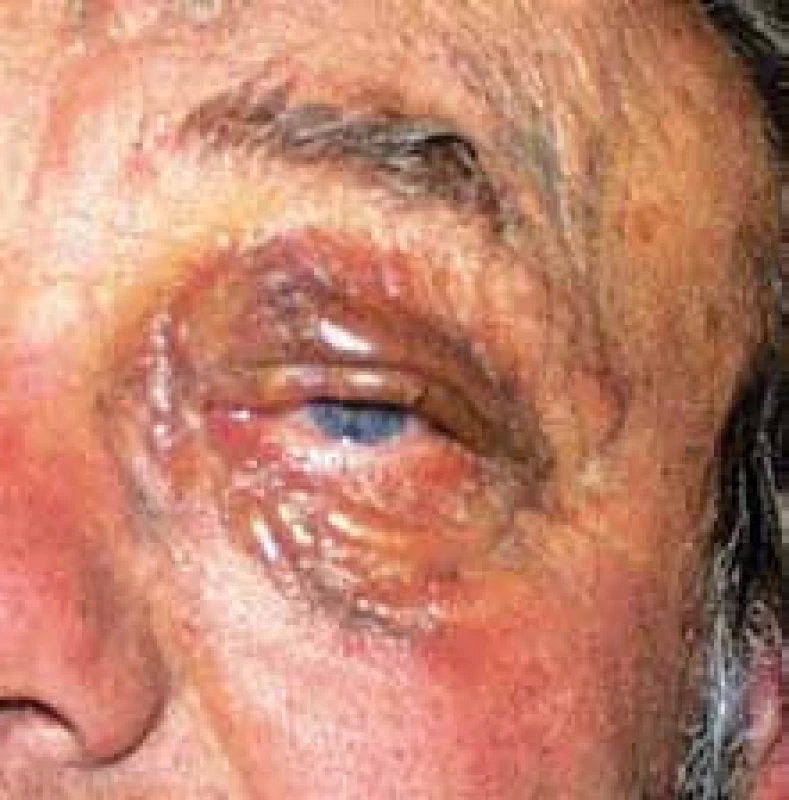
Muž s vaskulární malformací v oblasti klíční kosti
Muž narozen roku 1982 (26 let v době návštěvy naší ambulance) přišel s rezistencí v oblasti nadklíčku vpravo. Měl za sebou 5krát prováděnou embolizaci. Ale i přes tuto léčbu cévní malformace dle zobrazovacích vyšetření dále rostla. Angiograficky byla hodnocena jako objemná ateriovenózní malformace (synonymem angiomatóza) v oblasti šíje a krku; aspekcí a palpačně prominovala a vyplňovala oblast celého pravého nadklíčku a pravé strany krku (v nejdelším rozměru takřka 18–20 cm). Pro riziko krvácení nebyla provedena histologie. U tohoto pacienta byla malformace léčena konformní radioterapií brzdným svazkem lineárního urychlovače (6 MV) a za použití 3D plánování. Akcelerovanou frakcionací 5krát 3,0 Gy/týden byla celkově aplikována dávka 54 Gy. Při ukončení léčby zářením byl v místě vstupních polí sytý erytém a pigmentace (radiodermatitida 1. st. RTOG/EORTC klasifikace); průběh léčby byl bez komplikací. Po ukončení léčby došlo už v průběhu následujících 3–4 měsíců k výrazné regresi útvaru a po 6–9 měsících od ukončení léčby k zmenšení minimálně o 50–60 % (hodnoceno aspekcí a palpačně; výraznou regresi prokázalo i kontrolní MR vyšetření).
Diskuze
Hemangiomy a angiomatóza
Hemangiomy mohou v dospělosti být náhodně diagnostikovány v kterémkoliv orgánu. Obvykle jde o hemangiomy neprogredující, které nezpůsobují žádné klinické příznaky, a nevyžadují tedy žádnou léčbu. Výjimečný je však progredující hemangiom, který vyžaduje léčbu. Postihnout může kterýkoliv orgán a projevit se v kterémkoliv věku, obvykle však ve věku do 40 let.
Progredující a expandující hemangiomy mohou způsobit lokální destrukci tkáně a komprimovat okolní tkáně. Mohou být zjevné jako viditelný či hmatný patologický útvar, pokud jsou na povrchu těla či znázornitelné zobrazovacím vyšetřením (sonografickým, CT či MR zobrazením), pokud postihují vnitřní tkáně, orgány či kosti [1,3]. V našem popisu uvádíme případ progredujícího hemangiomu pravého víčka, kterého si maminka našeho pacienta všimla asi v 5 letech a který se postupně rozšířil na celou tvář a zaujal i nos a ret. To je tedy typický případ progredujícího hemangiomu (angiomatózy). V literatuře lze nalézt popisy dalších podobných případů [4,5].
Progredující hemangiom však nemusí být solitární, může mít podobnu mnohočetných vaskulárních neoplazií. Pro tyto případy, mnohočetné nemaligní vaskulární neoplazie postihující buď jen některé orgány, nebo současně více orgánů a tkání se používá termín angiomatóza či hemangiomatóza [1,6]. Angiomatóza je difuzní forma hemangiomu, postihuje velkou část těla, tvoří jednolitou masu nebo mnohočetná ložiska. Dříve se pro tyto velké útvary používaly jako synonyma názvy vaskulární malformace (arteriovenózní či venózní malformace). V současnosti platná klasifikace tumorů měkkých tkání řadí arteriovenózní či venózní malformace pod společný termín angiomatóza. Přibližně 2/3 těchto případů je diagnostikováno do 20 let a skoro všechny do věku 40 let [1]. Ale i lymfatické cévy mohou dát vznik lymfangiodysplaziím, jak znázorňujeme na obr. 11. V některých případech ohlašuje solitární kožní hemangiomy viscerální angiomatózu (synonymem hemangiomatózu) [7]. Velmi nebezpečnou situaci představují mozkové hemangiomy.
Projevy angiomatózy v oblasti hrudníku
V oblasti hrudníku postihuje angiomatóza nejčastěji plíce. Mnohočetné cévní malformace v plicích způsobují krvácení a hemoptýzu, případně i plicní hypertenzi [8–12].
Projevy angiomatózy v dutině břišní
V dutině břišní bývají v některých případech ložiska angiomatózy omezena na trávicí trubici bez postižení dalších struktur [13,14]. Tento typ angiomatózy (střevní angiodysplazie) se nejčastěji projevuje jako hypochromní anémie způsobená chronickými krevními ztrátami, a to jak v dětském, tak i v dospělém věku [15–25].
V dalších případech je popisováno postižení nejen trávicí trubice, ale i sousedních struktur, mezenteria a vůbec všech orgánů a tkání dutiny břišní [26–28]. Angiomatóza v dutině břišní může postihnout ale také např. jen játra a slezinu [29–34]. V ojedinělých případech bylo popsáno postižení jak měkkých částí dutiny břišní, tak i pánve [35,36].
Život ohrožující komplikací je krvácení, nejen do trávicí trubice, ale také spontánní ruptury a krvácení do dutiny břišní [37].
Hemangiomy a angiomatózy kostí
Ve skeletu jsou hemangiomy často jen vedlejšími nálezy, nicméně výjimečně jsou popsány případy, kdy nemocní měli kostní bolesti způsobené proliferujícími kostními hemangiomy a vyžadovali léčbu [36,38]. Ve výjimečných případech způsobily i spinální kompresi [24,39–41]. Popisovaný první pacient měl také projevy bolesti kostí a osteolýzu způsobenou angiomatózou.
Koagulační poruchy způsobené hemangiomy
Je‑li hemangiom dostatečně velký, můžebýt příčinou stabilní lokalizované intravaskulární koagulace s konzumpcí koagulačních faktorů, snížením fibrinogenu a trvalým zvýšením D‑dimerů. Někdy dochází i k sekvestraci destiček a ke trombocytopenii. Klasický Kasabachův-Merittové syndrom je popisován jako hypokoagulace s deficitem trombocytů [21,42].
Oběhové problémy způsobené hemangiomy
Pokud ve vaskulární neoplazii vzniknou významné arteriovenózní zkraty, způsobí to hyperkinetický oběh a výjimečně i srdeční selhání [43].
Základní poznámky k patofyziologii vzniku hemangiomů a angiodysplazií
Zásadní roli při rozvoji a progresi hemangiomů a angiodysplazií má vaskulární endoteliální růstový faktor (Vascular Endothelial Growth Factor – VEGF), který je hlavním mediátorem časné fáze angiogeneze. Jeho zásadní role byla prokázána právě při rozvoji Oslerovy nemoci a vzniku nehereditárních střevních angiodysplazií. Zvýšená lokální produkce VEGF (odpovídající proliferativní fázi angiogeneze) byla prokázána v resekovaných částech střeva, obsahujících krvácivé angiodysplazie [44,45]. Výše koncentrace VEGF zřejmě odpovídá za to, zda proces má charakter normální či abnormální angiogeneze [46].
Experimentálně bylo prokázáno, že v prostředí velmi vysoké koncentrace VEGF vzniká chaotická struktura novotvořených cév, podobná struktuře cév v hemangiomu či angiodysplazii. Novotvořené cévy v prostředí vysoké koncentrace VEGF mají tenké stěny, chybí jim hladká svalovina, jsou křehké, mají zvýšenou permeabilitu a snadno spontánně praskají. Díky těmto samovolným rupturám dochází ke krvácení. V případě, že nejsou přítomny další cytokiny, nutné k vývoji normální cévy, zůstávají cévy vytvořené pod vlivem vysoké koncentrace VEGF v tomto stadiu [46,47].
Přepokládá se tedy, že hemangiomy a angiodysplazie a angiomatóza vznikají v přítomnosti vysoké lokální koncentrace VEGF z masivně aktivované časné fáze angiogeneze. Tím vznikne primitivní endoteliální komplex cév. Vývoj těchto cév se však zastaví v tomto primitivním stadiu cévního labyrintu. Pokud je takto vytvořený hemangiom (angiodysplazie) obklopen parenchymem orgánu, nedochází v případě, že se zastaví proliferace útvaru, ke krvácení. Pokud je však hemangiom (angiodysplazie) lokalizován v oblasti mukózních stěn či kůže, dochází ke krvácení z fragilního útvaru. Proto také u našich pacientů docházelo ke krvácení v oblasti trávicího traktu a také z velkého hematomu na obličeji [47,48].
Léčba hemangiomů a angiomatózy
Léčba na těchto cévních malformacích by měla být multioborová. Dle lokalizace a možnosti lze použít operační léčbu, radioterapii, cévní embolizaci a medikamentózní léčbu. Proto je vhodné, aby tyto případy řešil po domluvě:
- cévní či plastický chirurg
- intervenční radiolog provádějící embolizace cév
- radioterapeut
- a lékař poskytující medikamentózní léčbu
V předchozích letech se pro případy angiodysplazií v oblasti střevní stěny testovaly estrogeny, ale nezdá se, že by přinesly zásadní prospěch [48–50].
Klasickými léky používanými již po mnoho let, dominantně pediatry, jsou cytostatika, vinkristin a cyklofosfamid a pak také glukokortikoidy, vše v opakovaných dlouhodobých dávkách (tab. 2). Sami s cytostatickou ani kortikoidní léčbou hemangiomů a angiomatózy vlastní zkušenosti nemáme.
Dalšími doporučovanými léky byly koxiby, jenže ty byly bohužel z trhu staženy, protože jejich dlouhodobé podávání zvyšovalo mortalitu, zřejmě díky inhibici kardiální neovaskularizace. Škoda, že tyto léky byly staženy z trhu globálně a že nebyly ponechány alespoň pro podávání v indikaci antiangiogenní léčby. A poslední koxiby, které jsou na trhu, mají omezenou preskripci na revmatology, takže je na naší ambulanci nemůžeme předepsat.
Z necytostatických preparátů je klasickým lékem pro hemangiomy, lymfangiomy, ale i mnohočetnou angiomatózu interferon α, a to již od 90. let minulého století.
V posledním desetiletí minulého stolení došlo ke znovuobjevení thalidomidu pro léčbu mnohočetného myelomu a některých dalších maligních chorob. Na jeho protinádorovém účinku má výrazný podíl antiangiogenní efekt tohoto léku.
Méně častou indikací thalidomidu jsou ale také progredující hemangiomy, angiomatóza a krvácející střevní angiodysplazie. Jsou popsány četné případy, kdy thalidomid pomohl právě pacientům s krvácivými střevními hemangiomy a angiodysplaziemi, ale také při krvácivých komplikacích Crohnovy choroby a rovněž u pacientů s heretidárními hemoragickými teleangiektaziemi [51,52]. Úspěchy thalidomidu vedly ke hledání podobného, ale méně toxického léku. První z této skupiny je lenalidomid, který je používán pro léčbu mnohočetného myelomu. Míra antiangiogenetického účinku je však nižší než u thalidomidu.
Interferon i thalidomid jsem zvyklí podávat pacientům s mnohočetným myelomem jako udržovací léčbu a na základně citovaných informací jsme se rozhodli pro použití uvedených léků i u našich nemocných.
V prvních dvou případech byla dlouhodobě podávána kombinace uvedených léků. V prvním případě angiomatózy je pacient již po 5 let v parciální remisi onemocnění a dobrém klinickém stavu, mladý muž je schopen práce i sportu. Rozsah a velikost angiomatózních útvarů po původním zmenšení se stabilizovala asi na 50 % původního rozsahu a vymizely klinické příznaky. Ve druhém případě progredujícího hemangiomu obličeje vedla tato kombinovaná léčba k oploštění útvaru, jeho zbělení a hlavně ustalo spontánní krvácení či krvácení z tváře po nepatrném traumatu. Tato změna umožnila první zákrok na dolním rtu, který byl dříve pro krvácení nemyslitelný s odběrem histologie. Při histologickém vyšetření byla potvrzena účinnost této léčby – ve vyšetřovaném preparátu chyběla proliferace kapilár. Histologické vyšetření tedy potvrdilo zastavení progrese této cévní neoplazie. Tč. je muž po rozsáhlém rekonstrukčním plastickém výkonu provedeném na Klinice plastické chirurgie a popálenin v Brně‑Bohunicích.
V třetím případě nebyla možná pro netoleranci interferonu kombinovaná léčba. Popisovaný muž toleruje naštěstí dobře monoterapii thalidomidem. Díky jeho podávání ustalo život ohrožující krvácení ze střeva.
V posledních letech se dostala do standardní léčby u metastatického karcinomu tlustého střeva, ledvin, prsu a nemalobuněčného plicního karcinomu protilátka proti vaskulárnímu endoteliálním růstovému faktoru (VEGF), s jehož pomocí si nádorové buňky zajišťují neovaskularizaci nádoru, potřebnou pro jeho růst. Tato monoklonální protilátka se jmenuje bevacizumab. Zastavením neovaskularizace se zastaví růst nádoru.
Prvními neonkologickými indikaci tohoto léku byly oční angiodysplazie. Dnes lze v literatuře najít kvanta publikací věnovaných aplikaci bevacizumabu v oftalmologii. Popisovány jsou jak lokální aplikace, tak nitrožilní aplikace. Z popisu účinku tohoto léku se jeví naděje, že by mohl být lékem volby pro mnohočetnou angiomatózu. Zatím však není mnoho literárních údajů o účinku a toleranci tohoto léku u pacientů s mnohočetnou angiomatózou.
Mezi nežádoucími účinky bevacizumabu se popisuje krvácení z nosu. Dále při kombinované chemoterapii obsahující bevacizumab bylo popsáno krvácení z plicních metastáz i krvácení ze střeva a vznik perforací a píštělí. Bevacizumab také komplikuje hojení ran. Krvácení se vysvětluje náhlým poklesem VEGF, který způsobí nestabilitu pod vlivem VEGF proliferujících endoteliálních cévních sítí, a to může způsobit krvácení. Dalšími nežádoucími účinky jsou hypertenze a proteinurie. Epistaxe je poměrně častá, ale nebývá závažného stupně. Frekvence epistaxe dle některých autorů koreluje s použitou dávkou. Proto není jasné, zda je tato monoklonální protilátka vhodná pro léčbu krvácejících hemangiomů a angiomatózy [53,54].
Krvácivé komplikace však nejsou popisovány pouze u bevacizumabu, ale také u dalších nových blokátorů angiogenezy – sorafenibu, sunitinibu, angiostatinu, endostatinu a látce s označením KRN951. Sice většina popisových krvácení je velmi lehkých, ale byly zaznamenány v 1–4 % i závažná krvácení, nesouvisející s tumorem.
Výjimkou jsou tyrozinkinázové inhibitory, inhibitor tyrozinové kinázy 2-VEGF vatalanib a semaxanib, které byly použity pro léčbu Hippelovy‑Lindauovy nemoci a hemagnioblastomu [55]. Vývoj semaxanibu však neopustil experimentální použití a byl zastaven, protože nepřinesl očekávaný antitumorózní efekt. Přehled existujících inhibitorů angiogeneze přináší tab. 3.
Jednou z prvních zpráv popisujících účinek bevacizumab na hemangiom je popis pacienta, kterému byl podán bevacizumab po operaci kolorektálního karcinomu pro velké ložisko v játrech, u něhož se předpokládal metastatický původ. V průběhu chemoterapie obsahující bevacizumab došlo k výraznému zmenšení ložiska na takové rozměry, že útvar bylo možné operačně odstranit. Překvapením však byla histologie tohoto ložiska – nejednalo se o metastázu, ale o velký hemangiom, který se v průběhu aplikace bevacizumabu výrazně zmenšil [56].
V současnosti zatím zůstává nezodpovězenou otázkou, proč některé antiangiogenní substance (jako je bevacizumab) mohou způsobovat krvácení ze sliznic, zatímco jiné (jako je thalidomid) je nezpůsobují. Tato fakta jsou důvodem, proč jsme u našich pacientů bevacizumab v této indikaci zatím nepodali.
Doufáme, že v následujících letech se objeví další léky pro tyto nemocné, anebo informace o možnosti použít bevacizumab i v této indikaci.
Další důležitou léčbou alternativou je radioterapie. Využívá se jejího fibrotizujícího účinku na cévy, který se v případě radioterapie maligních nádorů zařazuje do chronických a ireverzibilních nežádoucích účinků léčby zářením. Nelze však vyloučit i další, zatím neznámý mechanizmus účinku záření na angiomatózy. Základní radiobiologické znalosti popisují zvýšení rizika obliterace cév po ozáření akcelerovanou a hypofrakcionovanou radioterapií, tzn. jednotlivé dávky vyšší než 2 Gy/den (např. 4–5 Gy 2–3krát týdně). Maximálně účinné je pak ozáření vysokou dávkou jednorázově, které se provádí u arteriovenózních malformací mozku radiochirurgickou technikou (gamanůž, X‑nůž), např. 1krát 20–25 Gy. Obliterační efekt po ozáření se objevuje asi od 3. měsíce po ozáření, plně svého účinku dosahuje 12–24 měsíců po ukončení radioterapie. Výhodou radioterapie proti chirurgickým metodám a endovaskulárním embolizacím je protrahovaný nástup účinku a možnost vytvoření kolaterálního cévního řečiště [57].
Tato léčba byla použita pouze v jednom z našich případů. Jak vidět z uváděné dávky, je zřejmé, že v ozářené oblasti nemohou být radiosenzitivní orgány a uvedená dávka záření není vhodná pro velké objemy. Nicméně radioterapie je důležitou alternativou volby pro vhodné lokalizace solitárních hemangiomů.
Publikované zkušenosti s léčbou hemangiomů a angiomatózy shrnuje tab. 2.
Závěr pro praxi
- Thalidomid v kombinaci s interferonem α, ale i thalidomid v monoterapii jsou úspěšnými léky pro léčbu mnohočetné angiomatózy, angiodys-plazií či progredujícího hemangiomu.Thalidomid se používá v dávce, která je dlouhodobě tolerovatelná, obvykle100–200 mg, zcela výjimečně 300 mg denně.
- Uvedené léky zastaví neovaskularizaci, což způsobí částečnou regresi velikosti cévní malformace. Nevedou však k vymizení této malformace. Pokud tato malformace není odstraněna chirurgicky či zářením, je nutná trvalá medikace, která blokuje progresi angiogeneze v této cévní malformaci, jinak hrozí obnovení symptomů nemoci.
- V případě postižení kostí je vhodná pravidelná aplikace zoledronátu pro jeho antiangiogenní působení a inhibici osteoklastů.
- Nové antiangiogenní léky představují nové potenciální léky pro cévní dysplazie a angiomatózu, mnohé z těchto léků však způsobují krvácení ze sliznic, a proto je nutné být velmi pozorný při podávání těchto nových inhibitorů angiogeneze pacientům s velkými hemangiomy či angiomatózou. Zatím jsou klinické zkušenosti s těmito léky u hemangiomů a angiomatózy velmi, ale opravdu velmi omezené [143,144].
- Protože všechny antiangiogenní léky jsou potenciálně teratogenní, je nutná velká opatrnost při jejich podávání fertilním ženám.
- Léčba musí být multioborová, mimo medikamentózní léčbu je vždy nutno zvažovat možnosti operační, možnosti cévní embolizace a možnosti radioterapie.
Text byl připraven v rámci projektu MŠMT: LC 06027 a VZ 0021622434 VZ, MSMT 0021622434.
Doručeno do redakce: 20. 11. 2009
Přijato po recenzi: 4. 1. 2010
prof. MUDr. Zdeněk Adam, CSc.
www.fnbrno.cz
e‑mail: z.adam@fnbrno.cz
Zdroje
1. Weiss SW, Goldblum J, Enzinger FM et al. Hemangiomas and angiomatosis. In: Christopher DM, Krishnan UK, Fredrik M (eds). WHO classification of tumours: pathology and genetics of tumours of soft tissue and bone. Lyon: IARC Press 2002 : 161–168.
2. Adam Z, Křikavová L, Krejčí M et al. Léčba mnohočetné angiomatózy postihující skelet, břišní i hrudní dutinu interferonem alfa, thalidomidem a zoledronatem. Vnitř Lék 2008; 54 : 653–664.
3. Sundine MJ, Wirth GA. Hemangiomas: an overview. Clin Pediatr (Phila) 2007; 46 : 206–221.
4. Argenta LC, David LR, Sanger C et al. Advances in hemangioma evaluation and treatment. J Craniofac Surg 2006; 17 : 748–755.
5. Werner JA, Eivazi B, Folz BJ et al. State of art zur Klassifikation, diagnostik und therapie von zervikofazialen Hämangiomen und vaskulären Malformationen. Laryngo-Rhino-Otol 2006; 85 : 883–891.
6. Srbová J. Hemangiomatóza. Sestra 2005; 15 : 46.
7. Metry DW, Hawroth A, Altman C et al. Association of solitary, segmental hemangiomas of the skin with visceral hemangiomatosis. Arch Dermatol 2004; 140 : 591–596.
8. Vevaina JR, Mark EJ. Thoracic hemangiomatosis masquerading as interstitial lung disease. Chest 1988; 93 : 657–659.
9. Sullivan A, Chmura K, Cool CD et al. Pulmonary capillary hemangiomatosis: an immunohistochemical analysis of vascular remodeling. Eur J Med Res 2006; 11 : 187–193.
10. Cioffi U, De Simone M, Pavoni M et al. Pulmonary capillary hemangiomatosis in an asymptomatic elderly patient. Int Surg 1999; 84 : 168–170.
11. Fugo K, Matsuno Y, Okamoto K et al. Solitary capillary hemangioma of the lung: report of 2 resected cases detected by high‑resolution CT. Am J Surg Pathol 2006; 30 : 750–753.
12. Ito K, Ichiki T, Ohi K et al. Pulmonary capillary hemangiomatosis with severe pulmonary hypertension. Circ J 2003; 67 : 793–795.
13. Levy AD, Abbott RM, Rohrmann CA Jr et al. Gastrointestinal hemangiomas: imaging findings with pathologic correlation in pediatric and adult patients. AJR Am J Roentgenol 2001; 177 : 1073–1081.
14. Lyon DT, Mantia AG. Large-bowel hemangiomas. Dis Colon Rectum 1984; 27 : 404–414.
15. Park DD, Ricketts RR. Infantile gastrointestinal hemangioma as a cause of chronic anemia. South Med J 1992; 85 : 201–205.
16. Mills CS, Lloyd TV, van Aman ME et al. Diffuse hemangiomatosis of the colon. J Clin Gastroenterol 1985; 7 : 416–421.
17. Mottl H, Koutecký J, Buncová M et al. Sdružený výskyt preaurikulárního hemangiomu s hemangiomatózou tenkého střeva a mesenteria. Čes Slov Pediatr 1985; 40 : 523–526.
18. Lakhkar B, Abubacker S. Duodeno‑jejunal hemangiomatosis. Indian J Pediatr 2000; 67 : 931–933.
19. Djouhri H, Arrive L, Bouras T et al. Diffuse cavernous hemangiomatosis of the rectosigmoid colon: imaging findings. J Comput Assist Tomogr 1998; 22 : 851–855.
20. Dobozi BM, Rockey DC. Diffuse colonic hemangiomatosis. Gastrointest Endosc 2004; 60 : 799.
21. Elsayes KM, Menias CO, Dillman JR et al. Vascular malformation and hemangiomatosis syndromes: spectrum of imaging manifestations. AJR Am J Roentgenol 2008; 190 : 1291–1299.
22. Hsu RM, Horton KM, Fishman EK. Diffuse cavernous hemangiomatosis of the colon: findings on three-dimensional CT colonography. AJR Am J Roentgenol 2002; 179 : 1042–1044.
23. Scafidi DE, McLeary MS, Young LW. Diffuse neonatal gastrointestinal hemangiomatosis. CT finding. Pediatr Radiol 1998; 28 : 512–518.
24. Schulze PJ, Langendorff G. Extensive, diffuse haemangiomatosis of the skeleton. Rofo 1979; 131 : 67–71.
25. Seelhoff A, Schumacher B. 72‑year-old woman with anemia and suspected intestinal blood loss. Dtsch Med Wochenschr 2009; 134 : 1819–1820.
26. Parker WT, Harper JG, Rivera DE et al. Mesenteric cavernous hemangioma involving small bowel and appendix: a rare presentation of a vascular tumor. Am Surg 2009; 75 : 811–816.
27. Marinis A, Kairi E, Theodosopoulos T et al. Right colon and liver hemangiomatosis: a case report and a review of the literature. World J Gastroenterol 2006; 12 : 6405–6407.
28. Ibarguen E, Sharp HL, Snyder CL et al. Hemangiomatosis of the colon and peritoneum: case report and management discussion. Clin Pediatr (Phila) 1988; 27 : 425–430.
29. Bláhová K, Mottl M, Tůma S. Hemangiomatóza jater u tříměsíčního kojence. Čes Slov Pediatr 1991; 46 : 434–436.
30. Moon WS, Yuy HC, Lee JM et al. Diffuse hepatic hemangiomatosis in an adult. J Korean Med Sci 2000; 15 : 471–474.
31. Langer C, Thonhofer R, Hagenbarth K et al. Difuse Hämangiomatose von Leber und Milz bei Erwachsenen. Pathologie 2001; 22 : 424–428.
32. Kalousová J. Komplexní léčba hemangiomatózy jater. Čes Slov Pediatr 1994; 49 : 698–699.
33. Kim JD, Chang UI, Yang JM Clinical challenges and images in GI. Diffuse hepatic hemangiomatosis involving the entire liver. Gastroenterology 2008; 134 : 1830, 2197.
34. D’Antonio A, Boscaino A, de Dominicis G et al. Splenic hemangiomatosis. A report of two cases and review of literature. Adv Clin Path 2002; 6 : 119–124.
35. Kairi‑Vassilatou E, Grapsa D, Kontogianni‑Katsarou K et al. Clinicopathological features of unusual vascular lesions of the pelvis, retroperitoneum and colon in females: a report of five cases and review of the literature. Eur J Gynaecol Oncol 2006; 27 : 250–255.
36. Dixit VK, Sharma H, Ratnakar KS. Splenic hemangiomatosis with osseous involvement. Indian J Gastroenterol 1993; 12 : 105–106.
37. Lin CH, Hsieh HF, Yu JC et al. Spontaneous rupture of a large exogastric hemangioma. complicated by hemoperitoneum and sepsis. J Formos Med Assoc 2006; 105 : 1027–1030.
38. Valentini V, Nicolai G, Lorè B et al. Intraosseous hemangiomas. J Craniofac Surg 2008; 19 : 1459–1464.
39. Plowman PN. Skeletal haemangiomatosis presenting with spinal cord compression – postoperative management of pro-gressive disease. Br J Radiol 1997; 70 : 429–431.
40. Bandiera S, Gasbarrini A, De Iure F et al. Symptomatic vertebral hemangioma: the treatment of 23 cases and a review of the literature. Chir Organi Mov 2002; 87 : 1–15.
41. Janecek M, Dufek P. Generalized hemangiomatosis in relation to the synovial membrane. Acta Chir Orthop Traumatol Cech 1985; 52 : 155–160.
42. Dufau JP, le Tourneau A, Audouin J et al. Isolated diffuse hemangiomatosis of the spleen with Kasabach‑Merrit‑like syndrome. Histopathology 1999; 35 : 337–344.
43. Lantuéjoul S, Sheppard MN, Corrin B et al. Pulmonary veno‑occlusive disease and pulmonary capillary hemangiomatosis: a clinicopathologic study of 35 cases. Am J Surg Pathol 2006; 30 : 850–857.
44. Junquera F, Saperas E, de Torres I et al. Increased expression of angiogenic factors in human colonic dysplasia. Am J Gastroenterol 1999; 94 : 1070–1076.
45. Cirulli A, Liso A, D’Ovidio F et al. Vascular endothelial growth factor serum levels are elevated in patients with hereditary hemorrhagic telangiectasia. Acta Haematol 2003; 110 : 29–32.
46. Ozawa CR, Banfi A, Glazer NL et al. Microenvironmental VEGF concentration, not total dose, determines a threshold between normal and aberrant angiogenesis. J Clin Invest 2004; 113 : 516–527.
47. Lee RJ, Springer ML, Blanco-Bose WE et al. VEGF gene delivery do myocardium: deleterious effects of unregulated expression. Circulation 2000; 102 : 898–901.
48. Bauditz J, Lochs H, Voderholzer W. Macroscopic appearance of intestinal angiodysplasias under antiangiogenic treatment with thalidomide. Endoscopy 2006; 38 : 1036–1039.
49. Vase P. Estrogen treatment of hereditary hemorrhatic telangiectasia. A double blind controlled trial. Acta Med Scand 1981; 209 : 393–396.
50. Junquera F, Feu F, Papo M et al. A multicenter, randomized, clinical trial of hormonal therapy in the prevention of rebleeding from gastrointestinal angiodysplasia. Gastroenterology 2001; 121 : 1073–1079.
51. Wettstein AR, Meagher AP. Thalidomide in Crohn’s disease. Lancet 1997; 350 : 1445–1446.
52. Pérez-Encinas M, Rabuñal Martínez MJ, Bello López JL. Is thalidomide effective for the treatment of gastrointestinal bleeding in hereditary hemorhagic telangiectasia? Haematologica 2002; 87 : 34–35.
53. Bauditz J, Schachschal G, Wedel S et al. Thalidomie for treatment of severe intestinal bleeding. Gut 2004; 53 : 609–612.
54. Bauditz J. Angiogeneseinhibitoren zur Behandlung Angiodysplasie assoziirter gastrointestinaler Blutungen. Dtsch Med Wochenschr 2009; 134 : 1893–1896.
55. Madhusudan S, Deplanque G, Braybrooke JP et al. Antiangiogenic therapy for Hippel Lindau disease. JAMA 2004; 291 : 943–944.
56. Mahajan D, Miller C, Hirose K et al. Incidental reduction of the size of liver hemangioma following use of VEGF inhibitor bevacizumab. J Hepatol 2008; 49 : 867–870.
57. Šlampa P, Petera J et al. Radiační onkologie. Praha: Galén 2007, 30–32, 418–419.
58. Blei F, Orlow SJ, Geronemus R. Multimodal management of diffuse neonatal hemangiomatosis. J Am Acad Dermatol 1997; 37 : 1019–1021.
59. Gozal D, Saad N, Bader D et al. Diffuse neonatal haemangiomatosis: successful management with high dose corticosteroids. Eur J Pediatr 1990; 149 : 321–324.
60. Hasan Q, Tan ST, Gush J et al. Steroid therapy of a proliferating hemangioma: histochemical and molecular changes. Pediatrics 2000; 105 : 117–120.
61. Haxhija EQ, Lackner H, Höllwarth ME. Medical treatment of children with hemangiomas and its limitations. Handchir Mikrochir Plast Chir 2009; 41 : 78–82.
62. Mulliken JB, Boon LM, Takahashi K et al. Pharmacologic therapy for endangering hemangiomas. Curr Opin Dermatol 1995; 2 : 109–113.
63. Musumeci ML, Schlecht K, Perrotta R et al. Management of cutaneous hemangiomas in pediatric patients. Cutis 2008; 81 : 315–322.
64. Roganovic J. An update on the treatment of high‑risk hemangiomas in infants. Eur J Pediatr Surg 2007; 17 : 147.
65. Uysal KM, Olgun N, Erbay A et al. High dose oral methylprednisolone therapy in childhood hemangiomas. Pediatr Hematol Oncol 2001; 18 : 335–341.
66. Wilson MW, Hoehn ME, Haik BG et al. Low‑dose cyclophosphamide and interferon alfa 2a for the treatment of capillary hemangioma of the orbit. Ophthalmology 2007; 114 : 1007–1011.
67. Drucker AM, Pope E, Mahant S et al. Vincristine and corticosteroids as first‑line treatment of Kasabach‑Merritt syndrome in kaposiform hemangioendothelioma. J Cutan Med Surg 2009; 13 : 155–159.
68. Gottschling S, Schneider G, Meyer S et al. Two infants with life-threatening diffuse neonatal hemangiomatosis treated with cyclophosphamide. Pediatr Blood Cancer 2006; 46 : 239–242.
69. Hara K, Yoshida T, Kajiume T et al. Successful treatment of Kasabach-Merritt syndrome with vincristine and diagnosis of the hemangioma using three-dimensional imaging. Pediatr Hematol Oncol 2009; 26 : 375–380.
70. Hurvitz SA, Hurvitz CH, Sloninsky L et al. Successful treatment with cyclophosphamide of life-threatening diffuse hemangiomatosis involving the liver. J Pediatr Hematol Oncol 2000; 22 : 527–532.
71. Hauer J, Graubner U, Konstantopoulos Net al. Effective treatment of kaposiform hemangioendotheliomas associated with Kasabach-Merritt phenomenon using four-drug regimen. Pediatr Blood Cancer 2007; 49 : 852–854.
72. Harper L, Michel JL, Enjolras O et al. Successful management of a retroperitoneal kaposiform hemangioendothelioma with Kasabach-Merritt phenomenon using alpha-interferon. Eur J Pediatr Surg 2006; 16 : 369–372.
73. Hartman KR, Moncur JT, Minniti CP et al Mediastinal Kaposiform hemangioendothelioma and Kasabach-Merritt phenomenon in an infant: treatment with interferon. J Pediatr Hematol Oncol 2009; 31 : 690–692.
74. Chao YH, Liang DC, Chen SH et al. Interferon‑alpha for alarming hemangiomas in infants: experience of a single institution. Pediatr Int 2009; 51 : 469–473.
75. Jiménez-Hernández E, Dueñas-González MT, Quintero‑Curiel JL et al. Treatment with interferon‑alpha-2b in children with life-threatening hemangiomas. Dermatol Surg 2008; 34 : 640–647.
76. Lindner DJ. Interferons as antiangiogenic agents. Curr Oncol Rep 2002; 4 : 510–514.
77. Nevolová P, Bláhová K, Kabelka Z. Úspěchy léčby rozsáhlé hemangiomatózy u 17měsíčního dítěte po podání interferonu alfa. Ref výběr Dermatovenereol 1996; 2 : 83.
78. Radzikowska E, Szczepulska-Wójcik E, Roszkowski K. Pulmonary epithelioid haemangioendothelioma – interferon 2‑alpha treatment – case report. Pneumonol Alergol Pol 2008; 76 : 281–285.
79. Schiavetti A, De Pasquale MD, Di Salvo S et al. Recombinant interferon alfa 2a in hepatic hemangiomatosis with congestive heart failure: a case report. Pediatr Hematol Oncol 2003; 20 : 161–165.
80. Stratte EG, Tope WD, Johnson CL et al. Multimodal management of diffuse neonatal hemangiomatosis. J Am Acad Dermatol 1996; 34 : 337–342.
81. Suskan E, Tekin D, Atay G et al. Airway haemangioma treated with interferon‑alpha 2a. Acta Paediatr 2008; 97 : 393–394.
82. Szymik-Kantorowicz S, Kobylarz K, Krysta M et al. Interferon‑alpha in the treatment of high‑risk haemangiomas in infants. Eur J Pediatr Surg 2005; 15 : 11–16.
83. White CW. Treatment of hemangiomatosis with recombinant interferon alfa. Semin Hematol 1990; 27 (3 Suppl 4): 15–22.
84. Wu JM, Lin CS, Wang JN et al. Pulmonary cavernous hemangiomatosis treated with interferon alfa‑2a. Pediatr Cardiol 1996; 17 : 332–334.
85. Kaselas C, Tsikopoulos G, Papouis G et al. Intralesional administration of interferon A for the management of severe haemangiomas. Pediatr Surg Int 2007; 23 : 215–218.
86. Eichler A, Ukena D, Wilkens H et al. Interferon alfa‑2a in the treatment of diffuse thoracic angiomatosis in adulthood. Pneumologie 2000; 54 : 243–248.
87. Sardi I, Sanzo M, Giordano F et al. Monotherapy with thalidomide for treatment of spinal cord hemangioblastomas in a patient with von Hippel-Lindau disease. Pediatr Blood Cancer 2009; 53 : 464–467.
88. Takahashi A, Ogawa C, Kanazawa T et al. Remission induced by interferon alfa in a patient with massive osteolysis and extension of lymph-hemangiomatosis: a severe case of Gorham‑Stout syndrome. J Pediatr Surg 2005; 40: E47–E50.
89. Or R, Feferman R, Shoshan S. Thalidomide reduces vascular density in granulomatous tissue of subcutaneously implanted polyvinyl alcohol sponges in guinea pigs. Exp Hematol 1998; 26 : 217–221.
90. Vacca A, Scavelli C, Montefusco V et al. Thalidomide down regulates angiogenic genes in bone marrow endothelial cells of patients with multiple myeloma. J Clin Oncol 2005; 23 : 5334–5346.
91. Rajkumar SV, Witzig TE. A review of angiogenesis and antiangiogenic therapy with thalidomide in multiple myeloma. Cancer Treat Rev 2000; 26 : 351–362.
92. Bauer KS, Dixon SC, Figg WD. Inhibition of angiogenesis by thalidomide requires metabolic activation, which is species dependent. Biochem Pharmacol 1998; 55 : 1827–1834.
93. D’Amato RJ, Loughnan MS, Flynn E et al. Thalidomide is an inhibitor of angiogenesis. Proc Natl Acad Sci USA 1994; 91 : 4082–4085.
94. Kenyon BM, Browne F, D’Amato RJ. Effects of thalidomide and related metabolites in a mouse corneal model of neovascularization. Exp Eye Res 1997; 64 : 971–978.
95. Piribauer M, Czech T, Dieckmann K et al. Stabilization of a progressive hemangioblastoma under treatment with thalidomide. J Neurooncol 2004; 66 : 295–299.
96. Mascarenhas RC, Sanghvi AN, Friedlander L et al. Thalidomide inhibits the growth and progression of hepatic epithelioid hemangioendothelioma. Oncology 2004; 67 : 471–475.
97. Frei-Jones M, McKinstry RC, Perry A et al. Use of thalidomide to diminish growth velocity in a life-threatening congenital intracranial hemangioma. J Neurosurg Pediatr 2008; 2 : 125–129.
98. Jarvi K, Roebuck DJ, Sebire NJ et al. Successful treatment of extensive infantile hemangiomatosis of the small bowel in a 3-month-old with thalidomide and somatostatin analog. J Pediatr Gastroenterol Nutr 2008; 46 : 593–597.
99. Almadi M, Ghali PM, Constantin A et al. A. Recurrent obscure gastrointestinal bleeding: dilemmas and success with pharmacological therapies. Case series and review. Can J Gastroenterol 2009; 23 : 625–631.
100. Bauditz J, Lochs H. Angiogenesis and vascular malformations: antiangiogenic drugs for treatment of gastrointestinal bleeding. World J Gastroenterol 2007; 13 : 5979–5984.
101. Kirkham SE, Lindley KJ, Elawad MA et al. Treatment of multiple small bowel angiodysplasias causing severe life-threatening bleeding with thalidomide. J Pediatr Gastroenterol Nutr 2006; 42 : 585–587.
102. Mimidis K, Kaliontzidou M, Tzimas T at al. Thalidomide for treatment of bleeding angiodysplasias during hemodialysis. Ren Fail 2008; 30 : 1040–1041.
103. Alberto SF, Felix J, de Deus J. Thalidomide for the treatment of severe intestinal bleeding. Endoscopy 2008; 40 : 788.
104. Selinger CP, Ang YS. Gastric antral vascular ectasia (GAVE): an update on clinical presentation, pathophysiology and treatment. Digestion 2008; 77 : 131–137.
105. Dunne KA, Hill J, Dillon JF. Treatment of chronic transfusion‑dependent gastric antral vascular ectasia (watermelon stomach) with thalidomide. Eur J Gastroenterol Hepatol 2006; 18 : 455–456.
106. Hirri HM, Green PJ, Lindsay J. Von Willebrand’s disease and angiodysplasia treated with thalidomide. Haemophilia 2006; 12 : 285–286.
107. Fraiman G, Ganti AK, Potti A et al. Angiosarcoma of the small intestine: a possible role for thalidomide? Med Oncol 2003; 20 : 397–402.
108. Shurafa M, Kamboj G. Thalidomide for the treatment of bleeding angiodysplasias. Am J Gastroenterol 2003; 98 : 221–222.
109. Dabak V, Kuriakose P, Kamboj G et al. A pilot study of thalidomide in recurrent GI bleeding due to angiodysplasias. Dig Dis Sci 2008; 53 : 1632–1635.
110. Heidt J, Langers AM, van der Meer FJ et al. Thalidomide as treatment for digestive tract angiodysplasias. Neth J Med 2006; 64 : 425–428.
111. Ma L, del Soldato P, Wallace JL. Divergent effects of new cyclooxygenase inhibitors on gastric ulcer healing. Shifting the antiogenic balance. Proc Natl Acad Sci USA 2002; 99 : 13243–13247.
112. Masferrer JL, Leahy KM, Koki AT et al. Antiangiogenic and antitumor activities of cyclooxygenase‑2 inhibitors. Cancer Res 2000; 60 : 1306–1311.
113. Meyerle CB, Freund KB, Iturralde D et al. Intravitreal bevacizumab (Avastin) for retinal angiomatous proliferation. Retina 2007; 27 : 451–457.
114. Ziemssen F, Voelker M, Inhoffen W et al. Combined treatment of juxtapapillary retinal capillary haemagnioma with intravitreal bevacizumab and photodynamic therapy. Eye 2007; 21 : 1125–1126.
115. von Buelow M, Pape S, Hoerauf H. Systemic bevacizumab treatment of a juxtapappillary retinal haemangioma. Acta Ophthalmol Scand 2007; 85 : 114–116.
116. Joeres S, Heussen FM, Treziak T et al. Bevacizumab (Avastin) treatment in patients with retinal angiomatous proliferation. Graefes Arch Clin Exp Ophthalmol 2007; 245 : 1597–1602.
117. Belmont L, Zemoura L, Couderc LJ. Pulmonary epithelioid haemangioendothelioma and bevacizumab. J Thorac Oncol 2008; 3 : 557–558.
118. Gilheeney SW, Scott, RM, Turner C et al. Treatment of Von Hippel Lindau associated hemangioblastoma in pediatric patients with bevacizumab (Avastin). Neurolo‑Oncology 2007; 9. Abstract 168.
119. Nelson SC, Bostrom BC. Successful use of bevacizumab in live threatening steroid‑resistant infantile hepatic hemangioendotelioma. Pediatr Blood Cancer 2007; 48. Abstract 611.
120. Kline RM, Buck LM. Bevacizumab treatment in multifocal lymphangioendotheliomatosis with thrombocytopenia. Pediatr Blood Cancer 2009; 52 : 534–536.
121. Smith AR, Jane H, Margaret HK et al. Reversible bony changes after treatment with bevacizumab in a child with cutaneovisceral angiomatosis with thrombocytopenia syndrome: A case report and review of the literature. Blood 2007; 110 : 1323.
122. Bose P, Holter JL, Selby GB et al. Use of bevacizumab in hereditary hemorhagic telangiectasia. Blood 2008; 112 (Suppl). Abstract 3928.
123. Mitchell A, Adams LA, MacQuillan Get al. Bevacizumab reverse need for liver transplantation in hereditary hemorhagic telangiectasia. Liver Transplant 2008; 14 : 210–213.
124. Smith AR, Hennessy JM, Kurth MA et al. Reversible skeletal changes after treatment with bevacizumab in a child with cutaneovisceral angiomatosis with thrombocytopenia syndrome. Pediatr Blood Cancer 2008; 51 : 418–420.
125. Ramasamy K, Stephen LW, Jackie C et al. Bevacizumab for POEMS syndrome. Blood 2006; 108. Abstract 366B.
126. Misri R, Kharkar V, Dandale A et al. Multiple capillary hemangiomas: a distinctive lesion of multicentric Castleman’s disease and POEMS syndrome. Indian J Dermatol Venereol Leprol 2008; 74 : 364–366.
127. Bellahcène A, Chaplet M, Bonjean K et al. Zoledronate inhibits alphavbeta3 and alphavbeta5 integrin cell surface expression in endothelial cells. Endothelium 2007; 14 : 123–130.
128. Croucher PI, De Hendrik R, Perry MJet al. Zoledronic acid treatment of 5T2MM‑bearing mice inhibits the development of myeloma bone disease: evidence for decreased osteolysis, tumor burden and angiogenesis, and increased survival. J Bone Miner Res 2003; 18 : 482–492.
129. Fournier P, Boissier S, Filleur S et al. Bisphosphonates inhibit angiogenesis in vitro and testosterone‑stimulated vascular regrowth in the ventral prostate in castrated rats. Cancer Res 2002; 62 : 6538–6544.
130. Hasmim M, Bieler G, Rüegg C. Zoledronate inhibits endothelial cell adhesion, migration and survival through the suppression of multiple, prenylation‑dependent signaling pathways. J Thromb Haemost 2007; 5 : 166–173.
131. Li EC, Davis LE. Zoledronic acid: a new parenteral bisphosphonate. Clin Ther 2003; 25 : 2669–2708.
132. Wood J, Bonjean K, Ruetz S et al. Novel antiangiogenic effects of the bisphosphonate compound zoledronic acid. J Pharmacol Exp Ther 2002; 302 : 1055–1061.
133. Yu H, Qin A. Could local delivery of bisphosphonates be a new therapeutic choice for hemangiomas? Med Hypotheses 2009; 73 : 495–497.
134. Nardone G, Rocco A, Balzano T et al. The efficacy of octreotide therapy in chronic bleeding due to vascular abnormalities of the gastrointestinal tract. Aliment Pharmacol Ther 1999; 13 : 1429–1436.
135. Scaglione G, Pietrini L, Russo F et al. Long acting octreotide as rescue therapy in chronic bleeding from gastrointestinal angiodysplasia. Aliment Pharmacol Ther 2007; 26 : 935–942.
136. Nardone G, Rocco A, Balzano T et al. The efficacy of octreotide therapy in chronic bleeding due to vascular abnormalities of the gastrointestinal tract. Aliment Pharmacol Ther 1999; 13 : 1429–1436.
137. Loo WJ, Lanigan SW. Recent advances in laser therapy for the treatment of cutaneous vascular disorders. Lasers Med Sci 2002; 17 : 9–12.
138. Winter H, Dräger E, Sterry W. Sclerotherapy for treatment of hemangiomas. Dermatol Surg 2000; 26 : 105–108.
139. Colella G, Vuolo G, Siniscalchi G et al. Radiotherapy for maxillo‑facial hemangiomas in children. Dental and periodontal long term effects. Minerva Stomatol 2005; 54 : 509–516.
140. Kwok-Williams M, Perez Z, Squire Ret al. Radiotherapy for life-threatening mediastinal hemangioma with Kasabach-Merritt syndrome. Pediatr Blood Cancer 2007; 49 : 739–744.
141. Leong E, Bydder S. Use of radiotherapy to treat life‑threatening Kasabach‑Merritt syndrome. J Med Imaging Radiat Oncol 2009; 53 : 87–91.
142. Blatný J, Štěrba J, Magnová O. Léčba život ohrožujícího krvácení u kojence s hemangiomatózou a s projevy Kasabacha‑Merritové pomocí rekombinantního faktoru VIIA. Čes Slov Pediatr 2002; 57 : 401–402.
143. McLaughlin ER, Morris R, Weiss SW et al. Diffuse dermal angiomatosis of the breast: response to isotretinoin. J Am Acad Dermatol 2001; 45 : 462–465.
144. van Heeckeren WJ, Sanborn SL, Narayan A et al. Complication from vascular disrupting agents and angiogenesis inhibitors: aberrant control for hemostasis and thrombosis. Curr Opin Hematol 2007; 14 : 468–480.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2010 Číslo 8- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Jak a proč změnily staré léky prognózu nemocných s primárním lymfomem CNS? – editorial
- Problematika primárních lymfomů centrálního nervového systému – editorial
- Zmeny hladín NT‑proBNP u pacientov s fibriláciou predsiení v závislosti od srdcového zlyhávania
- Primární lymfomy centrálního nervového systému
- Péče o nemocné na umělé plicní ventilaci z pohledu lékaře internisty
- Úspěšná léčba angiomatózy thalidomidem a interferonem α. Popis pěti případů a přehled léčby angiomatózy a proliferujících hemangiomů
- Imunoglobulin G4 pozitivní cholangitida
- K významnému životnímu jubileu prof. MUDr. Jindřicha Špinara, CSc., FESC,
- K životnímu jubileu prof. MUDr. Jindřicha Špinara, CSc., FESC
- Rizikový profil hypertonika
- Komplexní léčba kardiovaskulárního rizika. Zaměřeno na telmisartan
- Charakteristiky a osud pacientov s akútnym srdcovým zlyhávaním v aktuálnej klinickej praxi
- Anémie při chronickém srdečním selhání
- Terapie implantabilními kardiovertery-defibrilátory (ICD) na prahu 3. tisíciletí
- Význam fenofibrátu v liečbe aterogénnej dyslipoproteinémie
- Fibrilace síní v době katétrové ablace
- Rychlost aortální pulzové vlny u nemocných s metabolickým syndromem a hypertenzí léčených sartany
- Transplantace srdce – minulost, současnost a výhled do budoucna
- Šobrův den, XXV. konference o hyperlipoproteinemiích
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Péče o nemocné na umělé plicní ventilaci z pohledu lékaře internisty
- Terapie implantabilními kardiovertery-defibrilátory (ICD) na prahu 3. tisíciletí
- Anémie při chronickém srdečním selhání
- Zmeny hladín NT‑proBNP u pacientov s fibriláciou predsiení v závislosti od srdcového zlyhávania
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy









