-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Léčba akutní exacerbace chronické obstrukční plicní nemoci za hospitalizace a na lůžku intenzivní péče
Treatment of acute exacerbation of the obstructive pulmonary disease with hospitalization at an Intensive Care Unit.
Bronchodilatation is preferably achieved with β-2-agonists (SABA), salbutamol. Therapy is intensified with anticholinergics (ipratropium bromide monohydrate). A combined preparation may also be used (ipratropium bromide monohydrate and fenoterole hydrobromide). Methylxantines (theophylline) are the second line option. Corticosteroids are administered orally (prednisolone) or intravenously (methylprednisolone or hydrocortisone). Patients who have problems expectorating are administered mucolytics (ambroxol hydrochloride or bromhexine hydrochloride). Some patients are treated with antibiotics. Oxygenotherapy is indicated in patients with hypoxemia. Insufficient treatment effect and progression of respiratory insufficiency warrants application of mechanical or non-invasive ventilation.
Key words:
acute exacerbation – bronchodilatation treatment – intensive care
Autoři: Y. Staňková; J. Skřičková; S. Potrepčiaková
Působiště autorů: Klinika nemocí plicních a tuberkulózy Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednostka prof. MUDr. Jana Skřičková, CSc.
Vyšlo v časopise: Vnitř Lék 2011; 57(10): 834-838
Kategorie: Přehledné referáty
Souhrn
V bronchodilatační léčbě jsou preferovány β-2-agonisté (SABA), salbutamol. Terapii posilujeme o anticholinergika (ipratropii bromidum monohydricum). Lze použít i kombinovaný preparát (ipratropii bromidum monohydricum a fenoteroli hydrobromidum). Metylxantiny (teofylin) jsou léky druhé linie. Kortikoidy podáváme perorálně (prednisolon) či intravenózně (metylprednisolon nebo hydrokortison). Mukolytika (ambroxoli hydrochloridum nebo bromhexini hydrochloridum) medikujeme u pacientů s obtížnou expektorací. V některých případech je vhodná léčba antibiotiky. Při hypoxemii je indikována oxygenoterapie. Při nedostatečném efektu léčby a progresi respirační insuficience je indikována umělá plicní ventilace nebo neinvazivní ventilace.
Klíčová slova:
akutní exacerbace – bronchodilatační léčba – intenzivní péčeÚvod
Velmi často se setkáváme s požadavkem interních pracovišť jiných odborností o převzetí pacienta s exacerbací chronické obstrukční plicní nemocí (CHOPN) na lůžko intenzivní péče. Proto je tato práce pojata jako sdělení zaměřené právě na tyto lékaře a měla by přehledně shrnout indikačních kritéria a možnosti léčby za hospitalizace a na lůžku intenzivní péče.
Definice
Exacerbace CHOPN je definována jako událost v přirozeném vývoji choroby, která je charakterizována změnou dušnosti, kašle nebo sputa nad rámec normální denní variability. Vzniká akutně a může vyžadovat úpravu běžné léčby nemocného s CHOPN. Příčinou exacerbace je nejčastěji infekce dolních cest dýchacích a inhalace vzdušných polutantů. Zhruba v 1/3 případů není možné příčinu identifikovat [1].
Hodnocení tíže exacerbace
Hodnocení tíže exacerbace vychází z anamnézy nemocného, přítomnosti komorbidit a symptomů. Nutné je zhodnocení fyzikálního vyšetření, provedení vyšetření arteriálních krevních plynů a dalších laboratorních vyšetření. Nález purulentního sputa je indikace k zahájení ATB (antibiotické) léčby (nejčastějším původcem exacerbací jsou Streptococcus pneumoniae, Hemophilus influenzae a Moraxella catarhalis). Kultivační vyšetření sputa provádíme zejména u nemocných nereagujících na iniciální antibiotickou léčbu. Spirometrické vyšetření nebo měření špičkového expiračního průtoku (PEF) není pro hodnocení tíže exacerbace doporučeno [2,3]. Použití pulzní oxymetrie je vhodné pro rozhodnutí o potřebě oxygenoterapie. U hospitalizovaných je tíže exacerbace hodnocena vyšetřením arteriálních krevních plynů. PaO2 < 8,0 kPa (60 mm Hg) a/nebo SaO2 < 90 % s hodnotou nebo bez hodnoty PaCO2 > 6,7 kPa (50 mm Hg) je považována za respirační selhání. Přítomnost acidózy (pH < 7,36) se současnou hyperkapnií (PaCO2 > 6–8 kPa, 45–60 mm Hg) je u nemocného s respiračním selháním indikací k neinvazivní plicní ventilaci [2–4,6,7].
Indikace přijetí do nemocniční péče
Indikací k přijetí do nemocniční péče je výrazné zvýšení intenzity symptomů (např. rozvoj klidové dušnosti), závažná forma CHOPN v předchorobí a dále rozvoj nových příznaků jako např. cyanóza, otoky dolních končetin atd. Hospitalizace je nutná u pacientů, u kterých selhala léčba iniciální (zvýšení dávek a frekvence bronchodilatační léčby, která byla doposud při stabilizovaném stavu indikována). Za vhodnou považujeme hospitalizaci u pacientů s významnou komorbiditou, častými exacerbacemi, u pacientů s novým výskytem arytmií a u pacientů s diagnostickou nejistotou. Vysoký věk a nedostatečné domácí zázemí je rovněž indikací přijetí k hospitalizaci [6,19,20].
Léčba na standardním lůžku
Prioritní po přijetí na oddělení akutního příjmu je zahájení kyslíkové léčby a vyhodnocení toho, zda se jedná o život ohrožující exacerbaci. Léčba těžké, ale nikoli život ohrožující exacerbace zahrnuje zhodnocení závažnosti symptomů, krevních plynů a nálezu na RTG plic. Nutná je kontrolovaná oxygenoterapie s opakovaným vyšetřením krevních plynů po 30–60 min. Bronchodilatační léčba zahrnuje podávání zvyšujících se dávek nebo frekvencí podání kombinace β-2-agonistů a anticholinergik s použitím spacerů nebo nebulizace zvlhčeným vzduchem. Vhodné je zvážit použití nitrožilních metylxantinů, známe-li hladinu teofylinu v séru (bezpečná terapeutická koncentrace je 10–15 mg/l). Léčbu doplňujeme o perorální nebo nitrožilní aplikaci kortikoidů, zvažujeme podání antibiotik. Průběžně monitorujeme tekutinovou bilanci. Profylakticky podáváme léky k prevenci tromboembolické nemoci, diagnostikujeme a léčíme přidružené stavy (srdeční selhávání, arytmie apod.). Monitorujeme vývoj stavu nemocného. V případě hypoxemie je podávána oxygenoterapie. Cílem je PaO2 > 8,0 kPa, 60 mm Hg, nebo SpO2 > 90 %. Vyšetření krevních plynů je doporučeno po 30–60 min od zahájení oxygenoterapie (vyloučení progrese hyperkapnie) [6,18–20].
Při splnění některého z níže uvedených kritérií musí být nemocný neodkladně hospitalizován na lůžku intenzivní péče (JIP – jednotka intenzivní péče nebo KARIM – Klinika anesteziologie, resuscitace a intenzivní medicíny).
Indikace k přijetí a léčba na lůžku intenzivní péče
Indikace k přijetí na lůžko intenzivní péče jsou následující:
- těžká dušnost nereagující na iniciální léčbu,
- změna mentálního stavu (zmatenost, letargie, koma),
- přetrvávající nebo progredující hypoxemie (PaO2 < 5,3 kPa, 40 mm Hg) a/nebo těžká/zhoršující se hyperkapnie (PaCO2 > 8,0 kPa, 60 mm Hg) a/nebo těžká/zhoršující se respirační acidóza (pH < 7,25) přes oxygenoterapii a neinvazivní ventilaci,
- potřeba OTI (orotracheální intubace) a UPV (umělá plicní ventilace), event. neinvazivní plicní ventilace,
- oběhová nestabilita a nutnost podávání vazopresorů [6,19].
V bronchodilatační léčbě je preferováno inhalační podání krátkodobě působících β-2-agonistů (SABA), které lze aplikovat z různých inhalačních systémů. Pokud jsou bronchodilatancia aplikována pomocí nebulizátorů, používá se jako nosné medium Vincentka nebo fyziologický roztok se salbutamolem – Ventolin sol 1krát 20 ml/120 mg 0,5–1 ml 3krát denně. Terapii posilujeme o inhalaci anticholinergik (ipratropii bromidum monohydricum – Atrovent inh sol 1krát 20 ml 2–4 ml 3–4krát denně). Lze použít i kombinovaný preparát (ipratropii bromidum monohydricum a fenotetoli hydrobromidum – Berodual inh sol 1krát 20 ml 0,5–1 ml 3krát denně). Metylxantiny (teofylin – Syntophyllin inj. 10 ml/250 mg) jsou považovány za léky druhé linie, jejich dávkování je 3–4 amp. kontinuálně i.v. na 24 hod zředěné fyziologickým roztokem. V případě, že je nemocný léčen perorálním teofylinem, je nutné počítat s úzkým terapeutickým oknem a opakovaně provádět kontroly hladiny teofylinu v séru, minimálně však při zahájení léčby.
Nitrožilní nebo perorální podání kortikoidů je doporučeno jako součást léčby hospitalizovaných. Perorální dávka 30–40 mg prednisolonu/den po dobu 7–10 dní je považována za účinnou a bezpečnou. Za hospitalizace však bývá častější podávání kortikoidů intravenózně – metylprednisolon (Solu-Medrol 40, 125, 250, 500 mg) nebo hydrokortison (Hydrokortison inj 100 mg), v dávkách závislých na závažnosti stavu nemocného. Mukolytika (ambroxoli hydrochloridum – Mucosolvan sirup 3krát 4 ml perorálně, nebo bromhexini hydrochloridum – Paxirasol inj sol 2 ml/4 mg 3krát 1 amp. intravenózně) podáváme u pacientů s obtížnou expektorací.
Podání antibiotik je doporučeno u nemocných se souběžným výskytem 3 tzv. kardinálních příznaků zahrnujících nárůst dušnosti, množství sputa a purulentní charakter sputa. Podání antibiotik je doporučeno i u nemocných se současným výskytem 2 tzv. kardinálních příznaků, je-li alespoň jedním z nich purulentní charakter sputa nebo u nemocných, kteří vyžadují umělou plicní ventilaci (včetně neinvazivní ventilace) [20]. Na našem pracovišti však u pacientů neinvazivně ventilovaných profylakticky ATB léčbu nezahajujeme (bývá však již často léčbou základního onemocnění).
Pro volbu antibiotik je důležitá znalost lokální epidemiologické situace. Je preferována perorální forma léčby, je-li možná. Doporučená doba podávání antibiotik je 3–7 dní [20].
Rizikové faktory pro nepříznivý výsledek nemocných s exacerbací CHOPN jsou komorbidity, těžká forma CHOPN, časté exacerbace (> 3/rok) a použití antibiotik v posledních 3 měsících. Rizikové faktory pro infekci Pseudomonas aeruginosa jsou nedávná hospitalizace, časté podávání antibiotik (> 4/poslední rok), těžká exacerbace CHOPN a předchozí záchyt Pseudomonas aeruginosa [20].
Doporučení pro volbu antibiotik vychází z tab. 1 – doporučení GOLD 2008 [21]:
- skupina A: mírná exacerbace, bez rizikových faktorů pro nepříznivý výsledek
- skupina B: středně těžká exacerbace nebo rizikové faktory pro nepříznivý výsledek
- skupina C: těžká exacerbace, rizikové faktory pro infekci Pseudomonas aeruginosa.
Tab. 1. Rozdělení nemocných s exacerbací CHOPN pro antibiotickou léčbu a potenciální mikroorganizmy, které se na ní mohou podílet. GOLD 2008 [21]. ![Rozdělení nemocných s exacerbací CHOPN pro antibiotickou léčbu a potenciální mikroorganizmy, které se na ní mohou podílet. GOLD 2008 [21].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/4e59bedcdc064c120367be7e8bf35c78.jpeg)
V případě hypoxemie je podávána oxygenoterapie (viz výše).
Další diagnostické a terapeutické postupy zdůrazňují význam sledování bilance tekutin, nutriční podporu, profylaxi hluboké žilní trombózy atd. Manuální nebo mechanické perkuse hrudníku mohou být prospěšné u nemocných s vysokou produkcí sputa. Nejsou k dispozici údaje prokazující příznivý efekt inhalačního podávání sekretolytik (i když se v některých případech k této léčbě přikláníme) [1–3,5,8].
V případě nedostatečného efektu léčby a progrese respirační insuficience je indikována umělá plicní ventilace (UPV). Cílem ventilační terapie je dosažení přiměřených parametrů ventilace a oxygenace. Základním klinickým cílem UPV je zvládnutí hypoxemie, respirační acidózy a dechové tísně [1–3,5,8–17].
Neinvazivní ventilace (NIV) je definována jako způsob ventilační podpory bez nutnosti zajištění dýchacích cest intubací nebo tracheostomií. Dnes je neinvazivní ventilace (resp. neinvazivní ventilační podpora) zajišťována pozitivním přetlakem pomocí utěsněné masky (obr. 1) či helmy (obr. 2) a s použitím ventilátoru (obr. 3).
Obr. 1. Maska pro neinvazivní plicní ventilaci. 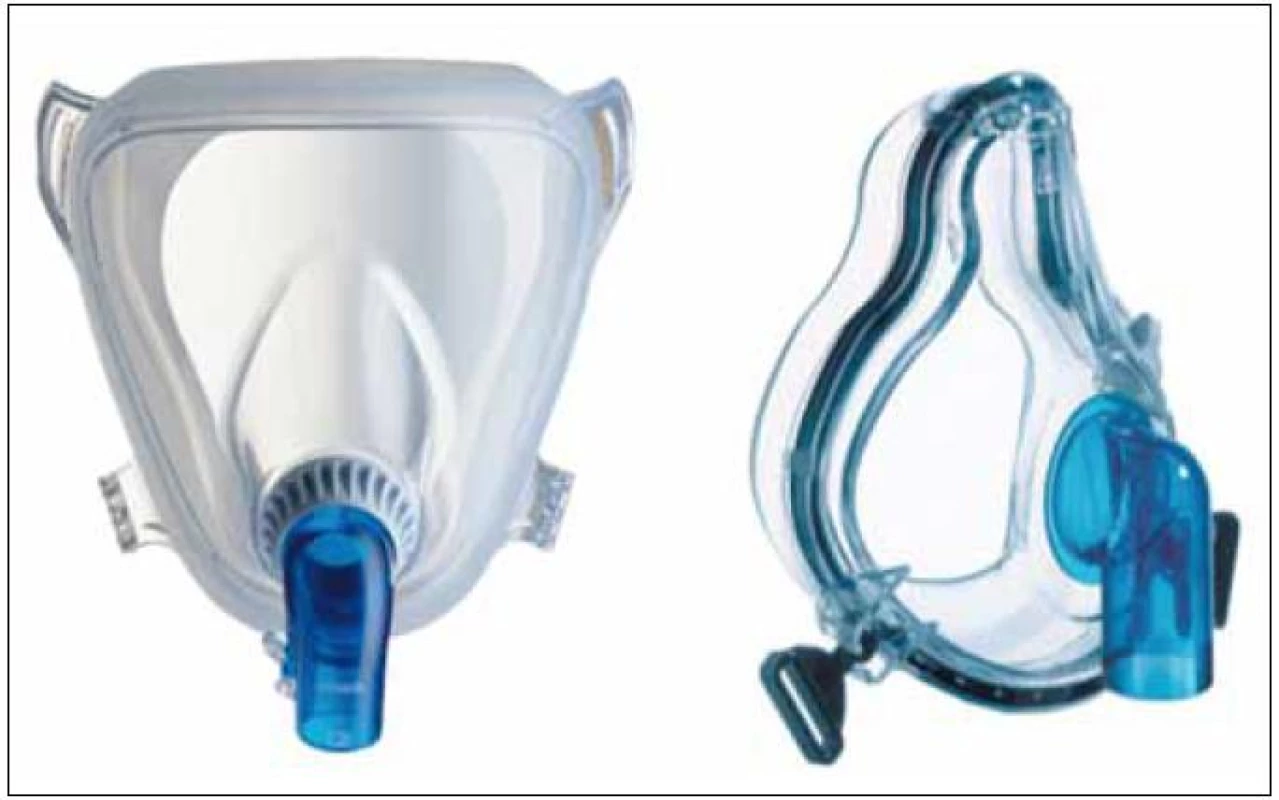
Obr. 2. Helma pro neinvazivní plicní ventilaci. 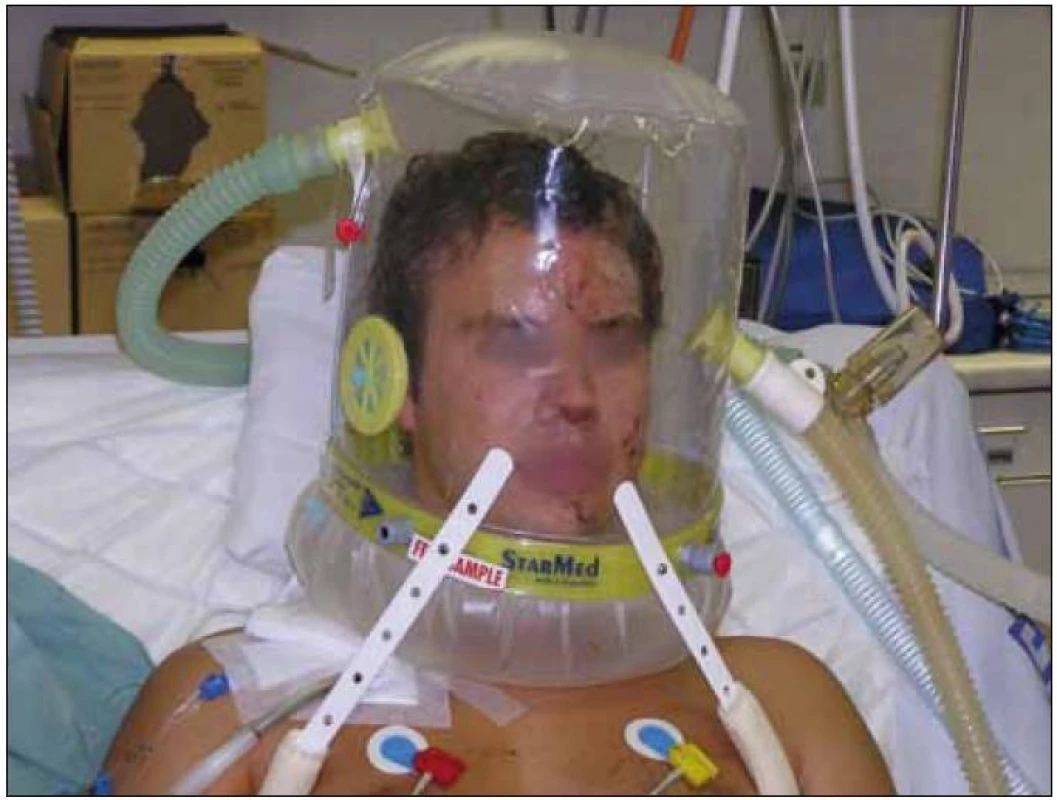
Obr. 3. Ventilátor pro neinvazivní plicní ventilaci BiPAP Vision. 
Indikace neinvazivní plicní ventilace při akutním zhoršení jsou:
- dyspnoe, tachypnoe > 30/min,
- zapojení akcesorních dýchacích svalů a paradoxní abdominální dýchání,
- PaCO2 > 6,5 kPa při pH < 7,35,
- těžká hypoxemie při nedostatečném efektu oxygenoterapie,
- pooperační hypoxické respirační selhávání (např. po plicních resekcích),
- při weaningu [2,7–11,17].
Přístrojem je zajišťován dvojúrovňový pozitivní přetlak. Velikost tlaků se určuje dle klinického efektu a dle tolerance nemocného [2,7–11,14].
Absolutní kontraindikace neinvazivní plicní ventilace jsou:
- zástava dechu,
- těžká porucha vědomí (Glasgow Coma Scale < 8),
- snížení nebo absence faryngeálního reflexu a z toho plynoucí nebezpečí aspirace,
- nespolupracující nemocný,
- pneumotorax, pneumomediastinum,
- oběhová nestabilita (šokový stav, akutní ischemie myokardu, závažné arytmie),
- neschopnost udržet průchodnost dýchacích cest (porucha kašlacího a polykacího reflexu),
- poranění obličeje, popáleniny, stav po chirurgickém výkonu v orofaciální oblasti, anatomické abnormality bránící těsnosti obličejové masky,
- obezita (větší než 200 % ideální tělesné hmotnosti),
- akutní ischemie myokardu.
V těchto případech je obvykle nutná intubace a invazivní plicní ventila-ce [2,7–11,14].
Pro invazivní umělou plicní ventilaci je nutné zajištění dýchacích cest intubací nebo tracheostomií. Umělá plicní ventilace slouží po dobu nezbytně nutnou. Rozhodnutí zahájit UPV je s výjimkou urgentních situací založeno na zhodnocení klinického stavu nemocného, charakteru základního onemocnění a odpovědi na konzervativní léčbu. V praxi lze pro hrubou orientaci použít hodnocení parametrů oxygenace, ventilace a plicní mechaniky a celkového stavu nemocného.
Zahájení UPV musíme zvažovat, je-li:
- apnoe,
- dechová frekvence > 35/min,
- vitální kapacita < 10–15 ml/kg,
- PaO2 < 9 kPa při FIO2 0,4,
- PaCO2 > 7,5 kPa při respirační acidóze (pH < 7,2),
- poměr mrtvého prostoru a dechového objemu VD/VT > 60 % [1,2,5,7,12,19].
Významnější je však zhodnocení dosavadního a předpokládaného vývoje stavu nemocného než konkrétní hraniční hodnoty sledovaných ukazatelů. Neoddělitelnou součástí terapeutické rozvahy je i posouzení prognózy nemocného. Více než konkrétní izolované hraniční hodnoty posuzujeme trend vývoje stavu nemocného [17].
V případě, že se jedná o pacienta v terminálním stadiu onemocnění, UPV nezahajujeme.
Podrobné informace o ventilačních režimech, parametrech nastavování či indikacích k weaningu nejsou náplní tohoto článku, proto se této problematice v příspěvku nevěnujeme.
Prevence exacerbací
Prevence exacerbací spočívá v eliminaci rizikových faktorů. Nutností je zanechat kouření. Bylo prokázáno, že počet exacerbací snižuje léčba inhalačními kortikosteroidy, tiotropiem i fixními kombinacemi inhalační kortikosteroidů a dlouhodobě působících β-2-mimetik, které mají efekt předcházet exacerbací ve stabilizované fázi onemocnění. Je rovněž doporučováno očkování proti chřipce a rehabilitace [1].
Závěr
U pacientů s těžkou a velmi těžkou exacerbací nebo u pacientů se závažnými komorbiditami existuje vždy riziko vzniku těžké a život ohrožující exacerbace vyžadující léčbu na JIP či KARIM. Pro zvládnutí exacerbace je vždy nutné její včasné rozpoznání a včasná, účinná léčba.
MUDr. Mgr. Yvonne Staňková, Ph.D.
www.jnbrno.cz
e-mail: ystankova@fnbrno.cz
Doručeno do redakce: 4. 10. 2010
Přijato po recenzi: 7. 3. 2011
Zdroje
1. Musil J. Zvládání exacerbací chronické obstrukční plicní nemoci. Stud pneumol phtiseol 2007; 18 : 175–180.
2. Chytra I, Šrámek V, Ševčík P. Kyslíková léčba, neinvazivní a invazivní umělá plicní ventilace. In: Ševčík P, Skřičková J, Šrámek V (eds). Záněty plic v intenzivní medicíně. 1. vyd. Praha: Galén 2004 : 92–102.
3. Pužman P, Teřl M. Neinvazivní ventilace. In: Teřl M, Krákorová G, Pešek M (eds). Plicní lékařství. Praha: Karolinum 2004 : 89–91.
4. Šrámek V, Chytra I. Umělá plicní ventilace. In: Ševčík P, Skřičková J, Šrámek V (eds). Záněty plic v intenzivní medicíně. Praha: Galén 2004 : 92–100.
5. Pužman P. Invazivní ventilace. In: Teřl M, Krákorová G, Pešek M (eds). Plicní lékařství. Praha: Karolinum 2004 : 91–95.
6. Zazula R, Spálený A. Exacerbace chronické obstrukční plicní nemoci z pohledu intenzivisty. Prakt lék 2008; 88 : 437–442.
7. Drábková J. Invazivní a neinvazivní plicní ventilace v pneumologii. Novinky v anesteziologii, intenzivní medicíně a léčbě bolesti. Praha: Galén 2007 : 39–42.
8. Dostál P. Selhání neinvazivní ventilace – rizikové faktory, příčiny a možnosti ovlivnění. Ročenka intenzivní medicíny 2004. 11. dny intenzivní medicíny. Kroměříž 2004 : 17–22.
9. Mehta S, Hill NS. Noninvasive ventilation (State of the art). Am J Respir Crit Care Med 2001; 163 : 540–577.
10. Herold I. Neinvazivní ventilace v intenzivní péči. Prakt Lék 2008; 88 : 506–511.
11. Antonelli M, Conti G, Rocco M et al. A comparison of noninvasive positive-pressure ventilation and conventional mechanical ventilation in patients with acute respiratory failure. N Engl J Med 1998; 339 : 429–435.
12. Marini JJ, Gattinoni L. Ventilatory management of acute respiratory distress syndrome: a consensus of two. Crit Care Med 2004; 32 : 250–255.
13. Ricard JD, Dreyfuss D, Saumon G. Ventilator-induced lung injury. Eur Respir J Suppl 2003; 42 : 2–9.
14. Pinsky MR. Heart-lung interactions durin positive-presure ventilation. New Horiz 1994; 2 : 443–456.
15. Armaganidis A, Kotanidou A, Roussos C. Mechanical ventilation in circulatory failure. In: Vincent JL (ed.). Yearbook of intensive care and emergency medicine. Berlin: Springer-Verlag 1995 : 185–208.
16. Drábková J. Extubace-reintubace a možnost překlenutí rizika neinvazivní ventilací. Ref Výb Anest Resuscit suppl 2004; 51 : 162–167.
17. Drábková J. Bude smrt s rozvojem medicínské techniky postupně spojována s umělou plicní ventilací? Ref Výb Anest Resuscit suppl 2003; 50 : 158–159.
18. Drábková J. Záludnosti umělé ventilace při obstrukčních chorobách. Ref Výb Anest Resuscit 2006 : 53 : 34–41.
19. Dostál P, Ševčík P. Umělá plicní ventilace a kyslíková terapie. In: Ševčík P, Černý V, Vítovec J (eds). Intenzivní medicína. Praha: Galén 2003 : 51–63.
20. Kašák V. Chronická obstrukční plicní nemoc. In: Kolek V, Kašák V et al (eds). Pneumologie – vybrané kapitoly pro praxi. Praha: Maxdorf 2010 : 33–69.
21. The Global Initiative for Chronic Obstructive Lung Disease. Pocket guide to COPD diagnosis, management and prevention. GOLD 2008. Aviable from: www.goldcopd.org.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2011 Číslo 10- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Kritické zhodnocení optimální farmakoterapie u kandidátů srdeční resynchronizační léčby – zkušenosti jednoho centra
- Náklady na rehospitalizaci pacientů s akutním srdečním selháním
- Očkování proti virové hepatitidě B u pacientů s chronickým selháním ledvin – dvacetileté zkušenosti
- Normální hodnoty tlaků v plicním oběhu u zdravých osob v klidu a při cvičení
- Resynchronizačná liečba srdcového zlyhávania – stále veľa otáznikov
- Diagnostický algoritmus synkop: integrativní přístup
- Léčba akutní exacerbace chronické obstrukční plicní nemoci za hospitalizace a na lůžku intenzivní péče
- Úloha centrálneho nervového systému v etiopatogenéze chorôb periférnych orgánov
- Prognostické faktory u chronické lymfocytární leukemie
- Diagnostika a léčba komunitní pneumonie dospělých
- Benígny solitárny vred slepého čreva
- MR dokumentované vymizení infiltrace infundibula hypofýzy u pacientů s histiocytózou z Langerhansových buněk po léčbě 2-chlorodeoxyadenosinem
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Normální hodnoty tlaků v plicním oběhu u zdravých osob v klidu a při cvičení
- Léčba akutní exacerbace chronické obstrukční plicní nemoci za hospitalizace a na lůžku intenzivní péče
- Resynchronizačná liečba srdcového zlyhávania – stále veľa otáznikov
- Prognostické faktory u chronické lymfocytární leukemie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



