-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Pokroky v metabolizmu a výživě 2011 a cesta k personalizované léčbě
Advances in metabolism and nutrition 2011 and the route to personalized treatment
Current model of metabolic and nutritional disorders management utilizes modern techniques that promote some of the nutritional techniques to pharmacoteherapy. This approach is demonstrated on an example of multiple organ failure and systemic inflammatory reaction managed with pharmacologically active nutritional substrates, such as arginine, glutamine, taurine, threonine and cysteine. Treatment of sarcopenia in older age is also discussed. Personalized nourishment as a component part of a wider term personalized medicine represents a new approach that requires recognition of individual differences in human genome and its expression. However, this approach also requires a change of attitude towards laboratory diagnostics and clinical practice, with patients and clinical prediction as the focal point. From this perspective, there is a need to replace current traditional laboratory tests with a new system that utilizes molecular biology and bioinformatics.
Key words:
personalized medicine – nutritional pharmacology – nutrigenomics – multiple organ failure – sarcopenia
Autoři: Z. Zadákihash3 1, 2 1, 2; M. Hronek 1; R. Hyšpler 2
Působiště autorů: Centrum pro výzkum a vývoj Lékařské fakulty UK a FN Hradec Králové, vedoucí pracoviště prof. MUDr. Zdeněk Zadák, CSc. 1; Klinika gerontologická a metabolická Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Luboš Sobotka, CSc. 2
Vyšlo v časopise: Vnitř Lék 2011; 57(11): 970-974
Kategorie: 80. narozeniny prof. MUDr. Jaroslava Rybky, DrSc.
Souhrn
Nová koncepce terapie poruch metabolizmu a výživy je založena na moderních přístupech, které staví některé nutriční postupy na úroveň farmakoterapie. Tento přístup je demonstrován na příkladu léčby multiorgánového selhání a systémové inflamatorní reakce, kdy jsou využívány nutriční substráty s farmakologickým účinkem jako arginin, glutamin, taurin, threonin a cystein. Další diskutovanou problematikou je léčba sarkopenie ve stáří. Personalizovaná výživa jako součást širšího pojetí personalizované medicíny představuje novou cestu, která je založena na poznání individuálních rozdílů v lidském genomu a jeho expresi. Tato cesta však vyžaduje zcela odlišný přístup k laboratorní diagnostice i klinickému pojetí, které je mnohem více orientováno na jednotlivého pacienta a klinickou predikci. Z tohoto hlediska se jeví nutností nahradit dosavadní klasické laboratorní testy novým systémem, který využívá molekulární biologii a bioinformatiku.
Klíčová slova:
personalizovaná medicína – nutriční farmakologie – nutrigenomika – multiorgánové selhání – sarkopenieÚvod
Ovlivnění metabolizmu a použití orgánově specifických nutričních substrátů vede k novému konceptu léčby akutních i chronických stavů v interních oborech, chirurgických oborech i v intenzivní medicíně. Tato nová koncepce terapie poruch metabolizmu a výživy je založena na moderních přístupech, které staví některé nutriční postupy na úroveň farmakoterapie. Tím jsou definovány nutriční oblasti, jako je nutriční farmakologie, imunonutrice a personalizovaná výživa.
Nový koncept metabolizmu a výživy v diagnóze multiorgánového selhání (MOF) a systémové inflamatorní reakce (SIRS)
Prevence vzniku a léčba těchto stavů patří i přes farmakologický a technologický pokrok k nejobtížnějším oblastem medicíny. Stále přetrvávající vysoká mortalita i u mladších věkových kategorií je dokladem závažnosti těchto situací.
Rozvoj multiorgánové dysfunkce probíhá většinou ve 2 směrech:
- Primární inzult orgánů, např. renální selhání, rabdomyolýza, jaterní selhání, sepse, polytrauma, které bezprostředně přejde do multiorgánové dysfunkce (first hit).
- Druhotná reakce – vzdálené orgánové poškození, které vzniká jako důsledek prvotní zánětlivé, infekční a traumatické reakce (second hit).
Z hlediska účinku mediátorů se v primární reakci uplatňuje zejména hyperinflamatorní proces, na který syndrom multiorgánové dysfunkce naváže plynule a projeví se cytokinovou bouří a specifickým výběrem mediátorů (TNF-α, IL-2, IL-6, IL-8). Charakteristická je stimulace apoptózy v lymfocytech i enterocytech, a naopak opožděná apoptóza neutrofilů [1]. Tato metabolická odezva na hypoperfuzi a následnou tvorbu reaktivních forem kyslíku (ROS) má několik forem řešení:
- hemodynamická podpora a stabilizace (volumová resuscitace, farmakologická podpora),
- zajištění ventilace (protektivní strategie mechanické ventilace),
- léčba infekce (konvenční antibiotika, nově antimikrobiální peptidy, peptaiboly, defenziny, nové náhrady konvenčních antibiotik),
- úprava fluidokoagulační rovnováhy,
- stabilizace neuroregulačních poměrů (rovnováha mezi sympatickým a parasympatickým systémem),
- metabolická a nutriční podpora (nutriční farmakologie, použití orgánově specifické výživy, imunomodulační výživa).
Nové možnosti využití nutričních substrátů s farmakologickým účinkem
Arginin
Přestože arginin není esenciální aminokyselina a jeho syntéza v organizmu je za obvyklých situací dostatečná, při stresové zátěži může vzniknout jeho nedostatek se závislostí organizmu na přívodu argininu z vnějšího prostředí. Vedle účinného transportu aminodusíku a jeho role v tvorbě močoviny je arginin důležitým článkem v produkci plynového mediátoru oxidu dusnatého – NO [2].
Deficit tvorby NO při depleci argininu se projeví následujícími změnami:
- nedostatečná klinická reakce, např. leukocytóza, pokles albuminu a malý vzestup C-reaktivního proteinu při závažné infekci a fulminantní sepsi. S tím souvisí i nedostatečná produkce hnisu v místě zánětu a celkově utlumená lokální inflamatorní reakce;
- při nedostatku argininu chybí regenerace poškozených tkání, je snížena granulační reakce v oblasti přítomnosti cizorodých tělísek a infekčních agens, je snížena produkce fibrinu. S tím souvisí i defektní vytváření bariér protiinfekčních agens a toxinů, např. ztluštění serózních membrán (peritoneum, pleura), jsou potlačeny nebo chybí vytváření adhezí v místě poškození a tendence k ohraničení místní inflamatorní reakce;
- klinicky se nedostatek argininu a snížená tvorba NO projeví jako obraz terapie kortikosteroidy;
- dochází k pomalému, ale nevyhnutelnému zhoršení klinického stavu charakterizovaného rozšířením infekce (bakteriální, virové, kandidové) s málo vyjádřenou obrannou reakcí;
- výsledkem je opožděná, avšak vysoká mortalita, která není dosti často klinikem spojována s deficitem argininu.
Glutamin
Role této neesenciální, avšak ubikvitárně se v proteinech teplokrevných živočichů vyskytující aminokyseliny, je často zdůrazňována. Role glutaminu spočívá zejména v těchto funkcích:
- zdroj energie a komponenta v proteosyntéze rychle se dělících buněk a proliferujících tkání;
- prekurzor pro syntézu nukleotidů při růstu a reparaci tkání (poškozená mukóza tenkého střeva, regenerace kostní dřeně, dělící se buňky v průběhu reparace tkáně poškozené toxiny, chemoterapií, ozářením, hypoxií a traumatem).
Role glutaminu v reparačním procesu vyjadřuje obr. 1 [8].
Obr. 1. Vliv glutaminu na komplikace akutní pankreatitidy (translokace, sepse, MOF). Podle [8]. ![Vliv glutaminu na komplikace akutní pankreatitidy (translokace, sepse, MOF). Podle [8].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/7f8f6e6b7d5532d75c6a6652f19e4806.jpg)
Taurin
Význam aminokyseliny poslední dobou velmi výrazně vzrostl, protože vedle udržení a vývoje funkce sítnice se ukazuje, že má nezbytnou roli jako intracelulární aminokyselina ve stabilizaci membrán, dále působí antiarytmicky a pozitivně inotropně cestou regulace transportu kalcia. V podmínkách SIRS, aktinoterapie, chemoterapie a při expozici reaktivním formám kyslíku působí jako mohutný intracelulární antioxidant. Snižuje závažný účinek endotoxinu a potlačuje efekt TNF-α.
Treonin
Negativní účinek deficitu treoninu se projevuje zejména při rozvoji kachexie a deprivace treoninu má za následek neúměrné zvýšení neužitečné energetické potřeby. Pravděpodobným mechanizmem zvýšení energetické potřeby při deficitu treoninu je odpojení mitochondriální energetiky od ATP a změna počtu mitochondrií v játrech. V důsledku toho zvýšený přívod treoninu zřetelně zlepšuje oxidační fosforylaci a tvorbu ATP v játrech.
Cystein, cystin
Tyto fyziologicky ekvivalentní aminokyseliny obsahující síru jsou nezbytné pro tvorbu glutationu a tím se zařazují do skupiny nezbytné pro antioxidační rovnováhu a detoxikační reakce. Antioxidační efekt cysteinu je důležitý pro ochranu plic při zvýšeném riziku rozvoje šokové plíce a MODS. Cystein a cystin vyrovnávají přestřelenou inflamatorní reakci a podílejí se na inhibici virů HIV v monocytech.
Novou kapitolou v chápání akutních stavů typu MODS, SIRS je vyhodnocení role sirovodíku (H2S) jako dalšího mediátorového plynu na úrovni NO a CO (obr. 2). Tento 3. endogenní plynný transmiter [2,3] se významně uplatňuje v etiopatogenezi rozvoje MODS a SIRS a pro jeho generování je nezbytná přítomnost dostatečného množství aminokyselin obsahujících síru (cystein, cystin).
Obr. 2. Role tří plynů – NO, H<sub>2</sub>S a CO v metabolizmu. Podle [2]. ![Role tří plynů – NO, H<sub>2</sub>S a CO v metabolizmu. Podle [2].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/f5cfaae7894ecd91622a2efcf9b9b9eb.jpg)
Lipidy
Farmakonutriční účinek lipidů na vazomotoriku, fluidokoagulační rovnováhu a imunomodulaci je znám teoreticky dlouho, doznal však praktického využití až v posledním desetiletí. Mechanizmy, jakými se lipidy v regulaci fyziologických i patologických dějů uplatňují, jsou následující:
- a) ovlivnění struktury celulární a subcelulární (struktura a fluidita subcelulárních a celulárních membrán, ovlivnění aktivity enzymů, přenos buněčných signálů, tvorba lipidových mediátorů);
- b) na úrovni tkání a anatomických struktur se vliv polynesaturovaných mastných kyselin (PUFA) ω-3 a ω-6 uplatňuje zejména účinkem na vaskulární permeabilitu, viskozitu krve a vazokonstrikci v plicním i periferním řečišti, dále změnami fluidokoagulační rovnováhy.
Významnou roli hrají zejména ω-3 mastné kyseliny v potlačení rozvoje ARDS (akutní respirační distress syndrom), DIC (syndrom diseminované intravaskulární koagulace), MODS (syndrom multiorgánové dysfunkce) a SIRS (syndrom systémové zánětlivé odpovědi) svým účinkem na zlepšení krevního průtoku ve splanchnické oblasti, a tím na zlepšení funkce střevní bariéry (tab. 1). Důsledkem zlepšeného průtoku ve splanchnické oblasti je navíc pokles tvorby laktátu i při existující hypoxii. Optimální poměr ω-3 a ω-6 zároveň potlačuje nadměrnou inflamatorní reakci, produkci superoxidů a přestřelenou tvorbu NO [4]. Výsledkem je snížení mortality kriticky nemocných na translokační sepsi při porušení střevní bariéry. V dostupných studiích založených na farmakonutričním účinku tukových emulzí s vyváženým poměrem ω-6 a ω-3 byl navržen optimální poměr těchto dvou komponent v rozmezí asi 2,5–3 : 1.
Tab. 1. Účinek PUFA n-3 v klinice. 
Poněkud opomíjenou oblastí, kde však hrají polynesaturované mastné kyseliny ω-3 ve skutečnosti významnou roli, je hepatopatie spojená s parenterální výživou (tab. 2). Tento jev pozorujeme zhruba u 65 % případů syndromu krátkého střeva a méně často jako důsledek transplantace jater. Mezi další příčiny hepatopatie asociované s parenterální výživou (parenteral nutrition associated liver disease – PNALD) je exces příjmu energie, zejména ve formě sacharidů, nevyvážené aminokyselinové roztoky (přetížení metioninem) a pravděpodobně i přetížení fytosteroly obsaženými v konvenčních tukových emulzích. Polynesaturované mastné kyseliny řady ω-3 jsou vedle omezení příjmu energie parenterální výživou důležitým léčebným prostředkem, který jednak snižuje příjem fytosterolů v tukové emulzi, dále zlepšuje zánětlivou reakci jaterního parenchymu, zvyšuje mobilizaci lipidů akumulovaných v játrech a snižuje zátěž glukózou [5].
Tab. 2. Parenteral nutrition-associated liver disease (PNALD) – význam nových typů lipidových emulzí omezujících vedlejší účinky. 
Léčba sarkopenie v kritickém stavu a ve stáří
Sarkopenie (úbytek svalové hmoty) je nevyhnutelnou složkou stárnutí a projevuje se od dosažení dospělosti až do pozdního stáří. Od 40 let věku ubývá každou dekádu 5 % tělesné hmoty a po 70. roce věku se zvyšuje úbytek svalstva na každou dekádu o dalších 10 %. Z tohoto hlediska je úbytek svalstva jedním z hlavních projevů stárnutí. Bez ohledu na věk dochází k úbytku svalstva při každém těžším onemocnění, zejména pokud je spojeno s katabolizmem a tělesnou inaktivitou. V kritických stavech dochází k úbytku svalové hmoty až ve výšce 300 g za den. Sarkopenie je z tohoto hlediska jedním ze závažných projevů, který je, zejména při postižení dechového svalstva, spojen s výrazně zvýšenou mortalitou. Z tohoto hlediska je sarkopenie a její potlačení ve středu zájmu jak gerontologů, tak intenzivistů. Mezi základní prostředky snižující sarkopenii, a tím i závažné důsledky každého těžšího onemocnění je udržení dobrého stavu výživy a co nejvyšší tělesné aktivity. Nutriční podpora a rehabilitace patří z tohoto hlediska k nepostradatelným léčebným i preventivním opatřením.
Mezi nová specifická opatření typu farmakonutrice a orgánově specifické výživy patří využití β-hydroxy-β-metyl-butyrátu (HMB). Využití tohoto orgánově specifického nutrientu vychází ze skutečnosti, že rozvětvené aminokyseliny leucin, izoleucin a valin tvoří více než 1/3 svalového proteinu. Mezi nejsledovanější z těchto aminokyselin patří leucin, který má široký efekt na metabolizmus proteinů, glukózovou homeostázu a inzulinovou senzitivitu. Mechanizmus, který hraje velkou roli v pozitivním účinku leucinu na potlačení sarkopenie a zvýšení svalové hmoty, je tvorba α-ketoizokaproátu (KIC). Studie poslední doby ukazují, že hydroxymetylbutyrát vytváří antikatabolický, anabolický a lipolytický účinek, který zlepšuje energetickou rovnováhu svalu a zvyšuje jeho aerobní kapacitu. Studie z poslední doby prokazují anabolický a ergogenní účinek suplementace HMB u starých jedinců. Podání hydroxymetylbutyrátu netrénovaným starým jedincům vedlo za 8 týdnů k zvýšené výkonnosti o 13 % ve srovnání s placebem [6].
Mechanizmus účinku HMB není sice do detailu prozkoumán, předpokládá se však, že vede ke stabilizaci a zvýšení syntézy cholesterolu ve svalové sarkolemě a současně působí regulačním účinkem na ubikvitin-proteazomový komplex. Průkazný je v tomto smyslu zejména účinek HMB u nádorové kachexie s úbytkem svalové hmoty, kde byl prokázán inhibiční účinek na ubikvitin-proteazomovou proteolytickou cestu.
Nové cesty v personalizované výživě
Personalizovaná výživa jako součást širšího pojetí personalizované medicíny představuje novou cestu, která je založena na poznání individuálních rozdílů v lidském genomu a jeho expresi. Personalizovaná medicína reprezentuje využití genetiky současně s farmakologií, nutriční vědou a z genetiky odvozených „-omik“ (proteomiky, transkriptomiky, metabolomiky, lipidomiky) a dalších analogických oblastí (obr. 3).
Obr. 3. Současné z genetiky odvozené -omiky. 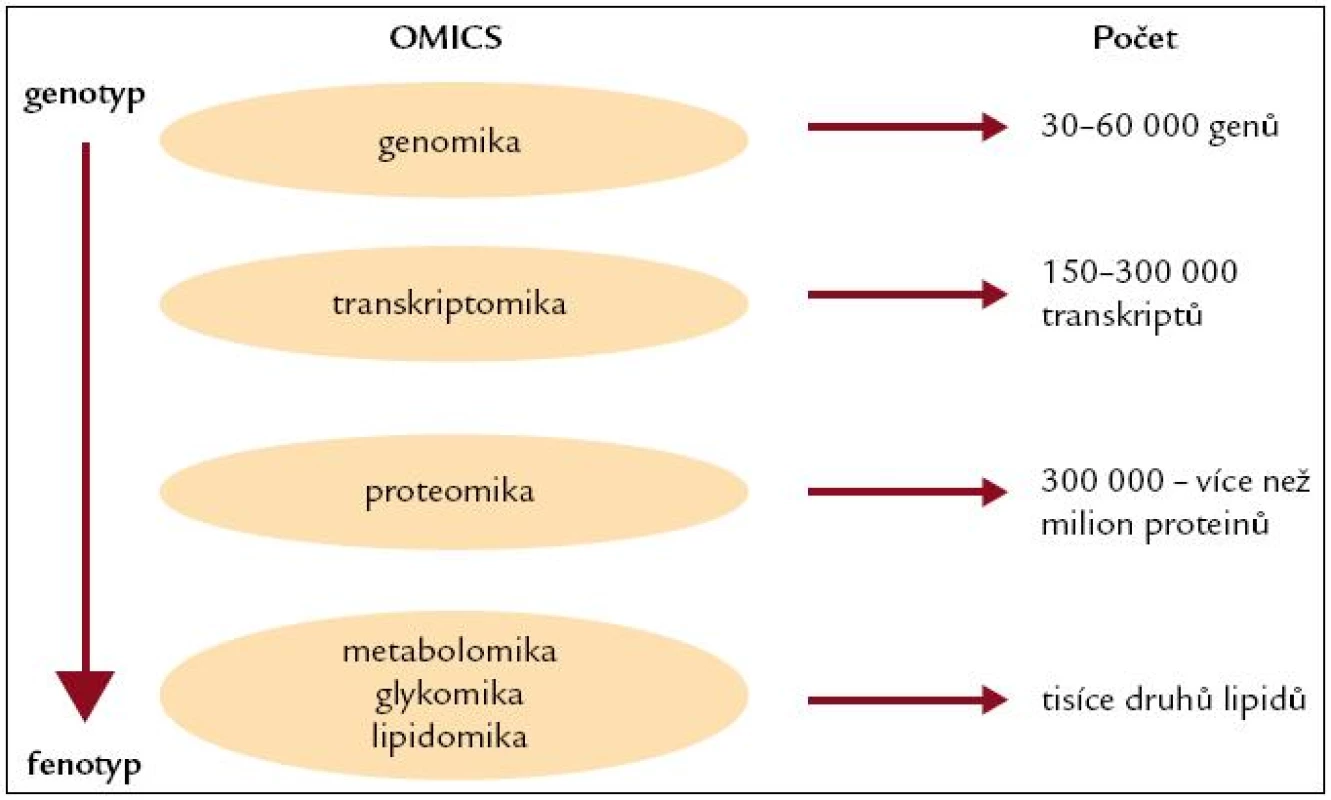
Aby personalizovaná medicína, respektive personalizovaná výživa byly prakticky použitelné a efektivní, měly by být založeny a vyvíjeny na základě zjištěných genetických odchylek jednotlivců, a tím jejich metabolických i strukturálních odlišností. Tato cesta však vyžaduje zcela odlišný přístup k laboratorní diagnostice i klinickému pojetí, které je mnohem více orientováno na jednotlivého pacienta a klinickou predikci. Z tohoto hlediska se jeví nutností nahradit dosavadní klasické laboratorní testy novým systémem, který využívá molekulární biologii a bioinformatiku.
Vzhledem k tomu, že dosavadní molekulárně biologické přístupy a praktická použitelnost bioinformatiky v klinice zatím nedovoluje rozšíření, do kliniky byl navržen hybridní způsob, který využívá fenotypické bioindikátory, jejichž kombinace s využitím role individuální variability testů pomáhá zařadit nemocného do poměrně dobře definovaného individuálního obrazu, který umožní i do značné míry individualizovanou léčbu. Takové pojetí využití kombinace klasických laboratorních testů umožňuje personalizovanou medicínu, respektive personalizovanou výživu i v oblastech, které nejsou metodami molekulární biologie a bioinformatiky dosud prakticky dostupné [7].
Závěr
Nutriční farmakologie přináší v posledních letech významný pokrok, který je jednak soustředěn na poznání metabolických reakcí v průběhu život ohrožujících stavů, jako je MODS, SIRS a DIC, jednak přináší významné rozšíření terapeutických možností. Nutriční podpora v kritických stavech se tak dostává daleko za hranici nutriční problematiky a zejména je důležité, že záhy po poznání některých patogenetických mechanizmů se rychle nutriční farmakologie orientuje na praktický vývoj dostupných prostředků jak v oblasti parenterální, tak enterální výživy. Poznání některých důležitých mechanizmů předurčujících osud nemocného, jako je např. souvislost nutričních prekurzorů s tvorbou regulačních plynů (NO, CO, H2S), jasně ukazuje, že umělá výživa a nutriční farmakologie zdaleka nepřekročily svůj zenit v praktické klinické medicíně.
Práce byla podpořena Výzkumným záměrem MZO 00179906.
prof. MUDr. Zdeněk Zadák, CSc.
www.fnhk.cz
e-mail: zadak@fnhk.cz
Doručeno do redakce: 23. 9. 2011
Zdroje
1. Aslami H, Juffermans NP. Induction of a hypometabolic state during critical illness – a new concept in the ICU? Neth J Med 2010; 68 : 190–198.
2. Li L, Hsu A, Moore PK. Actions and interactions of nitric oxide, carbon monoxide and hydrogen sulphide in the cardiovascular system and in inflammation – a tale of three gases! Pharmacol Therap 2009; 123 : 386–400.
3. Wagner F, Asfar P, Calzia E et al. Bench-to-bedside review: Hydrogen sulfide – the third gaseous transmitter: applications for critical care. Crit Care 2009; 13 : 213.
4. Mizock BA. The Multiple Organ Dysfunction Syndrome. Dis Mon 2009; 55 : 476–526.
5. Diamond IR, Pencharz PB, Wales PW. Omega-3 lipids for intestinal failure associated liver disease. Semin Pediatr Surg 2009; 18 : 239–245.
6. Vukovich MD, Stubbs NB, Bohlken RM. Body Composition in 70-Year-Old Adults Responds to Dietary β-Hydroxy-β-Methylbutyrate Similarly to That of Young Adults. J Nutr 2001; 131 : 2049–2052.
7. Guidi GC, Lippi G. Will „personalized medicine“ need personalized laboratory approach? Clin Chim Acta 2009; 400 : 25–29.
8. Zadák Z. Výživa v intenzivní péči. 2. vyd. Praha: Grada 2008.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2011 Číslo 11- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Životní jubileum prof. MUDr. Jaroslava Rybky, DrSc.
- Aktuální a budoucí možnosti léčby osteoporózy
- Chronická pankreatitida v roce 2011
- Patofyziologické podklady inkretinové léčby: dokáže ještě více, než si myslíme?
- Jak se dívat na psychosomatickou medicínu
- Možnosti plnění mezinárodních doporučení terapie syndromu diabetické nohy v České republice
- Antibiotická léčba akutních bakteriálních infekcí
- Inkretiny změnily a dále mění strategii léčby diabetu 2. typu
- Moderní technologie v diabetologii. CSII (kontinuální subkutánní infuze inzulinu) a CGM (kontinuální glykemický monitoring) v klinické praxi
- Lze zpomalit rentgenovou progresi ankylozující spondylitidy?
- Inzulinová léčba v roce 2011
- Genetika monogénových foriem diabetu
- Terapie obezity – postupy, účinnost a perspektivy
- Patogeneze diabetes mellitus 1. a 2. typu v roce 2011 – jednotící model poruchy glykoregulace
- Nahlédnutí do budoucnosti farmakoterapie diabetes mellitus 2. typu
- Pharmacotherapy of chronic heart failure after the first decade of 21st century
- Farmakoterapie po srdečním infarktu
- Pokroky v metabolizmu a výživě 2011 a cesta k personalizované léčbě
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Antibiotická léčba akutních bakteriálních infekcí
- Moderní technologie v diabetologii. CSII (kontinuální subkutánní infuze inzulinu) a CGM (kontinuální glykemický monitoring) v klinické praxi
- Terapie obezity – postupy, účinnost a perspektivy
- Genetika monogénových foriem diabetu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



