-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vplyv dlhodobej glykemickej kompenzácie na zmeny v lipidovom profile detí a adolescentov s diabetes mellitus 1. typu
Impact of long-term glycemic control on changes of lipid profile in children and adolescents with 1 type diabetes mellitus
Introduction:
Abnormalities in lipid metabolism contribute significantly to the increased occurrence of cardiovascular events in individuals with T1DM compared to healthy subjects. Disorder of lipid metabolism in T1DM is heavily dependent on maintaining of blood glucose values near the physiological range. DCCT study confirmed that patients with well compensated diabetes have similar lipid spectrum to the healthy subjects one.Aims:
We aimed to study relations of lipid profile parameters (cholesterol of high density HDL, cholesterol of low density LDL, total cholesterol - TC, triglycerides - TAG) to age, duration of T1DM (DD), blood glucose, HbA1c and if the blood pressure (BP), BMI corrected for age (BMIc) and daily insulin doses per kilogram (DI) in 30 patients with T1DM with good long-term glycemic compensation. We aimed also to find mathematical models of lipid profile parameters dependence of the parameters of glycemic control, age, duration of DM1T, blood pressure (systolic and diastolic BPs, BPd, respectively) BMIc and DI.Results:
HbA1c levels were significantly higher in diabetic patients compared to controls (p < 0.01), HDL were higher in diabetics than in controls (not significantly). LDL levels were in diabetics similar to controls. TAG was significantly lower in diabetics than in controls (p < 0.01). HDL significantly positively correlated with HbA1c (r = 0.372, p < 0.05) and negatively with BPs (r = -0.373, p < 0.05), TAG correlated with age (r = 0.546, p < 0.01), DD (r = 0.577, p < 0.001) and BPs (r = 0.407, p < 0.05). We also found a statistically appropriate mathematical models of the relationship of HDL and TAG with the parameters: age, DD, glucose, HbA1c, BP, BMIc, DI (r = 0.785, r2 = 0.616, p < 0.01, R = 0.758; r2 = 0.574, p < 0.05, respectively).Conclusion:
The changes in HDL and TAG values in juvenile diabetics are significantly affected by particularly long-term glycemic control and insulin therapy.Key words:
HbA1c - total cholesterol - HDL - LDL - triglycerides - blood pressure - insulin doses
Autoři: J. Kostolanská 1; V. Jakuš 2; Ľ. Barák 3; A. Staníková 4
Působiště autorů: I. detská klinika Lekárskej fakulty UK a DFNsP Bratislava, Slovenská republika, prednostka doc. MUDr. Oľga Červeňová, PhD. 1; Ústav lekárskej chémie, biochémie a klinickej biochémie Lekárskej fakulty UK Bratislava, Slovenská republika, prednostka prof. Ing. Zdeňka Ďuračková, PhD. 2; Detské diabetologické centrum SR pri I. detskej klinike UK a DFNsP Bratislava, Slovenská republika, vedúci pracoviska MUDr. Ľubomír Barák, CSc. 3; Detská otorinolaryngologická klinika Lekárskej fakulty UK a DFNsP Bratislava, Slovenská republika, prednostka prof. MUDr. Janka Jakubíková, CSc. 4
Vyšlo v časopise: Vnitř Lék 2011; 57(6): 533-539
Kategorie: Původní práce
Souhrn
Úvod:
Abnormality v metabolizme lipidov výrazne prispievajú k zvýšenému výskytu kardiovaskulárnych príhod u osôb s DM1T v porovnaní so zdravými jedincami. Porucha metabolizmu lipidov pri diabete 1. typu je výrazne závislá od udržiavania hodnoty glykémie blízko fyziologického rozmedzia. Štúdia DCCT potvrdila, že pacienti s dobre kompenzovaným DM1T majú podobné lipidové spektrum ako zdraví jedinci.Cieľ:
Cieľom práce bolo preskúmať u 30 pacientov s DM1T s dobrou dlhodobou glykemickou kompenzáciou vzťahy parametrov lipidového profilu (cholesterol s vysokou hustotou HDL, cholesterol s nízkou hustotou LDL, celkový cholesterol – TC, triacylglyceroly – TAG) k veku, trvaniu DM1T, glykémii, HbA1c a k hodnotám krvného tlaku (TK), BMI korigovanému na vek (BMIc) a denným dávkam inzulínu na kg hmotnosti (DI) a tiež stanoviť matematické modely závislosti týchto parametrov od glykemickej kompenzácie, veku, trvania DM1T, krvného tlaku systolického a diastolického (TKs, resp. TKd), BMIc a DI.Výsledky:
Hodnoty HbA1c boli signifikantne vyššie u diabetikov v porovnaní s kontrolami (p < 0,01), HDL boli vyššie u diabetikov ako u kontrol (rozdiel nie je signifikantný). LDL boli u diabetikov podobné ako u kontrol. TAG boli signifikantne nižšie u diabetikov ako u kontrol (p < 0,01). HDL signifikantne pozitívne koreluje s HbA1c(r = 0,372; p < 0,05), negatívne s TKs (r = –0,373, p < 0,05), TAG s vekom (r = 0,546, p < 0,01), trvaním DM1T (r = 0,577, p < 0,001) a s TKs (r = 0,407, p < 0,05). Našli sme tiež štatisticky vhodné matematické modely vzťahu HDL a TAG so sledovanými parametrami: vek, trvanie DM1T, glykémia, HbA1c, TK, BMIc, DI (r = 0,785; r2 = 0,616; p < 0,01; resp. r = 0,758; r2 = 0,574; p < 0,05).Záver:
Na zmeny v hodnotách HDL a TAG u mladých diabetikov má významný vplyv najmä dlhodobá glykemická kompenzácia a inzulínová terapia.Kľúčové slová:
HbA1c – celkový cholesterol – HDL – LDL – triacylglyceroly – krvný tlak – dávky inzulínuÚvod
Dyslipidémie zahrňujú kvantitatívne i kvalitatívne abnormality lipoproteínov, včítane zmien rôznych tried a podtried lipoproteínov v dôsledku modifikácie glykáciou a oxidáciou a zmien v zložení a pomere lipidov a proteínov [1].
Kvalitatívne a kvantitatívne abnormality lipidov sú často prítomné u pacientov s diabetom 1. typu (DM1T) [2].
Napriek tomu, že u ľudí s DM1T bez inzulínovej rezistencie je nižší výskyt obezity, hypertenzie a dyslipidémií ako u osôb s DM2T, existuje u nich po celý život riziko kardiovaskulárnych chorôb (KVCH) [3].
Koncentrácie lipidov sú úzko spojené nielen s rizikom makrovaskulárnych ochorení (ischemická choroba srdca – ICHS, cievna mozgová príhoda a periférne cievne ochorenia), ale tiež s rizikom mikrovaskulárnych komplikácií, ako sú nefropatia – DNF, retinopatia – DR a neuropatia – DNP [1,2,4]. Mnohé štúdie však ukazujú, že abnormálne hladiny lipidov a aterogénne zmeny v zložení lipoproteínov, a to aj pri relatívne krátkom trvaní choroby (DD), možno pozorovať už u mladých pacientov s DM1T [4,5]. Glykémia je dôležitým prostredníkom týchto abnormalít. Dôsledná kontrola glykémie znižuje pravdepodobnosť vývinu mikrovaskulárnych diabetických komplikácií (DK) a tiež subklinických a klinických makrovaskulárnych ochorení [3] a prináša dlhodobý osoh adolescentom s DM1T [4,5]. U dospelých osôb s diabetom je zloženie lipoproteínov viac aterogénne ako u zdravých [5]. Podľa niektorých autorov optimalizácia glykémie obvykle obnoví normálne koncentrácie lipoproteínov, nie však ich normálne kvalitatívne vlastnosti [6].
Úloha lipoproteínov v rozvoji diabetických komplikácií
Jednoznačne sa preukázala primárna úlohu celkového cholesterolu (TC) a LDL-cholesterolu (LDL) v rozvoji aterosklerotickej ICHS. Viaceré štúdie potvrdili závažnosť cholesterolu ako najdôležitejšieho prediktora ICHS, a tiež fakt, že s aj malým poklesom koncentrácie TC klesá aj riziko ICHS [7]. Zvýšené koncentrácie cholesterolu sú prediktívne vo vzťahu k progresii obličkových ochorení [8], dôsledkom ktorých môžu byť u pacientov s DM1T diabetické retinopatie. Pokročilá DR môže byť indikátorom renálneho postihnutia a pokročilá DNF môže akcelerovať progresiu DR [1]. Uvádza sa recipročný vzťah medzi prítomnosťou DR a DNF, takzvaný retino-renálny syndróm [9].
Počiatočná liečba pacientov s diabetom, ktorí majú vysoké hladiny TC, je zameraná na zníženie hladín LDL [10], čo má pozitívny vplyv na morbiditu a mortalitu v diabetickej populácii [1,11-13]. Zvýšená hladina LDL je rizikovým faktorom schopným podmieniť rozvoj aterosklerózy u experimentálnych zvierat a u ľudí pravdepodobne aj bez prítomnosti iných známych rizikových faktorov [7]. Hyperglykémia môže priamo zvýšiť oxidačný stres a opäť podporiť oxidáciu LDL [1], ktorý je obzvlášť citlivý na modifikácie spôsobené hyperglykémiou a oxidačným stresom a ľahko podlieha neenzýmovej glykácii a peroxidácii. Glykovaný LDL sa hneď po extravazácii hromadí, zotrváva v stenách ciev a ďalej zvyšuje pravdepodobnosť oxidácie. Modifikované LDL častice sú potom vychytávané makrofágmi, čo podporuje tvorbu penových buniek [6]. Tieto mechanizmy môžu byť rozhodujúce pri vývine DK.
HDL častice majú okrem transportnej funkcie lipidov aj ďalšie antiaterogénne funkcie, vrátane antioxidatívnych, antitrombotických a protizápalových [7,14]. Aj keď populačné štúdie naznačujú, že vysoká hladina HDL je vo všeobecnosti protektívna pred ICHS, u niektorých pacientov vysoké HDL nepotvrdzujú kardioprotektivitu. Je známych niekoľko genetických príčin vysokých hladín HDL. Ďalej HDL častice sú vysoko heterogénne a výrazne sa navzájom líšia veľkosťou, skladbou a funkčnosťou. Za určitých okolností môže dokonca dôjsť k tvorbe abnormálnych častíc HDL s prozápalovými a proaterogénnymi vlastnosťami. Takéto častice sa podieľajú na patofyziológii aterosklerózy viacerými komplexnými mechanizmami, ktoré nie sú doteraz jednoznačne vysvetlené [7,14,15]. To naznačuje, že viac ako kvantitatívne stanovenie HDL je dôležité poznať jeho zloženie. K tomu by mohlo napomôcť využitie novej metódy, ktorá umožňuje vyhodnotiť aterogénne a neaterogénne lipoproteínové entity a tiež lipoproteíny s neistou aterogenicitou [16].
TAG majú úzky vzťah k metabolizmu a zloženiu častíc HDL a LDL [7]. Obézne deti i dospelí majú často zvýšené koncentrácie TAG a znížené HDL v sére.
Zloženie lipoproteínov je spojené s obezitou [17], ktorá je taktiež jedným z rizikových faktorov aterosklerózy [18]. Obezita má dôležitú úlohu i pri vývine DNF [19], s ktorou býva často spojená hypertenzia. Aby pacienti s DM1T predchádzali DK, ich liečba sa zameriava v prvom rade na dosiahnutie dlhodobej dobrej kompenzácie diabetu, čím sa podstatne znižuje riziko vývinu DK. Dôležitá je tiež antiagregačná a hypolipidemická liečba. Pozornosť je však potrebné venovať aj predchádzaniu obezite a kontrole hypertenzie [20,21]. Plné pochopenie patogenézy a identifikácia vysoko-rizikových diabetikov pomôže zlepšiť terapeutické možnosti a tým aj prognózu chorého [22].
Cieľ práce
V našej práci sme sa zamerali na pacientov s dlhodobo dobrou glykemickou kompenzáciou, u ktorých sme chceli stanoviť vzťah lipoproteínov k veku (A), DD, ku glykemickej kompenzácii, reprezentovanej hodnotami glykémie (G), HbA1c a priemerom HbA1c za posledné 2 roky, TK, BMIc, a tiež sme chceli zistiť vplyv inzulínovej liečby na lipidový status u týchto pacientov. Inzulínová liečba je reprezentovaná dennými dávkami inzulínu nakg hmotnosti (DI).
Súbory a metódy
Súbor pacientov tvorí 30 detí a adolescentov vo veku 15,5 (10,8; 16,9) rokov, z toho je 18 chlapcov vo veku 15,6 (9,9; 17,5) rokov a 12 dievčat vo veku 15,4 (11,9; 16,8) rokov. Pacienti majú DM1T najmenej 5 rokov, priemerné hodnoty HbA1c za posledné 2 roky neprekročili 8,5 % a hodnoty glykémie po jedle boli najviac 12 mmol/l. Z tejto skupiny 5 pacientov má inzulínovú pumpu. Kontroly tvorí 16 zdravých detí vo veku 13,5 (10,7; 16,0) rokov.
BMI bol korigovaný na vek podľa Pfizer, Czech republic [23].
HbA1c bolo merané pomocou HPLC podľa kalibrácie NGSP na Oddelenie laboratórnej medicíny DFNsP Bratislava (D-10, BioRAD, USA), TC, HDL, LDL a TAG boli stanovené z čerstvého séra enzýmovými metódami na Oddelenie laboratórnej medicíny DFNsP Bratislava ako súčasť bežného vyšetrenia.
Normalitu distribúcie dát sme testovali pomocou Shapiro-Wilkovho testu. Dáta sme porovnávali v prípade súborov s normálnou distribúciou pomocou nepárového Studentovhot-testu (výsledky sú prezentované ako priemer ± SD), ak nebola splnená podmienka normality distribúcie u oboch porovnávaných súborov, použili sme Mann-Whitneyho neparametrický test (výsledky sú prezentované ako medián – 1. kvartil; 3. kvartil). Korelácie a vzťahy medzi parametrami sme zisťovali pomocou Pearsonovho korelačného koeficientu. Štatistická signifikancia bola stanovená ako p < 0,05. Na štatistické spracovanie údajov sme použili programy Excel 2003, BioSTAT 2009 a Origin 8.
Výsledky
Klinické a biochemické parametre pacientov s DM1T a zdravých kontrol sú uvedené v tab. 1. Z našich pacientov podľa [23] je 1 obézny a 3 majú nadhmotnosť. Hodnoty HbA1c sú signifikantne vyššie u pacientov s DM1T ako u kontrol (7,70 ± 0,69 vs 4,5 ± 0,26; p < 0,01; tab. 1), hodnoty TC sú mierne zvýšené u pacientov s DM1T v porovnaní s kontrolami, rozdiel nie je signifikantný. Hodnoty LDL sú nesignifikantne nižšie u pacientov s DM1T ako u kontrol. HDL sú vyššie u DM1T ako u kontrol (rozdiel taktiež nie je signifikantný; tab.1, obr. 1) a TAG sú signifikantne nižšie u pacientov s DM1T v porovnaní s kontrolami [0,76 (0,59; 0,95) vs 1,07 (0,91; 1,19); p < 0,01; tab. 1, obr. 2]. V žiadnom zo sledovaných parametrov neboli signifikantné rozdiely v sledovaných parametroch medzi chlapcami a dievčatami s DM1T, HbA1c, TC a HDL nadobúdali dokonca identické priemerné hodnoty (HbA1c: 7,7 ± 0,6 vs 7,7 ± 0,8 %; p > 0,05; TC: 4,04 ± 0,75 vs 4,04 ± 0,55 mmol/l; p > 0,05; HDL: 1,59 ± 0,52 vs 1,59 ± 0,25 mmol/l; p > 0,05).
Tab. 1. Porovnanie sledovaných parametrov u pacientov s DM1 a kontrol. 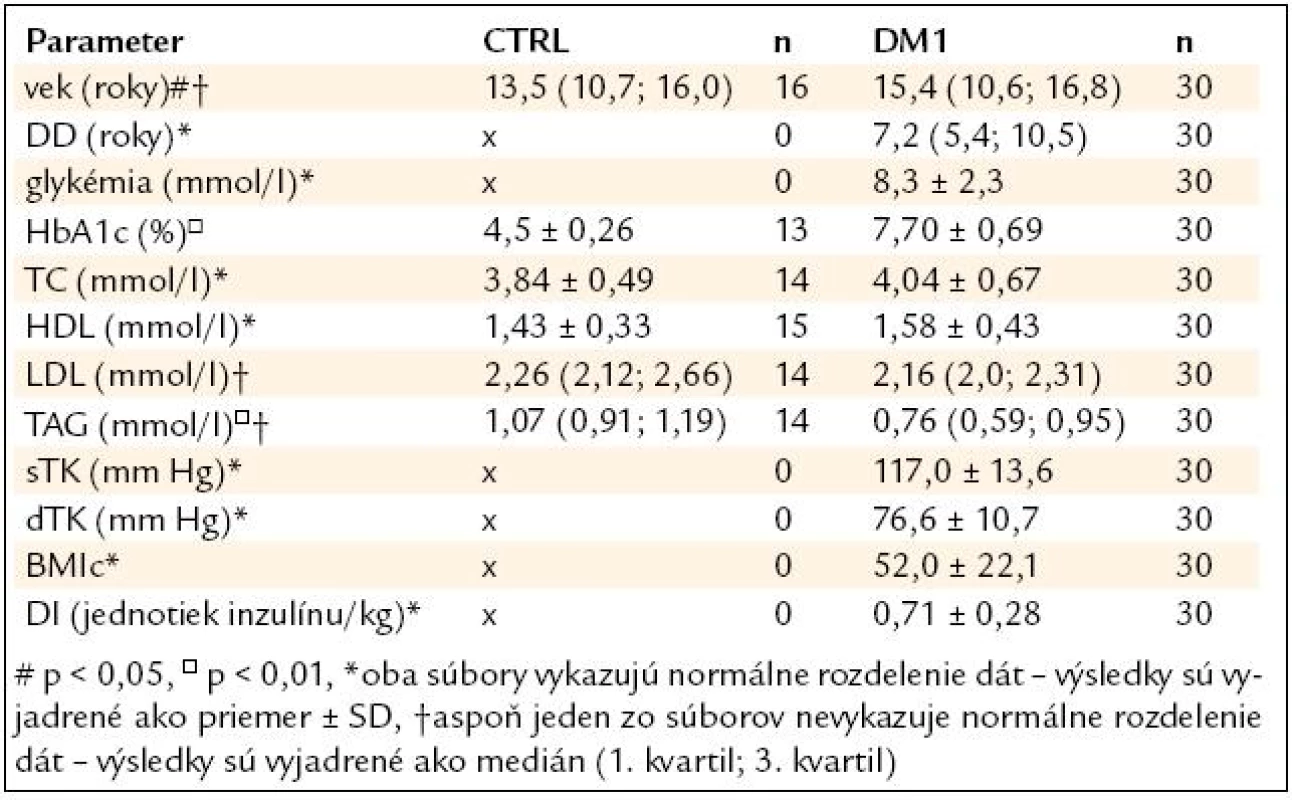
Obr. 1. Hodnoty HDL u detí a adolescentov s DM1T (n = 30) a kontrol (n = 15). Pacienti s DM1T majú HDL vyššie ako zdraví jedinci (1,58 ± 0,43 vs 1,43 ± 0,33), avšak rozdiel nie je štatisticky signifikantný. 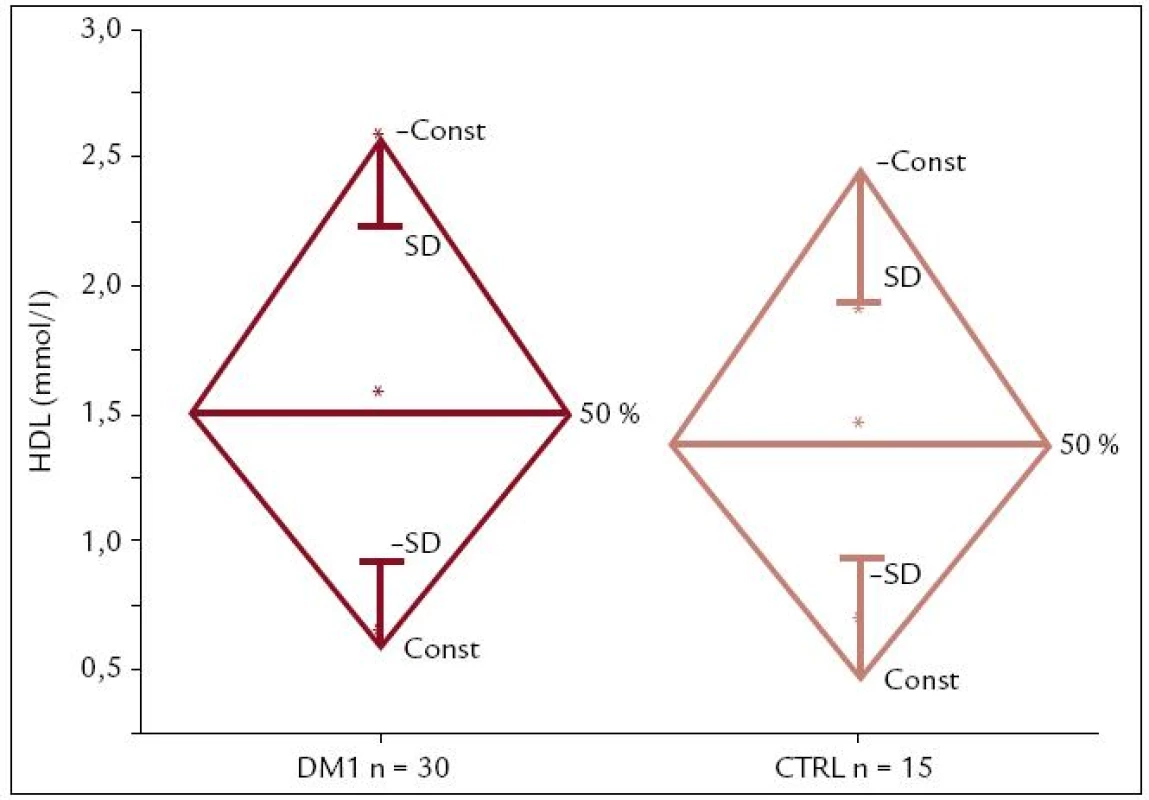
Obr. 2. Hodnoty TAG u detí a adolescentov s DM1T (n = 30) a kontrol (n = 14). Pacienti s DM1T majú TAG signifikantne nižšie ako zdraví jedinci [0,76 (0,59; 0,95) vs 1,07 (0,91; 1,19); p < 0,01]. ![Hodnoty TAG u detí a adolescentov s DM1T (n = 30) a kontrol (n = 14).
Pacienti s DM1T majú TAG signifikantne nižšie ako zdraví jedinci [0,76 (0,59; 0,95) vs 1,07 (0,91; 1,19); p < 0,01].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/c206296163bf8b1d765a034d21af7048.jpeg)
Vzťahy a korelácie medzi sledovanými parametrami sú uvedené v tab. 2. U pacientov s DM1T HDL signifikantne pozitívne korelovali s HbA1c(r = 0,378; p < 0,05; tab. 2, obr. 3), a negatívne s vekom (r = –0,620; p < 0,001) a s TKs (r = –0,373; p < 0,05). Našli sme signifikantnú pozitívnu koreláciu TAG s vekom (r = 0,546, p < 0,01; tab. 2), DD (r = 0,577, p < 0,001; tab. 2) a s TKs (r = 0,407; p < 0,05; tab. 2). Paradoxne priemerné hodnoty HbA1c za posledné 2 roky signifikantne pozitívne korelovali s DI (r = 0,442; p < 0,05; tab. 2) a BMIc negatívne s priemernými hodnotami HbA1c za posledné 2 roky (r = –0,491; p < 0,05; tab. 2) a s DI (r = –0,394; p < 0,05; tab. 2).
Tab. 2. Vzťahy a korelácie medzi sledovanými parametrami u pacientov s DM1 a kontrol. 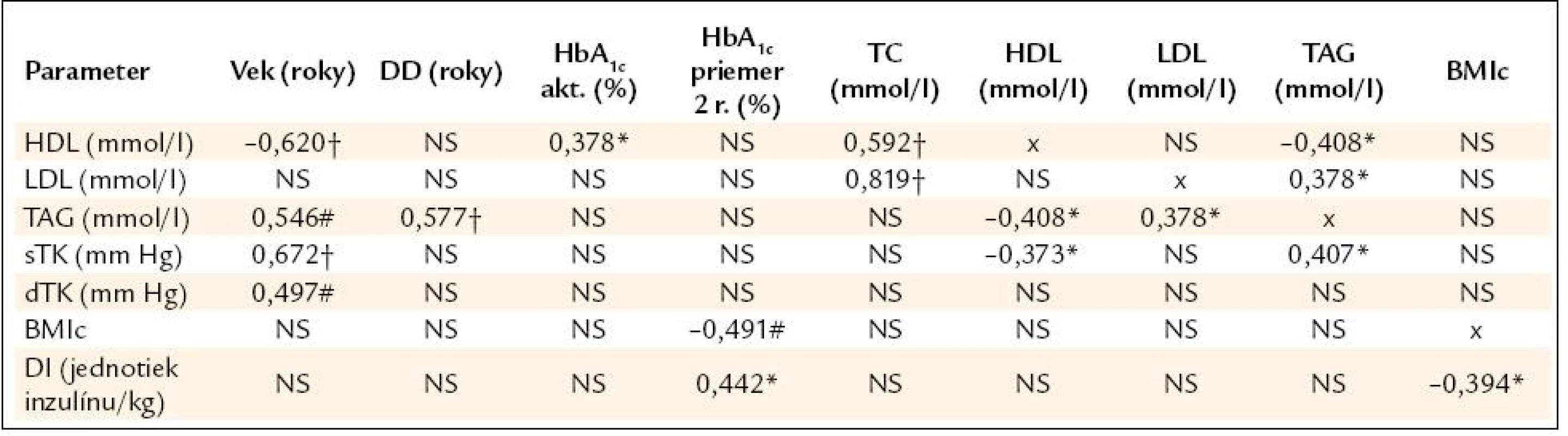
V tabuľke sú uvedené Pearsonove korelačné koeficienty r. *p < 0,05, #p < 0,01, †p < 0,001, NS – vzťah nie je štatisticky signifikantný, p > 0,05. Obr. 3. Korelácia HDL s HbA<sub>1c</sub> u detí a adolescentov s DM1T. Našli sme slabú, avšak štatisticky signifikantnú pozitívnu koreláciu HDL s aktuálnymi hodnotami HbA<sub>1c</sub> (r = 0,378; p < 0,05; n = 30). 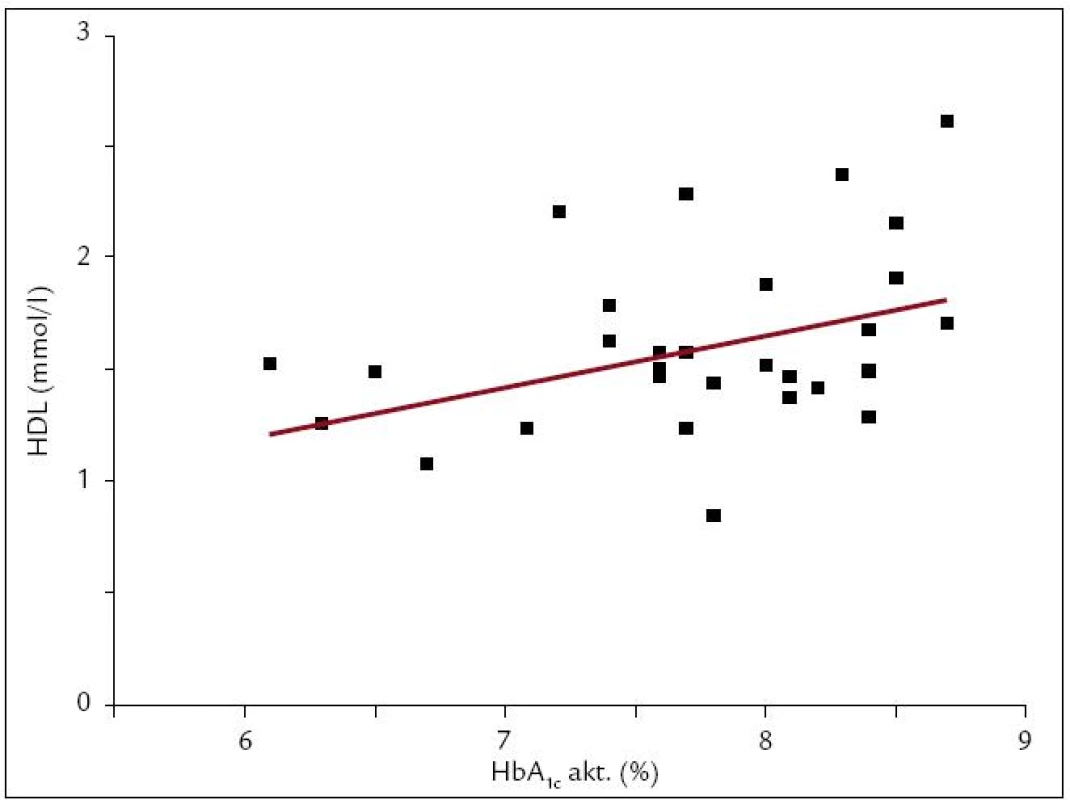
Našli sme regresnú polynomickú funkciu 2. stupňa HDL (y) a HbA1c (x):
y = 9,6881 – 2,4397*x + 0,1786*x2(r = 0,441, r2 = 0,194; p = 0,05; obr. 4).
Obr. 4. Polynomická funkcia 2. stupňa medzi HDL a HbA<sub>1c</sub>. Medzi HDL (y) a aktuálnymi hodnotami HbA<sub>1c</sub> (x) sme našli vzťah: y = 9,6881 – 2,4397*x + 0,1786*x<sup>2</sup> (r = 0,441, r<sup>2</sup> = 0,194; p = 0,05; n = 30). Zisťovali sme priebeh funkcie a ďalšími matematickými výpočtami sme zistili, že HDL stúpa so stúpajúcim HbA<sub>1c</sub> do hodnoty HbA<sub>1c</sub> = 6,8 %, od tejto hodnoty HDL so stúpajúcim HbA<sub>1c</sub> klesá. Nakoľko táto skupina pacientov bola definovaná ako taká, kde HbA<sub>1c</sub> ≤ 8,5 %, HDL klesá so stúpajúcim HbA<sub>1c</sub> v intervale (6,8; 8,5) %. 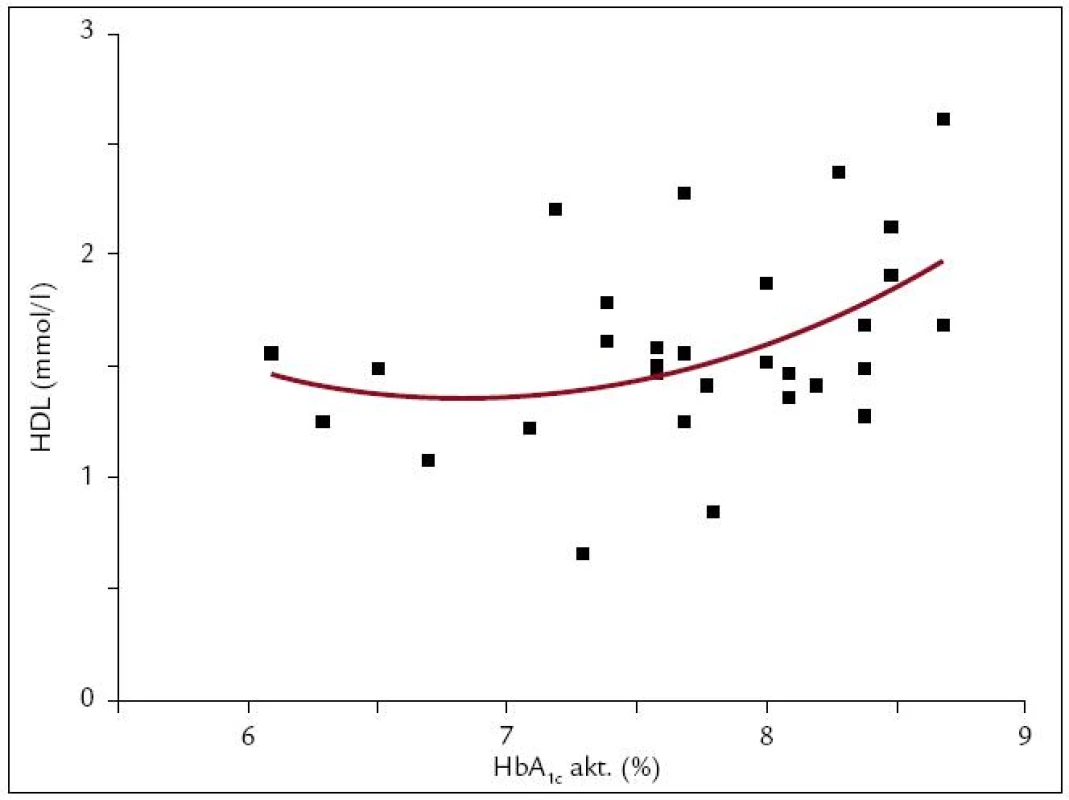
Ďalšími matematickými výpočtami sme dospeli k poznatku, že funkcia rastie v intervale HbA1c od 6,8 do 8,5 %. Regresné rovnice TC, LDL a TAG ako funkcie HbA1c neboli štatisticky vhodné (p > 0,05).
Našli sme štatisticky vhodný matematický model vzťahu HDL k zmenám veku, trvania DM (DD), glykémie (G), HbA1c (H), priemerných hodnôt HbA1c za posledné 2 roky (Hp), TKs a TKd, BMIc a DI:
HDL = 0,401 – 0,082*A + 0,022*DD + 0,033*G + 0,300*H – 0,125*Hp + 0,008*TKd + 0,003*BMIc – 0,258*DI (r = 0,785; r2 = 0,616; p < 0,01), a tiež TAG k zmenám uvedených parametrov:
TAG = –0,111 + 0,008*A + 0,048*DD + 0,002*G – 0,103*H + 0,116*Hp + 0,014*TKs – 0,016*TKd – 0,002*BMIc – 0,056*DI (r = 0,758; r2 = 0,574; p < 0,05).
Nenašli sme štatisticky vhodné matematické modely závislosti zmien TC a LDL od nelipidových sledovaných parametrov.
Diskusia
Viaceré naše výsledky korešpondujú s výsledkami štúdie [5], ktorá prezentuje hladiny lipoproteínov u pacientov s DM1T priaznivejšie ako u kontrol. V našej práci mali osoby s DM1T vyššie hladiny TC ako kontroly (rozdiel nebol štatisticky významný) a signifikantne nižšie hodnoty TAG v porovnaní so zdravými jedincami. Vohnout a Rašlová [7] uvádzajú, že po liečbe dochádza u ich pacientov k zvýšeniu HDL, a súčasne k podstatnému zníženiu TAG. Podľa týchto autorov, a tiež podľa [10,24], sa často využíva na zníženie vysokých hladín TAG liečba, ktorou sa dosiahne zvýšenie HDL. U našich dobre kompenzovaných pacientov s DM1T sú priaznivé hodnoty TAG sprevádzané priaznivými hodnotami HDL, čo korešponduje s prácou [5], kde sú vyššie HDL a nižšie TAG vysvetlené ako dôsledok dobrej glykemickej kontroly alebo intenzívnej inzulínovej terapie. TAG sú hydrolyzované enzýmom lipoproteínovou lipázou (LPL), ktorá je indukovaná v tukovom tkanive inzulínom, preto je inzulínová terapia spojená so značným poklesom TAG. Vohnout a Rašlová [7] vysvetľujú vyššie hladiny HDL ako možný dôsledok prítomnosti abnormálnych častíc HDL, ktoré majú nie protektívne, ale pozápalové a proaterogénne účinky, avšak u našich pacientov takéto abnormality nepredpokladáme. Podľa autorov [24] u pacientov s DM1T, ktorí nemajú DNF, nemusí byť zvýšené riziko ICHS. U osôb s DM1T je toto riziko spojené s vysokými hladinami LDL, avšak táto asociácia je evidentná len za prítomnosti klinickej albuminúrie. Liečba zameraná na zníženie LDL sa podľa týchto autorov odporúča u tých pacientov, ktorí už majú makrovaskulárne komplikácie, alebo u diabetikov 1. typu bez makrovaskulárneho postihnutia, ale s prítomnou klinickou albuminúriou alebo s inými rizikovými faktormi poukazujúcimi na zvýšené kardiovaskulárne riziko. V našej práci majú pacienti s DM1T hladiny LDL dokonca nižšie ako kontroly a takáto liečba zatiaľ u nich nebola potrebná.
Porovnanie hladín lipoproteínov v našej práci vyznieva skôr v prospech osôb s DM1T ako kontrol. Vysvetlením by mohlo tiež byť na jednej strane prísne a dlhodobé dodržiavanie diéty a pohybovej aktivity našej skupiny osôb s DM1T (z nášho súboru 23 pacientov podľa vyjadrenia ich rodičov dodržiava diétu, u 6 boli zistené v dodržiavaní diétneho režimu občasné drobné chyby a potreba dozoru rodičov; 19 pacientov má dostatok pohybu, 6 má pohybové aktivity na strednej úrovni, resp. bola zistená potreba dozoru rodičov, 1 pacient má pohybu málo a u ostatných nie sú uvedené pohybové aktivity), na druhej strane konzumácia potravy bohatšej na tuky u kontrol pred odbermi.
Petitti et al [4] našli u dobre kompenzovaných pacientov s DM1T signifikantné korelácie LDL a TAG s HbA1c – obe pozitívne. V našej práci sú vzťahy LDL a TAG s HbA1c taktiež pozitívne, avšak nie sú štatisticky významné. V štúdii [4] na rozdiel od nás zistili tiež nesignifikantný pozitívny vzťah HDL s HbA1c v skupine mladých pacientov s DM1T s nízkymi hodnotami HbA1c, hodnoty HDL veľmi slabo stúpali so stúpajúcim HbA1c, v našej práci je sklon korelačnej priamky vyšší a korelácia je signifikantná, avšak žiadnu inú štúdiu s pozitívnou koreláciou HDL s HbA1c sme nenašli. Je známe, že u osôb s DM1T vplyvom hyperglykémií dochádza ku glykácii, glykooxidácii a oxidácii biogénnych molekúl, a na tieto reakcie je citlivý najmä LDL, čo vedie k vývinu neskorších DK. Zvýšený HDL so stúpajúcim HbA1c v našej skupine pacientov by mohla byť aj kompenzačná reakcia organizmu – snaha chrániť sa pred účinkami glykačných a oxidačných reakcií. U zle kompenzovaných osôb s DM1T v žiadnej práci sme takýto korelačný vzťah nenašli a tiež v našich predošlých štúdiách u zle kompenzovaných pacientov boli korelácie HDL s HbA1c negatívne. Ladeia et al [25] našli signifikantné pozitívne korelácie TC a TAG s HbA1c, kým v našej práci je signifikantná len korelácia HDL s HbA1c. Našli sme tiež polynomickú funkciu 2. stupňa medzi HDL a HbA1c. Matematickým výpočtom sme zistili, že táto funkcia má klesajúci charakter do hodnoty HbA1c = 6,8 % a od tejto hodnoty nadobúda stúpajúci trend, čo by aj zodpovedalo pozitívnej lineárnej korelácii. Keďže skupina pacientov je definovaná tak, že HbA1c ≤ 8,5 %, stúpajúci charakter funkcie je obmedzený touto hodnotou. V našej predošlej práci sme u zle kompenzovaných pacientov s DM1T našli negatívnu koreláciu medzi týmito parametrami, čo potvrdzuje náš predpoklad, že HDL má stúpajúci trend len u dobre kompenzovaných mladých pacientov. Podľa našich výsledkov zmeny HbA1c značne ovplyvňujú zmeny v HDL, ale tiež zmeny v DI majú významný vplyv, a štatisticky vhodný matematický model, ktorý sme našli, môže vysvetľovať viac ako 60 % variabilít [26].
Naši pacienti majú podobne ako v štúdii [25] signifikantne nižšie TAG ako kontroly. Myslíme si, že tento jav je spojený s priaznivými hodnotami HDL u tejto skupiny, čo naznačuje aj signifikantná negatívna korelačná závislosť medzi týmito parametrami (r = –0,408; p < 0,05). Ladeia et al [25] prezentujú tiež korelácie TAG s trvaním DM a DI, čo sme u našich pacientov nezistili, avšak podobne ako v uvedenej štúdii, aj v našej práci sme našli signifikantnú negatívnu koreláciu DI s BMI. V našej práci TAG signifikantne korelujú z nelipidových parametrov len s vekom a trvaním choroby, nenašli sme ani štatisticky významnú polynomickú funkciu 2. stupňa závislosti TAG a HbA1c. Našli sme však štatisticky vhodný matematický model, ukazujúci vplyv zmien všetkých sledovaných nelipidových parametrov na zmeny v TAG, ktorým je možné vysvetliť 57,4 % variabilít [26].
Záver
Pri sekundárnych dyslipidémiách u detí pediatri často uvažujú o farmakologickej liečbe, ktorá je vzhľadom k veku a nežiaducim vedľajším účinkom hypolipidemík kontraindikovaná. Naša štúdia naznačuje, že deti a adolescenti s DM1T, ktorí si dlhodobo udržujú dobrú glykemickú kompenzáciu, mávajú hladiny lipoproteínov v normálnom rozmedzí. K tomu výrazne prispievajú najmä inzulínová liečba a zdravý spôsob života, ktorý je spojený s dodržiavaním predpísaného diétneho a pohybového režimu. Odstránenie sekundárnej príčiny porúch lipoproteínov u pacientov s DM1T vedie k úprave parametrov lipidového metabolizmu, čo im tiež môže pomôcť vyhnúť sa vývinu neskorších komplikácií vrátane ICHS.
Práca bola podporovaná grantom Vega 1-0375-09 a jej časť bola odprezentovaná na 46. Diabetologických dňoch v Luhačoviciach (ČR) formou posteru.
Ing. Jana Kostolanská, PhD.
www.dfnsp.sk
e-mail: j.kostolanska@gmail.com
Zdroje
1. Wu M, Chen Y, Wilson K et al. Intraretinal leakage and oxidation of LDL in diabetic retinopathy. Invest Ophthalmol Vis Sci 2008; 49 : 2679-2685.
2. Marcovecchio ML, Dalton RN, Prevost AT et al. Prevalence of abnormal lipid profiles and the relationship with the development of microalbuminuria in adolescents with type 1 diabetes. Diabetes Care 2009; 32 : 658-663.
3. Skyler JS, Bergenstal R, Bonow RO et al. American Diabetes Association; American College of Cardiology Foundation; American Heart Association. Intensive Glycemic Control and the Prevention of Cardiovascular Events: Implications of the ACCORD, ADVANCE, and VA Diabetes Trials: a position statement of the American Diabetes Association and a scientific statement of the American College of Cardiology Foundation and the American Heart Association. Circulation 2009; 119 : 351-357.
4. Petitti DB, Imperatore G, Palla SL et al. SEARCH for Diabetes in Youth Study Group. Serum lipids and glucose control: the SEARCH for Diabetes in Youth study. Arch Pediatr Adolesc Med 2007; 161 : 159-165.
5. Guy J, Ogden L, Wadwa RP et al. Lipid and lipoprotein profiles in youth with and without type 1 diabetes: The search for diabetes in youth case-control study. Diabetes Care 2009; 32 : 416-420.
6. Sánchez-Quesada JL, Pérez A, Caixàs A et al. Effect of glycemic optimization on electronegative low-density lipoprotein in diabetes: relation to nonenzymatic glycosylation and oxidative modification. J Clin Endocrinol Metab 2001; 86 : 3243-3249.
7. Vohnout B, Rašlová K. Rizikové faktory rozvoja aterosklerózy: Lipidy a ich vzťah k ateroskleróze. Via practica 2009; 6 : 116-119.
8. Šebekova K, Heidland A. Diabetická nefropatia: novšie poznatky o patogenéze a terapii. Bratisl Lek Listy 2000; 101 : 580-581.
9. Beszédešová N. Screening diabetickej retinopatie. Interní Med 2007; 9 : 345-348.
10. Preventing diabeties complications. Posted by at on February 25, 2010. Dostupné na: http://diabetta.wordpress.com/2010/02/25/preventing-diabetes-complications/. Stiahnuté 10. 6. 2010.
11. Brizzi MF, Dentelli P, Gambino R et al. STAT5 activation induced by diabetic LDL depends on LDL glycation and occurs via src kinase activity. Diabetes 2002; 51 : 3311-3317.
12. Shaw JE, Zimmet PZ, Gries FA et al. Epidemiology of diabetic neuropathy. In: Gries FA, Cameron NE, Low PA et al (eds). Textbook of diabetic neuropathy. New York: Thieme 2003 : 64-82.
13. Thomas MC, Rosengård-Bärlund M, Mills V et al. Serum lipids and the progression of nephropathy in type 1 diabetes. Diabetes Care 2007; 30 : 2706-2707.
14. Mineo C, Deguchi H, Griffin JH et al. Endothelial and antithrombotic actions of HDL. Circ Res 2006; 98 : 1352-1364.
15. Becker G. Could HDL be bad for you? Health Central. MyDiabetesCentral.com. Dostupné na: http://www.healthcentral.com/diabetes/c/5068/19167/hdl-bad. Stiahnuté 11. 6. 2010.
16. Oravec S, Dukát P, Gavorník P et al. Zmeny v lipoproteínovom spektre pri končatinovo-cievnej ischemickej chorobe. Vnitř Lék 2010; 56 : 620-623.
17. Freedman DS, Bowman BA, Otvos JD et al. Differences in the relation of obesity to serum triacylglycerol and VLDL subclass concentrations between black and white children: the Bogalusa Heart Study. Am J Clin Nutr 2002; 75 : 827-833.
18. Urbanová Z., Šamánek M, Češka R et al. Diagnostika a léčba dyslipidémií u dětí a dospívajících. Doporučení pro diagnostiku a léčbu dyslipidémií u dětí a dospívajících vypracované výborem České společnosti pro aterosklerózu. Čes Slov Pediat 2008; 63 : 164-172.
19. Šebeková K, Klassen A, Bahner U et al. Nadváha a obezita - faktory podmieňujúce vývin a progresiu ochorení obličiek. Vnitř Lék 2004; 50 : 544-549.
20. Rušavý Z. Diabetická nefropatie. Aktuality v nefrologii 2002; 8. Dostupné na: Tigis web, http://www.tigis.cz/AVN/Index.htm. Stiahnuté 14. 9. 2010.
21. Charvát J, Kvapil M. Therapy of hyperglycemia and risk of ischemic heart disease: 2010 (Abstrakt). Čas Lék Čes 2010; 149 : 235-236.
22. Kaňková K. Molecular pathophysiology of late complications diabetes mellitus -hyperglycemia-induced changes (Abstrakt). Vnitř Lék 2004; 50 : 756-767.
23. www.rustovyhormon.cz. Percentilové grafy. Dostupné na: http://www.rustovyhormon.cz/mereni-a-hodnoceni-telesne-delky-vysky. Stiahnuté 21. 9. 2010.
24. Tkáč I, Fábryová Ľ, Rašlová K. Manažment dyslipidémií u pacientov s diabetes mellitus. Vyjadrenie stanoviska Slovenskej diabetologickej spoločnosti a Slovenskej asociácie aterosklerózy. Interná med 2006; 6 : 45-52.
25. Ladeia AM, Adan L, Couto-Silva AC et al. Lipid profile correlates with glycemic control in young patients with type 1 diabetes mellitus. Prev Cardiol 2006; 9 : 82-88.
26. Chajdiak J. Štatistika v Exceli. Bratislava: Statis 2002.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Brugada syndromČlánek Primární jaterní karcinoid
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2011 Číslo 6- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Statinová intolerance
- Genetický podklad a screening familiární hypercholesterolémie
- Metabolit živočišné stravy produkovaný střevní mikroflórou zvyšuje riziko závažných kardiovaskulárních příhod
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
-
Všetky články tohto čísla
- Změna spektra supraventrikulárních tachyarytmií indikovaných ke katetrové ablaci – editorial
- Brugada syndrom: syndrom vzácný, ale zákeřný – editorial
- Primární jaterní karcinoid – editorial
- Vplyv dlhodobej glykemickej kompenzácie na zmeny v lipidovom profile detí a adolescentov s diabetes mellitus 1. typu
- Účinnost a bezpečnost podávání moxonidinu u pacientů s metabolickým syndromem (klinické hodnocení O.B.E.Z.I.T.A.)
- Dlouhodobé výsledky katetrizační ablační léčby u supraventrikulárních tachyarytmií
- Brugada syndrom
- Senioři a kardiovaskulární medikace
- Infekční endokarditida – klíčová včasná diagnóza
- Úspěšná léčba Erdheimovy-Chesterovy nemoci chemoterapií obsahující 2-chlorodeoxyadenozin. Popis dvou případů a přehled literatury
- Primární jaterní karcinoid
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Brugada syndrom
- Primární jaterní karcinoid
- Senioři a kardiovaskulární medikace
- Dlouhodobé výsledky katetrizační ablační léčby u supraventrikulárních tachyarytmií
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



