-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Lieky a štítna žľaza
Medicines and thyroid gland
From their primary pharmacological effect, many drugs may also affect the thyroid gland function or the results of thyroid function tests. In addition to the drugs with a known effect on thyroid gland, including thionamides, thyroid hormones, recombinant TSH, iodine, iodide, amiodarone, lithium and heparin, novel compounds, including tyrosin-kinase inhibitors, immunomodulators and cytokines also have adverse effects on the thyroid gland. Novel drugs are then associated with new types of adverse thyroid effects.
Key words:
drugs – thyroid gland dysfunction – tyrosine kinase inhibitors – immunomodulators – cytokines
Autoři: M. Tajtáková
Působiště autorů: I. interná klinika Lekárskej fakulty UPJŠ a UN Košice, Slovenská republika, prednostka prof. MUDr. Ivica Lazúrová, CSc.
Vyšlo v časopise: Vnitř Lék 2012; 58(2): 140-144
Kategorie: Přehledné referáty
Souhrn
Mnohé lieky popri primárnom farmakologickom účinku môžu svojim vedľajším efektom ovplyvňovať funkciu štítnej žľazy alebo vplývať na výsledky funkčných testov. Vedľajší efekt liečby vplývajúci na funkciu štítnej žľazy, okrem už známych liekov, ako sú thionamidy, hormóny štítnej žľazy, rekombinantný TSH, jód, jodid, amiodarón, lithium, heparín, majú i ďalšie v poslednej dobe používané lieky, ako sú inhibítory tyrozínkinázy, imunitné modulátory a cytokíny, ktoré svojím vedľajším efektom môžu navodiť dysfunkciu štítnej žľazy. Tak ako sa zavádzajú nové lieky, sú popisované nové ovplyvnenia štítnej žľazy.
Kľúčové slová:
lieky – dysfunkcia štítnej žľazy – inhibítory tyrozínkinázy – imunitné modulátory – cytokínyÚvod
Mnohé lieky popri primárnom farmakologickom účinku môžu svojim vedľajším efektom, hlavne u starších chorých, ovplyvňovať funkciu štítnej žľazy alebo ovplyvňovať výsledky funkčných testov.
Vedľajší efekt liečby vplývajúci na funkciu štítnej žľazy. Okrem už známych liekov, ako sú thionamidy, hormóny štítnej žľazy, rekombinantný ľudský TSH (Thyrogen), jód, jodid, amiodarón, majú i ďalšie v poslednej dobe používané lieky. Objavujú sa informácie o ich vplyve na funkciu štítnej žľazy a/alebo na výsledky funkčných testov. Tak ako sa zavádzajú nové lieky, sú popisované nové ovplyvnenia štítnej žľazy.
Mechanizmus účinku niektorých liekov na štítnu žľazu
Lieky vplývajúce na transportné bielkoviny (TBG a/alebo transtyretín)
Koncentráciu thyroxin-binding globulínu (TBG) zvyšujú estrogény, Tamoxifen, Heroin, Methadon, Clofibrát, 5-Flurouracil, Mitotan, Perfenazín, inhibítory tyrozinkinázy (ITK). Koncentráciu TBG znižujú androgény, anabolické steroidy, glukokortikoidy.
S väzbou hormónov na TBG a/alebo transtyretín interferujú furosemid v dávke vyššej ako 80 mg podaný i.v., salicyláty v dávke viac ako 2 g denne, diazepam, sulfonylurea, Phenytoin, Heparín.
Lieky vplývajúce na syntézu a sekréciu hormónov štítnej žľazy
Tvorbu alebo vylučovanie trijódtyronínu (T3)/tyroxínu (T4) znižuje Propycil, Carbimazol, Thyrozol, Thyocianat, Perchlorát, Jodid, Lithium, amiodarón, cytokíny (IFN-γ, IL-2, GM-CSF), Aminoglutetimid, Dexametazon. Jodid, amiodarón, cytokíny (IFN-γ, IL-2, GM-CSF) môžu tvorbu alebo vylučovanie T3/T4 aj zvyšovať.
Lieky vplývajúce na koncentráciu tyreotropínu alebo na odpoveď na tyreoliberín
Koncentráciu tyreotropínu (TSH) alebo odpoveď na tyreoliberín (TRH) znižujú trijódtyronín, tyroxín, glukokortikoidy, rastový hormón, Octreotid, Somatostatín, opiáty, Dopamín, L Dopa, Bromocriptín, Metformín, Fentolamín, Thioridazín, Cyproheptadin, statíny, antihistaminiká, antimigrenózne lieky. Koncentráciu TSH alebo odpoveď na TRH zvyšujú Jodid a Lithium.
Lieky ovplyvňujúce metabolizmus hormónov štítnej žľazy
Sú to lieky, ktoré aktivujú alebo inaktivujú dejodázový systém alebo vplývajú na aktivitu cytochróm P450 v pečeni. Takto môže pôsobiť Rifampicín, Phenytoin, Carbazepím, barbituráty, Imatinib (ITK), antidepresíva – SSRI.
Lieky interferujúce s rezorbciou levothyroxinu v tráviacom trakte
Absorpciu levothyroximu (LT4 ; Euthyrox, L-thyroxin) znižujú, v dôsledku poklesu žalúdkovej acidity, antacida, inhibítory protónovej pumpy, antagonisti H2-receptorov, ako aj calcium carbonicum, sukralfát, alumínium hydroxid. Pri týchto liekoch existuje aj ich priama väzba s LT4 v tráviacom trakte, čo znižuje množstvo LT4 pre intestinálnu mukózu. Preparáty železa tak isto znižujú absorpciu LT4 v dôsledku priamej väzby na LT4 v tráviacom trakte.
Opačne pôsobí Cholestyramín, ktorý absorpciu LT4 zvyšuje, ale aj interferuje s enterohepatálnou cirkuláciou, čo môže spôsobiť endogénnu hypertyreózu a intoxikáciu hormónmi štítne žlázy (ŠŽ).
Vplyv liekov na štítnu žľazu sa takto môže prejaviť aj na výsledkoch funkčných testov, ako to prezentuje tab. 1.
Tab. 1. Vplyv liekov na výsledok funkčných testov. 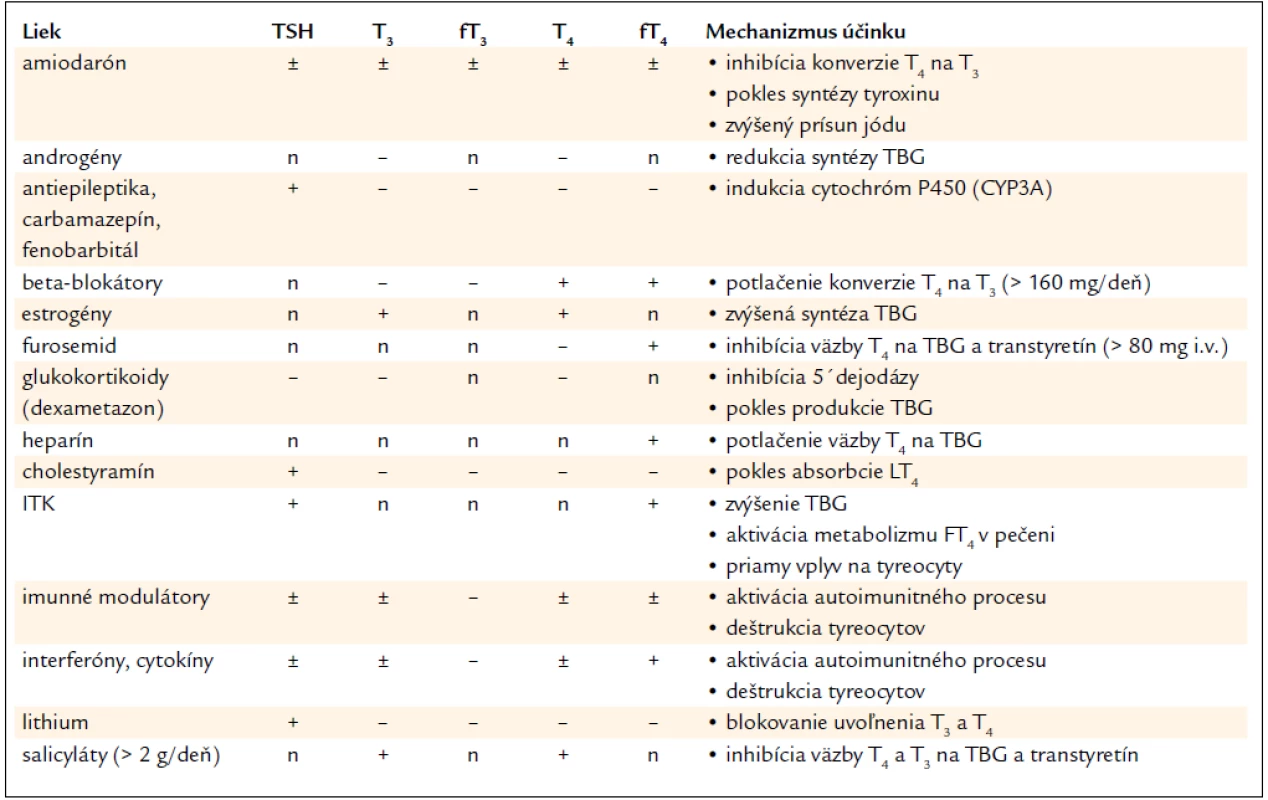
Najčastejšie užívané lieky a ich vplyv na štítnu žľazu
Amiodarón
Amiodarón je využívaný hlavne v kardiológii. Molekula amiodarónu obsahuje 37 % jódu. Pri udržiavacích terapeutických dávkach 200–600 mg/deň sa môže až 250-násobne zvýšiť denný prísun jódu. Lipofilný furán sa akumuluje v tukovom tkanive, myokarde, pečeni, rohovke, pľúcach, ŠŽ a v bunkových lipoidných štruktúrach. Polčas rozpadu je relatívne dlhý: 30–100 dní. Vylučovanie jódu močom po skončení liečby sa normalizuje po 6 mesiacoch [1].
Amiodarón je štrukturálny analóg tyroxínu. Účinkuje v oblasti hypofýzy, kde redukuje intracelulárny transport tyroxínu (T4) a jeho väzbu na jadrové receptory. Okrem toho blokuje tkanivové dejodázy (dejodázu typu I) a konverziu T4 na rT3, čím vzniká tkanivová hypotyreóza napriek zvýšeným hladinám celkového T4 a sčasti aj voľného tyroxínu (fT4).
Pri liečbe Amiodarónom sa tiež môže indukovať alebo reaktivovať spiaci autoimunitný proces v ŠŽ za tvorby protilátok proti peroxidázam (anti-TPO), proti tyreoglobulínu (anti-Tg), ale aj proti TSH receptoru (anti-TSHr).
Dôsledkom môže byť:
- a) Amiodarónom indukovaná tyreotoxikóza (AIT). Prevalencia hypertyreózy u ľudí liečených Amiodarónom je 2–12 %. Je častejšia v podmienkach jódového deficitu [3]. Môže sa objaviť kedykoľvek počas liečby s maximom výskytu v 2.–3. roku liečby. Sú známe 2 typy AIT:
- I. typ – príčinou je jódom indukované zvýšenie syntézy hormónov štítnej žľazy. Účinná je blokáda transmemranózneho prenášača jódu (NIS) pomocou kalium perchloratu, prípadne tyreostatická liečba a prerušenie liečby.
- II. typ – príčinou je jódom indukované cytotoxické poškodenie ŠŽ s následným vyplavením jódtyronínov do cirkulácie, tzv. deštruktívna tyreoiditída. Účinná je liečba glukokortikoidmi, prerušenie liečby Amiodarónom nie je nutné.
- b) Amiodarónom indukovaná hypotyreóza (AIH). Vyskytuje sa častejšie v oblasti s dostatočným príjmom jódu (5–15 %), u starších chorých, žien a u chorých s prítomnými a TPO alebo a Tg protilátkami. AIH môže byť trvalá alebo prechodná a objaví sa do 18 mesiacov od začiatku liečby, často po 2–3 mesiacoch od zahájenia liečby. Keď sa diagnostikuje AIH, je potrebná substitučná liečba LT4 [4,5].
Lithium
Lithium sa využíva u psychiatrických chorých hlavne pri liečbe depresií. Aktívne sa koncentruje v tyreocytoch, blokuje uvoľnenie hormónov štítnej žľazy, ovplyvňuje systém dejodáz. Má aj priamy toxický efekt na tyreocyty.
Zvyšuje efekt liečby 131J u chorých s hypertyreózou. Liečba sa má zahájiť 5 dní pred podávaním 131J.
Dôsledkom užívania tohto lieku môže byť:
- a) difúzna struma (1–60 %) s normálnou echogenitou pri USG, bez poruchy funkcie ŠŽ,
- b) subklinická alebo klinická hypotyreóza (3–14 %), ktorá sa lieči substitúciou LT4,
- c) deštrukčná tyreotoxikóza s pozitívnymi protilátkami (50 %) a bolestivou štítnou žľazou, kde v liečbe možno využiť beta-blokátory alebo blokátory kalciového kanála, prípadne tyreostatiká spolu s Lithiom [4–6].
Metformín
Metformín je p.o. antidiabetikum, je využívaný v liečbe chorých s diabetes mellitus 2. typu.
Liečba Metformínom u diabetkov, ktorí majú súčasne liečenú primárnu hypotyreózu levothyroxinom, je spojená s poklesom sérovej hladiny TSH bez zmeny v sérovej hladine celkového trijódtyronínu, celkového tyroxínu a voľného trijódtyronínu (T3, T4, fT3). Sérová hladina voľného tyroxínu (fT4) môže stúpnuť, pritom ale funkcia štítnej žľazy je v norme. Pokles TSH neznamená predávkovanie substitučnej liečby a dávku substitúcie nie je potrebné znižovať. Predpokladá sa, že Metformín zvyšuje resorbciu podávaného levothyroxinu (LT4) v tráviacom trakte, prípadne vplýva na centrálnu sekréciu TSH [7]. Pokles sérovej hladiny TSH sa pozoroval už po 5–6 mesiacoch liečby. Nebol ale zaznamenaný u eutyreóznych diabetikov liečených Metformínom [7].
Vplyv na sérovú hladinu TSH v priebehu liečby Metformínom sa pozoroval aj u žien so syndróm polycystických ovárií (PCO) súčasne liečených pre hypotyreózou [8].
Tiazolidindiony
Tiazolidindiony – agonisti receptoru PPAR γ. Pozorovalo sa, že súčasná liečba rosiglitazónom môže u chorých po definitívnej liečbe pre karcinómom štítnej žľazy (operácia, 131J) v priebehu supresnej liečby hormónmi štítnej žľazy viesť k falošne nízkej hladine sérového tyreoglobulínu aj v prípade, že pacient má už metastázy. Súčasne sa zvýšilo vychytávanie radioaktívneho jódu [9].
Súčasné podávanie tiazolidindionov (pioglitazónu) chorým s Graves-Basedowovou (GB) tyreotoxikózou a GB oftalmopatiou, ktorí museli byť zároveň liečení interferónom γ (IFN-γ), potláčalo efekt interferónu na produkciu cytokínov (CXCL10) z tyreocytov, orbitálnych fibroblastov a preadipocytov. Rušil sa nežiaduci vplyv intereferónu γ na štítnu žľazu [10].
Heparín
Heparín je antikoagulans. Jeho podávanie vedie k abnormalitám vo funkčných testoch, pričom je funkcia štítnej žľazy v norme. Stúpa sérová hladina fT3, fT4, ale sérová hladina TSH zostáva v norme.
Heparín vedie k zvýšenému uvoľneniu lipoproteínlipázy z cievneho endotelu a k stúpnutiu voľných mastných kyselín, čo je príčinou interferencie heparínu s väzbou hormónov štítnej žľazy na transportné bielkoviny a zmeny vo výsledkoch funkčných testov [11].
Statíny
Statíny – lieky, ktoré okrem hypolipidemickéhu účinku majú antiinflamačný a imunomodulačný efekt – môžu zlepšovať funkciu štítnej žľazy u chorých s Hashimotovou tyreoiditídou (HT). Potláčajú expresiu HLA DR antigénu na tyreocytoch chorých s HT [12,13].
Statíny zvyšujú sérovú hladinu fT3 a fT4 a potláčajú sérovú hladinu TSH, čo suponuje hypertyreózu. V podstate ide o pseudohypertyreózu bez klinických príznakov. Pacientovi, ktorý súčasne s hormónmi štítnej žľazy berie aj statíny, sa dávka substitúcie nemá meniť [14].
Ak je podozrenie, že vyšší cholesterol môže súvisieť s hypotyreózou, má sa sérová hladina TSH vyšetriť ešte pred zahájením liečby statínmi.
Antidepresíva – SSRI
V priebehu liečby týmito antidepresívami, v dôsledku ovplyvnenia metabolizmu hormónov ŠŽ, je navodená reverzibilná hypotyreóza, často bez klinickej symptomatológie, iba so vzostupom sérovej hladiny TSH a poklesom fT4.
Antidepresíva – SSRI zvyšujú serotonín v mozgu, ale aj počet receptorov pre serotonín v tenkom čreve, čím sa znižuje resorbcia LT4 a tým aj efekt liečby u už liečených chorých, čo je potrebné tiež brať do úvahy [15].
Inhibítory tyrozínkinázy
Sú to chemoterapeutiká, ktoré sa využívajú v liečbe niektorých malignít včítane karcinómu štítnej žľazy. Inhibujú niektoré receptory s tyrozínkinázovou aktivitou, čím ovplyvňujú kancerogenézu, bunkovú proliferáciu a neoangiogenézu. Bránia vstupu ATP do bunky a tým následnú fosforyláciu substrátov. Potláčajú funkciu proonkogénu C-kit proteínu a vaskulárneho endoteliálneho rastového faktora (VEGF). Bránia rastu nádorových buniek a potláčajú neovaskularizáciu [4].
Najčastejšie využívané sú tieto ITK:
- Imatinib – ITK využívaný v liečbe hematologických malignít, ako je chronická myleoidná leukémie s pozitívnym Ph chromozómom (CLM), gistómov (tumory tenkého čreva) a tyroidálnych karcinómov.
- Sunitinib, Sorafenib – ITK využívaný v liečbe renálnych a hepatocelulárnych karcinómov a Imatinib rezistentných gastrointestinálnych stromálnych tumorov a karcinómov ŠŽ, ktoré nereagujú na liečbu.
ITK môžu navodiť primárnu hypotyreózu (36–71 %), často ireverzibilnú u chorých, predtým zdravých z dôvodu priameho toxického pôsobenia na tyreocyty (degenerácia folikulov), čo sa prejaví atrofiou ŠŽ [4,16,17] (zmenšovanie objemu pri USG vyšetrení v priebehu liečby). Pre priamy vplyv na VEGF klesá prietok a znižuje sa vaskularita ŠŽ, čo sa potvrdí tiež jej USG vyšetrením. Tento vplyv je výraznejší pri liečbe Sunitinibom a Sorafenibom než Imatinibom [4,16,18–21]. Priamy toxický vplyv na tyreocyty sa môže na začiatku prejaviť aj prechodnou tyreotoxikózou [16,20,25].
ITK okrem toho ovplyvňujú vychytávanie jódu [26,27]. Potláčajú expresiu NIS mRNAr a tým vplývajú na natrium iodide symporter (NIS), čo je proteín potrebný pre transmembránový transport jodidu. ITK majú aj antiperoxydázový efekt [28], vedú k vzostupu TBG [4], zvyšujú aktivitu dejodáz (DI3), čím zvyšujú metabolizmus tyroxínu a trijódtyronínu (T4 a T3) [29]. Súčasne zvyšujú metabolizmus LT4 v pečeni. Výsledkom je vzostup TSH > 10 mIU/l, pričom sérová hladina T4 môže byť v dôsledku vzostupu TBG v norme. Liečba ITK môže zvyšovať aj sérovú hladinu tyreoglobulínu [21] a aktivovať autoimunitný proces [20,30].
Substitučná liečba LT4 je individuálna, ale ITK zvyšujú požiadavku na substitučnú dávku LT4 u chorých, už liečených hormónmi štítnej žľazy, a to predovšetkým u chorých, ktorí sa podrobili liečbe ITK po totálnej tyreoidektómii. Dávku substitúcie LT4 je potrebné zvýšiť niekedy až dvojnásobne [4,21].
Imunné modulátory
Imunné modulátory, z ktorých sa využívajú v liečbe:
- a) Alentuzumab (Campath-1H), čo je monoklonálna protilátka namierená proti povrchovému antigénu CD52 Ly (výsledkom je lýza) [4].Tento imunný supresor sa využíva v liečbe relapsu sclerosis multiplex (SM), chronickej lymfatickej leukémie (CLL), kožného T-bunkového lymfómu a po transplantácii kostnej drene a obličiek. Liečba vedie k supresii Th1 lymfocytov a poklesu pomeru Th1 : Th2 [31]. Počas tejto liečby sa môžu objaviť protilátky proti TSHr (de novo) a aktivovať autoimunitný proces v štítnej žľaze [31].
Dysfunkcia štítnej žľazy sa môže manifestovať až u 22 % liečených ako GB hypertyreóza alebo Gravesová oftalmopatia v priebehu 6–31 mesiacov od začiatku liečby, alebo ako autoimunitná hypotyreóza [4].
Vplyv na ŠŽ sa pozoroval hlavne u chorých so SM, a to hlavne u tých, u ktorých bola vyššia sérová hladina interleukínu 21 (IL-21) [32]. Sledovanie IL-21 by mohlo u týchto chorých takto slúžiť ako biomarker pre riziko rozvoja autoimunity v štítnej žľaze [32]. - b) Remicade (infliximab) a Humira, čo sú protilátky proti TNF-α a využívajú sa ako biologická liečba u chorých v reumatológii a gastroenetrológii (reumatoidná artritída, Crohnova choroba). Liečba môže byť komplikovaná zvýšeným rizikom rozvoja infekcií a rôznych typov karcinómov (lymfómy, karcinómy kože, prsníka, pľúc a tráviaceho traktu) [33].
Protilátky proti TNF-α in vitro inhibovali aj proliferáciu a hyperpláziu tyreocytov [34]. Pri liečbe protilátkami proti TNF-α sa v 0,10 % zaznamenal, ako vedľajší efekt liečby, výskyt papilárneho karcinómu štítnej žľazy (folikulárny variant). Najčastejšie v 2–5 roku liečby, častejšie u žien vo veku 50–59 roku života [35]. Bolo by preto vhodné jedincov liečených protilátkami proti TNF-α, u ktorých sa nájde uzol v ŠŽ, sledovať.
Cytokíny (interferóny, interleukíny a granulocyty a makrofágy stimulujúci rastový faktor – GM-CSF)
Interferóny sa využívajú v liečbe chronickej hepatitídy C, ťažkých infekcií. Interleukín 1 pri liečbe malignít (melanóm, karcinóm obličiek) a GM-CSF na stimuláciu granulocytov a monocytov u chorých po chemoterapii a po alogénnej transplantáciu u chorých s hematologickými malignitami.
V priebehu tejto liečby sa u niektorých chorých môže manifestovať hypertyreóza alebo hypotyreóza. Príčiny môžu byť autoimunitné alebo neautoimunitné.
- a) Autoimunitné príčiny: interferóny menia pomer Th1 lymfocytov/Th2 lymfocytov, čím sa zvyšuje produkcia cytokínov, ktoré sú schopné aktivovať tyreocyty [10].
Liečba interferónom α je spojená so vzostupom aTPO a aTg protilátok. Dysfunkcia štítnej žľazy (GB hypertyreóza, GB oftalmopatia, Hashimotová tyreoiditída) sa môže objaviť u 10–20 % liečených po 3 mesiacoch od zahájenia liečby a pretrvávať aj po jej prerušení [5]. Symptómy tyreotoxikózy môžu zhoršovať flu-like prejavy súvisiace s liečbou INFα.
Interferón γ zvyšuje expresiu HLA antigénov II. triedy na povrchu tyreocytov, čo je spojené s iniciáciou autoimunity a zvýšenou produkciou cytokínov tyreocytmi, fibroblastami a preadipocytmi [10].
Vplyv cytokínov na ŠŽ sa prejaví výraznejšie u chorých, ktorí mali pred zahájením liečby subklinickú prípadne manifestnú poruchu funkcie ŠŽ. Pri autoimunitnom postihnutí ŠŽ sa pozoruje okrem laboratórnych abnormalít aj zmena USG obrazu štítnej žľazy. Mení sa veľkosť aj echogenita ŠŽ. - b) Neautoimunitné príčiny: ide o priamy toxický účinok na tyreocyty, čo má za následok deštrukčnú tyreotoxikózu. ŠŽ je bolestivá a infiltrovaná lymfocytmi. Pozorovalo sa to hlavne pri liečbe interleukínom 2 (20 %). Sérová hladina TSH je suprimovaná, protilátky sú negatívne, ale echogenita štítnej žľazy je zmenená, nehomogénna a znížená [4,5]. GM-CSF svojimi účinkami môžu zvyšovať tvorbu a uvoľňovanie T3/T4 štítnou žľazou.
Záver
Mnohé nové lieky, ktoré sa v poslednej dobe zavádzajú do liečby mnohých netyreoidálnych zápalových a nádorových ochorení, ovplyvňujú po určitom čase užívania funkčný stav štítnej žľazy a/alebo výsledok funkčných testov (T3, T4, fT4, fT3, TSH). Môže isť o aktiváciu autoimunitného procesu v štítnej žľaze s dôkazom aTPO, aTg, prípadne aTSHr protilátok, toxický vplyv lieku priamo na tyreocyty, vplyv na metabolizmus hormónov alebo vplyv na rezorbciu LT4 pri súčasnej substitučnej liečbe. Je preto dôležité, aby bol lekár o týchto vplyvoch na štítnu žľazu informovaný. K takejto informácii by mal slúžiť aj predkladaný súborný referát.
prof. MUDr. Mária Tajtáková, CSc.
www.upjs.sk
e-mail: maria.tajtakova@upjs.sk
Doručeno do redakce: 13. 7. 2011
Přijato po recenzi: 12. 9. 2011
Zdroje
1. Heufelder AE, Wiersinga WM. Störungen der Schilddrüsenfunktion: durch Amiodaron Pathogenese, Diagnostik and Therapie. Dtsch Arztebl 1999; 96 : 34–41.
2. Harjai KJ, Licata AA. Amiodarone induced hyperthyroidism: a case series and brief review of literature. Pacing Clin Electrophysiol 1996; 19 : 1548–1554.
3. Eskes SA, Wiersinga WM. Amiodarone and thyroid. Best Pract Res Clin Endocrinol Metab 2009; 23 : 735–731.
4. Barbesino G. Drugs affecting thyroid function. Thyroid 2010; 20 : 763–700.
5. Joe G, Shashank RJ. Drugs and thyroid. JAPI 2007; 55 : 215–221.
6. Bocchetta A, Loviselli A. Lithium treatment and thyroid abnormalities. Clin Pract Epidemiol Ment Health 2006; 2 : 23.
7. Cappelli C, Rotondi M, Pirola I et al. TSH-Lowering Effect of Metformin in Type 2 Diabetic Patients. Differences between euthyroid, untreated hypothyroid, and euthyroid on L-T4 therapy patients. Diabetes Care 2009; 32 : 1589–1590.
8. Morteza Taghavi S, Rokni H, Fatemi S. Metformin decreases thyreotropin in overweight women with polycystic ovarian syndrome and hypothyroidism. Diab Vasc Dis Res 2011; 1 : 47–48.
9. Kebebew E, Lindsay S, Clark OH et al. Results of rosiglitazone therapy in patients with thyreoglobulin-positive and radioiodine - negative advanced differentiated thyroid cancer. Thyroid 2009; 19 : 953–956.
10. Antonelli A, Ferrari SM, Fallahi P et al. Cytokines (interferon γ and tumor necrosis fac-tor α)-induced nuclear factor-kB activation and chemokine (C-X-C motif) ligand 10 release in Graves disease and ophthalmopathy are modulated by pioglitazone. Metabolism 2011; 60 : 277–283.
11. Laji K, Rhidha R, John R et al. Abnormal serum free thyroid hormone levels due to heparin administration. Q J Med 2001; 94 : 471–473.
12. Wu X, Schott M, Liu C et al. Statins decrease the aberrant HLA-DR expression on thyreocytes from patients with Hashimoto’s thyroiditis. Horm Metab Res 2008; 40 : 838–841.
13. Gullu S, Emral R, Bastemir M et al. In vivo and in vitro effects of statins on lymphocytes in patients with Hashimoto’s thyroiditis. Eur J Endocrinol 2005; 153 : 41–48.
14. Medical News Today. http://www.medicalnewstoday.com/. 2009.
15. Eker SS, Akkaya C, Ersoy C et al. Reversible escitalopram-induces hypothyroidism. Gen Hosp Psychiatry 2010; 32 : 559.
16. Shinohara N, Takahashi M, Kamishima T et al. The incidence and mechanism of sunitinib--induced thyroid atrophy in patients with metastatic renal cell carcinoma. Br J Cancer 2011; 104 : 241–247.
17. Torino F, Corsello SM, Longo R et al. Hypothyroidism related to tyrosinekinase inhibitors: an emerging toxic effect of targeted therapy. Nat Rev Clin Oncol 2009; 6 : 219–228.
18. Makita N, Miyakawa M, Fujita T et al. Sunitinib induces hypothyroidism with a markedly reduced vascularity. Thyroid 2010; 20 : 323–326.
19. Sherman SI. Thyrosine kinase inhibitors and the thyroid. Best Pract Res Clin Endocrinol Metab 2009; 23 : 713–722.
20. Rogiers A, Wolter P, Op de Beeck K et al. Shrinkage of thyroid volume in sunitinib-treated patients with renal-cell carcinoma: a potential marker of irreversible thyroid dysfunction? Thyroid 2010; 20 : 317–322.
21. Sato S, Muraishi K, Tani J et al. Clinical characteristics of thyroid abnormalities induced by sunitinib treatment in Japanes patients with renal cell carcinoma. Endocr J 2010; 57 : 873–880.
22. Sakurai K, Fukazawa H, Arihara Z et al. Sunitinib-induced thyreotoxicosis followed by persistent hypothyroidism with shrinkage of thyroid volume. Tohoku J Exp Med 2010; 222 : 39–44.
23. Lio S. Thyroid function and sunitinib treatment. In: In Endocrine Abstracts ITC 2010; 207.
24. van Doorn L, Eskens FA, Visser TJ et al. Sorafenib induced thyroiditis in two patients with hepatocellular carcinoma. Thyroid 2011; 21 : 197–202.
25. Faris JE, Moore AF, Daniels GH. Sunitinib (sutent)-induced thyreotoxicosis due to destructive thyroiditis: a case report. Thyroid 2007; 17 : 1147–1149.
26. Mannavola D, Coco P, Vannucchi G et al. A novel tyrosine-kinase selective inhibitor, sunitinib, induces transient hypothyroidism by blocking iodine uptake. J Clin Endocrinol Metab 2007; 92 : 3531–3534.
27. Choi EH, Kim WG, Kim EY et al. The effect of sunitinib on growth and proliferation of normal rat thyroid cell line, FRTL-5. In: Endocrine Abstracts ITC 2010 : 207.
28. Wong E, Rosen LS, Mulay M et al. Sunitinib induces hypothyroidism in advanced cancer patients and may inhibit thyroid peroxidase activity. Thyroid 2007; 17 : 351–355.
29. Abdulrahman RM, Verloop H, Hoftijzer H et al. Sorafenib-induced hypothyroidism is associated with increased typ 3 deiodination. J Clin Endocrinol Metab 2010; 95 : 3758–3762.
30. Kim TD, Schwarz M, Nogai H et al. Thyroid dysfunction caused by second-generation tyrosinekinase inhibitors in Philadelphia chromosome-positive chronic myeloid leukemia. Thyroid 2010; 20 : 1209–1214.
31. Wotherspoon F, Kajicek JP, Flanagan DE. Autoimmune thyroid disease following treatment of multiple sclerosis with Campath-1H. In: Endocrine Abstracts BES 2005; 9 : 207.
32. Jones JL, Phuah CL, Cox AL et al. IL-21 drives secondary autoimmunity in patients with multiple sclerosis, following therapeutic lymphocyte depletion with alemtuzumab (Campath-lH). J Clin Invest 2009; 119 : 1852–1853.
33. Bongartz T, Sutton AJ, Sweeting MJ et al. Anti-TNF antibody therapy in rheumatoid arthritis and the risk of serious infections and malignancies: systematic review and meta-analysis of rare harmful effects in randomized controlled trials. JAMA 2006; 295 : 2275–2285.
34. Yu S, Fang Y, Sharav T et al. CD8+ T cells induce thyroid epithelial cell hyperplasia and fibrosis. J Immunol 2011; 186 : 2655–2662.
35. Remicade side effect: Thyroid cancer. http://www.ehealthme.com/. 2011.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2012 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Trvalá virologická odpoveď kombinovanej imunomodulačnej liečby pegylovaným interferónom-α a ribavirínom u bývalých intravenóznych drogovo závislých jedincov s chronickou vírusovou hepatitídou C
- Příznaky bažení po jídle u dětí staršího školního věku a jejich vztah k body-mass indexu
- Klinické dôsledky zväčšenia ľavej predsiene
- Hemokoagulační mechanizmy v procesu aterotrombózy
- Význam urokinázy a jejích inhibitorů pro invazi a metastazování zhoubných nádorů
- Měkké tkáně, hormony a skelet
- Lieky a štítna žľaza
- Vývoj koagulačních markerů chronické diseminované intravaskulární koagulace (DIK) u pacienta s mnohočetnou angiomatózou v průběhu léčby antiangiogenními léky: interferonem α, thalidomidem a lenalidomidem
- Goodův syndrom (s thymomem spojená hypogamaglobulinemie) – 2 kazuistiky
- Shrnutí doporučení České pracovní skupiny pro Ph-negativní myeloproliferativní onemocnění (CZEMP) České hematologické společnosti ČLS JEP pro diagnózu a terapii BCR/ABL-negativních myeloproliferací
- Je potřeba zavádět pojem bažení do klinické praxe? – editorial
- Přehled dosud publikovaných analýz srovnávajících efektivitu léčby inzulinovou pumpou a režimu několika injekcí inzulinu denně u diabetiků 1. typu
- Léčba hypertyreózy radiojodem 131I v ambulantním režimu – bezpečná, účinná a ekonomická varianta
- Celiakie – opomíjená diagnóza
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Klinické dôsledky zväčšenia ľavej predsiene
- Lieky a štítna žľaza
- Léčba hypertyreózy radiojodem 131I v ambulantním režimu – bezpečná, účinná a ekonomická varianta
- Goodův syndrom (s thymomem spojená hypogamaglobulinemie) – 2 kazuistiky
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



