-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Shrnutí doporučení České pracovní skupiny pro Ph-negativní myeloproliferativní onemocnění (CZEMP) České hematologické společnosti ČLS JEP pro diagnózu a terapii BCR/ABL-negativních myeloproliferací
Autoři: M. Penka 1; J. Schwarz 2; V. Campr 3; D. Pospíšilová 4; L. Křen 5; Lucie Nováková 2; C. Bodzásová 6; Y. Brychtová 7; O. Černá 8; P. Ďulíček 9; A. Jonášová 10; J. Kissová 1; Z. Kořístek 7; M. Schutzova 11; I. Vonke 12; L. Walterová 13
Působiště autorů: Oddělení klinické hematologie FN Brno, přednosta prof. MUDr. Miroslav Penka, CSc. 1; Klinický úsek Ústavu hematologie a krevní transfuze Praha, přednosta prof. MUDr. Petr Cetkovský, Ph. D. 2; Ústav patologie a molekulární medicíny 2. lékařské fakulty UK a FN Motol Praha, přednosta prof. MUDr. Roman Kodet, CSc. 3; Dětská klinika Lékařské fakulty UP a FN Olomouc, přednosta prof. MUDr. Vladimír Mihál, CSc. 4; Ústav patologie Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta doc. MUDr. Josef Feit, CSc. 5; Ústav klinické hematologie FN Ostrava, přednosta prim. MUDr. Jaromír Gumulec 6; Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr, Jiří Mayer, CSc. 7; Oddělení klinické hematologie FN Královské Vinohrady Praha, přednosta doc. MUDr. Tomáš Kozák, Ph. D., MBA 8; Oddělení klinické hematologie II. interní kliniky Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Jaroslav Malý, CSc. 9; I. interní klinika 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Marek Trněný, CSc. 10; Hemato-onkologické oddělení FN Plzeň, přednosta prim. MUDr. Vladimír Koza 11; Oddělení klinické hematologie Nemocnice České Budějovice, přednosta prim. MUDr. Ivan Vonke, MBA 12; Oddělení klinické hematologie Krajské nemocnice Liberec, přednostka prim. MUDr. Lenka Walterová 13
Vyšlo v časopise: Vnitř Lék 2012; 58(2): 163-168
Kategorie: Doporučené postupy
Východiska, literární rozbor a zdůvodnění, jakož i všechny postupy v diagnostice a léčbě BCR/ABL-negativních myeloproliferativních onemocnění (MPO) vypracované Českou pracovní skupinou pro Ph - myeloproliferativní onemocnění (CZEMP) v roce 2009 jsou podrobně uvedeny ve v loňském roce vydaném článku [1]. Současná doporučení se týkají všech tří nejčastějších onemocnění z této skupiny: esenciální trombocytemie (ET), pravé polycytemie (PV) a primární myelofibrózy (PMF) a navazují na předchozí doporučení z roku 2005 [2,3], která byla zaměřena především na léčbu Ph - MPO, provázených trombocytemií (MPO-T). Současný souhrn nových doporučení je stručným přehledem nejdůležitějších postupů a byl schválen Českou hematologickou společností České lékařské společnosti J. E. Purkyně v listopadu roku 2011.
1. Diagnostika Ph - MPO
1.1. Algoritmus pro vyšetření trombocytózy
- Osobní a rodinná anamnéza (včetně zaměření na rozpoznání familiárního postižení MPO) a vyloučení evidentních sekundárních případů (hyposideremie, jiné nádory atd.).
- Vyšetření JAK2V617F mutace a fúze BCR/ABL (k odlišení CML).
- Biopsie kostní dřeně (není-li přítomna polyglobulie; je-li přítomna, postupujeme podle příslušného algoritmu pro polyglobulii – viz níže; u případů s hraničními hodnotami parametrů červené řady nutno vyšetřit sérový erytropoetin – s-Epo a celkový erytrocytární volum – RCM).
1.2. Algoritmus pro vyšetření a diferenciální diagnostiku polyglobulie
- Osobní a rodinná anamnéza (včetně zaměření na rozpoznání familiárního postižení MPO). Vyloučit evidentní sekundární případy (jiné nádory, ventilační insuficience včetně případů kardiálního selhávání a spánkové apnoe aj.).
- JAK2V617F mutace, saturace hemoglobinu kyslíkem (stačí HbO2 oxymetrie), s-Epo.
- U případů s hraničními hodnotami parametrů červené řady nutno vyšetřit RCM.
- U všech JAK2V617F negativních případů: provést biopsii dřeně, vyšetřit mutaci JAK2 v exonu 12, vyšetřit růst erytropoetin nezávislých erytroidních kolonií (EEC) a patologické hemoglobiny.
- V závislosti na výsledcích s-Epo a EEC, event. provést u JAK2 negativních případů vyšetření dalších vzácných mutací (HIF-2α, PHD2, VHL, genu pro Epo-receptor).
1.3. Souhrn diagnostiky Ph - MPO
CZEMP doporučuje vlastní „nosologická“ diagnostická kritéria (jde vždy o určitou diagnostickou jednotku, která se může lišit v různých stadiích svého vývoje) – viz souhrn v tab. 1 a viz níže. Tato kritéria (obvykle s výjimkou PV) jsou však aplikovatelná pouze za předpokladu odečtení histopatologického nálezu, nezatíženého předchozí cytoreduktivní léčbou, expertním patologem. Pro zbytek případů a starší nemocné je možno doporučit „non-nosologická,“ laboratorně-symptomatologická kritéria PVSG [4].
Tab. 1. Souhrn diagnostiky Ph- (BCR/ABL-) MPO. 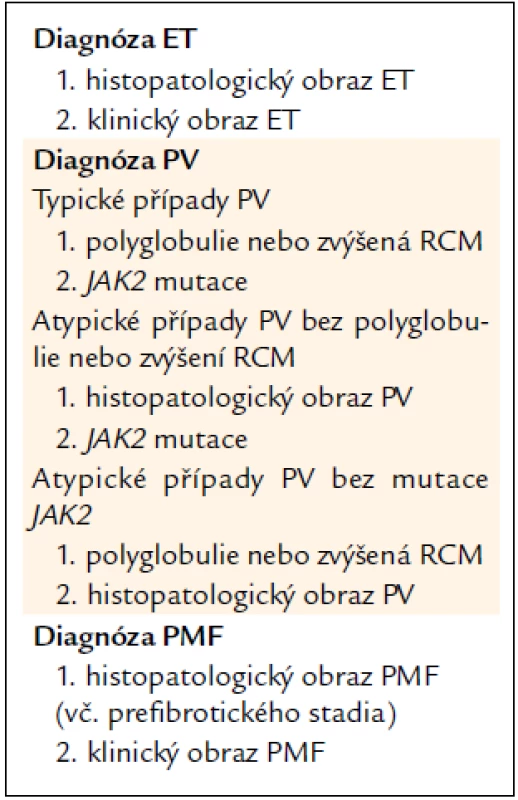
1.3.1. Souhrn diagnostiky ET
Diagnóza ET se opírá o typický histopatologický obraz v souladu s popisy WHO 2001/ECP 2002 [5,6], který by měl být v souladu s typickými rysy onemocnění. CZEMP neužívá žádné hraniční kritérium pro počet trombocytů, je-li splněn požadavek jasného histopatologického obrazu. Pouze případy s bioptickým nálezem ET, diagnostikovaným podle pravidel WHO/ECP, bez předchozí cytoreduktivní léčby, lze považovat za ET v nosologickém smyslu dle pravidel CZEMP. Případy bez takto provedené histopatologické verifikace lze pouze diagnostikovat jako ET v širším smyslu podle starších kritérií PVSG. (Jako ET podle PVSG kritérií se mohou diagnostikovat případy prepolycytemické fáze PV a prefibrotické fáze PMF.)
Typické rysy ET: v naprosté většině případů se naleznou zvýšené počty trombocytů, normální nebo jen mírně zvýšený počet leukocytů s převahou neutrofilů bez vyplavování méně zralých forem granulocytů nebo erytroblastů. Hodnoty červeného krevního obrazu anebo RCM nepřekračují normu. JAK2V617F pozitivní případy mají sice tendenci k vyšším hodnotám, ale nikoli nad normu (v tom případě by se jednalo o diagnózu PV). JAK2V617F pozitivita bývá u 50 % případů, a to vždy v heterozygotní formě, jen u vzácných případů lze nalézt jednu z mutací MPLW515. V naprosté většině není hmatná splenomegalie (ale při sonografii může být slezina lehce zvětšená). Všichni nemocní jsou ohroženi trombózou anebo krvácením (v závislosti na počtu trombocytů – viz obr. 1, na věku, na přítomnosti mutace JAK2V617F a na geneticky podmíněných anebo získaných trombofilních stavech). Transformace do myelofibrózy (navzdory nedávné definici „post-ET MF“) je extrémně vzácná. Nebývá pozorována transformace do s-AML (není-li způsobena genotoxickou léčbou). Klinický obraz nekomplikované ET je po dlouhá léta (desetiletí) neměnný.
Obr. 1. Schéma rizika trombózy a krvácení v závislosti na počtu trombocytů s naznačením léčebných opatření. Podle [7]. ![Schéma rizika trombózy a krvácení v závislosti na počtu trombocytů s naznačením léčebných opatření. Podle [7].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/414660e216bc55df465bc3a61540c44d.png)
1.3.2. Souhrn diagnostiky PV
Diagnóza PV je dána splněním vždy 2 kritérií (jde celkem o 3 možné situace):
- V typických případech:
- Polyglobulie (erytrocytóza) nebo zvýšený RCM (nutno jej vyšetřit v případech hraničních hodnot červeného krevního obrazu) + JAK2V617F mutace.
- V atypických případech:
- Není-li přítomna polyglobulie (anebo zvýšená hodnota RCM), histopatologický obraz PV dle definice WHO/ECP + JAK2V617F mutace postačují pro diagnózu.
- Není-li přítomna JAK2V617F mutace, histopatologický obraz PV dle definice WHO/ECP + polyglobulie (anebo zvýšený RCM) postačují pro diagnózu.
Nutno však odlišit „nepravou“ či „relativní“ polycytemii u stavů s restrikcí celkového plazmatického objemu (obvykle při dehydrataci). V každém hraničním či klinicky suspektním případě je doporučeno vyšetřit RCM: vždy při hematokritu 0,48–0,59 u muže a 0,44–0,55 u ženy, spolu se stanovením celkového plazmatického objemu. RCM by měl být vztažen k tělesnému povrchu pacienta. Za zvýšený RCM arbitrárně (v souladu s doporučeními ICSH a britskými doporučeními pro diagnostiku PV) považujeme hodnoty > 125 % předpokládané výše.
Typické znaky PV: nalézáme v naprosté většině případů zvýšené parametry červeného krevního obrazu anebo zvýšený RCM. Počet trombocytů v počátku onemocnění bývá obvykle zvýšený, později normální. Počet leukocytů je obvykle mírně zvýšený, jde o zralé neutrofily. Nevyplavují se erytroblasty, počet retikulocytů je v normě, parametr anizocytózy erytrocytů je snížen. Hladina s-Epo je snížená anebo na dolní hranici normy. Růst EEC je běžný. Nemusí být žádná, ale může být až značná splenomegalie při palpaci (i pod úroveň pupku), při ultrazvukovém vyšetření (USG) je splenomegalie obvyklá. Typická, alespoň heterozygotní JAK2V617F mutace (v exonu 14) je přítomna u asi 97–98 % případů při detekci alela-specifickou PCR. Homozygozita (tzn. průkaz > 50 % mutovaných alel) je však u pokročilejších fází poměrně častá. Různé mutace (a také delece, ojediněle i s insercí) v exonu 12 genu JAK2 u JAK2V617F negativních pacientů jsou velmi vzácné, byl však při nich popsán odlišný histopatologický obraz, bližší idiopatické erytrocytóze než PV, i poněkud rozdílné hodnoty KO – v průměru vyšší hodnoty parametrů červené řady, ale nižší hodnoty leukocytů a trombocytů. U PV se nevyskytují mutace genu MPL. Aktuálním rizikem každého pacienta je nebezpečí trombózy a krvácení. K rizikovým faktorům pro trombózu počítáme věk, předchozí trombózu, hodnotu hematokritu, zvýšený počet trombocytů, přídatný trombofilní stav (dědičný nebo získaný) včetně hormonální antikoncepce. Role (resp. spíše mezní hodnota) WBC i úloha nálože JAK2V617F alely jsou předmětem diskuze. Přechod do postpolycytemické myelofibrózy je častý, proces však trvá mnoho let. Přímý přechod do s-AML v krátké době je neobvyklý, ale možný (role genotoxické léčby je velmi suspektní). Častěji k s-AML dojde po desetiletích vývoje onemocnění přes stadium postpolycytemické myelofibrózy. Rizikové faktory pro krvácení jsou: léčba ASA, event. jiná antiagregační/antikoagulační léčba, lokální defekty (např. sliznic), v přirozeném vývoji onemocnění počet trombocytů (> 1 000 u starších a > 1 500 × 109/l u mladších nemocných), nezřídka spojený s prodlouženými časy v globálních koagulačních testech, někdy i se sekundární von Willebrandovou chorobou. Rizikové faktory přechodu do myelofibrózy nejsou známy.
1.3.3. Souhrn diagnostiky PMF
Hlavním kritériem pro stanovení je histopatologický obraz PMF (včetně prefibrotického stadia) v souladu s definicemi WHO 2001/ECP 2002 [6,8]. Histopatologický nález však musí zhruba zapadat do typického klinického obrazu příslušného stadia PMF (tab. 2). Vývoj onemocnění od raného obrazu (který je v souladu s diagnózou ET podle PVSG kritérií) až do pokročilejších fází s výraznou myeloidní metaplazií trvá obvykle 2–3 desetiletí. Pokud se týká časných stadií PMF, pouze případy s bioptickým nálezem PMF, diagnostikovaným podle pravidel WHO/ECP, bez předchozí cytoreduktivní léčby, lze považovat v nosologickém smyslu za PMF dle pravidel CZEMP. Případy bez takto provedené histopatologické verifikace lze pouze diagnostikovat jako ET v širším smyslu podle starších kritérií PVSG [4]. Pokročilá stadia PMF, je-li k dispozici bioptický nález, již diagnostický problém nečiní.
Tab. 2. Srovnání klinických a laboratorních projevů počátečního a pokročilého stadia PMF. 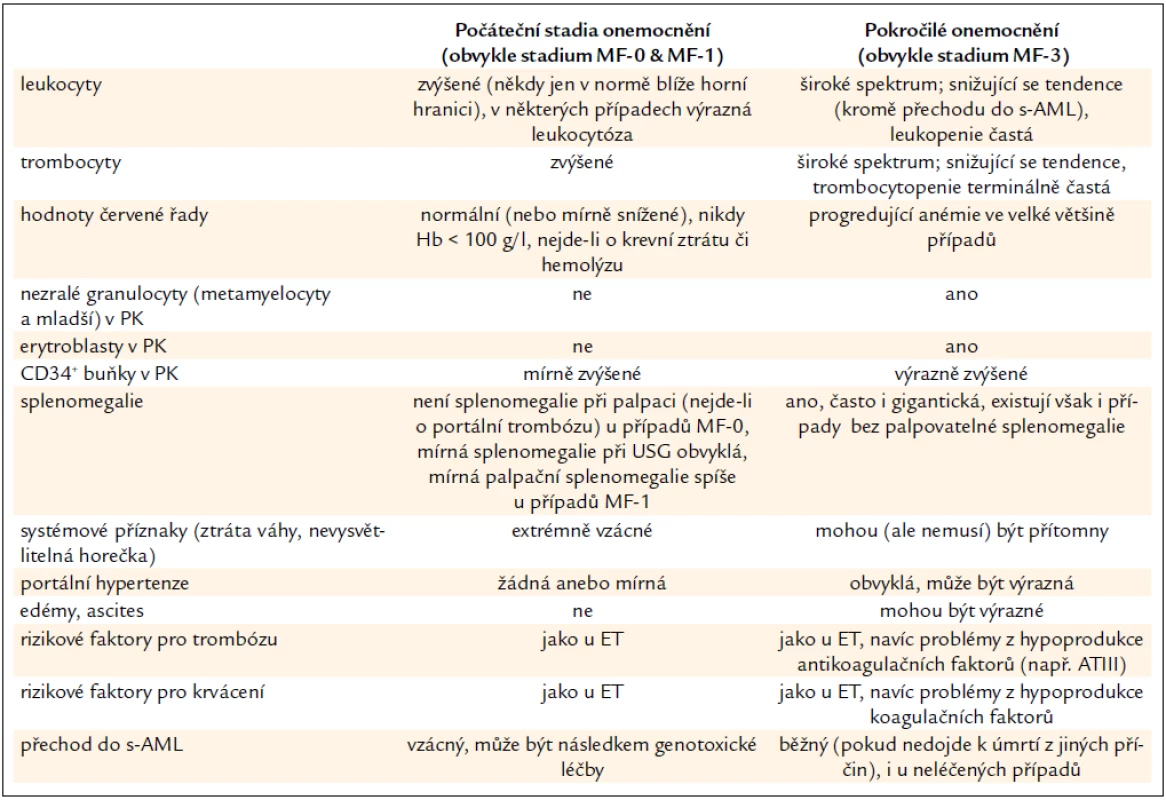
Typické rysy onemocnění od počátečních stadií až k pokročilé PMF jsou shrnuty v tab. 2. Vedle toho uvádíme ještě některé další laboratorní a klinické charakteristiky PMF: JAK2V617F mutace je přítomna v asi 55 % případů při detekci alela-specifickou PCR, homozygozita (> 50 % mutovaných alel) v pokročilejších stadiích je možná. Mutace MPLW515K/L jsou relativně vzácné (asi 5–10 %) a mohou se vyskytnout i jako homozygotní. K celkovému stanovení prognózy doporučujeme Lille skóre, Mayo klasifikaci, kolínské skóre, skóre dle IWG-MRT (International Working Group for Myelofibrosis Research and Treatment). Všechna jsou založena pouze na hodnotách krevního obrazu, event. na klinických znacích a jsou všeobecně aplikovatelná. Upozornění: k posouzení indikace transplantace hematopoetických buněk je však potřeba vzít v úvahu i další kritéria – viz níže.
2. Léčba Ph - MPO
CZEMP doporučuje podávat léčbu podle individuálního rizika daného pacienta, a to jak ve smyslu rizika trombózy a krvácení, tak i biologického vývoje onemocnění, především možného přechodu onemocnění do s-AML. Vždy je třeba vycházet z principu non nocere a každou podanou léčbu vážit z tohoto hlediska, s přihlédnutím k odhadu celkového přežití, morbidity a kvality života bez zvažované léčby.
2.1. Léčba MPO s trombocytemií (MPO-T)
Léčebný postup, i nyní doporučovaný CZEMP [1], byl již publikován v roce 2005 [2,3]. V těchto publikacích je detailní rozbor literatury, která vedla k formulaci minulé verze doporučení. Doporučení byla založena především na analýze rizikových faktorů pro trombózu a stratifikaci léčby podle přítomnosti těchto rizik. Při formulaci doporučení byl uplatněn princip primum non nocere, tj. vyhnutí se potenciálně leukemogenním látkám při léčbě mladších jedinců pod 60 let. Naše doporučení byla a nadále jsou založena především na konsenzuálním expertním názoru, neboť v literatuře prakticky chybí kvalitně interpretované studie kategorie A z hlediska tzv. „evidence-based medicine“.
Od doby první publikace [2,3] doznala doporučení CZEMP pro léčbu MPO-T jen několik málo změn:
- Mutace JAK2V617F byla zařazena do rizikové stratifikace pacientů s MPO-T jako trombogenní faktor.
- Byla zvýšena věková hranice pacientů z 60 na 65 let pro diferenciaci léčby v souladu s rostoucím mediánem věku v české populaci.
2.1.1. Základní východiska
Doporučení pro léčbu mají několik základních východisek:
- Analýza hlavních rizikových faktorů trombózy, což jsou:
- a) věk,
- b) předchozí trombóza,
- c) přídatné trombofilní stavy, a to vrozené, ale i získané,
- d) mutace JAK2V617F,
- e) počet krevních destiček, a navíc i doba expozice postiženého jedince trombocytemií; podobně i riziko krvácení u MPO-T je i funkcí počtu trombocytů; u MPO-T dochází k paradoxu, že v jednom okamžiku je pacient ohrožen jak trombózou, tak i krvácením – tento stav nazýval Dameshek „double jeopardy,” tj. dvojí nebezpečí; Michiels et al [7] doporučují nejprve cytoreduktivní léčbou eliminovat riziko krvácení, a dostat tak pacienta do stavu, kdy je již ohrožen především rizikem trombózy, a teprve tehdy mu nasadit antiagregační léčbu k její prevenci – viz obr. 1,
- f) počet leukocytů se v některých studiích jeví jako prognostický faktor z hlediska rizika trombózy, nicméně údaje se rozcházejí, a proto doporučení CZEMP zatím na počet leukocytů neberou zřetel,
- g) tzv. kardiovaskulární rizika, platná v obecné populaci bez MPO, měla v některých studiích signifikantní dopad na incidenci trombózy při MPO-T, v jiných však ne; týká se to např. obezity, zvýšené hladiny cholesterolu a triglyceridů, hypertenze, kouření, přítomnosti diabetes mellitus. Ošetřující lékař má při volbě terapie právo k nim přihlédnout.
- Tromboreduktivní léčba snižuje riziko trombózy u pacientů s vysokým rizikem.
- Tromboreduktivní léčba odstraňuje symptomy trombocytemie.
- Antiagregační léčba snižuje riziko trombózy. Navíc účinně odstraňuje mikrovaskulární symptomy.
- Všechna dlouhodobě podávaná cytostatika (včetně nejpoužívanější hydroxyurey – HU) jsou prokazatelně, anebo přinejmenším potenciálně leukemogenní.
2.1.2. Algoritmus pro léčbu MPO-T
Z výše uvedených východisek vyplývá doporučený terapeutický algoritmus – viz tab. 3. Uvedený postup byl v červnu roku 2010 přijat i jako standard léčby CEMPO (Central European Myeloproliferative Study Organization). Rizikové pacienty (stačí jeden rizikový faktor) zásadně léčíme tromboreduktivy. Mladší pacienty do 65 let anagrelidem (ANG) nebo interferonem-α (IFN), starší pacienty > 65 let hydroxyureou (HU). Trombaferéza je indikována vždy při počtu trombocytů > 3 000 × 109/l, u symptomatických a krvácejících pacientů při počtu trombocytů > 2 000 × 109/l – ale i u nekrvácejících pacientů je při tomto počtu trombocytů legitimní možností.
Tab. 3. Algoritmus pro léčbu MPO-T. 
Arbitrárně stanoveným terapeutickým cílem je dosažení a udržování počtu trombocytů < 400 × 109/l u vysokorizikových, resp. < 600 × 109/l u nízkorizikových pacientů. Antiagregační terapie, preferenčně nízkými dávkami kyseliny acetylsalicylové (ASA), se řídí u MPO-T počtem trombocytů: nepodáváme ji u pacientů s trombocyty > 1 000 × 109/l, event. u mladších jedinců do 40 let při počtu > 1 500 × 109/l trombocytů, jelikož by se podstatně zvyšovalo riziko krvácení. Teprve je-li dosaženo tromboreduktivní léčbou stabilní úrovně počtu destiček < 400 × 109/l, je možno ASA vysadit, nemá-li pacient v anamnéze arteriální trombózu. Překročí-li pacient užívající neleukemogenní léčbu hranici 65 let, není důvod ji měnit. Detaily týkající se látek užívaných při léčbě MPO-T (ANG, IFN, HU, ASA) jsou uvedeny v podrobných doporučeních [1].
2.2. Léčba polycythaemia vera
Základním kamenem léčby PV jsou venepunkce (event. erytrocytaferézy), antiagregační terapie a při nedostatečnosti předchozích opatření cytoreduktivní terapie.
Cytoreduktivní léčba je indikována v různých situacích:
- a) jde-li o vysokorizikového pacienta z hlediska trombózy – především o nemocné s předchozí trombotickou událostí, o pacienty se současnou trombocytemií (jakýmkoli počtem trombocytů > 400 × 109/l), event. s přidruženým trombofilním stavem,
- b) nestačí-li léčba venepunkcemi udržet hodnotu hematokritu pod 0,45,
- c) vyvíjí-li se (hepato-)splenomegalie,
- d) je-li nemocný výrazně symptomatický.
Podobně jako u ET, i cytoreduktivní terapie u PV musí vycházet z principů primum non nocere. Proto v léčbě první linie upřednostňujeme IFN u pacientů do 65 let, u starších podáváme HU.
Antiagregační terapie (nejlépe pomocí ASA 50–100 mg denně) představuje spolu s venepunkcemi standardní terapii PV 1. linie, není-li ASA kontraindikována a není-li přítomna zároveň trombocytemie > 1 000 × 109/l (znamenající riziko krvácení).
2.3. Léčba pokročilých stadií primárních MPO s myelofibrózou
Zatímco léčebná strategie u časných, proliferativních stadií PMF je v podstatě identická s postupy popsanými pro Ph - MPO-T (viz kapitola 2.1.), pokročilé fáze myelofibrózy, vyznačující se cytopeniemi v různých řadách (obvykle nejprve anémií) a rostoucí mírou myeloidní metaplazie (hepato-/splenomegalií a výskytem nezralých buněk neutrofilní řady a erytroblastů v periferní krvi), vyžadují speciální postupy. Není přitom důležité, zda jde o pokročilou fázi PMF, anebo zda jde o postpolycytemickou myelofibrózu. Jediným dostupným kurativním opatřením je provedení alogenní transplantace krvetvorných kmenových buněk (HSCT), kterou je třeba zvažovat u všech pacientů mladších 65 let. Cílem je nedopustit, aby onemocnění přešlo do s-AML, která je fatální komplikací. Indikace k HSCT shrnuté v tab. 4 vycházejí ze známek rizika transformace do s-AML a z přítomnosti klinických symp-tomů. Naopak všechna ostatní opatření je třeba vnímat v podstatě jako paliativní, zaměřená na zachování co nejvyšší kvality života. Základem paliativní léčby je substituce transfuzními přípravky. V podrobných doporučeních [1] je diskutováno použití dalších léčiv: kortikoidů, androgenů, Epo a darbepoetinu, inhibitorů angiogenezy, JAK2 inhibitorů a také řada dalších opatření, jako splenektomie, radioterapie a postup při portální hypertenzi, včetně založení transjugulárního portosystémového shuntu (TIPS).
Tab. 3. Indikace HSCT u PMF a PPMF. 
prof. MUDr. Miroslav Penka, CSc.
www.fnbrno.cz
e-mail: m.penka@fnbrno.cz
Doručeno do redakce: 6. 2. 2012
Zdroje
1. Schwarz J, Penka M, Campr V et al. Diagnostika a léčba BCR/ABL-negativních myeloproliferaticních onemocnění – principy a východiska doporučení CZEMP. Vnitř Lék 2011; 57 : 189–213.
2. Penka M, Schwarz J, Pytlík R et al. Doporučený postup diagnostiky a terapie esenciální trombocytemie a trombocytemie provázející jiné myeloproliferativní choroby. Vnitř Lék 2005; 51 : 741–751.
3. Schwarz J, Pytlík R, Doubek M et al. Analysis of risk factors: the rationale of the guidelines of the Czech Hematological Society for diagnosis and treatment of chronic myeloproliferative disorders with thrombocythemia. Semin Thromb Hemost 2006; 32 : 231–245.
4. Murphy S. Diagnostic criteria and prognosis in polycythemia vera and essential thrombocythemia. Semin Hematol 1999; 36 (1 Suppl 2): 9–13.
5. Imbert M, Pierre R, Thiele J et al. Essential thrombocythemia. In: Jaffe E, Harris N, Stein H et al (eds). WHO Classification of Tumours: Pathology & Genetics of Tumours of Haematopoietic and Lymphoid Tissues. Lyon: IARC Press 2001 : 39–41.
6. Michiels JJ, Thiele J. Clinical and pathological criteria for the diagnosis of essential thrombocythemia, polycythemia vera, and idiopathic myelofibrosis (agnogenic myeloid metaplasia). Int J Hematol 2002; 76 : 133–145.
7. Michiels JJ, Berneman ZN, Schroyens W et al. Pathophysiology and treatment of platelet-mediated microvascular disturbances, major thrombosis and bleeding complications in essential thrombocythaemia and polycythaemia vera. Platelets 2004; 15 : 67–84.
8. Thiele J, Pierre R, Imbert M et al. Chronic idiopathic myelofibrosis. In: Jaffe E, Harris N, Stein H et al (eds). WHO Classification of Tumours: Pathology & Genetics of Tumours of Haematopoietic and Lymphoid Tissues. Lyon: IARC Press 2001 : 35–38.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2012 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Trvalá virologická odpoveď kombinovanej imunomodulačnej liečby pegylovaným interferónom-α a ribavirínom u bývalých intravenóznych drogovo závislých jedincov s chronickou vírusovou hepatitídou C
- Příznaky bažení po jídle u dětí staršího školního věku a jejich vztah k body-mass indexu
- Klinické dôsledky zväčšenia ľavej predsiene
- Hemokoagulační mechanizmy v procesu aterotrombózy
- Význam urokinázy a jejích inhibitorů pro invazi a metastazování zhoubných nádorů
- Měkké tkáně, hormony a skelet
- Lieky a štítna žľaza
- Vývoj koagulačních markerů chronické diseminované intravaskulární koagulace (DIK) u pacienta s mnohočetnou angiomatózou v průběhu léčby antiangiogenními léky: interferonem α, thalidomidem a lenalidomidem
- Goodův syndrom (s thymomem spojená hypogamaglobulinemie) – 2 kazuistiky
- Shrnutí doporučení České pracovní skupiny pro Ph-negativní myeloproliferativní onemocnění (CZEMP) České hematologické společnosti ČLS JEP pro diagnózu a terapii BCR/ABL-negativních myeloproliferací
- Je potřeba zavádět pojem bažení do klinické praxe? – editorial
- Přehled dosud publikovaných analýz srovnávajících efektivitu léčby inzulinovou pumpou a režimu několika injekcí inzulinu denně u diabetiků 1. typu
- Léčba hypertyreózy radiojodem 131I v ambulantním režimu – bezpečná, účinná a ekonomická varianta
- Celiakie – opomíjená diagnóza
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Klinické dôsledky zväčšenia ľavej predsiene
- Lieky a štítna žľaza
- Léčba hypertyreózy radiojodem 131I v ambulantním režimu – bezpečná, účinná a ekonomická varianta
- Goodův syndrom (s thymomem spojená hypogamaglobulinemie) – 2 kazuistiky
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



