-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Trvalá virologická odpoveď kombinovanej imunomodulačnej liečby pegylovaným interferónom-α a ribavirínom u bývalých intravenóznych drogovo závislých jedincov s chronickou vírusovou hepatitídou C
Virological sustained response to former young intravenous drug abusers with chronic hepatitis C treated by pegylated interferon-α plus ribavirin
Introduction:
The most risk group with high rate of infection of viral hepatitis C represents the former drug abusers (IDUs).Objectives:
The objectives of the clinical study were to assess the sustained virological response (SVR) in the group of former IDUs with chronic hepatitis C (CHC) treated with pegylated interferon-α and ribavirin.Patients and methods:
Of 293 previously untreated (naive) former IDUs with CHC who have started treatment, we assessed 239 (69 women, 170 men) with an average age of 27 years who completed treatment and received a follow-up examination after 24 weeks. Prior to therapy abstinence to drug abuse 6 and more months has been required. The CHC has been diagnostics by the standard virological diagnostic tests, increased activity of aminotranferases (ALT) and histology of liver biopsy. Patients were treated with combined immunomodulatory therapy in the standard duration and standard regimen. SVR was considered if qualitative test HCV RNA was negative 24 weeks after the completion of the treatment.Results:
End-of-treatment virological response was in 224/94 % patients. Overall SVR rate was 95 %, 227 subjects had negative HCV RNA and only 12 patients no response. During treatment there was a statistically significant decrease in ALT. Treatment was accompanied by the expected side effects.Conclusion:
Young age, short duration of HCV infection, high prevalence of genotype 3 and low grade of liver fibrosis in majority of patients and good adherence of patients to treatment were crucial predictive factors resulting in high SVR.Key words:
chronic hepatitis C – pegylated interferon-α – ribavirin – former intravenous drug abusers
Autori: K. Gazdíková 1; †f. Gazdík 2; I. Kajaba 1; D. Hučková 3; D. Daniš 4; Ľ. Okruhlica 5
Pôsobisko autorov: Fakulta ošetrovateľstva a zdravotníckych odborných štúdií Slovenskej zdravotníckej univerzity Bratislava, Slovenská republika, rektorka Dr. h. c. prof. PhDr. Dana Farkašová, CSc. 1; Oddelenie imunológie a imunotoxikológie Slovenskej zdravotníckej univerzity Bratislava, Slovenská republika, rektorka Dr. h. c. prof. PhDr. Dana Farkašová, CSc. 2; HPL spol. s r. o., Bratislava, Slovenská republika, riaditeľ MUDr. Juraj Hanzen 3; Ústav patológie Slovenskej zdravotníckej univerzity Bratislava, Slovenská republika, rektorka Dr. h. c. prof. PhDr. Dana Farkašová, CSc. 4; Inštitút drogových závislostí, Centrum pre liečbu drogových závislostí Bratislava, Slovenská republika, riaditeľ MUDr. Ľubomír Okruhlica, PhD. 5
Vyšlo v časopise: Vnitř Lék 2012; 58(2): 104-109
Kategória: Původní práce
Súhrn
Úvod:
Drogovo závislí jedinci (IDUs) predstavujú najrizikovejšiu skupinu pacientov z hľadiska hepatitídy C. Cieľom sledovania bolo vyhodnotiť trvalú virologickú odpoveď (SVR) na štandardnú liečbu pegylovaným interferónom-α a ribavirínom u bývalých IDUs s chronickou vírusovou hepatitídou C (CHC).Pacienti a metódy:
Z 293 doteraz neliečených (naivných) bývalých IDUs s CHC, u ktorých sme zahájili liečbu, sme vyhodnotili 239 (69 žien, 170 mužov) s priemerným vekom 27 rokov, ktorí ukončili liečbu a absolvovali aj follow-up vyšetrenie po 24 týždňoch liečby (kritérium SVR). Kritériom CHC bolo trvanie infekcie ≥ 6 mesiacov, potvrdené intermitentne/trvale zvýšenými hodnotami aminotransferáz (ALT), virologickým nálezom (protilátky anti-HCV, HCV RNA pozitivita, genotyp) a histologickým nálezom, ak biopsia pečene nebola kontraindikovaná. Do liečby boli zaradení pacienti s minimálne 6-mesačnou abstinenciou užívania drog. Na virologickú diagnostiku sa použili štandardné diagnostické metódy. Pacienti boli liečení kombinovanou imunomodulačnou liečbou v štandardnej dľžke a v štandardnom dávkovacom režime. Kritériom posúdenia SVR bol negatívny nález HCV RNA 24 týždňov od ukončenia liečby.Výsledky:
Na konci liečby odpovedalo 224 pacientov (94 %). SVR sme zaznamenali u 227/95 % pacientov. Pacienti s genotypom 3 odpovedali v 98 % (147 pacientov) a s genotypom 1 v 90 % (80 pacientov). Počas liečby došlo k štatisticky signifikantnému poklesu ALT. Liečba bola sprevádzaná očakávanými vedľajšími účinkami.Záver:
Faktory podieľajúce sa na účinnosti liečby boli: včasný záchyt infekcie u mladej populácie bývalých IDUs; prevaha genotypu 3; nízky stupeň fibrózy a optimálna adherencia k terapii.Kľúčové slová:
chronická hepatitída C – pegylovaný interferón-α – ribavirín – drogovo závislí jedinciÚvod
Celosvetovo je približne 170–200 miliónov jedincov infikovaných vírusom hepatitídy C (HCV), čo predstavuje asi 3 % celosvetovej populácie. Vysoká prevalencia od 40–70 % sa vyskytuje v industrializovaných krajinách sveta, predovšetkým v rizikovej skupine drogovo závislých jedincov (IDUs). Podobná situácia je aj na Slovensku s výskytom HCV infekcie v tejto rizikovej skupine v 25–40 % [1–3]. Riziko infekcie spočíva v progresii akútnej hepatitídy do chronickej v 50–85 %, s rizikom vývoja ireverzibilného poškodenia pečene – cirhózy a rakoviny pečene v priebehu niekoľkých desiatok rokov [4,5]. V USA chronická HCV infekcia a jej komplikácie sú najčastejšiu indikáciou transplantácie pečene [6].
Od roku 1989, kedy bol po prvýkrát identifikovaný HCV, vývoj antivírusovej liečby zaznamenal 3 významné etapy. Poslednou je zavedenie pegylovaného interferónu-α (PEG-IFN-α) 2a a 2b v kombinácii s ribavirínom (R), ktorá doposiaľ predstavuje najefektívnejší spôsob a „zlatý“ štandard liečby chronickej hepatitídy C (CHC).
Ciele klinického sledovania
Cieľom klinického sledovania bolo vyhodnotiť biochemickú a trvalú virologickú odpoveď (sustained virological response – SVR) u bývalých IDUs s CHC, liečených na našej ambulancii PEG-IFN-α-2a a 2b s R.
Pacienti a metódy
Na Oddelení imunológie a imunotoxikológie Slovenskej zdravotníckej univerzity sme v rokoch 2002–2008 zahájili u 293 bývalých IDUs s CHC kombinovanú imunomodulačnú liečbu PEG-IFN-α a R. Päťdesiati štyria pacienti neabsolvovali kompletné vyšetrenia na vyhodnotenie SVR. Dvaja pacienti (1 %) museli predčasne ukončiť liečbu z dôvodu nežiaducich účinkov – u jedného sa jednalo o ťažkú trombocytopéniu s prejavmi krvácania a u jednej došlo k manifestácii reumatoidnej artritídy s nutnosťou terapie. Osemnásti (6 %) pacienti neukončili liečbu pre nespoluprácu a 34 (11 %) sa nedostavilo na vyšetrenie po 1/2 roku od ukončenia liečby, čím nebolo možné vyhodnotiť SVR.
Indikačnými kritériami pre zaradenie do liečby boli abstinencia od drog minimálne 6 mesiacov, potvrdená psychiatrom a opakovanými negatívnymi vyšetreniami moču, pozitívny virologický nález ribonukleovej kyseliny vírusu hepatitídy C (HCV RNA) v sére, stanovený genotyp, pozitivita protilátok proti vírusu hepatitídy C (anti-HCV) pred zahájením liečby, intermitentne alebo trvale zvýšená aktivita aminotransferáz v sére (ALT) počas posledných 6 mesiacov, absencia závažných onkologických, kardiovaskulárnych, neurologických a psychiatrických (ťažké depresívne syndrómy) chorôb. Ďalšou podmienkou bolo, u pacientov bez kontraindikácií, vykonanie biopsie pečene s histologickým vyhodnotením.
Celkovo sme vyhodnotili efektivitu liečby u 239 naivných bývalých IDUs [69 žien (Ž), 170 mužov (M)] s CHC s priemerným vekom 27 rokov (od 17 do 50 rokov), ktorí kompletne ukončili štandardnú kombinovanú imunomodulačnú liečbu a absolvovali aj follow-up vyšetrenie na vyhodnotenie SVR po 24 týždňoch od ukončenia liečby. Genotyp 3 bol stanovený u 150/63 % (43 Ž, 107 M) a genotyp 1 u 89/37 % (26 Ž, 63 M) (tab. 1). Zo 182 (76 %) pacientov (127/70 % M; 55/30 % Ž) liečených PEG-IFN-α-2a s R bol genotyp 1 stanovený u 69 (38 %) a genotyp 3 u 113 (62 %), pričom u jednej pacientky s genotypom 3 sa jednalo o koinfekciu s vírusom hepatitídy B. Z 57 (24 %) pacientov liečených PEG-IFN-α-2b s R bolo 43 mužov (75 %) a 14 žien (25 %), u 20 (35 %) bol stanovený genotyp 1 a u 37 (65 %) genotyp 3.
Tab. 1. Charakteristika súboru. 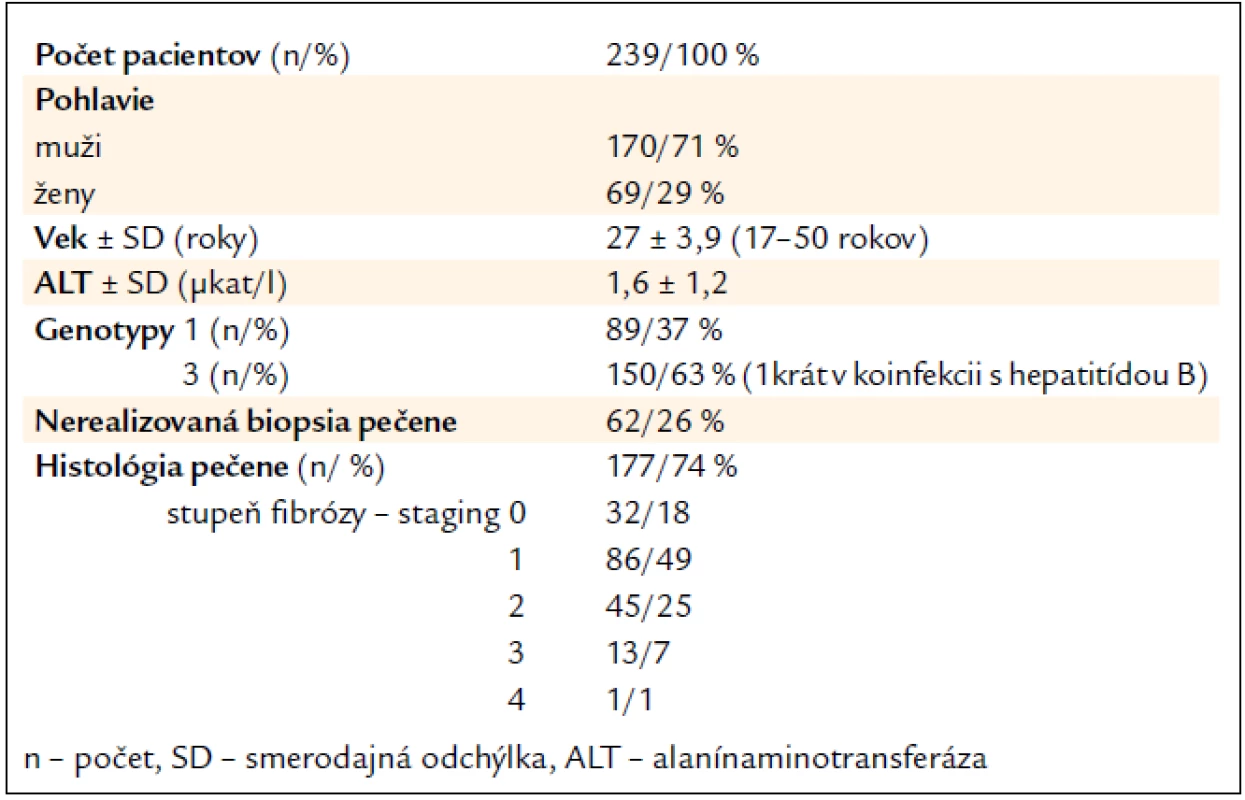
Biopsia pečene bola po vylúčení kontraindikácií realizovaná u 177 pacientov (74 %), z čoho stupeň fibrózy (Staging – S), hodnotený podľa systému Ishaka et al, S0 bol u 32 (18 %), S1 u 86 (49 %), S2 u 45 (25 %), S3 u 13 (7 %) a S4 iba u 1 (1 %) pacienta (tab. 1) [7]. Vo vyhodnotenom súbore nebola zistená pokročilá septálna fibróza (S5) ani cirhóza (S6). U 60 (25 %) bola biopsia pečene kontraindikovaná a u 2 (1 %) sa aj napriek opakovaným pokusom nepodarilo získať reprezentatívnu vzorku pečene. Počas biopsií pečene, ani po nich, neboli zaznamenané žiadne komplikácie.
Najviac liečených pacientov bolo vo veku 26–30 rokov (117/49 %), nasledovali 21–25-roční (70/29 %). Na druhej strane iba do 1 % boli pacienti vyšších vekových skupín 46–50-roční (1/0,5 %) a 41–45-roční (2/1 %) (tab. 2).
Tab. 2. Charakteristika pacientov podľa vekového rozloženia. 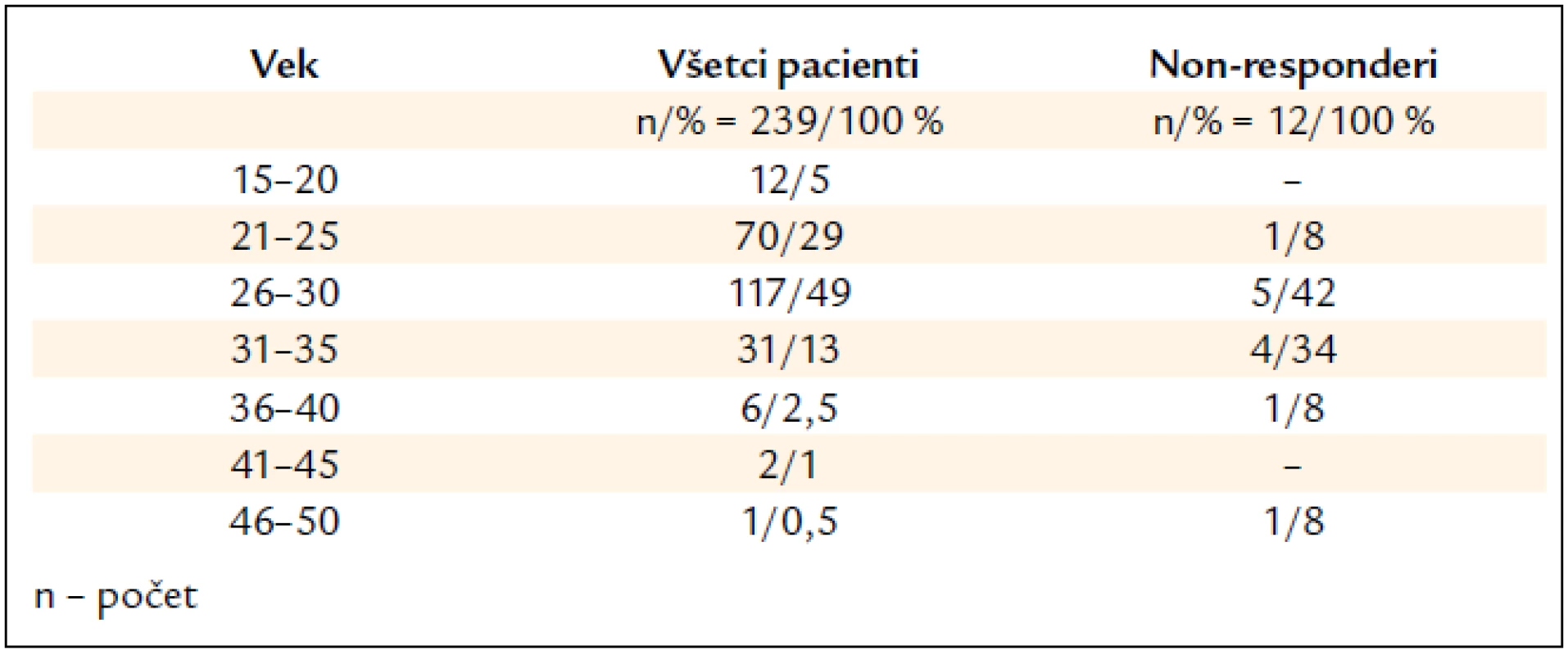
Liečba a sledované parametre
Pred začiatkom liečby boli pacienti písomne, ako aj ústne informovaní o dĺžke liečby, dávkovacom režime, nežiaducich účinkoch liečby a o spôsobe monitorovania bezpečnosti liečby. Každý zo zaradených pacientov podpísal „Informovaný súhlas“.
Pacienti s genotypom 3 absolvovali 24-týždňovú liečbu PEG-IFN-α + R a pacienti s genotypom 1 48-týždňovú liečbu. Dávkovanie PEG-IFN-α 2a a 2b (prípravky Pegasys inj. à 180 μg, Hoffmann-La Roche, Švajčiarsko, PegIntron inj. od 80–150 μg, 1,5 μg/kg//týždeň, Schering Plough, USA) bolo 1-krát týždenne subkutánne a R v dennej dávke od 800–1 200 mg v závislosti od hmotnosti pacienta (Copegus tbl. à 200 mg, Hoffmann-La Roche, Rebetol tbl. à 200 mg, Schering Plough, USA). Za SVR sa považoval negatívny virologický nález v sére (nedetegovateľná HCV RNA PCR metódou) 24 týždňov od ukončenia liečby. Aktivita ALT (μkat/l) sa stanovovala pred začiatkom liečby, v 12. týždni, na konci liečby a 24 týždňov od ukončenia liečby.
Virologický nález (kvalitatívne testy na dôkaz HCV RNA) sme sledovali pred začiatkom liečby, po 12. týždni (EVR – early virological response), na konci (ETVR – end-of-treatment virological response) a 24 týždňov od ukončenia liečby (SVR). Bezpečnosť liečby sme zabezpečovali pravidelným podrobným monitorovaním klinického a laboratórneho nálezu (krvný obraz, diferenciálny rozpočet leukocytov).
Virologické metódy
Protilátky anti-HCV boli vyšetrené ELISA metódou (anti-HCV – Innotest HCV Ab IV, Innogenetics, Belgicko). Kvalitatívny dôkaz HCV bol vykonaný metódou polymerázovej reťazovej reakcie (PCR metódou; Cobas, Hoffmann La Roche, Švajčiarsko), genotyp bol stanovený metódou Versant HCV genotype Assay (LiPA), Bayer HealthCare, USA probova hybridizácia alebo Linear Array HCV genotyping test, Roche, Nemecko.
Biochemické a hematologické metódy
Aktivita ALT a parametre krvného obrazu (erytrocyty, hemoglobín, leukocyty, trombocyty, diferenciálny rozpočet leukocytov) boli stanovené štandardnými metódami v laboratóriách Slovenskej zdravotníckej univerzity.
Biopsia pečene
Pred vykonaním biopsie pečene pacienti absolvovali podrobné interné predoperačné vyšetrenie na zistenie prípadných kontraindikácií k výkonu. Vzorky boli vyhodnotené v Ústave patológie Slovenskej zdravotníckej univerzity s histologickým vyhodnotením podľa skórovacieho systému vypracovaného Ishakom et al [7].
Štatistické spracovanie
Výsledky boli spracované párovým t-Studentovým testom.
Výsledky
Virologická odpoveď
Po 12. týždni a na konci liečby odpovedalo negatívnym HCV RNA nálezom 206/86 %, respektíve 224/94 % pacientov (graf 1). Celková SVR bola zaznamenaná u 227/95 % pacientov, pričom pacienti s genotypom 3 odpovedali v 98 % (147 pacientov) a s genotypom 1 v 90 % (80 pacientov) (graf 1).
Graf 1. Stanovenie HCV RNA počas kombinovanej imunomodulačnej liečby PEG-IFN-α + R (n = 239). EVR (early virological response) – počet pacientov HCV RNA negatívnych po 12. týždni liečby, ETVR (end-of-treatment virological response) – počet pacientov HCV RNA negatívnych na konci liečby, SVR (sustained virological response) – počet pacientov HCV RNA negatívnych po 24 týždňoch od skončenia liečby 
Stopäťdesiatsedem (86 %) pacientov liečených PEG-IFN-α-2a s R dosiahlo EVR, 170 (93 %) ETVR a 173 (95 %) SVR. Porovnateľné výsledky boli zistené aj u pacientov liečených PEG-IFN-α-2b s R EVR dosiahlo 49 pacientov (86 %), ETVR a SVR 54 (95 %) pacientov.
Napriek tomu, že v súčasnosti patrí k štandardu diagnostiky pri genotype 1 aj kvantitatívne vyšetrenie vírusu pred liečbou a následne po 12 týždňoch liečby, ako podklad pre ďalšie rozhodovanie sa o terapeutickom postupe, v našom súbore máme tieto údaje len u časti pacientov, nakoľko v prvých rokoch sledovania nepatrili tieto vyšetrenia k štandardom. Kvantitatívne vyšetrenie bolo stanovené u 1/3 pacientov s genotypom 1 (26 pacientov). Priemerná vírusová nálož bola 2 867 946 IU/ml (102 000–12 530 000 IU/ml). U ďalších 10 pacientov bola semikvantitatívne vyhodnotená vysoká HCV RNA pozitivita. U non-responderov bola stanovená vírusová nálož iba u 2 (120 000 IU/ml; 663 000 IU/ml).
Aktivita ALT (μkat/l)
Po 12. týždni liečby signifikantne poklesla sérová aktivita ALT (1,60 μkat/l vs 0,64 μkat/l, p < 0,05) a na konci liečby sa upravila do referenčného rozmedzia (1,60 μkat/l vs 0,52 μkat/l, p < 0,05) (tab. 3).
Tab. 3. Vplyv kombinovanej imunomodulačnej liečby PEG-IFN-α + R na aktivitu ALT a parametre krvného obrazu (n = 239). 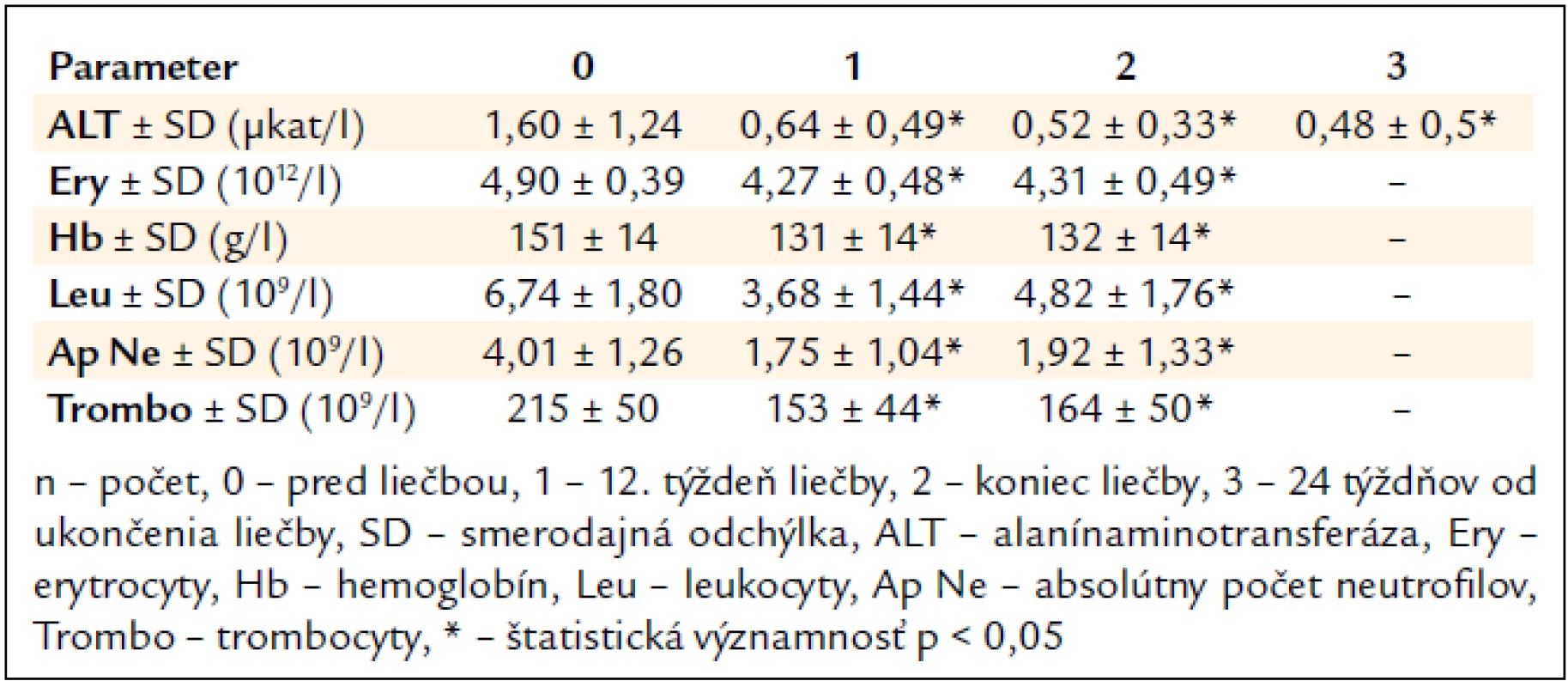
Vedľajšie účinky
Najčastejšími očakávanými vedľajšími účinkami liečby boli flu-like syndróm u 203 pacientov (85 %), gastrointestinálne ťažkosti (nechutenstvo, hnačky, dyspepsia, úbytok hmotnosti) u 191 (80 %), neuropsychiatrické ťažkosti (nervozita, depresie, agresivita) u 88 (37 %) a kožné prejavy (suchá koža, ekzém) u 43 pacientov (18 %). V laboratórnom náleze sme zaznamenali signifikantný pokles parametrov krvného obrazu (tab. 3).
Tab. 4 sumarizuje hlavné pozitívne prediktívne faktory SVR, ktoré sme zaznamenali v analyzovanom súbore pacientov (tab. 4).
Tab. 4. Prediktívne faktory ovplyvňujúce trvalú virologickú odpoveď na kombinovanú imunomodulačnú liečbu PEG-IFN-α + R u 239 bývalých IDUs. 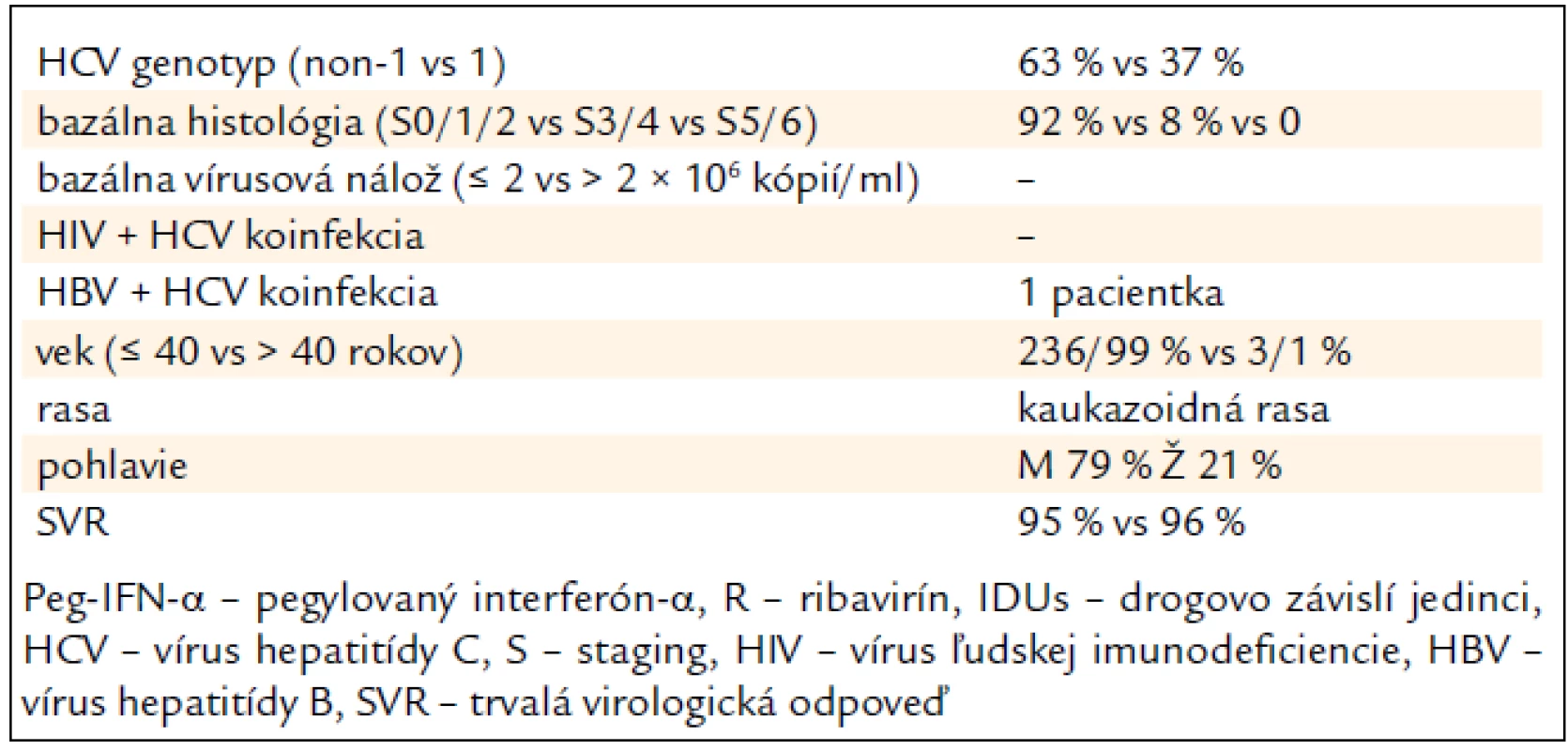
Non-responderi
V skupine 12 non-responderov (5 %) boli 3 ženy a 9 mužov, u 3 bol stanovený genotyp 3, u ostatných 1. Piati pacienti (42 %) boli vo veku 26–30 rokov (4/42 %) a štyria (34 %) 31–35 rokov, najmladší mal 25 rokov a na liečbu neodpovedala aj najstaršia 50-ročná pacientka (tab. 2). U non-responderov bola biopsia pečene realizovaná u 10 (83 %) a z toho po 1 pacientovi (10 %) bola zistená S0, S3, S4; S1 u 3 (30 %), S2 u 4 (40 %) pacientov. U non-respoderov, rovnako ako v celom našom súbore, prevažovali pacienti (7/80 %) s nízkym stupňom fibrózy S0–S2.
Pokles biochemickej aktivity ALT bol zaznamenaný štatisticky významný iba po 12 týždňoch liečby (2,3 μkat/l vs 0,78 μkat/l, p < 0,5), na konci liečby, rovnako ako 6 mesiacov od ukončenia liečby, sa hodnoty ALT štatisticky významne nelíšili (0,81 μkat/l, resp. 1,99 μkat/l).
EVR bola v tejto skupine zaznamenaná u 4 (34 %), ETVR u 7 (58 %) pacientov. Z 9 pacientov s genotypom 1 iba u jedného (1 %) bola dosiahnutá EVR a u 5 (56 %) ETVR.
Diskusia
Už niekoľko rokov sa intenzívne študujú prediktívne faktory, ovplyvňujúce efektivitu liečby HCV infekcie. Je nepochybné, že na účinnosti liečby sa podieľajú ako faktory vírusu, tak aj faktory hostiteľského organizmu [8].
V USA a v krajinách západnej Európy v najrizikovejšej skupine IDUs dominuje genotyp 1 nad genotypom 3, avšak v zhode s našimi výsledkami v Európe pribúdajú práce dokladujúce prevahu genotypu 3 v tejto rizikovej skupine [9–12]. Genotyp 3 priaznivejšie odpovedá na kombinovanú liečbu (70–80 % SVR) v porovnaní s genotypom 1 (40–53 % SVR) [13–16]. Urbánek et al zistili u malého súboru 7 naivných pacientov s genotypom 3, resp. 2 až 100 % SVR [17]. V našej štúdií bola SVR vyhodnocovaná iba u pacientov, ktorí ukončili celú liečbu a absolvovali aj vyšetrenie po 24 týždňoch od ukončenia liečby. Neodpovedali 9 pacienti (9 %) s genotypom 1 a iba 3 (2 %) s genotypom 3, čo potvrdzuje vyššiu úspešnosť liečby pacientov s genotypom 3.
Vek pacientov a dĺžka trvania infekcie sú známe prediktívne faktory odpovede na liečbu [18]. Analyzovaný súbor pacientov z tohto hľadiska predstavoval homogénny súbor (iba bývalí IDUs) s nízkym vekovým priemerom v porovnaní s inými, doposiaľ publikovanými, štúdiami. Vek nad 40 rokov sa považuje za nepriaznivý prediktívny faktor, najpravdepodobnejšie súvisiaci s kapacitou a funkčnosťou imunitného systému, podobne ako pri onkologických ochoreniach [19]. V našom súbore boli iba 5 pacienti starší ako 40 rokov, z toho 2 neodpovedali na liečbu. Priemerný vek pacientov neodpovedajúcich na liečbu bol vyšší (32 rokov) v porovnaní s celkovým priemerným vekom (27 rokov). Najmladší non-responder bol 25-ročný a na liečbu neodpovedala aj najstaršia vyhodnotená 50-ročná pacientka, čo dokladuje význam veku ako faktora SVR.
Krátke trvanie infekcie u mladých jedincov (predpokladáme rádovo niekoľko rokov), bývalých IDUs, je v súlade s histologickými nálezmi biopsie pečene, ktoré dokladujú u väčšiny pacientov nízky stupeň fibrózy pečene S0–S2 163/92 %. Naopak, pokročilá fibróza pečene s prechodom do cirhózy pečene je nepriaznivým prediktívnym faktorom a v našom súbore sa štádia S5 (pokročilá septálna fibróza) ani S6 (cirhóza) nevyskytovali, čo mohlo prispieť k vysokej SVR [19].
Nízka vírusovú nálož pred začiatkom liečby je akceptovaným prediktívnym faktorom úspešnosti liečby [20]. V našej klinickej štúdii sa kvantitatívne testy HCV RNA nevykonávali u všetkých pacientov, nakoľko v prvých rokoch sledovania nepatrili k štandardnej diagnostike. K dispozícií máme vyšetrenia iba pacientov zaradených do liečby po štandardizácii tohto vyšetrenia v rámci diagnostiky a liečby HCV infekcie. Kvantitatívne vyšetrenie máme vyhodnotené iba u 1/3 pacientov s genotypom 1 s priemernou hodnotou 2 867 946 IU/ml. Kvantitatívne vyšetrenie vírusovej nálože pred zahájením liečbu u všetkých pacientov s genotypom 1 by pomohlo sofistikovanejšie vyhodnotiť vplyv tohto faktora na SVR, aj keď dostupné výsledky nenaznačujú, že by sa jednalo o najrelevantnejší faktor úspešnosti liečby nášho súboru. Na druhej strane zaznamenanie EVR iba u jedného z 12 non-responderov potvrdzuje význam EVR pri dosiahnutí SVR.
K úspešnosti liečby prispela aj optimálna adherencia pacientov k liečbe, ktorá bola podmienená úzkou spoluprácou pacientov s ošetrujúcim personálom. McHutchison et al opisujú signifikantne vyššiu terapeutickú účinnosť, ak liečba trvá viac ako 80 % náležitej dĺžky a pacient prijal viac ako 80 % náležitej dávky IFN-α a R. Autori považujú adherenciu k terapii za dôležitý faktor, napomáhajúci k vysokej terapeutickej účinnosti [21]. V našom súbore z pôvodne liečených 293 pacientov 54 (18 %) neukončilo liečbu, z čoho u 2 (necelé 1 %) sa jednalo o zdravotné dôvody, 34 (11 %) neabsolvovali vyšetrenie po 6 mesiacoch od ukončenia liečby, čím nemohla byť vyhodnotená SVR, aj keď liečba bola u nich kompletne ukončená a iba 18 (6 %) pacientov neukončilo liečbu pre nespoluprácu. Všetci pacienti, ktorí ukončili liečbu, spĺňali minimálne kritérium 3 × 80.
Vysoká úspešnosť liečby zistená v našom súbore evokuje možnosť liečby akútnej hepatitídy C so známou vysokou efektivitou liečby. Zaradenie pacientov s pozitivitou anti-HCV, eleváciou hepatálnych testov staršou ako 1/2 roka a minimálne 6 mesačnou abstinenciou od drog (zhodné s kritériom chronicity HCV infekcie) minimalizuje, resp. eliminuje túto možnosť. Ďalším podporným faktom je, že S0 bola iba u 18 % pacientov, kým stupeň fibrózy S1–S4 boli zistené u ostávajúcich 82 % pacientov, ktorí absolvovali biopsiu pečene. V našom súbore neboli pacienti so štádiami S5 a S6, čo na druhej strane podporuje krátke trvanie infekcie u liečených IDUs a môže sa podieľať sa úspešnosti liečby.
Zvýšenia SVR oproti ETR u 3 pacientov – u 2 s genotypom 3 a u jednej s genotypom 1, bude najpravdepodobnejšie spôsobené chybným zberom dát alebo laboratórnou nepresnosťou. U uvedených pacientov boli vykonané kontrolné vyšetrenia aj po roku od ukončenia liečby, ktoré potvrdili negatívne výsledky HCV RNA.
Výsledky uvedenej štúdie otvárajú viaceré otázky, ktoré by v budúcnosti mohli objasniť ďalšie faktory ovplyvňujúce SVR. Nepochybne významnú úlohu budú zohrávať faktory imunitného systému infikovaného jedinca. V súčasnosti prebiehajú sledovania vplyvu variácii lokusu IL-28B na úspešnosť liečby [22]. Ďalším faktorom ovplyvňujúcim odpoveď na kombinovanú imunomodulačnú liečbu podľa Furusyo et al sa javí koncentrácia ribavirínu [23].
Záver
Výsledky predloženej štúdie bývalých drogovo závislých pacientov s chronickou hepatitídou C, liečených PEG-IFN-α 2a a 2b a R, potvrdili vysokú SVR. Nepochybne najdôležitejšími faktormi úspešnosti liečby boli: mladý vek pacientov, krátke trvanie choroby po infikovaní, nízky stupeň fibrózy pečene, prevaha genotypu 3 oproti 1 a veľmi dobrá adherencia pacientov k terapii. Výsledky klinickej štúdie dokladujú význam vyhľadávacieho programu, uskutočňovaného v spolupráci s psychiatrami, adiktológmi a psychológmi; ako aj skoré zahájenie liečby s jej vyššou úspešnosťou.
Klinická štúdia bola realizovaná za podpory grantu MZ SR 2005/28-SZU-06.
doc. MUDr. Katarína Gazdíková, PhD.
www. szu.sk
e-mail: katarina.gazdikova@szu.sk
Doručeno do redakce: 17. 3. 2011
Přijato po recenzi: 30. 8. 2011
Zdroje
1. Gazdik F, Bednarova A, Kazar J et al. Hepatitis C virus genotypes distribution among risk groups in the Slovak Republic. Hepatology 2001; 34 : 559.
2. Gazdík F, Gazdíková K, Kajaba I et al. Séroprevalencia HCV infekcie a distribúcia genotypov u intravenóznych drogovo závislých jedincov v regióne západného Slovenska. Slov Lekár 2006; 16 : 275–278.
3. Gazdik F, Pijak M, Kazar J et al. Hepatitis C virus prevalence among general population and risk groups in the Slovak Republic. Hepatology 2001; 34 : 559.
4. Di Bisceglie AM. Natural history of hepatitis C: its impact on clinical management. Hepatology 2000; 31 : 1014–1018.
5. Seef LB. Natural history of chronic hepatitis C. Hepatology 2002; 36: S35–S46.
6. Biggins SW, Terrault NA. Treatment of recurrent hepatitis C after liver transplantation. Clin Liver Dis 2005; 9 : 505–523.
7. Ishak K, Baptista A, Bianchi L et al. Histological grading and staging of chronic hepatitis. J Hepatol 1995; 22 : 696–699.
8. Oltman M, Kužela L. Vírus hepatitídy C a imunitný systém. Trendy HEPA 2010; 1 : 18–22.
9. Matheï C, Wollants E, Verbeck J et al. Molecular epidemiology of hepatitis C among drug users in Flanders, Belgium: Association of genotype with clinical parameters and with sex - and drug-related risk behaviours. Eur J Clin Microbial Infect Dis 2005; 24 : 514–522.
10. Thomson BJ, Finch RG. Hepatitis C virus infection. Clin Microbiol Infect 2005; 11 : 86–94.
11. Koncova-Fejdiova K, Gazdik F, Hruzikova H. Comparison of the HCV genotypes between active drug users and patients in therapeutic process in the Slovak Republic in the years 2004––2005. J Clin Virology 2006; 26 : 108.
12. Krekulová L, Rehák V, Strunecký O et al. Current situation and trends in the hepatitis C genotype distribution among injecting drug users in the Czech Republic. Epidemiol Mikrobiol Imunol 2009; 58 : 84–89.
13. Fried MW, Siffman ML, Reddy KR et al. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection. N Engl J Med 2002; 347 : 975–982.
14. Hadziyannis SJ, Cheinquer H, Morgan T et al. Peginterferon alfa-2A (40KD) (Pegasys) in combination with ribavirin (RBV): efficacy and safety results from a phase III, randomized, double--blind, multicentre study examining effect of duration of treatment and RBV dose. J Hepatol 2002; 36 : 3.
15. Manns MP, McHutchison JG, Gordon SC et al. Peginterferon alfa-2b plus ribavirin compared with interferon alfa-2b plus ribavirin for initial treatment of chronic hepatitis C: a randomised trial. Lancet 2001; 358 : 958–965.
16. Zeuzem S, Hultcrantz R, Bourliere M et al. Peginterferon alfa-2b plus ribavirin for treatment of chronic hepatitis C in previously untreated patients infected with HCV genotypes 2 or 3. J Hepatol 2004; 40 : 993–999.
17. Urbánek P, Subhanová I, Janoušková E et al. Účinnost terapie pegylovaným interferonem a ribavirinem u pacientů s chronickou HCV infekcí. Vnitř Lék 2009; 55 : 474–479.
18. He LL, Chen Z, Chen Y et al. Association between influential factors and the effectiveness of pegylated interferon alpha-2a plus ribavirin as a combination treatment for chronic hepatitis C patients. Zhonghua Gan Zang Bing Za Zhi 2011 : 19 : 34–37.
19. Schuppan D, Krebs A, Bauer M et al. Hepatitis C and liver fibrosis. Cell Death Differ 2003; 10: S59–S67.
20. Husa P, Šlesinger P, Štroblová H et al. Ovlivnění úspešnosti léčby chronické hepatitdy C hmotností a pohlavím pacienta a výši vstupní viremie. Vnitř Lék 2006; 52 : 590–595.
21. McHutchison JG, Manns M, Patel K et al. International Hepatitis Interventional Therapy Group. Adherence to combination therapy enhances sustained response in genotype-1-infected patients with chronic hepatitis C. Gastroenterology 2002; 123 : 1061–1069.
22. Ochi H, Maekawa T, Abe H et al. IL-28B predicts response to chronic hepatitis C therapy – fine-mapping and replication study in Asian populations. J Gen Virol 2011; 92 : 1071–1081.
23. Furusyo N, Murata M, Ogawa E et al. Ribavirin concentration in the later stages of 48 week pegylated interferon-α-2b plus ribavirin therapy for chronic hepatitis C is useful for predicting virological response. J Antimicrob Chemother 2011; 66 : 1127–1139.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2012 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Trvalá virologická odpoveď kombinovanej imunomodulačnej liečby pegylovaným interferónom-α a ribavirínom u bývalých intravenóznych drogovo závislých jedincov s chronickou vírusovou hepatitídou C
- Příznaky bažení po jídle u dětí staršího školního věku a jejich vztah k body-mass indexu
- Klinické dôsledky zväčšenia ľavej predsiene
- Hemokoagulační mechanizmy v procesu aterotrombózy
- Význam urokinázy a jejích inhibitorů pro invazi a metastazování zhoubných nádorů
- Měkké tkáně, hormony a skelet
- Lieky a štítna žľaza
- Vývoj koagulačních markerů chronické diseminované intravaskulární koagulace (DIK) u pacienta s mnohočetnou angiomatózou v průběhu léčby antiangiogenními léky: interferonem α, thalidomidem a lenalidomidem
- Goodův syndrom (s thymomem spojená hypogamaglobulinemie) – 2 kazuistiky
- Shrnutí doporučení České pracovní skupiny pro Ph-negativní myeloproliferativní onemocnění (CZEMP) České hematologické společnosti ČLS JEP pro diagnózu a terapii BCR/ABL-negativních myeloproliferací
- Je potřeba zavádět pojem bažení do klinické praxe? – editorial
- Přehled dosud publikovaných analýz srovnávajících efektivitu léčby inzulinovou pumpou a režimu několika injekcí inzulinu denně u diabetiků 1. typu
- Léčba hypertyreózy radiojodem 131I v ambulantním režimu – bezpečná, účinná a ekonomická varianta
- Celiakie – opomíjená diagnóza
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Klinické dôsledky zväčšenia ľavej predsiene
- Lieky a štítna žľaza
- Léčba hypertyreózy radiojodem 131I v ambulantním režimu – bezpečná, účinná a ekonomická varianta
- Goodův syndrom (s thymomem spojená hypogamaglobulinemie) – 2 kazuistiky
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



