-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Příprava kardiaka k nekardiální operaci
Autoři: H. Skalická 1; J. Bruthans 2; J. Hradec 3
Působiště autorů: Kardioambulance, s. r. o. Praha, vedoucí pracoviště MUDr. Hana Skalická, CSc., FESC 1; Pracoviště preventivní kardiologie IKEM Praha, přednostka doc. MUDr. Věra Adámková, CSc. 2; III. interní klinika 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Štěpán Svačina, DrSc., MBA 3
Vyšlo v časopise: Vnitř Lék 2012; 58(Suppl 1): 70-78
Kategorie: Doporučené postupy
Úvod
Operační výkony představují výraznou zátěž organizmu. Jsou spojeny s rizikem ischemie myokardu a tkání v důsledku vzniku trombu na nestabilním aterosklerotickém plátu, zvýšené spotřeby kyslíku myokardem a zvýšených metabolických nároků tkání. Zvyšuje se riziko srdečního selhání, zejména kardiodepresivním působením anestetik na myokard. Anestezie, obvykle spinální a epidurální, je spojena s rizikem hypotenze. Operace provází řada komplikací: akutní infarkt myokardu, tromboembolické příhody, krevní ztráty, poruchy ventilace, infekce. Kardiovaskulární komplikace jsou nejčastějšími a velmi závažnými nechirurgickými peroperačními a pooperačními komplikacemi, na peroperační mortalitě se podílejí až 50 %. Pacienti s kardiálním onemocněním jsou ohroženi mnohem více než operovaní s normálním kardiovaskulárním nálezem, perioperační mortalita kardiaků může dosáhnout i několika procent. Mezi pacienty, kteří se podrobují nekardiálním chirurgickým výkonům, představují nemocní s kardiovaskulárním onemocněním 1/4 operovaných. Vzhledem ke stále vyššímu věku operovaných a nárůstu prevalence kardiovaskulárních chorob i počtu operovaných s věkem se počet operovaných kardiaků bude dále zvyšovat. Naše znalosti optimálních postupů pro snížení operačních rizik vycházejí z dosud relativně limitovaného počtu randomizovaných prospektivních studií, ve značné míře jsou podkladem našeho rozhodování retrospektivní studie a paralely s diagnostickými a léčebnými postupy u neoperovaných kardiaků [1]. Pokroky v chirurgii, anesteziologii a kardiologické léčbě i přesnější metody stanovení perioperačního rizika snižují frekvenci kardiovaskulárních komplikací nekardiální chirurgie. Racionální léčba beta-blokátory, antiagregancii, statiny, inhibitory ACE, blokátory receptorů AT1 pro angiotenzin II (sartany), hodnocení stavu koronární cirkulace v indikovaných případech a event. koronární revaskularizace snížily frekvenci perioperačního infarktu myokardu (IM) a úmrtí. Vzhledem k vysokým a stále rostoucím nákladům je snaha při předoperačním vyšetření a peroperační péči prosadit postupy, které budou co nejefektivnější i ekonomicky. Bylo nutné přistoupit k inovaci stávajících doporučení [2].
Zásady předoperačního vyšetření
Při předoperačním přípravě kardiaků je třeba zhodnotit zdravotní stav pacienta včetně komorbidit, určit klinický rizikový profil tak, aby ho pacient, anesteziolog a chirurg mohli použít při svém rozhodování, a formulovat doporučení pro celé operační a pooperační období. Cílem předoperačního hodnocení je posoudit riziko operace i dlouhodobé kardiovaskulární riziko a doporučit opatření, která sníží riziko připravovaného chirurgického výkonu, nikoli pouze vágní formulace typu „není kontraindikace k výkonu“ [3]. Intervenční výkon výhradně s cílem snížit riziko nekardiálního chirurgického výkonu je indikován jen ojediněle, potřeba intervence je posuzována v kontextu celkového stavu nemocného i možnosti ovlivnit jeho pooperační prognózu.
Úspěšné předoperační vyhodnocení a příprava kardiologického nemocného vyžaduje spolupráci a komunikaci pacienta, internisty nebo kardiologa, anesteziologa a chirurga tak, aby byl zajištěn bezpečný průběh operace a minimum komplikací při nákladově efektivním vyšetření a přípravě. Je třeba, aby byly internistovi nebo kardio-logovi provádějícímu předoperační vyšetření na vyžádání poskytnuty, např. praktickým lékařem, relevantní informace o zdravotním stavu pacienta. Internista či kardiolog se zejména vyjadřuje k riziku výkonu a postupům k jeho snížení. Rozsah vyhodnocení a přípravy závisí na závažnosti kardiovaskulárního onemocnění a jeho projevů, náročnosti výkonu a na toleranci zátěže pacientem a je vždy individuální. Závěry předoperačního vyšetření internistou nebo kardiologem jsou podkladem pro anesteziologické vyšetření, které předchází vlastní anestezii. Za bezpečnost nemocného a kvalitu anesteziologické péče ručí vždy konkrétní anesteziolog a je na jeho uvážení, zda doporučený rozsah vyšetření a přípravy v dané situaci rozšíří či omezí [4].
Postup při předoperačním vyšetření
Kardiolog nebo internista postupuje podle obvyklého algoritmu kardiologického vyšetření (tab. 1). V anamnéze se soustředí na kardiovaskulární onemocnění, rizikové faktory ICHS, cerebrovaskulární onemocnění a onemocnění periferních tepen a na další onemocnění, jako je diabetes mellitus, postižení ledvin, plicní, hepatální a hematologická onemocnění. Zjišťuje projevy ischemické choroby srdeční, elektrické nestability srdeční či srdečního selhání, posuzuje závažnost, dynamiku a dosavadní léčbu kardiovaskulárního onemocnění a dalších chorob. Vyhodnotí dostupnou dokumentaci. Odhadne pacientovu funkční kapacitu. V rámci fyzikálního vyšetření hodnotí kompletní interní a kardiologický nález. Součástí základního předoperačního kardiologického vyšetření je analýza EKG, základní laboratorní vyšetření, hemokoagulační vyšetření a vyšetření krevní skupiny, obvykle i RTG hrudníku a echokardiografie, jejíž provedení je jednoznačně indikováno při každé významnější funkční a morfologické patologii a při nejasném nálezu. K indikaci dalších laboratorních vyšetření (ABR), zátěžových testů (bicyklová ergometrie nebo běhátko, thaliová dipyridamolová scintigrafie, zátěžová echokardiografie s dobutaminem), holterovského monitorování, koronarografie a katetrizačního vyšetření přistupujeme uvážlivě. U pacientů s nízkým rizikem zpravidla postačuje základní vyšetření, u neodkladných výkonů je rozsah vyšetření časově limitován.
Tab. 1. Postup při předoperačním vyšetření. 
Stanovení rizika
Byla vypracována řada bodovacích systémů, které přiřazují různou váhu některým faktorům a dospívají k vyjádření celkového rizika chirurgického výkonu [5]. Za nejreprezentativnější v současné době lze považovat systémy, který vychází z revidovaných doporučení ACC/AHA [6,7] a recentních evropských doporučení [1]. Pro kardiaky byly v evropských guidelines definovány základní rizikové faktory, jimiž jsou angina pectoris, prodělaný IM, srdeční selhání, cévní mozková příhoda nebo tranzitorní ischemická ataka (TIA), renální insuficience, sérová koncentrace kreatininu > 170 µmol/l, diabetes mellitus vyžadující inzulinoterapii.
Rozsah předoperačního vyšetření a přípravy určují 3 hlediska:
- pacientovo kardiovaskulární riziko,
- operační riziko,
- funkční zdatnost pacienta.
Kardiovaskulární riziko pacienta
Vysoké kardiovaskulární riziko je spojeno s nestabilními koronárními syndromy: recentním infarktem myokardu (< 30 dnů), zejména při přetrvávajících klinických známkách koronární nestability, nestabilní anginou pectoris; akutním nebo akutně dekompenzovaným srdečním selháním, závažnými dysrytmiemi a hemodynamicky závažnými chlopenními vadami (tab. 2). Tito pacienti vyžadují další neinvazivní, event. i invazivní vyšetření a pečlivou přípravu. Nejde-li o nutný urgentní výkon, je vhodné operaci odložit, popřípadě i zrušit. Platí zásada, že elektivní chirurgické výkony by neměly být prováděny dříve než 4–6 týdnů po prodělaném IM a není-li nebezpečí z prodlení, je doporučován dokonce 6měsíční odklad.
Tab. 2. Klinické predikotry kardiovaskulárního rizika. 
Střední kardiovaskulární riziko představuje stabilní angina pectoris, stav po prodělaném IM (před 1–6 měsíci), kompenzované srdeční selhání či srdeční selhání v anamnéze, diabetes mellitus s podáváním inzulinu, anamnéza cévní mozkové příhody nebo tranzitorní ischemické ataky či renální insuficience. Další vyšetřovací postup u nemocného se středním kardiovaskulárním rizikem a předoperační příprava závisí na obtížnosti operace a funkční kapacitě pacienta.
Nízké kardiovaskulární riziko představuje nález abnormálního EKG (např. hypertrofie levé komory, blokáda levého Tawarova raménka, abnormality úseku ST–T) nebo hemodynamicky nevýznamné poruchy srdečního rytmu a kontrolovaná hypertenze. Podrobnější vyšetření vyžadují jen pacienti s nízkou funkční kapacitou (viz dále), kteří jsou indikováni k výkonům s vysokým operačním rizikem. Většinu pacientů s nízkým kardiovaskulárním rizikem lze doporučit k chirurgickému výkonu již po provedení základního vyšetření (tab. 1).
Kardiovaskulární riziko chirurgického výkonu
Stratifikace kardiálního operačního rizika chirurgických výkonů je ovlivněna 2 základními faktory: druhem operace a mírou a trváním hemodynamické zátěže. Operační riziko nekardiochirurgických operačních výkonů uvádí tab. 3.
Tab. 3. Kardiální* riziko nekardiálních chirurgických výkonů. 
Urgentní výkony lze vzhledem k omezenému času na přípravu pacienta považovat za zvláštní kategorii. Chirurgické aspekty určují operační strategii – zpravidla omezují podrobnější kardiologické vyhodnocení a léčbu.
Vysokým operačním rizikem se vyznačují prolongované operace, výkony spojené s velkými přísuny tekutin a krvácením. Jde především o výkony vaskulární chirurgie, též pro jejich častou koincidenci s koronární nemocí.
Střední operační riziko bývá typické pro chirurgii hlavy a krku, výkony intratorakální, intraperitoneální a ortopedické a pro chirurgii prostaty.
Nízké operační riziko mají výkony endoskopické, malá chirurgie, operace katarakty, ale i chirurgie prsu. Výši rizika ovlivňuje i počet provedených výkonů, respektive zkušenosti chirurgického pracoviště. U řady výkonů byla popsána inverzní lineární závislost mezi počtem provedených výkonů a operační mortalitou. Závažnější operace u vysoce rizikových kardiologických pacientů by měly být prováděny na renomovaných pracovištích.
Funkční kapacita pacienta
Dalším prediktorem peroperačních kardiálních komplikací je snížená funkční kapacita pacienta. Lze ji exaktně stanovit zátěžovým testem nebo odhadnout podle tolerovaných denních aktivit [8]. Funkční kapacita je nejlépe vyjádřitelná spotřebou kyslíku, která je v přímém vztahu s vykonanou prací. Klidová kyslíková spotřeba 40letého muže o hmotnosti 70 kg je 3,5 ml/kg/min, tato hodnota se označuje jako metabolický ekvivalent nebo 1 MET. Při zátěži jsou dosahovány násobky klidové spotřeby. Pro účely odhadu peroperačního rizika je funkční kapacita klasifikována jako výborná (> 7 METs), střední (4–7 METs) a špatná (< 4 METs). Střední funkční kapacita, tj. 4–7 METs, odpovídá rychlé chůzi, chůzi do patra nebo krátkému běhu, špatná funkční kapacita dovoluje pouze běžné denní aktivity, pomalejší až standardní chůzi a je spojena s vyšším peroperačním i dlouhodobým rizikem. Odhad MET podle vykonávaných aktivit ukazuje tab. 4, přibližné srovnání mezi METs a watty při bicyklové ergometrii uvádí Chaloupka [9].
Tab. 4. Odhad funkční kapacity nemocného podle tolerance různých aktivit. 
Algoritmus předoperační přípravy
Při přípravě kardiaků k nekardiálním chirurgickým výkonům je vhodné postupovat podle následujícího algoritmu (tab. 5).
Tab. 5. Rozhodovací algoritmus. 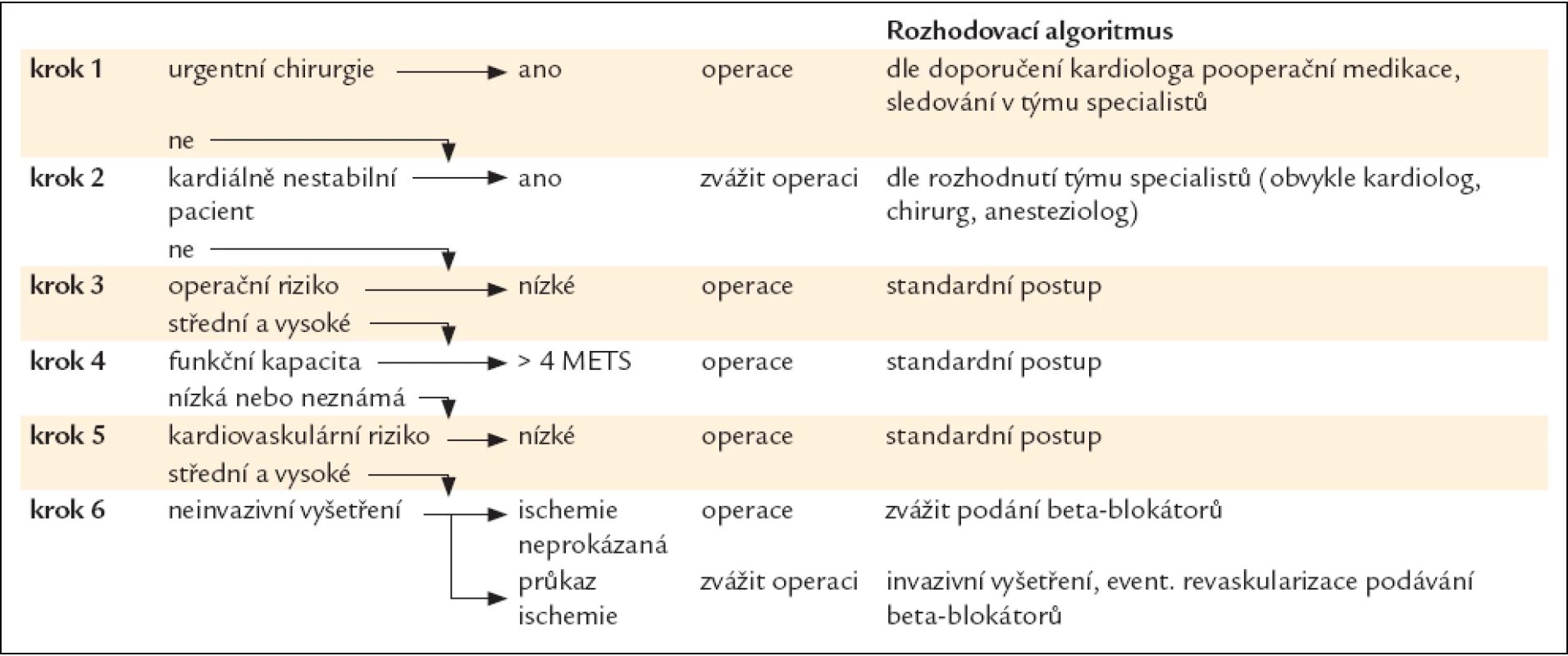
- U urgentních výkonů zpravidla nezbývá čas na rozsáhlejší předoperační přípravu. Můžeme být nuceni se omezit na základní a event. některé neinvazivní vyšetření, např. echokardiografické vyšetření u lůžka pacienta. Doporučíme peroperační sledování a léčbu, včetně pokračování chronické terapie. Je vhodné podrobněji vyhodnotit kardiovaskulární stav pacienta pooperačně.
- Kardiálně nestabilní pacienty a pacienty s jinými klinickými prediktory vysokého kardiovaskulárního rizika indikujeme k elektivním výkonům až po podrobném vyšetření, jehož součástí může být i koronarografické vyšetření. Náležitá příprava, např. revaskularizace myokardu, může vyžadovat odklad chirurgického výkonu a nakonec lze dojít i k závěru, že výkon by pro pacienta ani nemusel být únosný.
- Pacienty, u nichž byla v posledních 5 letech provedena koronární revaskularizace a jejichž klinický stav zůstal stabilní, bez známek ischemie, a pacienty, kteří byli v posledních 2 letech podrobně invazivně nebo neinvazivně kardiálně vyšetřeni včetně vyhodnocení stavu koronární cirkulace a jejichž stav byl shledán příznivým a dále se nezměnil, můžeme indikovat k výkonu zpravidla bez dalších speciálních vyšetření.
- U pacientů s nízkým kardiovaskulárním rizikem probíhají chirurgické výkony bezpečně. Výjimkou jsou nemocní s nízkou tolerancí zátěže podrobující se výkonům s vysokým operačním rizikem – u těchto pacientů o operaci rozhodne výsledek neinvazivních testů.
- U pacientů se středním kardiovaskulárním rizikem je nutné volit diferencovaný postup podle tolerance zátěže a náročnosti operace. Při přípravě pacientů s dobrou funkční kapacitou k výkonům s malým a středním operačním rizikem postačuje základní vyšetření. V ostatních případech je třeba přistoupit k neinvazivním vyšetřením.
- Pacienti s příznivými výsledky neinvazivních testů mají nízké riziko peroperačního infarktu a úmrtí. Invazivní vyšetření jsou indikována jen u pacientů s výrazně pozitivními neinvazivními testy.
- Rozhodnutí o invazivním vyšetření, zpravidla koronarografii, vyplývá z výsledků klinického hodnocení a neinvazivních testů a na základě stejných kritérií jako u jiných, operaci se nepodrobujících kardiologických nemocných. Indikace k revaskularizačním a korektivním výkonům neurčuje pouze snaha umožnit převedení pacienta přes rizika nekardiochirurgického výkonu, ale širší rozvaha o zlepšení prognózy takto ošetřených nemocných i v dalším pooperačním období. Součet rizika chirurgického revaskularizačního výkonu a nekardiochirurgické operace se zpravidla výrazněji neliší od operačního rizika nemocného bez předchozí revaskularizace. Nemocní po provedené intervenci mají proti neintervenovaným výrazně lepší dlouhodobou pooperační prognózu [10].
Další předoperační vyšetření
Jejich hlavním cílem je posouzení přítomnosti a závažnosti ischemie myokardu, vyhodnocení srdeční funkce a stanovení funkční kapacity pacienta a diagnostika dalších patologických stavů. Na podkladě těchto údajů je pak odhadnuto peroperační i dlouhodobé riziko a vzácně indikován revaskularizační nebo korektivní výkon.
Stanovení funkce levé komory
Se zhoršováním systolické, ale i diastolické funkce levé komory rychle roste riziko peroperačního selhání a při ejekční frakci levé komory < 0,35 i peroperační mortalita. Pokles ejekční frakce levé komory však není prediktorem ischemických příhod. Stanovení ejekční frakce levé komory je jednoznačně doporučeno u chronického srdečního selhání, vhodné je i při anamnéze srdečního selhání a u dyspnoe neznámého původu, není však indikováno jako rutinní test u pacientů bez anamnézy srdečního selhání. Ejekční frakci levé komory lze nejsnáze hodnotit echokardiograficky, ale také izotopovou nebo RTG kontrastní ventrikulografií a magnetickou rezonancí. Nejčastěji je hodnocena echokardiograficky. Toto relativně levné, dobře dostupné a pacienta nezatěžující vyšetření poskytuje funkční i morfologickou diagnostiku v celém spektru srdečních onemocnění.
Průkaz ischemie myokardu
Zátěžové testy zpřesňují diagnostiku ischemie myokardu a slouží k upřesnění funkční kapacity. Zpravidla předcházejí rozhodnutí o event. koronarografickém vyšetření. Průměrná senzitivita a specificita předoperačního zátěžového EKG vyšetření (bicyklová ergometrie, běhátko) pro průkaz koronární ischemie je 74 %, resp. 69 % [11]. Senzitivita vyšetření stoupá a specificita klesá s závažností koronárního postižení. Riziko peroperačních kardiálních komplikací a dlouhodobé riziko se zvyšuje u pacientů s abnormálním výsledkem zátěžového EKG při nízkém stupni zátěže. Pacienti s dobrou tolerancí zátěže mají naopak riziko peroperačních komplikací nízké [10].
Dobutaminová zátěžová echokardiografie nebo zátěžová perfuzní scintigrafie myokardu jsou indikovány při sporném výsledku zátěžového EKG vyšetření nebo za situace, kdy zátěžové EKG není proveditelné či hodnotitelné (pohybové omezení, abnormality EKG, které znemožňují hodnocení EKG známek ischemie, jako např. blokáda levého Tawarova raménka, stimulovaný rytmus). Slouží také k posouzení viability myokardu (reverzibilní perfuzní defekt). Obě metody mají srovnatelně vysokou negativní prediktivní schopnost peroperačních komplikací (90–99 %), ale jen omezenou pozitivní prediktivní hodnotu [12,13]. Zátěžová perfuzní scintigrafie myokardu je výrazně nákladnější než zátěžová echokardiografie. Zpravidla ji indikujeme při špatné kvalitě echokardiografického vyšetření. Obecně platí, že spolehlivost vyšetření je do značné míry podmíněna zkušeností a kvalitou laboratoře [14,15].
Selektivní koronarografie je v rámci předoperačního vyšetření indikována jen u pacientů s výrazně pozitivními výsledky zátěžových testů, anginou pectoris rezistentní na adekvátní farmakoterapii, nestabilní anginou pectoris a při sporných výsledcích zátěžových testů u pacientů s vysokým kardiovaskulárním rizikem, kteří jsou indikováni k výkonům zatíženým vysokým rizikem. Provedení koronarografie může být vhodné i u pacientů se středně závažným nálezem při zátěžovém testu, u urgentních výkonů v subakutní fázi IM a u pacientů, kteří prodělali peroperační IM. U vysoce rizikových pacientů lze indikovat provedení koronarografie jen na základě anamnézy, fyzikálního vyšetření, popř. klidového EKG, bez předchozích zátěžových testů.
Předoperační intervence
Na základě klinického nálezu, výsledků neinvazivních testů a katetrizačního nálezu rozhodujeme o indikaci revaskularizačního výkonu, korekci vady apod. Intervence má nejen snížit riziko nekardiochirurgického výkonu, ale též zlepšit další pooperační prognózu pacienta.
Indikační kritéria chirurgické koronární revaskularizace (aortokoronární bypass) jsou identická s obecnými indikacemi: akceptovatelné riziko revaskularizačního výkonu, viabilní ischemický myokard, stenóza kmene levé koronární arterie, nemoc 3 tepen s dysfunkcí levé komory nebo nemoc 2 tepen s významnou proximální stenózou ramus interventricularis anterior a angina pectoris rezistentní na maximální farmakoterapii. Chirurgickou revaskularizaci indikujeme jen u pacientů, u nichž je plánován výkon s vysokým chirurgickým rizikem [16].
Koronární angioplastika je indikována ke snížení peroperačních ischemických komplikací u pacientů s akutním koronárním syndromem. U stabilní ICHS má účinek sporný. Její indikace je akceptována u významné stenózy koronární tepny s průkazem těžké koronární insuficience při zátěžovém testu, symptomy koronární insuficience i při farmakoterapii a před chirurgickým výkonem s vysokým operačním rizikem. Chirurgický výkon lze provést nejdříve 1 měsíc po aortokoronárním bypassu, 14 dní po koronární angioplastice bez uložení stentu, 6 týdnů po angioplastice s uložením kovového stentu a nejdříve rok po uložení lékového stentu (obr. 1). U těchto pacientů by nemělo být přerušeno podávání kyseliny acetylsalicylové [1].
Obr. 1. Postup v návaznosti na koronární intervenci. PCI – perkutánní koronární intervence, PBA – prostá balonková angioplastika, BMS – metalický stent, DES – lékový stent. 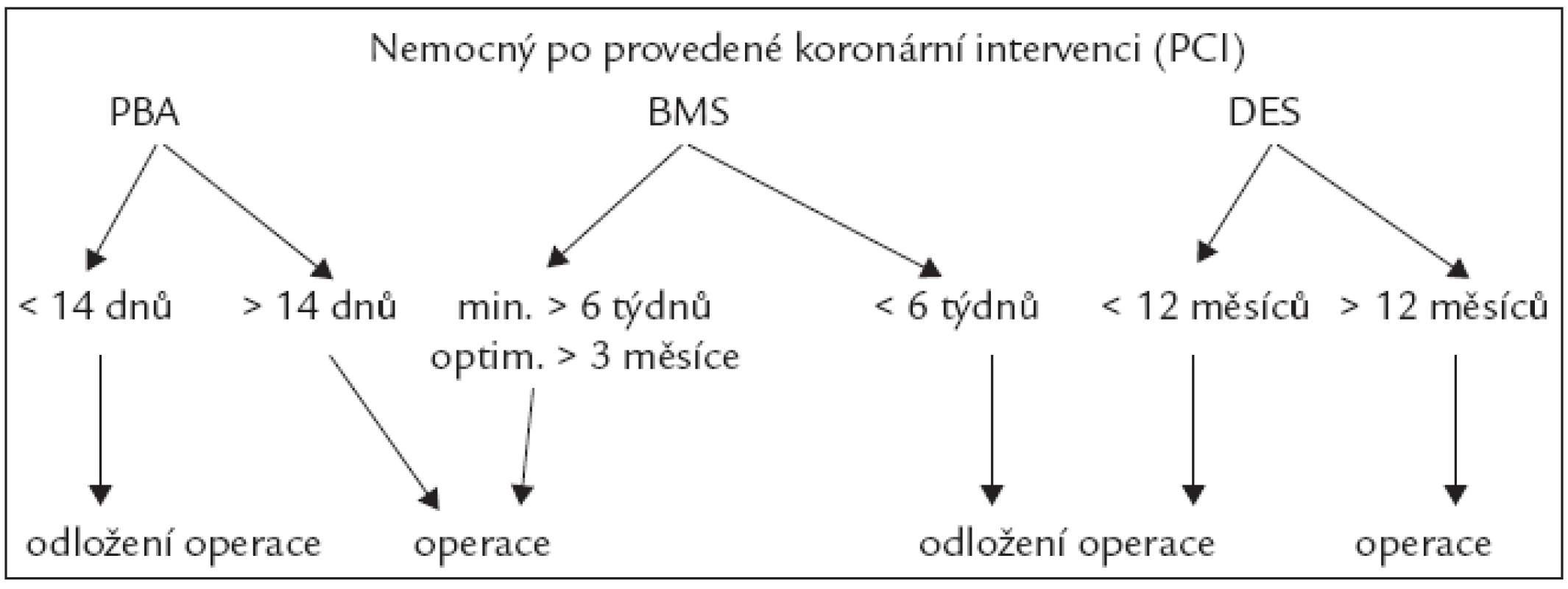
Farmakologické postupy ke snížení operačního rizika
Beta-blokátory: chronická léčba nemá být přerušena. Léčbu beta-blokátory je vhodné zahájit u pacientů s ICHS a u chirurgických výkonů s vysokým operačním rizikem [17]. Podle současných doporučení by k zahájení léčby mělo dojít 1 týden před plánovaným výkonem a dávka by měla být titrována do klidové srdeční frekvence 60–70/min a systolického krevního tlaku ne nižšího než 110 mm Hg [18].
Statiny: chronická léčba nemá být přerušena. Podávání u pacientů indikovaných k chirurgickým výkonům s vysokým rizikem může přispět ke stabilizaci aterosklerotických plátů.
Antikoagulační terapie zvyšuje krvácivé komplikace, operační výkon vyžaduje úpravu dosavadní antikoagulační terapie. Pro většinu výkonů představuje krvácení při perorální antikoagulační léčbě závažnou komplikaci, ale zároveň existuje i výrazné riziko tromboembolických příhod při jejím vysazení. U minimálně invazivních výkonů je doporučováno snížení antikoagulační léčby warfarinem tak, aby po dobu výkonu bylo dosaženo subterapeutických hodnot INR, a návrat k účinné dávce bezprostředně po výkonu. U větších výkonů se doporučuje ukončit podávání warfarinu 5 dnů před výkonem s kontrolou INR v den operace, akceptovatelná je hodnota ≤ 1,5. Podávání dabigatranu se doporučuje 1–2 dny před operací při clearance kreatininu > 50 ml/min, 3–5 dní při clearence kreatininu ≤ 50 ml/min. Podávání rivaroxabanu by podle předběžných údajů mělo být ukončeno minimálně 24 hod před výkonem, je-li to podle posouzení lékaře možné. Nelze-li výkon odložit, je třeba posoudit zvýšené riziko krvácení vůči neodkladnosti zákroku. Léčba rivaroxabanem má být po výkonu znovu zahájena co nejdříve, pokud to situace umožní a pokud je dosaženo odpovídající hemostázy.
Pacienty vyžadující trvalou antikoagulační léčbu (mechanická chlopeň, kratší než roční anamnéza trombózy nebo embolie, hyperkoagulační stav, fibrilace síní, event. též ejekční frakce levé komory < 0,30 %) je třeba převést na nízkomolekulární heparin (obr. 2). Při korekci anémie a trombocytopenie navozené antikoagulační léčbou, transfuzí či náplavy je doporučován spíše konzervativnější postup po konzultaci s chirurgem.
Obr. 2. Přerušení antikoagulační léčby před operací. 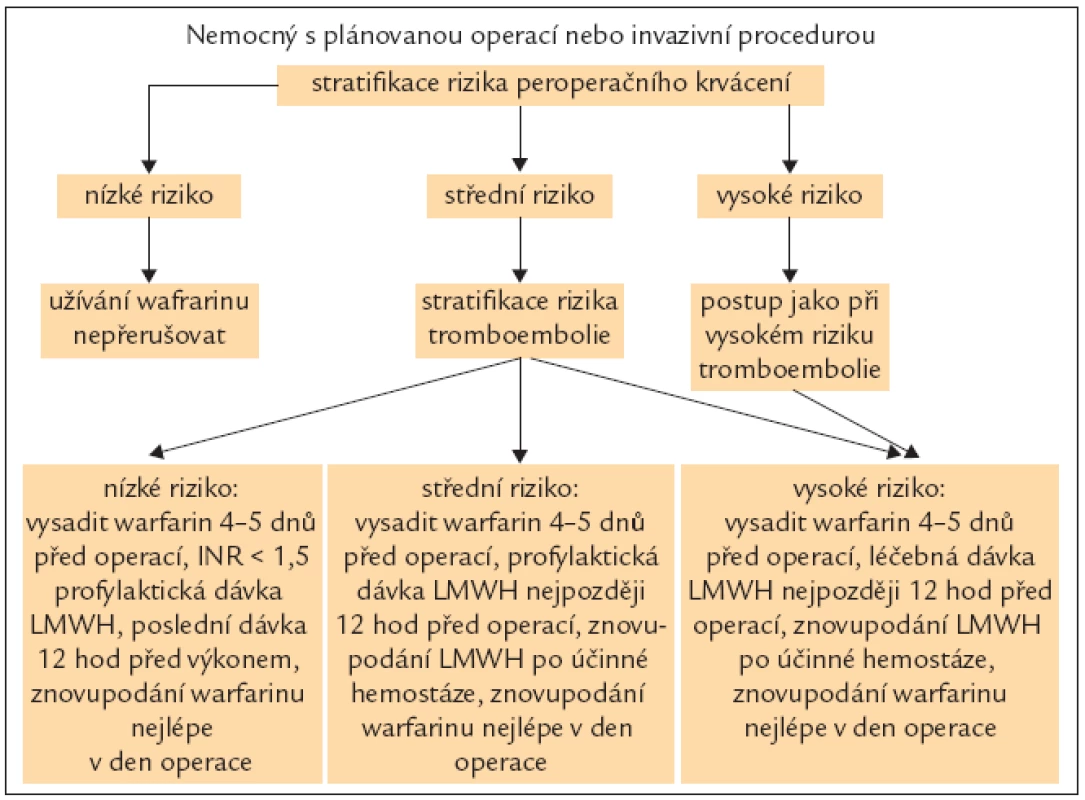
Antiagregační terapie sice zvyšuje riziko krvácivých komplikací operačního výkonu, ale její přerušení na druhou stranu zase zvyšuje riziko periprocedurální ischemie a IM až trojnásobně. V současné době na vysazení antiagregační terapie neexistuje jednotný názor, peroperační podávání antiagregancií je nutné konzultovat s chirurgem. U nemocných s vysokým rizikem aterotrombotické příhody (tab. 6) by se antiagregační léčba měla přerušit jen při operacích s vysokým rizikem krvácení (tab. 7), které jednoznačně převýší prospěch z antiagregační léčby. U nemocných s lékovými stenty je vysazení duální antiagregační terapie do roka po výkonu kontraindikováno. Přehledně viz obr. 3.
Tab. 6. Klinické situace, které jsou spojeny s vysokým rizikem aterotrombotické příhody. 
Tab. 7. Riziko krvácení při operacích a invazivních výkonech. 
Obr. 3. Antitrombotická terapie a operace. ASA – kyselina acetylsalicylová, BMS – metalický stent, DES – polékový stent. 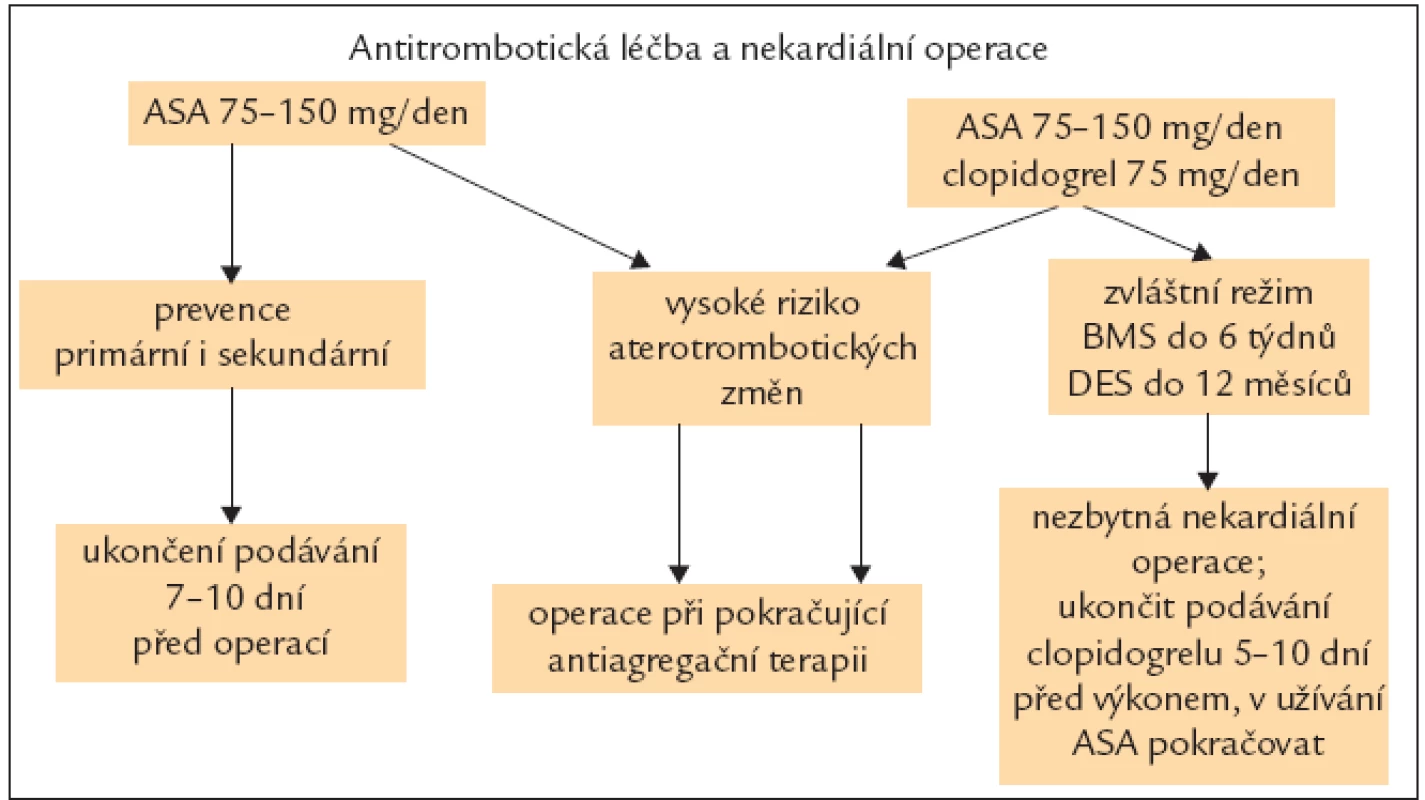
Postup u jednotlivých srdečních onemocnění
Nejčastěji se setkáváme s ischemickou chorobou srdeční (ICHS), která je hlavním rizikovým faktorem peroperační morbidity a mortality kardiovaskulárních nemocných. Riziko peroperačního a pooperačního IM zvyšuje až 10krát. Elektivní chirurgický výkon by neměl být prováděn dříve než 6 měsíců po prodělaném IM, nelze-li jej odložit, pak alespoň 4–6 týdnů po IM, dříve jen z vitální indikace. Přítomnost závažného koronárního postižení nemusí být zjevná, např. u nemocných s výrazným funkčním omezením při postižení pohybového aparátu nebo při periferním vaskulárním onemocnění. Pro přesné stanovení rizika je potřeba určit rozsah postiženého myokardu a stupeň zátěže vyvolávající ischemii a zhodnotit funkci levé komory. Neobejdeme se bez neinvazivních vyšetření, a především zátěžových testů. Prognózu chirurgického výkonu výrazně negativně ovlivňuje diabetes mellitus, vyšší věk (mortalita peroperačního a perioperačního IM se zvyšuje s věkem) a pohlaví pacienta (premenopauzální ženy mají nižší incidenci ICHS, akutní IM je u žen zatížen vyšší mortalitou). Je třeba posoudit, zda je léčba pacienta optimální. Je vhodné pokračovat v dosavadní farmakoterapii ICHS a nepřerušovat podávání především beta-blokátorů, které prokazatelně snižují výskyt peroperační myokardiální ischemie i infarktu myokardu [19]. Ranní perorální dávku léků lze podat ještě v den operace, peroperačně lze pokračovat parenterální aplikací. Na přerušení antiagregační terapie není jednoznačný názor, je třeba zvážit na jedné straně riziko perioperační ischemie či rozvoje IM, na straně druhé riziko krvácení. Podávání antiagregancií se přeruší zhruba týden před operací – viz výše.
Lehká a středně těžká arteriální hypertenze není nezávislým rizikovým faktorem pro vznik peroperačních kardiovaskulárních komplikací. Na druhé straně jsou předoperační vysoké hodnoty krevního tlaku spojeny s výraznějším kolísáním tlaku během operace a větším rizikem vzniku peroperační ischemie. Riziko zvyšují komplikace hypertenze (dysfunkce levé komory, renální selhání). Kardiolog se má vyjádřit k závažnosti hypertenze a event. orgánovým postižením. V léčbě hypertenze je třeba pokračovat až do operace (ranní dávka hypotenziva v den operace). Velmi vhodnými antihypertenzivy jsou beta-blokátory, které snižují nestabilitu krevního tlaku během operace a snižují riziko vzniku peroperační ischemie. Před operací je třeba korigovat těžší hypertenzi (systolický tlak > 180 mm Hg, diastolický > 110 mm Hg).
Arytmie a poruchy srdečního vedení jsou sice nezávislými rizikovými faktory peroperačních komplikací, jejich závažnost je ale v zásadě podmíněna základním kardiologickým onemocněním a funkčním stavem nemocného. Na vzniku perioperačních a pooperačních arytmií se může podílet také toxicita podávaných léků, hypotenze, hypoxie, anémie, změny cirkulujícího objemu krve, metabolické a další změny vyvolané anestezií a operační léčbou. Intervenujeme pouze arytmie symptomatické a hemodynamicky významné, např. supraventrikulární tachykardie s nekontrolovanou srdeční frekvencí nebo setrvalou komorovou tachykardii.
Také pro léčbu poruch převodu platí obdobná kritéria jako při léčbě neoperovaných kardiaků. Ke kardiostimulaci, trvalé nebo dočasné, podle předpokládaného trvání poruchy srdečního rytmu, přistupujeme u pacientů se symptomatickými a pokročilými poruchami tvorby a převodu srdečního vzruchu (AV blokáda II. a III. stupně fixního typu, nově vzniklá bifascikulární blokáda v peroperačním období, těžká vagová bradykardie). Unipolární elektrokoagulace a některé další procedury při operaci mohou interferovat s funkcí implantovaných kardiostimulátorů a kardioverterů (ICD). U pacientů dependentních na stimulaci a s implantovaným ICD je proto třeba konzultovat arytmologa, který zajistí přiměřený režim kardiostimulátoru a ICD po dobu operace.
Srdeční selhání zvyšuje riziko nekardiologických operačních výkonů. Riziko výkonu koreluje s peroperační závažností selhání, nikoli s předoperačním stupněm kardiální insuficience. Anamnéza a fyzikální vyšetření v rámci předoperačního vyšetření má odhalit nepoznané srdeční selhání a určit jeho etiologii. Úlohou kardiologa je pacienta před chirurgickým výkonem kardiálně kompenzovat a stanovit peroperační léčbu.
Kardiomyopatie jsou spojeny s vyšším rizikem perioperačního srdečního selhání. Kardiolog diagnostikuje typ kardiomyopatie a posuzuje stupeň systolické a diastolické dysfunkce, zejména na základě echokardiografického vyšetření:
- dilatační kardiomyopatie v rozvinuté formě s těžkou dysfunkcí levé komory v pokročilém stadiu ohrožuje nemocné projevy srdečního selhání;
- hypertrofická kardiomyopatie je nejednotná skupina postižení; nejzávažnější formu představuje postižení septa s obstrukcí výtokového traktu, zvýraznění obstrukce při hypovolemii může být pro nemocné kritické [20];
- infiltrativní kardiomyopatie zahrnuje onemocnění vedoucí k postižení systolické i diastolické funkce; kardiovaskulární komplikace jsou podmíněny srdečním selháním, které závisí na etiologii a stupni postižení.
Chlopenní a vrozené srdeční vady: nemocní s asymptomatickou, hemodynamicky nevýznamnou chlopenní vadou, kteří jsou klinicky stabilní, mohou podstoupit výkon bez omezení.
Nemocní s chlopenní vadou méně až středně významnou, klinicky stabilní – stenotická vada (NYHA I–II) – představují malé až střední kardiovaskulární riziko operačního výkonu obdobně jako vady regurgitační (NYHA I–III). K chirurgickému výkonu lze nemocného doporučit.
Nemocní s významnou symptomatickou chlopenní vadou – významná stenotická vada (NYHA III–IV), regurgitační vada hemodynamicky významná (NYHA IV) – vyžadují velmi pečlivé zhodnocení s úvahou náhrady chlopně před plánovaným nekardiálním výkonem.
Nejvyšší riziko u chlopenních vad je spojeno s těžkou aortální stenózou (obr. 4), kdy je třeba před elektivním nekardiologickým chirurgickým výkonem zvážit operační řešení nebo katetrizační implantaci aortální chlopně (TAVI). Mitrální stenóza je v současnosti u nás už relativně vzácná. U těžké mitrální stenózy se doporučuje chirurgická korekce tam, kde výkon na chlopni prodlouží život pacienta a brání komplikacím nezávisle na plánované nekardiální chirurgii. Alternativním postupem může být balónková mitrální valvuloplastika (PTMV). U mitrální stenózy je nutná pečlivá kontrola srdeční frekvence a zamezení tachykardii v peroperačním a pooperačním období [21].
Obr. 4. Aortální stenóza a nekardiální operace. 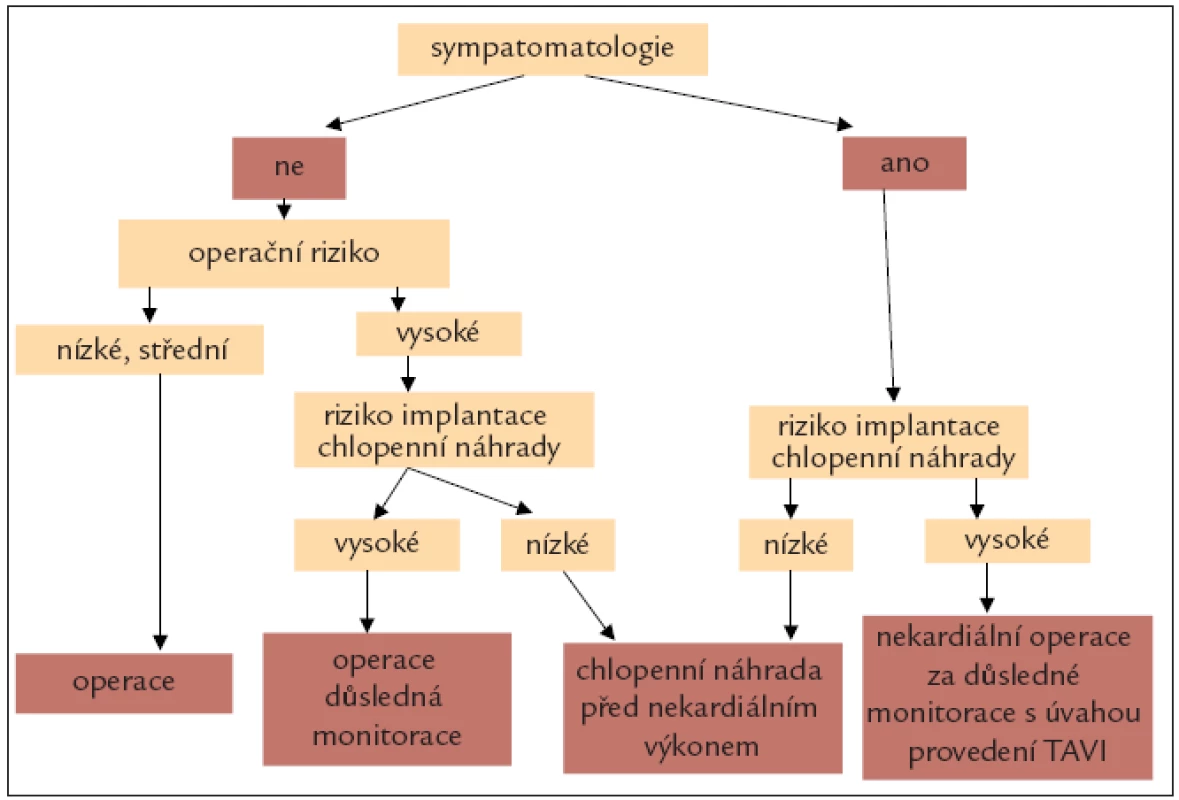
Regurgitační vady jsou peroperačně lépe tolerovány. Předoperační příprava je zaměřena na kardiální kompenzaci, kontrolu volumu a redukci afterloadu. Příprava je nutná zejména u těžké mitrální insuficience. Tachykardie je lépe tolerována u regurgitačních vad než u stenóz. U mitrální regurgitace již mírné snížení ejekční frakce levé komory může signalizovat výraznou poruchu funkce levé komory. Systémová hypotenze zvětší pravolevý zkrat u cyanotických vad. U pacientů s chlopenními vadami, zejména po náhradě chlopní, je při výkonech s rizikem bakteriemie nutná profylaxe infekční endokarditidy.
Tromboembolická choroba: u nemocných se středním a vyšším rizikem tromboembolických komplikací (anamnéza hluboké žilní trombózy a embolie, větší výkony u pacientů starších 60 let, operace malignit, výkony v pánvi, operace kyčelního kloubu, hyperkoagulační stavy, městnavá srdeční slabost) je třeba použít všechny prostředky prevence: elastické bandáže dolních končetin, časnou mobilizaci, cvičení, podání heparinu a nízkomolekulárního heparinu.
Plicní hypertenze, ať jako samostatná klinická jednotka, či provázející vrozené srdeční vady, vyžaduje individuální přístup na specializovaném pracovišti s týmovým rozhodnutím.
Závěr
Předoperační příprava kardiologických pacientů podstupujících nekardiologické chirurgické výkony vyžaduje úzkou spolupráci chirurga, anesteziologa a internisty nebo kardiologa. Rozsah kardiologického vyšetření a terapie je v zásadě stejný jako u kardiaků nepodstupujících operaci, ale konkrétní postup závisí na naléhavosti operace, kardiovaskulárním riziku pacienta, riziku chirurgického výkonu a funkční kapacitě pacienta. Neinvazivní a invazivní vyšetření je třeba provést v přiměřeném rozsahu – tak, aby výsledky provedených testů ovlivnily peroperační péči o pacienta. Kardiolog nebo internista formuluje závěr a doporučení s cílem snížit peroperační riziko. Zároveň by měl formulovat i doporučení pro pooperační období (další terapii, intervenci koronárních rizikových faktorů apod.).
MUDr. Hana Skalická, CSc., FESC
www.kardioambulance.cz
e-mail: mail@kardioambulance.cz
Doručeno do redakce: 20. 12. 2011
Otištěno s laskavým svolením výboru České kardiologické společnosti a redakční rady časopisu Cor et Vasa. Originálně publikováno v Cor Vasa 2011; 53 (Suppl 1): 78–85.
Zdroje
1. Poldermans D, Bax JJ, Boersma E et al. Task Force for Preoperative Cardiac Risk Assessment and Perioperative Cardiac Management in Non-cardiac Surgery; European Society of Cardiology (ESC). Guidelines for preoperative cardiac risk assesment and perioperative cardiac management in non-cardiac surgery. Eur Heart J 2009; 30 : 2769–2812.
2. Bruthans J, Skalická H. Doporučení pro přípravu kardiaka k nekardiální operaci. Cor Vasa 2001; 43: Kardio 101–106.
3. Herold I. Metodický návod k provádění vyšetření nemocných před operačními a diagnostickými výkony v celkové a svodné anestesii. Anestesiologie a nedkladná péče 1995; 12–15.
4. Skalická H, Šturma J, Křikava K et al. Předoperační vyšetření. Praha: Grada Publishing 2007.
5. Goldman L, Caldera DL, Nusbaum SR et al. Multifactorial index of cardiac risk in noncardiac surgical procedures. N Engl J Med 1977; 297 : 845–850.
6. Eagle KA, Brundage BH, Chaintman BR et al. Guidelines for perioperative cardiovascular evaluation for noncardiac surgery. Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Committee on Perioperative Cardiovascular Evaluation for Noncardiac Surgery. Circulation 1996; 93 : 1278–1317.
7. Fleischer LA, Beckman JA, Brown KA et al. ACC/AHA 2007 guidelines on perioperative cardiovascular evaluation and care for noncardiac surgery: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation 2007; 116: e418–e500.
8. Hlatky MA, Boineau RE, Higginbotham MB et al. A brief self-administred questionnaire to determine functional capacity (the Duke Activity Status Index). Am J Cardiol 1989; 64 : 651–654.
9. Chaloupka V. Zátěžové testy v kardiologii. Zátěžová elektrokardiografie. Doporučené postupy v kardiologii II. Česká kardiologická společnost Brno 2000 : 75–81.
10. Kertai MD, Boersma E, Bax JJ et al. A meta-analysis comparing the prognostic accuracy of six diagnostic tests for predicting perioperative cardiac risk in patients undergoing major vascular surgery. Heart 2003; 89 : 1327–1334.
11. Weiner DA, Ryan TJ, McCabe CH et al. Prognostic impertance of a clinical profile and exercise test in medically treated patients with coronary artery disease. J Am Coll Cardiol 1984; 3 : 772–779.
12. Younis L, Stratmann H, Takase B et al. Preoperative clinical assessment and dypiridamole thalium-201 scintigraphy for prediction and prevention of cardiac events in patients having major noncardiovascular surgery and known or suspected coronary artery disease. Amer J Cardiol 1994; 74 : 311–317.
13. Poldermans D, Fioretti PM, Forster T et al. Dobutamine stress echocardiography for assessment of perioperative cardiac risk in patients undergoing major vascular surgery. Circulation 1993; 87 : 1506–1512.
14. Mandysová E. Doporučení k provádění zátěžoé echokardiografie. Doporučené postupy v kardiologii II. Česká kardiologická společnost Brno 2000 : 85–88.
15. Mysliveček M, Kamínek M. Doporučení k provádění zátěžových testů v nukleární kardiologii. Doporučené postupy v kardiologii II. Česká kardiologická společnost Brno 2000 : 82–84.
16. Hradec J, Bultas J, Želízko M. Stabilní angina pectoris. Doporučený diagnostický a léčebný postup České kardiologické společnosti. Cor Vasa 2010; 52 : 543–561.
17. Pasternack PF, Grossi EA, Baumann FG et al. Beta blockade to decreasesilent myocardial ischaemia during peripheral vascular surgery. Am J Surg 1989; 158 : 113–116.
18. Fleischmann KE, Beckman JA, Buller CE et al. 2009 ACCF/AHA Focused update on perioperative beta blockade: a report of the American college of cardiology foundation/American heart association task force on practice guidelines. Circulation 2009; 120 : 2123–2151.
19. Poldermans D, Boersma E, Bax JJ et al. The effect of bisoprolol on perioperative mortality and myocardial infarction in high risk patients undergoing vascular surgery. Dutch Echocardiographic Cardiac Risk Evaluation Applying Stress Echocardiography Study Group. N Engl J Med 1999; 341 : 1789–1794.
20. Thomson RC, Libertson RR, Lowenstein E. Perioperative anesthetic risk of noncardiac surgery in hypertrophic obstructive cardiomyopathy. JAMA 1985; 254 : 2419–2421.
21. Vahanian A, Baugartner H, Bax J et al. Task Force on the Management of Valvular Hearth Disease of the European Society of Cardiology; ESC Committee for Practice Guidelines. Guidelines on the management of valvular heart disease: The Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology. Eur Heart J 2007; 28 : 230–268.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2012 Číslo Suppl 1- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Nech brouka žít… Ať žije astma!
- Intermitentní hladovění v prevenci a léčbě chorob
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Doporučení pro diagnostiku a léčbu chronického srdečního selhání – ČKS 2011
-
Fibrilace síní
Doporučený diagnostický a léčebný postup České kardiologické společnosti vypracovaný Pracovní skupinou arytmie a trvalé kardiostimulace - Příprava kardiaka k nekardiální operaci
- Revaskularizace myokardu. Perkutánní koronární intervence a aortokoronární bypass
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Doporučení pro diagnostiku a léčbu chronického srdečního selhání – ČKS 2011
-
Fibrilace síní
Doporučený diagnostický a léčebný postup České kardiologické společnosti vypracovaný Pracovní skupinou arytmie a trvalé kardiostimulace - Příprava kardiaka k nekardiální operaci
- Revaskularizace myokardu. Perkutánní koronární intervence a aortokoronární bypass
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



