-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Revaskularizace myokardu. Perkutánní koronární intervence a aortokoronární bypass
Autori: P. Kala 1; P. Němec 2; M. Želízko 3; J. Pirk 3; P. Widimský 4; Oponenti: L. Groch 1; Š. Černý 2; R. Rokyta 3
Pôsobisko autorov: Oponenti I. interní kardio-angiologická klinika Lékařské fakulty MU a FN u sv. Anny Brno, přednosta prof. MUDr. Jiří Vítovec, CSc., FESC 1; Interní kardiologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jindřich Špinar, CSc., FESC 1; Oponenti Kardiocentrum Nemocnice na Homolce Praha, přednosta prim. MUDr. Štěpán Černý, CSc. 2; Centrum kardiovaskulární a transplantační chirurgie Brno, ředitel doc. MUDr. Petr Němec, CSc. 2; Oponenti Kardiologické oddělení, vedoucí lékař prof. MUDr. Richard Rokyta, Ph. D., I. interní klinika Lékařské fakulty UK a FN Plzeň, přednosta prof. MUDr. Martin Matějovič, Ph. D. 3; Kardiocentrum Institutu klinické a experimentální medicíny Praha, přednosta prof. MUDr. Jan Pirk, DrSc. 3; Kardiocentrum III. lékařské fakulty UK a FN Královské Vinohrady Praha, přednosta prof. MUDr. Petr Widimský, DrSc., FESC 4
Vyšlo v časopise: Vnitř Lék 2012; 58(Suppl 1): 79-103
Kategória: Doporučené postupy
Obsah
- Obecné principy indikací k revaskularizaci
1.1. Porovnání rizika přirozeného průběhu s rizikem revaskularizačního výkonu
1.2. Způsoby rizikové stratifikace
1.3. Indikační pohovor (společný „kardio-tým“ kardiologů a kardiochirurgů), indikační protokol, odpovědnost za indikaci
1.4. Způsob informování nemocných
1.5. Nákladová efektivita revaskularizačních výkonů - Revaskularizace u nemocných s chronickými formami ischemické choroby srdeční
2.1. PCI vs konzervativní léčba
2.1.1. PCI
2.1.2. Farmakoterapie
2.1.3. PCI vs farmakoterapie
2.2. PCI vs CABG
2.3. CABG vs konzervativní léčba - Revaskularizace u nemocných s akutními koronárními syndromy bez elevací úseku ST
3.1. Kdy je vhodná emergentní koronarografie a PCI (do 2 hod od vzniku obtíží)
3.2. Kdy je vhodný invazivní přístup
3.3. Kdy je vhodný konzervativní postup
3.4. Kdy je CABG vhodnější než PCI u non-STEMI - Revaskularizace u nemocných s akutním infarktem myokardu s elevacemi úseku ST
4.1. Primární PCI (p-PCI)
4.2. Facilitovaná PCI, rescue PCI, odložená PCI u STEMI
4.2.1. Facilitovaná PCI
4.2.2. Rescue PCI
4.2.3. Rutinní časná PCI po trombolýze
4.2.4. Odložená PCI
4.3. Kdy je vhodné léčit STEMI emergentním nebo urgentním CABG - Revaskularizace u nemocných se srdečním selháním
5.1. Akutní srdeční selhání v rámci AKS
5.2. Chronické srdeční selhání - Revaskularizace u polymorbidních nemocných
6.1. Diabetes mellitus
6.2. Renální insuficience
6.3. Anémie, krvácení, nesrdeční operace
6.4. Současná přítomnost ICHS a chlopenní vady
6.5. Současná přítomnost postižení koronárních a karotických (mozkových) tepen - Procedurální aspekty revaskularizačních technik
7.1. Elektivní PCI (pro chronickou ICHS nebo pro stabilizovaný AKS)
7.2. Emergentní/urgentní PCI (pro STEMI či vysoce rizikový NSTEMI)
7.3. Radiální či femorální přístup ke katetrizaci
7.4. Elektivní CABG (pro chronickou ICHS nebo pro stabilizovaný AKS)
7.5. Emergentní CABG (pro rozvíjející se/pokračující infarkt myokardu) - Farmakoterapie před revaskularizačními výkony, během výkonů a po nich
8.1. Farmakoterapie při elektivní koronarografii a PCI
8.2. Farmakoterapie při AKS bez elevací úseku ST léčeném PCI
8.3. Farmakoterapie při STEMI léčeném primární PCI
8.4. Farmakoterapie při elektivním CABG
8.5. Farmakoterapie při duální či trojkombinované antitrombotické léčbě před nekardiální operací - Komplikace PCI
9.1. Periprocedurální ischemické komplikace (úmrtí, infarkt myokardu, CMP)
9.2. Periprocedurální krvácivé komplikace
9.3. Ostatní komplikace PCI - Komplikace CABG
10.1. Periprocedurální ischemické komplikace (úmrtí, infarkt myokardu, CMP)
10.2. Periprocedurální krvácivé komplikace
10.3. Infekční komplikace
10.4. Ostatní komplikace
1. Obecné principy indikací k revaskularizaci
1.1. Porovnání rizika přirozeného průběhu s rizikem revaskularizačního výkonu
Ischemická choroba srdeční (ICHS) je vedoucí příčinou úmrtí dospělé populace vyspělých zemí.
Relativně nejlepší prognózu mají pacienti se stabilními formami ICHS, významně horší mají pacienti s akutním koronárním syndromem (AKS). Pro odhad životní prognózy pacientů je důležitá aktuální znalost morfologického, ale i funkčního stavu srdce a srdečních cév.
Revaskularizace by měla být indikována pokud možno vždy u pacientů s AKS, kde očekávaná jednoroční kardiovaskulární mortalita přesahuje 3 % [1] – tzv. prognostická indikace k revaskularizaci. U pacientů s chronickými formami ICHS je indikace k revaskularizaci složitější a více se odvíjí od symptomatologie, neboť asymptomatičtí či oligosymptomatičtí nemocní s chronickou ICHS, až na výjimky, nemají z revaskularizace prospěch – jde o tzv. symptomatickou indikaci k revaskularizaci.
Prognózu nemocných určují jednak klinické faktory a jednak faktory angiografické:
Za prognosticky významný koronární nález je považováno hemodynamicky významné postižení (angiograficky > 70 %):
- kmene levé koronární tepny (LMCA),
- proximální části ramus interventricularis anterior (RIA),
- všech 3 věnčitých tepen (RIA + RC ++ ACD) bez ohledu na lokalizaci stenóz,
- stenóza poslední věnčité tepny, zásobující normálně se kontrahující myokard (v povodí ostatních tepen je porucha kinetiky myokardu).
Prognóza pacientů s AKS je dána těmito klinickými faktory:
- přítomností srdečního selhání (i v anamnéze), dysfunkcí levé srdeční komory,
- přítomností maligních arytmií,
- přítomností přidružených onemocnění zmíněných v kapitole 1.2., které však obecně zhoršují prognózu pacientů s ICHS (zejména diabetes mellitus, chronická renální insuficience a anémie).
1.2. Způsoby rizikové stratifikace
Riziková stratifikace pacientů před revaskularizačními výkony srdce zahrnuje komplex faktorů, a to jak klinických, tak „technických“ včetně odhadu rizika vlastní procedury a následné kvality života. V současnosti využívané rizikové skórovací systémy posuzují především riziko úmrtí (v souvislosti s operací v případě kardiochirurgických skóre) a v případě perkutánní koronární intervence (PCI) také riziko vzniku hlavních kardiovaskulárních příhod v následném období (Major Adverse Cardiovascular Events – MACE). Zde se odhaduje tzv. kombinované riziko sestávající z výskytu minimálně jedné z následujících příhod: úmrtí, infarkt myokardu, opakovaná revaskularizace a cévní mozková příhoda.
Nejčastěji využívané PCI skórovací systémy
Mayo Clinic PCI rizikové skóre [2,3] posuzující přítomnost a závažnost jednotlivých klinických faktorů, kterými jsou věk, sérová koncentrace kreatininu, ejekční frakce levé komory, pohlaví, preprocedurální šokový stav, infarkt myokardu během posledních 24 hod a postižení periferních tepen (www.zunis.org/Mayo%20Clinic%20-%20Death%20and%20MACE%20After%20PCI%20-%20Risk%20Calculator%202007.htm).
Syntax PCI skóre [4] je podrobné angiografické posouzení jednotlivých lézí s redukcí diametru o ≥ 50 %. Skupinu s nízkým rizikem vzniku MACE určuje rozmezí hodnot 0–22, 23–32 značí riziko střední a ≥ 33 riziko vysoké. Jedná se o čistě morfologické posouzení bez ohledu na funkční významnost jednotlivých lézí (www.syntaxscore.com/calc/start.htm).
Zjednodušeně lze říci, že při Syntax skóre 0–22 poskytuje PCI v porovnání s CABG lepší nebo srovnatelné výsledky a při skóre > 32 je jednoznačně lepší volbou pro nemocného aortokoronární bypass (CABG). Jde však o čistě angiografický ukazatel, v rozhodování hrají samozřejmě důležitou roli faktory klinické (operační riziko).
Nejčastěji využívané kardiochirurgické skórovací systémy
EuroSCORE (European System for Cardiac Operative Risk Evaluation) je nejčastěji používaný systém odhadu operační mortality založený na kombinaci různých rizikových faktorů, poprvé představený v roce 1998. Skórovací systém vychází z posouzení vlivu 97 rizikových faktorů u více než 19 000 pacientů v 6 evropských zemích. V současnosti se využívá především tzv. logistické kalkulace [5] lépe odpovídající kombinaci různých rizikových faktorů, zejména u rizikovější populace. Starší je kalkulace aditivní [6] (www.euroscore.org). Logistické EuroScore vcelku realisticky předpovídá procentuální riziko úmrtí v souvislosti s kardiochirurgickou operací.
STS a Parsonnet Score
STS skóre je obsáhlejší systém vytvořený Společností hrudní chirurgie (Society of Thoracic Surgeons) [7], které společně s modifikovaným skórem dle Parsonneta předpovídá nejen pooperační mortalitu, ale i morbiditu [8,9] (http://209.220.160.181/STSWebRiskCalc261/de.aspx; www.sfar.org/scores2/parsonnet2.html).
Riziková stratifikační skóre pro PCI a CABG shrnuje tab. 1.
Tab. 1. Riziková stratifikační skóre pro PCI a CABG. Převzato a upraveno z [10]. ![Riziková stratifikační skóre pro PCI a CABG. Převzato a upraveno z [10].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/3bcd2948c7cfd08511708e6e7fea727c.png)
1.3. Indikační pohovor (společný „kardio-tým“ kardiologů a kardiochirurgů), indikační protokol, odpovědnost za indikaci
Každé pracoviště provádějící revaskularizační výkony (komplexní kardiovaskulární centrum nebo kardiovaskulární centrum) je povinno mít v písemné podobě vypracovaný systém indikací k revaskularizačním výkonům. Tento systém musí být koncipován jako kolektivní (několik atestovaných kardiologů) rozhodovací proces s pravidelnou účastí kardiochirurga a s event. účastí specialistů dalších oborů dle potřeby [10]. Kolektivní rozhodování se odehrává v rámci společných indikačních pohovorů (tzv. kardio-tým). Minimální přípustný počet účastníků takového pohovoru je 3: intervenční kardiolog, kardiochirurg, klinický kardiolog. Tab. 2 ukazuje, kteří nemocní by měli (revaskularizace ve druhé době po koronarografii) a kteří nemusí (ad-hoc revaskularizace ihned po koronarografii) projít indikačním pohovorem před rozhodnutím o způsobu revaskularizace.
Tab. 2. Kdy by měl nemocný projít indikačním pohovorem a kdy nemusí. 
Odpovědnost (odbornou i forenzní) za rozhodnutí, zda nemocný podstoupí ad-hoc PCI, nebo zda bude konzultován na indikačním pohovoru „kardio-týmu“, má vždy ten intervenční kardiolog, který provedl koronarografii (případně který odpovídal za provedení koronarografie lékařem ve výcviku intervenční kardiologie). Jakmile nemocný projde indikačním pohovorem, odpovědnost za indikaci konkrétního zákroku přebírá celý kolektiv pracoviště (reprezentovaný vedoucím pracoviště nebo jeho pověřeným zástupcem, který vedl konkrétní indikační pohovor).
O každém nemocném, který projde indikačním pohovorem, je veden písemný indikační protokol, který musí mít minimálně tyto náležitosti: příjmení, jméno a rodné číslo nemocného, seznam závažných diagnóz (nejen kardiologických) zjištěných u tohoto nemocného, hodnotu kreatininu, hodnotu ejekční frakce levé komory, rizikové skóre (např. EuroSCORE), závěr indikačního pohovoru, podpis kardiologa, který vedl indikační pohovor, podpis kardiochirurga, který byl přítomen indikačnímu pohovoru (příloha 1).
Příloha 1. Protokol indikačního pohovoru před revaskularizací myokardu. 
1.4. Způsob informování nemocných
Pacient musí být lékařem o své nemoci a možnostech léčby informován pro něho srozumitelným způsobem a tak, aby byl schopen aktivně vstoupit do rozhodovacího procesu. Podané informace musí odpovídat vědeckým poznatkům a veškerým možnostem léčby včetně jejich úspěšnosti a rizik ve vztahu k úmrtí, symptomům ICHS, kvalitě života a nutnosti následné revaskularizace jak z krátkodobého, tak i z dlouhodobého hlediska. S výjimkou pacientů s akutním koronárním syndromem vyžadujícím emergentní léčbu je pacientům s komplexním koronárním postižením vhodné ponechat dostatek času pro zvážení všech léčebných eventualit a doporučení „kardio-týmu“ (viz kapitola 1.3.). Pacienty je třeba informovat také o nutnosti následné trvalé farmakoterapie a důsledného dodržování sekundárně-preventivních opatření.
1.5. Nákladová efektivita revaskularizačních výkonů
Posouzení nákladové efektivity revaskularizace vyplývá z ceny spojené s vlastním výkonem, následnou léčbou a dosaženou kvalitou života za dané časové období. Závisí na posuzovaném regionu a nejsou do něho zahrnuty pozitivní dopady na sociální systémy.
- Akutní infarkt myokardu s elevacemi úseku ST (STEMI): PCI vs trombolýza – bez ohledu na vzdálenost ke katetrizačnímu centru je PCI spojena s vyšším zdravotním efektem při nižších nákladech na léčbu [11].
- PCI ve srovnání s CABG: z přímých i nepřímých porovnání vyplývá, že tyto typy léčby jsou v horizontu 1–5 let podobně účinné a PCI je spojena s celkově nižšími náklady [12].
- PCI s implantací lékových (DES – drug-eluting stent) vs holých stentů (BMS – bare-metal stent) u onemocnění více tepen: DES jsou spojeny s vyšší efektivitou oproti BMS [13].
2. Revaskularizace u nemocných s chronickými formami ischemické choroby srdeční
2.1. PCI vs konzervativní léčba
Cíle léčby pacientů s chronickou formou ICHS jsou obecně platné a zaměřené na:
- snížení úmrtnosti spojené se zlepšením prognózy pacientů,
- zmenšení či odstranění symptomů.
U většiny nemocných s chronickou ICHS je indikace k revaskularizaci symptomatická (viz výše), jen u menšího počtu nejrizikovějších pacientů je též prognostická – viz tab. 3 a 4.
Tab. 3. PCI vs farmakologická léčba u pacientů s chronickou ICHS. 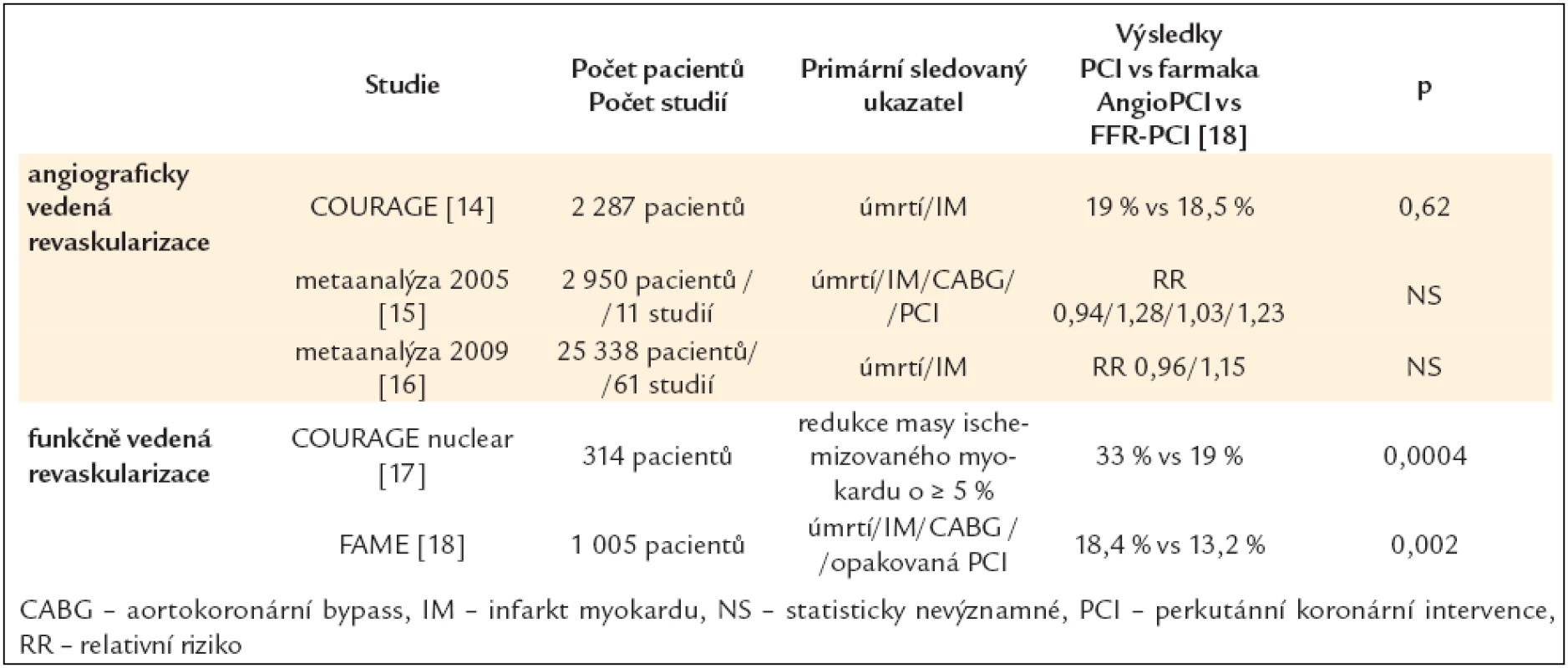
Tab. 4. Indikace k revaskularizaci pacientů s chronickou ICHS. Převzato a upraveno dle [10]. ![Indikace k revaskularizaci pacientů s chronickou ICHS. Převzato a upraveno dle [10].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/21a1c3b9ff1a841111b4eb392b101f55.png)
2.1.1. PCI
Od první prosté balónkové dilatace provedené A. Gruentzigem v roce 1977 se přešlo k implantaci koronárních stentů, zpočátku BMS a od roku 2001 i pokrytých antiproliferačně působícími léky (tzv. lékové stenty či DES), výrazně redukujícími riziko restenózy.
Při rozhodování o volbě stentu je nutné vzít v potaz následující relativní kontraindikace implantace DES: nedostatečné anamnestické údaje nebo nedostatečná spolupráce, zvýšené riziko krvácení, přítomnost alergie na kyselinu acetylsalicylovou nebo clopigorel/prasugrel/ticagrelol, nutnost časného neplánovaného chirurgického zákroku nebo absolutní indikace pro dlouhodobou antikoagulační léčbu.
V indikovaných případech mohou být součástí PCI i přesné invazivní zobrazovací či funkční metody. Intravaskulární ultrazvuk (IVUS) a optická koherentní tomografie (OCT) patří mezi morfologické zobrazovací techniky, frakční průtoková rezerva myokardu (FFRmyo) naopak mezi techniky funkční (IA). Ačkoli jednoznačný vliv těchto technik na zlepšení prognózy nemocných nebyl prokázán, mohou být využívány především u komplexních koronárních postižení.
2.1.2. Farmakoterapie
Optimálně vedená farmakoterapie je vedle úpravy životosprávy základem sekundární prevence ICHS. Skupinová léčba zahrnuje léky ovlivňující prognózu, kterými jsou antitrombotika, hypolipidemika, blokátory renin-angiotenzin-aldosteronového systému, beta-blokátory a léky symptomatické. Sem patří kalciové blokátory, nitráty, molsidomin, trimetazidin, ivabradin a nicorandil.
2.1.3 PCI vs farmakoterapie
O vysoké selekci pacientů zařazovaných do studií srovnávajících PCI a farmakoterapii svědčí studie COURAGE [14], do které bylo zařazeno pouze 6,4 % všech vhodných pacientů; vyřazeni byli nemocní s komplexním a prognosticky významným postižením. Z výsledků metaanalýz však vyplývá, že se oba typy léčby neliší ve výskytu úmrtí a IM a PCI je spojena pouze s přechodně vyšším ústupem anginy pectoris [15]. Implantace DES významně snižuje nutnost následné revaskularizace ve srovnání s prostou balónkovou dilatací (RR = 0,30) i BMS (RR = 0,44) [16].
V podstudii COURAGE nuclear [17] byla PCI spojena s výrazným a prognosticky příznivým snížením rozsahu ischemizovaného myokardu, a to především u pacientů s iniciálně středním až těžkým stupněm (≥ 10 % myokardu).
Otázce, které konkrétní léze řešit pomocí PCI, se věnovala invazivní studie FAME (porovnání studií – viz tab. 3) [18].
Funkčně významná stenóza byla stanovena poměrem tlaků před stenózou a za stenózou v prostředí maximální, farmakologicky navozené hyperemie – FFRmyo. Hodnoty ≤ 0,80 značily hranici indikující revaskularizaci. Ve skupině FFR vedené PCI byly prokázány významně lepší výsledky [19] oproti angiograficky vedené PCI. Další analýza [20] této studie ukázala rozdíly v angiografickém a funkčním posouzení významnosti: stenózy 50–70 %, resp. 71–90 %, resp. 91–99 % se ukázaly jako funkčně nevýznamné v 65 %, resp. 20 %, resp. 4 %.
2.2. PCI vs CABG
Aortokoronární bypass (coronary artery bypass grafting – CABG) je chirurgickou formou revaskularizace myokardu. Poprvé byl popsán v roce 1960 týmem R. Goetze a od původních žilních štěpů se stále více přikláníme k našívání štěpů arteriálních z důvodu jejich dlouhodobé průchodnosti (90% průchodnost LIMA vs 50% žilního graftu po 10 letech). Základem je levá mamární tepna (left internal mammary artery – LIMA) pro přemostění povodí RIA, pro další povodí se mohou využít RIMA či radiální tepny. Trvá diskuze nad přínosem techniky „off-pump“ nevyžadující napojení mimotělního oběhu.
Suverénní doménou kardiochirurgické léčby je kombinované postižení koronárních tepen a zároveň srdečních nebo jiných struktur indikovaných ke korekci. Možným přístupem, zvláště při využití miniinvazivních a robotických technik, jsou tzv. hybridní revaskularizace s přemostěním RIA pomocí LIMA a následné PCI dalších lézí.
Porovnávání výsledků intervenční a chirurgické revaskularizace, tzn. PCI vs CABG, se datuje hluboko do 80. let minulého století.
První etapa: CABG vs prostá balónková dilatace – obdobný vliv na úmrtnost i riziko výskytu IM a méně následných revaskularizací a symptomů v průběhu prvních 3 let po CABG [21]. Výsledky potvrdila i největší randomizovaná studie BARI [22] u 1 829 pacientů z let 1988–1991 a dobou sledování 5 a 10 let. Na rozdíl od celého souboru a pacientů bez diabetes mellitus měli diabetici lepší prognózu při léčbě chirurgické.
Druhá etapa: CABG vs BMS – studie ARTS [23] a SoS [24] – u pacientů s postižením více koronárních tepen a také nestabilní anginou pectoris. Úmrtnost, výskyt IM i cévních mozkových příhod se v průběhu jednoročního sledování nelišily, nadále byla chirurgická revaskularizace spojena s nižší potřebou následné revaskularizace. Nedávná metaanalýza [25] zahrnující 10 studií s CABG ve srovnání s prostou PCI (6 studií) nebo implantací BMS (4 studie) pak poukázala na lepší dlouhodobé přežívání diabetiků po chirurgické revaskularizaci.
Třetí etapa: CABG vs DES – studie SYNTAX [26] – 1 800 pacientů s onemocněním kmene a/nebo 3 koronárních tepen vhodných k intervenční i chirurgické léčbě. Ve skupině PCI byli pacienti léčeni implantací paclitaxelového stentu, v CABG skupině byly ve 26 % našity obě mamární tepny. Studie, která byla postavena jako non-inferiorní pro PCI, selhala v dosažení primárního sledovaného ukazatele, kterým byl výskyt MACE v průběhu 12 měsíců (PCI vs CABG – 17,8 % vs 12,3 %, p = 0,002). Po PCI byla četnější nutnost následné revaskularizace, naopak výskyt CMP byl častější ve skupině CABG a významný rozdíl nebyl zaznamenán v celkovém úmrtí a IM. Po rozdělení pacientů do skupin dle Syntax skóre (kapitola 1.2.) bylo zjištěno, že lepších výsledků v léčbě pacientů s komplexním koronárním postižením (Syntax skóre ≥ 33) dosahoval chirurgický přístup.
2.3. CABG vs konzervativní léčba
Výhoda chirurgické revaskularizace myokardu nad medikamentózní léčbou byla prokázána již před 15 lety [27]. Data ze 7 randomizovaných studií prokázala nižší úmrtnost po 5 a 10 letech a nutnost CABG u 41 % nemocných léčených medikamentózně do 10 let od začátku sledování. Lepší výsledky byly dosaženy zejména u stenózy kmene levé věnčité tepny, onemocnění 3 tepen a postižení proximální RIA. Prospěch z revaskularizace měli i rizikoví nemocní (snížená ejekční frakce levé komory, AP III.–IV. stupně, anamnéza IM, hypertenze). Výhodu v přežívání prokázala i metaanalýza z roku 2007 (snížení rizika úmrtí – HR 0,62; 95% CI 0,50–0,77) [28]. Současné rutinní používání jednoho nebo více tepenných štěpů tyto výhody ještě více zdůrazňuje [29].
CABG by měl být upřednostněn oproti medikamentózní léčbě:
- u stabilní chronické ICHS při stenóze kmene ACS, postižení 3 tepen, postižení proximální RIA (tab. 4–7),
- při zhoršené funkci LK (zejména s průkazem hibernovaného myokardu),
- při limitujících symptomech (AP III.–IV. stupně),
- u diabetiků.
Tab. 5. Prognostické a symptomatické indikace k PCI a k CABG u chronické ICHS (tabulka neplatí pro AKS a doplňuje tab. 4). 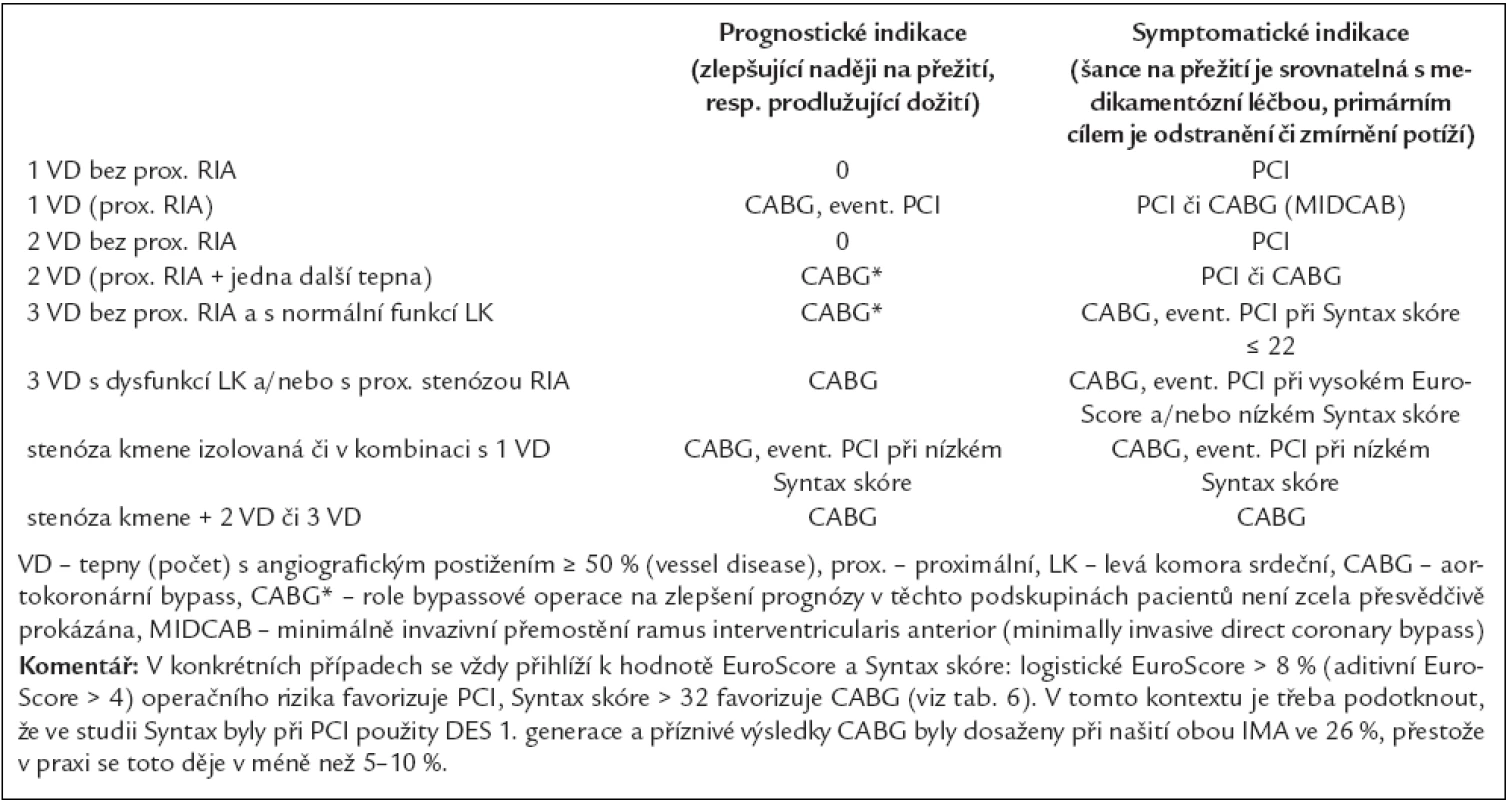
Tab. 6. Typ revaskularizace pacientů s chronickou formou ICHS (v návaznosti na tab. 5). 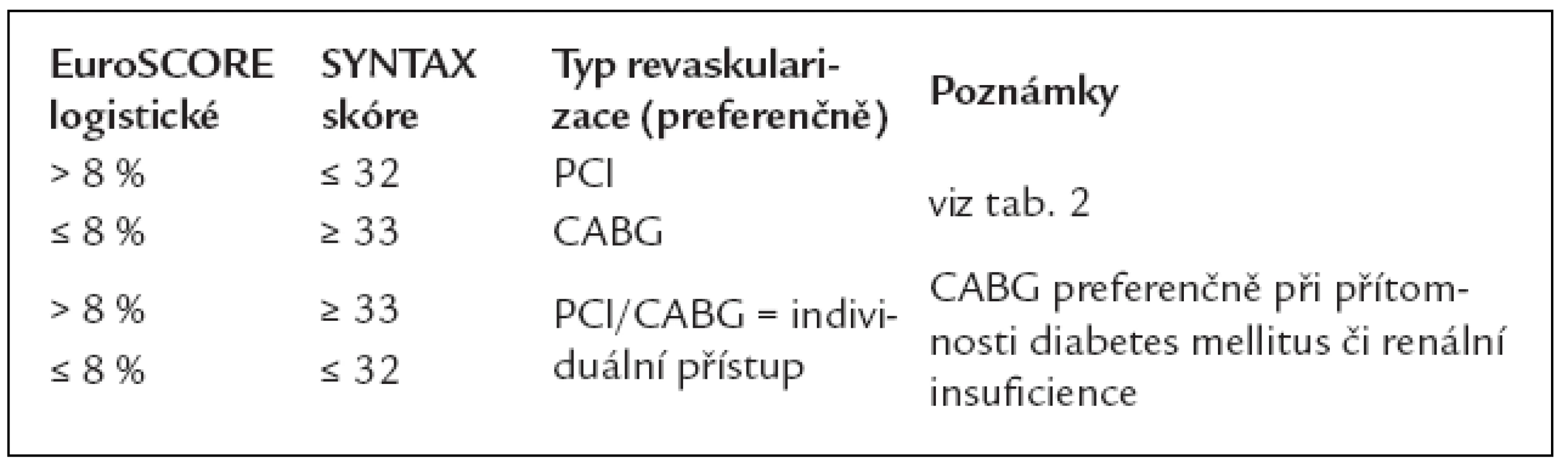
Tab. 7. Doporučení pro revaskularizaci u AKS bez ST elevací 
3. Revaskularizace u nemocných s akutními koronárními syndromy bez elevací úseku ST
Selektivní koronarografie je indikována u všech nemocných s prokázaným akutním koronárním syndromem, u nemocných bez elevací úseku ST je její načasování podřízeno rizikové stratifikaci. Ta má 3 roviny úrovně:
- riziko související s rizikem trombotické okluze koronární tepny spolu se závažností a rozsahem ischemie myokardu,
- riziko související s obecným rizikovým profilem nemocného (kardiální, interní komorbidity) a
- riziko krvácení v souvislosti s farmakologickou léčbou.
Novější studie FRISC II [30], RITA-3 [31], VINO [32], GUSTO IV [33], ICTUS [34], metaanalýzy [35] a recentně i TIMACS [36] prokázaly nižší mortalitu i morbiditu a dlouhodobě méně následných revaskularizací rutinně invazivního přístupu oproti iniciálně konzervativní léčbě, zejména u nemocných s vysokým a středním rizikem, přičemž některé studie naznačují, že čím dříve byla intervence provedena (do 2,5 hod), tím větší byl profit (ISAR-COOL [37]: výskyt primárního výsledného ukazatele – úmrtí, nefatální infarkt myokardu do 30 dnů – byl 11,6 % u nemocných léčených první 3 dny konzervativně oproti 5,9 % u nemocných léčených okamžitou revaskularizací). Platí tedy obecná zásada: čím větší riziko ischemických komplikací, tím časnější indikace ke koronarografii a navazující revaskularizaci (tab. 7).
3.1. Kdy je vhodná emergentní koronarografie a PCI (do 2 hod od vzniku obtíží)
K emergentní koronarografii jsou indikováni nemocní s vysokým rizikem ischemických komplikací se závažnou a rozsáhlou ischemií myokardu. Zahrnuje tyto stavy:
- opakované klidové stenokardie nebo stenokardie trvající 20 min a déle,
-
dynamické změny ST segmentu:
- ST deprese ≥ 1 mm,
- přechodné (trvající < 30 min) elevace úseku ST ≥ 1 mm,
- nově vzniklou kompletní raménkovou blokádu,
- hemodynamickou nestabilitu s projevy srdečního selhání (hypotenze, tachykardie jako známka rozsáhlé ischemie),
- život ohrožující arytmie (komorová tachykardie, fibrilace komor).
3.2. Kdy je vhodný invazivní přístup
K časné koronarografii jsou indikováni nemocní se středním rizikem ischemických komplikací nebo s vysokým klinickým rizikem ICHS:
- s bolestí, která byla delší než 20 min a již spontánně ustoupila, případně klidovou bolestí s úlevou po nitroglycerinu,
- s inverzí vln T na EKG,
- s mírně zvýšenou koncentrací troponinů (TnT > 0,01, ale < 0,1 ng/ml),
- nemocní starší než 75 let,
- s anamnézou prodělaného infarktu myokardu nebo AP, známým koronárním nálezem či předchozí revaskularizací,
- s dysfunkcí levé komory srdeční (EFLK ≤ 40 %, zvýšení BNP a/nebo NT pro-BNP, hs-CRP),
- s diabetes mellitus,
- s renální insuficiencí.
3.3. Kdy je vhodný konzervativní postup
Ačkoli randomizované studie prokázaly přínos rutinně invazivního postupu převážně u nemocných se středním a vysokým rizikem, ve skupině selektivně invazivního přístupu je během 1. roku koronarografováno až 50 % nemocných. Z tohoto pohledu se jeví koronarografie jako rutinní vyšetření u nemocných s AKS. Iniciálně konzervativní postup je možné zvolit u nemocných s nízkým rizikem, jako jsou:
- mladší nemocní, zejména ženy, s atypickými obtížemi,
- hemodynamicky stabilní nemocní,
- pacienti bez změn na EKG,
- nemocní s negativní hodnotou kardiomarkerů,
- pacienti bez rizikových faktorů ICHS.
V takovém případě je nutné provedení časného zátěžového testu. Pokud je negativní, pak je další postup konzervativní, je-li pozitivní, je indikována koronarografie. Pokud je zátěžový test nediagnostický, pak je nutné jej opakovat za 2 měsíce nebo provést klasickou nebo CT-koronarografii.
Koronarografické nálezy a indikace k PCI
Ve 30 % nacházíme nemoc 1 tepny, ve 25 % nemoc 2 tepen, ve 25 % nemoc 3 tepen a u 4–8 % nacházíme významnou stenózu kmene levé koronární tepny. U 10–20 % je nález nevýznamný nebo normální. Většina potíží nemocných s akutním koronárním syndromem je řešitelná pomocí PCI s těmito zásadami:
- jako první je provedena PCI klinicky dominantní léze;
- PCI dalších stenóz je indikována, pokud jsou jednoznačně významné (předcházela AP nebo jde o stenózy velkých větví ≥ 70 %) a katetrizačně ošetřitelné; zpravidla je ošetření dalších stenóz prováděno ve druhé době (tzv. staged procedure), i když randomizované studie pro tento postup chybí;
- lékové stenty jsou preferovány u lézí s vysokým rizikem klinické restenózy;
- v případě mnohočetného postižení věnčitých tepen, které není technicky řešitelné PCI, je vhodné konzultovat kardiochirurga s návrhem akutního CABG.
Dodržování výše uvedených doporučení v praxi hodnotily příznivě výsledky velkých registrů GRACE [38] a CRUSADE [39].
3.4. Kdy je CABG vhodnější než PCI u non-STEMI
CABG má u non-STEMI omezenou roli, přesto má některé výhody:
- je spojen s nízkým stupněm rekurentní ischemie a nízkou potřebou opakované revaskularizace;
- častěji je touto metodou dosaženo kompletní revaskularizace u rozsáhlejšího koronarografického nálezu, což přispívá k lepší funkci myokardu.
Vzhledem k logistickým obtížím při nutnosti co nejkratší doby do reperfuze postižené oblasti je akutní CABG vhodný při morfologickém nálezu:
- komplexní stenózy kmene ACS nebo jeho ekvivalentů (třída I),
- trvající ischemie při maximální konzervativní léčbě a nevhodném morfologickém nálezu pro PCI (třída I),
- onemocnění 2 nebo 3 tepen včetně proximální stenózy RIA (třída IIa),
- onemocnění více tepen s nejasnou culprit lézí.
Nejdůležitějším faktorem je správné načasování operace, nutnost časné operace (do 3–7 dnů) od vzniku zvyšuje úmrtnost. Vyšší riziko operace je dáno i rizikem větších krevních ztrát při antiagregační terapii podané v úvodu onemocnění.
Při stabilizaci stavu a elektivní koronarografii se postup neliší od pacientů se stabilní ICHS.
4. Revaskularizace u nemocných s akutním infarktem myokardu s elevacemi úseku ST
4.1. Primární PCI (p-PCI)
Termínem primární (direct) PCI označujeme PCI, která je provedena jakožto primární reperfuzní strategie (bez podání trombolytika) v akutní fázi infarktu myokardu s elevacemi úseku ST. Primární PCI oproti trombolýze významně zlepšuje osud nemocných. Průkopnická studie PAMI [40] a později metaanalýza randomizovaných studií [41] prokázala snížení úmrtnosti (9,3 % vs 7,0 %, p = 0,0002), reinfarktu (6,8 % vs 2,5 %, p < 0,0001) i cévní mozkové příhody (2,0 % vs 1,0 %, p = 0,0002, hemoragická CMP 1,0 % vs 0 %, p < 0,0001) ve prospěch primární PCI proti trombolýze. Transport do centra PCI i za cenu transportního zdržení do 90 min (čas do rekanalizace 120 min) stále přináší profit PCI oproti trombolýze (studie PAMI-AIR [42], PRAGUE [43], PRAGUE-2 [44], DANAMI-2 [45]), a to zejména u nemocných s dobou ischemie nad 2 hod [46]. U nemocných v kardiogenním šoku revaskularizace (PCI a CABG) významně snížila úmrtnost nemocných a zlepšila jejich dlouhodobý osud (SHOCK trial – viz dále). V reálném životě je 30denní úmrtnost všech nemocných léčených primární PCI kolem 6,5–7 % a 1roční mortalita 12 % (NRKI, analýza období 2005–2009, ČR, neselektovaný soubor, zahrnuti všichni nemocní včetně nemocných v kardiogenním šoku a vysokém věku).
Několik studií prokázalo, že kombinace léčebné mírné hypotermie a PCI je proveditelná a bezpečná u pacientů po kardiopulmonální resuscitaci také při akutním infarktu myokardu (vhodné zahájení či nepřerušování hypotermie i během katetrizace).
Primární PCI je indikována u STEMI v následujících časových intervalech:
- u všech nemocných s dobou ischemie do 12 hod, přičemž u nemocných s dobou ischemie 0–2 hod nesmí předpokládané transportní zdržení (oproti času podání trombolytika) překročit 90 min;
- u nemocných s dobou ischemie 12–24 hod při přetrvávání jasné stenokardie a elevací úseku ST, pokud je předpoklad zachovalé alespoň částečné viability ischemického myokardu (nepřítomnost obrazu QS v EKG či akineze/dyskineze infarktové oblasti) – nejčastěji jde o případy s vlnovitým průběhem stenokardie při intermitentní okluzi infarktové tepny;
- u všech nemocných v kardiogenním šoku s dobou ischemie do 48 hod.
Z hlediska organizace přednemocniční diagnostiky a transportu nemocných rozeznáváme následující situace:
- přímý transport na PCI centrum: předpokládá natočení 12svodového EKG v terénu a v případě jednoznačných změn je nemocný (primárně) transportován přímo na nejbližší PCI centrum – optimální situace;
- mezinemocniční transport: nemocný s akutním infarktem myokardu je nejprve dopraven do nejbližší nemocnice, kde je stanovena diagnóza STEMI, a následně je nemocný (sekundárně) transportován na PCI centrum – zpoždění 30–60 min k p-PCI;
- pacient se symptomy AIM přicházející přímo do nemocnice s katetrizačním centrem: neodkladné natočení EKG (klasické 12svodové, event. doplněné o svody V7–V9 – viz výše) a provedení p-PCI.
Situace v ČR je specifická díky husté síti PCI center a propracovanému systému přednemocniční diagnostiky infarktu myokardu a následného přímého transportu. Díky tomu je jedinou alternativou primární PCI pouze přednemocniční trombolýza bolusovým lytikem (ve shodě s výsledky studie CAPTIM [47], která však byla předčasně ukončena pro nedostatečný nábor pacientů, primární výsledný ukazatel 8,2 % vs 6,2 % ve prospěch primární PCI). I v takovém případě je však transport ke koronarografii a časné PCI vhodnější než nespolehlivá a organizačně později provedená rescue PCI.
4.2. Facilitovaná PCI, rescue PCI, odložená PCI u STEMI
4.2.1. Facilitovaná PCI
Facilitovaná PCI je definována jako farmakologická reperfuzní léčba podaná před plánovanou PCI. V rámci farmakologické reperfuzní léčby bylo testováno podání plné dávky trombolytika, poloviční dávky trombolytika ve spojení s podáním inhibitoru destičkových glykoproteinových receptorů (GPI) nebo podání samotného GPI. Ačkoli koncept kombinované reperfuze (farmakologicko-mechanický) je logický, dosud provedené randomizované studie neprokázaly přínos tohoto postupu. Průchodnost infarktové tepny před PCI byla vyšší pouze u režimů používajících trombolytikum – studie BRAVE [48], ASSENT-4 PCI [49] a FINESSE [50]. Úmrtnost byla stejná nebo vyšší a krvácivé komplikace byly častější ve skupině facilitované PCI. Ve studiích s GPI – TIGER-PA [51], On-TIME [52] – jejich podání nemělo vliv, metaanalýza 16 studií s GPI [53] udává pro GPI + p-PCI vs samotná p-PCI úmrtnost 2,8 % vs 2,9 %, reinfarkt 1,5 % vs 1,9 % (obojí ns), závažné krvácení 3,9 % vs 2,6 % (p = 0,0005). Na základě výsledků těchto studií má v současnosti facilitovaná PCI opodstatnění pouze v regionech s transportním časem přesahujícím 90–120 min, tzn. ne v České republice.
4.2.2. Rescue PCI
Záchranná (rescue) PCI je definována jako PCI infarktové tepny, která zůstává uzavřená po trombolytické léčbě u nemocných s dobou ischemie do 12 hod. Neinvazivní hodnocení efektu trombolýzy je nepřímé a je opřeno o ústup elevací úseku ST o ≥ 50 % za 60–90 min po podání trombolytika při současném ústupu stenokardie. Randomizované studie RESCUE [54], RESCUE II [55] a REACT [56] prokázaly významné snížení výskytu reinfarktu myokardu, srdečního selhání a trend k nižší úmrtnosti ve prospěch rescue PCI oproti konzervativní léčbě nebo další dávce trombolytika. K rescue PCI jsou tak indikováni nemocní s klinickými i EKG známkami chybějící reperfuze s rozsáhlým infarktem, dobou ischemie do 12 hod, za předpokladu rychlého překladu na PCI centrum. Vzhledem k absolutně převažující primární PCI v léčbě STEMI je v České republice indikace rescue PCI zcela výjimečná.
4.2.3. Rutinní časná PCI po trombolýze
Rutinní časná PCI po trombolýze (early post thrombolysis) označuje situaci, kdy je jako primární reperfuzní strategie podána trombolýza a následně (v období 3–24 hod po podání trombolytika) je provedena rutinní koronarografie a (pokud je schůdná) i PCI infarktové tepny. Výsledky studií GRACIA-1 [57], CAPITAL AMI [58], GRACIA-2 [59], CARESS-in-AMI [60] a TRANSFER-AMI [61] shodně prokázaly dlouhodobě lepší klinický osud rutinně provedené PCI po trombolýze oproti strategii konzervativní léčby nebo rescue PCI (nižší výskyt reinfarktu myokardu díky zábraně reokluze trombolytikem zprůchodněné tepny, případně reperfuze uzavřené infarktové tepny). Tento postup nenahrazuje primární PCI, ale představuje definitivní ošetření infarktové tepny u nemocných, pokud byli primárně léčeni trombolýzou („lyse now, stent later“).
4.2.4. Odložená PCI
Infarktová tepna
Rutinní rekanalizace uzavřené infarktové tepny u stabilních nemocných v období 3.–28. dne po infarktu myokardu neprokázaly žádný klinický efekt výkonu (včetně podskupiny nemocných intervenovaných v období 24–72 hod) oproti konzervativnímu postupu – závěry studie TOAT [62], DECOPI [63], OAT [64].
Neinfarktová tepna
Až 2/3 nemocných s akutním infarktem myokardu má kromě infarktové tepny i postižení dalších koronárních tepen. V případě, že nález na koronárních tepnách je prognosticky významný (tab. 4 a 5), pak je indikací ke kompletní revaskularizaci (PCI nebo CABG dle komplexnosti nálezu). Jeho načasování záleží na rozsahu infarktu, přítomnosti symptomů před ním a typu výkonu (PCI je možné provést časně již během hospitalizace, CABG je zpravidla prováděn elektivně za 4–6 týdnů po zhojení infarktu).
V případě, že nález není prognosticky významný, je rozhodnutí o revaskularizaci neinfarktové tepny individuální dle rozsahu a závažnosti postižení a přítomnosti symptomů. U nemocných s inducibilní ischemií je indikace k revaskularizaci. Významné stenózy (> 70 %, kdy tepna zásobuje větší oblast myokardu) a technicky snadno řešitelné stenózy je možné ošetřit elektivně PCI během prvotní hospitalizace, případně postupovat konzervativně a revaskularizaci indikovat v odstupu (podle stejných zásad jako u nemocných s chronickou stabilní ICHS, viz tab. 4 a 5).
4.3. Kdy je vhodné léčit STEMI emergentním nebo urgentním CABG
Při rozvíjejícím se STEMI je oproti non-STEMI nutnost časné reperfuze ještě více vyjádřena, proto je tím více omezena role CABG.
Indikací pro emergentní CABG je vyvíjející se STEMI (v prvních 3–4 hod) při ohrožení větší oblasti myokardu a předpokladu reperfuze oblasti před vznikem nekrózy nebo závažné komplikace PCI neřešitelné intervenčně.
Indikací k urgentnímu výkonu je:
- recidivující nestabilní AP s nálezem nevhodným k provedení PCI,
- akutně vzniklá mitrální regurgitace jako komplikace IM.
Nemocní s nutností emergentní nebo urgentní CABG představují nejrizikovější skupinu, proto musí být individuálně posouzen poměr přínosu a rizika úmrtí, zejména v prvních 3 dnech po vzniku STEMI.
Při stabilizaci stavu je výhodou odložení CABG o 3–7 dnů po STEMI, neboť byl prokázán pokles úmrtnosti se vzrůstajícím časovým intervalem od vzniku IM [65,66].
U obou skupin nemocných však chybí randomizované klinické studie.
5. Revaskularizace u nemocných se srdečním selháním
5.1. Akutní srdeční selhání v rámci AKS
Akutní srdeční selhání vzniká v důsledku rozsáhlé myokardiální ischemie, arytmie nebo mechanické komplikace infarktu myokardu (defekt septa komor, mitrální regurgitace). Nejjednodušší klinická klasifikace je dle Killipa. Data z Národního registru kardiovaskulárních intervencí jsou u nemocných se STEMI léčených primární PCI následující: většina nemocných (75–80 %) se STEMI nemá známky srdečního selhání, 30denní úmrtnost je kolem 3 % a 1roční 7–8 %. Již lehké srdeční selhání v akutní fázi STEMI (Killip třída 2, incidence 10 %) je spojeno s 2–3krát vyšší časnou i 1roční úmrtností (30denní 10,5 %, 1roční 17,5 %). Těžké srdeční selhání (Killip třída 3, incidence 3 %) má 30denní úmrtnost 20 % a nemocní v kardiogenním šoku (Killip třída 4)mají 30denní úmrtnost > 40 %. Revaskularizace myokardu je indikována v co nejkratším čase (PCI nebo CABG dle rozsahu nálezu), u nemocných se STEMI v kardiogenním šoku do 48 hod – SHOCK trial [67,68], SMASH trial [69]. Emergentní CABG po selhání PCI nebo fibrinolýzy je indikován pouze u pacientů s pokračující hemodynamickou nestabilitou nebo s život ohrožujícími arytmiemi v důsledku extenzivní ischemie myokardu (LMCA nebo 3 těžké VD).
Především u pacientů v kardiogenním šoku je nutná komplexní diagnostika s využitím akutní echokardiografie a komplexní léčba zahrnující časnou revaskularizaci, mechanickou ventilaci, intraaortální balónkovou kontrapulzaci a podání katecholaminů doplněných v případě individuální potřeby o jiné podpory oběhu (ECMO, Impella, Tandem Heart apod.); randomizované studie nejsou proveditelné.
5.2. Chronické srdeční selhání
Stanovení indikace k CABG je poněkud složitější, protože je nesnadné předpovědět, zda chronicky ischemický myokard zlepší svoji funkci po zlepšení zásobování krví po provedené rekonstrukci. To se týká zejména nemocných bez anginy pectoris, u kterých v klinických příznacích dominuje dušnost.
Dosud nebyla ukončena žádná prospektivní randomizovaná studie týkající se efektu revaskularizace pacientů s výrazně omezenou funkcí levé komory, tj. EFLK ≤ 35 %, i když v současné době několik studií již probíhá. Indikace k revaskularizaci je většinou dosud stanovena na základě studií udávajících při retrospektivním hodnocení lepší výsledky po aortokoronární rekonstrukci než při farmakoterapii, která je v současné době považována za neadekvátní. Ještě méně je důkazů o použití PCI u těchto nemocných. Studie, které se snaží porovnávat dlouhodobý efekt PCI a CABG, vesměs jednoznačně vyznívají ve prospěch CABG. Rovněž tak složité je rozhodnutí o korekci insuficientní mitrální chlopně. 30denní úmrtnost nemocných s dysfunkcí LK podstupujících kombinovaný výkon (CABG + mitrální valvuloplastiku) je v průměru 13 %. Pokud je EFLK ≤ 30 %, stoupá úmrtnost výrazně nad 20 %.
Mezi vyšetření, která při rozhodování pomohou zjistit přítomnost hibernovaného či chronicky ischemického myokardu, patří pozitronová emisní tomografie, dobutaminová echokardiografie či magnetická rezonance. Na základě těchto metod je možné posouzení, zda jde o viabilní myokard či jizvu, včetně procentuálního vyjádření ireverzibilního postižení. Ke koronární rekonstrukci jsou indikováni zpravidla nemocní s kompenzovaným srdečním selháním, s EFLK ≥ 20 % a s prokázaným viabilním myokardem. Ostatní jsou indikováni spíše k ortotopické transplantaci srdce.
Vlastní technika a taktika výkonu se neliší od aortokoronární rekonstrukce u nemocných s dobrou funkcí levé komory. Operace však má být prováděna těmi nejzkušenějšími chirurgy vzhledem k tomu, že i minimální technická či taktická chyba při operaci může vést ke katastrofálním následkům. Velký důraz je kladen na co nejdokonalejší perioperační ochranu myokardu, a z toho důvodu je v současné době u těchto nemocných používána krevní kardioplegie. Stále diskutovanou otázkou zůstává provádění rekonstrukcí off-pump [70–76].
6. Revaskularizace u polymorbidních nemocných
6.1. Diabetes mellitus
Diabetes mellitus představuje významný negativní faktor ovlivňující prognózu pacientů. Koronární tepny diabetiků jsou často postiženy difuzním aterosklerotickým procesem a oba typy revaskularizace jsou zatíženy vyšším rizikem restenózy či uzávěru. I přesto je jisté, že diabetici s AKS mají z revaskularizace minimálně stejný prospěch jako nediabetici [77]. V případě STEMI je metodou první volby provedení primární PCI, v případě non-STE AKS je rozvaha o volbě optimální metody revaskularizace komplexnější a závisí individuálně na klinickém stavu pacienta, přítomnosti dalších komorbidit, a především na rozsahu koronárního postižení. V úvahu je nutné vzít alespoň významně vyšší riziko následné revaskularizace po PCI oproti CABG.
Mezi randomizované studie zaměřené na diabetiky patří BARI 2D [78] porovnávající farmakoterapii vs PCI + CABG u pacientů s převážně stabilní ICHS. V průběhu 5 let nebyl zjištěn rozdíl ve výskytu MACE (úmrtí, IM, CMP – 12,2 % vs 11,7 %). Chirurgická léčba však byla oproti medikamentózní spojena s vyšším přežíváním bez MACE (77 % vs 69,5 %; p = 0,01), přestože mortalita ovlivněna nebyla.
Rozsah adjuvantní antitrombotické léčby před revaskularizací, při ní a po ní se neodvíjí od diabetu jako takového, ale závisí na formě ICHS (viz kapitola 8).
Z pohledu léčby diabetu je doporučeno 2 dny před každým angiografickým vyšetřením vysadit metformin a jeho opětovné nasazení zvážit nejdříve za 48 hod po kontrole renálních funkcí vzhledem k riziku laktátové acidózy.
6.2. Renální insuficience
ICHS a chronická renální insuficience (CHRI) jsou navzájem se ovlivňujícími závažnými diagnózami. Pacienti s CHRI umírají obecně dříve a nejčastěji na ICHS, zároveň je snaha o časnou diagnostiku a léčbu ICHS spojena s rizikem poškození ledvin (kontrastní látka, CABG). Ve spojení s podáním kontrastní látky mluvíme o kontrastní látkou indukované nefropatii (CIN – kapitola 9.3.). Pro přesné posouzení by bylo nutné sledovat vývoj renálních funkcí v průběhu minimálně 48 hod po zákroku, orientačně však postačuje kontrolní vyšetření sérové koncentrace kreatininu již za 12 hod (riziko CIN značí nárůst o 5–10 % oproti vstupní hodnotě). Pro predikci rizika je výhodnější stanovení glomerulární filtrace – GFR (kalkulátory MDRD [79] nebo Cockroftova-Gaultova formule), nejpřesnější je stanovení hladiny cystatinu C, které by se mělo využívat alespoň u pacientů ve vysokém věku (> 75 let). V případě lehkého až středního snížení GFR je PCI spojena s výrazně vyšším rizikem restenózy a pozdní trombózy stentů a metodou revaskularizace první volby je CABG. Obtížnější je rozhodování o metodě revaskularizace u pacientů s těžkým renálním postižením, event. postižením vyžadujícím hemodialyzační program. Obě jsou zatíženy vyšším rizikem komplikací – pozdních v případě PCI a časných u CABG.
Prevence vzniku CIN je v případě koronarografie/PCI založena především na intravenózní hydrataci pacientů, kombinované farmakoterapii beta-blokátorem, statinem a inhibitorem ACE či blokátorem receptorů AT1 pro angiotenzin II, ale také na maximálně šetrné spotřebě nízkoosmolární nebo izoosmolární kontrastní látky. Přehled preventivních opatření je uveden v kapitole 9.3, u CABG jasná preventivní doporučení chybějí.
6.3. Anémie, krvácení, nesrdeční operace
Vedle CHRI je anémie v předchorobí dalším nezávislým prognostickým rizikovým faktorem, a to bez ohledu na metodu revaskularizace či přítomnost akutního koronárního syndromu [80,81]. Zatím nedořešen zůstává vliv krevních převodů na prognózu pacientů.
Závažné krvácení je nezávislým faktorem zvyšujícím riziko úmrtí v průběhu 1 roku po výkonu a po PCI se vyskytuje v 7,3 % během prvních 30 dnů [82]. Riziko je zvýšené u pacientů ženského pohlaví, nízké tělesné hmotnosti, staršího věku, s AKS, anémií a zvýšenou sérovou koncentrací kreatininu a u pacientů léčených kombinací více než 3 antitrombotických léků [např. kyselina acetylsalicylová (ASA) + clopidogrel + heparin + inhibitory GP IIb/IIIa]. Z pohledu techniky výkonu riziko krvácení významně snižuje volba transradiálního přístupu.
Vzhledem ke stárnutí populace je přítomnost ICHS u pacientů před nesrdeční operací stále častější, naopak v některých případech je vhodné po přítomnosti ICHS před rozsáhlými operacemi pátrat (neplatí v případě operace urgentní – emergentní). Rozhodnutí o nutnosti neinvazivního zátěžového testování, koronarografie či následné revaskularizace vychází především z klinického stavu pacienta (rozhodující je přítomnost akutního koronárního syndromu), míry rizika nekardiální operace, funkční kapacity pacienta, přítomnosti rizikových faktorů ICHS, rozsahu ischemizovaného myokardu a stupně koronárního postižení. Podrobně je postup popsán v doporučeních Evropské kardiologické společnosti [83], v případě podezření na ICHS je nutné vždy zvážit podání beta-blokátorů, statinů a při systolické dysfunkci levé komory také inhibitorů ACE ještě před operací.
6.4. Současná přítomnost ICHS a chlopenní vady
V případě elektivních výkonů a známé chlopenní vady v operačním stadiu je doporučeno provést předem koronarografii u všech mužů ve věku ≥ 40 let a u žen po menopauze. I u pacientů mladších je katetrizace doporučena při přítomnosti rizikových faktorů ICHS. Přibližně ve 40 % je při koronarografii zjištěna přítomnost ICHS a seznam doporučení u jednotlivých typů srdečního postižení je uveden v tab. 8.
Tab. 8. Doporučení pro pacienty s kombinovanou přítomností ICHS a chlopenní vady. Převzato a upraveno dle [10]. ![Doporučení pro pacienty s kombinovanou přítomností ICHS a chlopenní vady. Převzato a upraveno dle [10].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/f962073035cc1a3d22e2002bc0536323.png)
Kombinované výkony jsou obecně rizikovější, v případě náhrady aortální chlopně je ale zároveň kombinace s revaskularizací pro pacienty klinicky výhodná s ohledem na riziko úmrtí, nemocnosti a perioperačního IM [10]. U pacientů s vysokým chirurgickým rizikem je možné zvážení hybridních výkonů nebo implantace aortální chlopně transkutánní cestou (TAVI).
Obecně lze říci, že při indikaci CABG u nemocného s lehčí až středně závažnou kalcifikovanou aortální stenózou se současná operace chlopně doporučuje tehdy, je-li realistický předpoklad dožití 10 let po operaci. Je velmi pravděpodobné, že s rozvojem perkutánní implantace aortální chlopně (TAVI) bude tento přístup v budoucnu modifikován. Indikace k mitrální valvuloplastice u nemocných podstupujících CABG zůstává vždy obtížným a empirickým rozhodnutím – chybí důkaz o zlepšení prognózy ve srovnání s prostým CABG (bez valvuloplastiky) [84].
6.5. Současná přítomnost postižení koronárních a karotických (mozkových) tepen
Jedná se o relativně častou koincidenci tepenného postižení (40 % u pacientů indikovaných ke karotické endarterektomii) [85], která je známkou rozsáhle probíhajícího aterosklerotického procesu. Zvýšeno je i riziko vzniku CMP po CABG, přestože tato komplikace má příčin více (chronická renální insuficience, anamnéza CMP/TIA, postižení karotických tepen, hypertenzní nemoc, diabetes mellitus, věk > 75 let, nízký srdeční výdej a fibrilace síní) [86]. Riziko vzniku CMP po CABG, resp. PCI se obecně pohybuje v průměru mezi 2–3 %, resp. 0,2 %. Duplexní ultrasonografie je indikována u pacientů s anamnézou CMP/TIA nebo auskultačně zjištěným šelestem nad karotickým povodím (I C) a zvážena by měla být u pacientů starších 75 let, s onemocněním kmene levé věnčité tepny a závažnou ischemickou chorobou dolních končetin (IIa C). Indikace revaskularizace karotických tepen je popsána v tab. 9 a nezbytnou podmínkou je zkušený tým s velmi dobrými výsledky (30denní výskyt úmrtí/CMP < 3 % u asymptomatických a < 6 % u symptomatických stenóz). Při vlastním načasování operací je nutné vyjít především z rozsahu a komplexity tepenného postižení a ovlivnění rizika obou výkonů – simultánní řešení je pak vhodné u pacientů s nejvyšším rizikem.
Tab. 9. Indikace revaskularizace karotických tepen. Převzato a upraveno dle [10]. ![Indikace revaskularizace karotických tepen. Převzato a upraveno dle [10].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/febec4dfeddadfb1b198ce5fe6bc37a5.png)
7. Procedurální aspekty revaskularizačních technik
7.1. Elektivní PCI (pro chronickou ICHS nebo pro stabilizovaný AKS)
Od roku 2002 jsou v praxi i lékové stenty (DES), kdy je na stent ve většině případů navázán polymer, který postupně uvolňuje účinné antiproliferační látky (paclitaxel, sirolimus a další). Použití DES snížilo výskyt restenózy proti běžným stentům (BMS), angiograficky o více než 75 %, klinicky DES snížily nutnost opakované revaskularizace o více než polovinu (z 20 % na 8–10 %), úmrtnost ani výskyt infarktu myokardu se dlouhodobě neliší. Data z prvních studií srovnávající DES a BMS – RAVEL [87], SIRIUS [88], C-SIRIUS [89], E-SIRIUS [90], TAXUS I, II, IV, V, VI [91–94] – vedla k určité euforii, nicméně dlouhodobé sledování v rámci dalších studií (BASKET LATE [95]) a velkých registrů (SCAAR [96]) upozornilo v souvislosti s opožděnou a neúplnou endotelizací DES na zvýšené riziko velmi pozdní trombózy stentů (0,6 % ročně) u první generace DES, které bylo sníženo na 0,2 % u dalších generací, prakticky odpovídající riziku BMS. Ačkoli dlouhodobě převažují výhody DES nad BMS, nejsou DES doporučovány v situacích, kdy nemocný nemůže brát duální antiagregační léčbu nejméně 6–12 měsíců (plánovaná operace, nutnost současné antikoagulační léčby). U nemocných v akutní fázi STEMI snižuje použití lékových stentů nutnost opakované revaskularizace – studie TYPHOON [97] a PASSION [98], SESAMI i HORIZON-AMI. V současnosti lze odhadovat minimální potřebu DES na asi 50 % všech implantovaných stentů. Doporučené postupy ESC z roku 2010 však preferují DES ve všech případech kromě těch, kde je zvýšené riziko dlouhodobé duální protidestičkové léčby.
7.2. Emergentní/urgentní PCI (pro STEMI či vysoce rizikový NSTEMI)
Hlavní zásadou PCI v akutní fázi ischemie je obnova reperfuze (TIMI 3 flow – tzn. normální rychlost průtoku postiženou tepnou) v co nejkratším čase. Proto je zásadně doporučováno provést PCI pouze na tzv. infarktové tepně a PCI dalších lézí provést plánovaně ve druhé době („staged PCI“). U nemocných s úplným trombotickým uzávěrem tepny je vysoké riziko distální embolizace fragmentů trombu a nestabilního plátu s následným slow-flow nebo no-reflow fenoménem (zablokování mikrocirkulace), a proto je doporučeno po rekanalizaci vodičem provést nejprve aspiraci trombu katetrem a následně implantovat stent. Studie TAPAS [99] i menší PIHRATE prokázaly větší ústup elevací úseku ST (ale nikoli menší rozsah nekrózy měřený hodnotou CK, CK-MB) u nemocných se STEMI, kterým byla provedena tromboaspirace + PCI oproti klasické PCI. Naproti tomu v této indikaci selhaly distální protekční systémy (AngioGuard i Filterwire) či složité aspirační systémy (Angiojet, X-sizer apod.). U trombotických lézí hraje zásadní roli i patřičná farmakoterapie (včetně intrakoronárního podání glykoproteinových inhibitorů a ve výjimečných případech rozsáhlé intrakoronární trombózy i lokálního podání trombolytika). Použití aspiračních katetrů je v současnosti indikováno selektivně u nemocných s velkou masou trombu a TIMI 0-1 flow po rekanalizaci infarktové tepny vodičem. V ostatních situacích je optimální technikou primární implantace stentu.
7.3. Radiální či femorální přístup ke katetrizaci
Závažné krvácivé a cévní komplikace katetrizačních výkonů jsou spojeny s delší hospitalizací, horší prognózou a vyšší cenou. Femorální přístup má výhodu ve snadnější punkci tepny, kalibr 6–8 mm umožňuje zavedení instrumentária až kalibru 18–21 French (1 French = 0,33 mm), je možné vyšetřit prakticky všechny oblasti (koronární, mozkové, renální i končetinové tepny), instrumentárium k PCI má velkou šíři typů a tvarů umožňujících dosáhnout vysoké pasivní opory. Nevýhodou femorálního přístupu je obtížná komprese tepny a s ní související riziko krvácivých (rozsáhlé hematomy, život ohrožující retroperitoneální krvácení) a cévních komplikací (pseudoaneuryzma, arteriovenózní píštěl), vyžadován je klid na lůžku po výkonu po dobu minimálně 6–8 hod s bandáží třísla. Radiální přístup má relativní nevýhodu v obtížnější punkci (mizí s learning curve), kalibr radiální tepny je 2–3 mm, což je dostatečné pro standardní instrumentárium 5 F a 6 F nebo tzv. sheathless techniku poskytující výrazně větší vnitřní průměr vodicích cévek. Obtížně a ne vždy je možné vyšetřit karotické tepny a obtížněji se sondují koronární bypassy. Limitem radiálního přístupu může být gracilní kalibr radiální tepny (pozitivní Allenův test, osoby s tělesnou výškou < 150 cm), přítomnost spazmů (lze potlačit podáním vazodilatačních látek) a vinutí nebo smyčky v průběhu. Zásadní výhodou je však velmi snadné dosažení hemostázy jednoduchou kompresí (elastická bandáž nebo speciální kompresní zařízení), což prakticky eliminuje krvácivé komplikace a umožňuje okamžitou mobilitu nemocného. Radiální přístup je tak ideální pro ambulantní provádění koronarografie a PCI. Literární data srovnávající femorální a radiální přístup udávají následující: úspěšnost výkonu 99 % vs 97 %, závažné krvácivé komplikace 2 % vs 0 %, cévní komplikace 1 % vs 0 % při srovnání femorálního a radiálního přístupu. Radiální přístup má stále více zastánců a v současnosti je takto katetrizováno 30–90 % nemocných. Obě metody je nutné považovat za rovnocenné a vzájemně se doplňující.
7.4. Elektivní CABG (pro chronickou ICHS nebo pro stabilizovaný AKS)
Revaskularizace myokardu je komplexní výkon, který lze provádět jen na kardiochirurgických pracovištích Komplexních kardiovaskulárních center k tomu určených, s odpovídajícím personálním a technickým vybavením.
Pro vlastní výkon je možné použít jednu z 2 technických alternativ:
- operace s použitím mimotělního oběhu (MTO) a ischemické srdeční zástavy (ISZ) – během ISZ lze použít k ochraně myokardu krystaloidní nebo krevní kardioplegii; tímto způsobem se operuje ve světě asi 70 % pacientů;
- operace za srdeční akce na bijícím srdci bez použití MTO.
Obě techniky mají svoje zastánce i odpůrce. Není možné jednoznačně určit, která z nich je lepší. Velká metaanalýza 66 randomizovaných studií prokázala pouze nižší výskyt pooperační fibrilace síní při operacích na bijícím srdci bez použití MTO, v jiných parametrech rozdíl prokázán nebyl [100].
Výběr vhodných konduitů závisí na morfologii koronárního řečiště a stavu tepenného a žilního řečiště pacienta. Nezanedbatelnou roli hraje i věk a přítomnost dalších komorbidit (CHOPN, DM, obezita, ICHDKK, chronická žilní insuficience).
Použití jedné mamární tepny (internal mammary artery – IMA) zlepšuje výsledky, co se týče úmrtnosti, IM a nutnosti nové revaskularizace, oproti použití jen žilních štěpů. Použití tepen (LIMA + RIMA nebo IMA + AR) k revaskularizaci povodí levé koronární tepny zlepšuje dlouhodobé výsledky ve srovnání s použitím jen jedné IMA. Výhody použití tepen pro revaskularizaci povodí ACD nebyly prokázány [29].
Použití tepenných konduitů do povodí levé koronární tepny u mladších nemocných (do 65 let) by mělo být standardem. Použití levé IMA na RIA by mělo být standardem pro všechny ostatní nemocné.
Standardem by mělo být i provedení kompletní revaskularizace (přemostění všech tepen o průměru > 1,5 mm se stenózou > 75 %), neboť se tím zlepší prognóza pacientů.
Použití „side-to-side“ anastomóz snižuje nárok na délku štěpů a snižuje počet proximálních anastomóz na aortu.
7.5. Emergentní CABG (pro rozvíjející se/pokračující infarkt myokardu)
Prvotní snahou musí být hemodynamická stabilizace pacienta, často za cenu použití intraaortální balónkové kontrapulzace. Při hemodynamické nestabilitě jde o život zachraňující výkon. Je nutné použít MTO i z důvodu zvýšení minutového výdeje a zlepšení perfuze všech orgánů a tkání. Periferní anastomózy je možné našít za srdeční akce nebo použít krevní kardioplegii [101]. První periferní anastomóza by měla být našita na tepnu vedoucí do infarktové oblasti.
Maximální důraz je nutné klást na jemnou operační techniku a velmi pečlivé zastavování krvácení z důvodu poruchy hemokoagulace při antiagregační terapii a poškození orgánových funkcí při hypoperfuzi. Jakákoli pooperační chirurgická komplikace (větší krvácení, nutnost časné reoperace, porucha hojení rány apod.) výrazně zhoršuje celkové výsledky.
8. Farmakoterapie před revaskularizačními výkony, během výkonů a po nich
Farmakoterapie je nedílnou součástí bezpečného a efektivního provedení všech typů revaskularizačních výkonů a můžeme ji rozdělit do 3 skupin. Symptomatická zahrnuje nitráty, molsidomin, trimetazidin, ivabradin a nicorandil. Sekundárně-preventivní farmakoterapie je zaměřena na zlepšení dlouhodobé prognózy pacientů s ICHS:
- stabilizací aterosklerotických koronárních plátů s cílem jejich regrese (statiny),
- snížením rizika náhlé srdeční smrti (beta-blokátory),
- redukcí negativní remodelace levé srdeční komory po prodělaném infarktu myokardu (inhibitory ACE a při nemožnosti jejich podání blokátory receptorů AT1 pro angiotenzin II) a
- prevencí koronární trombózy (antiagregační léčba).
V souvislosti s PCI je nejdůležitější terapie antitrombotická a stále větší pozornost je upřena na riziko krvácivých komplikací, které při kombinaci různých antitromboticky účinných látek narůstá. V této souvislosti je posuzován tzv. net-benefit nových farmak zahrnující vedle efektivity také jejich bezpečnost. Jedním ze základních bezpečnostních doporučení je nekombinovat nefrakcionovaný a nízkomolekulární heparin.
Z hlediska dávkování antikoagulancií je nutné zohledňovat hmotnost nemocného a renální funkce. Minimálně v případě pacientů s vysokým trombotickým rizikem je vhodné testování na rezistenci k ASA a clopidogrelu.
8.1. Farmakoterapie při elektivní koronarografii a PCI
Diagnostická koronarografie je bezpečnou vyšetřovací metodou a standardně se většinou podává pouze malá dávka nefrakcionovaného heparinu (UFH). Volba konkrétní dávky heparinu se pohybuje v rozmezí 1 000–5 000 IU (25–50 j./kg) v případě femorálního přístupu a 2 000–5 000 IU (40–60 j./kg) v případě přístupu radiálního. Z femorálního přístupu u stabilních forem ICHS lze koronarografii provést i bez použití heparinu.
Antiagregačně účinná léčba není před diagnostickou koronarografií nutná – neukončuje se v případě kyseliny acetylsalicylové, rutinně není před koronarografií doporučeno podání clopidogrelu [102].
Elektivně provedená PCI je zatížena nízkým rizikem komplikací a standardně se podává následující léčba:
-
a) Antikoagulační léčba:
- nefrakcionovaný heparin (UFH) je standardním lékem v bolusové i.v. dávce 70–100 IU/kg. V případě výkonu trvajícího déle než 60 min je vhodné přidání UFH, nejlépe dle ACT nebo naslepo v dávce 1 000–2 000 IU,
- enoxaparin jako rovnocenný preparát v dávce 0,5–0,75 mg/kg [103].
Podání UFH či LMWH po PCI s nekomplikovaným průběhem není indikováno.
- b) Antiagregační léčba:
V optimálním případě je pacient předléčen duální antiagregační léčbou pomocí ASA v dávce 75–100 mg denně a clopidogrelu v dávce 75 mg minimálně po dobu 3 dnů nebo alternativně v sytící „loading“ dávce 600 mg minimálně 2 hod před PCI. V opačném případě je nutné pacientovi nepředléčenému antiagregancii podat i.v. bolus ASA v dávce 250–500 mg a 600 mg clopidogrelu před vlastní PCI. Udržovací dávka je 75–100 mg ASA a 75 mg clopidogrelu. V případě vysokého angiografického nebo klinického rizika je vhodné zvýšit udržovací dávku clopidogrelu na 150 mg denně.
Rutinní podání blokátorů destičkových glykoproteinových receptorů IIb/IIIa není indikováno.
8.2. Farmakoterapie při AKS bez elevací úseku ST léčeném PCI
Z rizikových skórovacích systémů AKS bez elevací úseku ST (NSTE AKS) je možné definovat pacienty se středním až vysokým klinickým rizikem, na které je nutné zaměřit naši pozornost (kapitola 3.1.). Následující léčba je zaměřena na pacienty léčené urgentní PCI:
-
a) Antikoagulační léčba:
V naprosté většině PCI lze použít heparin (UFH) jakožto nejlevnější variantu, která není méně účinná než dražší léky.- UFH v dávce 60–100 IU/kg v závislosti na podání blokátorů GP IIb/IIIa s úpravou dávky dle ACT (200–250, resp. 250–350 s inhibitory GP IIb//IIIa nebo bez nich), nebo
- enoxaparin v následujícím režimu v závislosti na časovém odstupu od poslední s.c. aplikace plné terapeutické dávky:
- a) < 8 hod = bez dalšího bolusu,
- b) 8–12 hod = i.v. bolus 0,30 mg/kg,
- c) > 12 hod = i.v. bolus 0,75 mg/kg;
- fondaparinux [104] je pro pacienty urgentně léčené pomocí PCI nevhodný – v případě, že i přesto je pacient předléčen standardní dávkou 2,5 mg s.c., je nutné přidání UFH v bolusové dávce 50–100 IU/kg před PCI;
- bivalirudin v monoterapii [105]: 0,5 mg/kg i.v. + 1,75 mg/kg/hod kontinuálně. Bivalirudin prokázal ve studiích lepší výsledky než kombinace UFH + inhibitory GP IIb/IIIa, tento rozdíl byl však způsoben výhradně větším výskytem krvácení ve skupině léčené UFH + inhibitory GP IIb/IIIa, nikoli větším antiischemickým efektem bivalirudinu. Bohužel velká studie zkoumající, zda samotný bivalirudin je lepší než samotný heparin (bez inhibitorů GP IIb/IIIa), nebyla dosud realizována.
- b) Antiagregační léčba:
Základem je duální protidestičková léčba (ASA + prasugrel, ASA + ticagrelor nebo ASA + clopidogrel) (tab. 10).- ASA: 250–500 mg i.v., event. 150–300 mg p.o. s udržovací dávkou 75–100 mg;
- clopidogrel: sytící dávka 600 mg s udržovací dávkou 75 mg denně nebo 150 mg po dobu 1–2 týdnů v případě vysokého rizika [108]. Clopidogrel u AKS lze použít při nedostupnosti účinnějšího preparátu (prasugrelu či ticagreloru). Hlavní nevýhodou clopidogrelu je riziko (u 2–14 % nemocných) clopidogrelové rezistence vedoucí k riziku trombózy stentu;
- prasugrel [106]: sytící dávka 60 mg s udržovací dávkou 10 mg denně. Jednou z jasných indikací podání je trombóza ve stentu při duální antiagregační léčbě ASA + clopidogrel. Vyšší efektivita prasugrelu oproti clopidogrelu je však spojena se zvýšeným rizikem závažných krvácení u pacientů s anamnézou TIA (tranzitorní ischemická ataka)/CMP, ve věku ≥ 75 let a s nízkou váhou < 60 kg, u kterých by tato léčba neměla být nasazena vůbec nebo s největší obezřetností;
- ticagrelol [107]: sytící dávka 180 mg s udržovací dávkou 90 mg 2krát denně;
- inhibitory GP IIb/IIIa: selektivní podání v závislosti na klinickém a angiografickém riziku [109], rutinní podání není indikováno.
Tab. 10. Antiagregační léčba po revaskularizaci. 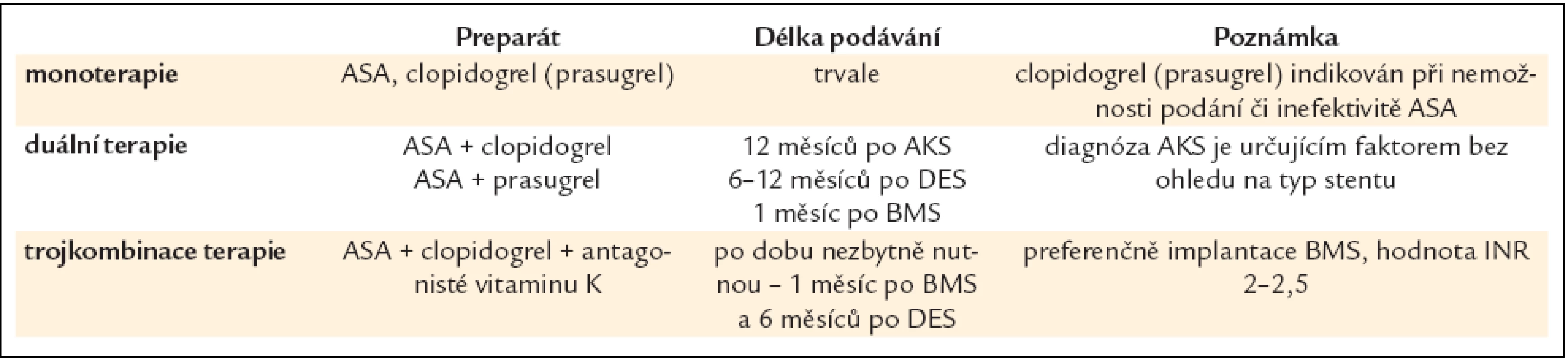
8.3. Farmakoterapie při STEMI léčeném primární PCI
Při prvním kontaktu po stanovení diagnózy STEMI:
-
a) Antikoagulační léčba:
- UFH v dávce 70–100 IU/kg v závislosti na podání inhibitorů GP IIb//IIIa. LMWH t. č. není doporučen.
- b) Antiagregační léčba:
- ASA: 500 mg i.v.;
- clopidogrel: sytící dávka 600 mg nebo
- prasugrel 60 mg.
Na katetrizačním sále:
-
a) Antikoagulační léčba:
- UFH dle aktivovaného koagulačního času (ACT) (200–250, resp. 250–350 s inhibitory GP IIb/IIIa nebo bez nich);
- bivalirudin v monoterapii: 0,5 mg/kg i.v. + 1,75 mg/kg/hod kontinuálně – podání je spojeno s významně nižším výskytem krvácení oproti kombinaci UFH + inhibitory GP IIb/IIIa, ale vyšším výskytem trombóz ve stentu.
- prasugrel 60 mg (pokud nebyla dříve již podána sytící dávka clopidogrelu či prasugrelu),
- inhibitory GP IIb/IIIa: selektivní podání v závislosti na klinickém a angiografickém riziku, event. komplikacích. Podání bolusu možné i.c.
Po PCI:
-
a) Antikoagulační léčba:
Antikoagulační léčba již není po PCI indikována (výjimkou jsou preventivní dávky LMWH u nemocných upoutaných z jakýchkoli důvodů na lůžko).
- b) Antiagregační léčba:
Po PCI pokračuje duální protidestičková léčba kombinací ASA 100 mg + + prasugrel 10 mg, event. u nemocných s kontraindikací prasugrelu či při jeho nedostupnosti ASA 100 mg + clopidogrel 75–150 mg.
8.4. Farmakoterapie při elektivním CABG
Pacientům, kteří jsou přijati k výkonu chirurgické revaskularizace, je obyčejně podána řada léčiv, zejména beta-blokátory, inhibitory ACE, blokátory kalciového kanálu a protidestičkové léky. V léčbě beta-blokátory je doporučeno pokračovat vzhledem ke snížení rizika vzniku akutní ischemie, která hrozí při přerušení této léčby, i pro vliv na snížení perioperačních arytmií [110–112]. Obecná praxe ukončení podávání clopidogrelu minimálně 5 dnů před operací, event. včetně ASA u stabilních pacientů, je v současnosti modifikována, a přestože je přerušení protidestičkové léčby stále předmětem diskuze, konkrétní doporučení jsou uvedena v tab. 11 a 12.
Tab. 11. Chirurgické zákroky při duální (kombinované) antiagregační léčbě. 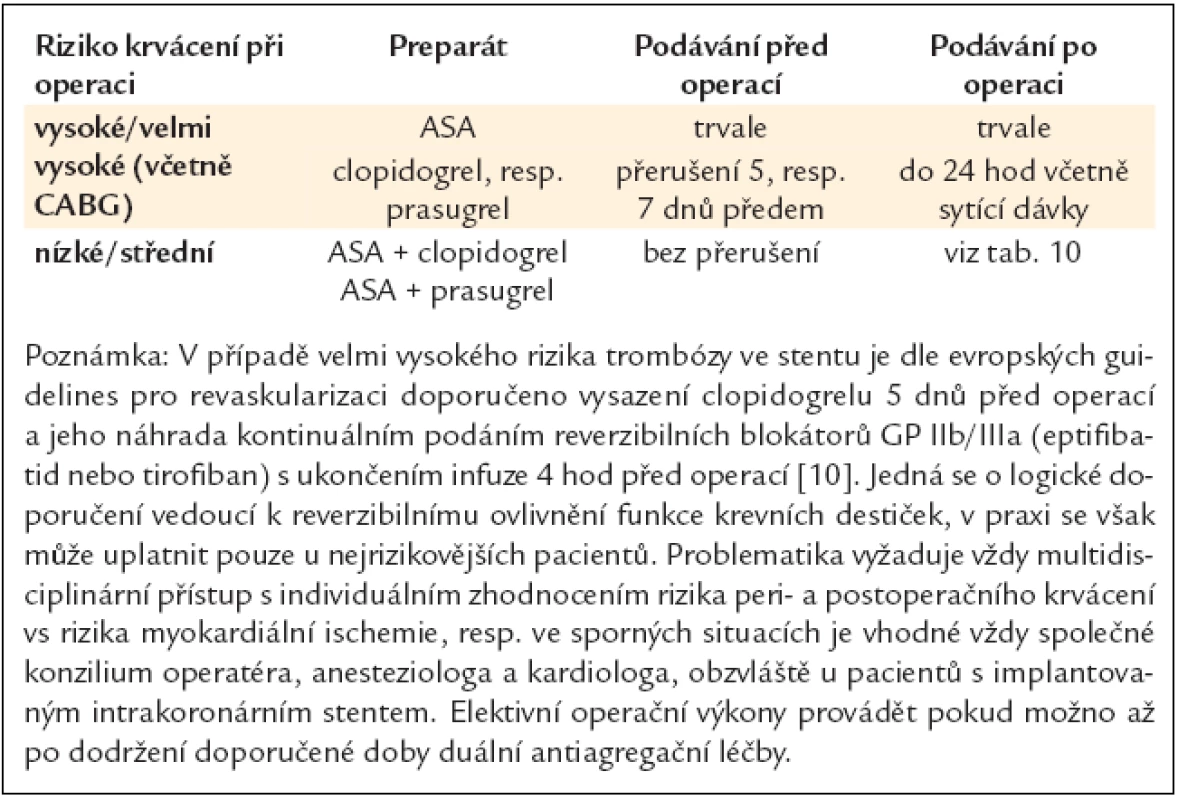
Tab. 12. Doporučené schéma antitrombotické medikace v období okolo operace CABG. 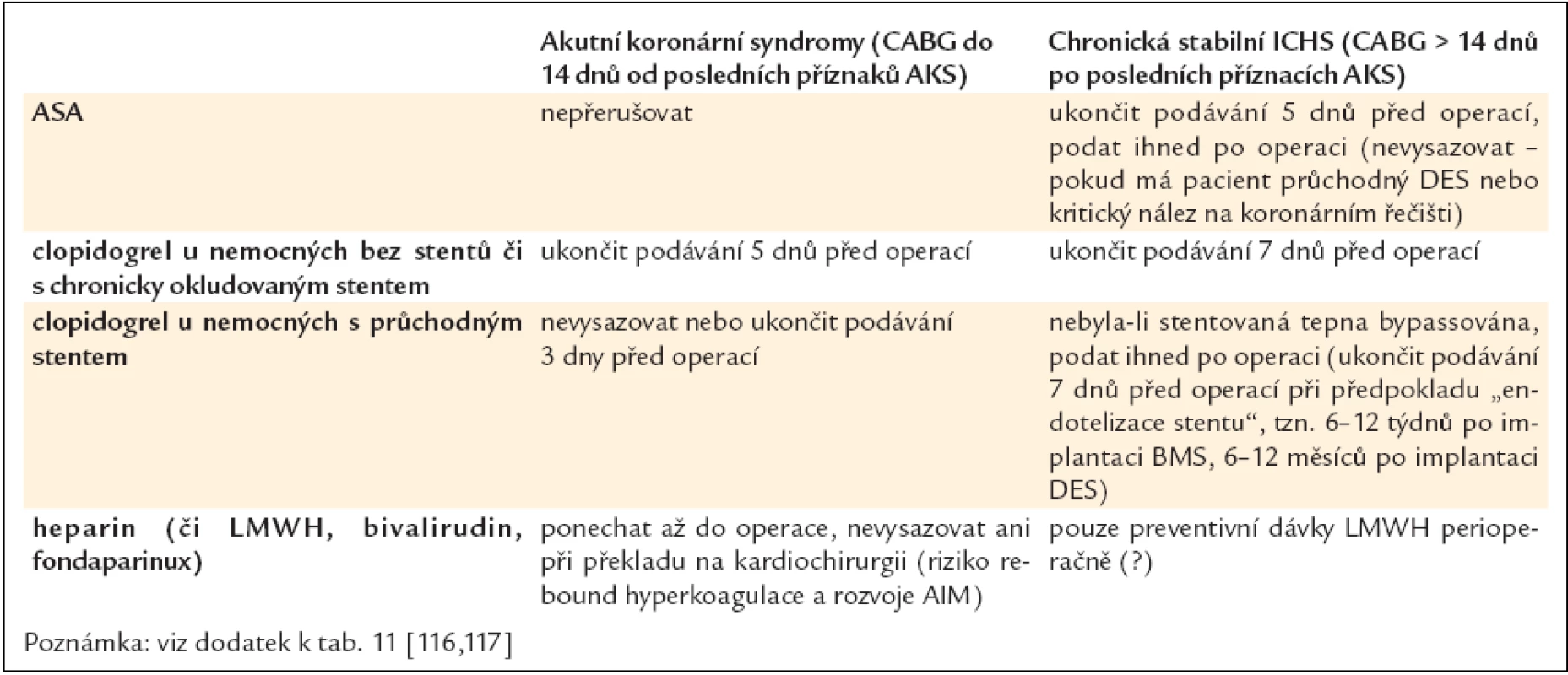
Ke snížení výskytu pooperační fibrilace síní je doporučováno den před operací podat 2krát 200 mg amiodaronu p.o. ráno s premedikací a pokračovat ve stejném dávkování ihned po extubaci [113].
Antiagregační léčbu je třeba zahájit co nejdříve po operaci, její podání 2. pooperační den a později na průchodnost aortokoronárních bypassů má již menší vliv [114,115].
V případě neurochirurgických operací a některých očních operací je u operace v období po předpokládané endotelizaci stentu doporučeno nepodávat ASA 7 dnů před výkonem.
8.5. Farmakoterapie při duální či trojkombinované antitrombotické léčbě před nekardiální operací
Ukončení podávání antitrombotické léčby je spojeno s vysokým rizikem trombózy ve stentu, které může vést až v 21 % k úmrtí nemocných. Rizikové období, ve kterém by se neměly provádět žádné plánované operace, nutící k nepodávání antitrombotické léčby, trvá po dobu 1 měsíce po implantaci BMS a 6–12 měsíců po implantaci DES (viz kapitola 2.1.1.) (tab. 11).
V případě nutnosti nekardiální operace nemocného, který je léčen trojkombinací antitrombotik (duální antiagregace a antikoagulační léčba), je nutné individuálně zvážit převažující riziko ukončení jejich podávání:
- v případě trombózy ve stentu je postup popsán v tab. 11;
- v případě tromboembolizačního rizika je doporučeno týden před operací zaměnit antitrombotickou léčbu za léčebné dávky LMWH.
Poslední dávka se podá den před operací a nasazuje se co nejdříve po operaci spolu s původní antitrombotickou léčbou.
9. Komplikace PCI
Každý nemocný, který podstupuje revaskularizační zákrok (PCI nebo CABG), má právo na podrobnou informaci o možných komplikacích včetně procentuálního vyjádření jejich pravděpodobnosti. Nemocný musí dostat rovněž informaci o tom, jaké je předpokládané riziko přirozeného průběhu choroby (při konzervativní léčbě, bez revaskularizace) v jeho konkrétním případě, aby se mohl rozhodnout, zda je ochoten riziko zákroku podstoupit. Nemocný musí být též srozumitelně informován, zda v jeho konkrétním případě lze od revaskularizace očekávat prodloužení života (to platí zpravidla u akutních koronárních syndromů), nebo pouze zlepšení kvality života (to platí zpravidla pro chronické formy ICHS).
9.1. Periprocedurální ischemické komplikace (úmrtí, infarkt, CMP)
PCI je spojena s určitým nevelkým rizikem velmi závažných komplikací: úmrtí, vzniku infarktu myokardu nebo CMP. Riziko úmrtí v důsledku komplikace PCI se díky pokroku v kvalitě materiálu (menší rozměry, větší ohebnost) i zlepšené periprocedurální farmakoterapii snížilo z původních 1–2 % na současných 0,1–0,5 %. V dobrých centrech je riziko úmrtí v důsledku komplikace PCI 0,1–0,2 %, v žádné instituci by v současné době toto riziko nemělo převyšovat 1 %. Riziko vzniku nefatálního Q-infarktu myokardu (zpravidla způsobeného okluzí dilatované tepny) se pohybuje kolem 1 %. Riziko vzniku klinicky patrného non-Q infarktu myokardu (zpravidla způsobeného okluzí boční větve nebo slow-flow fenoménem) je asi 2–3 %. Riziko vzniku minimálního („laboratorního“) infarktu (zvýšený troponin bez klinického korelátu) je asi 15–30 %. Riziko vzniku mozkové cévní příhody je < 1 %.
Tab. 13 ukazuje přehledně možné příčiny těchto komplikací a cesty, jak jim předcházet.
Tab. 13. Ischemické komplikace PCI. 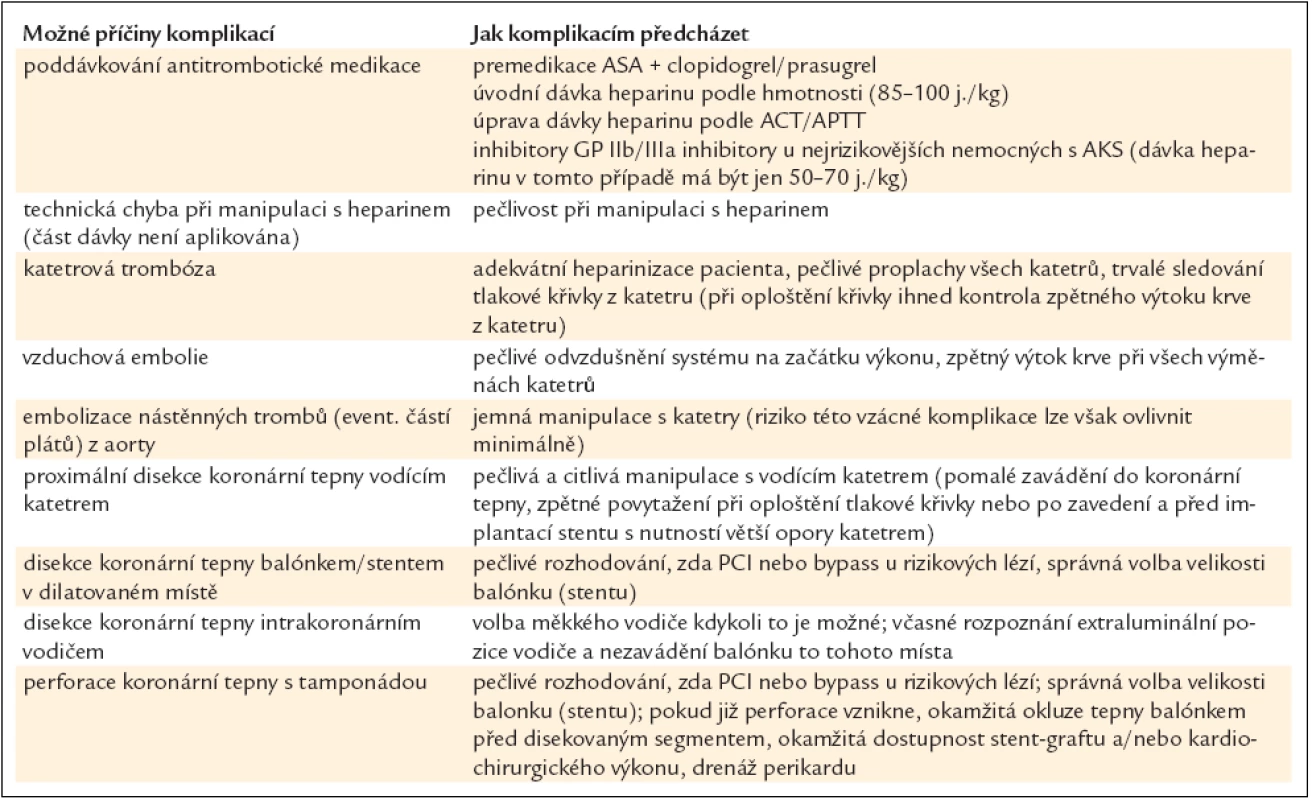
9.2. Periprocedurální krvácivé komplikace
Tab. 14 uvádí nejčastější krvácivé komplikace vyskytující se po intervenčních výkonech, jejich obvyklou diagnostiku a léčbu.
Tab. 14. Nejčastější krvácivé komplikace, jejich obvyklá diagnostika a léčba. 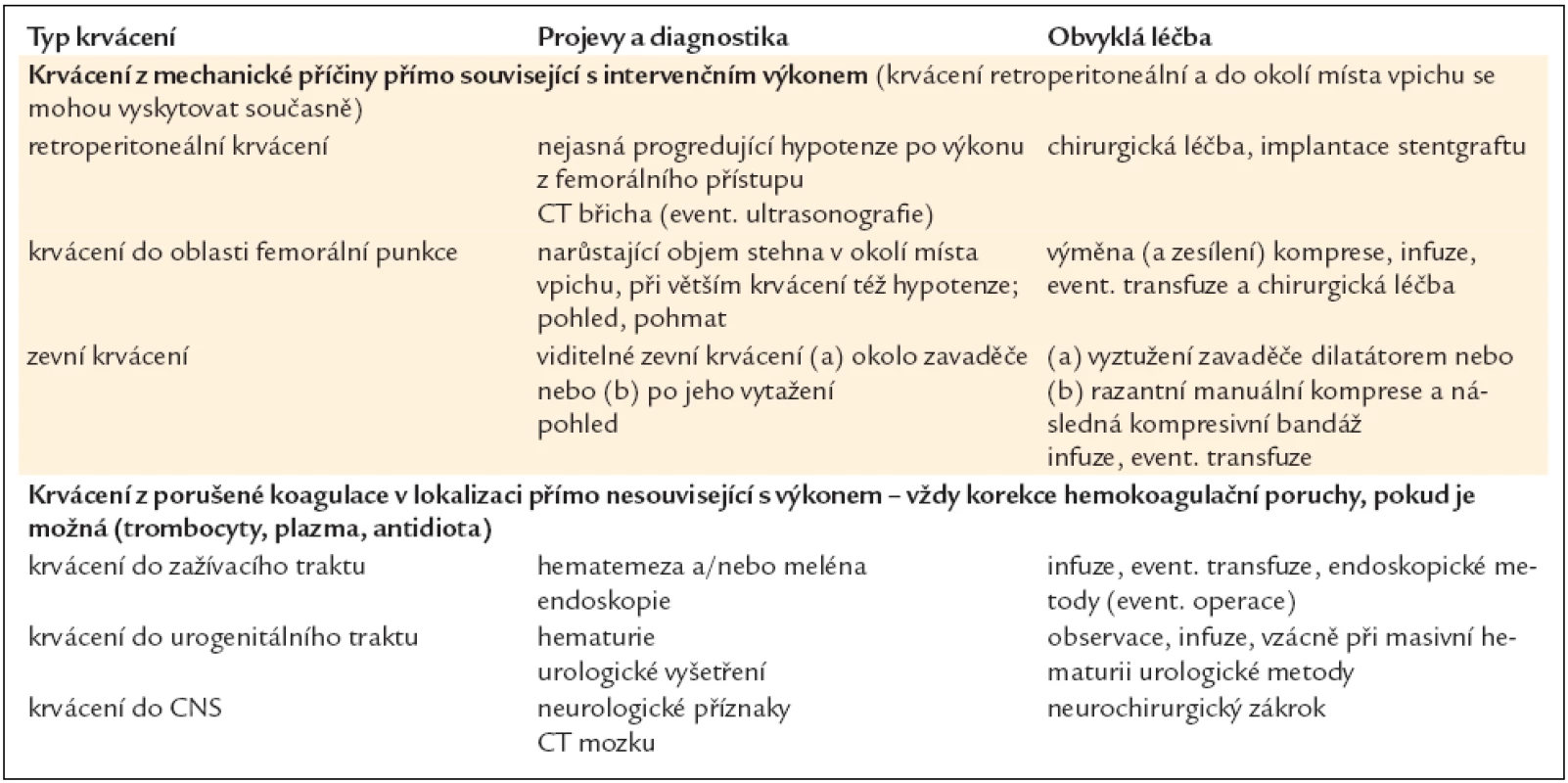
Při vzniku krvácivých komplikací je vždy nutné individuálně pečlivě zvážit, zda je konkrétní pacient ohrožen více vzniklým krvácením, nebo případnou akutní trombózou stentu (pokud by přerušení antitrombotické léčby bylo příliš razantní). Při život ohrožujícím krvácení (šokový stav při jakémkoli krvácení, každé retroperitoneální krvácení, každé krvácení do CNS) je samozřejmě nutné ukončit veškerou antitrombotickou medikaci a antagonizovat účinek antikoagulancií a event. i antiagregancií. Protamin sulfát antagonizuje účinek nefrakcionovaného heparinu a částečně nízkomolekulárního heparinu. K antagonizaci warfarinu podáváme protrombinový komplex faktorů II, VII, IX, X nebo mraženou plazmu. Fondaparinux lze antagonizovat pouze finančně nákladným rekombinantním faktorem VII. Pro antagonizaci účinku antiagregancií je nutné podat trombonálevy. Při méně dramatických klinických obrazech se zpravidla ukončí podávání veškerých antitrombotik kromě clopidogrelu/prasugrelu (jehož ponechání zpravidla stačí k prevenci akutní trombózy stentu). O podání transfuzí je vhodné rozhodnout též se zřetelem ke klinickému obrazu.
Pseudoaneuryzma femorální arterie je poměrně častou komplikací PCI (2–4 % výkonů) nebo koronarografie (0,5–2 % výkonů). Častější výskyt po PCI souvisí s intenzivnější antitrombotickou léčbou u těchto nemocných. Diagnóza je stanovena fyzikálním vyšetřením (dobře ohraničená pulzující rezistence v místě vpichu, často s krátkým slabým systolickým šelestem) a ultrasonograficky. Léčba je mechanická (komprese ultrazvukovou sondou do trombotizace výdutě nebo prolongovaný kompresivní obvaz), event. farmakologická (injekce trombinu do výdutě za ultrazvukové kontroly). Mechanická komprese vede k trombotizaci (s následnou pomalou resorpcí) 63–95 % nepravých výdutí, injekce trombinu má efektivitu 93–100 %. Nevýhodou trombinové metody [118] je malé riziko komplikací (uzávěr a. femoralis ve 2 %, ruptura výdutě v 1 %, vznik abscesu v 1 %, ischemie distálních částí končetiny v 1 %). Jen ve zcela výjimečných případech (mimořádné velkého a progredujícího pseudoaneuryzmatu) je nutné cévně chirurgické řešení.
9.3. Ostatní komplikace PCI
Kontrastem indukovaná nefropatie
Podání kontrastní látky může způsobit zpravidla reverzibilní akutní poškození funkce ledvin, které se objevuje brzy po podání kontrastu [119]. Kontrastní látkou indukovaná nefropatie (contrast induced nephropathy – CIN) je definována jako zvýšení sérové koncentrace kreatininu o > 44 µmol/l nebo o > 25 % za 48–72 hod po podání kontrastní látky [120]. Nutnost hemodialýzy po elektivní koronarografii či PCI je raritní (< 1 % [121]), avšak u nemocných s akutním koronárním syndromem toto riziko stoupá až na 12 % [122]. Rizikoví nemocní pro vznik CIN jsou ti, kteří mají preexistující snížení renálních funkcí (eGFR < 60 ml/min/1,73 m2, obvykle sérovou koncentraci kreatininu > 132 µmol/l), zejména diabetici léčení biguanidy.
Prevence CIN. Pacienti s normální renální funkcí mají velmi malé riziko a u nich stačí, aby před výkonem dostatečně pili (výkon by neměl být prováděn u nemocného s dehydratací). U nemocných se zvýšeným rizikem CIN jsou doporučena následující preventivní opatření [123]:
- nejnižší možná dávka kontrastu;
- na výkon musí jít nemocný dobře hydratovaný;
- v den výkonu nepodávat diuretika, pokud to není nezbytně nutné;
- nepoužívat v době okolo výkonu nesteroidní protizánětlivé léky a aminoglykosidová antibiotika;
- metformin nesmí být podáván 48 hod před výkonem a 48 hod po výkonu;
- použít izoosmolární kontrastní látku;
- při nutnosti opakovaného vyšetření by mezi nimi mělo být více než 48 hod a hodnoty kreatininu by se měly před 2. vyšetřením vrátit k původním hodnotám;
- podávat izotonické infuze před výkonem, během výkonu a několik hodin po něm. Doporučený režim [124]: fyziologický roztok 1,0 ml/kg/hod, začít 6 hod před výkonem a pokračovat 6–12 hod po výkonu;
- význam podávání acetylcysteinu je sporný. Někteří doporučují dávku 600–1 200 mg p.o. (nikoli i.v.!) 2krát denně den před výkonem a v den výkonu, jiné práce význam této léčby popírají;
- profylaktická hemofiltrace zahájená 6 hod před výkonem (nebo event. bezprostředně po výkonu s ohledem na podanou dávku kontrastní látky) může být zvážena u pacientů s těžkou renální insuficiencí a doporučuje se pokračovat 24 hod po výkonu.
Arteriovenózní píštěl
Přibližně u 0,5–1 % nemocných po srdeční katetrizaci či PCI dojde ke vzniku komunikace mezi tepnou a žílou v místě vpichu. Diagnóza je velmi jednoduchá fonendoskopicky: nalézáme typický kontinuální systolicko-diastolický šelest, ten je jednoznačným průkazem. Léčba zpravidla není třeba žádná – píštěl během několika týdnů či měsíců po výkonu spontánně zanikne téměř u všech nemocných.
10. Komplikace CABG
10.1. Periprocedurální ischemické komplikace (úmrtí, infarkt, CMP)
Úmrtí na CABG se v ČR dle údajů Národních kardiochirurgického registru (NKR) pohybuje mezi 1,7–2,1 %. Absolutní číslo nevypovídá zcela o kvalitě pracoviště. K objektivnějšímu zhodnocení výsledků pracovišť slouží tzv. riziková stratifikace, kdy je pomocí skórovacího systému porovnáván výsledek pracoviště se standardem. Bylo vypracováno mnoho systémů, všechny se opírají o 2 typy – aditivní a procentuální (kapitola 1.2.).
Vzhledem k tomu, že procento úmrtí po CABG je malé, byl jako alternativa k úmrtnosti zvolen tzv. Near Miss+. Operace je takto hodnocena, pokud pacient zemřel, došlo k CMP, byla nutná dialýza či pooperační pobyt byl delší než 15 dnů (www.sfar.org/scores2/parsonnet2.html).
Závažnou komplikací je perioperačně vzniklý infarkt myokardu (2–4 %). V tab. 15 jsou uvedena doporučení u pacientů po CABG, u kterých jsou přítomny známky ischemie po příjezdu na pooperační oddělení. Nutno podotknout, že procento ischemických příhod je úměrné důkladnosti, s jakou je po jejich výskytu pátráno.
Tab. 15. Indikace akutní koronarografie po CABG. 
Další léčba závisí na koronarografickém nálezu. Může být indikován konzervativní postup (bypassy průchodné), PCI či reoperace [125].
Neurologické komplikace (výskyt 2–3 %) patří mezi nejzávažnější komplikace CABG. Ischemická choroba srdeční je projev aterosklerózy, systémového onemocnění. Znamená to, že stejným procesem, kterým jsou postiženy věnčité tepny, mohou být postiženy cévy v celém tepenném řečišti včetně tepen mozkových. Příčinou neurologických komplikací může být krvácení, ale častěji je to embolizace do CNS. Jeho zdrojem mohou být ateromové pláty v oblouku aorty v extrakraniálních i intrakraniálních tepnách, zásobujících mozek. Neurologické příznaky mohou být od drobných tranzistorních příhod až po těžké ložiskové nálezy. Mnohem závažnější, avšak naštěstí vzácnější, jsou příhody způsobené krvácením. Kromě toho se mohou vyskytovat dočasné poruchy kognitivních funkcí [126].
I když se stále hovoří o provádění aortokoronárních rekonstrukcí off-pump, stále nejméně 70 % všech rekonstrukcí je prováděno za použití mimotělního oběhu. Ischemické komplikace mohou být v těchto případech způsobeny i použitím mimotělního oběhu. Vzhledem k velkému umělému povrchu může dojít nejen k vzniku mikroembolů s následnou embolizací [127], ale – jak udává zejména starší literatura – i poruchou oxygenace, která se udává v počtu 1 případ na 13 662 operací [128]. Výskyt neurologických komplikací je popisován zejména tehdy, je-li tlak při perfuzi mimotělního oběhu > 80 mm Hg.
10.2. Periprocedurální krvácivé komplikace
Na rozdíl od ostatních oborů chirurgie, tromboembolické komplikace se v kardiochirurgii prakticky nevyskytují. Je to způsobeno tím, že podstatná část operace je prováděna v celkové heparinizaci a použití mimotělního oběhu porušuje hemokoagulační faktory tak, že převažuje obava před krvácivými komplikacemi [129]. Závažným zdrojem mohou být technické chyby při šití anastomóz, kdy zdrojem je krvácení v centrální či periferní anastomóze. Avšak naprostá většina krvácivých komplikací není způsobena technickými chybami při šití anastomóz, ale zejména drobným krvácením, např. po odběru a. mammaria, či poruchami koagulace. Je nutná dobrá a trvalá spolupráce chirurga s anesteziologem na pooperačním oddělení. Nutnost krevních převodů je přibližně 30 % a zásady pro indikaci k revizi jsou následující: krevní ztráty ve 3 po sobě následujících hodinách ≥ 200 ml či ztráty ve 2 po sobě následujících hodinách ≥ 300 ml či jednorázová ztráta ≥ 400 ml (výskyt asi 2 %). U složitých reoperací či akutních výkonů je výhodou užití metody rekuperace krve (tzv. Cell Saveru).
10.3. Infekční komplikace
Infekční komplikace patří mezi závažné komplikace, vedoucí nezřídka k trvalé invaliditě nemocného. U operací pro ischemickou chorobu srdeční se může jednat o infekce ve sternotomické ráně (asi 1 %) či v místech po odběru žilního štěpu z v. safena magna (asi 5 %). Infekce ve sternotomické ráně mohou být povrchní, kožní a podkožní či hluboké, spojené se zánětem mezihrudí či osteomyelitidou sterna. Kromě radikálního chirurgického vyčištění operační rány a cílené antibiotické terapie je třeba dodržovat zásady operování v tzv. chráněném koagulu a pečlivě sledovat bakteriologickou situaci pracoviště a přizpůsobovat mu antibiotickou politiku.
Mnohem častější jsou komplikace po odběru žilního štěpu z v. saphena magna. Mezi ně patří dehiscence rány na podkladě infekce, perimaleolární otoky či neurologické poruchy v důsledku poranění n. saphenus. I když tyto komplikace, na rozdíl od infekce sternotomie, většinou neohrožují nemocného na životě, jsou největším zdrojem stesků operovaných. Správné technice odběru žilních štěpů z dolních končetin je třeba věnovat velkou pozornost.
Pro snížení infekčních komplikací v ráně po odběru žilního štěpu na dolní končetině má zásadní význam provádění miniinvazivní techniky, a nikoli odběr z jednoho velkého řezu. Miniinvazivní odběr žilního štěpu by až na určité výjimky měl být metodou volby [130].
10.4. Ostatní komplikace
Mezi ostatní komplikace patří obecně chirurgické komplikace. K jejich diagnostice a řešení se doporučuje přizvat zkušeného břišního chirurga s příslušnou kvalifikací. Jejich diagnostika může být komplikovaná složitým pooperačním stavem spojeným s podáváním antibiotik, event. analgetik. Z celé plejády možných komplikací, které jsou předmětem učebnic chirurgie, bychom chtěli upozornit na velice závažné, tj. komplikace v oblasti gastrointestinálního traktu. Může dojít nejen ke vzniku stresového žaludečního vředu, ale i ke vzniku ileózních komplikací, event. ischemických příhod z důvodu uzávěru cév ve splanchnické oblasti [131]. Tyto komplikace, i když vzácné, jsou velice závažné s vysokou úmrtností. Prevence komplikací gastrointestinálního traktu spočívá v provádění předoperační gastroskopie u nemocných s anamnézou recentní vředové choroby či přeléčení infekce.
Z daleka nejčastější komplikací je vznik fibrilace síní, ke které dochází až ve 40 % (prevence viz kapitola 8.4), relativně často je pozorováno i přechodné zhoršení renálních funkcí (5–10 %).
Poznámka
Výše uvedený text doplňuje a rozšiřuje česká a evropská doporučení pro léčbu pacientů s akutním koronárním syndromem s/bez ST elevací a stabilní anginou pectoris [132–136].
Seznam zkratek použitých v textu
- ACD – a. coronaria dextra
- ACS – a. coronaria sinistra
- AIM – akutní infarkt myokardu
- AKS – akutní koronární syndrom
- ACT – aktivovaný koagulační čas
- AP – angina pectoris
- AR – a. radialis
- ASA – kyselina acetylsalicylová
- BMS – kovový holý stent (bare-metal stent)
- BNP – B-natriuretický peptid
- CABG – aortokoronární bypass (coronary artery bypass rafting)
- CIN – kontrastem indukovaná nefropatie (contrast induced nephropathy)
- CMP – cévní mozková příhoda
- CT – výpočetní tomografie (computer tomography)
- DES – lékový stent (drug-eluting stent)
- DM – diabetes mellitus
- FFRmyo – frakční průtoková rezerva myokardu (fractional flow reserve of myocardium)
- GFR – glomerulární filtrace
- GPI – inhibitory glykoproteinových receptorů destiček IIb/III (GP IIb/IIIa)
- GpIIb/IIIa – blokátory glykoproteinových receptorů destiček IIb/IIIa
- Hs-CRP – high-sensitivity (vysoce citlivý) C-reaktivní protein
- CHOPN – chronická obstrukční plicní nemoc
- CHRI – chronická renální insuficience
- ICHDK – ischemická choroba tepen dolních končetin
- ICHS – ischemická choroba srdeční
- IM – infarkt myokardu
- IMA – a. thoracica interna (internal mammary artery)
- INR – international normalized ratio
- ISZ – ischemická srdeční zástava
- IVUS – intravaskulární ultrazvuk (intravascular ultrasound)
- LIMA – levá IMA (left internal mammary artery)
- LK – levá komora srdeční
- LMCA – kmen levé věnčité tepny (left main coronary artery)
- LMWH – nízkomolekulární heparin (low-molecular heparin)
- MACE – hlavní kardiovaskulární příhody (major adverse cardiovascular events)
- MTO – mimotělní oběh
- Non-STEMI – akutní infarkt myokardu bez elevací úseku ST
- NT pro-BNP – N-terminální natriuretický peptid typu B
- OCT – optická koherentní tomografie (optical coherent tomography)
- PCI – perkutánní koronární intervence (percutaneous coronary intervention)
- p-PCI – primární PCI
- RIA – ramus interventricularis anterior
- RIMA – pravá IMA (right internal mammary artery)
- RC – ramus circumflexus
- RR – míra rizika (risk ratio)
- STEMI – akutní infarkt myokardu s elevacemi úseku ST
- TAVI – perkutánní implantace aortální chlopně (transcatheter aortic valve implantation)
- TIA – tranzitorní ischemická ataka (mozku)
- TnT – troponin T
- VD – tepny s angiografickým postižením ≥ 50 % (vessel disease)
- UFH – nefrakcionovaný heparin (unfractionated heparin)
- TEE – transezofageální echokardiografie
MUDr. Petr Kala, Ph.D., FESC
www.fnbrno.cz
e-mail: kalapetr@yahoo.com
Doručeno do redakce: 15. 12. 2011
Otištěno s laskavým svolením výboru České kardiologické společnosti a redakční rady časopisu Cor et Vasa. Originálně publikováno v Cor Vasa 2011; 53 (Suppl 1): 3–24.
Zdroje
1. The Task Force on the Management of Stable Angina Pectoris of the European Society of Cardiology. ESC Committee for Practice Guidelines (CPG). Guidelines on the management of stable angina pectoris: executive summary: The Task Force on the Management of Stable Angina Pectoris of the European Society of Cardiology. Eur Heart J 2006; 27 : 1341–1381.
2. Singh M, Rihal CS, Lennon RJ et al. Bedside estimation of risk from percutaneous coronary intervention: the new Mayo Clinic risk scores. Mayo Clinic Proceedings 2007; 82 : 701–708.
3. Singh M, Peterson ED, Milford-Beland S et al. Validation of the Mayo Clinic risk score for in-hospital mortality after percutaneous coronary interventions using the National Cardiovascular Data Registry. Circ Cardiovasc Interv 2008; 1 : 36–44.
4. Sianos G, Morel MA, Kappetein AP et al. The SYNTAX Score: an angiographic tool grading the complexity of coronary artery disease. Euro Interv 2005; 1 : 219–227.
5. Roques F, Michel P, Goldstone AR et al. The logistic EuroSCORE. Eur Heart J 2003; 24 : 882–883.
6. Roques F, Nashef SA, Michel P et al. Risk factors and outcome in European cardiac surgery: analysis of the EuroSCORE multinational database of 19030 patients. Eur J Cardiothorac Surg 1999; 15 : 816–822; discussion 822–823.
7. Anderson RP. First publications from the Society of Thoracic Surgeons National Database. Ann Thorac Surg 1994; 57 : 6–7.
8. Parsonnet V, Dean D, Bernstein AD. A method of uniform stratification of risk for evaluating the results of surgery in acquired adult heart disease. Circulation 1989; 79: I3–I12.
9. Hattler BG, Madia C, Johnson C et al. Risk stratification using the Society of thoracic surgeons programme. Ann Thorac Surg 1994; 52 : 1348–1352.
10. The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). European Association for Percutaneous Cardiovascular Interventions (EAPCI). Wijns W, Kolh P, Danchin N et al. Guidelines on myocardial revascularization. Eur Heart J 2010; 31 : 2501–2555.
11. Selmer R, Halvorsen S, Linnestad K et al. Cost-effectiveness of thrombolysis versus percutaneous coronary intervention (PCI) for acute myocardial infarction. Proc One HTA Health Technol Assess Int Meet 1st 2004 Krakow Pol 2004; 1 : 10.
12. Stroupe KT, Morrison DA, Hlatky MA et al. Investigators of Veterans Affairs Cooperative Studies Program #385 (AWESOME: Angina With Extremely Serious Operative Mortality Evaluation). Cost-Effectiveness of Coronary Artery Bypass Grafts Versus Percutaneous Coronary Intervention for Revascularization of High-Risk Patients. Circulation 2006; 114 : 1251–1257.
13. Klein LW. Are Drug-Eluting Stents the Preferred Treatment for Multivessel Coronary Artery Disease? J Amer Coll Cardiol 2006; 47 : 22–26.
14. Boden WE, O’Rourke RA, Teo KK et al. Optimal medical therapy with or without PCI for stable coronary disease. N Engl J Med 2007; 356 : 1503–1516.
15. Katritsis DG, Ioannidis JP. Percutaneous coronary intervention versus conservative therapy in nonacute coronary artery disease: a meta-analysis. Circulation 2005; 111 : 2906–2912.
16. Trikalinos TA, Alsheikh-Ali AA, Tatsioni A et al. Percutaneous coronary interventions for non-acute coronary artery disease: a quantitative 20-year synopsis and a network meta-analysis. Lancet 2009; 373 : 911–918.
17. Shaw LJ, Berman DS, Maron DJ et al. COURAGE Investigators. Optimal medical therapy with or without percutaneous coronary intervention to reduce ischemic burden: results from the Clinical Outcomes Utilizing Revascularization and Aggressive Drug Evaluation (COURAGE) trial nuclear substudy. Circulation 2008; 117 : 1283–1291.
18. Tonino PA, De Bruyne B, Pijls NH et al. FAME Study Investigators. Fractional flow reserve versus angiography for guiding percutaneous coronary intervention. N Engl J Med 2009; 360 : 213–224.
19. Pijls NH, Fearon WF, Tonino PA et al. FAME Study Investigators. Fractional flow reserve versus angiography for guiding percutaneous coronary intervention in patients with multivessel coronary artery disease: 2-year follow-up of the FAME (Fractional Flow Reserve Versus Angiography for Multivessel Evaluation) study. J Am Coll Cardiol 2010; 56 : 177–184.
20. Tonino PA, Fearon WF, De Bruyne B et al. Angiographic versus functional severity of coronary artery stenoses in the FAME study fractional flow reserve versus angiography in multivessel evaluation. J Am Coll Cardiol 2010; 55 : 2816–2821.
21. Pocock SJ, Henderson RA, Rickards AF et al. Meta-analysis of randomised trials comparing coronary angioplasty with bypass surgery. Lancet 1995; 346 : 1184–1189.
22. Comparison of coronary bypass surgery with angioplasty in patients with multivessel disease. The Bypass Angioplasty Revascularization Investigation (BARI) Investigators. N Engl J Med 1996; 335 : 217–225.
23. Serruys PW, Unger F, Sousa JE et al. Arterial Revascularization Therapies Study Group. Comparison of coronary-artery bypass surgery and stenting for the treatment of multivessel disease. N Engl J Med 2001; 344 : 1117–1124.
24. SOS Investigators. Coronary artery bypass surgery versus percutaneous coronary intervention with stent implantation in patients with multivessel coronary artery disease (the Stent Or Surgery trial): a randomised controlled trial. Lancet 2002; 360 : 965–970.
25. Hlatky MA, Boothroyd DB, Bravata DM et al. Coronary artery bypass surgery compared with percutaneous coronary interventions for multivessel disease: a collaborative analysis of individual patient data from ten randomised trials. Lancet 2009; 373 : 1190–1197.
26. Serryus PW, Morice MC, Kappetein AP et al. SYNTAX Investigators. Percutaneous Coronary Intervention versus Coronary Atrery Bypass Grafting for Severe Coronary Artery Disease. N Engl J Med 2009; 360 : 961–972.
27. Yusuf C, Zucker D, Peduzzi P et al. Effect of coronary artery bypass graft surgery on survival: overview of 10-year results from randomised trials by the Coronary Artery Bypass Graft Surgery Trialists Collaboration. Lancet 1994; 344 : 563–570.
28. Jeremias A, Kaul S, Rosengart TK et al. The impact of revascularization on mortality in patients with nonacute coronary artery disease. Am J Med 2009; 122 : 152–161.
29. Taggart DP, D’Amico R, Altman DG. Effect of arterial revacularisation on survival: a systemic review of studies comparing bilateral and single internal mammary arteries. Lancet 2001; 358 : 870–875.
30. The FRISC II Investigators. Invasive compared with non-invasive treatment in unstable coronary-artery disease: FRISC II prospective randomised multicentre study. FRagmin and Fast Revascularisation during InStability in Coronary artery disease Investigators. Lancet 1999; 354 : 708–715.
31. Fox KA, Poole-Wilson PA, Henderson RA et al. Interventional versus conservative treatment for patients with unstable angina or non-ST-elevation myocardial infarction: the British Heart Foundation RITA 3 randomised trial. Randomized Intervention Trial of unstable Angina. Lancet 2002; 360 : 743–751.
32. Spacek R, Widimsky P, Straka Z et al. Value of first day angiography/angioplasty in evolving Non-ST segment elevation myocardial infarction: an open multicentre randomized trial. The VINO Study. Eur Heart J 2002; 23 : 230–238.
33. Ottervanger JP, Armstrong P, Barnathan ES et al. GUSTO IV-ACS Investigators. Association of revascularisation with low mortality in non-ST elevation acute coronary syndrome, a report from GUSTO IV-ACS. Eur Heart J 2004; 25 : 1494–1501.
34. Hirsch A, Windhausen F, Tijssen JG et al. Invasive versus Conservative Treatment in Unstable coronary Syndromes (ICTUS) investigators. Long-term outcome after an early invasive versus selective noninvasive treatment strategy in patients with non-ST-elevation acute coronary syndrome and elevated cardiac troponin T (the ICTUS trial): a follow-up study. Lancet 2007; 369 : 827–835.
35. Mehta SR, Cannon CP, Fox KA et al. Routine vs selective invasive strategies in patients with acute coronary syndromes: a collaborative meta-analysis of randomized trials. JAMA 2005; 293 : 2908–2917.
36. Mehta RS, Granger CB, Boden WE et al. TIMACS Investigators. Early versus Delayed Invasive Intervention in Acute Coronary Syndromes. N Engl J Med 2009; 360 : 2165–2175.
37. Neumann FJ, Kastrati A, Pogatsa-Murray G et al. Evaluation of prolonged anti-thrombotic pre treatment (“cooling off” strategy) before intervention in patients with unstable coronary syndromes: a randomized controlled trial. JAMA 2003; 290 : 1593–1599.
38. Fox KA, Goodman SG, Anderson FA Jr et al. GRACE Investigators. From guidelines to clinical practice: the impact of hospital and geographical characteristics on temporal trends in the management of acute coronary syndromes. The Global Registry of Acute Coronary Events (GRACE). Eur Heart J 2003; 24 : 1414–1424.
39. Bhatt DL, Roe MT, Peterson ED et al. CRUSADE Investigators. Utilization of early invasive management strategies for high-risk patients with non-ST-segment elevation acute coronary syndromes: results from the CRUSADE Quality Improvement Initiative. JAMA 2004; 292 : 2096–2104.
40. Grines CL, Browne KF, Marco J et al. A comparison of immediate angioplasty with thrombolytic therapy for acute myocardial infarction. The Primary Angioplasty in Myocardial Infarction Study Group. N Engl J Med 1993; 328 : 673–679.
41. Keeley EC, Boura JA, Grines CL. Primary angioplasty versus intravenous thrombolytic therapy for acute myocardial infarction: a quantitative review of 23 randomised trials. Lancet 2003; 361 : 13–20.
42. Grines CL, Westerhausen DR Jr, Grines LL et al. Air PAMI Study Group. A randomized trial of transfer for primary angioplasty versus on-site thrombolysis in patients with high-risk myocardial infarction: the Air Primary Angioplasty in Myocardial Infarction study. J Am Coll Cardiol 2002; 39 : 1713–1719.
43. Widimsky P, Groch L, Zelizko M et al. Multicentre randomized trial comparing transport to primary angioplasty vs immediate thrombolysis vs combined strategy for patients with acute myocardial infarction presenting to a community hospital without a catheterization laboratory. The PRAGUE study. Eur Heart J 2000; 21 : 823–831.
44. Widimsky P, Budesinsky T, Vorac D et al. ‚PRAGUE‘ Study Group Investigators. Long distance transport for primary angioplasty vs immediate thrombolysis in acute myocardial infarction. Final results of the randomized national multicentre trial – PRAGUE-2. Eur Heart J 2003; 24 : 94–104.
45. Andersen HR, Nielsen TT, Rasmussen K et al. DANAMI-2 Investigators. A comparison of coronary angioplasty with fibrinolytic therapy in acute myocardial infarction. N Engl J Med 2003; 349 : 733–742.
46. Zijlstra F, Patel A, Jones M et al. PCAT collaboration. Clinical characteristics and outcome of patients with early (≤ 2 h), intermediate (2–4 h) and late (> 4 h) presentation treated by primary coronary angioplasty or thrombolytic therapy for acute myocardial infarction. Eur Heart J 2002; 23 : 550–557.
47. Bonnefoy E, Lapostolle F, Leizorovicz A et al. Comparison of Angioplasty and Prehospital Thrombolysis in Acute Myocardial Infarction (CAPTIM) study group. Primary angioplasty versus prehospital fibrinolysis in acute myocardial infarction: a randomised study. Lancet 2002; 360 : 825–829.
48. Kastrati A, Mehilli J, Schlotterbeck K et al. Bavarian Reperfusion Alternatives Evaluation (BRAVE) Study Investigators. Early administration of reteplase plus abciximab vs abciximab alone in patients with acute myocardial infarction referred for percutaneous coronary intervention: a randomized controlled trial. JAMA 2004; 291 : 947–954.
49. Assessment of the Safety and Efficacy of a New Treatment Strategy with Percutaneous Coronary Intervention (ASSENT-4 PCI) investigators. Primary versus tenecteplase-facilitated percutaneous coronary intervention in patients with ST-segment elevation acute myocardial infarction (ASSENT-4 PCI): randomised trial. Lancet 2006; 367 : 569–578.
50. Ellis SG, Tendera M, de Belder MA et al. FINESSE Investigators. Facilitated PCI in patients with ST-elevation myocardial infarction. N Engl J Med 2008; 358 : 2205–2217.
51. Lee DP, Herity NA, Hiatt BL et al. TIrofiban Given in the Emergency Room before Primary Angioplasty. Adjunctive platelet glycoprotein IIb/IIIa receptor inhibition with tirofiban before primary angioplasty improves angiographic outcomes: results of theTIrofiban Given in the Emergency Room before Primary Angioplasty (TIGER-PA) pilot trial. Circulation 2003; 107 : 1497–1501.
52. Van’t Hof AW, Ernst N, De Boer MJ et al. On-TIME study group. Facilitation of primary coronary angioplasty by early start of a glycoprotein 2b/3a inhibitor: results of the ongoing tirofiban in myocardial infarction evaluation (On-TIME) trial. Eur Heart J 2004; 25 : 837–846.
53. Keeley EC, Boura JA, Grines CL. Comparison of primary and facilitated percutaneous coronary interventions for ST-elevation myocardial infarction: quantitative review of randomised trials. Lancet 2006; 367 : 579–588.
54. Ellis SG, da Silva ER, Heyndrickx G et al. Randomized comparison of rescue angioplasty with conservative management of patients with early failure of thrombolysis for acute anterior myocardial infarction. Circulation 1994; 90 : 2280–2284.
55. Ellis SG, Da Silva ER, Spaulding CM et al. Review of immediate angioplasty after fibrinolytic therapy for acute myocardial infarction: insights from the RESCUE I, RESCUE II, and other contemporary clinical experiences. Am Heart J 2000; 139 : 1046–1053.
56. Gershlick AH, Stephens-Lloyd A, Hughes S et al. REACT Trial Investigators. Rescue Angioplasty after Failed Thrombolytic Therapy for Acute Myocardial Infarction. N Engl J Med 2005; 353 : 2758–2768.
57. Fernández-Avilés F, Alonso JJ, Castro-Beiras A et al. GRACIA (Grupo de Análisis de la Cardiopatía Isquémica Aguda) Group. Routine invasive strategy within 24 hours of thrombolysis versus ischaemia-guided conservative approach for acute myocardial infarction with ST-segment elevation (GRACIA-1): a randomised controlled trial. Lancet 2004; 364 : 1045–1053.
58. Le May MR, Wells GA, Labinaz M et al. Combined angioplasty and pharmacological intervention versus thrombolysis alone in acute myocardial infarction (CAPITAL AMI study). J Am Coll Cardiol 2005; 46 : 417–424.
59. Fernández-Avilés F, Alonso JJ, Pena G et al. GRACIA-2 (Groupo de Análisis de Cardiopatía Isquémica Aguda) Investigators. Primary angioplasty vs early routine post-fibrinolysis angioplasty for acute myocardial infarction with ST-segment elevation: the GRACIA-2 non-inferiority, randomized, controlled trial. Eur Heart J 2007; 28 : 949–960.
60. Di Mario C, Dudek D, Piscione F et al. CARESS-in-AMI (Combined Abciximab RE-teplase Stent Study in Acute Myocardial Infarction) Investigators. Immediate angioplasty versus standard therapy with rescue angioplasty after thrombolysis in the Combined Abciximab Reteplase Stent Study in Acute Myocardial Infarction (CARESS-in-AMI): an open, prospective, randomised, multicentre trial. Lancet 2008; 371 : 559–568.
61. Cantor WJ, Fitchett D, Borgundvaag B et al. TRANSFER-AMI Trial Investigators. Routine Early Angioplasty after Fibrinolysis for Acute Myocardial Infarction. N Engl J Med 2009; 360 : 2705–2718.
62. Yousef ZR, Redwood SR, Bucknall CA et al. Late intervention after anterior myocardial infarction: effects on left ventricular size, function, quality of life, and exercise tolerance: results of the Open Artery Trial (TOAT Study). J Am Coll Cardiol 2002; 40 : 869–876.
63. Steg PG, Thuaire C, Himbert D et al. DECOPI Investigators. DECOPI (DEsobstruction COronaire en Post-Infarctus): a randomized multicentre trial of occluded artery angioplasty after acute myocardial infarction. Eur Heart J 2004; 25 : 2187–2194.
64. Hochman JS, Lamas GA, Buller CE et al. Occluded Artery Trial Investigators. Coronary intervention for persistent occlusion after myocardial infarction. N Engl J Med 2006; 355 : 2395–2407.
65. Weiss ES, Chang DD, Joyce DL et al. Optimal timing of coronary artery bypass after acute myocardial infarction: a review of California discharge data. J Thorac Cardiovasc Surg 2008; 135 : 503–511.
66. Lee DC, Oz MC, Weinberg AD et al. Appropriate timing of surgical intervention after transmural acute myocardial infarction. J Thorac Cardiovasc Surg 2003; 125 : 115–119.
67. Hochman JS, Sleeper LA, Webb JG et al. Early revascularization in acute myocardial infarction complicated by cardiogenic shock. SHOCK Investigators. Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock. N Engl J Med 1999; 341 : 625–634.
68. Hochman JS, Sleeper LA, White HD et al. SHOCK Investigators. Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock. One-year survival following early revascularization for cardiogenic shock. JAMA 2001; 285 : 190–192.
69. Urban P, Stauffer JC, Bleed D et al. A randomized evaluation of early revascularization to treat shock complicating acute myocardial infarction. The (Swiss) Multicentre Trial of Angioplasty for Shock-(S)MASH. Eur Heart J 1999; 20 : 1030–1038.
70. Smith PK, Califf RM, Tuttle RH et al. Selection of surgical or percutaneous coronary intervention provides differential longevity benefit. Ann Thorac Surg 2006; 82 : 1420–1428.
71. Allman KC, Shaw LJ, Hachamovitch R et al. Myocardial viability testing and impact of revascularization on prognosis in patients with coronary artery disease and left ventricular dysfunction: a meta-analysis. J Am Coll Cardiol 2002; 39 : 1151–1158.
72. Bourque JM, Hasselblad V, Velazquez EJ et al. Revascularization in patients with coronary artery disease, left ventricular dysfunction, and viability: a meta-analysis. Am Heart J 2003; 146 : 621–627.
73. O’Connor CM, Velazquez EJ, Gardner LH et al. Comparison of coronary artery bypass rafting versus medical therapy on long-term outcome in patients with ischemic cardiomyopathy (a 25-year experience from the Duke Cardiovascular Disease Databank). Am J Cardiol 2002; 90 : 101–107.
74. Tarakji KG, Brunken R, McCarthy PM et al. Myocardial viability testing and the effect of early intervention in patients with advanced left ventricular systolic dysfunction. Circulation 2006; 113 : 230–237.
75. Tsuyuki RT, Shrive FM, Galbraith PD et al. APPROACH Investigators. Revascularization in patients with heart failure. CMAJ 2006; 175 : 361–365.
76. Buszman P, Szkróbka I, Gruszka A et al. Comparison of effectiveness of coronary artery bypass grafting versus percutaneous coronary intervention in patients with ischemic cardiomyopathy. Am J Cardiol 2007; 99 : 36–41.
77. Cannon CP, Weintraub WS, Demopoulos LA et al. TACTICS (Treat Angina with Aggrastat and Determine Cost of Therapy with an Invasive or Conservative Strategy) – Thrombolysis in Myocardial Infarction 18 Investigators. Comparison of early invasive and conservative strategies in patients with unstable coronary syndromes treated with the glycoprotein IIb/IIIa inhibitor tirofiban. N Engl J Med 2001; 344 : 1879–1887.
78. BARI 2D Study Group. Frye RL, August P, Brooks MM et al. A randomized trial of therapies for type 2 diabetes and coronary artery disease. N Engl J Med 2009; 360 : 2503–2515.
79. Levey AS, Coresh J, Greene T et al. Chronic Kidney Disease Epidemiology Collaboration. Using standardized serum creatinine values in the modification of diet in renal disease study equation for estimating glomerular filtration rate. Ann Intern Med 2006; 145 : 247–254.
80. Astor BC, Coresh J, Heiss G et al. Kidney function and anemia as risk factors for coronary heart disease and mortality: The Atherosclerosis Risk in Communities (ARIC) Study. Am Heart J 2006; 151 : 492–500.
81. Jones DA, Rathod K, Guttmann O et al. Anaemia On Admission Is A Powerful Predictor For Worse Outcome In Patients Undergoing Primary Pci. J Am Coll Cardiol 2010; 56: B101.
82. Mehran R, Pocock SJ, Nikolsky E et al. A Risk Score to Predict Bleeding in Patients With Acute Coronary Syndromes. J Am Coll Cardiol 2010; 55 : 2556–2566.
83. Poldermans D, Bax JJ, Boersma E et al. Guidelines for preoperative cardiac risk assessment and perioperative cardiac management in noncardiac surgery: the Task Force for Preoperative Cardiac Risk Assessment and Perioperative Cardiac Management in Non-cardiac Surgery of the European Society of Cardiology (ESC) and endorsed by the European Society of Anaesthesiology (ESA). Eur Heart J 2009; 30 : 2769–2812.
84. Benedetto U, Meliga G, Roscitato A et al. Does combined mitral valve surgery improve survival when compared to revascularization alone in patients with ischemic mitral regurgitation? A meta-analysis on 2 479 patients. J Cardiovasc Med 2009; 10 : 109–114.
85. Stamou SC, Hill PC, Dangas G et al. Stroke After Coronary Artery Bypass: Incidence, Predictors, and Clinical Outcome Stroke 2001; 32 : 1508–1513.
86. Trehan N, Mishra M, Sharma OP et al. Further reduction in stroke after off-pump coronary artery bypass grafting: a 10-year experience. Ann Thorac Surg 2001; 72: S1026–S1032.
87. Morice MC, Serruys PW, Barragan P et al. Long-term clinical outcomes with sirolimus-eluting coronary stents: five-year results of the RAVEL trial. J Am Coll Cardiol 2007; 50 : 1299–1304.
88. Holmes DR Jr, Leon MB, Moses JW et al. Analysis of 1-year clinical outcomes in the SIRIUS trial: a randomized trial of a sirolimus-eluting stent versus a standard stent in patients at high risk for coronary restenosis. Circulation 2004; 109 : 634–640.
89. Schampaert E, Cohen EA, Schlüter M et al. C-SIRIUS Investigators. The Canadian study of the sirolimus-eluting stent in the treatment of patients with long de novo lesions in small native coronary arteries (C-SIRIUS). J Am Coll Cardiol 2004; 43 : 1110–1115.
90. Schofer J, Schlüter M, Gershlick AH et al. E-SIRIUS Investigators. Sirolimus-eluting stents for treatment of patients with long atherosclerotic lesions in small coronary arteries: double-blind, randomised controlled trial (E-SIRIUS) Lancet 2003; 362 : 1093–1099.
91. Grube E, Silber S, Hauptmann KE et al. TAXUS I: six - and twelve-month results from a randomized, double-blind trial on a slow-release paclitaxel-eluting stent for de novo coronary lesions. Circulation 2003; 107 : 38–42.
92. Stone GW, Ellis SG, Cox DA et al. TAXUS-IV Investigators. One-year clinical results with the slow-release, polymer-based, paclitaxel-eluting TAXUS stent: the TAXUS-IV trial. Circulation 2004; 109 : 1942–1947.
93. Stone GW, Ellis SG, O’Shaughnessy CD et al. TAXUS V ISR Investigators. Paclitaxel-eluting stents vs vascular brachytherapy for in-stent restenosis within bare-metal stents: the TAXUS V ISR randomized trial. JAMA 2006; 295 : 1253–1263.
94. Grube E, Dawkins KD, Guagliumi G et al. TAXUS VI 2-year follow-up: randomized comparison of polymer-based paclitaxel-eluting with bare metal stents for treatment of long, complex lesions. Eur Heart J 2007; 28 : 2578–2582.
95. Pfisterer M, Brunner-La Rocca HP, Buser PT et al. BASKET-LATE Investigators. Late clinical events after clopidogrel discontinuation may limit the benefit of drug-eluting stents: an observational study of drug-eluting versus bare-metal stents. J Am Coll Cardiol 2006; 48 : 2584–2591.
96. Lagerqvist B, James SK, Stenestrand U et al. Long-Term Outcomes with Drug-Eluting Stents Versus Bare-Metal Stents in Sweden. N Engl J Med 2007; 356 : 1009–1019.
97. Spaulding C, Henry P, Teiger E et al. TYPHOON Investigators. Sirolimus-eluting versus uncoated stents in acute myocardial infarction. N Engl J Med 2006; 355 : 1093–1104.
98. Laarman GJ, Suttorp MJ, Dirksen MT et al. Paclitaxel-eluting versus uncoated stents in primary percutaneous coronary intervention. N Engl J Med 2006; 355 : 1105–1113.
99. Svilaas T, Vlaar PJ, van der Horst IC et al. Thrombus Aspiration during Primary Percutaneous Coronary Intervention. N Engl J Med 2008; 358 : 557–567.
100. Møller CH, Penninga L, Wetterslev J et al. Clinical outcomes in randomized trials of off - vs on-pump coronary artery bypass surgery: systematic review with meta-analyses and trial sequential analyses. Eur Heart J 2008; 29 : 2601–2616.
101. Guru V, Omura J, Alghamdi AA et al. Is blood superior to crystalloid cardioplegia? A meta-analysis of randomized clinical trials. Circulation 2006; 114: I331–I338.
102. Widimsky P, Motovská Z, Simek S et al. PRAGUE-8 Trial Investigators. Clopidogrel pre-treatment in stable angina: for all patients > 6 h before elective coronary angiography or only for angiographically selected patients a few minutes before PCI? A randomized multicentre trial PRAGUE-8. Eur Heart J 2008; 29 : 1495–1503.
103. Montalescot G, White HD, Gallo R et al. STEEPLE Investigators. Enoxaparin versus unfractionated heparin in elective percutaneous coronary intervention. N Engl J Med 2006; 355 : 1006–1017.
104. Mehta SR, Granger CB, Eikelboom JW et al. Efficacy and safety of fondaparinux versus enoxaparin in patients with acute coronary syndromes undergoing percutaneous coronary intervention: results from the OASIS-5 trial. J Am Coll Cardiol 2007; 50 : 1742–1751.
105. Stone GW, Witzenbichler B, Guagliumi G et al. HORIZONS-AMI Trial Investigators. Bivalirudin during Primary PCI in Acute Myocardial Infarction. N Engl J Med 2008; 358 : 2218–2230.
106. Wiviott SD, Braunwald E, McCabe CH et al. TRITON-TIMI 38 Investigators. Prasugrel versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2007; 357 : 2001–2015.
107. Wallentin L, Becker RC, Budaj A et al. PLATO Investigators. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2009; 361 : 1045–1057.
108. Mehta SR, Tanguay JF, Eikelboom JW et al. CURRENT-OASIS 7 trial investigators. Double-dose versus standard-dose clopidogrel and high-dose versus low-dose aspirin in individuals undergoing percutaneous coronary intervention for acute coronary syndromes (CURRENT-OASIS 7): a randomised factorial trial. Lancet 2010; 376 : 1233–1243.
109. Kastrati A, Mehilli J, Neumann FJ et al. Intracoronary Stenting and Antithrombotic: Regimen Rapid Early Action for Coronary Treatment 2 (ISAR-REACT 2) Trial Investigators. Abciximab in patients with acute coronary syndromes undergoing percutaneous coronary intervention after clopidogrel pretreatment: the ISAR-REACT 2 randomized trial. JAMA 2006; 295 : 1531–1538.
110. Boudoulas H, Snyder GL, Lewis RP et al. Safety and rationale for continuation of propranolol therapy during coronary bypass operation. Ann Thorac Surg 1978; 26 : 222–227.
111. Reduto LA, Berger HJ, Geha A et al. Radionuclide assessment of ventricular performance during propranolol withdrawal prior to aortocoronary bypass surgery. Am Heart J 1978; 96 : 714–722.
112. Gomes JA, Ip J, Santoni-Rugiu F et al. Oral d, I sotalol reduces the incidence of postoperative atrial fibrilation in coronary artery bypass surgery patients: a randomized, double-blind, placebo-controlled study. J Am Coll Cardiol 1999; 34 : 334–339.
113. Davis EM, Packard KA, Hilleman DE. Pharmacologic prophylaxis of postoperative atrial fibrillation in patients undergoing cardiac surgery: beyond beta-blockers. Pharmacotherapy 2010; 30 : 749, 274e–318e.
114. Kim DH, Daskalakis C, Silvestry SC et al. Aspirin and clopidogrel use in the early postoperative period following on-pump and off-pump coronary artery bypass grafting. J Thorac Cardiovasc Surg 2009; 138 : 1377–1384.
115. Pirk J, Vojáček J, Kováč J et al. Improved patency of the aortocoronary bypass by antithrombotic drugs. Ann Thorac Surg 1986; 42 : 378–381.
116. Dunning J, Versteegh M, Fabbri A et al. EACTS Audit and Guidelines Committee. Guideline on antiplatelet and anticoagulation management in cardiac surgery. Eur J Cardiothorac Surg 2008; 34 : 73–92.
117. Chassot PG, Delabays A, Spahn DR. Perioperative antiplatelet therapy: the case for continuing therapy in patients at risk of myocardial infarction. Br J Anaesth 2007; 99 : 316–328.
118. Weinmann EE, Chayen D, Kobzantzev ZV et al. Treatment of postcatheterisation false aneurysms: ultrasound-guided compression vs ultrasound-guided thrombin injection. Eur J Vasc Endovasc Surg 2002; 23 : 68–72.
119. Asif A, Epstein M. Prevention of radiocontrast-induced nephropathy. Am J Kidney Dis 2004; 44 : 12.
120. McCullough PA. Contrast-Induced Acute Kidney Injury. J Am Coll Cardiol 2008; 51 : 1419–1428.
121. Weisbord SD, Hartwig KC, Sonel AF et al. The incidence of clinically significant contrast-induced nephropathy following non-emergent coronary angiography. Catheter Cardiovasc Interv 2008; 71 : 879–885.
122. Recio-Mayoral A, Chaparro M, Prado B et al. The reno-protective effect of hydration with sodium bicarbonate plus N-acetylcysteine in patients undergoing emergency percutaneous coronary intervention – the RENO study. J Am Coll Cardiol 2007; 49 : 1283–1288.
123. Rudnick MR, Tumlin JA. Prevention of radiocontrast media-induced acute kidney injury. UpToDate in Nephrology and Hypertension. www.uptodate.com (last update Oct 16, 2008).
124. Mueller C, Buerkle G, Buettner HJ et al. Prevention of contrast media-associated nephropathy: randomized comparison of 2 hydration regiments in 1620 patients undergoing coronary angioplasty. Arch Intern Med 2002; 162 : 329.
125. Kačer P, Smetana M, Pirk J et al. 64multislice CT – roční zkušenost v detekci časného uzávěru štěpů po aortokoronární rekonstrukci. Cor et Vasa v tisku.
126. Hejjel L, Szluka G, Göbölös L et al. Pharmacotechnological pitfalls of primic – possible source of microembolization during open heart Sumery. Perfusion 2010; 25 : 2067–2651.
127. Dominik J. Kardiochirurgie. 1. vyd. Praha: Grada Publishing 1998.
128. Kurusz M, Conti VR, Arens JF et al. Perfusion accident surfy. Proc Am Acad Cardiovasc Perfusion 1986; 7 : 57–64.
129. Kaplan JA. Management of coagulation and bleeding disorders. In: Kaplan JA (ed.). Cardiac anesthesia. 3rd ed. Philadelphia, PA: W. B. Saunders Company 1997 : 951.
130. Čoček D, Pirk J. Méně invazivní odběr žilního štěpu ke koronárnímu bypassu. Cor et Vasa 2000; 42 : 397–400.
131. Varga M, Matia I, Kučera M et al. Akutní uzávěr splanchnického řečiště po kardiochirurgických výkonech. Cor et Vasa 2010; 52 : 252–256.
132. Hradec J, Bultas J, Želízko M. Stabilní angina pectoris – Doporučený diagnostický a lečebný postup Česke kardiologicke společnosti. Cor Vasa 2010; 52 : 543–561.
133. Widimský P, Hlinomaz O, Kala P et al. Diagnostika a léčba akutního infarktu myokardu s elevacemi ST. Cor Vasa 2009; 51 : 724–740.
134. Bělohlávek J, Aschermann M. Doporučený postup pro diagnostiku a léčbu akutních koronárních syndromů bez elevací ST úseků na EKG. Cor Vasa 2008; 50 (Suppl): 1S7–1S23.
135. De Werf FV, Bax J, Betriu A et al. ESC Committee for Practice Guidelines (CPG). Management of acute myocardial infarction in patients presenting with persistent ST-segment elevation: the Task Force on the Management of ST-Segment Elevation Acute Myocardial Infarction of the European Society of Cardiology. Eur Heart J 2008; 29 : 2909–2945.
136. Bassand JP, Hamm CW, Ardissino D et al. The Task Force for the Diagnosis and Treatment of Non-ST-Segment Elevation Acute Coronary Syndromes of the European Society of Cardiology. Guidelines for the diagnosis and treatment of non-ST-segment elevation acute coronary syndromes. Eur Heart J 2007; 28 : 1598–1660.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2012 Číslo Suppl 1- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Co dělat při intoleranci statinů?
-
Všetky články tohto čísla
- Doporučení pro diagnostiku a léčbu chronického srdečního selhání – ČKS 2011
-
Fibrilace síní
Doporučený diagnostický a léčebný postup České kardiologické společnosti vypracovaný Pracovní skupinou arytmie a trvalé kardiostimulace - Příprava kardiaka k nekardiální operaci
- Revaskularizace myokardu. Perkutánní koronární intervence a aortokoronární bypass
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Doporučení pro diagnostiku a léčbu chronického srdečního selhání – ČKS 2011
-
Fibrilace síní
Doporučený diagnostický a léčebný postup České kardiologické společnosti vypracovaný Pracovní skupinou arytmie a trvalé kardiostimulace - Příprava kardiaka k nekardiální operaci
- Revaskularizace myokardu. Perkutánní koronární intervence a aortokoronární bypass
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



