-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Současné trendy v léčbě a dispenzarizaci pacientů s diferencovaným karcinomem štítné žlázy – zkušenosti s využitím rekombinantního humánního tyreotropinu
Current trends in treatment and follow-up of patients with differentiated thyroid carcinoma – experience with the use of recombinant human thyrotropin
Differentiated thyroid carcinoma is the most common endocrine malignancy with an excellent prognosis in the case of its early detection. Radioiodine 131I and thyroid hormones continue to be the pivotal drugs in treatment and follow-up for more than 50 years. The therapeutical and diagnostic options were recently expanded by the use of recombinant human thyrotropin (rhTSH). Our experience with the diagnostic administration of rhTSH confirms the outcomes of official trials and also indicates that the effect of rational therapy with 131I after rhTSH is similar to the outcome after standard regime using long-term thyroid hormone withdrawal.
Key words:
differentiated thyroid carcinoma – radioiodine 131I – thyrotropin (TSH) – TSH stimulation – rhTSH – thyroid hormone withdrawal – hypothyroidism – thyroxine (T4) – TSH suppression
Autoři: M. Macková; P. Vlček
Působiště autorů: Klinika nukleární medicíny a endokrinologie 2. lékařské fakulty UK a FN Motol Praha, přednosta prof. MUDr. Petr Vlček, CSc.
Vyšlo v časopise: Vnitř Lék 2013; 59(2): 106-112
Kategorie: Přehledný referát
Souhrn
Diferencovaný karcinom štítné žlázy představuje nejčastější malignitu v endokrinologii, při časném odhalení je prognóza velmi příznivá. V jeho léčbě a následné dispenzarizaci zůstávají již více než 50 let klíčovými farmaky radiojód 131I a tyreoidální hormony. V posledních letech jsou terapeutické i diagnostické možnosti rozšířeny o rekombinantní humánní TSH (rhTSH). Zkušenosti z našeho pracoviště s diagnostickou aplikací rhTSH u odléčených pacientů potvrzují závěry klinických studií. Současně ukazují, že efekt terapie 131I při racionálním využití rhTSH se významně neliší od klasického postupu s dlouhodobým vysazením tyreoidálních hormonů.
Klíčová slova:
diferencovaný karcinom štítné žlázy – radiojód 131I – rekombinantní humánní TSH (rhTSH) – hypotyreóza – tyroxin (T4) – substituce – suprese TSHIncidence, prognóza
Diferencovaný karcinom štítné žlázy – karcinom z tyreocytů (differentiated thyroid cancer – DTC) tvoří 1–2 % všech maligních onemocnění, v endokrinologii je však nejčastějším zhoubným nádorem. Jedná se o heterogenní skupinu tumorů, hlavní podskupiny tvoří papilární a folikulární karcinom s vlastními subtypy. Přes svou relativní vzácnost patří ve věku 15–45 let mezi 5 nejběžnějších karcinomů. Vyskytuje se ve všech věkových kategoriích, u žen 4krát častěji než u mužů. Incidence DTC stále stoupá, Česká republika se výskytem tyreoidálních karcinomů řadí celosvětově na 14. místo ze 184 sledovaných. Zvyšující se incidenci lze částečně vysvětlit dokonalejšími diagnostickými metodami, které umožňují časný záchyt ještě asymptomatického onemocnění.
Prognóza DTC je ve většině případů velmi příznivá, zejména při včasném záchytu onemocnění ohraničeného na štítnou žlázu. Deset let od diagnózy u nás přežívá 92 % pacientů díky obvykle příznivé biologické povaze tumoru, možnosti cílené terapie radiojodem 131I a propracovanému systému následné celoživotní dispenzarizace. I v případě výskytu vzdálených metastáz (nejčastěji plicních a kostních) je několikaleté přežití běžné, DTC patří obvykle mezi relativně málo agresivní malignity. Vzhledem k možnosti pozdního relapsu choroby v odstupu několika let i desetiletí od diagnózy je však nutné celoživotní sledování i odléčených nemocných, kteří jsou dlouhodobě v remisi [1].
Iniciální chirurgická léčba DTC
Prvním a zásadním krokem v léčbě tyreoidálního karcinomu je úplné chirurgické odstranění tyreoidální tkáně – totální tyreoidektomie (TTE), podle doporučení některých autorů postačí unilaterální lobektomie, je-li primární tumor unifokální, menší než 1 cm a nejsou-li přítomny sonograficky patrné ložiskové změny v ponechaném laloku. U málo pokročilých tumorů má totální tyreoidektomie nezřídka plný kurativní efekt. V závislosti na histologii (zejména kódu TNM, ale i typu a subtypu karcinomu, rizikových morfologických znacích apod.) a vždy při podezření na perzistenci či relaps onemocnění je buď indikováno doléčení radiojodem 131I, nebo zaveden jen dispenzární režim.
K léčbě 131I za účelem dokončení eliminace zbytků tyreoidální tkáně (tyreoeliminace) po TTE je podle recentních evropských doporučení vhodné přistoupit při kterékoliv z těchto vlastností: velikost tumoru nad 1 cm, nádorový proces invadující pouzdro štítné žlázy nebo šířící se do extratyreoidálních tkání, multifokalita primárního tumoru, expozice zevnímu ozáření v anamnéze, nepříznivé histologické známky (varianta „tall-cell“, „columnar-cell“, difuzně sklerotizující subtyp) či přítomnost jakékoliv metastázy [2]. Základní výhodou tyreoeliminace je úplné odstranění fyziologického zdroje tyreoglobulinu (TGL), který poté lze s vysokou senzitivitou hodnotit jako tumorový marker.
Pacienty s unifokálním karcinomem velikosti do 1 cm zpravidla postačí dispenzarizovat, tito pacienti z paušálně aplikované léčby 131I neprofitují. K doléčení pomocí 131I lze přistoupit kdykoli v případě suspekce na perzistenci či recidivu onemocnění. Dokončení unilaterální lobektomie do TTE s sebou přináší jisté riziko trvalých komplikací (asi u 1 % výkonů v závislosti na zkušenostech pracoviště – typicky paréza n. laryngeus recurrens, trvalá hypoparatyreóza), ale z hlediska onkologické radikality je totalizace výkonu významnou výhodou. Bez histologického vyšetření nelze zcela vyloučit multifokalitu v kontralaterálním laloku štítné žlázy, která dlouho nemusí být při malé velikosti tumorózního ložiska sonograficky detekovatelná, může však založit metastázy. Výskyt metastatického postižení spádových lymfatických uzlin jsme na našem pracovišti pozorovali až u 7 % primárních karcinomů do velikosti 1 cm. Pokud je ponechán celý tyreoidální lalok in situ, nelze rovněž hodnotit tyreoglobulin jako nádorový marker, což ztěžuje včasnou detekci případného relapsu. I v případě přítomnosti celého intaktního laloku štítné žlázy po chirurgickém odstranění laloku s karcinomem je nutné udržovat sérovou hladinu TSH na dolní hranici normálních hodnot, což pro pacienta znamená nutnost celoživotního užívání substituce tyreoidálních hormonů.
Jednotného globálního konsenzu problematiky totalizace tyreoidektomie u nízce rizikových unifokálních mikrokarcinomů do velikosti 1 cm dosud není dosaženo, pacient by měl být objektivně seznámen se všemi výhodami i riziky další operace a další postup v těchto případech je možné přizpůsobit individuálním preferencím nemocného.
Hormonální léčba DTC
Dlouhodobá až celoživotní suprese TSH pod 0,1 mIU/l pomocí hraničně vyšší substituce tyroxinem (T4), event. doplněné o trijodtyronin (T3), je významným doplňkovým preventivním i terapeutickým prvkem. Pro prevenci možných komplikací arteficiální subklinické hypertyreózy sérová hladina volného tyroxinu nesmí překročit rozmezí normálních hodnot. DTC jakožto tumor z endokrinní tkáně si většinou alespoň zčásti zachovává zpětnovazebnou dependenci na TSH, tedy v případě udržování nízkých hladin TSH je nižší i růstový potenciál benigních i maligně transformovaných tyreocytů. Naopak dlouhodobě zvýšené hladiny TSH stimulují růst a zvyšují tak riziko maligního zvratu buněk štítné žlázy, po jejím chirurgickém odstranění při nedostatečné substituci hrozí nadměrná regenerace benigních tyreoidálních reziduí a růst perzistujícího tumoru či metastatických ložisek.
Současné trendy omezují plošnou celoživotní supresi TSH, je třeba pečlivě a individuálně vyvažovat rizika pramenící z možné recidivy tyreoidálního karcinomu a metabolických následků mnohaleté subklinické hypertyreózy. Poslední doporučení European Thyroid Association racionálně omezují intenzitu a dobu trvání suprese TSH – u pacientů s nízkým rizikem recidivy a nemocných, kteří jsou dlouhodobě v remisi onemocnění, je cílová hladina TSH od 0,1 do 1,0 mIU/l.
Terapie radiojódem 131I
Radiojód 131I je smíšený β - a γ-zářič s poločasem rozpadu 8 dní. Je podáván ve formě roztoku soli (kalium iodatum), roztok je možné podat perorálně či formou infuze (na našem pracovišti k léčbě DTC využíváme výhradně perorální aplikaci). Terapie či scintigrafické vyšetření pomocí 131I využívá schopnosti tyreocytů vychytávat jodid. Aktivní transport jodidu dovnitř tyreocytu je stimulován TSH. Maligně transformované tyreocyty si určitý stupeň této schopnosti a dependence na TSH většinou zachovávají, což umožňuje relativně selektivní ozáření tyreocytů hlavně zářením β. Záření γ je pak výhodné pro možnost scintigrafického zobrazení. Pro diagnostickou scintigrafii se používá nezatěžující nízká aktivita 131I (na našem pracovišti 70–180 MBq). Význam podání terapeutické aktivity radiojódu 131I (2 900–7 400 MBq) spočívá v destrukci téměř vždy přítomné zbytkové benigní tkáně štítné žlázy po chirurgickém výkonu (pro zvýšení senzitivity tyreoglobulinu jako tumorového markeru), v poškození potenciálně přítomné nebo již známé maligní tyreoidální tkáně (přímý kurativní efekt) a v možnosti provedení celotělového scintigrafického vyšetření k určení rozsahu onemocnění (detekce/vyloučení vzdálených metastáz a nastavení individuálního terapeutického/dispenzárního plánu za současného zhodnocení rizikových faktorů, kódu TNM klasifikace a hladiny TGL).
Příprava k podání terapeutické nebo diagnostické aktivity 131I
K dosažení dostatečné akumulace 131I v tyreocytech nezbytné pro účinnou terapii a vysokou citlivost diagnostické scintigrafie je potřeba zvýšit sérový TSH na empirickou hladinu nejméně 30 mIU/l. „Klasické“ endogenní elevace TSH lze dosáhnout standardně 4 týdny trvajícím vysazením substituce T4 (event. 2 týdny trvajícím vysazením T3), tedy rozvojem metabolické hluboké hypotyreózy se všemi typickými nežádoucími průvodními symptomy. K exogenní elevaci TSH lze využít intramuskulární aplikaci rekombinantního humánního TSH (rhTSH, preparát Thyrogen), který zvýší sérovou hladinu rychle na několik dní při zachování plné eutyreózy.
Rekombinantní humánní TSH (rhTSH, thyrotropin alfa, preparát Thyrogen®) je na trhu od roku 1997, v České republice jej využíváme od roku 2005.
Původně byla indikace jeho použití omezena na dispenzární kontroly pacientů po léčbě 131I v remisi DTC. Posléze došlo k ověření jeho dostatečné účinnosti v přípravě před podáním tyreoeliminační terapeutické aktivity u nízkorizikových pacientů [2–5]. V současnosti se stále častěji na různých pracovištích s úspěchem využívá jeho „off-label“ aplikace také jako příprava před tyreoeliminací u vysoce rizikových pacientů [6] nebo před léčbou metastatického DTC. Dosavadní práce poukazují na srovnatelný efekt léčby a shodné 5leté přežití u pacientů s metastázami DTC opakovaně léčených 131I po 4týdenním vysazení tyreoidální substituce, po přípravě rhTSH i při kombinaci obou postupů, žádná rozsáhlá srovnávací studie však publikována nebyla [7–10].
V České republice bylo nejdříve schváleno využití Thyrogenu® před terapií pokročilých metastatických DTC (rok 2005), posléze k provádění dispenzárních vyšetření u odléčených pacientů (rok 2007).
Schéma podání rhTSH představuje intramuskulární aplikaci 2 ampulí po 0,9 mg thyrotropinu alfa v odstupu 24 hod, radiojod je podán v odstupu 24 hod po 2. injekci, kdy dochází k maximální elevaci sérové hladiny TSH. Elevace TSH poté přetrvává po několik dní (běžně 3–5 dní po podání 131I).
Nežádoucí účinky rhTSH jsou vzácné a zpravidla nezávažné. Nespecifické příznaky, jako bolesti hlavy, nauzea, zvracení, bývají popisovány až v 5 % případů, vyšší výskyt nežádoucích účinků ve srovnání s placebem však dosud není přesvědčivě zdokumentován. Na našem pracovišti je výskyt nežádoucích účinků zcela ojedinělý. V několika případech jsme zaznamenali komplikace vyplývající z hlavního účinku preparátu – edém metastatického ložiska ještě před terapií 131I (respirační insuficience u mnohačetných plicních metastáz, silné bolesti v místě kostního ložiska).
Výhody a nevýhody „klasické“ přípravy před terapií 131I
Výhody „klasického jodového programu“ spočívají kromě nižších finančních nákladů oproti aplikaci rhTSH hlavně v možnosti provést v průběhu jediné hospitalizace nejdříve diagnostickou scintigrafii a na jejím základě pak teprve rozhodnout o případném podání terapie 131I s možností individualizace potřebné aktivity 131I.
Pacientům je s předstihem odeslán informativní dopis s pokynem, aby neužívali jod v jakékoli formě (ideálně 3 měsíce před aplikací radiojodu) a vysadili substituci tyreoidálními hormony 4 týdny před přijetím na naše pracoviště. Déletrvající vysazení je kontraproduktivní, neboť zvyšuje riziko nadměrného růstu zbytků tkáně štítné žlázy po operaci. Terapeutickou aktivitu radiojodu je možné z důvodu prevence nadměrné radio-toxicity podat na tyreoidální rezidua se 24hodinovou akumulací max. 7–10 % z podané diagnostické aktivity 131I, jen ve výjimečných případech (inoperabilní nález) při akumulaci vyšší. Pokud je před terapií díky diagnostickému skenu známa nadměrná akumulace 131I či riziková lokalizace metastázy (mozek, kalva, orbita), je výhodou možnost včasného preventivního zajištění pacienta antiedematózní terapií kortikosteroidy.
Nevýhodou „klasického“ programu je vystavení pacienta hluboké hypotyreóze, v průběhu života často opakovaně. Hypotyreóza se rozvíjí od začátku 3. týdne vysazení hormonální substituce a ustupuje asi 2 týdny po jejím opětovném nasazení, trvá tedy obvykle 4 týdny. U ekonomicky aktivních pacientů je nutná déletrvající pracovní neschopnost, u chronicky nemocných je běžná (přechodná) dekompenzace základního onemocnění. Pro pacienty s vysokým rizikem ireverzibilního poškození v průběhu hypotyreózy (např. pacienti se systémovou autoimunitní chorobou nebo po transplantaci na trvalé imunosupresní léčbě) je tento program absolutně nevhodný. Podstatně déle trvající elevace hladiny endogenního TSH a pozvolnější eliminace 131I v hypotyreóze v důsledku zpomalení střevní peristaltiky a přechodného snížení renálních funkcí má za následek vyšší radiotoxicitu podaného 131I oproti exogenní stimulaci TSH [11]. Dosud však není jednoznačně potvrzeno, zda u klasického postupu ve srovnání s využitím rhTSH převažuje riziko vyšší radiotoxicity, riziko vyšší stimulace růstu reziduálních tyreocytů či benefit v podobě vyšší akumulace 131I v cílové tyreoidální tkáni (účinnější terapie, citlivější diagnostika?).
Výhody a nevýhody přípravy pomocí rhTSH
Podstatnou výhodou využití rhTSH je možnost potřebné elevace TSH při zachování plné metabolické eutyreózy, odpadají tím omezující symptomy a zdravotní (zejména kardiovaskulární) rizika protrahované hluboké hypotyreózy. Krátkodobá několikadenní elevace hladiny TSH cílená pouze na období podání 131I zabraňuje možné nežádoucí nadměrné růstové stimulaci benigní i maligní tyreoidální tkáně [12]. Plné zachování renálních funkcí umožňuje rychlejší eliminaci 131I nezachyceného v tyreoidální tkáni, tedy nižší radiotoxicitu. Otázka srovnatelnosti akumulace a účinku 131I v cílové tyreoidální tkáni po podání rhTSH proti využití hluboké hypotyreózy není dosud uspokojivě vyřešena [13–16].
Graf 1. Křivka hladiny TSH při 4týdenním vysazení I-T<sub>4</sub> vs po podání rhTSH [12]. ![Křivka hladiny TSH při 4týdenním vysazení I-T<sub>4</sub> vs po podání rhTSH [12].](https://pl-master.mdcdn.cz/media/image/7e42408ec204057863931c6046fe7d21.jpg?version=1537790372)
Hlavní nevýhodou využití rhTSH je vysoká cena preparátu pohybující se okolo 20 000 Kč za aplikaci u jednoho pacienta. Tato částka je však do značné míry ekonomicky návratná, vezmeme-li v úvahu podstatnou redukci délky potřebné pracovní neschopnosti a prevenci komorbidit u hypotyreózy [17].
Současná ekonomická situace českého zdravotnictví znemožňuje aplikovat Thyrogen v rámci jedné hospitalizace více než jednou, takže před podáním terapeutické aktivity 131I v programu „terapeutický Thyrogen“ není možné předem provést informativní diagnostickou scintigrafii. Postterapeutická scintigrafie tak plní zároveň diagnostickou funkci. Individualizace terapeutické aktivity před opakovanou léčbou 131I proto vychází z historie předchozích scintigrafií, případně dalších zobrazovacích metod, dynamiky hladiny tyreoglobulinu a empirických zkušeností.
Využití rhTSH v Motole v letech 2005–2011
V rámci programu s aplikací rhTSH před podáním terapeutické aktivity 131I (program „terapeutický Thyrogen“) bylo v tomto období na našem pracovišti podáno 445 terapií 131I u 301 pacientů: u 57 % pacientů na vzdálené metastázy, u 34 % pacientů na uzlinové metastázy (často obtížně operabilní//mediastinální), u 8 % pacientů k tyreoeliminaci nejčastěji po chirurgické revizi nadměrně akumulujících tyreoidálních reziduí či tumorózního regenerátu, u 1 % pacientů pro suspekci na recidivu na základě elevace hladiny TGL v průběhu dispenzarizace. Nejvyšší počet opakování terapie 131I po přípravě rhTSH u jednoho pacienta byl 7krát. Od roku 2005 u nás probíhají prakticky všechny terapie 131I na vzdálené metastázy, které byly patrné na předchozím postterapeutickém skenu, po přípravě rhTSH.
Graf 2. Terapie – věk první aplikace rhTSH (2005–2011). 
Relevantní srovnání efektivity (opakované) terapie 131I za využití rhTSH a endogenní hypotyreózy je velmi složité vzhledem k velké heterogenitě biologických vlastností subtypů DTC. Efekt terapie 131I závisí na celkové velikosti tumorózní masy a stupni dediferenciace maligních tyreocytů, který se navíc v čase mění (různě významná schopnost tumorózní tkáně akumulovat jód, rozdílný růstový potenciál, míra zachované dependence na TSH apod.). Naše dosavadní zkušenosti i dostupné zahraniční práce prozatím poukazují na přinejmenším podobný efekt terapie 131I po přípravě rhTSH ve srovnání s klasickou endogenní hypotyreózou.
V hospitalizačním programu s aplikací rhTSH před podáním diagnostické aktivity 131I (program „diagnostický Thyrogen“) bylo na našem pracovišti v letech 2007–2011 provedeno 404 scintigrafických vyšetření.
Tab. 1. Srovnání hospitalizačních programů na KNME s použitím <sup>131</sup>I. 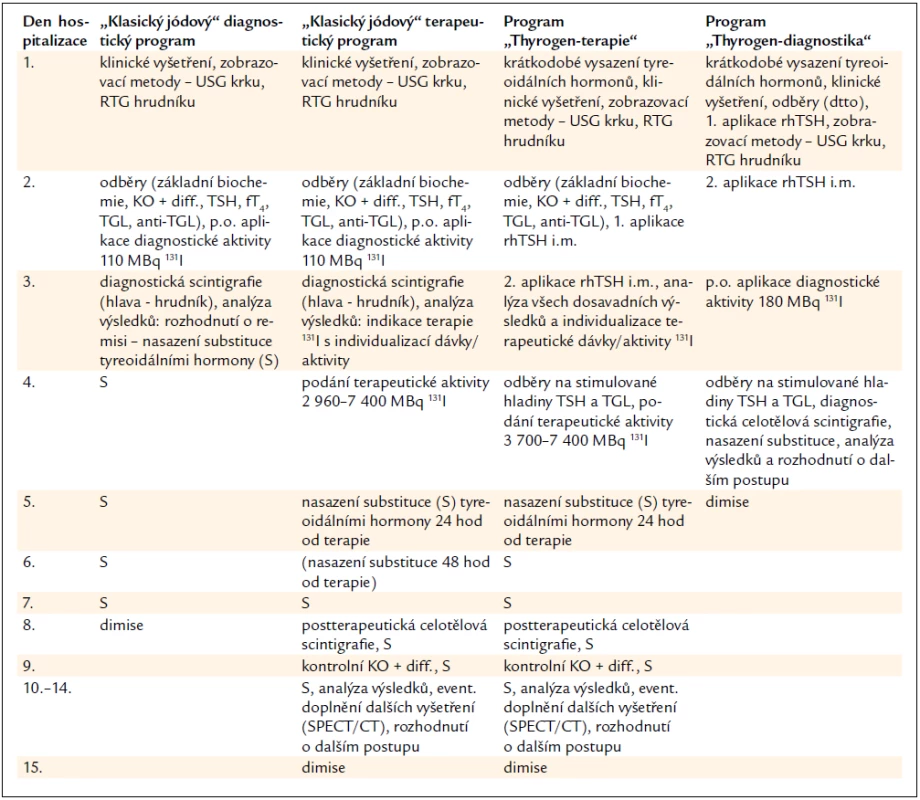
Za tuto dobu byla na scintigrafii zjištěna ložisková akumulace jen v 8 případech (7krát nesuspektní tyreoidální rezidua v ročním odstupu po tyreoeliminační terapii, 1krát vyšší akumulace nad plícemi u pacientky s odléčenými plicními metastázami), u všech těchto pacientů byla stimulovaná hladina TGL v „negativním“ rozmezí < 2 µg/l a následné dovyšetřování u žádného z těchto pacientů recidivu nepotvrdilo [18].
V 72 případech byla hladina TGL nenulová již na supresi TSH, po stimulaci rhTSH došlo 5. den hospitalizace k elevaci hladiny TGL v průměru 5,4krát (maximálně rozmezí 1–30krát). Scintigrafie provedená 5. den byla pozitivní pouze v jednom z těchto případů (tyreoidální rezidua v odstupu 1 roku od neúplné tyreoeliminace 131I). V těchto případech je tedy vhodnější pacienty přijmout rovnou v „klasickém“ jodovém programu s možností operativního zvážení terapie v průběhu jediné hospitalizace.
U 70 pacientů došlo po stimulaci rhTSH 5. den hospitalizace k vzestupu hladiny TGL z nedetekovatelné hladiny na nenulovou hladinu, u 11 z těchto sledovaných byla stimulovaná hladina TGL v pozitivním pásmu > 2 µg/l (maximálně 5,4 µg/l), zatím se u žádného z těchto nemocných relaps onemocnění nepotvrdil, nicméně v delším časovém odstupu nelze vyloučit, proto je v těchto případech nutná intenzivnější dispenzarizace a hospitalizace v „klasickém“ jódovém programu nejpozději do 2–3 let [19].
Možnosti dalšího užití rhTSH, které zatím nejsou v ČR využívány
V dlouhodobé dispenzarizaci pacientů v remisi je zásadně nutné pravidelné sledování a posuzování dynamiky sérové hladiny tyreoglobulinu, přičemž aktivita tyreocytů je potlačena cílenou supresí TSH. Hladina TGL po stimulaci TSH (endogenní či exogenní) má proto mnohem vyšší senzitivitu. Vzhledem k tomu, že diagnostická scintigrafie 131I po stimulaci rhTSH nepřináší obvykle novou informaci, bylo by postačující a pro pacienty více komfortní využít rhTSH v ambulantním provozu čistě jen k detekci stimulované hladiny TGL, což umožní selekci těch pacientů, u nichž je vhodná následná hospitalizace. V ekonomických podmínkách českého zdravotnictví je však tento postup v současné době nereálný.
K dovyšetření neznámého zdroje tyreoglobulinu neakumulujícího radiojód se využívají rovněž jiné scintigrafické metody, nejvyšší senzitivitu i specifitu přináší pozitronová emisní tomografie (PET). Je-li toto vyšetření prováděno za stavu suprese TSH, tumorózní ložisko nemusí vykazovat metabolickou aktivitu, neakumuluje 18-fluordeoxyglukózu a výsledek vyšetření tedy může být falešně negativní. Stimulace tyreocytů pomocí rhTSH může v těchto případech představovat významný benefit pro pacienta, umožní-li nalézt operabilní ložisko či zacílit následnou zevní aktinoterapii [20].
Chemoterapie diferencovaného karcinomu štítné žlázy představuje poslední možnost pro pacienty, jejichž pokročilé onemocnění není ovlivnitelné radiojódem, chirurgií ani zevní aktinoterapií. Její využití v ČR spadá pod všeobecná onkologická pracoviště a výsledky této léčby navzdory dílčím úspěchům stále nejsou příliš povzbudivé. Je otázkou, do jaké míry by k vyšší účinnosti mohla pomoci krátkodobá stimulace pomocí rhTSH cílená na období podání chemoterapie.
Závěr
Diferencovaný karcinom štítné žlázy je onemocnění s narůstající incidencí v kterémkoli věku, obvykle však zcela vyléčitelné za předpokladu včasné detekce onemocnění, i v případě pokročilého nálezu systematická léčba radiojodem a udržování suprese TSH zpravidla umožní podstatné prodloužení a udržení kvality života nemocného. U každého pacienta s DTC je nutné celoživotní sledování pomocí běžných zobrazovacích (sonografie), laboratorních (tyreoglobulin v séru) a scintigrafických metod (131I, PET/CT, 99mTc-MIBI), aby byla zajištěna včasná detekce a léčba případného relapsu onemocnění.
Graf 3. Diagnostika – věk aplikace rhTHS (2007–2011). 
Na základě našich zkušeností s ohledem na výsledky z jiných pracovišť a oficiální doporučení lze shrnout racionální indikace k zařazení do obou „Thyrogen programů“:
Racionální indikace k hospitalizačnímu programu „diagnostický Thyrogen“:
- dispenzární kontrola u pacientů po léčbě radiojodem 131I, u kterých dlouhodobě není suspekce na recidivu a mají při léčbě tyreoidálními hormony nedetekovatelnou hladinu TGL při negativních titrech protilátek anti-TGL,
- u pacientů se závažným chronickým onemocněním, kdy vlivem hluboké hypotyreózy hrozí trvalé zhoršení zdravotního stavu,
- plánovaná kontrola pacientů, u nichž je známa insuficientní produkce hypofyzárního TSH.
Racionální indikace k hospitalizačnímu programu „terapeutický Thyrogen“:
- tyreoablace radiojodem 131I u pacientů s nízkým rizikem recidivy (tumor do 2 cm ohraničený na štítnou žlázu, nízký TGL) nebo u pacientů se závažným chronickým onemocněním, kdy vlivem hluboké hypotyreózy hrozí trvalé zhoršení zdravotního stavu,
- prokázaný výskyt vzdálených metastáz akumulujících 131I na předchozí postterapeutické scintigrafii,
- u pacientů, u nichž je známa insuficientní produkce hypofyzárního TSH.
- individuální posouzení tyreoablace radiojodem 131I u pacientů, u nichž byla při úvodní hospitalizaci v hypotyreóze indikována chirurgická revize pro nález reziduální tyreoidální tkáně či regenerátu tumoru s příliš vysokou akumulací 131I znemožňující efektivní léčbu (k omezení nadměrné stimulace růstu benigní či maligní tyreoidální tkáně, ke kterému dochází vlivem protrahovaného vzestupu TSH při dlouhodobém vysazení hormonů).
MUDr. Markéta Macková
www.fnmotol.cz
e-mail: marketa.mackova@fnmotol.cz
Doručeno do redakce: 5. 12. 2012
Přijato po recenzi: 21. 1. 2013
Zdroje
1. Vlček P. Endokrinologicko-nukleárně medicínské aspekty v léčbě nádorů štítné žlázy. Vnitř Lék 2007; 53 : 807–811.
2. Luster M, Clarke SE, Dietlein M et al. Guidelines for radioiodine therapy of differentiated thyroid cancer. Eur J Nucl Med Mol imaging 2008; 35 : 1941–1959.
3. Tuttle RM, Brokhin M, Omry G et al. Recombinant human TSH-assisted radioactive iodine remnant ablation achieves short-term clinical recurrence rates similar to those of traditional thyroid hormone withdrawal. J Nucl Med 2008; 49 : 764–770.
4. Elisei R, Schlumberger M, Driedger A et al. Follow-up of low-risk differentiated thyroid cancer patients who underwent radioiodine ablation of postsurgical thyroid remnants after either recombinant human thyrotropin of thyroid hormone withdrawal. J Clin Endocrinol Metab 2009; 94 : 4171–4179.
5. Lee J, Yun MJ, Nam KH et al. Quality of life and effectiveness comparisons of thyroxine withdrawal, triiodothyronine withdrawal, and recombinant human thyroid-stimulating hormone administration for low-dose radioiodine remnant ablation of differentiated thyroid carcinoma. Thyroid 2010; 20 : 173–179.
6. Rosario PW, Xavier AC, Calsolari MR Recombinant human thyrotropin in thyroid remnant ablation with 131I-iodine in high-risk patients. Thyroid 2010; 20 : 1247–1252.
7. Robbins RJ, Driedger A, Magner J et al. Recombinant human thyrotropin-assisted radioiodine therapy for patients with metastatic thyroid cancer who could not elevace endogenous thyrotropin or be withdrawn from thyroxine. Thyroid 2006; 16 : 1121–1130.
8. Molinaro E, Viola D, Passannanti P et al. Recombinant human TSH (rhTSH) in 2009: new perspectives in diagnosis and therapy. Q J Nucl Med Mol Imaging. 2009; 53 : 490–502.
9. Klubo-Gwiezdzinska J, Burman KD, Van Nostrand D et al. Radioiodine treatment of metastatic thyroid cancer: relative efficacy and side effect profile after preparation by thyroid hormone withdrawal vs. recombinant human thyrotropin. Thyroid 2012; 22 : 310–317.
10. Tala H, Robbins R, Fagin JA et al. Five-year survival is similar in thyroid cancer patients with distant metastases prepared for radioactive iodine therapy with either thyroid hormone withdrawal or recombinant human TSH. J Clin Endocrinol Metab 2011; 96 : 2105–2111.
11. Frigo A, Dardano A, Danese E et al. Chromosome translocation frequency after radioiodine thyroid remnant ablation: a comparison between recombinant human thyrotropin stimulation and prolonged levothyroxine withdrawal. J Clin Endocrinol Metab 2009; 94 : 3472–3476.
12. Rosario PW, Salles DS, Purisch S Area under the curve of TSH after levothyroxine withdrawal versus administration of recombinant human TSH (rhTSH): possible implications for tumor growth. Arq Bras Endocrinol Metabol 2009; 53 : 767–770.
13. Menzel C, Kranert WT, Döbert N et al. rhTSH Stimulation Before Radioiodine Therapy in Thyroid Cancer Reduces the Effective Half-Life of 131I. J Nucl Med 2003; 44 : 1065–1068.
14. Vaiano A, Claudio Traino A et al. Comparison between remnant and red-marrow absorbed dose in thyroid cancer patients submitted to 131I ablative therapy after rh-TSH stimulation versus hypothyroidism induced by L-thyroxine withdrawal. Nucl Med Commun 2007; 28 : 215–223.
15. Rosário PW, Borges MA, Purisch S. Preparation with recombinant human thyroid-stimulating hormone for thyroid remnant ablation with 131I is associated with lowered radiotixicity. J Nucl Med 2008; 49 : 1776–1782.
16. Taïeb D, Sebag F, Farman-Ara B et al. Iodine biokinetics and radiodine exposure after recombinant human thyrotropin-assisted remnant ablation in comparison with thyroid hormone withdrawal. J Clin Endocrinol Metab 2010; 95 : 3283–3290.
17. Borget I, Remy H, Chevalier J et al. Lenght and cost of hospital stay of radioiodine ablation in thyroid cancer patients: comparison between preparation with thyroid hormone withdrawal and thyrogen. Eur J Nucl Med Mol Imaging 2008; 35 : 1457–1463.
18. Klubo-Gwiezdzinska J, Burman KD, Van Nostrand D et al. Does an undetectable rhTSH-stimulated Tg level 12 month after initial treatment of thyroid cancer indicate remission? Clin Endocrinol (Oxf) 2011; 74 : 111–117.
19. Kloos RT. Thyroid cancer recurrence in patients clinically free of disease with undetectable or very low serum thyroglobulin values. J Clin Endocrinol Metab 2010; 95 : 5241–5248.
20. Molinaro E, Viola D, Passannanti P et al. Recombinant human TSH (rhTSH) in 2009: new perspectives in diagnosis and therapy. Q J Nucl Med Mol Imaging 2009; 53 : 490–502.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2013 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Statinová intolerance
- Genetický podklad a screening familiární hypercholesterolémie
- Metabolit živočišné stravy produkovaný střevní mikroflórou zvyšuje riziko závažných kardiovaskulárních příhod
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
-
Všetky články tohto čísla
- Současné trendy v léčbě a dispenzarizaci pacientů s diferencovaným karcinomem štítné žlázy – zkušenosti s využitím rekombinantního humánního tyreotropinu
- Doporučené postupy a trendy v imunosupresivní léčbě glomerulonefritid podle KDIGO (Clinical Practice Guideline for Glomerulonephritis)
- Stanovisko výboru ČSAT k doporučením ESC/EAS pro diagnostiku a léčbu dyslipidemií z roku 2011
- Ischemická choroba dolních končetin a recidivující ileofemorální flebotrombóza u 24letého muže s antifosfolipidovým syndromem
- Synkopa ako prvý a jediný príznak myxómu ľavej predsiene
- Transplantace srdce a následná léčba AL-amyloidózy
- Role přímého inhibitoru trombinu mezi novými perorálními antikoagulancii
- Aortální regurgitace – editorial
- Současné trendy v léčbě a následné dispenzarizaci pacientů s diferencovaným karcinomem štítné žlázy – zkušenosti s využitím rekombinantního humánního tyreotropinu – editorial
- Představuje KDIGO Clinical practice Guideline for Glomerulonephritis přelom pro diagnostiku a léčbu glomerulonefritid? – editorial
- Srdeční myxomy – editorial
- Měnící se přístup k léčbě AL-amyloidózy – editorial
- Aortální regurgitace
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Aortální regurgitace
- Doporučené postupy a trendy v imunosupresivní léčbě glomerulonefritid podle KDIGO (Clinical Practice Guideline for Glomerulonephritis)
- Současné trendy v léčbě a dispenzarizaci pacientů s diferencovaným karcinomem štítné žlázy – zkušenosti s využitím rekombinantního humánního tyreotropinu
- Transplantace srdce a následná léčba AL-amyloidózy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



