-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Transplantace srdce a následná léčba AL-amyloidózy
Heart transplantation and the subsequent treatment of AL amyloidosis
Severe damage to the heart caused by AL amyloid deposits is a contraindication of high-dose chemotherapy with autologous haematopoietic stem cell transplantation. Severe heart damage caused by AL amyloid results in frequent life-threatening complications, even during the course of the classical chemotherapy treatment and it often makes keeping to the treatment schedule impossible. Scheduling heart transplantation before the treatment of AL amyloidosis will significantly improve the patients’ overall condition and enable them to undergo the intensive AL amyloidosis treatment with the hope that a long-term complete remission may be achieved.
Case descriptions:
Transplantations of heart damaged by AL amyloid deposits were conducted in three patients; two men, age 48 and 54, and one woman, age 63. In the interval of 3–6 months from the heart transplantation before the scheduled AL amyloidosis treatment was initiated, an examination of bone marrow, the concentration of monoclonal immunoglobulin and free light chains was carried out. Both men had more than 10% of plasma cells in the bone marrow after the heart transplantation and the concentrations of the λ free light chains were pathologically increased. During the first-line therapy, autologous haematopoietic stem cells were harvested from peripheral blood after mobilizaton with granulocyte growth factor (filgrastim) at the dose of 5 µg/kg twice a day. During the administration of filgrastim until the end of the haematopoietic stem cell harvest, the combined immunosuppressive treatment was reduced and a corticosteroid dose was compensatory increased. The prophylactic antiviral drug valganciclovir was discontinued during the haematopoietic stem cell harvest. High-dose chemotherapy (melphalan 100 mg/m2) with autologous haematopoietic stem cell transplantation followed. In the interval from administering melphalan until the rise in neutrophil count over 2 x 109/l, antiviral prophylaxis was discontinued again, the immunosuppressive drug doses were reduced and corticoid doses were slightly increased. High-dose chemotherapy with melphalan at the of 100 mg/m2 was tolerated without major complications and without mucositis; however, in neither of the male patients did it lead to a complete haematological remission. Consequently, the second-line therapy followed using bortezomib combined with dexamethasone and also with cyclophosphamide or doxorubicin. One of these two patients reached a complete haematological remission after the bortezomib therapy; the values of free light chains were normal, immunofixation was negative, and clonal plasma cells were absent in the bone marrow. In the case of the other patient, the bortezomib therapy only induced partial remission. In this case, the third-line therapy followed, applying a combination of lenalidomide, dexamethasone and cyclophosphamide. This therapy significantly reduced the values of free light chains; however, their ratio remained pathological. To conclude, the latter response can be described as a very good partial remission. Both men currently show no signs of disease activity and are in a good clinical condition 28 and 30 months after the heart transplantation. The third heart transplantation, due to severe heart damage by AL amyloid deposits, was conducted in a woman aged 63. An examination of this woman three months after the heart transplantation showed that the original pathological values of free light chains became normal. The woman had approx. 8% of clonal plasma cells before the heart transplantation. Three months after the heart transplantation the bone marrow contained only 3% of polyclonal plasma cells. In this case, the immunosuppressive treatment with corticosteroids after the heart transplantation probably induced a complete haematologic remission. The woman is in a complete AL amyloidosis remission seven months after the heart transplantation.Conclusion:
It was beneficial to perform the heart transplantation first and to initiate the AL amyloidosis treatment no sooner than three months after the heart transplantation in patients with severe heart damage caused by AL amyloid deposits. If the patients are in a good clinical conditions, autologous haematopoietic stem cells can be harvested after the heart transplantation and high-dose chemotherapy can be offered to the patients. If this intensive treatment does not induce remission, it is necessary to apply additional alternative treatments.Key words:
AL amyloidosis – high-dose chemotherapy – bortezomib – lenalidomide – cardiomyopathy – heart biopsy
Autoři: Z. Adam 1; J. Krejčí 2; M. Krejčí 1; P. Němec 3; L. Špinarová 2; V. Žampachová 4; Z. Čermáková 5; T. Pika 6; L. Pour 1; Z. Kořístek 1,7; M. Tomíška 1; P. Szturz 1; Z. Král 1; J. Mayer 1
Působiště autorů: Interní hematologická a onkologická klinika LF MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Mayer, CSc. 1; Mezinárodní centrum klinického výzkumu – I. interní kardio-angiologická klinika LF MU a FN u sv. Anny Brno, přednostka prof. MUDr. Lenka Špinarová, Ph. D. 2; Centrum kardiovaskulární a transplantační chirurgie Brno, ředitel doc. MUDr. Petr Němec, CSc. 3; I. patologicko-anatomický ústav LF MU a FN u sv. Anny Brno, přednostka prof. MUDr. Markéta Hermanová, Ph. D. 4; Oddělení klinické biochemie FN Brno, KLM LF MU, přednosta doc. MUDr. Milan Dastych, CSc., MBA 5; III. interní klinika – nefrologie, revmatologie a endokrinologie LF UP a FN Olomouc, přednosta prof. MUDr. Josef Zadražil, CSc. 6; Integrované centrum celulární a regenerativní medicíny, Mezinárodní centrum klinického výzkumu, FN u sv. Anny Brno 7
Vyšlo v časopise: Vnitř Lék 2013; 59(2): 136-147
Kategorie: Kazuistika
Souhrn
Závažné poškození srdce depozity AL-amyloidu je kontraindikací vysokodávkované chemoterapie s transplantací autologních kmenových krvetvorných buněk. Závažné poškození srdce AL-amyloidem způsobuje četné život ohrožující komplikace i v průběhu klasické chemoterapie a často znemožňuje dodržení léčebného plánu. Předřazení transplantace srdce před léčbu AL-amyloidózy zásadně zlepší celkový stav pacienta a umožní mu absolvovat intenzivní léčbu AL-amyloidózy s nadějí na dosažení dlouhodobé kompletní remise nemoci.
Popisy případů:
Transplantace srdce poškozeného depozity AL-amyloidu proběhla u 3 pacientů, u 2 mužů ve věku 48 a 54 let a u 1 ženy ve věku 63 let. V intervalu 3–6 měsíců od provedení transplantace srdce, před zahájením plánované léčby AL-amyloidózy, následovalo kontrolní vyšetření kostní dřeně, koncentrace monoklonálního imunoglobulinu a volných lehkých řetězců. Oba muži měli po transplantaci srdce v kostní dřeni více než 10 % plazmatických buněk a měli patologicky zvýšené koncentrace volných lehkých řetězců λ. V rámci léčby první linie byl proveden sběr autologních kmenových buněk krvetvorby z periferní krve po mobilizaci granulocytárním růstovým faktorem (filgrastim) v dávce 2krát denně 5 µg/kg. V průběhu aplikace filgrastimu až do ukončení sběru kmenových krvetvorných buněk byla redukována kombinovaná imunosupresivní léčba a kompenzatorně byla zvýšena dávka kortikosteroidů. Profylaktické antivirotikum valganciklovir bylo na dobu sběru hemopoetických kmenových buněk přerušeno. Následovala vysokodávkovaná chemoterapie (melfalan 100 mg/m2) s autologní transplantací kmenových krvetvorných buněk. V intervalu od podání melfalanu do vzestupu počtu neutrofilů nad 2 × 109/l byla opět přerušena antivirotická profylaxe a byly sníženy dávky imunosupresiv a mírně zvýšeny kortikoidy. Vysokodávkovaná chemoterapie s melfalanem v dávce 100 mg/m2 byla tolerována bez závažnějších komplikací, bez mukozitidy, nevedla však ani u jednoho nemocného ke kompletní hematologické remisi. Proto následovala léčba druhé linie, obsahující bortezomib v kombinaci s dexametazonem a dále s cyklofosfamidem anebo s doxorubicinem. Jeden z těchto dvou pacientů se dostal po léčbě režimem s bortezomibem do kompletní hematologické remise nemoci, s normálními hodnotami volných lehkých řetězců a s negativní imunofixací a nepřítomností klonálních plazmocytů v kostní dřeni. U druhého pacienta indukovala léčba obsahující bortezomib pouze parciální remisi. V tomto případně následovala třetí léčebná linie, kombinace lenalidomidu, dexametazonu a cyklofosfamidu. Ta výrazně snížila hodnoty volných lehkých řetězců, ale zůstal stále jejich patologický poměr, takže léčebná odpověď odpovídá velmi dobré parciální remisi nemoci. Oba muži jsou nyní bez známek aktivity nemoci v dobrém klinickém stavu 28 a 30 měsíců po transplantaci srdce. Třetí transplantace srdce pro závažné poškození srdce depozity AL-amyloidu byla provedena u ženy ve věku 63 let. Při kontrolním vyšetřením 3 měsíce po transplantaci srdce došlo u této ženy k normalizaci původně patologických hodnot volných lehkých řetězců. Tato žena měla před transplantací srdce kolem 8 % klonálních plazmocytů a 3 měsíců po transplantaci srdce byla v kostní dřeni jen 3 % polyklonálních plazmocytů. V tomto případně zřejmě imunosupresivní léčba po transplantaci srdce, obsahující kortikosteroidy, navodila kompletní hematologickou remisi onemocnění. Žena je 7 měsíců po transplantaci srdce v kompletní remisi AL-amyloidózy.Závěr:
U pacientů s těžkým poškozením srdce depozity AL-amyloidu bylo přínosné provést napřed transplantaci srdce od neživého dárce a léčbu AL-amyloidózy zahájit až 3 měsíce po transplantaci srdce. Při dobrém klinickém stavu pacientů po transplantaci srdce lze provést sběr autologních kmenových krvetvorných buněk a pacientům nabídnout vysokodávkovanou chemoterapii. V případě, že tato intenzivní léčba nenavodí remisi, je nutné použít další léčebné alternativy.Klíčová slova:
AL-amyloidóza – vysokodávkovaná chemoterapie – bortezomib – lenalidomid – kardiomyopatie – srdeční biopsieÚvod
Amyloidóza z lehkých řetězců (immunoglobulin light chain amyloidosis) – akronymem AL-amyloidóza – je choroba, která vzniká v důsledku tvorby monoklonálních lehkých řetězců se specifickou mutací. Tato mutace způsobuje odlišnou (lineární) prostorovou konfiguraci volných lehkých řetězců na rozdíl od fyziologické α helikální. Díky této odchylné struktuře amyloidogenní lehké řetězce spontánně agregují, vznikají tak oligomery, a ty pak vytvářejí depozita amyloidových fibril ve stabilní lineární struktuře. Podstatně méně často se ukládají ve formě amorfních hmot (light chain deposition disease) [1,2].
Amyloidogenní lehké řetězce jsou produkovány monoklonálními plazmatickými buňkami, lokalizovanými v kostní dřeni, případně ve slezině. Počet těchto klonálních plazmocytů obvykle není nijak velký. S pomocí krevního oběhu se pak amyloidogenní lehké řetězce imunoglobulinů dostávají k cílovým orgánům, v nichž se usazují díky zatím neznámým interakcím s matrix jednotlivých tkání (s glykosaminoglykany a s molekulami buněčných membrán). Tyto interakce mohou potencovat tvorbu oligomerů klonálních lehkých řetězců a konečné formování amyloidového depozita. To, v kterém orgánu se vytvoří nejmasivnější depozitum, a tedy největší poškození, je determinováno geny pro variabilní část lehkého řetězce, tedy strukturou amyloidogenního lehkého řetězce [3–5].
Klinické projevy mohou být velmi pestré a jsou popsány v mnoha českých publikacích [1,6–11].
Zda a kde vznikne amyloidové depozitum, je dáno mutací genetické informace pro lehký řetězec imunoglobulinu v klonálním plazmocytu [2,3].
Léčba AL-amyloidózy je komplikovaná tím, že léčíme člověka s poškozením životně důležitých orgánů depozity AL-amyloidu. Prognóza pacientů se odvíjí dominantně od míry poškození srdce. V době, kdy se AL-amyloidóza projeví selháním srdce, jde již obvykle o velmi pokročilý stav. Protinádorová léčba je vždy spojena s určitou zátěží nemocného. Závažné poškození člověka depozity amyloidu způsobuje „křehkost“ pacienta, která způsobuje zvýšenou morbiditu i mortalitu v průběhu léčby.
Klasická léčba AL-amyloidózy je dlouhodobá, probíhá po mnoho měsíců, nejméně 1/2 roku, než se dosáhne hematologické léčebné odpovědi (vymizení či pokles koncentrace amyloidotvorných lehkých řetězců), a teprve pak dochází postupně k orgánové léčebné odpovědi, k pomalému a postupnému odbourávání amyloidových depozit a zlepšování funkce orgánů.
Sběr kmenových krvetvorných buněk a léčba vysokodávkovanou chemoterapií s autologní transplantací krvetvorných buněk jsou proveditelné během 2 měsíců, ale jsou spojeny s mortalitou, která se i při pečlivém výběru pacientů bez závažného poškození srdce a dalších důležitých orgánů pohybuje kolem 15 % [2].
Pacienti, kteří mají závažné poškození srdce amyloidem, samozřejmě nejsou kandidáty pro vysokodávkovanou chemoterapii a i běžná chemoterapie je u nich spojena s četnými komplikacemi, které mohou způsobit smrt v průběhu léčby. Proto je medián přežití pacientů se závažným poškozením srdce řádově v měsících [1].
Novou naději pro mladé nemocné se závažným poškozením srdce, které je již kontraindikací intenzivní protinádorové léčby, je provedení transplantace srdce od dárce a zahájení léčby AL-amyloidózy až s novým srdcem, kdy je pacient v podstatně lepší fyzické kondici.
Následující sdělení popisuje zkušenosti s prvními třemi pacienty, kteří napřed podstoupili transplantaci srdce, a pak u nich byla zahájena léčba AL-amyloidózy.
Popis pacientů
Muž, narozený roku 1962, pacient č. 1
Muž, narozený roku 1962, k nám přišel poprvé v dubnu roku 2010, ve svých 48 letech, s těžkou hypertrofickou kardiomyopatií, známkami závažného poškození srdce, ejekční frakcí levé komory kolem 20 % a s monoklonální gamapatií. V rámci prvního hematologického vyšetření v dubnu roku 2010 byla provedena jen elektroforéza s nálezem malého množství monoklonálního imunoglobulinu v séru, odpovídajícího volným lehkým řetězcům λ.
Pro těžkou poruchu funkce srdce byl pacient dlouhodobě v péči I. interní kardio-angiologické kliniky LF MU a FN u sv. Anny v Brně. Kardiologové provedli endomyokardiální biopsii s cílem pojmenovat příčinu těžké kardiomyopatie. V odebraném materiálu však nebyla prokázána amyloidóza ani jiná střádavá či zánětlivá choroba. Po biopsii srdce tak zůstala příčina kardiomyopatie neobjasněna, nicméně těžké poškození srdce s obrazem hypertrofické kardiomyopatie bylo indikací pro zařazení pacienta do transplantačního programu.
Transplantace srdce byla provedena v Brně v červnu roku 2010. Převratným zjištění bylo prokázání depozit AL-amyloidu při histologickém vyšetření vyjmutého srdce. Patolog našel v explantátu srdce depozita AL-amyloidu v endokardu, myokardu i ve stěně cév. Depozita byla výrazně nehomogenně rozptýlena, v některých úsecích výraznější (papilární sval), v jiných téměř absentovala. Tím lze vysvětlit původně negativní biopsii. Depozita amyloidu byla zachycena rovněž v rektální sliznici. Klinické podezření na AL-amyloidózu srdce bylo vysoké již před transplantací, překvapením byl negativní výsledek endokardiální biopsie.
Na naše pracoviště se pacient vrátil až v září roku 2010. V té době již měl kombinovanou imunosupresivní léčbu obsahující takrolimus, mykofenolát mofetil a prednison 15 mg denně. V listopadu roku 2010 proběhlo vyšetření monoklonální gamapatie, která byla příčinou AL-amyloidózy. Uvedeme jen zásadní výsledky související s AL-amyloidózou. Koncentrace volných lehkých řetězců λ byla vysoká, 453 mg/l, zatímco koncentrace volných lehkých řetězců κ byla velmi nízká, menší než 3 mg/l a imunofixační elektroforéza potvrdila monoklonální imunoglobulin v séru typu lehkých řetězců λ. Bylo provedeno vyšetření kostní dřeně, trepanobiopsie lopaty kosti kyčelní. Patolog v odebraném materiálu popsal 15–20 % klonálních plazmocytů, exprimujících lehké řetězce λ. Při cytologickém hodnocení bylo popsáno 6,8 % plazmocytů.
Nález klonálních plazmocytů, nález monoklonálního imunoglobulinu a poškození srdce amyloidem tedy naplnilo formální kritéria symptomatického mnohočetného myelomu s AL-amyloidózou.
Velmi alarmujícím zjištěním bylo, že 10. kontrolní endomyokardiální biopsie, provedená 5 měsíců po transplantaci srdce, nalezla v transplantovaném srdci drobná depozita amyloidu. To znamenalo, že cirkulující volné lehké řetězce se rychle usazují i v novém srdci a začínají je poškozovat depozity amyloidu. Proto bylo nutné co nejdříve podat účinnou léčbu.
Proto byl v prosinci roku 2010 proveden sběr autologních kmenových buněk krvetvorby. Před zahájením mobilizace (aplikace granulocytárního růstového faktoru G-CSF, filgrastimu 5 µg/kg 2krát denně) byla redukována výše uvedená kombinovaná imunosupresivní léčba a přerušena antivirotická profylaxe (valganciklovir) s cílem snížit myelotoxicitu, a byly zvýšeny dávky prednisonu. U pacienta bylo získáno celkem 6,52 × 106 CD34+ buněk/kg hmotnosti. Po úspěšném sběru kmenových buněk krvetvorby z periferní krve byla opět navrácena výše uvedená kombinovaná imunosuprese.
V lednu roku 2011 byla provedena vysokodávkovaná chemoterapie v dávce 100 mg/m2 melfalanu s podporou transplantace autologních kmenových krvetvorných buněk. Kombinovaná imunosuprese (takrolimus a mykofenolát mofetil) byla na dobu neutropenie přechodně redukována a dále byla přerušena antivirotická profylaxe. Kompenzatorně byl navýšen prednison z 15 na 30 mg denně. Původní dávky imunosupresiv byly obnoveny až po návratu počtu neutrofilů nad 2,0 × 109/l. Změny imunosupresivní léčby v průběhu sběru kmenových hemopoetických buněk a vysokodávkované chemoterapie s autologní transplantací dokumentuje tab. 1.
Tab. 1. Úprava imunosupresivní léčby a dalších léků před sběrem kmenových krvetvorných buněk a v průběhu vysokodávkované chemoterapie s transplantací autologních kmenových buněk u pacienta č. 1. 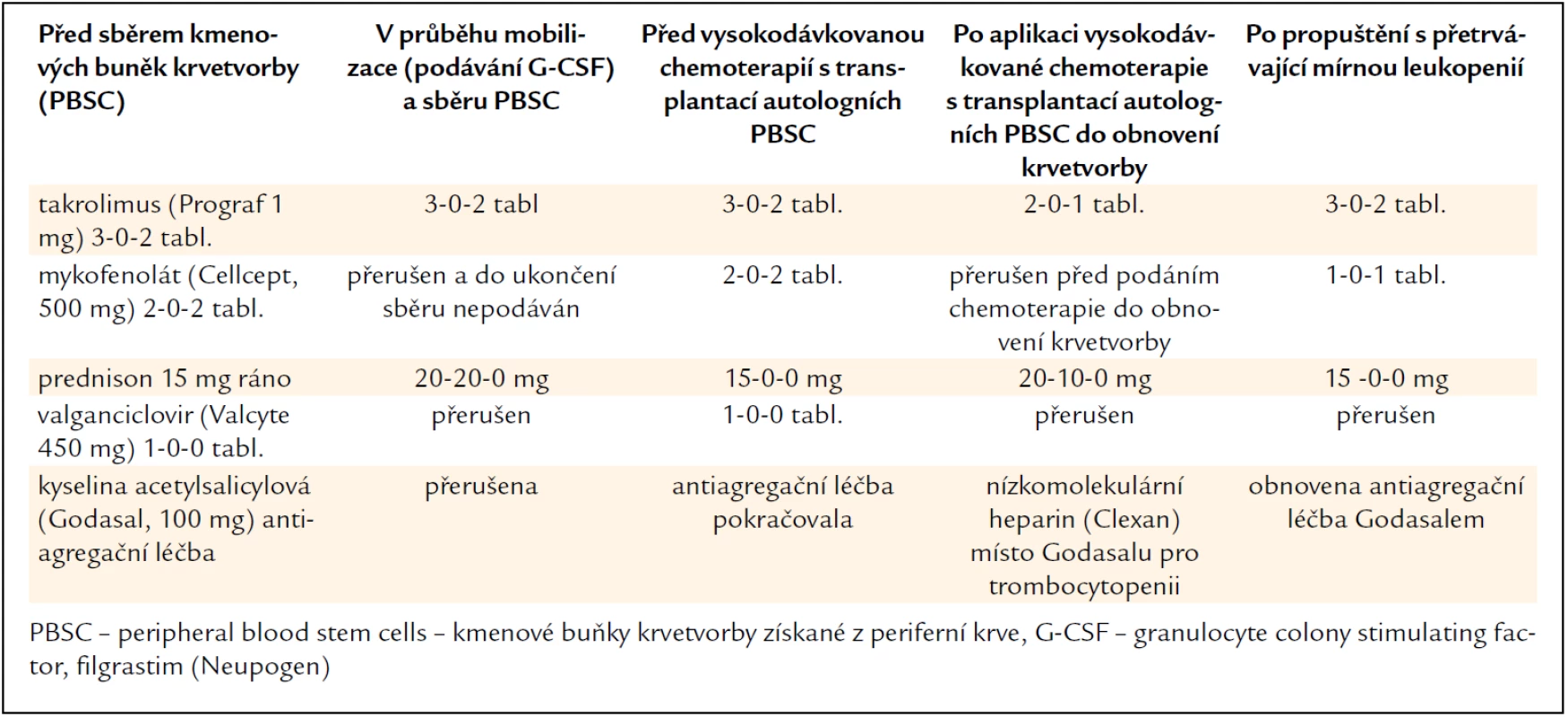
V březnu roku 2011 bylo pro nedostatečný pokles koncentrací volných lehkých řetězců λ (209 mg/l) po této vysokodávkované chemoterapii přistoupeno k druhé linii léčby AL-amyloidózy, k podávání cyklofosfamidu, bortezomibu a dexametazonu (cyklofosfamid 500 mg/m2 i.v. infuze 1. a 15. den 28deního cyklu, bortezomib 1,3 mg/m2 i.v. injekce 1., 4., 8. a 15. den 28denního cyklu a dexametazon 20 mg p.o. 1.–4. a 15.–18. den 28denního cyklu).
Pacient tuto léčbu ukončil v říjnu roku 2011 osmým cyklem léčby. Koncentrace volných lehkých řetězců λ se však nedostala do oblasti normálních hodnot, stále byla zvýšená (70 mg/l). Jejich koncentrace se v průběhu léčby snížila o více než 50 %, takže léčebnou odpověď bylo možné hodnotit jako parciální remisi. Cílem je však dosažení kompletní remise, aby se zamezilo další tvorbě amyloidu.
Proto byla v listopadu roku 2011 zahájena třetí linie léčby kombinací lenalidomidu, doxorubicinu a dexametazonu (lenadomid 25 mg 1.–21 den, doxorubicin 18 mg/m2 i.v. 1. den cyklu a dexametazon 1.–4. a 15.–18. den 28denního cyklu). Tato léčba byla ukončena v červnu roku 2012. Koncentrace volných lehkých řetězců λ poklesla na hodnoty kolem 30 mg/l při trvale nízké koncentraci volných lehkých řetězců κ.
V současnosti můžeme konstatovat, že koncentrace volných lehkých řetězců se blíží normální hodnotě, poměr koncentrace volných λ řetězců/volných κ řetězů je však stále patologický, takže nebylo dosaženo kompletní remise. Léčebnou odpověď hodnotíme jako velmi dobrou parciální remisi.
Tč. je pacient ve sledování kardiologické kliniky a u nás ve dvouměsíčních intervalech sledujeme odpad volných lehkých řetězců močí/24 hod a koncentraci volných lehkých řetězců v séru. V prosinci roku 2012 byl pacient 30 měsíců po transplantaci srdce bez známek recidivy nemoci (podle biopsie srdce byl poslední záchyt amyloidu v myokardu v listopadu roku 2011).
V séru jsou však stále přítomné v mírně zvýšené koncentraci amyloidogenní lehké řetězce λ, i když v cytologickém hodnocení kostní dřeně je jen nepatrný počet plazmocytů 0,2 % (norma 0–3,5 %). Léčebnou odpověď tedy hodnotíme jako velmi dobrou parciální remisi, kompletní remise nebyla dosažena. Při dalším vzestupu koncentrace lehkých řetězců λ bude následovat obnovení léčby. Zásadní data průběhu nemoci zachycuje tab. 2.
Tab. 2. Vývoj koncentrace volných lehkých řetězců imunoglobulinů, která odráží aktivitu nemoci, účinnost léčby a nálezy v kostní dřeni. 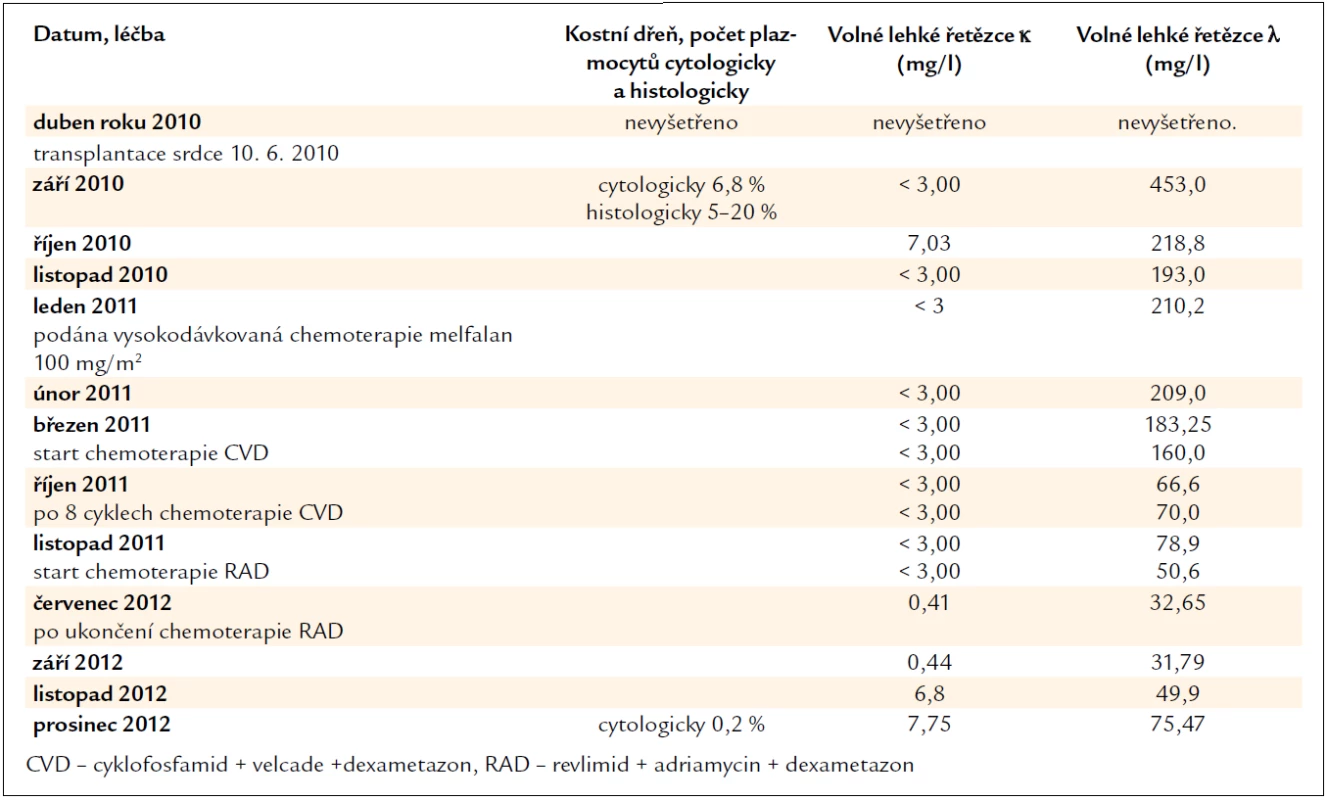
Muž, narozený roku 1955, pacient č. 2
Muž, narozený roku 1955, byl celý život zdráv, až do roku 2009 (54 let), kdy měl infarkt myokardu, řešený koronární intervencí s implantací stentu v květnu roku 2009. V průběhu roku 2009 se dále zhoršovala funkce srdce, ejekční frakce levé komory postupně se snižovala na 40 %, 35 % a posléze již jen 30 %. Pro oběhovou dekompenzaci byl přijat na I. interní kardio-angiologickou kliniku LF MU a FN u sv. Anny v Brně. Příčina narůstající srdeční slabosti nebyla jasná, a proto se uvažovalo o souběhu ischemické nemoci srdeční a dilatační kardiomyopatie. Proto kardiologové provedli rekoronarografii, ale nenalezli žádnou stenózu, odpovídající ischemické nemoci srdeční. Ani ve stentu nebyla zachycena restenóza. Selhávání srdce nebylo tedy vysvětlitelné ischemickou chorobou srdeční. Proto kardiologové provedli endomyokardiální biopsii a histologické hodnocení odebraného vzorku myokardu, které prokázalo depozita AL-amyloidu (obr. 1, 2 a 3). Punkční biopsie jater neprokázala jaterní amyloidózu.
Obr. 1. Myokard-amyloid – Kongo100krát: myokard explantovaného srdce s amyloidózou, barvení Kongo červení, zvětšení 100krát. Šipky ukazují amorfní červeně obarvená depozita amyloidu v intersticiu myokardu, je patrné disperzní rozložení depozit. 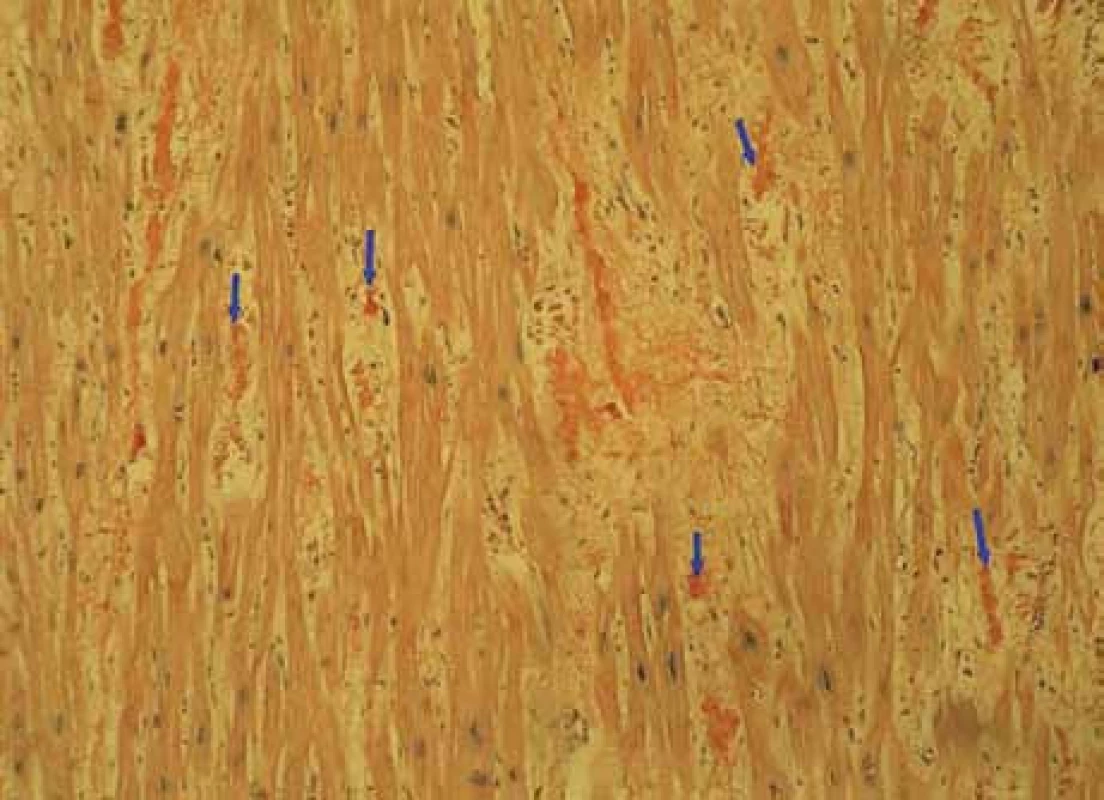
Obr. 2. Myokard explantovaného srdce s amyloidózou, barvení Kongo červení, polarizace. Šipky ukazují amorfní depozita amyloidu se specifickou zelenou birefringencí v polarizovaném světle, lokalizovaná v intersticiu myokardu, je patrné disperzní rozložení depozit. Žlutá birefringence se částečně mění v zelenou v závislosti na úhlu polarizace. Birefringence jiných barev (růžová, stříbřitá) znázorňuje jiné substance, např. kolagen. 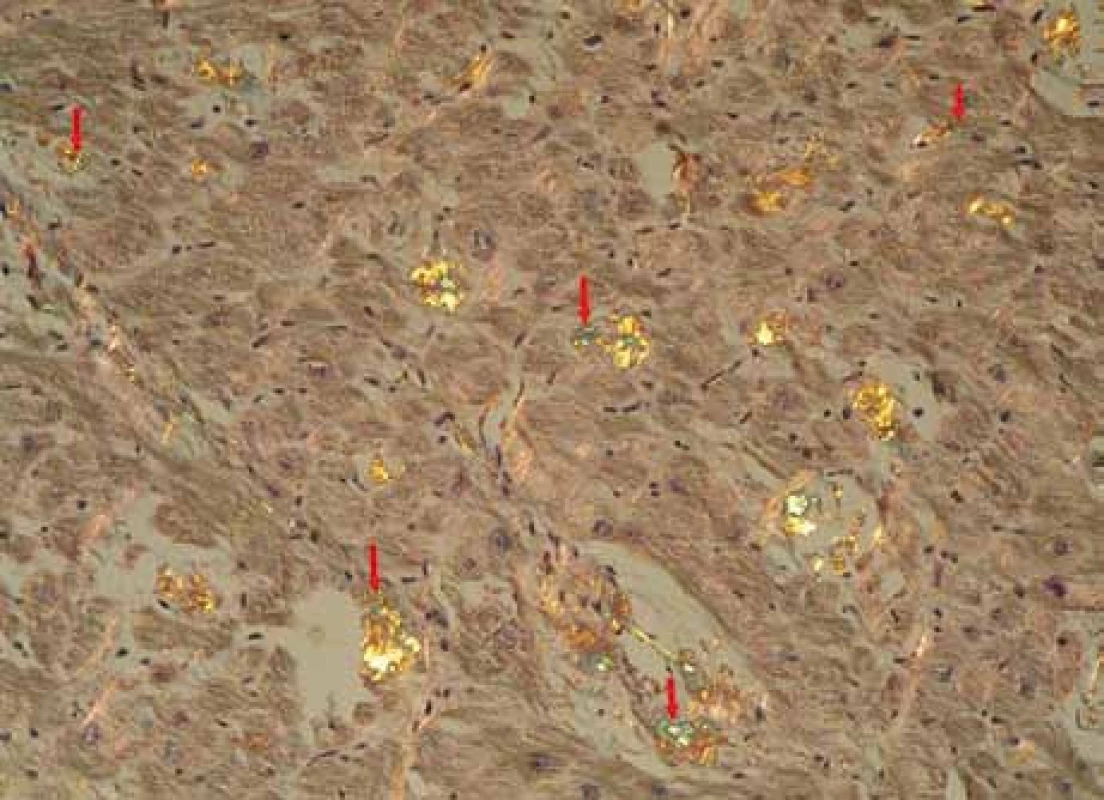
Obr. 3. Obdobný snímek. Myokard explantovaného srdce s amyloidózou, barvení Kongo červení, polarizace. Šipky ukazují proužky amorfních depozit amyloidu se specifickou zelenou birefringencí v polarizovaném světle, lokalizované v intersticiu myokardu a ve stěně cévy (okrouhlá struktura, šipka směřující zdola nahoru). 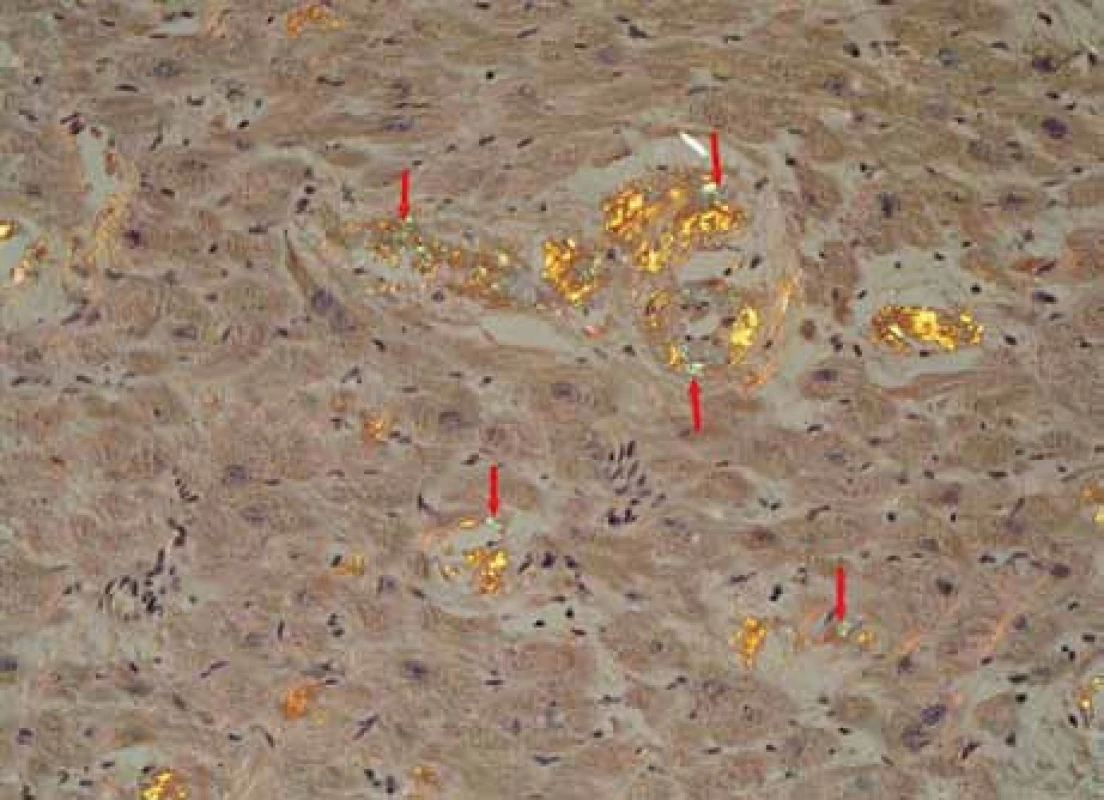
V dubnu roku 2010 byl tento muž předán na Interní hematologickou a onkologickou kliniku LF MU a FN Brno-Bohunice. Pacient byl dušný při každé drobné námaze. Echokardiografické vyšetření potvrdilo velmi nízkou ejekční frakci levé komory, jen 30 %, hypertrofii stěny levé komory, restrikcí plnění a známky plicní hypertenze.
Provedli jsme základní vyšetření, které mělo rozlišit, zda nemoc budeme klasifikovat jako primární systémovou AL-amyloidózu, nebo jako mnohočetný myelom s AL-amyloidózou.
Byla provedena sternální punkce, počet plazmocytů byl jen 5,8 %, nedosáhl signifikantního zvýšení na 10 % a výše. Při biochemickém vyšetření byly prokázány vyšší hodnoty volných lehkých řetězců λ v koncentraci 335 mg/l při normální hodnotě volných lehkých řetězů κ. Imunofixační elektroforéza prokázala klonální λ řetězce v séru. RTG vyšetření skeletu neprokázalo žádná osteolytická ložiska. Pro nízký počet plazmocytů v myelogramu nebyla splněna kritéria mnohočetného myelomu. To znamenalo, že pacient splňuje kardiologická kritéria pro transplantaci srdce. Podle kardiologů je transplantace srdce indikována, pokud gamapatie splní kritéria primární systémové AL-amyloidózy, a ne mnohočetného myelomu.
Z druhé strany fakt, že nemoc splní jen kritéria primární systémové AL-amyloidózy, ale ne mnohočetného myelomu s AL amyloidózou, znamená, že pacient nemůže dostat nové léky, konkrétně bortezomib. Bortezomib je u této diagnózy velmi účinný, není však pro tuto vzácnou diagnózu registrován a tedy hrazený plátci zdravotní péče.
Pro iniciální léčbu jsme navrhli klasickou kombinaci cyklofosfamidu a dexametazonu (cyklofosfamid 50 mg denně a dexametazon 20 mg 1.–4. den a 15.–18. den 28denního cyklu). Léčbu zahájil 28. dubna 2010.
Dexametazon má potenciál redukovat počet patologických plazmocytů, má však v uvedené dávce velké nežádoucí účinky, způsobuje retenci tekutin, což pro člověka se selhávajícím srdcem je velkým problémem, který znemožňuje ambulantní průběh této léčby.
Pacient tuto léčbu velmi špatně toleroval a srdeční slabost postupně progredovala. Proto kardiologové revidovali původní doporučení a indikovali provedení ortotopické transplantace srdce od neživého dárce.
Transplantace srdce byla provedena v Centru kardiovaskulární a transplantační chirurgie v Brně dne 2. 8. 2010.
Na Interní hematologickou a onkologickou kliniku LF MU a FN Brno-Bohunice se pacient vrátil až v únoru roku 2011 díky transplantovanému srdci ve výrazně lepším stavu, než tomu bylo v roce 2010. Nicméně zvýšená koncentrace volných lehkých řetězců λ (86 mg/l) při nízké koncentraci κ řetězců (14,70 mg/l) signalizovala aktivitu nemoci, produkci amyloidogenních lehkých řetězců λ.
Proto byl proveden sběr kmenových buněk krvetvorby z periferní krve po aplikaci filgrastimu (Neupogenu) v dávce 5 µg/kg 2krát denně. Po dobu mobilizace a sběru kmenových krvetvorných buněk byla redukována imunosupresivní léčba. Sběr byl úspěšný, bylo získáno celkem 5,20 × 106 CD34+ buněk/kg hmotnosti.
A tak 23. března 2011 byla provedena vysokodávkovaná chemoterapie, melfalan 100 mg/m2 i.v. infuze s následující transplantací autologních kmenových buněk. Změny v dávkách imunosupresiv a dalších léků dokumentuje tab. 3.
Tab. 3. Úprava imunosupresivní léčby před sběrem kmenových krvetvorných buněk a v průběhu transplantace u pacienta č. 2. 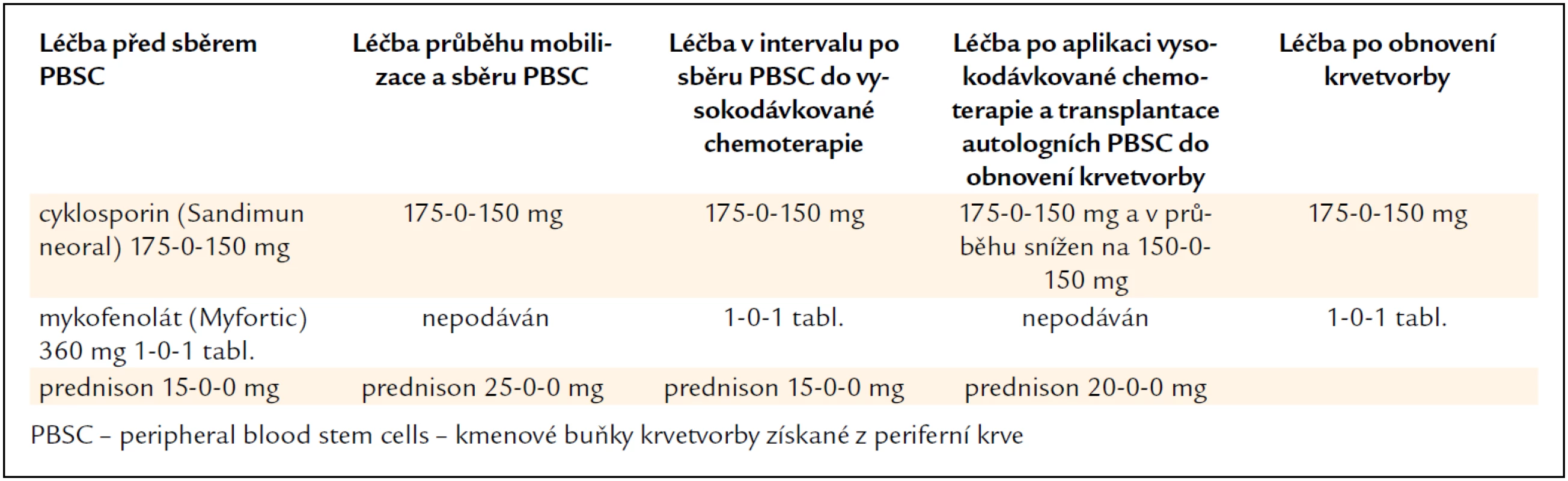
Bohužel samotná vysokodávkovaná chemoterapie (melfalan 100 mg/m2) již nenavodila zásadní pokles volných lehkých řetězců, jak ukazuje tab. 2. Hodnoty se postupně zvyšovaly a v prosinci roku 2011 dosáhly hodnoty 123 mg/l. Proto bylo v prosinci roku 2012 provedeno opětovně vyšetření kostní dřeně, nyní již metodou trepanobiopsie s histologickým hodnocením válečku kostní dřeně.
Histologicky byla popsána kostní dřeň se známkami klonální proliferace plazmatických buněk exprimujících volné lehké řetězce λ v počtu 5–10 %.
V této chvíli již byla počtem klonálních plazmocytů v kostní dřeni a přítomností monoklonálního imunoglobulinu splněna kritéria mnohočetného myelomu, takže jsme mohli původní primární systémovou AL-amyloidózu překlasifikovat na mnohočetný myelom s AL-amyloidózou. Tato klasifikační změna znamenala, že lze použít bortezomibu nebo lenalidomidu, jako u mnohočetného myelomu.
V únoru roku 2012 byla tedy zahájena chemoterapie bortezomib, doxorubicin a dexametazon (BDD) – bortezomib (Velcade) 1,3 mg/m2 i.v. + doxorubicin 9 mg/m2 i.v. + dexametazon 20 mg i.v. 1., 4., 8. a 15. den v 28denních cyklech.
Kombinovaná imunosupresivní léčba pokračovala po celou dobu chemoterapie beze změny, (cyklosporin + mykofenolát + prednison). Pacient absolvoval celkem 7 cyklů chemoterapie a pak následovalo přešetření aktivity nemoci.
Jak uvádí tab. 4, hodnoty volných lehkých řetězců byly opakovaně v normě, a imunofixační elektroforéza byla negativní jak v krvi, tak i v séru. V kostní dřeni bylo cytologicky 0 % plazmocytů a histologicky 2–3 % polyklonálních plazmocytů. Byly tak splněny biochemické i morfologické parametry kompletní remise. Pacient je nyní nadále sledován ve 2–3měsíčních intervalech. Pacient byl v prosinci roku 2012 již 28 měsíců po transplantaci srdce bez známek aktivity nemoci v dobrém klinickém stavu.
Tab. 4. Vývoj koncentrace volných lehkých řetězců imunoglobulinů, který odráží aktivitu nemoci a účinnost léčby a nálezy v kostní dřeni u pacienta č. 2. 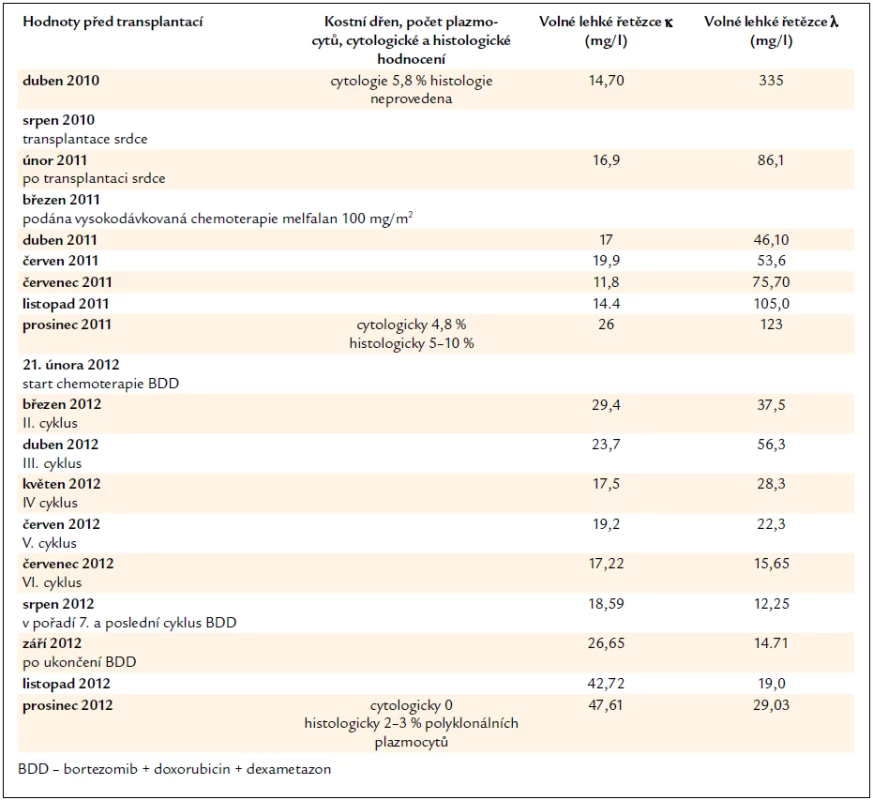
Žena, narozená roku 1949, pacientka č. 3
Žena, narozená roku 1949 (63 let), byla vyšetřována na III. interní klinice LF UP a FN Olomouc pro srdeční selhání s ejekční frakcí levé komory kolem 25 %. Byla nalezena monoklonální gamapatie a depozita AL-amyloidu. Při prvním vyšetření v Olomouci měla v histologickém hodnocení kostní dřeně 8–10 % plazmocytů s dominantní expresí volných lehkých řetězců λ. Vzhledem k typické nízké voltáži na EKG (obr. 4) a typickém echokardiografickém nálezu (obr. 5) bylo pojato podezření na AL-amyloidózu srdce.
Obr. 4. EKG – sinusový rytmus, výrazně nízká voltáž v končetinových svodech, obraz „pseudoinfarktu“ přední stěny (QS V<sub>1–3</sub>). 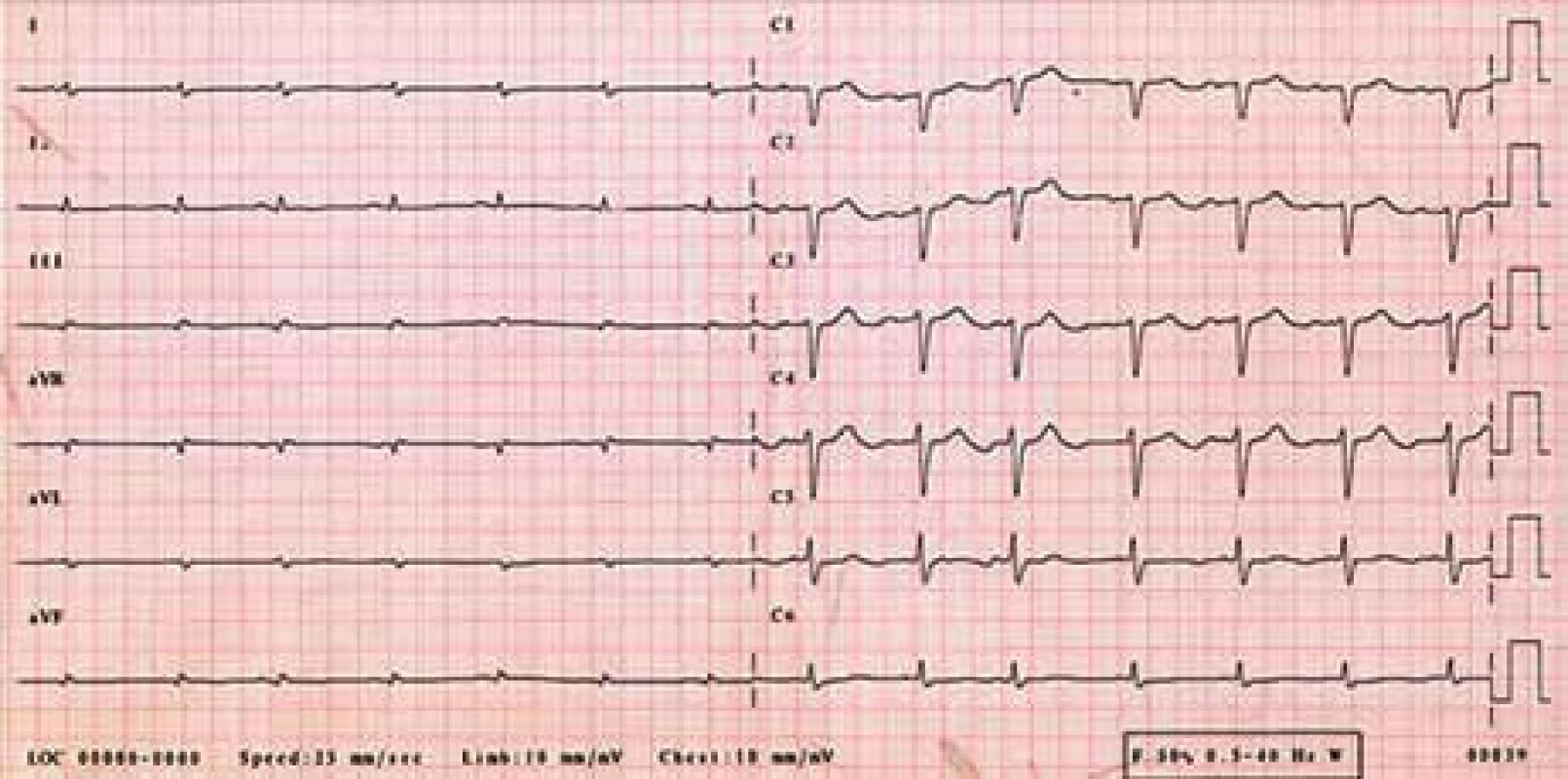
Obr. 5. Echokardiografické zobrazení srdce. Hypertrofie myokardu stěn levé komory a interventrikulárního septa při srdeční amyloidóze, obraz zrnitého myokardu – „granular sparkling“, B a M obraz v projekci PLAX (dlouhá parasternální osa), IVSd = 23,1 mm (šíře interventrikulárního septa v diastole). Poskytnuto MUDr. R. Metelkou, Ph.D., III. interní klinika LF UP a FN Olomouc. 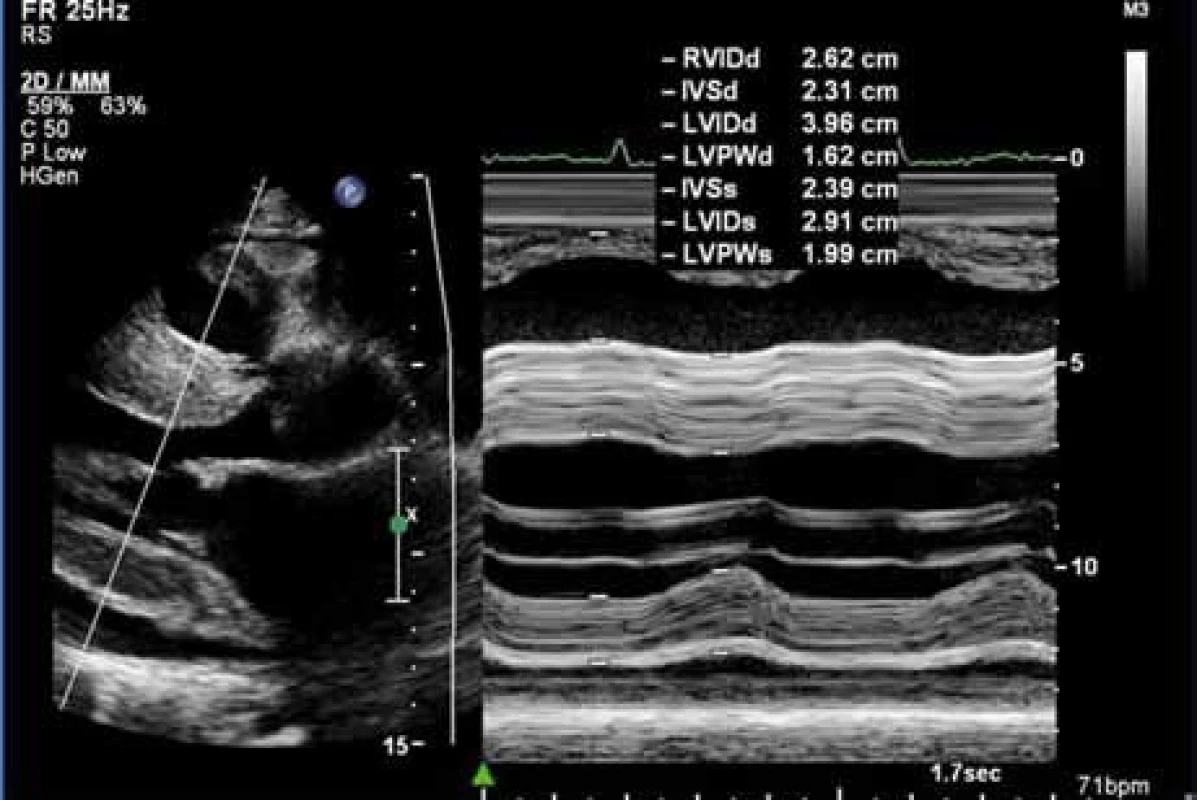
Pacientka byla odeslána k provedení endomyokardiální biopsie pro potvrzení srdeční amyloidózy na I. interní kardio-angiologickou kliniku LF MU a FN u sv. Anny v Brně. V lednu roku 2012 při vyšetření měla nízkou koncentrace volných lehkých řetězců κ, 7,6 mg/l, volné lehké řetězce λ dosahovaly koncentrace 104 mg/l, a při vyšetření imunofixační elektroforézou byl potvrzen monoklonální Ig λ v séru, v moči byl výsledek imunofixační elektroforézy negativní. Vzhledem k závažnému kardiálnímu postižení a absenci postižení dalších orgánů bylo v průběhu hospitalizace rozhodnuto o zařazení na čekací list pro transplantaci srdce. Ta byla provedena v květnu roku 2012. Histologické hodnocení explantovaného srdce prokázalo rozsáhlá depozita ve stěně arterií, v intersticiu, okolo pericytů.
Po transplantaci srdce pacientka dostávala obvyklou kombinovanou imunosupresivní léčbu (takrolimus, mykofenolát mofetil a prednison).
U pacientky jsme zvažovali léčbu vysokodávkovanou chemoterapií s autologní transplantací. Proto jsme v září roku 2012 provedli přešetření aktivity nemoci.
Příznivým překvapením bylo, že v kostní dřeni výrazně poklesl počet plazmatických buněk z původního počtu 8–10 % klonálních plazmocytů na 2–3 % polyklonálních plazmocytů a zároveň poklesla koncentrace volných lehkých řetězců λ na 19,56 mg/l. Imunofixační elektroforéza jak v séru, tak i v moči měla negativní výsledek.
Vzhledem k tomu, že vyšetření neprokázalo zvýšené množství amyloidogenních volných lehkých řetězců λ, bylo od léčby AL-amyloidózy zatím ustoupeno a u pacientky by měly být nadále sledovány koncentrace volných lehkých řetězců v séru a prováděna imunofixační elektroforéza v 2měsíčních intervalech.
Pacientka byla v prosinci roku 2012 již 7 měsíců od transplantace srdce bez známek recidivy amyloidózy. Základní data o této pacientce shrnuje tab. 5.
Tab. 5. Vývoj koncentrace volných lehkých řetězců imunoglobulinů, který odráží aktivitu nemoci a účinnost léčby a nálezy v kostní dřeni. U pacientky č. 3 došlo k normalizaci koncentrace volných lehkých řetězců v průběhu imunosupresivní léčby obsahující prednison. 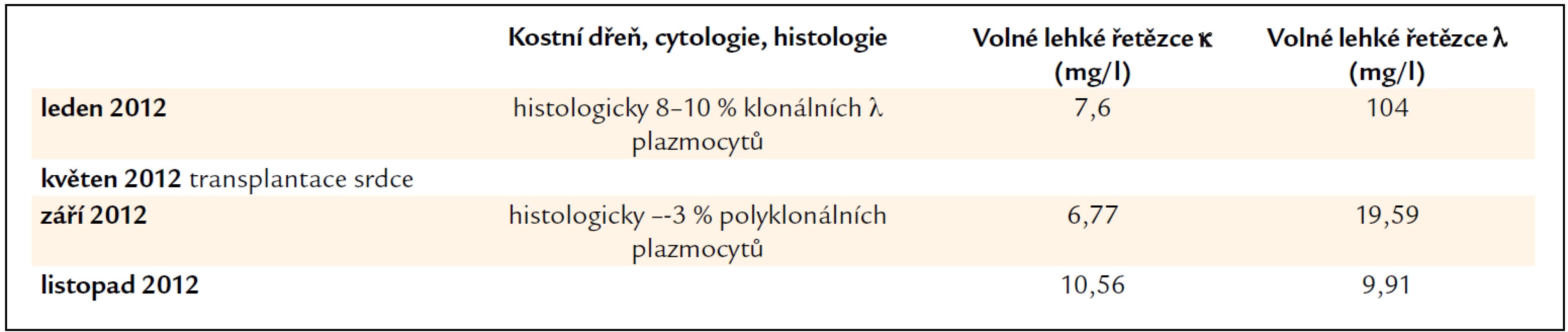
Diskuze
Nepříznivá prognóza pacientů s poškozením srdce
Prognóza pacientů s AL-amyloidózou je dána, stejně jako je tomu u všech onkologických chorob:
- rozsahem nemoci, tedy mírou pokročilostí poškození orgánů amyloidovými depozity,
- biologickými vlastnostmi maligních buněk.
Největší vliv na prognózu má poškození srdce. Proto četné práce dávají do souvislosti prognózu pacienta a funkci srdce dokumentovanou laboratorně či sonografickým a MR vyšetřením [12–16]. Tento fakt se odráží v analýzách jednotlivých prognostických faktorů a je zohledněn při tvorbě prognostických indexů. Pacienti, kteří mají poškozeny jiné orgány než srdce, žijí podstatně déle než pacienti s poškozením srdce. Pacienti s poškozením srdce mají opravdu jen velmi málo času na účinnou léčbu.
Míru poškození srdce lze vyjádřit pomocí echokardiografie, případně pomocí dalších zobrazovacích vyšetření, jejich výsledky však závisejí na přístroji a také na hodnotícím lékaři. Proto jsou pro rutinní praxi vhodnější standardizovaná biochemická vyšetření, která jsou dobře dostupná.
Nejnovější index byl stanoven analýzou v souboru 810 pacientů s nově stanovenou diagnózou AL-amyloidóza [14]. V multivariantní analýze byly jako nezávislé prognostické faktory prokázány následující:
- kardiální biomarker troponin-T (cTnT),
- kardiální biomarker N-terminální pro-B-typ natriuretického peptidu (NT-pro BNP),
- hodnota FLC, konkrétně diference mezi klonálním typem lehkého řetězce a neklonálním typem (FLC-diff).
Z těchto 3 faktorů bylo vytvořeno skóre 0–3 poměrně robustně odlišující 4 prognostické skupiny (p < 0,001), které je uvedeno v tab. 6.
Tab. 6. Prognostický skórovací systém pro všechny pacienty s AL-amyloidózou z roku 2012 [15] odráží skutečnost, že délka života všech pacientů s AL-amyloidózou je odvislá od míry poškození myokardu. Osoby, které mají poškozeny depozity AL-amyloidu jiné orgány než srdce, žijí podstatně déle než nemocní se závažným poškozením srdce. Míru poškození srdce lze dokumentovat i kvantifikovat pomocí zobrazovacích vyšetření, ale pro obecně platný prognostický index je vhodnější použít dobře dostupná a standardizovaná biochemická vyšetření troponinu-T (jako ukazatele poruchy integrity myocytu) a BNP (brain natriuretický peptid) jako humorálního ukazatele dysfunkce především levé komory. Třetím faktorem, od něhož se odvozuje prognóza, je výška koncentrace amyloidotvorných lehkých řetězců. Pro tento účel je použit rozdíl mezi koncentracemi volných lehkých řetězců κ a λ. Když je tento rozdíl větší než 180 mg/l, je to považováno za nepříznivý faktor. ![Prognostický skórovací systém pro všechny pacienty s AL-amyloidózou z roku 2012 [15] odráží skutečnost, že délka života všech pacientů s AL-amyloidózou je odvislá od míry poškození myokardu. Osoby, které mají poškozeny depozity AL-amyloidu jiné orgány než srdce, žijí podstatně déle než nemocní se závažným poškozením srdce. Míru poškození srdce lze dokumentovat i kvantifikovat pomocí zobrazovacích vyšetření, ale pro obecně platný prognostický index je vhodnější použít dobře dostupná a standardizovaná biochemická vyšetření troponinu-T (jako ukazatele poruchy integrity myocytu) a BNP (brain natriuretický peptid) jako humorálního ukazatele dysfunkce především levé komory. Třetím faktorem, od něhož se odvozuje prognóza, je výška koncentrace amyloidotvorných lehkých řetězců. Pro tento účel je použit rozdíl mezi koncentracemi volných lehkých řetězců κ a λ. Když je tento rozdíl větší než 180 mg/l, je to považováno za nepříznivý faktor.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/241b52bbf42ea6b50fc48a31bfd1f101.png)
V tab. 7 je uveden index založený pauze na měření hladiny troponinu a NT-pro BNP [15]. V našich poměrech lze použít místo NT-pro BNP hodnotu BNP.
Tab. 7. Prognostický index založený jenom na troponinu a NT-pro BNP (podle [16]). ![Prognostický index založený jenom na troponinu a NT-pro BNP (podle [16]).](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/1f9e0851c74ef1478b36c270c58c03fb.png)
Uvedením těchto prognostických klasifikací chceme zdůraznit, že pacienti se závažným poškozením srdce mají bez transplantace srdce velmi, ale opravdu velmi nepříznivou prognózu řádově v několika měsících. Naši tři pacienti také spadali do této nejméně příznivé skupiny a nebýt transplantace srdce, již by pravděpodobně nebyli mezi živými.
Transplantace srdce je však posunula do prognosticky příznivější kategorie a umožnila posléze podat účinnou léčbu potlačující tvorbu amyloidogenních volných lehkých řetězců. Jejich další prognóza bude záležet na tom, zda se dlouhodobě podaří potlačit tvorbu amyloidotvorných lehkých řetězců. Na druhé straně je třeba zdůraznit pečlivou selekci případných kandidátů srdeční transplantace zejména s ohledem na vyloučení multiorgánového poškození, které je pokládáno za kontraindikaci tohoto léčebného přístupu. A limitací je také biologický věk nemocného, adepti na tuto léčbu by měli být mladší 65 let.
Transplantace srdce umožní podat účinnou léčbu
Těžce poškozené srdce je kontraindikací vysokodávkované chemoterapie. Ale i konvenční léčba, obsahující vysoké dávky dexametazonu, která obvykle způsobuje retenci tekutin, nemusí být proveditelná při závažném poškození srdce. Podle našich zkušeností byla někdy léčba dexametazonem spojena se značnou retencí tekutin, která vedla až k plicnímu edému. V uvedených dávkách mají kortikoidy i přímý negativní vliv na srdce. Možnosti, jak potlačit tvorbu amyloidogenních volných lehkých řetězců, jsou u člověka s těžkým poškozením srdce velmi limitované.
Pokud jde o mladšího člověka a ostatní orgány nejsou kriticky poškozeny, je možné provést nejprve transplantaci srdce. Tím se výrazně zlepší celková zdatnost. Pak je možno použít vysokodávkovanou chemoterapii s podporou transplantace vlastních krvetvorných buněk s cílem eradikovat amyloidogenní klon plazmocytů.
Pro které nemocné připadá transplantace orgánu v úvahu?
V literatuře lze nalézt četné popisy menších skupin nemocných, které dokládají přínos provedení orgánové transplantace nejvíce poškozeného orgánu (tedy nejen srdce), následované léčbou amyloidózy [17–24]. Podstatné je, aby pacient byl v celkově dobrém stavu a měl amyloidózou závažně poškozen pouze jeden orgán, který je nahrazen orgánem transplantovaným. Zřejmě i do budoucna půjde o výjimečnou léčbu, její častější použití bude váznout nedostatkem vhodných lidských srdcí pro transplantační program. Z citované literatury je zřetelné, že upřednostnění transplantace srdce poškozeného amyloidem či jiného poškozeného orgánu představuje léčbu, která výrazně prodlužuje přežití.
Interval mezi transplantací srdce a zahájením léčby
Interval mezi transplantací srdce a zahájením léčby AL-amyloidózy musí být takový, aby bylo dokončeno hojení po operaci, neboť léčba AL-amyloidózy by hojící procesy zpomalovala. Z druhé strany interval mezi transplantací srdce a zahájením léčby AL-amyloidózy nesmí být tak dlouhý, aby darované srdce bylo poškozeno depozity amyloidu.
Kolegové z Heidelbergu, kde tento postup provádějí již více let, doporučují minimálně tříměsíční odstup vysokodávkované chemoterapie s autologní transplantací krvetvorných buněk od transplantace srdce. Provedení vysokodávkované chemoterapie doporučují v intervalu 3–6 měsíců po ortotopické transplantaci srdce [21]. A tak jsme stejný interval respektovali i u nás.
Úprava dávek imunosupresiv v průběhu sběru PBSC a vysokodávkované chemoterapie
Pacienti po transplantaci srdce jsou však na kombinované imunosupresivní léčbě a tato léčba může ovlivnit další kroky spojené se sběrem kmenových krvetvorných buněk a s obnovením krvetvorby po vysokodávkované chemoterapii a transplantaci těchto autologních kmenových buněk.
Proto jsme konzultovali prof. Hartmuta Goldschmidta z Centra pro léčbu amyloidózy v Heidelbergu (Německo), kde doporučují po dobu aplikace G-CSF (filgrastim, 5 µg/kg 2krát denně) přerušení podávání mykofenolátu (Cellceptu nebo Myforticu) s kompenzatorním zvýšením kortikoidů. Dále doporučují přerušení antivirotické profylaxe (valganciklovir) s cílem zmenšit myelotoxicitu podávané léčby.
V průběhu vysokodávkované chemoterapie doporučují opět přerušení podávání mykofenolátu a redukci dávek cyklosporinu tak, aby plazmatická hladina byla po dobu aplazie v rozmezí 150–200 µg/l, s případným navýšením kortikokoidů, a to až do vzestupu leukocytů nad 2,0 × 109/l. Antivirotickou profylaxi valganciklovirem také doporučují přerušit.
Z této obecné informace jsme vycházeli při úpravě dávek imunosupresiv u našich pacientů, tak jak to ilustrují tab. 1 a 3. Dávky imunosupresivních léků byly sníženy tak, abychom se vyhnuli jejich myelotoxickému působení a kompenzatorně byly zvýšeny dávky kortikoidů. Při této modifikaci imunosupresivní léčby nedošlo k žádné kardiální komplikaci a sběr kmenových krvetvorných buněk byl úspěšný, stejně tak i obnova krvetvorby po podání transplantátu.
Léčba AL-amyloidózy po transplantaci srdce
Vysokodávkovanou chemoterapii s transplantací autologních kmenových buněk jsme použili jako léčbu první linie, protože je stále považována v této indikaci za nejúčinnější léčbu s výbornými dlouhodobými výsledky. Pro vysokodávkovanou chemoterapii s autologní transplantací se používá melfalan v dávce 100–200 mg/m2.
U našich dvou pacientů jsme použili nižší dávku, jen 100 mg/m2, důvodem byly naše obavy z toxicity vyšší dávky, kdy může vzniknout mukozitida v trávicím traktu. A pokud by byl tento trakt poškozen depozity amyloidu, mohlo by dojít ke krvácení. Léčba však představuje vždy určitou zátěž pro srdce [25–29].
Nicméně, jak je vidět z popisů případů, ani u jednoho pacienta nevedla tato vysokodávkovaná chemoterapie ke kompletní remisi nemoci, čili k normalizaci hodnot volných lehkých řetězců imunoglobulinů v séru. Obecně je akceptován fakt, že melfalan v dávce 100 mg/m2 je méně účinný i méně toxický než melfalan v dávce 200 mg/m2. U obou pacientů musela po vysokodávkované chemoterapii následovat další léčba.
U obou jsme pro léčbu druhé linie zvolili chemoterapii obsahující bortezomib, protože podle současných zkušeností je to nejúčinnější lék pro tuto diagnózu. Leč pouze v jednom případě jsme dosáhli touto léčbou poklesu koncentrace volných lehkých řetězců λ na normální hodnoty a vymizení klonálních plazmocytů v kostní dřeni (kompletní remise). V druhém případě jsme museli podat léčbu třetí linie, kombinaci s lenalidomidem. Tato léčba vedla k zásadnímu poklesu hodnot volných lehkých řetězců, ale nevedla ještě k úplné normalizaci jejich hodnot. Poměr koncentrace volných lehkých řetězců κ/λ zůstává stále v oblasti patologie.
Zajímavé a překvapující je, že ve třetím případě se hodnoty volných lehkých řetězců v průběhu imunosupresivní léčby, obsahující vyšší dávky kortikoidů, dostaly do normálních hranic, takže tato pacientka je pouze sledována, ale po transplantaci srdce již nenásledovala léčba AL-amyloidózy.
Závěry pro praxi
- U mladších pacientů je vhodné při nejasné příčině selhávání srdce provést biopsii srdce a histologickým hodnocením pojmenovat nemoc, která selhání způsobila.
- U pacientů s AL-amyloidózou a závažným poškozením srdce lze v případě izolovaného nebo dominantního postižení srdce zvážit zařazení do transplantačního programu.
- Předřazení transplantace srdce před léčbu AL-amyloidózy umožní nemocnému absolvovat účinnou léčbou AL-amyloidózy, kterou by bez transplantace srdce nebyl schopen tolerovat. Tento postup vede k podstatnému prodloužení života pacientů s těžkým poškozením srdce depozity amyloidu.
- U každého nejasného poškození srdce či jiného orgánu by se měly vyšetřit koncentrace volných lehkých řetězců κ a λ a provést imunofixační elektroforézu séra, ale i moči. Při potvrzení monoklonálního imunoglobulinu je vhodné vyšetřit, zda se nejedná o poškození orgánů depozity volných lehkých řetězců ve formě amorfních hmot či ve formě amyloidových depozit.
Tato práce byla podpořena granty IGA Ministerstva zdravotnictví NT12215, NT12130 a NT13190 a dále podporováno Evropským fondem pro regionální rozvoj - projekt FNUSA ICRC CZ.1.05/1.1.00/2/0123, a také aktivitou označenou jako MUNI/A/0784/2012.
prof. MUDr. Zdeněk Adam, CSc.
www.fnbrno.cz
e-mail: z.adam@fnbrno.cz
Doručeno do redakce: 30. 11. 2012
Přijato po recenzi: 21. 1. 2013
Zdroje
1. Ščudla V, Pika T. Současné možnosti léčby systémové AL amyloidózy. Vnitř Lék 2009; 55: (Suppl. 1): 77–87.
2. Merlini G, Bellotti V. Molecular mechanisms of amyloidosis. N Engl J Med 2003; 349 : 583–596.
3. Abraham RS, Geyer SM, Price-Troska L et al. Immunoglobulin light chain variable (V) region genes influence clinical presentation and outcome of light chain-associated amyloidosis. Blood 2003; 101 : 3801–3808.
4. Comenzo RL, Zhang Y, Martinez C et al. The tropism of organ involvement in primary systemic amyloidosis: contributions of Ig VL germ line use and clonal plasma cell burden. Blood 2001; 98 : 714–720.
5. Bellotti V, Chiti F. Amyloidogenesis in its biological environment: challenging a fundamental issue in protein mis-folding diseases. Curr Opin Struct Biol 2008; 18 : 771–779.
6. Adam Z, Ščudla V. Klinické projevy a diagnostika AL-amyloidózy a některých dalších typů amyloidóz. Vnitř Lék 2001; 47 : 36–45.
7. Tichý M. Primární amyloidóza. Lék Zpr UK Hradec Králové 1999; 44 : 99–107.
8. Kroupa R, Dastych M, Šenkyřík M et al. Systémová amyloidóza s dominující klinickou manifestací v trávicím traktu. Vnitř Lék 2005; 51 : 588–592.
9. Ryšavá R. Amyloidóza ledvin. Postgrad Med 2006; 8 : 207–212.
10. Ryšavá R. Léčba paraproteinemické nefropatie a primární amyloidózy ledvin. Aktual v Nefrol 2005; 11 : 62–65.
11. Linhartová K, Daum O. Srdeční amyloidóza. Cor et Vasa, 2005; 47 : 328.
12. Kastritis E, Dimopoulos MA. Prognosis and risk assessment in AL amyloidosis – state of the art. Amyloid 2011; 18: (Suppl. 1): 84–86.
13. Mekinian A, Lions C, Leleu X et al. Amyloidosis Study Group. Prognosis assessment of cardiac involvement in systemic AL amyloidosis by magnetic resonance imaging. Am J Med 2010; 123 : 864–868.
14. Kristen AV, Giannitsis E, Lehrke S et al. Assessment of disease severity and outcome in patients with systemic light-chain amyloidosis by the high-sensitivity troponin T assay. Blood 2010; 116 : 2455–2461.
15. Kumar S, Dispenzieri A, Lacy MQ et al. Revised prognostic staging system for light chain amyloidosis incorporating cardiac biomarkers and serum free light chain measurements. J Clin Oncol 2012; 30 : 989–995.
16. Dispenzieri A, Gertz M, Kyle A et al. Serum cardiac troponins and N-terminal Pro-Brain Netriuretic Peptide: A staging system for primary AL--amyloidosis. J Clin Oncol 2004; 22 : 3751–3757.
17. Audard V, Matignon M, Weiss L et al. Successful long-term outcome of the first combined heart and kidney transplant in a patient with systemic Al amyloidosis. Am J Transplant 2009; 9 : 236–240.
18. Mignot A, Varnous S, Redonnet M et al. Heart transplantation in systemic (AL) amyloidosis: a retrospective study of eight French patients. Arch Cardiovasc Dis. 2008; 101 : 523–532.
19. Lacy MQ, Dispenzieri A, Hayman SR et al. Autologous stem cell transplant after heart transplant for light chain (Al) amyloid cardiomyopathy. J Heart Lung Transplant 2008; 27 : 823–829.
20. Mignot A, Bridoux F, Thierry A et al. Successful heart transplantation following melphalan plus dexamethasone therapy in systemic AL amyloidosis. Haematologica. 2008; 93: e32–e35.
21. Sack FU, Kristen A, Goldschmidt H et al. Treatment options for severe cardiac amyloidosis: heart transplantation combined with chemotherapy and stem cell transplantation for patients with AL-amyloidosis and heart and liver transplantation for patients with ATTR-amyloidosis. Eur J Cardiothorac Surg 2008; 33 : 257–262.
22. Perz JB, Kristen AV, Rahemtulla A et al. Long--term survival in a patient with AL amyloidosis after cardiac transplantation followed by autologous stem cell transplantation. Clin Res Cardiol 2006; 95 : 671–674.
23. Gillmore JD, Goodman HJ, Lachmann HJ et al. Sequential heart and autologous stem cell transplantation for systemic AL amyloidosis. Blood 2006; 107 : 1227–1229.
24. Dubrey SW, Burke MM, Hawkins PN et al. Cardiac transplantation for amyloid heart disease: the United Kingdom experience. J Heart Lung Transplant 2004; 23 : 1142–1153.
25. Jedlička F, Elbl L, Vášová I et al. Chronický fatigue syndrome u pacientů s nádorovou chorobou. Vnitř Lék 2007; 53 : 979–985.
26. Elbl L, Vášová I, Navrátil M et al. Srovnání plazmatických hladin B-natriuretic peptidu s echokardiografickými indikátory funkce levé komory po léčbě doxorubicinen. Vnitř Lék 2006; 52 : 563–570.
27. Elbl L, Vášová I, Krejcí M et al. Efekt vysokodávkované chemoterapie a následující transplantace krvetvorných buněk na funkci levého komory u pacientů s maligními lymfomy léčenými doxorubicinen. Vnitř Lék 2006; 52 : 221–231.
28. Elbl L. Poruchy kardiovaskulárního systému v průběhu léčby maligních chorob. Vnitř Lék 2002; 48 : 619–625.
29. Elbl L, Vášová I, Kiss I et al. Kardiotoxicita protinádorové léčby. Vnitř Lék 2000; 46 : 178–183.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2013 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Nech brouka žít… Ať žije astma!
- Intermitentní hladovění v prevenci a léčbě chorob
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Současné trendy v léčbě a dispenzarizaci pacientů s diferencovaným karcinomem štítné žlázy – zkušenosti s využitím rekombinantního humánního tyreotropinu
- Doporučené postupy a trendy v imunosupresivní léčbě glomerulonefritid podle KDIGO (Clinical Practice Guideline for Glomerulonephritis)
- Stanovisko výboru ČSAT k doporučením ESC/EAS pro diagnostiku a léčbu dyslipidemií z roku 2011
- Ischemická choroba dolních končetin a recidivující ileofemorální flebotrombóza u 24letého muže s antifosfolipidovým syndromem
- Synkopa ako prvý a jediný príznak myxómu ľavej predsiene
- Transplantace srdce a následná léčba AL-amyloidózy
- Role přímého inhibitoru trombinu mezi novými perorálními antikoagulancii
- Aortální regurgitace – editorial
- Současné trendy v léčbě a následné dispenzarizaci pacientů s diferencovaným karcinomem štítné žlázy – zkušenosti s využitím rekombinantního humánního tyreotropinu – editorial
- Představuje KDIGO Clinical practice Guideline for Glomerulonephritis přelom pro diagnostiku a léčbu glomerulonefritid? – editorial
- Srdeční myxomy – editorial
- Měnící se přístup k léčbě AL-amyloidózy – editorial
- Aortální regurgitace
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Aortální regurgitace
- Doporučené postupy a trendy v imunosupresivní léčbě glomerulonefritid podle KDIGO (Clinical Practice Guideline for Glomerulonephritis)
- Současné trendy v léčbě a dispenzarizaci pacientů s diferencovaným karcinomem štítné žlázy – zkušenosti s využitím rekombinantního humánního tyreotropinu
- Transplantace srdce a následná léčba AL-amyloidózy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



