-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Myelodysplastický syndrom – pokrok v léčbě v 21. století
Myelodysplastic syndromes – therapy progress over the last two decades
Myelodysplastic syndrome is one of the most common hematology diseases in the age over the 60. Until recently the therapy of this disease was frustrating and often based only on supportive care. The last decade witnessed the emergence of promising drugs that represent a major breakthrough in the therapy and interest of decoding of the pathogenesis of this disease. In our work we summarize the evolution of MDS therapy with accent on the new drugs contribution.
Key words:
myelodysplastic syndromes – classification – prognosis – therapy
Autoři: A. Jonášová
Působiště autorů: I. interní klinika – klinika hematologie 1. lékařské fakulty UK a VFN Praha, přednosta prof. MU Dr. Marek Trněný, CSc.
Vyšlo v časopise: Vnitř Lék 2013; 59(7): 635-640
Kategorie: 80. narozeniny prof. MUDr. Marie Brodanové, DrSc.
Souhrn
Myelodysplastický syndrom je jedno z nejčastějších hematologických onemocnění ve věku nad 60 let. Donedávna byla terapie tohoto onemocnění velice svízelná a často končící jenom podpůrnou léčbou. V poslední době se objevily nové nadějné preparáty, které znamenají velký průlom nejen v terapii MDS, ale i v zájmu o patogenezi tohoto onemocnění. V naší práci se věnujeme vývoji v terapii MDS a zvláště pak novým preparátům a jejich přínosu.
Klíčová slova:
myelodysplastický syndrom – klasifikace – prognóza – terapieMyelodysplastický syndrom (MDS) představuje heterogenní skupinu klonálních chorob hemopoetické kmenové buňky charakterizovaných inefektivní hemopoézou, periferní cytopenií, morfologickou dysplazií a nebezpečím transformace do akutní myeloidní leukemie (AML). MDS, zvláště v raných fázích, je vlastně premaligním (preleukemickým) onemocněním.
MDS bylo jako přesněji definovaný soubor klinických podjednotek charakterizováno a pojmenováno v roce 1982 FAB (French ‑ American ‑ British) skupinou autorů. Odtud také název první FAB klasifikace jednotlivých podskupin MDS [1]. Od té doby se postupně rozšiřoval zájem o toto relativně „mladé“ onemocnění mezi hematologickou komunitou. Hromadily se nové informace a blíže se specifikovaly jednotlivé podskupiny onemocnění s přesnějším určením prognózy a návrhu správné terapie. Tak vznikaly nové klasifikace WHO 2001, WHO 2008, která je dnes užívána nejčastěji (tab. 1, obr. 1) a skórovací systémy IPSS (international prognostic scoring system) (tab. 2), WPSS (WHO prognostic scoring system) a poslední revidovaný skórovací systém R ‑ IPSS [2 – 5]. Klasifikace a skórovací systémy dělí tuto chorobu do četných podskupin s velmi rozdílným průběhem a prognózou. Nejdůležitějšími prognostickými faktory jsou: hloubka cytopenie, procento myeloblastů ve dřeni a cytogenetický nález.
Tab. 1. WHO klasifikace 2008 (Wardiman et al. Blood 2009; 114: 937–951). 
Obr. 1. Vývoj klasifikace MDS. 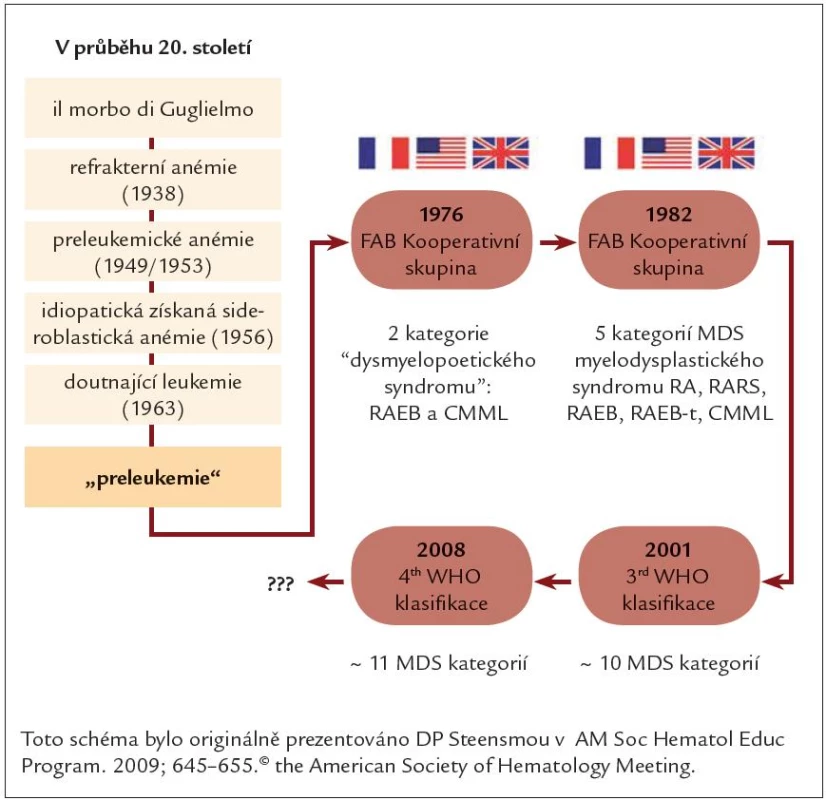
Se vzrůstajícím zájmem o MDS a lepší diagnostiku nemocných s nejasnými cytopeniemi se relativně zvyšovala také incidence onemocnění. U osob nad 60 let dosahuje 30 – 40// 100 000 (některá literární americká data uvádějí incidenci u populace nad 65 let až 75/ 100 000), což činí z MDS jednu z nejčastějších hematologických malignit v této věkové kategorii. MDS se s malou převahou vyskytuje častěji u mužů. Navzdory intenzivnímu výzkumu není etiologie onemocnění dosud objasněna. To se týká asi 80 % nemocných a onemocnění pak nazýváme primární MDS. U části nemocných je známa expozice toxickým látkám z prostředí, popřípadě onemocnění vzniká po předchozí chemoterapii či radioterapii pro jinou primární malignitu. Často se např. vyskytuje u nemocných, kteří podstoupili autologní transplantaci kmenových buněk. Tuto skupinu nazýváme sekundárním MDS. Charakteristickým znakem MDS jsou různé cytopenie, event. jejich kombinace a z nich plynoucí klinické komplikace. Většina, přes 90 % nemocných, má anémii, část nemocných má trombocytopenii a projevy krvácení, část neutropenii s možným rozvojem nejčastěji mykotických a bakteriálních infekcí. Hlavním znakem je dysplastická, většinou bohatá dřeň, která je právě v kontrastu s periferní cytopenií. Častý je výskyt početních chromozomálních aberací [5]. Příčinou úmrtí je asi u 30 – 40 % transformace do AML, u 40 % komplikace cytopenie a zbytek nemocných umírá na komorbidity, většinou též akcelerované přítomnou cytopenií.
I přes stálý intenzivní výzkum je MDS jednou z nejobtížněji řešitelných hematologických malignit. MDS je velice heterogenní choroba, u některých typů nemocní žijí dlouho a jejich prognóza je dobrá, v jiných případech se ale onemocnění může stát velmi zákeřným s rychlou progresí s pouze několikaměsíčním přežíváním. Proto i terapeutické přístupy musejí být orientované na jednotlivé podskupiny MDS. S ohledem na terapii nemocné dělíme na nižší a vyšší rizikové skupiny, pomáhá nám při tom skórovací systém IPSS (viz výše). Základní terapeutické možnosti jsou shrnuty v obr. 2. Hlavním cílem terapie nízce rizikových nemocných, t.j. nemocných s předpokládaným delším přežitím, lepší prognózou a menším rizikem transformace do AML, je zlepšení kvality život a prodloužení přežívání. Nemusíme usilovat, zvláště u starších nemocných, o eradikaci onemocnění. Zásadním problémem nízce rizikových nemocných je různě pokročilá cytopenie jedné či více hemopoetických řad a z ní plynoucí komplikace. Tímto směrem je též orientována léčba nízce rizikových nemocných.
Obr. 2. Základní terapeutické možnosti MDS – vývoj. 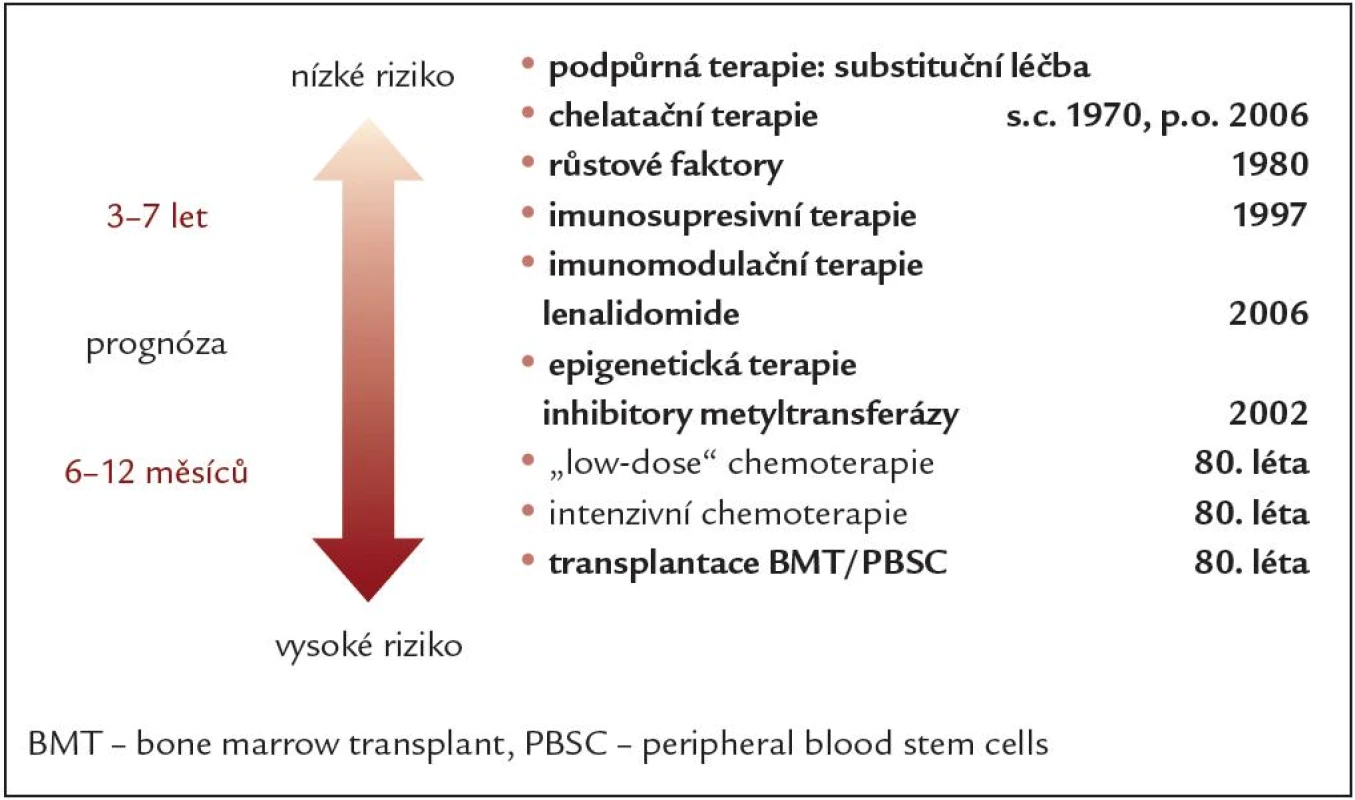
Vysoce rizikoví nemocní jsou ti, u kterých se objevila leukemická populace blastů. Terapie je proto vedle léčby cytopenií orientována na eradikaci patologického klonu buněk a prevenci transformace do AML. Našim hlavním cílem zvláště u mladších nemocných s MDS je dosažení kompletní remise.
Až do začátku 21. století byla terapie MDS na rozdíl od jiných hematologických chorob dosti frustrující, bez jediné terapie dosahující alespoň 50% odpovědi. U nízce rizikových nemocných vévodila podpůrná léčba. Ta samozřejmě stále hraje důležitou roli u cytopenických nemocných a sama o sobě znamenala oproti 80. letům minulého století, kdy bylo onemocnění definováno, velký pokrok. Dnes máme k dispozici velmi kvalitně připravované krevní preparáty a s vývojem nových účinných antibiotik a zvláště pak antimykotik můžeme lépe předcházet a léčit infekční komplikace. Asi 90 % nemocných má anémii a kolem 80 % dostává v průběhu svého onemocnění transfuze. Anémie je základním rysem onemocnění a bohužel většina nemocných se v průběhu svého onemocnění stane závislými na krevních převodech. Tito nemocní jsou ohroženi sekundární siderózou. Nadbytečné intracelulární Fe vede k tvorbě vysoce reaktivních hydroxylových radikálů, které mohou způsobit oxidativní poškození lipidů, proteinů, molekul DNA a vést až ke smrti buňky. Fe se hromadí v orgánech (srdce, játra, endokrinní orgány) s jejich následným poškozením vedoucím v některých případech až k selhání jejich funkcí. Přetížení Fe vede u MDS nemocných nejen ke snížení celkového přežití, ale i ke zhoršení výsledků u alogenních transplantací se zvýšenou peritransplantační mortalitou [6 – 8]. Přetížení železem brání chelatační terapie. Správnými kandidáty chelatační terapie jsou proto nemocní s nízkým rizikem, s ferritinem > 1 000 – 2 000 ng/ ml a event. kandidáti transplantace. Dlouhá léta byl k dispozici parenterální chelátor deferoxamin (Desferal), podával se v kontinuální subkutánní infuzi, vyžadující velkou trpělivost a spolupráci nemocného. V posledních letech se objevily nové a stejně účinné perorální chelátory. V ČR jsou k dispozici deferipron (Ferriprox) a deferasirox (Exjade). Nejčastěji je v současné době používán Exjade. Od 80. let minulého století patří k terapii nízce rizikových nemocných léčba růstovými faktory. Běžně používané jsou u nemocných se symptomatickou anémií erytropoézu stimulující látky. Sem patří především rekombinantní humánní erytropoetiny (Neorecornom, Eprex), pegylovaný erytropoetin s dlouhodobým efektem darbepoetin (Aranesp). Začátky používání erytropoetinů doprovázel relativně velký entuziasmus, nakonec ale velké studie ukázaly, že efekt je zřejmý jen zhruba kolem 20 % nemocných. V průběhu let se proto přesněji definoval okruh nemocných, kteří jsou ideálními kandidáty této terapie (s menší anémií, menší transfuzní dependencí a relativně nižší hladinou endogenního erytropoetinu), a navíc se ke zvýšení efektu začala používat kombinace erytropoetinů s růstovým faktorem bílé řady, a to G‑CSF (granulocyty stimulující faktor – Neupogen) pro jejich synergický antiapoptotický efekt [9 – 11]. Nyní zcela nově máme k dispozici levnější a pravděpodobně stejně dobře účinné „biosimilars“ (v případě červené řady je to u nás již používaný Binocrit). Posledními v řadě růstových faktorů, v současné době ve fázi ještě klinických studií, jsou dlouho očekávané trombopoézu stimulující látky. Do této skupiny léků patří u již autoimunní idiopatické trombocytopenie úspěšně používaný romiplostim (Nplate) a nový perorální preparát eltrombopag. Oba jsou trombopoetin‑mimetiky, stimulujícími trombopoetinový receptor. Mezi terapeutické možnosti nízce rizikových nemocných patří již od 90. let minulého století imunosupresivní léčba. V používání této terapie jsme přispěli i my jednou z prvních publikací popisujících úspěšnou léčbu MDS cyklosporinem v roce 1998 [12]. Používán je též antitymocytární globulin – ATG, stejně jako je tomu u aplastické anémie (AA) samostatně nebo v kombinaci s cyklosporinem [13]. Většinou je dosahováno odpovědi asi u 15 – 20 % pacientů [13,14]. Tato terapie je založena na teorii, že u určité skupiny nemocných s MDS autoimunní mechanizmus iniciovaný autoagresivními T buňkami, obdobně jako je tomu u aplastické anémie, může způsobit selhání hematopoézy či její poruchu [15,16]. Vhodnými kandidáty této terapie a podmínkami pro lepší odpověď jsou: nízce rizikoví nemocní zvláště s hypoplastickým MDS, mladší 60 let, krátce po stanovení diagnózy, nemocní s přidruženými autoimunitními onemocněními, HLA DR 15a PNH pozitivitou [17].
Nemocní s vyšším rizikem donedávna byli léčeni různými kombinacemi cytostatik více či méně obdobnými jako u terapie akutní myeloidní leukemie, či dle možností transplantací kostní dřeně. Bohužel MDS na rozdíl od jiných hematologických malignit je překvapivě rezistentní vůči standardní chemoterapii. Klasická chemoterapie byla v současné době vytěsněna v použití v širším měřítku demetylačními látkami. Chemoterapii u vysoce rizikových pacientů s MDS používáme dnes především v souvislosti s indikací k alogenní transplantaci, a to zvláště k redukci počtu blastů před transplantací. V tomto případě jde většinou o standardní chemoterapii jako u akutních myeloidních leukemií (založenou na použití cytosinarabinosidu). Samotná chemoterapie v průběhu let nezaznamenala u MDS žádný pokrok, nejsou nové lepší a účinnější preparáty.
U nemocných nad 65 let nebo nad 60 let s komorbiditami, ale ještě poměrně dobrým klinickým stavem, můžeme též zvolit klasickou terapii nízkými dávkami cytosinarabinosidu, a to v případě, nemáme‑li k dispozici demetylační látky. U starších pacientů a pacientů s významnými komorbiditami volíme buď monoterapii malými dávkami perorálních cytostatik, zvláště u nemocných s CMML, MDS/ MPS (hydroxycarbamid, mercaptopurin, melfalan), či pouze kvalitní podpůrnou léčbu.
Zatím jedinou kauzální terapií zůstává stále problematická alogenní transplantace kostní dřeně či dnes především periferních kmenových buněk (hemopoetic stem cell transplantation – HSCT), kterou vzhledem k věku toleruje jen malé procento nemocných. Transplantace je indikována pro nemocné mladší 60 let (individuálně 65 let) v dobrém celkovém stavu. Pokrokem, především s ohledem na starší populaci MDS nemocných, bylo zavedení transplantace s redukovaným přípravným režimem, který je méně toxický [18 – 20]. Problémem však je, že za cenu menších komplikací s ohledem k nižší dávce a toxicitě chemoterapie je sice snížena samotná transplantační mortalita, ale ještě stále zůstává dosti vysoké procento relapsů [21].
Čtyřletý odhad celkového přežívání po transplantaci u dospělé populace je zhruba 30 – 40 %.
Tato statistická data podtrhovala nezbytnost porozumění biologii MDS a v jeho důsledku rozšíření repertoáru „individualizované“ cílené biologické léčby.
Naštěstí se v posledních letech objevily pro obě skupiny, jak nemocné s nízkým, tak vysokým rizikem, nové terapeutické možnosti. Obě tyto nové skupiny léků znamenaly pro MDS doslova revoluci, a to nejen stran možností pro nemocné, ale i zájmem o tuto chorobu. Hrály proto i roli v intenzivnějším výzkumu patogeneze onemocnění. Jedná se o imunomodulační terapii a inhibitory metyltransferázy.
Imunomodulační terapie je zatím především terapií pro nemocné s nízkým rizikem, ale stále častěji se objevuje v kombinacích pro nemocné s vyšším rizikem.
Již léta prokazují mnohé studie, že dysregulace různých apoptotických, zánětlivých a angiogenních cytokinů může hrát důležitou roli v etiopatogenezi MDS. Imunomodulační terapie ovlivňuje hladiny těchto cytokinů, čímž působí na průběh, ne‑li na samotnou patogenezi onemocnění. Prvním preparátem použitým u MDS pacientů byl thalidomid, neblaze proslulý svým teratogenním efektem [22]. Důvodem jeho použití bylo zjištění, že tento lék má antiangiogennní vlastnosti, které pravděpodobně byly zodpovědné za jeho teratogenní efekt. U MDS je popisována větší vaskularizace dřeně. Výrazně lepší efekt má nový analog thalidomidu lenalidomid (Revlimide). Lenalidomid má efekt antiangiogenní, antiapoptotický, inhibuje TNF a, stimuluje T a NK buňky, produkci IL2, navíc pravděpodobně zvyšuje senzitivitu erytroidních progenitorů k erytropoetinu a možný je též přímý cytotoxický efekt na buňky patologického klonu. Výjimečný je jeho účinek zvláště u nemocných s delecí dlouhých ramének 5. chromozomu, zvláště 5q – syndromu. Delece dlouhého raménka 5. chromozomu je nejčastější cytogenetická abnormalita u MDS vyskytující se asi u 10 – 15 % nemocných. Na terapii lenalidomidem překvapivě dobře reagují i jiní MDS nemocní s touto chromozomální abnormalitou, a to jak izolovanou, tak v kombinaci s dalšími aberacemi. Právě pacienti s 5q – jsou často rezistentní na terapii ESP a většinou u nich nevyhnutelně dochází k rozvoji transfuzní dependence se všemi neblahými následky.
Lenalidomid vede u 60 – 70 % nemocných s 5q – aberací k erytrocytární odpovědi a transfuzní independenci s následnou dlouhodobou normalizací krevního obrazu [23,24]. Terapie vede též u asi 40 – 50 % nemocných ke kompletní cytogenetické odpovědi [24]. U nemocných s 5q – syndromem (starší ženy, 5q – izolovaná aberace, nízké procento blastů ve dřeni, normální či vyšší počet destiček) je dosahováno odpovědi až u 80 – 90 % nemocných (naše zkušenosti). Opatrnosti je třeba u nemocných s dalšími cytogenetickými aberacemi, zvýšeným počtem blastů a mutací p53, to jsou nemocní se zvýšeným rizikem časnější progrese choroby, a proto je u nich třeba zvážit agresivnější terapii [25]. U MDS nemocných bez 5q – aberace je nezávislosti na transfuzích dosahováno u zhruba 25 % [26]. Lenalidomid je relativně velmi dobře snášen, nejčastějšími vedlejšími účinky jsou neutropenie a trombocytopenie. Lenalidomid nezvyšuje u MDS v malých dávkách významně riziko trombóz, a tak zatím preventivní antitrombotická terapie není doporučována. Jde o perorální preparát, který se podává v jedné denní dávce.
Epigenetická terapie – demetylace. Epigenetická modulace zasahuje přímo do funkce genů, ovlivňuje genovou transkripci, a tím i expresi genů. DNA metylace je zprostředkována enzymem metyltransferázou. Pakliže dochází k hypermetylaci cytozinových reziduí v oblasti genového promotoru, dochází k poruše regulace transkripce genů a tím změně jejich exprese „gene silencing“. Inhibována může být exprese tumor supresorických genů a genů nezbytných pro normální regulaci proliferace, diferenciace a buněčné apoptózy [27 – 30]. Hypermetylaci DNA zabraňují 2 inhibitory metyltransferázy – 5 - azacitidin a 5 - aza ‑ 2’ - deoxycitidin (decitabin). U nás je povolen azacitidin (Vidaza). Zavedení tohoto preparátu do terapie MDS znamená relativně velký posun nejen v samotné terapii, ale i v poodhalování záhad samotné patogeneze MDS, kde se zdá, že epigenetická modulace hraje důležitou roli. Dnes se však s výzkumem funkce demetylačních preparátů objevují i jiné nové efekty těchto účinných léků, které pravděpodobně ovlivňují apoptózu, diferenciaci, diskutuje se i imunomodulační efekt. Cytostatický efekt azacitidinu byl popsán již v 60. letech minulého století, a to prvním naším vědcem Františkem Šormem (tehdy prezidentem Akademie věd a ředitelem Ústavu organické chemie a biochemie), který azacitidin syntetizoval.
Dnes již četné studie ukazují významný terapeutický efekt tohoto preparátu u všech skupin MDS nemocných [31 – 33]. Stěžejním výsledkem studií je dosažení významně delšího OS oproti dosud používané klasické terapii (podpůrná léčba, nízké dávky cytozin arabinosidu, intenzivní chemoterapie: 3 + 7 režim) u nemocných s MDS s vyšším rizikem [31,32]. Vedle toho se zdá, že azacitidin by mohl být používán v udržování kompletních remisí po standardní chemoterapii či alogenní transplantaci a v přípravách na transplantaci [34,35]. Specifický pro inhibitory metyltransferázy je jejich postupný a pozvolný nástup účinku, proto je účinek často patrný až po 4 – 6 cyklech terapie. Procento odpovědí stoupá s prodloužením terapie a efekt můžeme vidět i až po 8 a více cyklech [36].
Azacitidin je v současné době standardní terapií nemocných s vyšším rizikem dle IPSS a znamená pro tyto nemocné krok dopředu. Zvláště pro nemocné nad 65 let, kdy již transplantace může být diskutabilní a kdy velmi často pro současné komorbidity není možno podat standardní chemoterapii, která navíc měla u nemocných s vysokým rizikem (dle IPSS) stejně malé procento odpovědí. Velkou výhodou této terapie je možnost ambulantního podávání, únosné procento nežádoucích účinků, méně infekčních komplikací vyžadujících hospitalizaci a zvláště vysoké procento hematologických odpovědí, které jsou hlavním důvodem zkvalitnění života nemocných. Na cestě je též perorální forma tohoto preparátu. Nicméně i s touto terapií se stále pohybujeme kolem 50 % odpovědí a prodloužení života z 6 – 12 měsíců na 20 – 24 měsíců.
Je tedy stále ještě velký prostor pro nové léky. V klinických studiích fáze 1 či 2 je v současné době mnoho dalších preparátů, zatím není jasné, zda některý z nových preparátů povede k tak významnému zvýšení odpovědí či prodloužení přežívání jako 2 výše uvedené skupiny léků, nicméně jejich použití bude jistě v kombinacích právě s azacitidinem nebo lenalidomidem pro nemocné s nedostatečnou odpovědí. Do této skupiny patří např. nukleozidové analogy: sepacitabin, clofarabin, inhibitory kináz: Arry ‑ 614, ON1910 – rigosertib, Scio ‑ 649, Erlotinib, inhibitor TGF‑b (transforming growth facotr) sotatercept, protilátka neutralizující IL‑6 (interleukin 6) siltuximab, glutationový analog ezatiostat, aminopeptidázový inhibitor tosedostat a mnoho dalších.
Doufejme, že se v blízké budoucnosti dočkáme opět nové vlny dalšího zkvalitnění terapie pro nemocné s myelodysplastickým syndromem.
MU Dr. Anna Jonášová
www.vfn.cz
e‑mail: atjonas@hotmail.com; anna.jonasova@vfn.cz
Doručeno do redakce: 30. 4. 2013
Zdroje
1. Bennett JM, Catovsky D, Daniel MT et al. Proposals for the classification of the myelodysplastic syndromes. Br J Haematol 1982; 51 : 189 – 199.
2. Harris NL, Jaffe ES, Diebold J et al. World Health Organization classification of neoplastic diseases of the hematopoietic and lymphoid tissues: report of the Clinical Advisory Committee meeting ‑ Airlie House, Virginia, November 1997. J Clin Oncol 1999; 17 : 3835 – 3849.
3. Greenberg P, Cox C, LeBeau MM et al. International scoring system for evaluating prognosis in myelodysplastic syndromes. Blood 1997; 89 : 2079 – 2088. Erratum Blood 1998; 91 : 1100.
4. Greenberg PL, Tuechler H, Schanz J et al. Revised international prognostic scoring system for myelodysplastic syndromes. Blood 2012; 120 : 2454 – 2465.
5. Schanz J, Tüchler H, Solé F et al. New comprehensive cytogenetic scoring system for primary myelodysplastic syndromes (MDS) and oligoblastic acute myeloid leukemia after MDS derived from an international database merge. J Clin Oncol 2012; 30 : 820 – 829.
6. Armand P, Kim HT, Aleya EP et al. Prognostic impact of elevated pretransplantation serum ferritin in patients undergoing myeloablative stem cell transplantation. Blood 2007; 109 : 4586 – 4588.
7. Leitch HA, Wong D, Leger C et al. Improved leukemia‑free and overall survival in patients with myelodysplastic syndrome receiving iron chelation therapy: a subgroup analysis. Blood 2007; 110: abstract 1469.
8. Rose C, Brechignac S, Fenaux P et al. Positive impact of iron chelation therapy (CT) on survival in regularly transfused MDS patients. A prospective analysis by the GFM. Blood 2007; 110: Abstract 249.
9. Park S, Grabar S, Kelaidi C et al. GFM group (Groupe Francophone des Myélodysplasies). Predictive factors of response and survival in myelodysplastic syndrome treated with erythropoietin and G‑CSF: the GFM experience. Blood 2008; 111 : 574 – 582.
10. Hellström ‑ Lindberg E, Gulbrandsen N, Lindberg G et al. Scandinavian MDS Group. A validated decision model for treating the anaemia of myelodysplastic syndromes with erythropoietin + granulocyte colony ‑ stimulating factor: significant effects on quality of life. Br J Haematol 2003; 120 : 1037 – 1046.
11. Thompson JA, Gilliland DG, Prchal JT et al. Effect of recombinant human erythropoietin combined with granulocyte/ macrophage colony ‑ stimulating factor in the treatment of patients with myelodysplastic syndrome. GM/ EPO MDS Study Group. Blood 2000; 95 : 1175 – 1179.
12. Jonasova A, Neuwirtova R, Cermak J et al. Cyclosporin A therapy in hypoplastic MDS patients and certain refractory anaemias without hypoplastic bone marrow. Br J Haematol 1998; 100 : 304 – 309.
13. Killick SB, Mufti G, Cavenagh JD et al. A pilot study of antithymocyte globulin (ATG) in the treatment of patients with ‘low ‑ risk’ myelodysplasia. Br J Haematol 2003; 120 : 679 – 684.
14. Shimamoto T, Tohyama K, Okamoto T et al. Cyclosporin A therapy for patients with myelodysplastic syndrome: multicenter pilot studies in Japan. Leuk Res 2003; 27 : 783 – 788.
15. Molldrem JJ, Jiang YZ, Barrett AJ et al. Haematological response of patients with myelodysplastic syndrome to antithymocyte globulin is associated with a loss of lymphocyte ‑ mediated inhibition of CFU ‑ GM and alterations in T ‑ cell receptor Vbeta profiles. Br J Haematol 1998; 102 : 1314 – 1322.
16. Sloand EM, Mainwaring L, Barrett AJ et al. Preferential suppression of trisomy 8 compared with normal hematopoietic cell growth by autologous lymphocytes in patients with trisomy 8 myelodysplastic syndrome. Blood 2005; 106 : 841 – 851.
17. Barrett J, Sloand E, Young N. Determining which patients with myelodysplastic syndrome will respond to immunosuppressive treatment. Haematologica 2006; 91 : 583 – 584.
18. Lee SE, Kim YJ, Yahng SA et al. Survival benefits from reduced ‑ intensity conditioning in allogeneic stem cell transplantation for young lower ‑ risk MDS patients without significant comorbidities. Eur J Haematol 2011; 87 : 510 – 520.
19. Luger SM, Ringdén O, Zhang MJ et al. Similar outcomes using myeloablative vs reduced ‑ intensity allogeneic transplant preparative regimens for AML or MDS. Bone Marrow Transplant 2012; 47 : 203 – 211.
20. Lee SE, Lim J, Yahng SA et al. Reduced ‑ intensity conditioning regimen combined with low‑dose total body irradiation in the treatment of myelodysplastic syndrome. Acta Haematol 2011; 126 : 21 – 29.
21. Jabbour E, Mathisen MS, Garcia ‑ Manero Get al. Allogeneic hematopoietic stem cell transplantation versus hypomethylating agents in patients with myelodysplastic syndrome: a retrospective case ‑ control study. Am J Hematol 2013; 88 : 198 – 200.
22. Raza A, Meyer P, Dutt D et al. Thalidomide produces transfusion independence in long‑standing refractory anemias of patients with myelodysplastic syndromes. Blood 2001; 98 : 958 – 965.
23. List A, Dewald G, Raza A et al. Myelodysplastic Syndrome ‑ 003 Study Investigators. Lenalidomide in the myelodysplastic syndrome with chromosome 5q deletion. N Engl J Med 2006; 355 : 1456 – 1465.
24. Fenaux P, Giagounidis A, Selleslag D et al. MDS ‑ 004 Lenalidomide del5q Study Group. A randomized phase 3 study of lenalidomide versus placebo in RBC transfusion ‑ dependent patients with Low ‑ / Intermediate ‑ 1 - risk myelodysplastic syndromes with del5q. Blood 2011; 118 : 3765 – 3776.
25. Jädersten M, Saft L, Mufti GJ et al. TP53 mutations in low ‑ risk myelodysplastic syndromes with del(5q) predict disease progression. J Clin Oncol 2011; 29 : 1971 – 1979.
26. Raza A, Reeves JA, List AF et al. Phase 2 study of lenalidomide in transfusion ‑ dependent, low ‑ risk, and intermediate ‑ 1 risk myelodysplastic syndromes with karyotypes other than deletion 5q. Blood 2008; 111 : 86 – 93.
27. Hofmann WK, Takeuchi S, Takeuchi N et al. Comparative analysis of hypermethylation of cell cycle control and DNA ‑ mismatch repair genes in low ‑ density and CD34+ bone marrow cells from patients with myelodysplastic syndrome. Leuk Res 2006; 30 : 1347 – 1353.
28. Christiansen DH, Andersen MK, Pedersen ‑ Bjergaard J. Methylation of p15INK4B is common, is associated with deletion of genes on chromosome arm 7q and predicts a poor prognosis in therapy‑related myelodysplasia and acute myeloid leukemia. Leukemia 2003; 17 : 1813 – 1819.
29. Curik N, Burda P, Vargova K et al. 5 - azacitidine in aggressive myelodysplastic syndromes regulates chromatin structure at PU.1 gene and cell differentiation capacity. Leukemia 2012; 26 : 1804 – 1811.
30. Shin DY, Park YS, Yang K et al. Decitabine, a DNA methyltransferase inhibitor, induces apoptosis in human leukemia cells through intracellular reactive oxygen species generation. Int J Oncol 2012; 41 : 910 – 918.
31. Silverman LR, Demakos EP, Peterson BL et al.Randomized controlled trial of azacitidine in patients with the myelodysplastic syndrome: a study of the cancer and leukemia group B. J Clin Oncol 2002; 20 : 2429 – 2440.
32. Fenaux P, Mufti GJ, Hellstrom ‑ Lindberg E et al. International Vidaza High‑Risk MDS Survival Study Group. Efficacy of azacitidine compared with that of conventional care regimens in the treatment of higher ‑ risk myelodysplastic syndromes: a randomised, open ‑ label, phase III study. Lancet Oncol 2009; 10 : 223 – 232.
33. Itzykson R, Thépot S, Quesnel B et al. Groupe Francophone des Myelodysplasies (GFM). Prognostic factors for response and overall survival in 282 patients with higher ‑ risk myelodysplastic syndromes treated with azacitidine. Blood 2011; 117 : 403 – 411.
34. Grövdal M, Khan R, Aggerholm A et al. Maintenance treatment with azacitidine for patients with high‑risk myelodysplastic syndromes (MDS) or acute myeloid leukaemia following MDS in complete remission after intensive chemotherapy. Br J Haematol 2010; 150 : 293 – 302.
35. Damaj G, Duhamel A, Robin M et al. Impact of azacitidine before allogeneic stem ‑ cell transplantation for myelodysplastic syndromes: a study by the Societe Francaise de Greffe de Moelle et de Therapie ‑ Cellulaire and the Groupe ‑ Francophone des Myelodysplasies. J Clin Oncol 2012; 30 : 4533 – 4540.
36. Silverman LR, Fenaux P, Mufti GJ et al. Continued azacitidine therapy beyond time of first response improves quality of response in patients with higher ‑ risk myelodysplastic syndromes. Cancer 2011; 117 : 2697 – 2702.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Onemocnění jater u diabetikůČlánek Polypózy trávicího traktuČlánek Wilsonova chorobaČlánek Mnohočetný myelomČlánek Flavonoidy vážně i nevážně
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2013 Číslo 7- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- K významnému životnímu jubileu prof. MUDr. Marie Brodanové, DrSc.,
- K životnímu jubileu prof. MU Dr. Marie Brodanové, DrSc.
- Onemocnění jater u diabetiků
- Účinky GLP-1 (glucagon‑like peptide 1) na játra
- Polypózy trávicího traktu
- Vrozené hyperbilirubinemie a molekulární mechanizmy žloutenky
- Cystické nádory pankreatu – naše zkušenosti
- Wilsonova choroba
- Vliv jaterní cirhózy na farmakokinetiku a farmakodynamiku léčiv
- Katetrizace jaterních žil – vybrané aspekty hodnocení
- Reaktivace chronické hepatitidy B
- Akutní pankreatitida – novinky v léčbě
- Postižení jater u nemocných s ne-Hodgkinovým lymfomem
- Léčba chronické infekce virem hepatitidy C na začátku nové éry
- Vztah bilirubinu k nemocem vyvolaným zvýšeným oxidačním stresem
- Pokroky v onkohematologii v 21. století
- Inhibitory tyrozinových kináz – zásadní změna v prognóze chronické myeloidní leukemie
- Mnohočetný myelom
- Pokroky v léčbě chronické lymfocytární leukemie
- Myelodysplastický syndrom – pokrok v léčbě v 21. století
- Rifaximin v léčbě chronické divertikulózy
- Flavonoidy vážně i nevážně
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Vztah bilirubinu k nemocem vyvolaným zvýšeným oxidačním stresem
- Cystické nádory pankreatu – naše zkušenosti
- Onemocnění jater u diabetiků
- Akutní pankreatitida – novinky v léčbě
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




![IPSS [3].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/017630f38bc90dd00436243e4178051a.png)