-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Pomalidomid v léčbě mnohočetného myelomu – vlastní zkušenosti a přehled literatury
Pomalidomide in the treatment of multiple myeloma – own experience and overview of literature
In the Czech Republic, pomalidomide is covered for patients with multiple myeloma (in combination with dexamethasone), in the treatment of patients with relapsed and refractory multiple myeloma, who underwent at least 2 previous treatment schedules including both lenalidomide and bortezomibe, with disease progression despite the last therapy (i.e. during the therapy or within 60 days of its end), for whom the only remaining alternative of treatment (apart from pomalidomide) is that using high-dose dexamethasone, and who are not indicated for myeloablative treatment followed by a transplant of stem cells. At our centre pomalidomide was used in 53 patients at a median age of 66 years based on this indication. Pomalidomide was administered in 1 daily dose over 21 days in 28-day cycles. Considering the risk of thromboembolism occurring in this therapy, all patients were administered a prophylactic dose of low-molecular-weight heparin. No patient achieved complete remission (Czech Republic), 5 patients (9.4 %) achieved very good partial remission (VGPR), partial remission (PR) was achieved by 16 (30.2 %) patients, a minimum therapeutic response (MR) was recorded for 6 (11.3 %) patients. The median number of administered cycles was 4.4 (1–22). 16 (28.5 %) patients received treatment for more than 6 months. The overall survival median cannot be evaluated so far due to a short follow-up period. Nonetheless it was possible to evaluate a median time interval to progression (TTP) for the patients, which amounted to 7.0 (3.8–8.2) months. These results are consistent with large registration studies where therapeutic response (at least PR) is reached by 1/3 of the patients and medians of therapeutic response range between 7–10 months. Pomalidomide is a medicine with very good tolerance which is efficient in patients with a progressing multiple myeloma.
Key words:
lenalidomide – multiple myeloma – pomalidomide – thalidomide
Autoři: Zdeněk Adam 1; Luděk Pour 1; Marta Krejčí 1; Eva Vetešníková 1; Viera Sandecká 1; Martin Štork 1; Zdeňka Čermáková 2,3; Eva Pourová 4; Sabina Ševčíková 5; Zdeněk Král 1; Jiří Mayer 1
Působiště autorů: Interní hematologická a onkologická klinika LF MU a FN Brno, pracoviště Bohunice 1; Oddělení klinické biochemie FN Brno, pracoviště Bohunice 2; Katedra laboratorních metod LF MU, Brno 3; Ordinace praktického lékaře pro dospělé, Pustiměř 4; Ústav patologické fyziologie LF MU, Brno 5
Vyšlo v časopise: Vnitř Lék 2016; 62(12): 962-968
Kategorie: Původní práce
Souhrn
Pomalidomid je hrazen v ČR u pacientů s mnohočetným myelomem (v kombinaci s dexametazonem), při léčbě pacientů s relabovaným a refrakterním mnohočetným myelomem, kteří absolvovali alespoň 2 předchozí léčebná schémata zahrnující jak lenalidomid, tak bortezomib, s progresí onemocnění při poslední terapii (tj. během terapie nebo do 60 dnů od jejího ukončení), u kterých je jedinou další alternativou léčby (kromě pomalidomidu) léčba vysokodávkovaným dexametazonem a u kterých není indikována myeloablativní léčba s následnou transplantací krvetvorných buněk. Na našem pracovišti byl pomalidomid v této indikaci použit u 53 pacientů s mediánem věku 66 let. Pomalidomid byl podáván v 1 dávce denně po dobu 21 dnů v 28denních cyklech. Vzhledem k riziku tromboembolizmu při této léčbě byl všem pacientům podáván nízkomolekulární heparin v profylaktické dávce. Kompletní remise (CR) nebylo dosaženo u žádného pacienta, velmi dobré parciální remise (VGPR) dosáhlo 5 (9,4 %) pacientů, parciální remise (PR) dosáhlo 16 (30,2 %) pacientů, minimální léčebné odpovědi (MR) dosáhlo 6 (11,3 %) pacientů. Medián počtu podaných cyklů byl 4,4 (1–22). Více než 6 měsíců bylo léčeno 16 (28,5 %) nemocných. Pro krátkou dobu sledování nelze zatím hodnotit medián celkového přežití. U pacientů bylo ale možné vyhodnotit medián časového intervalu do progrese TTP, který byl 7,0 (3,8–8,2) měsíců. Tyto výsledky odpovídají velkým registračním studiím, v nichž léčebné odpovědi (alespoň PR) dosahuje třetina pacientů a mediány trvání léčebné odpovědi se pohybuji mezi 7–10 měsíci. Pomalidomid je lék s velmi dobrou tolerancí, který je účinný u pacientů s progredujícím mnohočetným myelomem.
Klíčová slova:
lenalidomid – mnohočetný myelom – pomalidomid – talidomidÚvod
Nové léky a nové léčebné postupy postupně zlepšují osudy nemocných s mnohočetným myelomem, zvyšují počty léčebných odpovědí, a to vede spolu s vývojem v oblasti podpůrné léčby k postupnému prodlužování celkového přežití [1,2].
V roce 1999 se objevily první zprávy o účinku talidomidu u mnohočetného myelomu. Na rozdíl od doposud používaných cytostatik, jejichž společný mechanizmus účinku je poškozování nukleových kyselin, talidomid svými mnohostrannými účinky zasahuje nejen do regulačních mechanizmů plazmocytů, ale i do regulačních mechanizmů celého organizmu. Jeho účinek je komplexní, proto je účinný i u jiných maligních chorob, např. u histiocytózy z Langerhansových chorob, ale i u nemaligních procesů, jako je Castlemanova choroba. Proto byla vytvořena nová léková kategorie, která byla nazvaná „imunomodulační léky“ (Immunomodulatory Drugs – IMIDs) [3]. Talidomid je stále široce používán v kombinaci s bortezomibem a dexametazonem v indukční léčbě pacientů s mnohočetným myelomem. Po průkazu antimyelomovému účinku talidomidu bylo zahájeno hledání nových derivátů s menšími nežádoucími účinky a lepší účinností.
V roce 2007 přišel do klinické praxe další IMID s generickým názvem lenalidomid a pod obchodním názvem Revlimid. Jeho neurotoxicita ve srovnání s talidomidem je minimální, ale zato má vyšší myelotoxicitu. Mírou rizika tromboembolizmu se od talidomidu signifikantně neliší [4,5]. Zatím posledním z této řady léků je pomalidomid, obchodním názvem Imnovid. Mechanizmus jeho účinku opět zahrnuje antiangiogenní, imunomodulační a přímý toxický účinek na myelomové buňky a opět ovlivnění mikroprostředí kostní dřeně. Pomalidomid by měl také snižovat aktivitu osteoklastů. Podobně jako u ostatních IMIDů je jeho účinek umožněn vazbou na protein cereblon. Pomalidomid je považován za nejúčinnější lék ze skupiny IMIDů. In vitro je asi 100krát účinnější než talidomid a 10krát účinnější než lenalidomid a funguje i u onemocnění rezistentních k talidomidu a lenalidomidu. Pomalidomid je velmi dobře tolerován, ale může způsobit aktivizaci hepatitidy, a proto je před jeho podáním vhodné zvážit vyšetření hepatitid. [6,7].
Pomalidomid byl registrován a je používán v USA od roku 2013. V České republice se dostal do klinické praxe před červnem 2015, kdy o něho bylo možné žádat na paragraf 16. Jeho častější používání umožnila až kategorizace (rozhodnutí) SÚKLU, platná od 30. 6. 2015, z jejíhož znění cituji: „Pomalidomid je v kombinaci s dexametazonem hrazen v léčbě dospělých pacientů s relabovaným a refrakterním mnohočetným myelomem, kteří absolvovali alespoň 2 předchozí léčebná schémata zahrnující jak lenalidomid, tak bortezomib s progresí onemocnění při poslední terapii (tj. během terapie nebo do 60 dnů od jejího ukončení) a u kterých je jedinou další alternativou léčby (kromě pomalidomidu) léčba vysokodávkovaným dexametazonem a u kterých není indikována myeloablativní léčba s následnou transplantací krvetvorných buněk. Zdůvodnění musí být uvedeno v dokumentaci pacienta. Ze zdravotního pojištění je hrazena léčba prováděná pouze 1 denní dávkou v odpovídající síle. Terapie je hrazena do progrese onemocnění nebo nepřijatelné toxicity.“
Uvedená kategorizace SÚKL tedy předurčuje tento lék opravdu jen pro pacienty s velmi špatnou prognózou, pro něž již neexistuje žádná dostupná alternativa. Vzhledem k tomu, že tato léčba má také nepřehlédnutelný ekonomický rozměr, v následujícím textu přinášíme vlastní zkušenosti a přehled klinických studií ověřujících účinek pomalidomidu.
Soubor pacientů
Od roku 2014 jsme na našem pracovišti léčili celkem 53 nemocných s mnohočetným myelomem, kteří splňovali indikace pomalidomidu. V roce 2014 byla léčba zahájena u 9 pacientů v rámci klinických studií, v roce 2015 byla léčba zahájena u 31 pacientů a do konce dubna roku 2016 byla tato léčba nově zahájena u 16 pacientů. Medián věku pacientů byl 66 (43–84) let. Ve všech případech se jednalo o nemocné, kteří již měli za sebou vyšší počet relapsů, a tedy i léčebných linií. Jde tedy o soubor s velmi nepříznivou prognózou. Medián počtu předchozích léčebných linií byl v tomto souboru 4 (1–9). Míru předléčenosti našich pacientů dokumentuje graf 1.
Graf 1. Linie léčby před podáním pomalidomidu 
Pomalidomid byl podáván u 40 (75 %) pacientů v kombinaci s dexametazonem, u 2 (3,8 %) byl použit v monoterapii a u 11 pacientů (20,8 %) byl použit v dalších kombinacích. U naprosté většiny pacientů (92,5%) byl použit v dávce 4 mg.
Pomalidomid byl podáván podobně jako lenalidomid 21 dnů v 28denních cyklech. Dexametazon byl podáván v klasickém dávkování jako v jiných režimech 20 mg nebo 40 mg celkem 8 dávek v průběhu 28denního léčebného cyklu. Spolu s dexametazonem byl podáván omeprazol. Vzhledem ke zvýšenému riziku tromboembolizmu při kombinaci IMIDu a kortikoidu byl podáván nízkomolekulární heparin v profylaktické dávce. Prevence pneumocystové pneumonie u těchto imunokompromitovaných nemocných zajištoval kotrimoxazol (Sumetrolim) v dávce 480 mg/den.
Definice léčebných odpovědí
Hodnocení kvality dosažených léčebných odpovědí je prováděno dle kritérií léčebných odpovědí International Myeloma Working Group. Dále jsou pro hodnocení efektu léčby použity následující časové pojmy.
Délka celkového přežití (overal survival – OS) je časový interval, který je definován v klinických studiích datem randomizace, mimo studie datem stanovení diagnózy či zahájením léčby, do úmrtí z jakékoliv (tedy i nemaligní) příčiny.
Progression-free survival – PFS je časový interval od data randomizace v rámci klinické studie (nebo mimo klinické studie od data zahájení léčby či od data stanovení diagnózy) do data prokázané progrese nemoci nebo do data, kdy pacient zemřel z jakékoliv (tedy i nemaligní) příčiny.
Časový interval (time to progression – TTP) je definován datem randomizace v klinické studii (nebo datem zahájením léčby při hodnocení mimo studii) do doby prokázané progrese. Termín TTP nezahrnuje tedy ty pacienty, kteří zemřeli z jiné příčiny, než je prokázaná progrese nemoci.
Bezpříznakové přežití (event-free survival – EFS) je interval od randomizace do progrese nemoci nebo smrti pacienta nebo přerušení léčby z jiné příčiny.
Trvání léčebné odpovědi (duration of response – DoR) je interval od data průkazu léčebné odpovědi do data progrese nemoci.
Výsledky léčby
Kompletní remise nebylo dosaženo u žádného pacienta, ale kritéria velmi dobré parciální remise (very good partial response – VGPR) splnilo 5 (9,4 %) pacientů, kritéria parciální remise (partial response – PR) splnilo 16 (30,2 %) pacientů, kritéria minimální léčebné (minimal response MR) odpovědi splnilo 6 (11,3 %) pacientů. Takže celkový počet dosažených léčených odpovědí (VGRP + PR) byl 21 (39,6 %). Pokud bereme v úvahu také MR a počet léčebných odpovědí definujeme jako součet CR + PR + MR, tak to bylo 27 (50,9 %), graf 2.
Graf 2. Maximální léčebná odpověď při léčbě pomalidomidem 
Medián počtu podaných cyklů byl 4,4 (1–22). Více než 6 měsíců bylo léčeno v našem souboru celkem 16 nemocných (28,5 %), graf 3. Podstatné je, že léčba byla a je velmi dobře tolerována (graf 4). Doba sledování našeho souboru je krátká, medián délky sledování je 4,7 měsíce, zatím nebylo dosaženo mediánu celkového přežití. Z intervalů, které již lze hodnotit, je důležitý medián časového intervalu do progrese (TTP), který je 7,0 (3,8–8,2) měsíců.
Graf 3. Doba léčby pomalidomidem 
Graf 4. Toxicita léčby obsahující pomalidomid 
Křivky celkového přežití a času do progrese od zahájení léčby v našem souboru ukazuje graf 5. Uvedená data z našeho souboru sumarizuje tab. 1.
Graf 5. Léčebné intervaly při léčba pomalidomidem 
Tab. 1. Statistická analýza 53 pacientů léčených na našem pracovišti od roku 2014 do května roku 2016 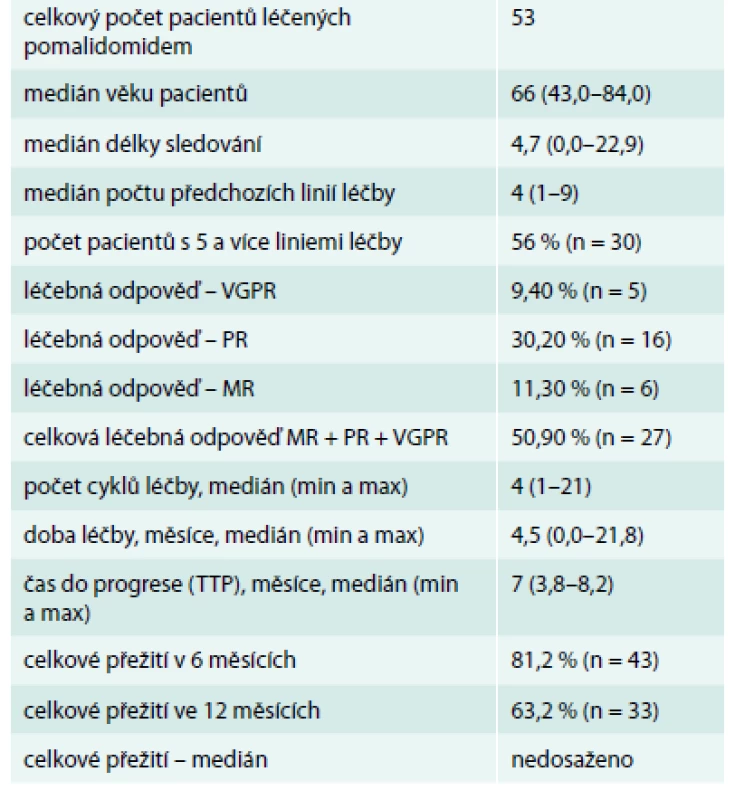
Diskuse
Z naší analýzy je zřetelné, že téměř třetina pacientů je takto léčena déle než 6 měsíců. To lze v této prognosticky nepříznivé skupině pacientů považovat za úspěch. Jinak výsledky léčby v našem souboru odpovídají nebo jsou dokonce v některých parametrech i lepší než v dalších publikovaných klinických studiích. Pomalidomid byl doposud zkoušen v klinických studiích s pacienty s nepříznivou prognózou a zatím nemáme žádné informace o účinnosti tohoto léku u dříve neléčeného onemocnění.
V pilotní klinické randomizované studii fáze 2 byl podáván pomalidomid s nebo bez dexametazonu. Do studie byli zařazováni pacienti, u nichž předcházela léčba IMIDy (lenalidomidem) a inhibitory proteazomu (bortezomibem nebo karfilzomibem). Do této klinické studie bylo zařazeno 38 pacientů.
Kombinace pomalidomidu a dexametazonu dosáhla u 3 % léčených kompletní remise (complete response – CR), u 18 % pacientů PR. Celkový počet léčebných odpovědí (PR + CR) byl 21 %. Pokud se připočetly i léčebné odpovědi hodnocené jako MR, pak se takto definovaný počet léčebných odpovědí (CR + PR + MR) zvýšil na 42 %. Medián trvání PFS (progressions free survival) a OS (overal survival) byl 4,6 a 18 měsíců [8]. Následovala klinická studie fáze 2 (MM-002). Do této klinické studie byli opět zařazováni pacienti, kteří absolvovali alespoň 2 předchozí léčebné linie, u nichž bych použit lenalidomid a bortezomib a u nichž došlo k další progresi nemoci do 60 dnů od ukončení poslední léčby. Pacienti byli randomizováni do skupiny léčené buď pouze pomalidomidem (4 mg, 21 dní v 28denním cyklu) nebo pomalidomidem a dexametazonem (40 mg 1krát týdně).
Do studie bylo zařazeno 221 pacientů. Medián počtu předchozích léčebných linií byl 5. Pomalidomid a dexametazon dostalo 113 pacientů, pomalidomid samotný 108 pacientů. Medián sledování byl 14,2 měsíce. Počet celkových léčebných odpovědí (overal response rate – ORR = CR + PR) byl 33 % (pomalidomid a dexametazon) a 18 % (pomalidomid v monoterapii). Medián bezpříznakového přežití (PFS) byl 4,2 měsíce ve skupině léčené pomalidomidem a dexametazonem a 2,7 měsíce ve skupině léčené pouze pomalidomidem. Medián trvání léčebných odpovědí (alespoň PR po dobu nejméně 6 týdnů) byl 8,3 měsíců (pomalidomid a dexametazon) a 10,7 měsíce (pouze pomalidomid). Medián celkového přežití (OS) byl 16,5 měsíce (pomalidomid a dexametazon) a 13,6 měsíců (jen pomalidomid). Neutropenie III.–IV. stupně se vyskytla u 41 % a 48 % nemocných [9].
Velká studie fáze 3 (MM-003) měla za cíl srovnat kombinaci pomalidomid + dexametazon s monoterapií dexametazonem. Pacienti užívající pomalidomid dostávali dexametazon 1krát týdně, zatímco skupina s dexametazonem v monoterapii jej dostávala častěji. Do studie byli zařazování pacienti refrakterní na lenalidomid i bortezomib, kteří byli na poslední léčbu rezistentní či relabovali do 60 dnů od ukončení předchozí léčebné linie. Populace byla tedy stejně definována jako ve výše citovaných studiích.
První skupina (302 pacientů) dostávala pomalidomid v dávce 4 mg 1.–21. den v 28denním cyklu + dexametazon 40 mg 1krát týdně. Druhá skupina (153 pacientů) měla pouze monoterapii dexametazonem 40 mg den 1.–4., 9.–12. a 17.–20. ve 28denním cyklu.
Léčba kombinací pomalidomidu a dexametazonu dosáhla CR u 3 %, VGPR u 5 % PR u 26 % a MR u 8 %. Léčba samotným dexametazonem nedosáhla žádné CR, PR dosáhla u 9 % a MR u 6 % pacientů. Medián dálky bezpříznakového přežití (PFS) s pomalidomidem a nízkou dávkou dexametazonu byla 4,0 měsíce, zatímco ve skupině léčené pouze dexametazonem jen 1,9 měsíce. Medián délky trvání léčebné odpovědi u pacientů s alespoň PR byl 7 (6–9) měsíců při léčbě pomalidomid a dexametazon a 6,1 (1,4–8,5) měsíce při monoterapii dexametazonem.
Tato studie byla publikována při mediánu sledování 10 měsíců, takže neudává délku celkového přežití. Po prokázání signifikantního prodloužení PFS ve skupině s pomalidomidem byla léčba pozměněna tak, že pomalidomid začali podávat i pacientům ve skupině s monoterapií dexametazonem. Toto překřížení bude později interferovat s hodnocením celkového přežití [10].
V rámci francouzské studie byl srovnáván pomalidomid podávaný denně, neboli 28 dní v 28denním cyklu (41 pacientů), s pomalidomidem podávaným jen 21 dní v 28denním cyklu (43 pacientů). Obě dvě skupiny dostávaly k tomu dexametazon 1krát týdně. Podmínkou k zařazení byl relaps alespoň po jedné předchozí léčebné linii. Medián počtu předchozích linií byl 5.
Počet léčebných odpovědí (alespoň PR) byl podobný v obou větvích 35 % a 34 %.
Medián trvání léčebné odpovědi byl 7,3 měsíce, medián bezpříznakového přežití (PFS) byl 4,6 měsíců. Medián celkového přežití byl 14,9 měsíce a 44 % pacientů žilo 18 měsíců od zahájení léčby [11].
Naše a publikované výsledky shrnuje tab. 2.
Tab. 2. Srovnání vlastních a publikovaných výsledků léčby pomalidomidem u pacientů, kteří již absolvovali léčbu bortezomibem i revlimidem a u nichž nemoc relabuje do 60 dnů od ukončení poslední linie léčby 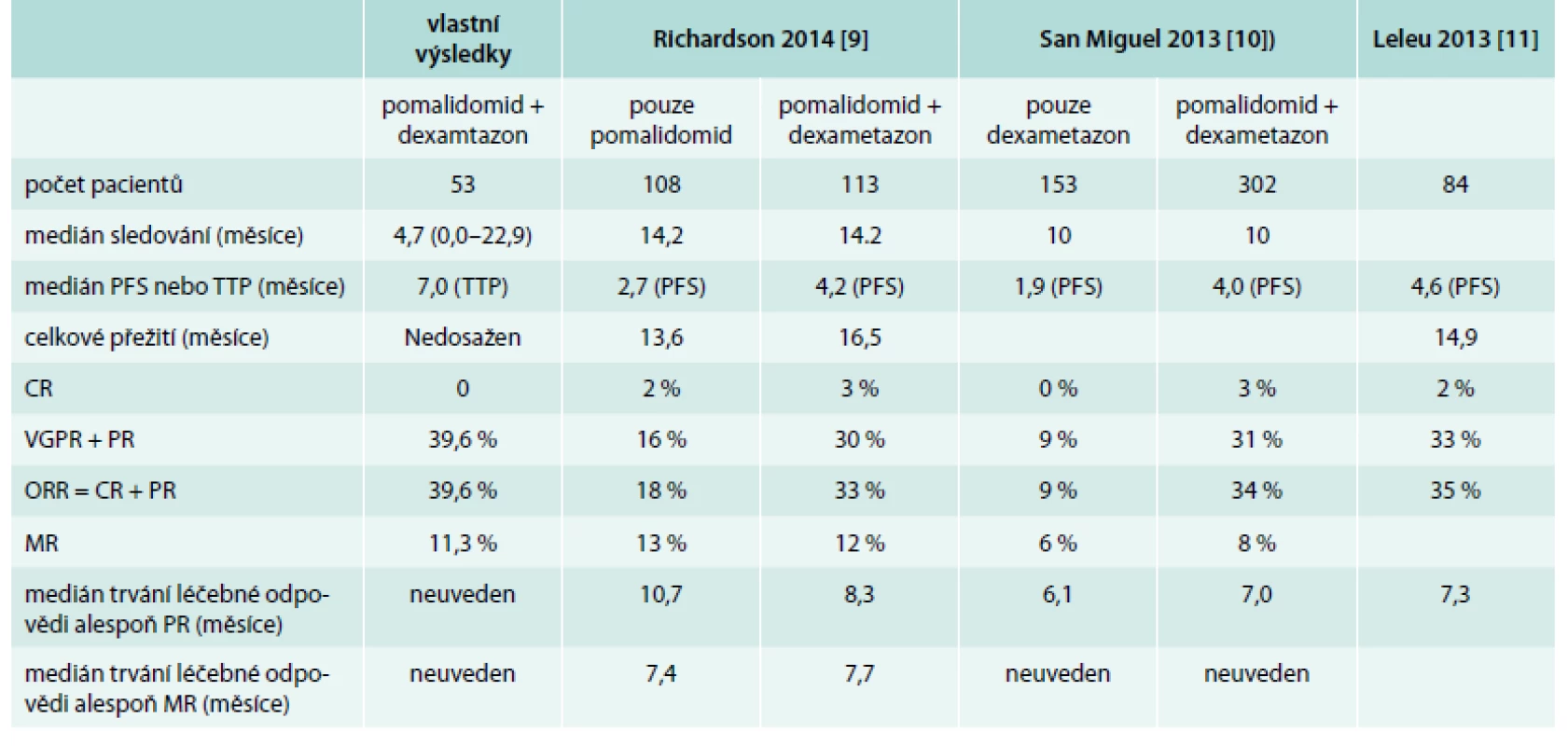
Závěr pro praxi
Naše zkušenosti a všechny studie prokázaly dobrou toleranci pomalidomidu. Dle publikovaných klinických studií je účinnost kombinace pomalidomidu s dexametazonem vyšší než u monoterapie dexametazonem. Standardní dávkování je 4 mg 1krát denně po dobu 21 dní a 7 dní pauza, délka cyklu je 28 dní. Dexametazon se podává v nízkých dávkách 20–40 mg 1krát týdně. Tento režim je indikován do progrese onemocnění. Pomalidomid má z imunomodulačních léků nejlepší profil toxicity. Není potřeba redukovat dávku u nemocných s renální insuficiencí. Mezi nejběžnější nežádoucí účinky patří hematologická toxicita, která zpravidla nebývá pro podávání léku limitující. Mohou se vyskytnout infekční komplikace a trombotické komplikace, pro které je nutné podávat antikoagulancia po celou dobu léčby.
U pacientů již dříve léčených bortezomibem a lenalidomidem s časnou recidivou po ukončené léčbě dosahuje tento lék léčebné odpovědi (alespoň parciální remise) u třetiny pacientů. Medián délky těchto léčebných odpovědí se pohyboval v našem souboru a v citovaných klinických studiích mezi 6–10 měsíci [12]. Jedná se tedy o účinný a dobře tolerovaný lék vhodný pro terapii progredující či rezistentní formy mnohočetného myelomu.
prof. MUDr. Zdeněk Adam, CSc.
zdenek.adam@fnbrno.czz
Interní hematologická a onkologická klinika LF MU a FN Brno,
pracoviště Bohunice
www.fnbrno.cz
Doručeno do redakce 20. 7. 2016
Přijato po recenzi 22. 8. 2016
Zdroje
1. Ščudla V, Bačovský J, Indrák K et al. Results of therapy and changing prognosis of multiple myeloma during the last 40 years in the region of North and Middle Moravia: group of 562 patients. Hematol J 2003; 4(5): 351–357.
2. Ščudla V, Bačovský J, Indrák K et al. Výsledky léčby a změny prognózy u pacientů s mnohočetným myelomem za posledních 40 let ve střední a severní Moravě. Vnitř Lék 2002; 48(8): 707–717.
3. Singhal S, Mehta J, Desican R et al. Antitumor activity of thalidomide in refractory multiple myeloma. N Engl J Med 1999; 341(21): 1565–1571.
4. Weber D, Chen Ch, Niesvitzky R et al. Lenalidomide plus Dexamethasone for Relapsed Multiple Myeloma in North America. N Engl J Med 2007; 357(21): 2133–2142.
5. Dimopoulos M, Spencer A, Attal M et al. Lenalidomide plus Dexamethasone for Relapsed of Refractory Multiple Myeloms. N Engl J Med 2007; 357(21): 2123–2132.
6. Zhu YX, Kortuem KM, Stewart AK. Molecular mechanism of action of immune-modulatory drugs thalidomide, lenalidomide and pomalidomide in multiple myeloma. Leuk Lymphoma 2013; 54(4): 683–687. Dostupné z DOI: <http://dx.doi.org/10.3109/10428194.2012.728597>.
7. McCurdy AR, Lacy MQ. Pomalidomide and its clinical potential for relapsed or refractory multiple myeloma: an update for the hematologist. Ther Adv Hematol 2013; 4(3): 211–216. Dostupné z DOI: <http://dx.doi.org/10.1177/2040620713480155>.
8. Richardson PG, Siegel D, Baz R et al. Phase 1 study of pomalidomide MTD, safety, and efficacy in patients with refractory multiple myeloma who have received lenalidomide and bortezomib. Blood 2013; 121(11): 1961–1967. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2012–08–450742>.
9. Richardson PG, Siegel DS, Vij R et al. Pomalidomide alone or in combination with low-dose dexamethasone in relapsed and refractory multiple myeloma: a randomized phase 2 study. Blood 2014; 123(12): 1826–1832. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2013–11–538835>. Erratum in Blood 2014; 123(20): 3208–3209.
10. San Miguel J, Weisel K, Moreau P et al. Pomalidomide plus low-dose dexamethasone versus high-dose dexamethasone alone for patients with relapsed and refractory multiple myeloma (MM-003): a randomised, open-label, phase 3 trial. Lancet Oncol 2013; 14(11): 1055–1066. Dostupné z DOI: <http://dx.doi.org/10.1016/S1470–2045(13)70380–2>.
11. Leleu X, Attal M, Arnulf B et al. Pomalidomide plus low-dose dexamethasone is active and well tolerated in bortezomib and lenalidomide-refractory multiple myeloma: Intergroupe Francophone du Myelome 2009–2002. Blood 2013; 121(11): 1968–1975. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2012–09–452375>.
12. Dimopoulos MA, Leleu X, Palumbo A et al. Expert panel consensus statement on the optimal use of pomalidomide in relapsed and refractory multiple myeloma. Leukemia 2014; 28(8): 1573–1585. Dostupné z DOI: <http://dx.doi.org/10.1038/leu.2014.60>.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2016 Číslo 12- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Von Hippelov-Lindauov syndróm – dve strany jednej mince
- Nová fixní kombinace tiotropium a olodaterol – její role v léčbě chronické obstrukční plicní nemoci v České republice
- Takotsubo syndrom: incidence, etiologie, komplikace, léčba a prognóza
- Letální případy krvácení do horní části gastrointestinálního traktu
- Společné stanovisko českých odborných společností ke konsenzu European Atherosclerosis Society a European Federation of Clinical Chemistry and Laboratory Medicine k vyšetřování krevních lipidů a k interpretaci jejich hodnot
- Odešel doc. MUDr. Karel Janků, CSc.
- Nefrologie je prostě amazing!
-
XIV. slovenské obezitologické dni s medzinárodnou účasťou
Nové pohľady na komplexný manažment pacienta s obezitou (2. časť) - Správa z XXI. kongresu Slovenskej kardiologickej spoločnosti
- Korespondence ke článku
- Milan Kolář. Respirační infekce a jejich léčba
-
Martina Vašáková, Jaroslav Polák, Radoslav Matěj.
Intersticiální plicní procesy -
Vítězslav Kolek, Iva Vágnerová a kol.
Kapesní průvodce ambulantní léčbou respiračních infekcí - Vítězslav Kolek a kol. Doporučené postupy v pneumologii
-
Aleš Linhart, Tomáš Paleček.
Echokardiografie u nemocných s plicní hypertenzí -
Jiří Widimský, Jiří Widimský jr.
Farmakoterapie hypertenze - Trombofilie – editorial
- Takotsubo kardiomyopatie – další pokračování příběhu – editorial
- Pomalidomid v léčbě mnohočetného myelomu – vlastní zkušenosti a přehled literatury
- Došlo v posledním desetiletí ke změně počtu a charakteristik pacientů se syndromem diabetické nohy hospitalizovaných k vysoké amputaci na specializovaném podiatrickém pracovišti?
- Přínos magnetické rezonance pro diagnostiku kardiomyopatií a myokarditidy (2. část)
- Trombofília
- Káva ako hepatoprotektívny faktor
- Perorální antidiabetika v léčbě diabetes mellitus 1. typu
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Trombofília
- Káva ako hepatoprotektívny faktor
- Perorální antidiabetika v léčbě diabetes mellitus 1. typu
- Takotsubo syndrom: incidence, etiologie, komplikace, léčba a prognóza
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



