-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Léčba levotyroxinem – faktory ovlivňující její úspěšnost
Levothyroxine therapy – factors influencing its outcome
The article gives an overview of the circumstances–eating habits, disorders of absorption in the intestinal and other disease, certain drugs and substances occurring in nature affecting the metabolism of thyroid hormones on many levels, thyroid disruptors, for which compensation may be healing broken thyroid function to be unsatisfactory in spite of following the rules of substitution treatment. Knowledge of these conditions and adapting to them timely by adjusting either the eating habits or thyroid hormone by adjusting benefits, allowing the patient to improve his subjective feelings from treatment and improving compliance.
Key words:
absorption – biological availability – compliance – levothyroxine therapy – drug interactions – nutritional habits – thyroid disruptors
Autoři: Marcela Dvořáková
Působiště autorů: Endokrinologický ústav, Praha
Vyšlo v časopise: Vnitř Lék 2016; 62(Suppl 3): 50-55
Kategorie: Přehledné referáty
Souhrn
Tyreopatie zaujímají jedno z předních míst mezi endokrinopatiemi. Tyreoidální hormony patří nejen u nás, ale i celosvětově k nejčastěji předepisovaným lékům. Podmínkou optimalizace léčby je znalost mechanizmů ovlivňujících vstřebání léku a jeho další využití v organizmu. Článek uvádí přehled okolností – stravovací návyky, poruchy vstřebání u střevních a jiných onemocnění, některé léky a v přírodě se vyskytující látky zasahující do metabolizmu tyreoidálních hormonů na mnoha úrovních, tzv. tyreoidální disruptory, při kterých může být léčebná kompenzace porušené funkce štítné žlázy neuspokojivá i přes dodržení pravidel substituční léčby. Znalost těchto stavů a přizpůsobení se jim včasnou úpravou buď stravovacích návyků nebo úpravou dávek tyreoidálních hormonů umožní pacientovi zlepšení jeho subjektivních pocitů z léčby a zlepšení kompliance.
Klíčová slova:
absorpce – biologická dostupnost – kompliance – léčba levotyroxinem – lékové interakce – nutriční zvyklosti – tyreoidální disruptoryÚvod
Léčba tyreoidálními hormony je velmi rozšířená, není drahá a zdá se být i jednoduchá. Převážná většina pacientů reaguje na substituční léčbu příznivě normalizací klinické odpovědi a normálními hladinami TSH (tyreoideu stimulující hormon) a fT4 (free tyroxin/volný tetrajodtyronin). Přesto u některých pacientů může být kompenzace funkce štítné žlázy problematická tím, že vyžaduje ještě vyšší než doporučovanou dávku. Levotyroxin se podává jednou denně a jeho dávka je nastavena v závislosti na typu onemocnění štítné žlázy tak, aby bylo dosaženo uspokojivé klinické odpovědi ze strany pacienta a současně bylo dosaženo optimálních laboratorních parametrů TSH a fT4 odpovídající příslušným referenčním mezím. Doporučovaná denní dávka levotyroxinu u hypofunkce štítné žlázy je 1,1–1,6 μg/kg/den. Vyšší dávka se doporučuje po operacích štítné žlázy pro diferencovaný karcinom s cílem dosažení suprese TSH pod 0,2 mIU/l, ale může být spojena s riziky iatrogenní hypertyreózy (arytmie, osteoporóza).
U difuzních strum s cílem dosažení regrese volumu je vhodná kombinace s jodem a léčba by při chybění efektu neměla být delší než 6 měsíců. Podávání levotyroxinu u polynodózních strum je problematické, ale tato medikace se zkouší i v případě izohormonální terapie u autoimunitních tyreopatií, jejímž principem je snížení autoimunitní aktivity podáváním malých dávek tyreoidálních hormonů k oddálení vzniku hypofunkce a zachování funkční reziduální kapacity štítné žlázy [1,2]. Klinický efekt není bezpečně ověřený, přesto byl experimentálně prokázán [3].
Kromě přesné znalosti důvodu podávání levotyroxinu se taktika léčby liší podle věku. U dětí, mladistvých a gravidních žen je fyziologicky potřeba dávky levotyroxinu vyšší, u seniorů je iniciální dávka nižší a pomalu se zvyšuje. Celková dávka k dosažení optimální saturace je závislá na věku, nezávisí na pohlaví, ale stoupá s tělesnou hmotností, přičemž zvýšené požadavky na dodávku levotyroxinu jsou více vztažené ke svalové hmotě než k celkové tělesné hmotnosti [4].
Příčiny zvýšených dávek levotyroxinu při substituční léčbě tyreoidálními hormony
- nedostatečná dávka (změna v chování pacienta, špatná kompliance)
- odpovídající léčba: dětství, adolescence, gravidita, obezita
- lékové interakce
- přidružené choroby
- polymorfizmus dejodázy 2. typu
- polymorfizmus transportérů tyreoidálních hormonů
Asvold et al [5] ve studii u více než 27 000 Norů bez předchozího tyreoidálního onemocnění, prokázali, že snížená funkce štítné žlázy byla sdružena spíše s vyšším BMI než s celkovou hmotností. Byly předloženy 2 hypotézy vysvětlující vztah funkce štítné žlázy a tělesné hmotnosti. První se týká vlivu leptinu a jiných adipokinů na tělesnou hmotnost a je podporována následujícími fakty – vysoké hladiny TSH se u obézních sníží po snížení jejich hmotnosti v důsledku redukční diety [6–8], u pacientů s mentální anorexií po nárůstu hmotnosti stoupá funkce štítné žlázy [9]. Podle druhé hypotézy může nízká funkce štítné žlázy vést k obezitě pravděpodobně redukcí bazálního metabolizmu [10]. Léčba subklinické hypotyreózy dosud není sjednocena, obvykle se doporučuje její zahájení při hodnotách TSH > 10 mIU/l. Je ovšem také třeba zvážit poruchy lipidového metabolizmu a klinické příznaky hypotyreózy.
Různá potřeba dávky levotyroxinu je spojena též s hormonálním stavem. Jonklaas zjistila u 50 pacientů po tyreoidektomii, že dávka levotyroxinu, která může normalizovat hladinu TSH, je u mužů i žen v průměru 1,7 µg/kg, ale premenopauzální ženy měly vyšší potřebu dávky než postmenopauzální ženy a než muži [11].
Kompliance k léčbě
Příčiny jsou většinou prozaické. Nejčastější příčinou častého zvyšování dávky levotyroxinu ze strany pacienta je špatný přístup k léčbě. Výchova, individuální přístup k pacientovi a zdůvodnění nutnosti užívání léčiva jsou důležité články pro zvládnutí všech chronických asymptomatických nebo oligosymptomatických nemocí, jako je např. diabetes, hypertenze a jiné nemoci, u kterých nejsou fyzické symptomy bezprostředně přítomny.
Poločas tyroxinu je dlouhý, krátkodobé vynechání dávky levotyroxinu se projeví na hladině tyreoidálních hormonů a TSH až za několik dní, jeho ojedinělé vynechání při laboratorních kontrolách se nemusí vůbec projevit.
Kompliance je vyšší u žen, u pacientů vyššího socioekonomického postavení a u mladých jedinců s malou zátěží přidružených onemocnění.
Další příčinou neuspokojivé kompenzace snížené funkce štítné žlázy může být rozdílná biologická dostupnost mezi jednotlivými preparáty levotyroxinu [12]. Všechny preparáty levotyroxinu dovážené do České republiky (Euthyrox, Letrox) jsou originální s ochrannou známkou. Přesto se mohou i ty vzájemně lišit v biologické dostupnosti. Výměna preparátu za jiný při stejné dávce v 1 tabletě může u pacienta vést k zvýraznění klinických známek hypotyreózy, hladina fT4 se může změnit až o 20 %. Z těchto důvodů se změny firemních preparátů nedoporučují, není-li ke změně závažný důvod. V případě změny preparátu je žádoucí, aby byl pacient upozorněn na přítomnost možných subjektivních potíží, změny klinického stavu (palpitace, únava) a na změny v laboratorních nálezech. Kontrola klinického stavu pacienta včetně laboratorního stanovení TSH, fT4 a ev. dalších parametrů by měla být provedena nejpozději za 4–6 týdnů po změně preparátu.
V roce 2007 došlo k přehodnocení kritérií FDA (Food and Drug Administration) z roku 1997 a jejich zpřísnění na obsah levotyroxinu v 1 tabletě na 95–105 % požadované síly tabletky z původních 90–110 %.
Za ekvivalentní k originálnímu levotyroxinu je považován generický levotyroxin, přesto při srovnávání biologické dostupnosti originálního a generického levotyroxinu vydaly ATA (American Thyroid Association) a AACE (American Association of Clinical Endocrinologists) společné prohlášení vyjadřující obavy o metodologii stanovující normy biologické dostupnosti u generického levotyroxinu a možného poškození pacientů [13]. Významný cenový rozdíl mezi originálními preparáty a generickými výrobky je rizikem v preferenci volby lékaře i pacienta mezi originálním a generickým levotyroxinem. Do České republiky se zatím generické preparáty levotyroxinu nedovážejí.
Nemoci ovlivňující absorpci levotyroxinu
Při špatné kompenzaci léčby je mimo předchozích situací nezbytné zvážení dalších faktorů, kterými jsou přidružená onemocnění, současně užívané léky z jiných indikací a stravovací návyky, u nichž by mohlo dojít ke zhoršení absorpce levotyroxinu nebo jeho účinnosti (tab. 1).
Tab. 1. Příčiny zhoršené absorpce levotyroxinu 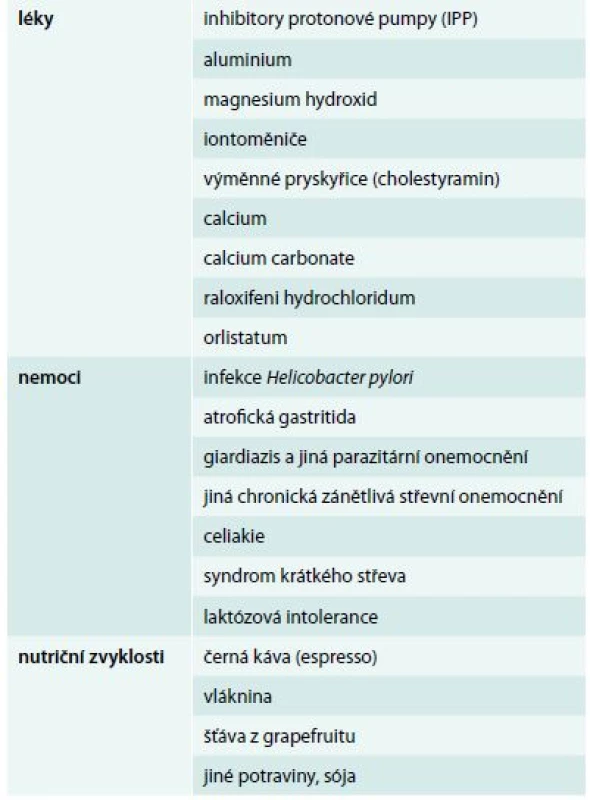
Po polknutí tabletky levotyroxinu se z dostupné dávky vstřebá přibližně 82 % dávky. Stupeň vstřebání je snížený u hypotyreózních pacientů [14]. K vstřebání dochází během prvních 3 hod, nejvíce v horních částech tenkého střeva (21 % v duodenu, 45 % v jejunu a 34 % v ileu). K maximálnímu vstřebávání dochází při prázdném žaludku, což podtrhuje význam žaludeční kyselosti v procesu absorpce [15,16].
Všechny formy zhoršené žaludeční acidity dospělých pacientů s chronickou atrofickou gastritidou a přidruženou infekcí Helicobacter pylori mají těžkou hypochlorhydrii a zvyšuje se u nich požadavek na denní příjem tyroxinu [17]. Centanni et al léčili tyroxinem 248 pacientů s polynodózní strumou s cílem redukovat velikost strumy nebo minimalizovat její další růst [18]. Dávku progresivně zvyšovali, dokud nebylo dosaženo suprese TSH (0,05–0,2 mIU/l). Ve skupině bylo 113 pacientů s polynodózní strumou a zhoršenou sekrecí žaludeční kyseliny. 53 pacientů mělo neatrofickou gastritidu vyvolanou Helicobacter pylori a 63 pacientů mělo gastritidu atrofickou. Autoři pozorovali, že pacienti s atrofickou gastritidou vyžadovali zvýšení dávky tyroxinu o 27 %, zatímco pacienti s neatrofickou gastritidou vyvolanou Helicobacter pylori vyžadovali zvýšení jen o 22 %. Zajímavé bylo, že pacienti se současným průkazem Helicobacter pylori a atrofickou gastritidou již potřebovali zvýšení denní dávky tyroxinu o 34 %.
I když je klinický význam těchto nálezů jasný, mechanizmus, kterým je střevní absorpce tyroxinu zhoršená, je neznámý. Můžeme pouze spekulovat, že perorálně podaný tyroxin ve formě sodné soli je méně lipofilní než přírodní hormon vstupující do cílových buněk pasivní difuzí a ve vazbě na přenašeče dochází k zpomalení absorpce [19]. Z tohoto hlediska achlorhydrie způsobená atrofickou gastritidou [20] a produkce amoniaku, charakteristického pro infekci Helicobacter pylori, nebo obojím, mohou pozměnit stav iontů a strukturální znaky tyroxinové molekuly, a tím schopnost střevní absorpce hormonu [21,22]. Mnoho jedinců s atrofickou gastritidou a přítomnými protilátkami proti parietálním buňkám má současně infekci způsobenou Helicobacter pylori. Hladiny TSH měřené před a po eradikaci infekce Helicobacter pylori ukazují zřetelný vliv infekce na zhoršení absorpce tyroxinu, jak prokázali Centanni [14] a Lahner [23]. Při infekci Helicobacter pylori je produkována ureáza neutralizující kyselé pH žaludku, která zhoršuje vstřebatelnost i mnoha jiných léků [24]. U dalších 10 pacientů s polynodózní strumou a gastroezofageálním refluxem léčených jak tyroxinem, tak omeprazolem, byla hodnocena hladina TSH před a po léčbě. Omeprazol měl vliv na zvýšení TSH pravděpodobně způsobením následné hypochlorhydrie, stejně jako všechny inhibitory protonové pumpy [17,24].
Na infekci Helicobacter pylori a hypochlorhydrii by se mělo pomýšlet v případě preskripce léků, jejichž absorpce je potencionálně ovlivněna intragastrickým pH.
Atrofická gastritida, celiakie a jiné autoimunitní choroby včetně zánětlivých onemocnění tenkého střeva jsou často spojené s autoimunitní tyreoiditidou [25,26] – hlavní příčinou hypotyreózy u dospělých pacientů a dalšími autoimunitními onemocněními sdružených do autoimunitních polyglandulárních syndromů [27].
Celiakie může mít mírné nebo subklinické příznaky. McDerrmot popsal případ rezistentní hypotyreózy jako jediné manifestace tohoto onemocnění [28]. Bariatrická operace a všechny chirurgické výkony, po nichž dochází k redukci povrchu absorpce v gastrointestinálním traktu, mohou též zhoršovat střevní absorpci levotyroxinu [29]. Seppel popsal těžký případ hypotyreózy zapříčiněné giardiázou ve střevě [30]. Jiné případy malabsorpce zahrnují laktózovou intoleranci [31].
Zvláštní pozornost zasluhují pacienti s kardiovaskulárními chorobami současně léčení tyreoidálními hormony. Existuje u nich obava z možných nežádoucích účinků tyreoidálních hormonů. Vysoké dávky levotyroxinu mohou zvýšením požadavků na dodávku kyslíku způsobit srdeční ischemii a arytmii spazmem koronárních arterií, a to i v tom případě, že není přítomno závažné onemocnění koronárních arterií [32]. Z těchto důvodů je u pacientů s kardiovaskulárním onemocněním úvodní denní dávka levotyroxinu velmi malá: 12,5 µg. Zvyšování dávky musí být vždy velmi pomalé a dlouhodobé s tendencí udržovat pacienta ve stavu mírné subklinické hypotyreózy. Experimentální data ukazují, že tyreoidální hormony zlepšují funkce myokardu, zvyšují průtok kapilárami a po prodělaném infarktu myokardu indukují angiogenezi. Ve skutečnosti podání tyreoidálních hormonů vykazuje inotropní a antiarytmické vlastnosti, snižuje riziko úmrtí po některých stavech jako městnavé srdeční selhání [33], transplantace srdce [34,35], koronární bypass [36], kardiopulmonální bypass [37], ischemie myokardu [38] a protrahovaná závažná netyreoidální onemocnění [39]. Proto je důležité zaměřit se na věk pacienta v rámci normálního rozmezí TSH, zvláště má-li pacient kardiovaskulární onemocnění. Městnavé srdeční selhání je spojeno se zhoršenou permeabilitou a absorpcí z trávicího traktu [40].
Léky ovlivňující absorpci levotyroxinu a lékové interakce
Z léků zhoršujících absorpci tyroxinu (tab. 1) jsou v popředí kromě již dříve uvedených inhibitorů protonové pumpy často užívaná antacida, soli železa užívané k léčbě sideropenické anémie, soli kalcia, stejně jako léky interferující s činností gastrointestinální lipázy v gastrointestinálním traktu [41]. Z jiných ne příliš často užívaných léků jsou to výměnné pryskyřice ke snížení hladiny cholesterolu.
Kromě výše uvedených léků, které zapříčiňují zhoršenou absorpci tyroxinu, to jsou léky, které interagují s tyroxinem. Jde např. o léky, které zvyšují jaterní metabolizmus a jsou příčinou hypotyreózy (karbamazepin, hydantoináty, fenobarbital, rifampicin). Léky snižující sekreci tyreoidálních hormonů (aminoglutetimid, amiodaron, jodid zahrnující a jod obsahující kontrastní radiofarmaka, lithium, metimazol, propyltiouracil, sulfonamidy, tolbutamid). Dále jde o léky, které zvyšují koncentraci globulinu vázajícího tyroxin (TBG thyroxine-binding globulin): tedy estrogeny, klofibráty, heroin, metadon, mitotan, tamoxifen, a ty, které koncentraci TBG snižují: tedy androgeny, anabolické steroidy, glukokortikoidy, kyselina nikotinová, aspargináza. Jiné léky nahrazují vazebná místa proteinů (furosemid v dávce > 80 mg i.v., heparin, hydantoináty, nesteroidní protizánětlivé léky). Další interferují s léčbou tyroxinem (antidiabetika: biguanidy, meglitimidy, sulfonylurea, tiazolidiny, inzulin; antidepresiva: bicyklická, tetracyklická, SSRI – serotonin re-uptake inhibitors – inhibitory zpětného vychytávání serotoninu, sertralin; růstový hormon; perorální antikoagulancia; cytokiny: interferon α, IL2; ketaminy, sympatomimetika, kardiální glykozidy, chlorhydrát, diazepam, etionamid, lovastatin, metoklopramid, 6-merkaptopurin, nitroprusid, kyselina para-aminosalycilová, perfenazin, resorcinol, tiazidová diuretika). Některé substance mohou být mezi sebou ve vzájemné shodě např. amiodaron a jodid mohou být příčinou jak hypotyreózy, tak i hypertyreózy. Amiodaron je velmi široce užívané antiarytmikum využívané v kardiologii. Jde o derivovaný benzosulfan bohatý na jod s některými strukturálními podobnostmi s tyroxinem, obsahuje přibližně 37 % vázaného hmotnostního jodu. Každá 200mg tableta amiodaronu obsahuje 75 mg organického jodu, z něhož je 8–17 % uvolňováno jako volný jod. Standardní udržovací terapie 200 mg amiodaronu zajišťuje více než 100násobnou denní potřebu jodu a může mít široké spektrum účinků na štítnou žlázu [42,43]. Může též snižovat aktivitu dejodázy. Propranolol, dexametazon a propyltiouracyl mohou snižovat T3, hladina T4 je obvykle normální nebo může být lehce zvýšená. U pacientů léčených zvýšenými dávkami propranololu > 160 mg/den se hladiny T3 a T4 mění pomalu, TSH zůstává v normě a pacienti jsou klinicky eutyreoidní. Krátkodobé podání vysokých dávek glukokortikoidů může vést k poklesu hladin T3 a k minimálním změnám hladin T4, dlouhodobá terapie glukokortikoidy může mít za následek lehce snížené hladiny T3 a T4 způsobené poklesem tvorby TBG. Hladinu TSH zvyšuje i metformin indikovaný u diabetiků 2. typu [44].
Stravovací návyky
Pro kontrolu hypotyreózních pacientů je velmi důležitá znalost jejich stravovacích návyků (tab. 1). Většina aktivních komponent v tabletě tyroxinu je absorbována během prvních 20–30 min po polknutí tablety, ačkoli kompletní absorpce trvá 3 hod. Pacientům je doporučováno užívání léku ráno na lačno s minimálně 30minutovým intervalem před snídaní a lék zapíjet vodou. Benvenga prokázal výrazně sníženou absorpci tyroxinu, pokud se spolknutý lék ráno zapije černou kávou, zvláště espressem. Ale pokud se šálek espressa vypije až za 60 min po požití levotyroxinu, křivka vstřebatelnosti levotyroxinu je stejná jako při požití léku nalačno a zapitého vodou. Posunutí snídaně o 60 min po spolknutí levotyroxinu vykazuje stejný charakter křivky vstřebatelnosti. Hladiny TSH byly stabilní [45]. Grapefruitový a ostatní citrusové džusy mohou vstřebání tyroxinu zhoršovat také, a proto se jimi nedoporučuje lék zapíjet [46]. Ke zhoršení vstřebatelnosti dochází i po požití vlákniny v podobě různých cereálních výrobků [47].
U pacientů, u nichž nelze ráno spolehlivě zajistit 30minutový interval mezi podáním léku a snídaní, je doporučeno individuální noční podávání levotyroxinu až za 4 hod po posledním večerním jídle. Hladiny TSH se nemění [48,49].
Tyreoidální disruptory
V poslední době se dostává do popředí zájmu narůstající počet látek ovlivňujících metabolizmus tyreoidálních hormonů na mnoha úrovních jeho metabolizmu, tzv. tyreoidálních disruptorů [50]. Tab. 2 udává přehled toxických látek, u mnohých z nich ještě není plně znám mechanizmus účinku ovlivňující metabolizmus tyreoidálních hormonů. Uzma et al nalezli u 42 zdravých nekuřáků zaměstnaných v plnírnách benzínu v Indii významný toxický účinek během dlouhodobé expozice, projevující se snížením TSH [51]. Účinky tyreoidálních disruptorů jsou komplexní a stále obtížně vysvětlitelné. Mohou vysvětlovat, proč u části pacientů, kteří jsou přesvědčeni o své komplianci a adekvátní léčbě, nedochází k poruchám vstřebávání, a přesto je jejich hypotyreóza obtížně kontrolovatelná.
Tab. 2. Tyreoidální disruptory: klinický účinek a pravděpodobný mechanizmus působení 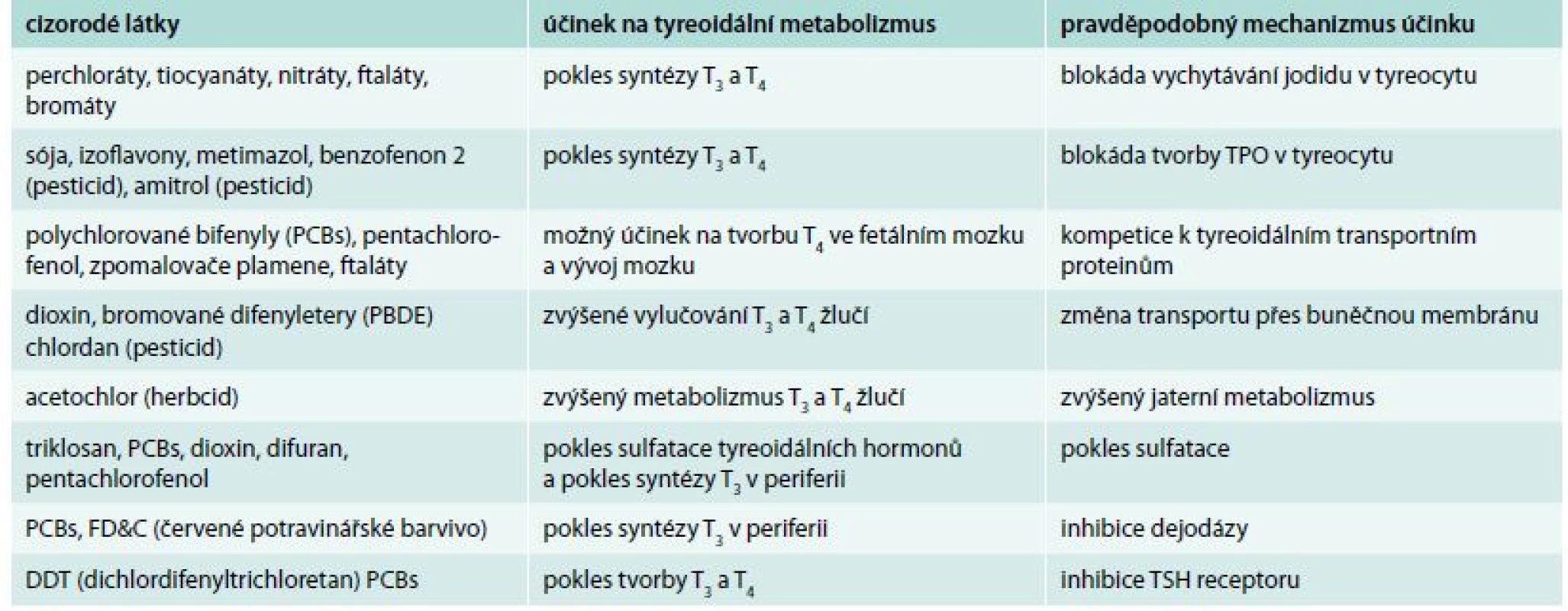
Informace o jednotlivých cizorodých látkách
PBCs (polychlorované bifenyly) – běžně užívány jako stabilizátory při výrobě flexibilních obalů PVC a elektroinstalací ke zvýšení teploty a odolnosti PVC na oheň
Perchloráty – užívány značně v pyrotechnickém průmyslu a amonium perchlorát je také složka pevného raketového paliva
Thiocyanáty – jsou užívány jako prekurzory pro syntézu léčiv a jiných chemikálií
Dioxiny – jsou produkty různých výrobních procesů (odbarvovací prostředek papírové drtě, výroba chemikálií) a pesticidů a spalovací činnosti (spalování domácího odpadu, lesní požáry)
Bromáty – jsou tvořeny mnoha různými cestami v městských pitných vodách
Ftaláty – jsou hlavně užívány jako změkčovadla (látky přidané do plastů ke zvýšení jejich flexibility, průhlednosti, trvanlivosti a delší životnosti)
Dituran – je užíván k rozvinutí nebo výrobě vůní a komponent do voňavek
Octylmetoxycinamát – jde o komponentu užívanou v krémech na opalování a balzámů na rty
Závěr
Závěrem lze konstatovat, že obtížně kontrolovatelný pacient je většinou nespolupracující nebo u něho není přesně stanovena diagnóza nebo nebyla předepsána adekvátní dávka léku. Ve skutečnosti většina našich pacientů odpovídá tomuto profilu a po několika oboustranně prospěšných konzultacích jsou k léčbě vstřícní. U části pacientů je ale potřeba vyloučit přidružené nemoci a lékové interakce. Všichni pacienti by měli být lékařem edukováni, aby dodržovali pravidla týkající se užívání levotyroxinu: ráno, nalačno a lék zapít vodou, ne džusem (zvláště ne grapefruitovým) ani černou kávou. Černou kávu si mohou dopřát až za hodinu po užití léku a snídani si mohou načasovat minimálně za půl hodiny po užití léku. Nakonec ve vzácných případech, u kterých byla předchozí problematika vyloučena, se nabízí hypotéza o přítomnosti tyreoidálních disruptorů, o možném polymorfizmu transportérů pro tyreoidální hormony, které vedou k požadavkům zvýšené dávky, a přizpůsobení se dávkou tyroxinu.
Léčba hypotyreózy problematického pacienta při uvědomění si všech těchto stavů nakonec nemusí být tak obtížná, jak se zdá.
Práce byla podpořena projektem MZ ČR – RVO (Endokrinologický ústav – EÚ, 00023761).
MUDr. Marcela Dvořáková, Ph.D.
mdvorakova@endo.cz
Endokrinologický ústav, Praha
www.endo.cz
Doručeno do redakce 4. 9. 2016
Přijato po recenzi 13. 9. 2016
Zdroje
1. Schloot N, Eisenbart GS. Isohormonal therapy of endocrine autoimmunity. Imunol Today 1995; 16(6): 289–294.
2. Šterzl I, Hrdá P. Izohormonální terapie autoimunitních endokrinopatií. Alergie 2010; 14(1): 56–59.
3. Peterson LD, van der Keur M, de Vries RR et al. Autoreactive and immunoregulatory T-cell subsets in insulin-dependent diabetes mellitus. Diabetologia 1999; 42(4): 443–449.
4. Santini F, Pinchera A, Marsili H et al. Lean body mass is a major determinant of levothyroxine dosage in the treatment of thyroid diseases. J Clin Endocrinol Metab 2005; 90(1): 124–127.
5. Asvold BO, Bjoro T, Vatten LJ. Association of serum TSH with high body mass differs between smokers and never-smokers. J Clin Endocrinol Metab 2009; 94(12): 5023–5027. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2009–1180>.
6. Weiss RE, Brown RL. Doctor...... could it be my thyroid? Arch Intern Med 2008; 168(6): 568–569. Dostupné z DOI: <http://dx.doi.org/10.1001/archinte.168.6.568>.
7. Kok P, Roelfsema F, Langendonk JG et al. High circulating thyrotropin levels in obese women are reduced after body weight loss induced by caloric restriction. J Clin Endocrinol Metab 2005; 90(8): 4659–4663.
8. Reinehr T, de Sousa G, Andler W. Hyperthyrotropinemia in obese children is reversible after weight loss and is not related to lipids. J Clin Endocrinol Metab 2006; 91(8): 3088–3091.
9. Onur S, Haas V, Bosy-Westphal A et al. L-tri-iodothyronine is a major determinant of rating energy expenditure in underweight patiens with anorexia nervosa and during weight gain. Eur J Endocrinol 2005; 152(2): 179–184.
10. Knudsen N, Bulow I, Laurberg P et al. Small differences in thyroid function may be important for body mass index and the occurrence of obesity in the population. J Clin Endocrinol Metab 2005; 90(7): 4019–4024.
11. Jonklaas J. Sex and age differences in levothyroxine dosage requirement. Endocr Pract 2010; 16(1): 71–79. Dostupné z DOI: <http://dx.doi.org/10.4158/EP09257.OR>.
12. Burman KD, Hennessey JV, McDermott M et al. The FDA revises requirements for levothyroxine products. Thyroid 2008; 18(5): 487–490. Dostupné z DOI: <http://dx.doi.org/10.1089/thy.2008.0109>.
13. [American Thyroid Association; Endocrine Society; American Association of Clinical Endocrinologists]. Joint statement on the U. S. Food and drug Administration´s decision regarding bioequivalence of levothyroxine sodium. Thyroid 2004; 14(7): 486.
14. Read DG, Hays MT, Hershman JM. Absorption of oral thyroxine in hypothyroid and normal man. J Clin Endocrinol Metab1970; 30(6): 798–799. Dostupné z DOI: <http://dx.doi.org/10.1210/jcem-30–6-798>.
15. Centanni M, Gargano L, Canettieri G et al. Malabsorption of T4: new insights on oral thyroxine treatment. Hot Thyroidology – Official Journal of ETA 2007; n. 169. Dostupné z DOI: http://www.hotthyroidology.com/editorial_169.html.
16. Wenzel KW, Kirschieper HE. Aspects of the absorption of oral L-thyroxine in normal man. Metabolism 1977; 26(1): 1–8.
17. Hanneman G, Docter R, Friesema EC et al. Plasma membrane transport of thyroid hormones and its role in thyroid hormone metabolism and bioavaibility. Endocr Rev 2001; 22(4): 451–476.
18. Centanni M, Gargano L, Canettieri G et al. Thyroxine in goiter, Helicobacter pylori infection and chronic gastritis. N Engl J Med 2006; 354(17): 1787–1795.
19. Centanni M, Robbins J. Role of sodium in thyroid hormone uptake by rat skeletal muscle. J Clin Invest 1987; 80(4): 1068–1072.
20. Centanni M, Marignani M, Gargano L et al Atrophic body gastritis in patients with autoimmnune thyroid disease: an underdiagnosed association. Arch Intern Med 1999; 159(15): 1726–1730.
21. Sachs G, Shin JM, Munson K et al. Review: the control of gastric acid and Helicobacter pylori eradication. Aliment Prarmacol Ther 2000; 14(11): 1383–1401.
22. Yao X, Forte JG. Cell biology of acid secretion by the parietal cell. Annu Rev Physiol 2003; 65 : 103–131.
23. Lahner E, Annibale B, Delle F. Systematic review: Helicobacter pylori infection and impaired drug absorption. Aliment Pfarmacol Ther 2009; 29(4): 379–386. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2036.2008.03906.x>.
24. Ananthakrishnan S, Braverman LE, Levin RM et al. The effect of famotidine, esomeprazole and ezetimibe on levothyroxine absorption. Thyroid 2008; 18(5): 493–498. Dostupné z DOI: <http://dx.doi.org/10.1089/thy.2007.0381>.
25. Collin P, Kaukinen K, Valimaki M et al. Endocrinological disorders and celiac disease. Endocr Rev 2002; 23(4): 464–483.
26. Boelaert K, Newby PR, Simmonds MJ et al. Prevalence and relative risk of other autoimmune diseases in subjects with autoimmune thyroid disease. Am J Med 2010; 123(2): 183.e1–9. Dostupné z DOI: <http://dx.doi.org/10.1016/j.amjmed.2009.06.030>.
27. Surks MI, Oritz E, Daniels GH et al. Subclinical thyroid disease .Scientific review and qudelines for diagnosis and management. JAMA 2004; 291 : 228–238.
28. Mc Dermot JH, Coss A, Walsh CH Celiac disease presenting as resistant hypothyroidism. Thyroid 2005; 15(4): 386–388.
29. Padwal R, Brocks D, Sharma AM. A systematic review of drug absorption following bariatric surgery and its theoretical implications. Obes Rev 2010; 11(1): 41–50. Dostupné z DOI: <http://dx.doi.doi.org/10.1111/j.1467–789X.2009.00614.x>.
30. Seppel T, Rose F, Schlaghecke R. Chronic intestinal giardiasis with isolated levothyroxine malabsorption as reason for severe hypothyroidism-implications for localization of thyroid hormone absorption in the gut. Exp Clin Endocrinol Diabetes 1996; 104(2): 180–182.
31. Muňoz-Torres M, Varsavsky M. Lactose intolerance revealed by severe resistence to treatment with levothyroxine. Thyroid 2006; 16(11): 1171–1173.
32. Pantos C, Mourouzis I, Xinaris C et al. Thyroid hormone and myocardial ischaemia. J Stroid Biochem Mol Biol 2008; 109(3–5): 314–322. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jsbmb.2008.03.011>.
33. Sandek A, Rauchhaus M, Anker SD et al. The emerging role of the gut in chronic heart failure. Curr Opin Clin Nutr Metab Care 2008; 11(5): 632–639. Dostupné z DOI: <http://dx.doi.org/10.1097/MCO.0b013e32830a4c6e>.
34. Goarin JP, Cohen S, Riou E et al. The effects of triiodothyronine on hemodynamic status and cardiac function in potentional heart donors. Anesth Analg 1996; 83(1): 41–47.
35. Cooper DK, Novitzky D, Wicomb WN et al. A review of studies relating to thyroid hormone therapy in brain-dead organ donors. Front Biosci (Landmark Ed) 2009; 14 : 3750–3770.
36. Mullis-Jansson SL, Argenaziano M, Corwin S et al. A ramdomized double-blind study of the effect of triiodothyronine on cardiac function and morbidity after coronary bypass surgery. J Thorac Cardiovasc Surg 1999; 117(6): 1128–1134.
37. Novitzky D, Cooper DK, Swanepoel A. Ionotropic effect of triiodothyronine (T3) in low cardiac output following cardioplegic arrest and cardiopulmonary bypass: an initial experience in patients undergoing open heart surgery. Eur J Cardiothoracic Surg 1989; 3(2): 140–145.
38. Henderson KK, Danzi S, Paul JT et al. Physiological replacement of T3 improves left ventricular function in an animal model of myocardial infarction-induced congestive heart failure. Circ Heart Fail 2009; 2(3): 243–252. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCHEARTFAILURE.108.810747>.
39. Brent GA, Hershman JM. Thyroxine therapy in patients with severe nonthyroidal illnesses and low serum thyroxine concentration. J Clin Endocrinol Metab 1986; 63(1): 1–8.
40. Moruzzi P, Doria E, Agostoni PG. Medium-term effectiveness of L-thyroxine treatment in idiopatic dilated cardiomyopathy. Am J Med1996; 101(5): 461–467.
41. Singh N, Weisler SL, Hershman JM. The acute effect of calcium carbonate on the intestinal absorption of levothyroxine. Thyroid 2001; 11(10): 967–971.
42. Eskes SA, Wiersinga WM. Amiodarone and thyroid. Best Pract Res Clin Endocrinol Metab 2009; 23(6): 735–751. Dostupné z DOI: <http://dx.doi.org/10.1016/j.beem.2009.07.001>.
43. Cohen-Lehman J, Dahl P, Danzi S et al. Effects of amiodarone therapy on thyroid fiction. Nat Rev Endocrinol 2010; 6(1): 34–41. Dostupné z DOI: <http://dx.doi.org/10.1038/nrendo.2009.225>.
44. Cappelli C, Rotondi M, Pirola I et al. TSH-lowering effect of metformin in type 2 diabetic patients: differences between euthyroid, untreated hypothyroid and euthyroid on L-T4 therapy patients. Diabetes Care 2009; 32(9): 1589–1590. Dostupné z DOI: <http://dx.doi.org/10.2337/dc09–0273>.
45. Benvega S, Bartolone L, Pappalardo MA et al. Altered intestinal absorption of L-tyroxine caused by coffe. Thyroid 2008; 18(3): 293–301. Dostupné z DOI: <http://dx.doi.org/10.1089/thy.2007.0222>.
46. Lilja JJ, Laitinene K, Neuvonen PJ. Effects of grapefruit juice on the absorption levothyroxine. Br J Clin Pharmacol 2005; 60(3): 337–341.
47. Chiu AC, Sherman SI. Effects of pharmacological fiber supplements on levothyroxine absorption. Thyroid 1998; 8(8): 667–671.
48. Elliot DP. Effect of L-T4 administration time on serum in elderly patients. Ann Pharmacotherapy 2001; 35(5): 529–532.
49. Bolk N, Visser TJ, Kalsbeek A et al. Effects of evening vs morning tyroxine ingestion on serum thyroid hormone profiles in hypothyroid patients. Clin Endocrinol 2007; 66(1): 43–48.
50. Patrick L. Thyroid disruption: mechanism and clinical implications in human health. Altern Med Rev 2009; 14(4): 326–346.
51. Uzma N, Salar BM, Kumar BS et al. Impact of organic solvents an environmental pollutants on the physiological function in petrol filling workers. Int J Environ Res Public Health 2008; 5(3): 139–146.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2016 Číslo Suppl 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Zásobení jodem u těhotných žen v České republice
-
Řešení jodového deficitu v České republice – historie a současný stav
20 let práce prof. MUDr. Václava Zamrazila v Meziresortní komisi pro řešení jodového deficitu - Psycho-imuno-endokrinologie štítné žlázy
- Karcinomy štítné žlázy – současné léčebné postupy
- Vitamin D a autoimunitní tyreopatie
- Testosteron a mortalita
- Vrozená adrenální hyperplazie v dospělosti
- Polyfarmakoterapie nahlížená nejen prizmatem multimorbidity, ale jako další geriatrický syndrom
- Mnohočetná endokrinní neoplazie I (Wermerův syndrom) – formy klinické manifestace: 5 kazuistik
- Priebeh ochorenia u pacientov s diferencovaným mikrokarcinómom štítnej žľazy pri použití rôznych liečebných postupov
- Projekt SPACE (Stav Pacientů Akceptovaných diabetologem Cestou Exportu)
- Zásobení jodem a jodurie obyvatel v České republice v letech 1995–2016
- Prof. MUDr. Václav Zamrazil, DrSc., slaví 80. narozeniny
- Jodurie u nemocných s diabetes mellitus 1. typu Vztahy k vybraným parametrům charakterizujícím diabetický syndrom
- Nádory štítné žlázy u dětí a dospívajících a jejich molekulárně genetická podstata
- Endokrinní komplikace moderní onkologické léčby
- Václav Zamrazil osmdesátníkem
- Léčba levotyroxinem – faktory ovlivňující její úspěšnost
- Endokrinní orbitopatie – téma stále živé
- Jsou tyreoidální hormony a tyreotropin asociovány s kardiometabolickými riziky a inzulinovou rezistencí u eutyreoidních jedinců?
- Současnost a perspektivy léčby akromegalie
- Kardiorenální syndrom – biomarkery a mediátory
- TSH produkující adenomy
- Centrální poruchy funkce štítné žlázy
- Vitamín D a syndróm polycystických ovárií
- Tyreoidální hormony a kardiovaskulární systém
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Vrozená adrenální hyperplazie v dospělosti
- Mnohočetná endokrinní neoplazie I (Wermerův syndrom) – formy klinické manifestace: 5 kazuistik
- Vitamin D a autoimunitní tyreopatie
- Centrální poruchy funkce štítné žlázy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



