-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Relabující autoimunitní pankreatitida 1. typu: kazuistika
Relapsing autoimmune pancreatitis type 1: case report
Autoimmune pancreatitis (AIP) is a rare form of chronic pancreatitis, classified into 2 subtypes – AIP type 1 and AIP type 2. We present a case of a 31-years-old female admitted to our institution with upper abdominal pain and obstructive jaundice. Endoscopic retrograde cholangiopancreatoscopy (ERCP) revealed stenosis of intrapancreatic distal bile duct. Diffuse parenchymal enlargement and typical features of AIP were shown by computed tomography (CT) and endoscopic ultrasonography (EUS). The patient´s serum IgG4 was elevated at 3.8 g/l (range 0.08–1.4 g/l). She was diagnosed with AIP type 1 and treated with prednisone (initial dose of 30 mg per day, then tapered by 5 mg/day every week). The maintenance dose of 5 mg per day was continued for 6 months. Despite clinical and radiological remission, serum levels of IgG4 remained elevated. The patient experienced disease relapse 25 months after first attack. Moreover, new finding of calcifications occured in pancreas. The relapse was managed with corticosteroids and maintenance immunosupression with azathioprin was started. Literature review on risk factor of relapse, long-term immunosupressive therapy indication and optimal follow-up of AIP type 1 patients are discussed.
Key words:
autoimmune pancreatitis type 1 – long-term follow-up – relapse – therapy
Autoři: Alena Ondrejková 1; Bohuslav Kianička 1; Hana Nechutová 1; Lukáš Hruška 2; Ivo Novotný 3; Miroslav Souček 1
Působiště autorů: Gastroenterologické oddělení II. interní kliniky LF MU a FN u sv. Anny v Brně 1; Klinika zobrazovacích metod LF MU a FN u sv. Anny v Brně 2; Gastroenterologické oddělení MOÚ, Brno 3
Vyšlo v časopise: Vnitř Lék 2017; 63(4): 277-283
Kategorie: Kazuistiky
Souhrn
Autoimunitní pankreatitida (AIP) je raritní chronické onemocnění slinivky břišní. V dnešní době jsou známy 2 formy onemocnění, AIP 1. a 2. typu. V kazuistice popisujeme případ 31leté pacientky přijaté pro obstrukční ikterus a bolesti v epigastriu. Endoskopická cholangiopankreatikografie (endoscopic retrograde cholangiopancreatoscopy – ERCP) prokázala stenózu suprapapilárního choledochu, CT vyšetření břicha a endosonografické vyšetření slinivky zobrazily difuzní zvětšení žlázy se známkami typickými pro autoimunitní pankreatitidu. V séru pacientky byla zjištěna zvýšená hladina IgG4 (3,8 g/l, norma 0,08–1,4 g/l). Byla stanovena diagnóza AIP 1. typu a nasazena léčba prednisonem v dávce 30 mg/den, její efekt byl verifikován klinicky a pomocí zobrazovacích metod. Poté byla denní dávka snižována o 5 mg prednisonu za týden. I přes klinickou remisi u pacientky přetrvávala elevace sérové hladiny IgG4. Za 25 měsíců od první ataky došlo k relapsu onemocnění. V této době již byly ve slinivce patrny kalcifikace. Po iniciálním zaléčení relapsu prednisonem byla nasazena udržovací imunosupresivní terapie azatioprinem. Autoři diskutují poznatky o rizikových faktorech relapsu, indikaci dlouhodobé imunosupresivní léčby a optimálního sledování s ohledem na prognózu pacientů s AIP 1. typu.
Klíčová slova:
autoimunitní pankreatitida 1. typu – dlouhodobé sledování – léčba – relapsÚvod
Autoimunitní pankreatitida (AIP) je raritní chronické onemocnění slinivky břišní. Jedná se o relativně nedávno identifikovanou jednotku. V posledních 2 desetiletích byly podrobně popsány charakteristické znaky onemocnění při vyšetření neinvazivními zobrazovacími metodami i jeho klinický a laboratorní obraz. V roce 2011 byl publikován mezinárodní konsenzus diagnostických kritérií – International Consensus of Diagnostic Criteria (ICDC) [1]. Pro českou odbornou veřejnost doporučení diagnostiky zpracovali Dítě et al [2]. Na základě histomorfologických a klinických rozdílů jsou známé 2 formy onemocnění. AIP 1. typu je charakteristická lymfoplazmocytárním infiltrátem pankreatu s IgG4 pozitivními buňkami a zvýšenou sérovou hladinou imunoglobulinů IgG4. V dnešní době je pokládána za pankreatickou manifestaci systémového onemocnění, tzv. IgG4 asociované nemoci. AIP 2. typu (idiopatická centroduktální chronická pankreatitida) je naproti tomu považována výlučně za onemocnění slinivky, častěji se vyskytuje u pacientů s idiopatickými střevními záněty a v histologickém obraze se objevují epiteliální granulární léze (GEL). Obě formy probíhají pod obrazem akutních atak, nejtypičtějším projevem je obstrukční ikterus a difuzní nebo fokální zvětšení slinivky. V této fázi onemocnění je zásadní diferenciální diagnostika proti pankreatickému karcinomu. Charakteristická je dobrá odpověď na léčbu kortikoidy vedoucí k navození remise. Relaps se vyskytuje u 27–50 % pacientů [3–7], zejména u AIP 1. typu. U části pacientů onemocnění progreduje do chronické pankreatitidy [7–10]. Zásadními otázkami v dnešní době jsou: jakým způsobem tyto pacienty dlouhodobě sledovat; zda lze predikovat relaps nebo identifikovat pacienty v riziku progrese do chronické pankreatitidy a kdy a jakým způsobem indikovat dlouhodobou imunosupresivní terapii.
Popis případu
31letá žena s anamnézou diabetes mellitus 1. typu a autoimunitní hypotyreózy byla v červenci roku 2014 přijata na naši kliniku pro ikterus a kolikovité bolesti v pravém podžebří. Předcházely tomu asi měsíc trvající mírné intermitentní tlakové abdominalgie v epigastriu. Vstupní hodnoty laboratorních parametrů vykazovaly známky cholestázy (AST 7,5 μkat/l, ALT 11,7 μkat/l, ALP 17,1 μkat/l, GGT 19,7 μkat/l, bilirubin celkový 160,2 μmol/l, glykemie 10,4 mmol/l) a hraničně zvýšenou sérovou amylázu (2,2 μkat/l). Krevní obraz i CRP byly v normálním rozmezí. Transabdominální ultrasonografické (USG) vyšetření břicha zobrazilo dilataci intrahepatálních a extrahepatálních žlučovodů a sludge ve žlučníku. Pankreas byl v USG obraze povšechně zvětšený (průměr hlavy 34 mm, těla 28 mm), hypoechogenní, dobře ohraničený, bez výpotku v okolí, bez dilatace hlavního vývodu. Vzhledem k trvajícím známkám obstrukce žlučových cest pacientka následně podstoupila endoskopickou retrográdní cholangiopankreatikografii (ERCP). Bylo zobrazeno hladkostěnné zúžení intrapankreatického choledochu a suprastenotická dilatace žlučových cest (obr. 1). Hlavní pankreatický vývod měl při vyšetření normální morfologii. Do žlučovodu byl zaveden plastikový duodenobiliární stent (10 Fr, 7 cm).
Obr. 1. ERCP. 
A – stenóza intrapankreatické části choledochu s prestenotickou dilatací žlučových cest (šipka) B – restituce nálezu po kortikoterapii (šipka) Stěrová cytologie a mikroexcize ze stenózy provedená během ERCP nepřinesla dostatečně validní materiál k patologickému posouzení. Vyšetření CA 19–9 v séru bylo negativní. Po zavedení drenáže žlučových cest dochází k poklesu bilirubinu, jaterních enzymů i normalizaci sérové amylázy.
V rámci došetření nálezu na slinivce a stenózy žlučovodu pacientka podstoupila CT vyšetření břicha. Byl patrný edém parenchymu žlázy se ztrátou lobulární struktury a s opožděným vysycováním kontrastní látkou. Zvětšení žlázy bylo více vyjádřeno v oblasti těla a kaudy, vytvářejíc tak typický „sausage-like“ obraz (obr. 2).
Obr. 1. CT břicha s kontrastem. 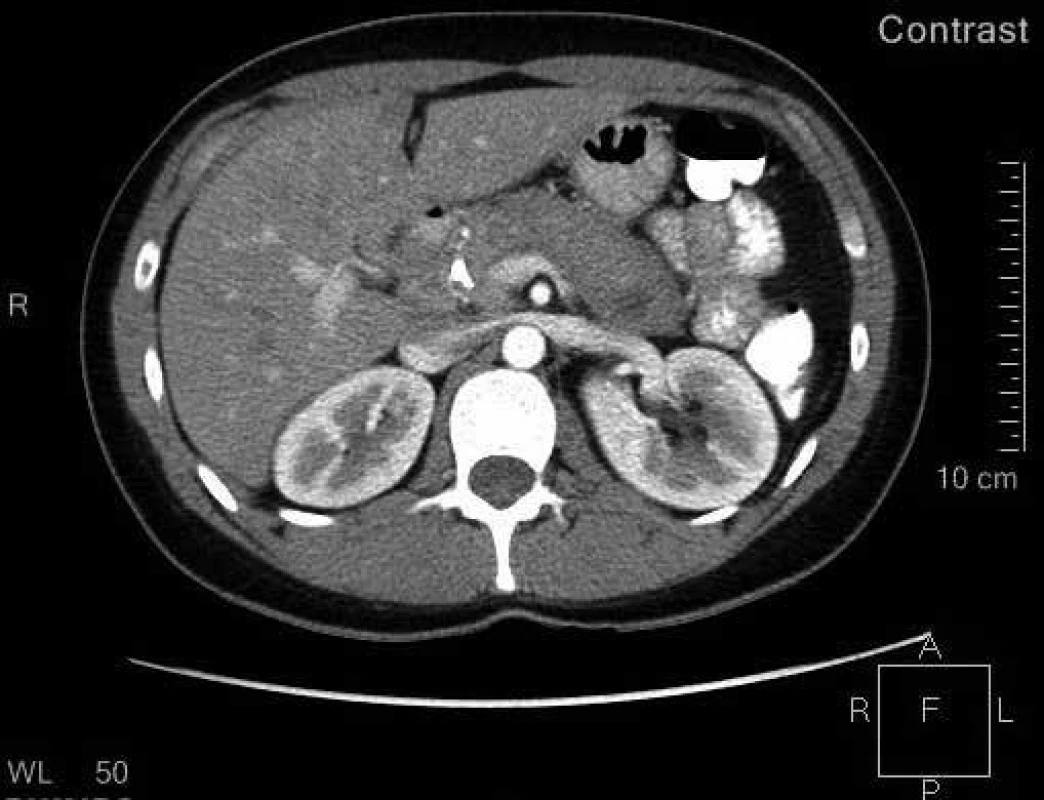
Difuzní edém parenchymu žlázy se ztrátou lobulární struktury a s opožděným vysycováním, typický „sausage-like“ tvar slinivky Následně jsme ještě pro diagnostické rozpaky doplnili endoultrasonografické (EUS) vyšetření pankreatu a žlučových cest. Výsledek podpořil podezření na autoimunitní pankreatitidu (obr. 3).
Obr. 3. Endoultrasonografie. 
A– zvětšená hlava pankreatu, difuzně hypoechogenní parenchym pankreatu (PP), nerozšířený hlavní pankreatický vývod (PD), „kolejničkový“ reflex duodenobiliárního drénu v choledochu (DBD) B – tělo pankreatu – hypoechogenní difuzně edematózní parenchym pankreatu (PP), štíhlý hlavní pankreatický vývod (PD), lienální véna (VL) a a. mestenterica superior (AMS) Imunologické vyšetření séra pacientky prokázalo zvýšenou hodnotu imunoglobulinů třídy IgG4 (3,8 g/l, norma 0,08–1,4 g/l) i celkových imunoglobulinů třídy G (21,2 g/l). Antinukleární protilátky (ANA) a revmatoidní faktor (RF) byly v normě.
Vzhledem k výsledkům vyšetření byla stanovena diagnóza autoimunitní pankreatitidy 1. typu a zahájena kortikoterapie – byl nasazen prednison v dávce 30 mg/den (tělesná hmotnost pacientky 52 kg, brán ohled na labilní diabetes 1. typu s nutností úprav inzulinové terapie po nasazení kortikoidů). Za 4 týdny po nasazení byla při vyšetření transabdominálním ultrazvukem patrna normalizace morfologie pankreatu. Pacientka podstoupila kontrolní ERCP s extrakcí duodenobiliárního stentu, stenóza intrapankreatického choledochu zobrazená při předchozím vyšetření již nebyla patrná (obr. 1).
Denní dávka prednisonu byla po 4 týdnech detrahována o 5 mg/týden. I přes normalizaci klinického stavu, jaterních testů a morfologického nálezu na slinivce nedošlo dle výsledků vyšetření zobrazovacími metodami po iniciální terapii k normalizaci sérových hodnot IgG4. Léčbu v dávce prednisonu 5 mg/den jsme proto prodloužili na 6 měsíců, pak jsme ji na žádost pacientky vysadili. Po léčbě bylo dosaženo minimální hodnoty IgG4 1,85 g/l (norma do 1,4 g/l). Poté postupně narůstala až na hodnotu 3,4 g/l, která byla stabilní více než rok. Klinické kontroly pacientky probíhaly v 1. roce po 3 měsících, poté po 6 měsících, slinivka zůstávala při USG kontrolách normální velikosti, základní biochemické parametry a krevní obraz v normě.
25 měsíců po první atace byla pacientka akutně vyšetřena pro intermitentní bolesti v epigastriu trvající asi 14 dnů, postupně se změnou charakteru do typických biliárních kolik. V laboratorních výsledcích byly opět známky cholestázy, bez elevace CRP či leukocytů, a hraničně zvýšená sérová amyláza. Hodnota IgG4 dosáhla 7,56 g/l a celkové imunoglobuliny třídy G 20,2 g/l, CA 19–9 bylo v normě. Při EUS vyšetření se opět zobrazila objemově zvětšená hypoechogenní žláza utlačující duodenum a intrapankreatický žlučovod. Nově byly difuzně patrné bodové kalcifikace a fokální drobné dilatace hlavního pankreatického vývodu do průměru 3–4 mm. Pacientka opět podstoupila ERCP se zavedením duodenobiliárního stentu. Stav byl vyhodnocen jako relaps AIP a byl nasazen prednison v dávce 30 mg/den s dobrým efektem. Analogicky jako při léčbě iniciální ataky jsme denní dávku po 4 týdnech začali detrahovat o 5 mg/týden. Vzhledem k průběhu onemocnění bylo rozhodnuto o ponechání dlouhodobé imunosupresivní terapie. Pro nevhodnost udržovací terapie kortikoidy (labilní diabetes 1. typu) byla po vysazení prednisonu zahájena medikace azatioprinem. Pacientka je nyní léčena cílovou dávkou 125 mg/den (2,3 mg/kg/den) po dobu 4 měsíců, zatím bez známek relapsu či komplikací léčby. U pacientky se během sledovaného období nevyskytly jiné projevy IgG4 asociované nemoci.
Diskuse
Diagnóza autoimunitní pankreatitidy se v posledních letech dostala do povědomí gastroenterologů i specialistů jiných odborností jako součást IgG4 asociované nemoci. Epidemiologie tohoto onemocnění v České republice není známa. V Japonsku, odkud tradičně pochází nejvíce dat ohledně AIP, se prevalence odhaduje na 4,6 případů na 100 000 obyvatel, roční incidence 1,4/100 000 [11]. AIP 1. typu je celosvětově častější, v Asii se vyskytuje téměř výhradně, v Evropě a Spojených státech amerických představuje více než 80 % případů [12,13]. O frekvenci tohoto onemocnění v ČR můžeme zprostředkovaně usuzovat z několika prací. Při analýze výskytu AIP v resekátech slinivky po operaci pro suspektní karcinom byla tato histologicky identifikována u 5,1 % případů [14]. Další česká práce z roku 2008 uvádí výskyt AIP u 4,7 % pacientů z jednoho pracoviště, u nichž byla původně diagnostikována jako idiopatická chronická pankreatitida [15].
Symptomatologie autoimunitní pankreatitidy může být různá. Nejtypičtější akutní manifestací je vznik obstrukčního ikteru, který může být nebolestivý nebo spojen jen s mírnou epigastrickou bolestí. Příznaky typické pro akutní pankreatitidu jako výrazné abdominalgie a zvýšení sérové amylázy nad 3násobek normy jsou pozorovány spíše u AIP 2. typu, i když ani zde nejsou pravidlem [14]. U AIP 1. typu mohou být postiženy i jiné orgány v rámci systémové IgG4 asociované nemoci (sklerotizující cholangoitida, sklerotizující sialoadenitida – retroperitoneální fibróza, tyreoiditida, tubulointersticiální nefritida, pneumonitida atd). Jejich přítomnost je důležitým vodítkem pro stanovení správné diagnózy [1]. Bolest typu biliární koliky, která se objevila u naší pacientky, není typická. Možným vysvětlením je koincidence s cholelitiázou.
AIP 1. typu nejčastěji postihuje muže staršího věku, maximum incidence je mezi 6. a 7. dekádou. U AIP 2. typu jsou pacienti průměrně o 10 let mladší [13]. Navzdory tomu není neobvyklé, že se onemocnění diagnostikuje i u mladých dospělých, jak tomu bylo v našem případě. Jsou dokonce popsány i případy manifestace nemoci v dětském věku.
Zobrazení parenchymu slinivky v akutním stadiu nemoci vykazuje charakteristický obraz při vyšetření USG, CT či MRI. Při CT zobrazení bývá klasicky pankreas difuzně zvětšen, se setřelou lobulární strukturou, „sausage-like“ tvaru, hladkých okrajů a může být patrno hypodenzní (na MRI hyposignální na T2 vážených obrazech) „halo“ kolem pankreatu. Typické je snížené sycení žlázy kontrastní látkou proti zdravému pankreatu v arteriální fázi [17]. Méně častý je fokální otok parenchymu nebo hypodenzní pankreatická masa (tumor), o to větší však činí diagnostické rozpaky. Peripankreatický prosak či tekutinové kolekce nepatří do obrazu AIP. Pro stanovení diagnózy AIP je důležité i zobrazení pankreatického vývodu (pomocí endoskopické retrográdní pankreatikografie – ERP či pankreatikografie pomocí MRI – MRP). Patognomická je dlouhá rovná striktura větší než třetina celkové délky nebo vícečetné striktury, bez prestenotické dilatace či dilatace postranních větví vycházejících z postiženého úseku [1]. Ze sérologických markerů bývá u AIP pozorováno zvýšení celkových IgG, podtřídy IgG4, z autoprotilátek ANA či RF. I když elevace IgG4 je charakteristickým znakem AIP 1. typu, není zcela specifická. Byly pozorovány zvýšené hodnoty IgG4 u pankreatického [18–20] i cholagiogenního karcinomu [21] a některých dalších patologií. Pro diagnózu AIP je signifikantní elevace IgG4 nad 2násobek normy [1]. Za pozornost stojí, že existuje i séronegativní forma AIP 1. typu (s neprokazatelným signifikantním zvýšením sérového IgG4) [22]. Do diagnostického algoritmu patří i vyšetření CA 19–9.
Stanovení diagnózy AIP 1. typu v kazuistice je v souladu diagnostickými kritérii dle mezinárodního konsenzu (ICDC) [1]. Tyto jsou pro AIP 1. typu shrnuty v tab. 1 a 2.
Tab. 1. Stanovení diagnózy definitivní a pravděpodobné AIP 1. typu dle International Concensus Diagnostic Criteria – ICDC [1] ![Stanovení diagnózy definitivní a pravděpodobné AIP 1. typu dle International Concensus Diagnostic Criteria – ICDC [1]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/88e8fbd3b708a019212644957e55639d.png)
vysvětlení zkratek – viz tab. 2 Tab. 2. Úroveň 1 a úroveň 2 diagnostických kritérií dle ICDC [1] ![Úroveň 1 a úroveň 2 diagnostických kritérií dle ICDC [1]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/0370a3b7be663efcec6b7051dd2d60d0.png)
Jak je patrno z popisu případu, podkladem pro definitivní diagnózu byly typické změny parenchymu slinivky v zobrazení CT a EUS a nálezu zvýšeného sérového IgG4 > 2násobek normy. Pankreatický vývod měl při ERP normální morfologii. U pacientky jsme neidentifikovali postižení jiných orgánů (OOI) dle uvedených kritérií. Biopsie pankreatu u pacientky provedena nebyla. Je známo, že histologické vyšetření při splnění jiných kritérií dle ICDC k stanovení definitivní diagnózy AIP 1. typu často nutné není. Na rozdíl od AIP 2. typu se správnou diagnózu AIP 1. typu bez histologického průkazu podaří stanovit až u 70 % pacientů [12]. Při jakýchkoliv atypických nálezech je ale nezbytná EUS fine needle aspirační biopsie (EUS–FNAB) k vyloučení přítomnosti onkologicky suspektních buněk.
Potvrzením diagnózy byla u pacientky dobrá odpověď na kortikoterapii. I když až 30 % AIP 1. typu může regredovat spontánně [16], kortikoterapie je obecně uznávanou léčbou u symptomatických pacientů. Až do konce roku 2016 zatím nebyl publikován jednoznačný mezinárodní konsenzus v terapeutických postupech. Iniciální dávka prednisonu je dle jednotlivých doporučení buď fixní 30–40 mg/den [12,13] nebo vypočtena z hmotnosti pacienta v dávce 0,6–1 mg/kg/den [1]. V této dávce se prednison ponechává po dobu 2–4 týdnů. ICDC [1] navrhuje zhodnocení efektu léčby pomocí zobrazovacích metod a CA19–9 po 2 týdnech kortikoterapie. Poté se denní dávka snižuje o 5 mg za týden.
Četnost relapsů po ukončení kortikoterapie se u AIP 1. typu pohybuje od 27–50 % [7–10]. Léčba relapsu obvykle probíhá analogicky s terapií první ataky, jak jsme postupovali i u našeho případu.
Vzhledem k vysokému riziku relabujícího průběhu se nabízí otázka udržovací terapie po navození remise. „Západní“ pracoviště tradičně preferovala ukončení léčby po 12 týdnech dle názoru, že riziko relapsu nepřevyšuje riziko komplikací spojených s dlouhodobou kortikoterapií [12]. V Asii je naopak narůstající evidencí podporovaný trend prodlužovat udržovací léčbu (v denní dávce 2,5–5 mg prednisonu), v současnosti jsou dokonce k dispozici data o efektu 3–5leté léčby [23]. Za alternativu kortikoterapie v udržovací léčbě je považován azatioprin v dávce 2–2,5 mg/den [16]. Zkušenosti jsou i s použitím rituximabu [24]. Výzkum se v dnešní době obrací k identifikaci prediktorů relapsů, případně prediktorů progrese AIP do chronické pankreatitidy, které by mohly vést k optimalizaci indikace a délky udržovací terapie v budoucnu.
Prediktivní hodnota monitorování sérových hodnot IgG4 zůstává nejasná. Problémem je, že po navození remise vždy nedochází k normalizaci IgG4. Naopak, u 28–42 % pacientů zůstává hladina IgG4 zvýšená i po klinickém a morfologickém zlepšení, ale jen u části z nich se vyvine relaps [7,18]. Rovněž snaha o stanovení hodnoty rizikové pro vzplanutí onemocnění je zatím neúspěšná. V recentně publikované multicentrické japonské studii byla zvolena jako možný cut-off pro predikci relapsu hodnota 2,8 g/l. Tato hodnota vycházela z dat pro riziko relapsu u jiných IgG4 asociovaných onemocnění [25]. Korelace u AIP 1. typu však potvrzena nebyla [23]. Navzdory tomu by v klinické praxi narůstající sérové hodnoty IgG4 měly být signálem k častějším kontrolám, aby došlo k co nejrychlejšímu záchytu klinických a radiologických známek relapsu [18]. Z dalších studovaných prediktivních faktorů se zvýšené riziko relapsu opakovaně prokázalo u pacientů s difuzním postižením pankreatu a obstrukčním ikterem v úvodu onemocnění [23,26].
Zkušenosti s dlouhodobým průběhem onemocnění a prognózou pacientů s AIP jsou zatím omezené. Když Yoshida et al před 20 lety předložili koncept autoimunitní pankreatitidy jako zcela nové nozologické jednotky [27], předpokládalo se, že onemocnění neprogreduje do obrazu pokročilé chronické pankreatitidy. Později se ukázalo, že morfologické změny (kalcifikace, nepravidelnosti pankreatického vývodu, atrofie žlázy) a exokrinní i endokrinní insuficience se vyvinou až u jedné třetiny pacientů do 3 let od stanovení diagnózy [7]. Důvodem je zřejmě perzistující zánětlivá reakce v pankreatu i v době klinické remise. Kalcifikace se téměř výhradně rozvíjí u AIP 1. typu (u 5–42 % pacientů). Rizikovým faktorem je relabující průběh (hlavní mechanizmus u naší pacientky), konzumace alkoholu (> 50 g/den), zúžení Wirsungova či Santoriniho vývodu. Zajímavé je, že chronická forma AIP nebývá spojena s algiemi typickými pro jiné formy chronické pankreatitidy [8]. Z uvedených skutečností vyplývá i předpokládané zvýšené riziko karcinomu pankreatu u pacientů s AIP. Data o synchronně a metachronně diagnostikovaných karcinomech pocházejí z kazuistik a kohortových studií, incidence kolísá od 0 do 4,2 % při době sledování 33–75 měsíců [8]. Je dokumentováno i zvýšené riziko extrapankreatických karcinomů při IgG4 asociovaném systémovém onemocnění [28]. Z praktického hlediska je proto potřeba zvažovat riziko záměny incidentálního karcinomu za relaps onemocnění, vhodná je kontrola sérového CA 19–9 a při jakýchkoliv pochybnostech časná indikace EUS-FNAB.
Závěr
Autoimunitní pankreatitida je vzácné chronické onemocnění slinivky břišní. Nejčastěji se manifestuje nebolestivým obstrukčním ikterem a difuzním zvětšením pankreatu. Může mít i fokální charakter, proto je důležitá v diferenciální diagnostice pankreatického karcinomu. V současné době jsou k dispozici mezinárodním konsenzem schválená diagnostická kritéria pro toto onemocnění [1]. Autoimunitní pankreatitida se vyskytuje ve dvou formách. AIP 1. typu je častější, je součástí IgG4 asociované systémové nemoci a vykazuje elevaci IgG4 v séru. Tato forma onemocnění má často relabující průběh. Iniciální ataku i relaps lze úspěšně léčit kortikosteroidy. Optimální strategie predikce relapsů a dlouhodobé imunosupresivní terapie v jejich prevenci je zatím ve fázi výzkumu. V dohledné době by měl být publikován mezinárodní konsenzus pro léčbu autoimunitní pankreatitidy schválený v červnu roku 2016 na konferenci International Association of Pancreatology. Vzhledem k riziku relapsů, progrese do chronické pankreatitidy a možnosti rozvoje karcinomu pankreatu by měli být pacienti s AIP v dlouhodobé dispenzarizaci specialisty.
Tato práce vznikla na Masarykově univerzitě v rámci projektu Diferenciální diagnostika a odhad prognózy interních nemocí, ev. číslo MUNI/A/0949/2016, podpořeného z prostředků účelové podpory na specifický vysokoškolský výzkum, kterou poskytlo MŠMT v roce 2017.
MUDr. Alena Ondrejková
ondrejkova@fnusa.cz
Gastroenterologické oddělení II. interní kliniky LF MU a FN u sv. Anny v Brně
www.fnusa.cz
Doručeno do redakce 27. 2. 2017
Přijato po recenzi 18. 3. 2017
Zdroje
1. Shimosegawa T, Chari ST, Frulloni L et al. International consensus diagnostic criteria for autoimmune pancreatitis: guidelines of the International Association of Pancreatology. Pancreas 2011; 40(3): 352–358. Dostupné z DOI: <http://dx.doi.org/10.1097/MPA.0b013e3182142fd2>.
2. Dítě P, Novotný I, Kianička B et al. Autoimmune pancreatitis - diagnostic consensus. Vnitř Lék 2015; 61(2): 114–118.
3. Hirano K, Tada M, Isayama H et al. Long-term prognosis of autoimmune pancreatitis with and without corticosteroid treatment. Gut 2007; 56(12): 1719–1724.
4. Kim HM, Chung MJ, Chung JB. Remission and relapse of autoimmune pancreatitis: focusing on corticosteroid treatment. Pancreas 2010; 39(5): 555–560. Dostupné z DOI: <http://dx.doi.org/10.1097/MPA.0b013e3181c8b4a5>.
5. Kubota K, Watanabe S, Uchiyama T et al. Factors predictive of relapse and spontaneous remission of autoimmune pancreatitis patients treated/not treated with corticosteroids. J Gastroenterol 2011; 46(6): 834–842. Dostupné z DOI: <http://dx.doi.org/10.1007/s00535–011–0393-y>.
6. Sahani DV, Sainani NI, Deshpande V et al. Autoimmune pancreatitis: disease evolution, staging, response assessment, and CT features that predict response to corticosteroid therapy. Radiology 2009; 250(1): 118–129. Dostupné z DOI: <http://dx.doi.org/10.1148/radiol.2493080279>.
7. Maire F, Le Baleur Y, Rebours V et al. Outcome of patients with type 1 or 2 autoimmune pancreatitis. Am J Gastroenterol 2011; 106(1): 151–156. Dostupné z DOI: <http://dx.doi.org/10.1038/ajg.2010.314>.
8. Ikeura T, Miyoshi H, Shimatani M et al. Long-term outcomes of autoimmune pancreatitis. World J Gastroenterol 2016; 22(34): 7760–7766. Dostupné z DOI: <http://dx.doi.org/10.3748/wjg.v22.i34.7760>.
9. Maruyama M, Watanabe T, Kanai K et al. Autoimmune pancreatitis can develop into chronic pancreatitis. Orphanet J Rare Dis 2014; 9 : 77. Dostupné z DOI: <http://dx.doi.org/10.1186/1750–1172–9-77>.
10. Takuma K, Kamisawa T, Tabata T et al. Short-term and long-term outcomes of autoimmune pancreatitis. Eur J Gastroenterol Hepatol 2011; 23(2): 146–152.
11. Kanno A, Masamune A, Okazaki K et al. Nationwide epidemiological survey of autoimmune pancreatitis in Japan in 2011. Pancreas 2015; 44(4): 535–539. Dostupné z DOI: <http://dx.doi.org/10.1097/MPA.0000000000000325>.
12. Sah RP, Chari ST. Autoimmune pancreatitis: an update on classification, diagnosis, natural history and management. Curr Gastroenterol Rep 2012; 14(2): 95–105. Dostupné z DOI: <http://dx.doi.org/10.1007/s11894–012–0246–8>.
13. Hart PA, Kamisawa T, Brugge WR et al. Long-term outcomes of autoimmune pancreatitis: a multicentre, international analysis. Gut 2013; 62(12): 1771–1776. Dostupné z DOI: <http://dx.doi.org/10.1136/gutjnl-2012–303617>.
14. Macinga P, Malušková J, Oliverius M et l. Autoimmune pancreatitis in patients resected for focal pancreatic lesion – First results. Gastroenterol Hepatol 2014; 68(4): 340–345.
15. Dite P, Novotny I, Trna J et al. Autoimmune pancreatitis. Best Pract Res Clin Gastroenterol 2008; 22(1): 131–143. Dostupné z DOI: <http://dx.doi.org/10.1016/j.bpg.2007.10.014>.
16. Sugumar A. Diagnosis and management of autoimmune pancreatitis. Gastroenterol Clin North Am 2012; 41(1): 9–22. Dostupné z DOI: <http://dx.doi.org/10.1016/j.gtc.2011.12.008>.
17. Chari ST, Takahashi N, Levy MJ et al. A diagnostic strategy to distinguish autoimmune pancreatitis from pancreatic cancer. Clin Gastroenterol Hepatol 2009; 7(10): 1097–1103. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cgh.2009.04.020>.
18. Sah RP, Chari ST. Serologic issues in IgG4-related systemic disease and autoimmune pancreatitis. Curr Opin Rheumatol 2011; 23(1): 108–113. Dostupné z DOI: <http://dx.doi.org/10.1097/BOR.0b013e3283413469>.
19. Raina A, Krasinskas AM, Greer JB et al. Serum immunoglobulin G fraction 4 levels in pancreatic cancer: elevations not associated with autoimmune pancreatitis. Arch Pathol Lab Med 2008; 132(1): 48–53. Dostupné z DOI: <http://dx.dpo.org/10.1043/1543–2165(2008)132[48:SIGFLI]2.0.CO;2>.
20. Bojková M, Dítě P, Dvořáčková J et al. Immunoglobulin G4, autoimmune pancreatitis and pancreatic cancer. Dig Dis 2015; 33(1): 86–90. Dostupné z DOI: <http://dx.doi.org/10.1159/000368337>.
21. Oseini AM, Chaiteerakij R, Shire AM et al. Utility of serum immunoglobulin G4 in distinguishing immunoglobulin G4-associated cholangitis from cholangiocarcinoma. Hepatology 2011; 54(3): 940–948. Dostupné z DOI: <http://dx.doi.org/10.1002/hep.24487>.
22. Balasubramanian G, Sugumar A, Smyrk TC et al. Demystifying seronegative autoimmune pancreatitis. Pancreatology 2012; 12(4): 289–294. Dostupné z DOI: <http://dx.doi.org/10.1016/j.pan.2012.05.003>.
23. Kubota K, Kamisawa T, Okazaki K et al. Low-dose maintenance steroid treatment could reduce the relapse rate in patients with type 1 autoimmune pancreatitis: a long-term Japanese multicenter analysis of 510 patients. J Gastroenterol 2017 Jan 6 (on-line). Dostupné z DOI: <http://dx.doi.org/10.1007/s00535–016–1302–1>.
24. Hart PA, Topazian MD, Witzig TE et al. Treatment of relapsing autoimmune pancreatitis with immunomodulators and rituximab: the Mayo Clinic experience. Gut 2013; 62(11): 1607–1615. Dostupné z DOI: <http://dx.doi.org/10.1136/gutjnl-2012–302886>.
25. Culver EL, Sadler R, Simpson D et al. Elevated Serum IgG4 Levels in Diagnosis, Treatment Response, Organ Involvement, and Relapse in a Prospective IgG4-Related Disease UK Cohort. Am J Gastroenterol 2016; 111(5): 733–743. Dostupné z DOI: <http://dx.doi.org/10.1038/ajg.2016.40>.
26. Sah RP, Chari ST, Pannala R et al. Differences in clinical profile and relapse rate of type 1 versus type 2 autoimmune pancreatitis. Gastroenterology 2010; 139(1): 140–148; quiz e12-e13. Dostupné z DOI: <http://dx.doi.org/10.1053/j.gastro.2010.03.054>.
27. Yoshida K, Toki F, Takeuchi T et al. Chronic pancreatitis caused by an autoimmune abnormality. Proposal of the concept of autoimmune pancreatitis. Dig Dis Sci 1995; 40(7): 1561–1568.
28. Yamamoto M, Takahashi H, Tabeya T et al. Risk of malignancies in IgG4-related disease. Mod Rheumatol 2012; 22(3): 414–418. Dostupné z DOI: <http://dx.dpo.org/10.1007/s10165–011–0520-x>.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Kontroverze okolo QALY
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2017 Číslo 4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Novinky v liečbe srdcového zlyhávania – editorial
- Syndrom diabetické nohy: význam MR spektroskopie lýtkových svalů pro hodnocení končetinové ischemie a efektu revaskularizace
- Kontroverze okolo QALY
-
Význam zobrazení srdce pomocí magnetické rezonance v diagnostice hypertrofické kardiomyopatie
Část II - Novinky v léčbě srdečního selhání
- AT1 blokátory – srovnatelnost kardioprotektivity s inhibitory ACE
- Jak (s)tvořit spolupracujícího pacienta pro antihypertenzní a hypolipidemickou léčbu
- Relabující autoimunitní pankreatitida 1. typu: kazuistika
- Histiocytóza z indeterminovaných buněk – vymizení kožní infiltrace po ozáření elektronovým svazkem a aplikace 2-chlorodeoxyadenozinu: kazuistika
- Antikoagulační terapie dabigatranem vs rivaroxabanem u seniorů ve věku nad 65 let: porovnání dat „head to head“
- Gender and Coronary Artery Disease – a challenge for the 21st century
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Relabující autoimunitní pankreatitida 1. typu: kazuistika
- Kontroverze okolo QALY
- Novinky v léčbě srdečního selhání
- AT1 blokátory – srovnatelnost kardioprotektivity s inhibitory ACE
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy





