-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vliv pulzatility na markery poškození vaskulatury u pacientů s implantovanou mechanickou srdeční podporou s kontinuálním průtokem
Effect of pulsatility on markers of vascular damage in patients with implanted continuous flow mechanical circulatory support
Ventricular assist devices are an important therapeutic modality in advanced surgical therapy of end-stage heart failure. Previously most frequently used devices generated mainly non-pulsatile blood flow. Despite indisputable clinical success of this therapy, we encounter complications specific to the devices generating continuous flow. Complications are mainly attributed to changes in shear stress and subsequent changes of the blood vessel characteristics, mainly of endothelium. Effect of continuous flow on the vasculature and blood elements, therefore, became a subject of intense recent research. Effect of continuous flow on the vascular bed is subject of intensive research. Widespread methods used in angiology measuring the state of vasculature are based mainly on imaging modalities and on the presence of pulsatile flow; therefore, under circumstances of non-pulsatile flow their use is limited and the attention is shifted also to laboratory methods, namely to detection of circulating indicators of vascular damage. Therefore, in our recent studies of the effect of mechanical ventricular assist devices on the blood flow we exploit combination of imaging and laboratory methods, including measurements of circulating microparticles and endothelial progenitor cells. Based on these studies interesting data were obtained studying the effect of implantation of mechanical cardiac support on the dynamics of vascular changes taking into account also response to changes of blood flow characteristics. In this paper we summarize our observations.
Key words:
continuous flow – endothelial progenitor cells – mechanical circulatory support – microparticles – vascular damage
Autoři: Peter Ivák 1,4; Jan Piťha 2,3; Ivana Králová Lesná 2; Ivan Netuka 1,5
Působiště autorů: Klinika kardiovaskulární chirurgie IKEM, Praha 1; Laboratoř pro výzkum aterosklerózy, Centrum experimentální medicíny IKEM, Praha 2; Interní klinika 2. LF UK a FN Motol, Praha 3; Ústav normální, patologické a klinické fyziologie 3. LF UK, Praha 4; II. chirurgická klinika – kardiovaskulární chirurgie 1. LF UK a VFN v Praze 5
Vyšlo v časopise: Vnitř Lék 2018; 64(1): 66-71
Kategorie: Přehledné referáty
Souhrn
Mechanické srdeční podpory jsou důležitou terapeutickou modalitou v oblasti pokročilé chirurgické terapie terminálního srdečního selhání. Doposud používaná zařízení generují převážně nepulzatilní tok krve. Navzdory prokazatelným klinickým úspěchům této léčby se setkáváme s komplikacemi specifickými pro zařízení s kontinuálním průtokem. Komplikace jsou připisovány také změně krevního toku a zvýšení smykového zatížení a změnám endotelu cév. Vliv kontinuálního průtoku na cévní řečiště a krevní elementy je předmětem intenzivního výzkumu. Běžně používané angiologické metody měření stavu vaskulatury založené převážně na zobrazovacích metodách a pulzatilním toku jsou však v tomto případě téměř nepoužitelné. Proto k posouzení vlivu pulzatility na vaskulaturu v našich projektech používáme kombinace zobrazovacích a laboratorních metod, včetně měření cirkulujících mikročástic a endoteliálních progenitorových buněk. Naše výsledky pak ukazují zajímavá data z hlediska vlivu implantace srdečních podpor na dynamiku cévních změn i v závislosti na změně charakteristik krevního toku. V této publikaci chceme shrnout naše dosavadní pozorování.
Klíčová slova:
endoteliální progenitorové buňky – kontinuální průtok – mechanická srdeční podpora – mikročástice – vaskulární postiženíÚvod
Implantace mechanické srdeční podpory (MSP) patří mezi modality chirurgické terapie terminálního srdečního selhání, i když transplantace srdce zůstává při této diagnóze zlatým léčebným standardem. Z důvodu nedostatku vhodných kandidátů na dárcovství srdce se díky indikaci „přemostění k transplantaci srdce“ (bridge to transplant – BTT) snížila morbidita a mortalita na čekací listině k transplantaci srdce. Nebývalý rozvoj však nastal v oblasti tzv. destinační terapie jako konečného řešení pro pacienty, kteří z různých důvodů nejsou vhodnými kandidáty na zařazení na čekací listinu k transplantaci srdce. Většina pacientů, kteří dostávají MSP, mají srdeční selhání v nejvyšším stupni klasifikačních schémat. Indikace a kontraindikace zejména pro destinační terapii MSP procházejí v současnosti výrazným vývojem a diskusemi a jejich podrobný výčet je nad rámec této souhrnné publikace.
Pacienti jsou pomocí dlouhodobé MSP léčeni v obou indikacích měsíce až roky. Tohoto pokroku bylo dosaženo díky technologickým inovacím a pokrokům v designu mechanických srdečních podpor. První generace MSP pracuje na pulzatilním principu, tyto pumpy však obsahují množství pohyblivých součástí a jejich dlouhodobé použití je limitováno zejména vysokým rizikem dysfunkce čerpadla, a také rizikem infekcí [1]. Druhá generace MSP je charakterizovaná přítomnosti čerpadla generujícího kontinuální průtok. Tento technologický průlom umožnil miniaturizaci čerpadla, zmenšení velikosti povrchu, který přichází do kontaktu s krví a zejména snížení počtu pohyblivých součástí pumpy. Tyto vlastnosti umožnily zlepšení implantability MSP 2. generace a vedly k redukci nežádoucích účinků, zejména ve smyslu dysfunkce čerpadla. Nejnovějším zdokonalením je použití elektromagnetického nebo hydrodynamického závěsu rotoru, a tedy eliminace přítomnosti ložisek u 3. generace MSP. Tím se zredukovalo mechanické opotřebení, traumatizace krevních elementů procházejících čerpadlem a opět se prodloužila životnost pump. Tyto MSP pracují na principu centrifugálního čerpadla na rozdíl od předchozích generací jsou umístěny přímo v perikardu – pumpa samotná se umisťuje do preperitoneální kapsy.
Při porovnání čerpadel s pulzatilním a kontinuálním průtokem byl zjištěn nižší výskyt pravostranného srdečního selhání nebo neurologických dysfunkcí, některé studie dokonce naznačují nižší výskyt potransplantační rejekce u nepulzatilních pump. Nevýhodou kontinuálního průtoku je zřejmě vyšší zátěž cévního systému a zhoršení endoteliální funkce, ale také vyšší míra krvácivých komplikací, získaná von Willebrandova nemoc nebo nižší objemový unloading levé komory v porovnání s čerpadly s pulzatilním průtokem. Navzdory tomu v posledních letech nepulzatilní čerpadla prakticky nahradily pumpy s pulzatilním tokem [2], a to zejména díky zásadním výhodám, jakým jsou nižší incidence trombózy pumpy, nižší míra infekčních komplikací a v neposlední řadě menší velikost umožňující široké využití i u pacientů drobnější postavy s malým tělesným povrchem.
Průtok tepnami je jednoznačně ovlivněn tokovým vzorem, který generuje čerpadlo, tedy nepulzatilním průtokem (obr. 1). Na ultrasonografii (USG) velkých tepen však může být detekovatelná pulzní vlna, která může vznikat otevíráním aortální chlopně, díky zachovalé reziduální kontraktilitě levé a pravé komory a na základě změny tlaku mezi levou komorou a aortou z důvodů senzitivity čerpadla k míře preloadu. Tato pulzní vlna však nedosahuje kvalit vlny detekované u pacientů bez MSP.
Obr. 1. Charakteristika průtoků měřená ultrasonografickým dopplerovským vyšetřením u osoby bez mechanické srdeční podpory (vlevo) a se srdeční podporou (vpravo) 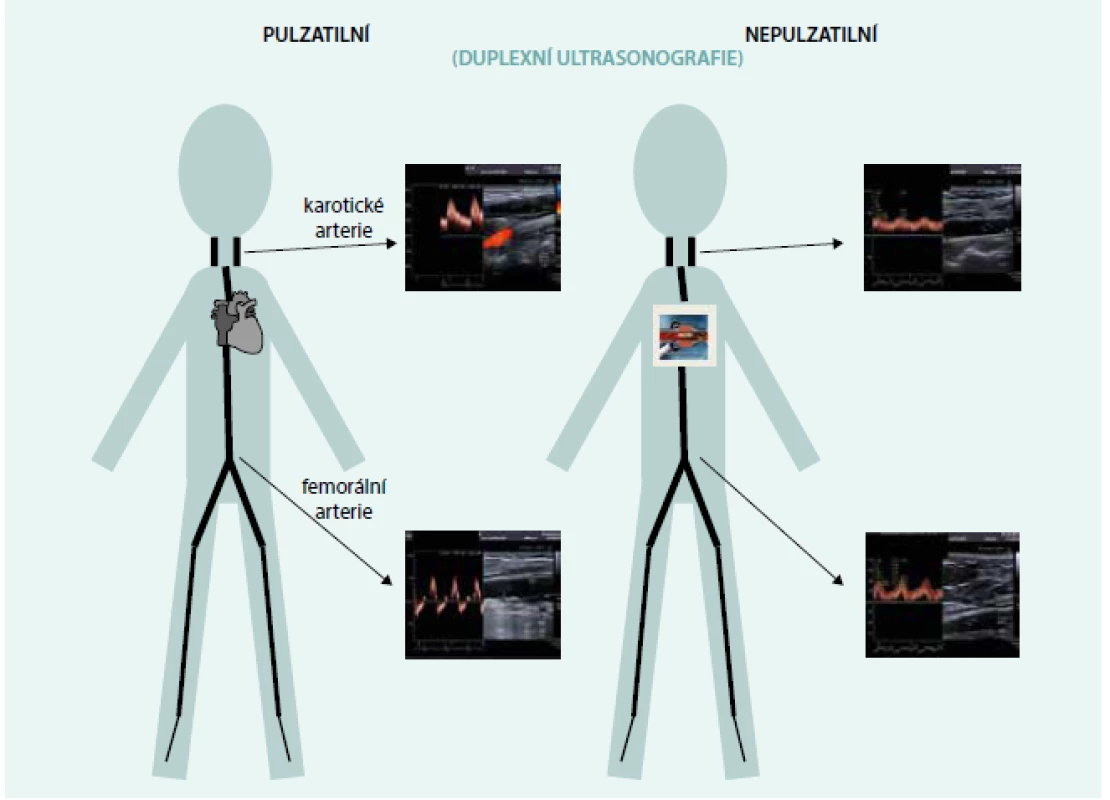
Zásadní otázkou zůstává, jestli je fyziologická pulzní vlna nezbytná pro normální dlouhodobé bezproblémové fungování cévního systému při přítomnosti nepulzatilní MSP. Na jedné straně se nepulzatilnímu toku připisují komplikace jako např. pozdní aortální regurgitace, komisurální fúze cípů aortální chlopně, změny vlastností velkých arterií, pozdní, tzv. nechirurgické krvácení, získaná von Willebrandova nemoc a prohloubení endoteliální dysfunkce. Na druhé straně je tento průtok během dlouhodobé terapie pomocí MSP velmi dobře tolerován [3–5]. Klinicky hodnotitelné, dostupné a časné zjištění poruchy cirkulace, zejména endoteliální dysfunkce navozené MSP, by tedy mohlo být velice cenné při sledování a terapii pacientů.
Teoreticky je nejdůležitějším vazodilatačním mediátorem uvolňovaným endotelem NO. Pulzatilní průtok napomáhá k bazálnímu uvolňování NO endotelem, a tím k udržení adekvátního vaskulárního tonu a rezistence [6]. V případě přítomnosti kontinuálního průtoku může být jedním z mechanizmů vzniku endoteliální dysfunkce a zvýšení vaskulární rezistence právě porucha syntézy NO. Chybějící pulzatilita tedy vyústí ve snížení bazální produkce NO a je následovaná zvýšenou periferní rezistencí a poruchou endoteliální funkce [7,8]. Negativní ovlivnění funkce cévní stěny se v doposud publikovaných pracích přisuzuje právě nepulzatilnímu průtoku [9–12]. Obecně je také přijímán názor, že průtok v kapilárách je kontinuální; proto je právě ovlivnění toku v kapilárách mechanickou srdeční podporou předmětem intenzivního výzkumu, a to na úrovni sofistikovaných experimentálních modelů [16]. Ve studiích Baba et al byl prokázán rozdíl při porovnání průtokových vzorů v kapilárách u kontinuálních a pulzatilních MSP [13]. Omezená pulzatilita a snížené cyklické namáhání cév tak může negativně ovlivnit parametry cévní stěny, zejména ve smyslu endoteliální (dys)funkce.
Běžně používané angiologické metody měření stavu vaskulatury založené převážně na zobrazovacích metodách periferních cév při pulzatilním toku nejsou však pro časné odhalení poruchy funkce cévní stěny v případě MSP spolehlivé. Pozornost se proto soustředí i na metody laboratorní – stanovení cirkulujících ukazatelů cévního poškození. K posouzení vlivu pulzatility na vaskulaturu proto v našich dosavadních studiích používáme kromě funkčních a zobrazovacích metod i laboratorní metodiky zaměřené na cirkulující biomarkery cévního poškození.
K nejvíce sledovaným cirkulujícím parametrům cévního postižení patří cirkulující endoteliální progenitorové buňky, hladké svalové buňky i fibroblasty ovlivněné mechanickými silami, které vytváří právě pulzatilní průtok. Pulzatilita ovlivňuje signální cesty a buněčné procesy jako např. buněčnou proliferaci a diferenciaci, kontrakci svalových buněk, vazodilataci a vazokonstrikci, produkci NO a bradykininu, oxidativní stres a vaskulární remodelaci včetně apoptózy, nebo v konečném důsledku i aterosklerózy [14–16]. Dalším velice intenzivně sledovaným faktorem jsou cirkulující mikročástice, které jsou uvolňovány za patologických i fyziologických podmínek a jejichž zvýšený vznik byl pozorován u mnoha onemocnění včetně kardiovaskulárních.
Dosavadní studie naší skupiny byly zaměřené zejména na sledování cirkulujících vaskulárních biomarkerů. Do studie byli zařazeni pacienti, kterým byla implantována mechanická srdeční podpora HeartMate II (Thoratec corp., Pleasanton, Kalifornie) z důvodu pokročilého srdečního selhání.
Cirkulující mikročástice
Předpokládá se, že nepulzatilní průtok se zvýšeným zatížením buněk vaskulárního systému je zdrojem potencionálního poškození těchto buněk. Mikročástice jsou jedním z konečných produktů apoptózy a jsou tedy pravděpodobně součástí normální celulární funkce. Jejich hladiny jsou ale zvýšené u některých chorobných stavů, zejména u kardiovaskulárních onemocnění. Cirkulující mikročástice tedy mohou být i potencionálním markerem vaskulárního poškození. Nejvíce mikročástic je uvolňováno z endoteliálních buněk a trombocytů. U 30 pacientů v naší péči byly po implantaci levostranné srdeční podpory (left ventricle assist device – LVAD) stanoveny cirkulující mikročástice (velmi malé částice tvořené fragmenty plazmatických membrán) pomocí ELISA metodiky (Hyphen BioMed, Francie), a to před a 3 měsíce po implantaci MSP. Koncentrace mikročástic byly vyjádřeny v nanomolech na litr vztažených ke koncentraci fosfatidylserinu (nMPS). Pacienti byli rozděleni do skupin podle etiologie srdečního selhání na skupinu s ischemickou a neischemickou etiologií srdečního selhání. V porovnání koncentrací před implantací mechanické srdeční podpory a 3 měsíce po výkonu byl pozorován signifikantní pokles koncentrací cirkulujících mikročástic (p = 0,03). Nebyl pozorován rozdíl mezi pacienty s ischemickou a neischemickou etiologií srdečního selhání. Výsledky provedené studie neprokázaly jednoznačný negativní efekt kontinuálního průtoku na funkci vaskulatury vyjádřený jako výrazný vzestup koncentrace cirkulujících mikročástic [17].
Endoteliální progenitorové buňky a kmenové buňky
Kromě diskutované a dosud nepotvrzené možnosti léčebného využití v léčbě ischemie dolních končetin [18–20] jsou cirkulující kmenové a endoteliální progenitorové buňky stanovené v cirkulaci sledovaných osob především ukazatelem buněčné obnovy a regenerační aktivity organizmu (obr. 2). Jsou uvolňovány z kostní dřeně při akutním vaskulárním postižení a nutnosti obnovení endotelu. V dosavadních pracích naší výzkumné skupiny byl zjišťován vliv levostranné mechanické srdeční podpory na dynamiku uvedených parametrů. K přesnějšímu určení vlivu kontinuálního průtoku na vaskulaturu lze využít právě tyto buňky. Je jim přisuzována participace na angiogenezi a reparačních cévních procesech a jejich hladiny se zvyšují při stavech s vaskulárním postižením. Za předpokladu, že kontinuální MSP vytvářejí zvýšené smykové zatížení cévní výstelky, zejména endoteliálních buněk, mohly by změny počtu cirkulujících endoteliálních progenitorových buněk vyjadřovat míru poškození navozeného nepulzatilním tokem.
Obr. 2. Předpokládaný význam endoteliálních progenitorových buněk v reparaci endotelové léze 
EC – endoteliální buňky/endothelial cells EPC – endoteliální progenitorové buňky/endothelial progenitor cells Analýzu tohoto faktoru jsme provedli u 23 pacientů indikovaných k implantaci mechanické srdeční podpory. Měření bylo provedeno ve 3 časových bodech: před, 3 měsíce a 6 měsíců po implantaci levostranné mechanické srdeční podpory. Cirkulující kmenové buňky (stem cell – SC) a cirkulující endoteliální progenitorové buňky (endothelial progenitor cell – EPC) byly měřeny pomocí průtokové cytometrie (obr. 3). Počty obou druhů buněk signifikantně poklesly 3 měsíce po implantaci MSP při porovnání se stavem před implantací. V 6. měsíci však došlo k jejich opětovnému nárůstu téměř na úroveň stavu před implantací. Koncentrace cirkulujících mikročástic se po celou dobu studie signifikantně nelišily. U pacientů byl dále pozorován signifikantní vliv věku na cirkulující kmenové buňky. U pacientů nad 55 let věku byl prokázán nižší počet kmenových buněk před implantací MSP, ani v této skupině jsme však nezaznamenali výrazné změny ve 3. měsíci po implantaci MSP [21].
Obr. 3. Hodnocení počtu a zastoupení endoteliálních progenitorových buněk (průtoková cytometrie) 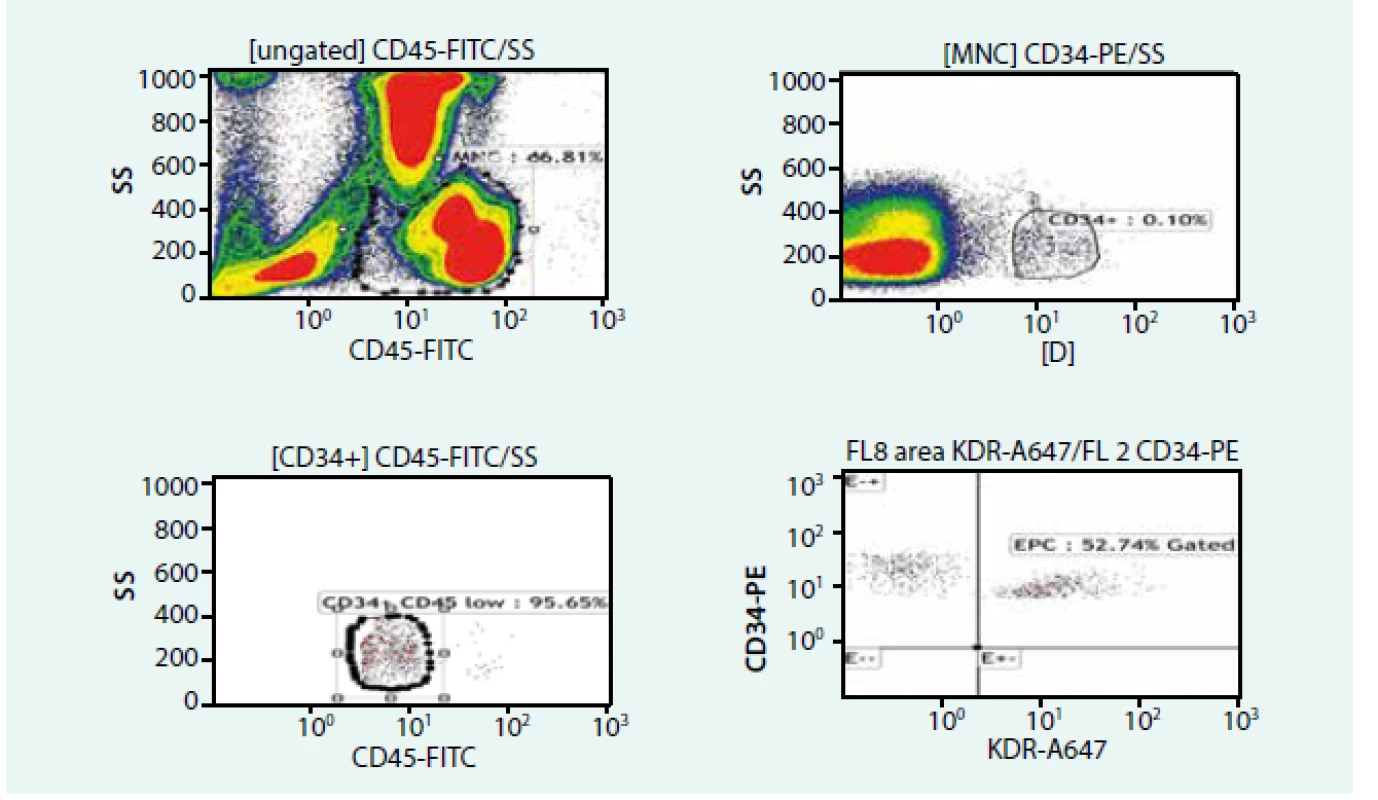
EPC – endoteliální progenitorové buňky MNC – mononuclear cells/mononukleární buňky Diskuse
Zjišťování vlivu nepulzatilního toku na vaskulaturu hraje významnou roli nejen v přípravě designu nových generací mechanických srdečních podpor, ale i v hlubším poznání (pato)fyziologie cévního systému obecně. V našich studiích koncentrace cirkulujících mikročástic jako ukazatele cévního postižení vykázaly po implantaci srdeční podpory převážně pokles. Tento pokles může být způsoben zlepšením perfuze většiny orgánů při úpravě hemodynamického stavu v krátké době po implantaci srdeční podpory. V dlouhodobém sledování by pokles mikročástic mohl být vysvětlen narušením struktury („rozbitím“) mikročástic mechanickými vlivy při průtoku čerpadlem. I z tohoto pohledu bude v dalším výzkumu jistě vhodná a nutná specifičtější detekce mikročástic dle původu z jednotlivých buněk pomocí cytoflowmetrie, i když většina námi detekovaných mikročástic má předpokládaný původ v endoteliální vrstvě cév a v trombocytech. Důležitým zjištěním však bylo, že na koncentrace námi stanovených mikročástic neměla vliv míra pulzatility a jejich koncentrace nebyly prediktorem závažných klinických příhod.
Hodnoty absolutního počtu sledovaných kmenových buněk a subpopulace endoteliálních progenitorových buněk v porovnání s předimplantačním obdobím signifikantně poklesly ve 3. měsíci. V dalším sledování hodnoty stoupaly k předimplantačním hladinám. Hodnoty zejména endoteliálních progenitorových buněk jsou považovány za ukazatel regenerační schopnosti organizmu a jejich zvýšení odráží zvýšenou nutnost obnovy endoteliální vrstvy cévní stěny. Jejich pokles ve 3. měsíci by tedy mohl být spojen s obnovením adekvátního srdečního výdeje po implantaci MSP. Na druhou stranu by však nepulzatilní průtok mohl v delším časovém odstupu vést k endoteliální dysfunkci při absenci cyklické, a tedy fyziologické zátěže cévní výstelky. Proto by se zvýšila nutnost obnovy endoteliálních buněk vyjádřená námi pozorovaným zvýšením hladin endoteliálních progenitorových buněk i kmenových buněk. Tyto změny jsou však jistě závislé i na celkovém stavu organizmu. Např. hodnoty kmenových buněk se u skupiny pacientů starších 55 let významně neměnily. Pravděpodobnou příčinou tohoto nálezu může být i snížená kapacita anebo vyčerpání rezerv kmenových buněk v oblasti krvetvorné tkáně u starších pacientů s pokročilou formou chronického srdečního selhání. Vliv vyššího věku na hodnoty kmenových buněk již byl dříve popsán [22].
Je nutné doplnit, že absence vztahu mezi mírou pulzatility přístroje a dynamikou změn sledovaných laboratorních parametrů může být způsobena i nižší statistickou silou při poměrně velké variabilitě těchto vyšetření. Relativně nízký počet pacientů a klinických příhod je také zřejmě důvodem, proč nebyla prokázána výrazná souvislost mezi studovanými biomarkery a nežádoucími klinickými událostmi; navíc bylo srovnávání výsledků většiny dostupných studií komplikováno různými intervaly sledování.
Závěr
Závěrem lze konstatovat, že dosavadní studie přinesly zajímavé výsledky o vývoji vaskulárních parametrů po implantaci mechanické srdeční podpory. I když dochází k dlouhodobé uspokojivé toleranci terapie MSP, jsou patrny výrazné změny cirkulujících biomarkerů odrážejících stav cévní stěny. Určení jejich skutečného významu pro prognózu pacientů po několika měsících sledování je předčasné. Přesto lze dle těchto dat předpokládat, že kontinuální průtok může mít z dlouhodobého hlediska i negativní vliv na řadu vaskulárních funkcí. Toto tvrzení je doloženo i popsanými změnami koncentrace endoteliálních progenitorových buněk.
Výzkum v této oblasti může také objasnit specifické, zejména krvácivé komplikace terapie MSP – epistaxi, krvácení z GIT a zejména krvácivé cévní mozkové příhody. Tyto komplikace skutečně mohou být spojeny s narušenou funkcí cévního systému a speciálně endotelu. Data získaná v prezentovaných studiích předběžně podporují tento předpoklad a mohou být nápomocná při vývoji nových generací MSP. Přítomnost pulzatility, možnosti nastavení pulzatilního režimu nebo synchronizace se srdečním rytmem pravděpodobně přinesou další průlom v dlouhodobém použití mechanických srdečních podpor z hlediska poměru jejich žádoucích i nežádoucích účinků.
Podpořeno programovým projektem Ministerstva zdravotnictví ČR s reg. č. 16–27630A. Dále podpořeno MZ ČR – RVO („Institut klinické a experimentální medicíny – IKEM, IČ 00023001“).
Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
doc. MUDr. Jan Piťha, CSc.
Interní klinika 2. LF UK a FN Motol, Praha
Laboratoř pro výzkum aterosklerózy, Centrum experimentální medicíny IKEM, Praha
Doručeno do redakce 3. 4. 2017
Přijato po recenzi 12. 11. 2017
Zdroje
1. Pasque MK, Rogers JG. Adverse events in the use of HeartMate vented electric and Novacor left ventricular assist devices: comparing apples and oranges. J Thorac Cardiovasc Surg 2002; 124(6): 1063–1067. Dostupné z DOI: <http://dx.doi.org/10.1067/mtc.2002.123520>.
2. Kirklin JK, Naftel DC, Pagani FD et al. Sixth INTERMACS annual report: A 10,000-patient database. J Heart Lung Transplant 2014; 33(6): 555–564. Dostupné z DOI: <http://dx.doi.org/10.1016/j.healun.2014.04.010>. Erratum in J Heart Lung Transplant. 2015; 34(10): 1356. Baldwin TJ.
3. Radovancevic B, Vrtovec B, de Kort E et al. End-organ function in patients on long-term circulatory support with continuous - or pulsatile-flow assist devices. J Heart Lung Transplant 2007; 26(8): 815–818. Dostupné z DOI: <http://dx.doi.org/10.1016/j.healun.2007.05.012>.
4. Sandner SE, Zimpfer D, Zrunek P et al. Renal function and outcome after continuous flow left ventricular assist device implantation. Ann Thorac Surg 2009; 87(4): 1072–1078. Dostupné z DOI: <http://dx.doi.org/10.1016/j.athoracsur.2009.01.022>.
5. Slaughter MS. Long-term continuous flow left ventricular assist device support and end-organ function: prospects for destination therapy. J Card Surg 2010; 25(4): 490–494.Dostupné z DOI: <http://dx.doi.org/10.1111/j.1540–8191.2010.01075.x>.
6. Lerman A, Burnett JC Jr. Intact and altered endothelium in regulation of vasomotion. Circulation 1992; 86(6 Suppl): III12-III19.
7. Nakano T, Tominaga R, Nagano I et al. Pulsatile flow enhances endothelium-derived nitric oxide release in the peripheral vasculature. Am J Physiol Heart Circ Physiol 2000; 278(4): H1098-H1104. Dostupné z DOI: <http://dx.doi.org/10.1152/ajpheart.2000.278.4.H1098>.
8. Hasin T, Matsuzawa Y, Guddeti RJ et al. Attenuation in peripheral endothelial function after continuous flow left ventricular assist device therapy is associated with adverse events. Circ J 2015; 79(4): 770–777. Dostupné z DOI: <http://dx.doi.org/10.1253/circj.CJ-14–1079>.
9. Gambillara V, Thacher T, Silacci P et al. Effects of reduced cyclic stretch on vascular smooth muscle cell function of pig carotids perfused ex vivo. Am J Hypertens 2008; 21(4): 425–431. Dostupné z DOI: <http://dx.doi.org/10.1038/ajh.2007.72>.
10. Nishinaka T, Tatsumi E, Nishimura T et al. Change in vasoconstrictive function during prolonged nonpulsatile left heart bypass. Artif Organs 2001; 25(5): 371–375.
11. Hutcheson IR, Griffith TM. Release of endothelium-derived relaxing factor is modulated both by frequency and amplitude of pulsatile flow. Am J Physiol 1991; 261(1 Pt 2): H257-H262. Dostupné z DOI: <http://dx.doi.org/10.1152/ajpheart.1991.261.1.H257>.
12. Thacher T, Gambillara V, da Silva RF et al. Reduced cyclic stretch, endothelial dysfunction, and oxidative stress: an ex vivo model. Cardiovasc Pathol 2010; 19(4): e91-e98. Dostupné z DOI: <http://dx.doi.org/10.1016/j.carpath.2009.06.007>.
13. Baba HA, Wohlschlaeger J. Morphological and molecular changes of the myocardium after left ventricular mechanical support. Curr Cardiol Rev 2008; 4(3): 157–169. Dostupné z DOI: <http://dx.doi.org/10.2174/157340308785160606>.
14. Templeton DL, Mosser KH, Chen CN et al. Effects of left ventricular assist device (LVAD) placement on myocardial oxidative stress markers. Heart Lung Circ 2012; 21(9): 586–597. Dostupné z DOI: <http://dx.doi.org/10.1016/j.hlc.2012.04.016>.
15. Segura AM, Gregoric I, Radovancevic R et al. Morphologic changes in the aortic wall media after support with a continuous-flow left ventricular assist device. J Heart Lung Transplant 2013; 32(11): 1096–1100. Dostupné z DOI: <http://dx.doi.org/10.1016/j.healun.2013.07.007>.
16. Prescimone T, Masotti S, D‘Amico A et al. Cardiac molecular markers of programmed cell death are activated in end-stage heart failure patients supported by left ventricular assist device. Cardiovasc Pathol 2014; 23(5): 272–282. Dostupné z DOI: <http://dx.doi.org/10.1016/j.carpath.2014.04.003>.
17. Ivak P, Pitha J, Wohlfahrt P et al. Endothelial dysfunction expressed as endothelial microparticles in patients with end-stage heart failure. Physiol Res 2014; 63(Suppl 3): S369-S373.
18. Madaric J, Valachovicova M, Paulis L et al. Improvement in asymmetric dimethylarginine and oxidative stress in patients with limb salvage after autologous mononuclear stem cell application for critical limb ischemia. Stem Cell Res Ther 2017; 8(1): 165. Dostupné z DOI: <http://dx.doi.org/10.1186/s13287–017–0622–2>.
19. Talapková R, Hudecek J, Sinák I et al. The salvage of ischaemic limb by therapeutical angiogenesis. Vnitř Lék 2009; 55(3): 179–183.
20. Procházka V, Gumulec J, Chmelová J et al. Autologous bone marrow stem cell transplantation in patients with end-stage chronical critical limb ischemia and diabetic foot. Vnitř Lék 2009; 55(3): 173–178.
21. Ivak P, Pitha J, Wohlfahrt P et al. Biphasic response in number of stem cells and endothelial progenitor cells after left ventricular assist device implantation: A 6 month follow up. Int J Cardiol 2016; 218 : 98–103. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ijcard.2016.05.063>.
22. Ahmed AS, Sheng MH, Wasnik S et al. Effect of aging on stem cells. World J Exp Med 2017; 7(1): 1–10. Dostupné z DOI: <http://dx.doi.org/10.5493/wjem.v7.i1.1>.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2018 Číslo 1- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Diabetická dyslipidemie a mikrovaskulární komplikace diabetu
- Familiární kombinovaná hyperlipidemie – nejčastější familiární dyslipidemie v běžné populaci i u pacientů s časným výskytem aterotrombotických kardiovaskulárních příhod
- Epidemiologie hypercholesterolemie
- MedPed – realita péče o familiární hypercholesterolemie v největším centru
- Postavení inhibitorů PCSK9 a lipoproteinové aferézy v léčbě homozygotní a závažné heterozygotní familiární hypercholesterolemie: Kdo z koho, nebo je to jinak?
- Kardiovaskulární riziko u pacientů s revmatickými chorobami a jeho management
- Ateroskleróza aneb Výběr z „interního kmene“
- Regrese koronární aterosklerózy a možnosti jejího zobrazení se zaměřením na výsledky studie GLAGOV
- Vliv pulzatility na markery poškození vaskulatury u pacientů s implantovanou mechanickou srdeční podporou s kontinuálním průtokem
- Poznámky k analytice biomarkerů kardiovaskulárního rizika
- Dlouhé nekódující RNA v patofyziologii aterosklerózy
- Postavení hydrochlorothiazidu mezi thiazidovými a thiazidům podobnými diuretiky
- Česko-slovenská lipidová akademie
- Josef Marek, Václav Hána a kolektiv. Endokrinologie.
- Stanovisko výboru České společnosti pro aterosklerózu k doporučením ESC/EAS pro diagnostiku a léčbu dyslipidemií z roku 2016
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Familiární kombinovaná hyperlipidemie – nejčastější familiární dyslipidemie v běžné populaci i u pacientů s časným výskytem aterotrombotických kardiovaskulárních příhod
- Epidemiologie hypercholesterolemie
- Diabetická dyslipidemie a mikrovaskulární komplikace diabetu
- Postavení hydrochlorothiazidu mezi thiazidovými a thiazidům podobnými diuretiky
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



