-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Weberova-Christianova choroba: kazuistika
Weber-Christian disease: a case report
Weber-Christian disease is a rare disease from the group of chronic fibrosing conditions characterized by inflammation of the adipose tissue – panniculitis and fibrosing with frequent systemic manifestations. Etiopathogenesis of the disease is not fully known, participation of autoimmune mechanisms is anticipated. Here, we report a case of a patient with this rare disease, diagnosed after a long and demanding diagnostic process, including repeated laparotomies. However, after immunosuppressive therapy, clinical and laboratory symptomatology improved rapidly as well as the patient’s quality of life.
Key words:
panniculitis – sclerosing mesenteritis – Weber-Christian disease
Autori: Kristína Brázdilová 1; Daniel Čierny 1; Katarína Hrubišková 1; Lukáš Plank 2; Zdenko Killinger 1; Juraj Payer 1
Pôsobisko autorov: V. interná klinika LF UK a UNB, Nemocnica Ružinov, Bratislava, Slovenská republika 1; Ústav patologickej anatómie JLF UK a UNM, Martin, Slovenská republika 2
Vyšlo v časopise: Vnitř Lék 2018; 64(10): 961-965
Kategória: Kazuistika
Súhrn
Weberova-Christianova choroba je raritné ochorenie spadajúce do skupiny chronických fibrotizujúcich ochorení, prejavujúce sa zápalom tukového tkaniva – panikulitídou a fibrotizáciou s častými systémovými prejavmi. Etiopatogenéza ochorenia nie je celkom známa, predpokladá sa účasť autoimunitných mechanizmov. V našej práci popisujeme prípad pacienta s týmto ochorením, u ktorého sa diagnóza stanovila po dlhom a náročnom diagnostickom procese vrátane opakovaných laparotómií. Po nasadení imunosupresívnej liečby však došlo k promptnému zlepšeniu klinickej i laboratórnej symptomatológie a k zlepšeniu kvality života pacienta.
Kľúčové slová:
panikulitída – sklerotizujúca mezenteritída – Weberova-Christianova choroba
Úvod
Weberova-Christianova choroba (Pfeiferova-Weberova--Christianova choroba, sklerotizujúca mezenteritída) je raritným chronickým zápalovým ochorením zo skupiny chronických fibrotizujúcich ochorení. Prejavuje sa zápalom tukového tkaniva – panikulitídou [1] s fibrotizáciou. Toto ochorenie prvýkrát popísal Pfeifer v roku 1892, ale ako samostatná nozologická jednotka je známe až keď Weber v roku 1925 a Christian v roku 1928 zdokumentovali viacero takýchto prípadov [2]. Od roku 1936 sa používa označenie Weberova-Christianova choroba [3]. V terminológii chronických fibrotizujúcich ochorení vládne do dnešného dňa zmätok, v literatúre sa môžeme stretnúť s pojmami ako systémová nodulárna panikulitída, mezenteriálny lipogranulóm, xantogranulomatózna mezenteritída. Chronické fibrotizujúce ochorenia histolopatologicky spája spoločný nález proliferatívnej fibrózy a chronického zápalu. Zvyknú sa rozdeľovať na 2 veľké skupiny – fibromatózy a IgG4 asociované ochorenia [4]. Samotná sklerotizujúca mezenteritída sa podľa dominancie histopatologických zmien klasifikuje na 3 subtypy, a to mezenterická panikulitída, mezenterická lipodystrofia a retraktilná mezenteritída. Sklerotizujúca mezenteritída sa podľa niektorých autorov považuje za abdominálnu formu IgG4 asociovaného ochorenia. Príčina ochorenia nie je známa, ale v súčasnosti už vieme, že základom sú autoinflamačné zápalové zmeny postihujúce tukové tkanivo s následnou fibrotizáciou. Charakteristickým prejavom je lobulárna panikulitída a klinický obraz aj priebeh ochorenia závisí od lokalizácie postihnutia [5].
Weberova-Christianova choroba
Weberova-Christianova choroba je mimoriadne zriedkavé ochorenie, ktoré nemá úplne typický prejav. Pacienti veľakrát imponujú udávanými polymorfnými ťažkosťami, zápalovou aktivitou aj nálezmi jednotlivých laboratórnych a zobrazovacích vyšetrení, ako so systémovým autoimunitným ev. onkologickým ochorením [5]. Pri tomto ochorení bola pozorovaná asociácia s viacerými inými idiopatickými zápalovými ochoreniami, ako je retroperitoneálna fibróza, sklerotizujúca cholangoitída, fibrotizujúca tyreoiditída a orbitálny pseudotumor, ale aj s dermatomyozitídou, systémovým lupus erythematosus, erythema nodosum, Hodgkinovým lymfómom, sarkoidózou, alebo glomerulonefritídou [5,6]. Ochorenia asociované s prejavmi systémovej fibrotizácie sú zhrnuté v tab. 1 [7]. V niektorých prípadoch býva primárne postihnuté podkožné tukové tkanivo, častejší je však priebeh so systémovými prejavmi [5].
Tab. 1. Ochorenia asociované so systémovou fibrózou 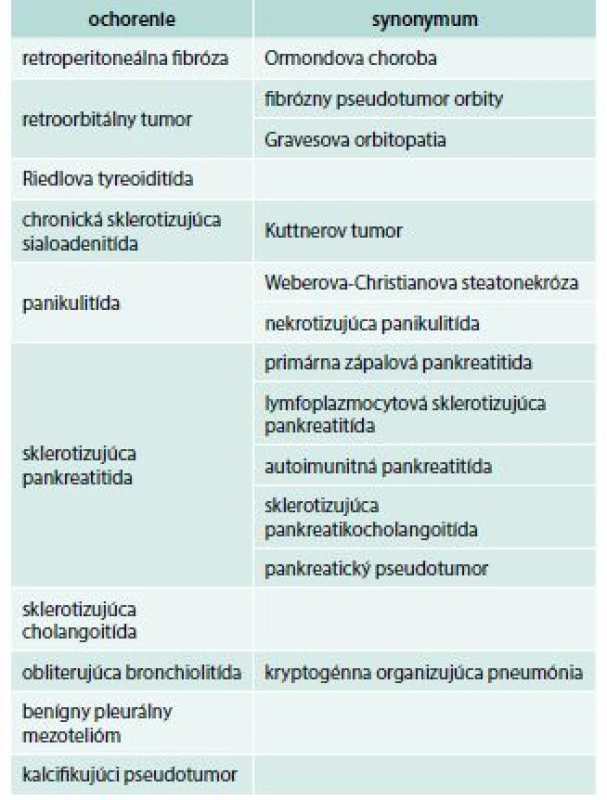
Vyvolávajúcim faktorom môže byť infekcia, trauma alebo stres podobne ako pri iných ochoreniach. Predpokladá sa, že v patogenéze sa uplatňujú autoimunitné mechanizmy. Výskyt sa zdá byť častejší u mužského pohlavia, ochorenie sa môže manifestovať vo veku od 20 až do 90 rokov s priemerným výskytom okolo 60 rokov [6].
Klinický obraz zahŕňa celkové prejavy v zmysle teplôt, slabosti, chudnutia, polyartralgie, kožné postihnutie vo forme erytematóznych podkožných ložísk a často abdominálnu symptomatológiu manifestujúcu sa nauzeou, zvracaním a bolesťami brucha [5,8]. Hlavné prejavy sklerotizujúcej mezenteritídy sú zhrnuté v tab. 2 [9].
Tab. 2. Hlavné prejavy sklerotizujúcej mezenteritídy 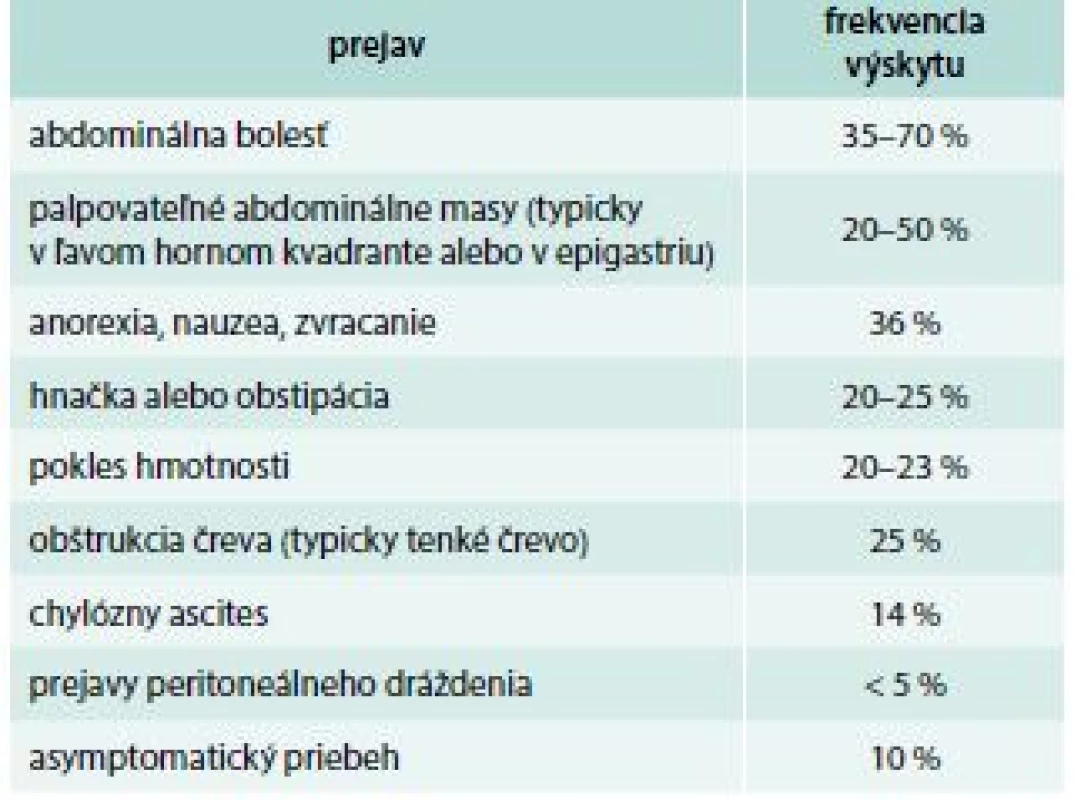
Podľa súčasných poznatkov delíme ochorenie na 2 histologické typy – akútny alebo subakútny charakterizovaný mezenteriálnou panikulitídou, a chronický, pre ktorý je typická retraktilná alebo sklerotizujúca mezenteritída. Predpokladá sa, že v závislosti od štádia a typu ochorenia sa u jedného pacienta môžu súčasne vyskytovať všetky 3 histologické zmeny – chronický nešpecifický zápal, nekróza tuku a fibróza [10]. Vývoj ochorenia možno tiež histologicky rozdeliť na 3 štádiá. Štádium 1 charakterizuje akútna zápalová reakcia, pri ktorej je tukové tkanivo infiltrované neutrofilmi, lymfocytmi a histiocytmi, v 2. štádiu dochádza k migrácii makrofágov a fagocytóze poškodených tukových buniek a k tvorbe charakteristických penových buniek. V 3. štádiu sú tieto bunky nahradené fibroblastami, zápalová reakcia ustupuje a dochádza k fibrotizácii postihnutých tkanív [11].
Vzhľadom k tomu, že klinická manifestácia je nešpecifická a atypická, stanovenie diagnózy je veľmi náročné a závisí od dobrej vzájomnej spolupráce chirurga, rádiológa a patológa [10]. Keďže je možný aj asymptomatický priebeh ochorenia, predpokladá sa, že ochorenie môže byť často poddiagnostikované. V diagnostickom procese majú dôležité miesto zobrazovacie vyšetrenia ako je CT a MRI, ale aj vyšetrovacie metódy z oblasti nuklerárnej medicíny (pozitrónová emisná tomografia – PET) pripadne exploratívna laparotómia s odberom vzorky na histologické vyšetrenie [6,11]. V rámci diferenciálnej diagnostiky je nutné vylúčiť lymfóm, karcinomatózu, primárny mezenteriálny mezotelióm alebo edém mezenteria [12]. V súčasnosti nepoznáme konkrétny diagnostický algoritmus, preto stanovenie diagnózy je možné až po vylúčení iných príčin stavu. Pre toto ochorenie taktiež nie sú žiadne typické laboratórne ukazovatele. Vzhľadom k tomu, že sa jedná o chronické zápalové ochorenie, častým nálezom je zápalová aktivita prejavujúca sa vzostupom CRP alebo sedimentácie erytrocytov, pri dlhšom priebehu ochorenia možno pozorovať anémiu chronických chorôb. Zriedkavo bola popísaná aj infiltrácia kostnej drene makrofágmi a hepatosplenomegália s následnými zmenami v krvnom obraze v rámci hypersplenizmu. Dôkaz autoprotilátok nie je pre toto ochorenie typický, vo väčšine prípadov sú negatívne, v prípade pozitivity sa nepredpokladá súvislosť s ochorením [3,13].
Liečba nie je zatiaľ presne stanovená, závisí od typu a priebehu ochorenia, ktoré môže byť benígne, ale aj rýchlo progredujúce s rizikom vzniku život ohrozujúcich komplikácií. V prípade benígneho typu možno pacienta ponechať bez liečby, inak sa podávajú imunosupresíva. Keďže zatiaľ neexistujú všeobecne platné odporúčania na liečbu tohto raritného ochorenia, voľba konkrétnych imunosupresív je individuálna a závisí najmä od klinických prejavov alebo prípadných kontraindikácií. V akútnych štádiách pri zápalovej aktivite sa podávajú glukokortikoidy, voľba ostatných imunospresív je na základe klinického obrazu a orgánového postihnutia. Zatiaľ bola dokumentovaná úspešná terapia azatioprinom a cyklosporínom A. Pri prevládajúcom kožnom postihnutí bez iných závažných prejavov ochorenia možno skúsiť antimalariká, a to aj v monoterapii bez kombinácie s glukokokortikoidmi. Z ostatných imunosupresív bol popísaný účinok liečby cyklofosfamidom, tetracyklínom, ale aj mykofenolát mofetilom. Metotrexát, leflunomid a sulfasalazin však boli bez efektu, preto sa v patogenéze zvažuje účasť T-lymfocytov [8]. Bol popísaný aj prípad úspešnej liečby inhibítorom TNF infliximabom u pacienta s postihnutím hrubého čreva [4]. V niektorých prípadoch je nutná aj chirurgická liečba, najmä ak sa stav skomplikuje napr. obštrukčným ileom [5,7].
Kazuistika
44-ročný pacient s anamnézou vyše ročných bolestí brucha, pre ktoré podstúpil v novembri roku 2016 exploratívnu laparoskopiu s nálezom tuhej zápalovej masy s infiltráciou prednej a laterálnej brušnej steny, bol diferenciálne diagnosticky riešený na našej klinike. Pacient opakovane podstúpil viaceré vyšetrenia (ultrasonografia – USG a výpočtová tomografia/computed tomography – CT brucha, magnetická rezonancia – enterografia, gastrofibroskopia – GFS a kolonoskopia). Vo februári roku 2017 bol pacient pre nález abscesov v dutine brušnej preložený na chirurgické oddelenie. Popisované hmoty boli operačne evakuované, makroskopicky sa javili ako infikované abscesy, histologicky boli resekáty z omenta s nálezom miernej fibrózy a nešpecifickej chronickej zápalovej celulizácie. Napriek tomu stav pacienta postupne progredoval, na kontrolnom CT brucha boli znovu popisované nešpecifické zápalové zmeny v dutine brušnej a pacient bol rehospitalizovaný na našej klinike. Pacient bol malnutričný až kachektický, s prítomnými rezistenciami na laterálnych stranách brucha. V laboratórnom obraze bola prítomná mikrocytová hypochrómna anémia ťažkého stupňa, trombocytóza, zvýšené zápalové parametre, deficit folátov a železa. Po prehodnotení anamnézy a doplňujúcich vyšetrení bol stav uzavretý ako chronické zápalové postihnutie mezentéria s fibrotizáciou – sklerotizujúca mezenteritída. Na základe histologického vyšetrenia resekátov z dutiny brušnej aj napriek absencii typických známok Weberovej-Christianovej choroby aj patológ suponoval toto ochorenie (obr. 1–7). Pre nález fluidotoraxov a atelektatických zmien na RTG pľúc bol pacient konzultovaný i pneumológom, ktorý zmeny hodnotil v kontexte základného ochorenia. Pacientovi bola nasadená imunosupresívna liečba glukokortikoidmi (Medrol 16 mg denne) a azatioprinom (Imuran 50 mg denne). Pri tejto liečbe sa jeho klinický stav výrazne zlepšil a došlo k poklesu zápalových parametrov. Pri následných ambulantných kontrolách sme už po 3 mesiacoch dokumentovali výrazný pozitívny efekt liečby, keď došlo k úplnému vymiznutiu klinickej symptomatológie, výraznému poklesu hladín zápalových markerov takmer na normu a vymiznutiu fluidotoraxov na kontrolnej RTG snímke hrudníka. Zlepšil sa aj nutričný status s nárastom telesnej hmotnosti a celkovým zlepšením kvality života pacienta.
Obr. 1. Fibrotické zmeny interstícia 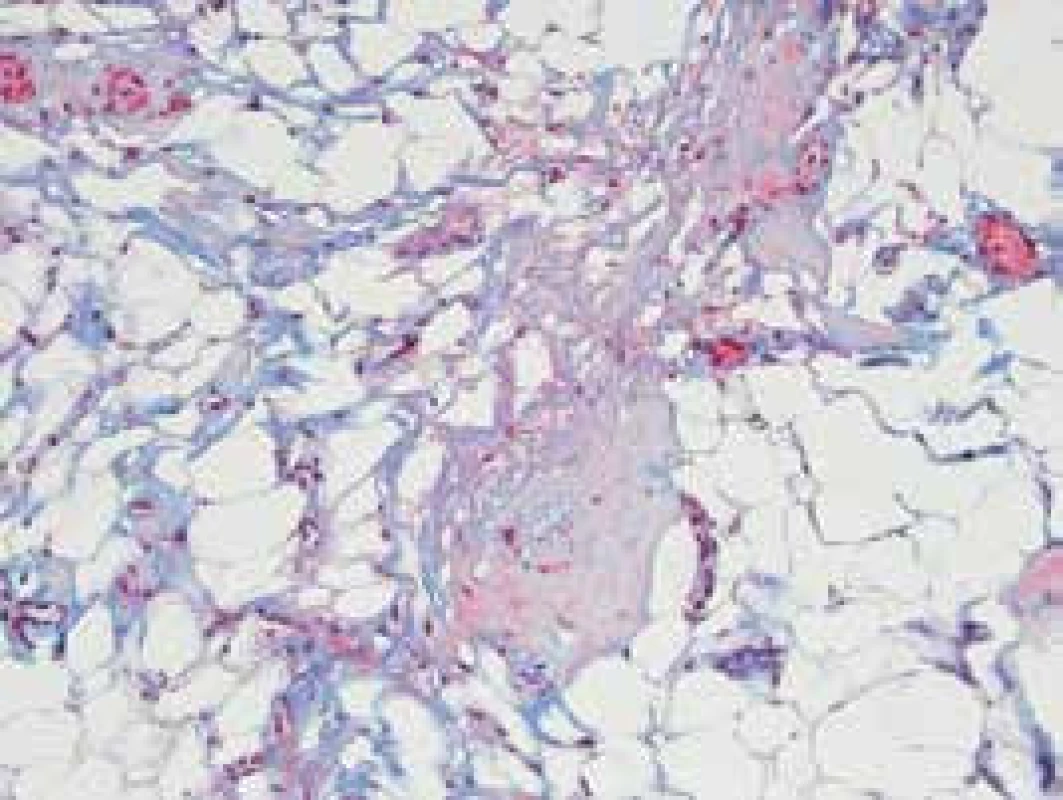
Obr. 2. Fokálna akumulácia malých lymfocytov v interstíciu – HE farbenie 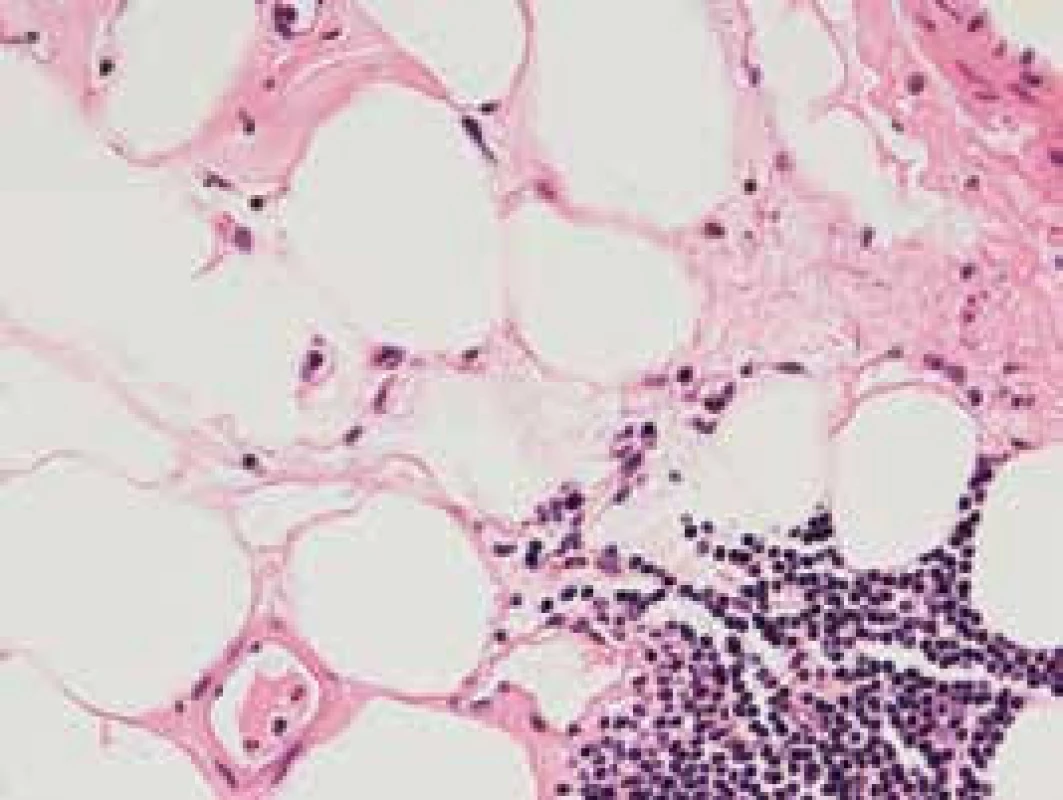
Obr. 3. Fokálna akumulácia malých lymfocytov v interstíciu, ojedinele IgG4 pozitívne plazmatické bunky – IHC IgG4 farbenie 
Obr. 4. Tukové tkanivo s minimálnou zápalovou reakciou – HE farbenie 
Obr. 5. Mierna aktivácia myofibroblastov vo fibrotických oblastiach – IHC farbenie 
Obr. 6. Mezenteriálna panikulitída – prehľad – Masson farbenie 
Obr. 7. CT brucha s nálezom mezenteriálnej panikulitídy 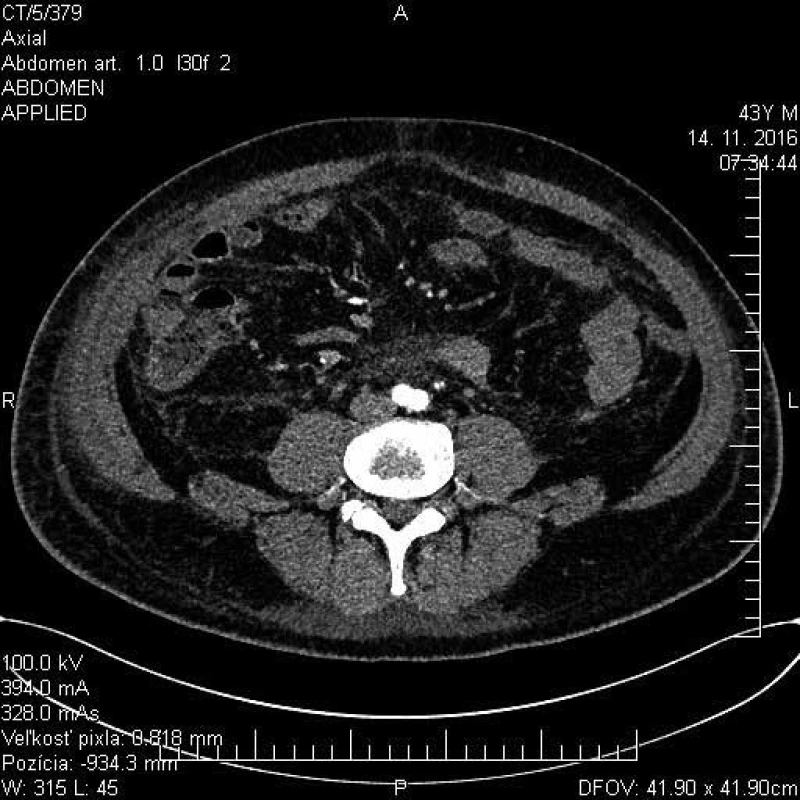
Záver
V našej práci popisujeme kazuistiku pacienta s raritným autoimunitným ochorením. Diagnóza a liečba bola stanovená až po dlhšom diagnostickom procese vrátane opakovaných laparotómií. Po nasadení imunosupresívnej liečby však došlo k promptnému zlepšeniu klinickej i laboratórnej symptomatológie a k zlepšeniu kvality života pacienta. Myslíme si, že ochorenie, i keď patrí medzi raritné, by sa v dnešnej dobe malo stať súčasťou diferenciálnej diagnostiky horúčok neznámeho pôvodu.
as. MUDr. Kristina Brázdilová, PhD.
V. interná klinika LF UK a UNB, Nemocnica Ružinov, Bratislava, Slovenská republika
Doručeno do redakce 7. 4. 2018
Přijato po recenzi 16. 5. 2018
Zdroje
- Requena L, Sanchez YE. Panniculitis. Part II. Mostly lobular panniculitis. J Am Acad Dermatol 2001; 45(3): 325–361; quiz 362–364.
- Christian HA. Relapsing febrile nodular nonsuppurative panniculitis. Arch Internal Med 1928; 42 : 338–351.
- Milner RDG, Mitchinson H. Systemic Weber-Christian disease. J Clin Path 1965; 18 : 150–156.
- George V, Tammisetti VS, Surabhi VR et al. Chronic fibrosing conditions in abdominal imaging. Radiographics 2013; 33(4): 1053–1080. Dostupné z DOI: <http://dx.doi.org/10.1148/rg.334125081>.
- Miranda-Bautista J, Fernández-Simón A, Pérez-Sánchez I et al. Weber-Christian disease with ileocolonic involvement successfully treated with infliximab. World J Gastroenterol 2015; 21(17): 5417–5420. Dostupné z DOI: <http://dx.doi.org/10.3748/wjg.v21.i17.5417>.
- Horton KM, Lawler LP, Fishman EK. CT findings in sclerosing mesenteritis (panniculitis): spectrum of disease. Radiographics 2003; 23(6): 1561–1567. Dostupné z DOI: <http://dx.doi.org/10.1148/rg.1103035010>.
- Neild GH, Rodriquez-Justo M, Wall C et al. Hyper-IgG4 disease: report and a characterisation of a new disease. BMC Med 2006; 4 : 23. Dostupné z DOI: <http://dx.doi.org/10.1186/1741–7015–4-23>.
- Conway SP, Smithells RW, Peters WM. Weber-Christian panniculitis. Ann Rheum Dis 1987; 46(4): 339–341.
- Irami AF, Cesar de CG, de Oliveira SA et al. Sclerosing mesenteritis – update on diagnostic and therapeutic approach. Transl Biomed 2016; 7 : 1. Dostupné z DOI: <http://dx.doi.org/10.21767/2172–0479.100048>.
- Gu GL, Wang SL, Wei XM et al. Sclerosing mesenteritis as a rare cause of abdominal pain and intraabdominal mass: a cases report. Cases Journal 2008; 1(1): 242. Dostupné z DOI: <http://dx.doi.org/10.1186/1757–1626–1-242>.
- Negalur VG, Negalur BV. Weber Christian Disease. J Assoc Physicians India 2003; 51 : 724–725.
- Hamrick-Turner J, Chiechi M, Abbitt P et al. Neoplastic and inflammatory processes of the peritoneum, omentum and mesentery: diagnosis with CT. Radiographics 1992; 12(6): 1051–1068. Dostupné z DOI: <http://dx.doi.org/10.1148/radiographics.12.6.1439011>.
- Agostinis P, Scott CA. Weber-Christian disease: ultrasound can see it. Ital J Med 2014; 8(1): 69–75. Dostupné z DOI: <https://doi.org/10.4081/itjm.2014.170>.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2018 Číslo 10- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Nech brouka žít… Ať žije astma!
- Intermitentní hladovění v prevenci a léčbě chorob
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Elastografie jater: moderní trend v diagnostice chronických jaterních onemocnění
- Tuk, pankreas a metabolický syndrom – editorial
- Je funkčná dyspepsia skutočne tak častá?
- Ovlivňuje doba od potíží do léčení průběh žilní trombózy dolních končetin?
- Tranzientní elastografie – přínos v hodnocení vývoje jaterního onemocnění
- Některé příčiny špatné adherence k dlouhodobé terapii statiny a jejich řešení
- Angioedém indukovaný inhibitory enzymu konvertujícího angiotenzin: epidemiologie, patogeneze a léčba
- Obštrukčné spánkové apnoe a dyslipidémia
- CD38 cílená léčba u mnohočetného myelomu
- Steatóza slinivky břišní: klinický význam
- Léčba pravé polycytemie
- Weberova-Christianova choroba: kazuistika
- Mnohočetné postižení tenkého střeva neuroendokrinním tumorem: kazuistika a přehled literatury
-
Rozlúčka s profesorom Milanom Pavlovičom
*21. 11. 1931 – †3. 7. 2018 -
Za profesorom MUDr. Miroslavom Mydlíkom, DrSc.
*21. 7. 1932 – †6. 9. 2018 - Z odborné literatury
-
Příspěvek ke článku Matýšková M et al. Antitrombotika dnes,
Vnitř Lék 2018; 64(5): 565–574
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Steatóza slinivky břišní: klinický význam
- Léčba pravé polycytemie
- Weberova-Christianova choroba: kazuistika
- Angioedém indukovaný inhibitory enzymu konvertujícího angiotenzin: epidemiologie, patogeneze a léčba
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



