-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Léčba pravé polycytemie
Treatment of polycythemia vera
Polycythemia vera is a chronic myeloproliferative neoplasm characterized by hematopoietic stem cell-derived clonal myeloproliferation resulting in erythrocytosis, leukocytosis and thrombocytosis. Survival is reduced compared with general population. Main reasons of death include thrombohemorrhagic complications, fibrotic progression and leukaemic transformation. Presence of Janus kinase (JAK2) gene mutations is a diagnostic marker and standard diagnostic criterion. World Health Organization 2016 diagnostic criteria focusing on hemoglobin levels, hematocrit, red cell mass and bone marrow morphology are mandatory. Therapeutic approach depends on stratification of patients according age and personal risk of thrombosis. Low-risk patients are treated first line with low-dose aspirin and phlebotomy. Cytoreduction is indicated in high-risk patients. Interferon-α has demonstrated efficacy in many clinical trials. Its pegylated form is well tolerated, enabling less frequent administration than standard interferon. Therefore it is therapy of choice based on Central European Myeloproliferative Neoplasm Organisation recommendation. Ropeginterferon α-2b has been shown to be more efficacious than hydroxyurea. Hydroxyurea is suspected of leukemogenic potential. JAK1/JAK2 inhibitor ruxolitinib is approved for hydroxyurea resistant/intolerant patients.
Key words:
diagnosis – polycythemia vera – therapy
Autoři: Petr Dulíček
Působiště autorů: IV. interní hematologická klinika LF UK a FN Hradec Králové
Vyšlo v časopise: Vnitř Lék 2018; 64(10): 955-960
Kategorie: Přehledné referáty
Souhrn
Pravá polycytemie je chronické klonální myeloproliferativní onemocnění charakterizované erytrocytózou, leukocytózou a trombocytózou. Doba přežití je snížena ve srovnání s normální populací. Mezi hlavní příčiny úmrtí patří trombohemoragické komplikace, progrese do fibrózy a transformace do akutní leukemie. Diagnostickým markerem je přítomnost JAK2 kinázy, mezi další hlavní kritéria dle WHO klasifikace z roku 2016 patří i hodnota hemoglobinu, hematokritu, objem erytrocytární masy a nález v trepanobiopsii. Terapie závisí na rozdělení nemocných dle míry rizika v závisti na věku a osobní anamnéze trombózy. Nemocní v nízkém riziku jsou v 1. linii léčeni venepunkcí a malou dávku aspirinu. Cytoreduktivní léčba je indikována u vysokého rizika. Interferon α prokázal účinnost v mnoha klinických studiích. Pegylovaná forma je dobře snášena a výhodou je nižší frekvence podávání. Proto je v doporučení Central European Myeloproliferative Neoplasm Organisation v 1. linii léčby. Ropeginterferon α-2b se ukazuje jako účinnější než hydroxyurea. Ta je velmi suspektní z leukemogenního potencionálu. JAK1/JAK2 inhibitor ruxolitinib je možné podávat u jedinců rezistentních na hydroxyureu, či u těch, kteří ji netolerují.
Klíčová slova:
diagnostika – léčba – pravá polycytemie
Úvod
Pravá polycytemie (polycythaemia vera – PV) je chronické klonální onemocnění patřící mezi Ph negativní (Ph-) myeloproliferativní neoplazie (MPN). Tam dále řadíme zejména esenciální trombocytemii (ET) a primární myelofibrózu (PMF). PV je onemocnění staršího věku (výskyt v mediánu 60 let věku), ale na MPN je důležité myslet i u mladých jedinců, u nichž je prvním projevem onemocnění trombóza, nejčastěji v splanchnické oblasti. Incidence PV se udává 1,9/100 000 (u mužů 2,8/u žen 1,3). V 95 % případů se vyskytuje JAK2 kináza v exonu 14 (V617F), u 3 % případů pak v exonu 12. Medián délky přežívání u PV činí 14 let, je tedy delší než u PMF, ale kratší než u ET [1].
Prognóza záleží na přítomnosti leukocytózy a abnormálního karyotypu. Existují proto různé prognostické modely založené na věku, leukocytóze > 15 × 109/l a osobní anamnéze venózního tromboembolizmu (VTE). Medián přežití je pak 27,8 let u nízkého rizika, 18,9 let u intermediálního a 10,9 let u vysokého rizika. Dle největší mezinárodní studie, Barbui T et al 2015, (1 545 nemocných) patří mezi rizikové faktory (RF) pro celkové přežívání: věk > 61 let, leukocytóza > 10,5 × 109/l, VTE v anamnéze a abnormální karyotyp. Medián přežívání, zaznamenaný v této studii, byl 23 let bez těchto rizikových faktorů a 9 let bez prvních 2 rizikových faktorů [2].
Trombohemoragické komplikace jsou nejčastější příčinou morbidity a mortality, pak následuje přechod do myelofibrózy a transformace do akutní leukemie [3].
Diagnostika pravé polycytemie
Diagnostika PV prošla a stále prochází vývojem, a to od diagnostických kritérií Polycythemia Vera Study Group (PVSG) přes WHO klasifikaci 2001 až po současnou z roku 2016.
Diagnostická kritéria WHO 2016 jsou následující:
diagnostická kritéria velká
- hemoglobin (Hb) > 165 g/l u mužů, > 160 g/l u žen nebo hematokrit (HTK) > 49 % u mužů, > 48 % u žen, či zvýšení RCM (Red blood Cell Mass) o 25 %
- trepanobiopsie – hypercelularita vzhledem k věku: trilineární hematopoéza (panmyelosis)
- JAK2V617F nebo JAK2 mutace v exonu 12
diagnostické kritérium malé
- snížená hodnota erytropoetinu
Diagnóza PV je tehdy, pokud jsou splněna všechna 3 hlavní kritéria nebo první 2 hlavní a malé kritérium.
Změny hemostázy patří mezi průvodní znaky PV s velmi variabilní klinickou expresivitou. U některých nejsou přítomny vůbec, u některých jsou spojeny s vyšším rizikem VTE či arteriální trombózy, u některých s vyšším rizikem krvácení. Incidence dle studie ECLAP (The European Collaboration on Low-dose Aspirin in PV), která sledovala 1 638 pacientů s PV (variabilní čas od diagnózy), v době náboru byla pozitivní osobní anamnéza trombózy ve 39 % (29 % arteriální, 14 % venózní) [4].
Při dalším sledování (medián 2,8 l) mělo kardiovaskulární příhodu 14 % nemocných (incidence 5,5 příhody/100 nemocných/rok, z toho 6,95 u pacientů s vyšším rizikem a 2,52 u nízkého rizika). Trombotická příhoda byla příčinou úmrtí v 41 %. Anamnézu krvácení mělo při náboru 8,1 % nemocných, resp. 2,9 % v dalším sledování. V novější a nedávné studii IWGMRT (International Working Group for MPN Research and Treatment) mělo v době diagnózy pozitivní osobní anamnézu (OA) trombózy 23 % jedinců (16 % arteriální, 7,2 % žilní) [5].
Výskyt trombotických událostí v dalším sledování (medián 6,9 roků) byl 21 % (12 % arteriální a 9 % žilní trombózy). Tyto výsledky jsou podobné jako v další práci (CYTO-PV) [6], kde arteriální trombóza byla v 17 % a venózní v 12 %. Za rizikové faktory pro trombózu je považován věk nad 65 let, trombóza v OA, arteriální hypertenze, kouření, srdeční selhání. Dnes jsou rizikové faktory více upřesněny a rozděleny na RF pro VTE a arteriální trombózu.
Mezi RF VTE patří přítomnost JAK2 kinázy, věk nad 65 let, vrozené nebo získané trombofilní stavy, VTE v OA, leukocytóza > 15 × 109/l.
Mezi rizikové faktory arteriální trombózy patří věk nad 65 let, kouření, diabetes mellitus, arteriální hypertenze, porucha lipidového metabolizmu. Jedinci s fibrózou kostní dřeně mají nižší riziko trombózy. Trombocytóza byla rizikovým faktorem pro trombózu i v registru nemocných léčených anagrelidem [7].
Rizikem pro krvácení jsou vysoké počty trombocytů, které vedou k získanému von Willebrandovu syndromu. Ke krvácení dochází často po požití aspirinu nebo nesteroidních antiflogistik. Proto by tyto léky neměly být podávány při hodnotě vWFRiCo (von Willebrand factor ristocetin co-factor activity) ≤ 30 %.
Terapie pravé polycytemie
Léčba PV není celosvětově zcela jednotná, liší se dle jednotlivých doporučených postupů (různé názory na toxicitu léků) a dostupnosti léků. Nicméně je nutno ctít princip „primum non nocere“.
Cíle terapie
Cíle terapie jsou následující:
- prevence trombotických komplikací – VTE, ATE, mikrocirkulace
- prevence transformace do myelofibrózy
- prevence transformace do akutní leukemie
- léčba symptomů – svědění kůže aj
V současné době nemáme možnost ovlivnit přechod do myelofibrózy či akutní leukemie, ale můžeme předcházet trombotickým a krvácivým komplikacím.
Koho léčit
Přes řadu pokroků v poznání patogeneze onemocnění i trombotických komplikací stále při odpovědi na tuto otázku platí rozdělení nemocných dle míry rizika založených na věku nemocného a osobní anamnéza trombotické příhody (tab. 1).
Tab. 1. Rozdělení nemocných dle míry rizika trombózy 
Čím léčit
Před zavedením venepunkce byla doba přežití nemocných pouze 2 roky, a to z důvodu velkého počtu trombotických komplikací [8].
Venepunkce (VP) s cílem hematokritu (HTK) < 45 % je skutečně spojena s redukcí trombotických komplikací. Přidání aspirinu vede k dalšímu snížení trombotických příhod [9].
Proto je dnes doporučena u všech jedinců venepunkce s cílem HTK ≤ 45 % a malá dávka aspirinu bez ohledu na přítomnost či absenci dalších rizikových faktorů. Pokud není HTK dobře kontrolován a je současně přítomna leukocytóza, riziko trombózy roste.
Historicky se v léčbě podával radioaktivní fosfor (32P), chlorambucil, dosud v některých částech světa i pipobroman.
Hydroxyurea (HU) je historicky dlouho a velmi často užívaným lékem v léčbě PV, na základě několika studií (včetně PVSG), v nichž užívání HU snížilo výskyt trombózy ve srovnání s venepunkcí (6,6 % vs 14 %) během 2 let. Také přechod do leukemické transformace ve srovnání s léčbou chlorambucilem či 32P byl nižší (5,9 % vs 10,6 %, respektive vs 8,3 % během prvních 11 let terapie).
O leukogenicitě HU dodnes panují různé názory, někteří ji považují za nedostatečně prokázanou s výskytem 1,0–5,6 % [10]. Jiné práce ukazují na zvýšené riziko transformace do akutní leukemie [11] či vyššího rizika nádorů, zejména kožních. Rozhodně dochází k výskytu různých keratóz a hyperkeratóz. Také u jedinců léčených s PV a postrombotickým syndromem je vzhledem ke kožnímu nálezu nutno často terapii ukončit. Návrat k původnímu stavu trvá většinou asi 5 měsíců. Také 10–20 % nemocných netoleruje léčbu, nebo na ní nereaguje, event. i malé dávky vedou k cytopenii.
Interferon (INF) se v léčbě MPN užívá více než 30 let. IFNα není považován za leukemogenní [12]. IFN je jediným známým lékem cíleným na maligní klony a s potenciálem k modifikaci onemocnění. V současné době jsou však všechny standardní i pegylované INF u MPN „off-label“ indikací. Nicméně zejména pegylovaná forma se v terapii jeví jako slibná. Pegylovaný IFNα v iniciální fázi terapie PV se projevuje jako bezpečný a účinný s dosažením kompletní hematologické remise v 76–95 % a molekulárně genetické v 18 %.
V probíhající fázi 3 klinické studie dosáhlo hematologickou remisi 81 % a molekulárně genetickou 19 %.
Otázkou je, zdali dosažení těchto remisí bude mít vliv na progresi onemocnění a na výskyt trombózy.
Naše pracoviště se účastní studie s RopegINF (charakteristika přípravku je na obr).
Jedná o nový monopegylovaný interferon α-2b s jedinou izoformou díky inovativní pegylační technologii. Dávkování 1krát každých 14 dní (1krát měsíčně při dlouhodobé udržovací léčbě) pomocí předplněného autoaplikačního pera s nastavitelnou dávkou je uživatelsky velmi přívětivé. Ve studii PEGINVERA (Pegylated Interferon Alpha 2b to Treat Polycythemia Vera) bylo dosaženo hematologické remise v 90 % (kompletní v 47 % a parciální v 43 %). Kompletní a parciální molekulární odpověď bylo dosaženo v 21 %, resp. v 47 % [12]. Také data z fáze 3 klinické studie PROUD-PV, která srovnává léčbu ropeginterferonem α-2b s HU jsou velmi slibná [13]. Ropeginterferon α-2b je ve fázi registrace v EU.
Co se týče 2. linie léčby, tak byl v randomizované klinické studii porovnáván ruxolitinib k nejlepší dostupné léčbě u HU rezistentních nebo HU netolerujících nemocných [14]. Terapie ruxolitinibem vedla ≥ 35% snížení velikosti sleziny (38 % vs 1 %) a ke kontrole symptomů (49 % vs 5 %). Terapie byla však provázena vyšším výskytem herpetických (Herpes zoster) infekcí (6 % vs 0 %) a pouze u 24 % nemocných vedla ke kompletní hematologické remisi a kompletní genetické remisi < 2 % [15]. Studie také neměla za cíl hodnocení klinicky relevantních cílů, jako období bez trombózy, leukemie či přechodu do myelofibrózy. Z výše uvedeného vyplývá, že názory na jednotlivá léčiva, a tudíž doporučení jsou různorodá. Příkladem může být např. rakouské doporučení – schéma 1 [16].
My postupujeme dle doporučení CEMPO (Central European Myeloproliferative Organization) [17].
Algoritmus terapie je založen na:
- limitované účinnosti současné terapie
- současných doporučení o prevenci trombózy
- posledních klinických studií
Cytoreduktivní terapie
Nízké riziko
1. linie: nízké dávky aspirinu + venepunkce
2. linie: IFNα (PEGylated IFNα)
Druhá linie je indikována také u nízkého rizika:
- špatná tolerance venepunkcí
- vysoká frekvence venepunkcí
- symptomy z nedostatku Fe (MCH < 28)
- symptomy PV (např. pruritus, únava, noční pocení)
- progresivní splenomegalie (ne z důvodu progrese do myelofibrózy)
- progresivní trombocytemie
- progresivní leukocytóza
- přítomnost kardiovaskulárních RF (AH, DM, hyperlipidemie, kouření)
Vysoké riziko
I. Věk < 70 let bez velkých komorbidit
1. linie: IFNα (PEGylated IFN-α) + ASA (kyselina acetylsalicylová)
2. linie: HU nebo JAK1/JAK2 inhibitor + ASA
Druhá linie je indikována také u „high-risk“ < 70 let s horší tolerancí či rezistencí k 1. linii léčby.
II. Věk ≥ 70 let nebo při přítomnosti komorbidit
1. linie: IFNα (PEGylated IFN-α) nebo HU + ASA
2. linie: JAK1/JAK2 inhibitor + ASA
Druhá linie je indikována také u „high-risk“ ≥ 70 let s horší tolerancí či rezistencí k 1. linii léčby. Algoritmus terapie shrnuje tab. 2.
Tab. 2. Terapie PV dle doporučení Central European Myeloproliferative Neoplasm Organisation (CEMPO) 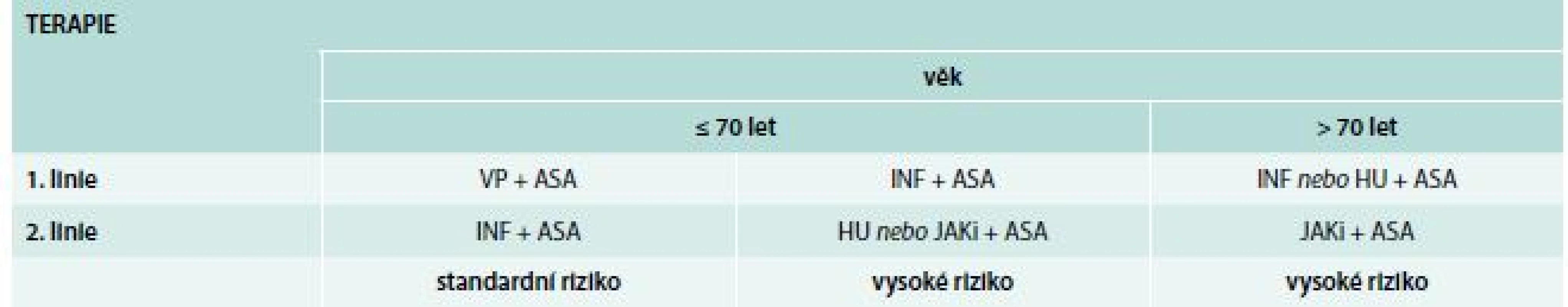
ASA – kyselina acetylsalicylová (aspirin) HU – hydroxyurea INF – interferon JAKi – JAK inhibitory VP – venepunkce Cíle léčby: HTK < 45 %, normalizace počtu trombocytů.
V České republice máme doporučení České pracovní skupiny pro Ph negativní myeloproliferativní onemocnění (Czech Group for Ph- Myeloproliferative Disorders – CZEMP), která jsou v souhlase s doporučeními CEMPO s jedinou odlišností, a to že anagrelid lze použít i v 1. linii u pacientů s trombocytózou.
Léčba svědění kůže
Tento projev patří k velmi svízelně ovlivnitelným, přitom dost obtěžujícím pro každého nemocného. Často nastává při koupeli v teplé vodě. V jedné studii s 1 545 nemocnými byl však tento příznak spojen s delším přežíváním [2]. Ze 418 nemocných z Mayo Clinic byl pruritus přítomen u 31 % nemocných v době stanovení diagnózy, a tito jedinci měli méně arteriální trombóz a vyšší nálož JAK2V617F mutace.
K léčbě používáme antihistaminika, antidepresiva SSRI, fotochemoterapii s psoralenem, PUVA záření, JAK2 inhibitory [18], TOR inhibitory [19].
Léčba trombotických komplikací
Prevence trombotické příhody je u MPN obzvláště důležitá, protože v případě již vzniklé příhody je zde vyšší riziko rekurence, a tudíž ve většině případů potřeba dlouhodobé až celoživotní antikoagulační terapie. Je také nutná cytoredukce, a to ve všech krevních řadách, na prvním místě v trombocytech.
Všichni jedinci s PV mají ASA v dávce 100 mg. V současnosti neexistuje důkaz, že by větší dávky či jiné antiagregans vedlo ke snížení výskytu infarktu myokardu (IM) nebo cévní mozkové příhody (CMP). V případě rizikových situací pro VTE (operace aj) nemocné zajišťujeme nízkomolekulárními hepariny (LMWH). V případě operací s nejvyšším stupněm rizika VTE (např. u náhrad nosných kloubů) u nemocných normalizujeme počet trombocytů.
V případě již prodělaného IM či CMP jsou jedinci léčeni dle patřičného odborníka, úlohou hematologa je volba správné cytoreduktivní léčby s cílem dosažením normalizace krevního obrazu.
U jedinců s VTE při výskytu spontánní hluboké žilní trombózy, plicní embolii či trombóze v neobvyklé lokalizaci volíme v akutní fázi léčbu LMWH s přechodem nejčastěji na warfarin. Antikoagulační terapie je většinou dlouhodobá, u trombóz v neobvyklé lokalizaci a při kumulaci RF pak celoživotní. Lze využít i některého z přímých perorálních antikoagulancií (Direct Oral AntiCoagulants – DOACs), ale při současné léčbě ruxolinitibem je jejich použití nedoporučováno (metabolizmus přes cytochrom 3A4), schéma 2.
Schéma 2. Léčba VTE u PV 
Poznámka: Cytoredukci tedy provádíme v případě počtu leukocytů > 10 × 109/l a počtu trombocytů > 400 × 109/l, venepunkci s cílem HTK ≤ 45 %.
SHRNUTÍ:
V několika bodech shrnujeme nejdůležitější aspekty v terapii MPN-PV
1. Včasná diagnóza PV (hlavně na MPN myslet!)
U všech jedinců s trombózou v abdominální oblasti (nádor, cirhóza)
JAK2, zejména u mladých, dosud zdravých jedinců!
Pozor: minimální nebo žádné změny v krevním obraze (okultní krvácení, hypersplenizmus, hemodiluce)
2. Zhodnocení všech rizikových, stratifikace nemocného dle míry rizika
3. U všech ASA
4. HTK ≤ 45 %
5. Zajištění všech rizikových faktorů pro VTE
6. V případě indikace k cytoreduktivní léčbě se řídit heslem „primum non nocere“, postupovat dle doporučených postupů s případnou individualizací léčby
7. V případě VTE – cytoreduktivní terapie a antikoagulační terapie
Jinak použití DOACs u MPN se jeví dle registru jako vysoce účinné a bezpečné [20]. Při akutní trombotické příhodě a vysokém počtu trombocytů lze provést akutně i trombocytaferézu.
Závěr
Léčba PV je stále diskutovaným problémem a názory na to, kterým lékem začít v případě nutné cytoredukce, nejsou jednotné a ani nemohou být ve světě jednotné. Nicméně se snažíme vždy eliminovat trombotické či krvácivé komplikace. V případě nutné cytoredukce pak volit takovou terapii, která je účinná, bezpečná a pro nemocného uživatelsky nejpříznivější a s co možná nejmenším výskytem závažných nežádoucích účinků. Proto očekáváme možnost rozšíření terapeutických možností o pegylovaný interferon.
Práce vznikla za podpory výzkumného záměru PROGRES Q40/08.
doc. MUDr. Petr Dulíček, Ph.D.
IV. interní hematologická klinika LF UK a FN Hradec Králové
Doručeno do redakce 1. 10. 2018
Přijato po recenzi: 4. 10. 2018
Zdroje
- Tefferi A, Guglielmelli P, Larson DR et al. Long-term survival and blast transformation in molecularly annotated essential thrombocythemia, polycythemia vera, and myelofibrosis. Blood 2014; 124(16): 2507–2513. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2014–05–579136>.
- Tefferi A, Rumi E, Finazzi G et al. Survival and prognosis among 1545 patients with contemporary polycythemia vera: an international study. Leukemia 2013; 27(9): 1874–1881. <http://dx.doi.org/10.1038/leu.2013.163>.
- Barbui T, Vannucchi AM, Carobbio A et al. Patterns of presentation and thrombosis outcome in patients with polycythemia vera strictly defined by WHO-criteria and stratified by calendar period of diagnosis. Am J Hematol 2015; 90(5): 434–437. Dostupné z DOI: <http://dx.doi.org/10.1002/ajh.23970>.
- Finazzi G. Low-dose aspirin in p. A prospective analysis of thrombotic events in the European collaboration study on low-dose aspirin in polycythemia (ECLAP). Pathol Biol (Paris) 2004; 52(5): 285–288. Dostupné z DOI: <http://dx.doi.org/10.1016/j.patbio.2004.02.007>.
- Barbui T, Carobbio A, Rumi E et al. In contemporary patients with polycythemia vera, rates of thrombosis and risk factors delineate a new clinical epidemiology. Blood 2014; 124(19): 3021–3023. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2014–07–591610>.
- Marchioli R, Finazzi G, Specchia G et al. Cardiovascular events and intensity of treatment in polycythemia vera. N Engl J Med 2013; 368(1): 22–33. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1208500>.
- Schwarz J, Ovesná P, Černá O et al. Thrombosis in thrombocythemic Ph-myeloproliferations is associated with higher platelet count prior to the event: results of analyses of prothrombotic risk factors from a registry of patients treated with anagrelide. Eur J Haematol 2016; 96(1): 98–106. <http://dx.doi.org/10.1111/ejh.12554.
- Chievitz E, Thiede T Complications and causes of death in polycythaemia vera. Acta Med Scand 1962; 172 : 513–523.
- Landolfi R, Marchioli R, Kutti J et al. Efficacy and safety of low-dose aspirin in polycythemia vera. N Engl J Med 2004; 350(2): 114–124. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa035572>.
- Finazzi G, Caruso V, Marchioli R et al. Acute leukemia in polycythemia vera. An analysis of 1,638 patients enrolled in a prospective observational study. Blood 2005; 105(7): 2664–2670. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2004–09–3426>.
- Alvarez-Larran A, Kerguelen A, Hernandez-Boluda JC et al. Frequency and prognostic value of resistance/intolerance to hydroxycarbamide in 890 patients with polycythemia vera. Br J Haematol 2016; 172(5): 786–793. Dostupné z DOI: <http://dx.doi.org/10.1111/bjh.13886>.
- Quintás-Cardama A, Kantarjian H, Manshouri T et al. Pegylated interferon alfa-2a yields high rates of hematologic and molecular response in patients with advanced essential thrombocythemia and polycythemia vera. J Clin Oncol 2009; 27(32): 5418–5424. Dostupné z DOI: <http://dx.doi.org/10.1200/JCO.2009.23.6075>.
- Gisslinger H, Zagrijtschuk O, Buxhofer-Ausch V et al. Ropeginterferon alfa-2b, a novel IFN alfa-2b, induces high response rates with low toxicity in patients with polycythemia vera. Blood 2015; 126(15): 1762–1769. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2015–04–637280>.
- Vannucchi AM. Ruxolitinib versus standard therapy for the treatment of polycythemia vera. N Eng J Med 2015; 372(5): 426–435. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1409002>.
- Vannucchi AM, Verstovsek S, Guglielmelli P et al. Ruxolitinib reduces JAK2p.V617F allele burden in patients with polycythemia vera enrolled in the RESPONSE study. Ann Hematol 2017; 96(7): 1113–1120. Dostupné z DOI: <http://dx.doi.org/10.1007/s00277–017–2994-x>.
- Burgstaller S, Buxhofer-Ausch V, Sliwa T et al. Austrian recommendations for the management of polycythemia vera. Wien Klin Wochenschr 2018; 130(17–18): 535–542. Dostupné z DOI: <http://dx.doi.org/10.1007/s00508–018–1359–3>.
- Hatalova A, Schwarz J, Gotic M et al. Recommendations for the diagnosis and treatment of patients with polycythaemia vera. Eur J Haematol 2018. Dostupné z DOI: <http://dx.doi.org/10.1111/ejh.13156>.
- Vaa BE, Tefferi A, Gangat N et al. Pruritus in primary myelofibrosis: management options in theera of JAK inhibitors. Ann Hematol 2016; 95(7): 1185–1189. Dostupné z DOI: <http://dx.doi.org/10.1007/s00277–016–2674–2>.
- Guglielmelli P, Barosi G, Rambaldi A et al. Safety and efficacy of everolimus, a mTOR inhibitor, as single agent in a phase 1/2 study in patients with myelofibrosis. Blood 2011; 118(8): 2069–2076. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2011–01–330563>.
- Lanotto JC, Couturier MA, Galinat H et al. Administration of direct oral anticoagulants in patients with myeloproliferative neoplasms. Int J Hematol 2017; 106(4): 517–521. Dostupné z DOI: <http://dx.doi.org/10.1007/s12185–017–2282–5>.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2018 Číslo 10- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Nech brouka žít… Ať žije astma!
- Intermitentní hladovění v prevenci a léčbě chorob
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Elastografie jater: moderní trend v diagnostice chronických jaterních onemocnění
- Tuk, pankreas a metabolický syndrom – editorial
- Je funkčná dyspepsia skutočne tak častá?
- Ovlivňuje doba od potíží do léčení průběh žilní trombózy dolních končetin?
- Tranzientní elastografie – přínos v hodnocení vývoje jaterního onemocnění
- Některé příčiny špatné adherence k dlouhodobé terapii statiny a jejich řešení
- Angioedém indukovaný inhibitory enzymu konvertujícího angiotenzin: epidemiologie, patogeneze a léčba
- Obštrukčné spánkové apnoe a dyslipidémia
- CD38 cílená léčba u mnohočetného myelomu
- Steatóza slinivky břišní: klinický význam
- Léčba pravé polycytemie
- Weberova-Christianova choroba: kazuistika
- Mnohočetné postižení tenkého střeva neuroendokrinním tumorem: kazuistika a přehled literatury
-
Rozlúčka s profesorom Milanom Pavlovičom
*21. 11. 1931 – †3. 7. 2018 -
Za profesorom MUDr. Miroslavom Mydlíkom, DrSc.
*21. 7. 1932 – †6. 9. 2018 - Z odborné literatury
-
Příspěvek ke článku Matýšková M et al. Antitrombotika dnes,
Vnitř Lék 2018; 64(5): 565–574
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Steatóza slinivky břišní: klinický význam
- Léčba pravé polycytemie
- Weberova-Christianova choroba: kazuistika
- Angioedém indukovaný inhibitory enzymu konvertujícího angiotenzin: epidemiologie, patogeneze a léčba
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy





