-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Srdeční postižení u suicidální intoxikace oxidem uhelnatým s rysy toxické i stresové kardiomyopatie: kazuistika
Myocardial injury after carbon monoxide intoxication in suicide attempt, with features of both toxic and tako-tsubo cardiomyopathy: case report
Severe carbon monoxide intoxication may cause tissue injury by hypoxemia and histotoxicity. The affection of the heart muscle often leads to transient global or regional systolic dysfunction of left ventricle or both ventricles and increased occurences of malignant arrhytmias. On the contrary, stress-induced cardiomyopathy is described as temporary segmental loss of contractility, mostly in apical segments of the left ventricle with mid - and basal sparing and less common hypokinesias in mid - or basal parts, or affection of both ventricles. This case report is dedicated to a 34-years old male, who was admitted to the department of emergency medicine after suicide attempt by carbon monoxide poisoning. Echocardiography at admission showed akinesias of midsegments of left ventricle and severe hypokinesias of apical and basal segments. Despite severe cardiogenic shock, adequate therapeutic management including mechanical ventilation, normobaric oxygenotherapy and catecholamine treatment led to a complete somatic recovery after 2 weeks, and without any permanent hypoxemic brain injury. Our case might be a coincidence of toxic cardiomyopathy, caused by carbon monoxide poisoning, and takotsubo cardiomyopathy as a result of long term exposition to combined stress factors that may lead even to a suicide attempt. Both types of cardiomyopathies often occure simultaneously due to similar pathophysiologic mechanisms. Both tako-tsubo and toxic cardiomypathy have good prognosis after overcoming the acute phase.
Key words:
carbon monoxide – cardiogennic shock – cardiomyopathy – suicide – tako-tsubo cardiomypathy
Autoři: Radek Vančata 1; Jan Lhotský 1; Václav Beránek 1; Josef Krištof 2; Richard Rokyta 1
Působiště autorů: Komplexní kardiovaskulární centrum – kardiologické oddělení, FN Plzeň, pracoviště Lochotín 1; Klinika anesteziologie, resuscitace a intenzivní medicíny LF UK a FN Plzeň 2
Vyšlo v časopise: Vnitř Lék 2018; 64(7-8): 797-801
Kategorie: Kazuistiky
Kazuistika byla prezentována ve zkrácené podobě jako poster na XXV. výročním sjezdu České kardiologické společnosti v Brně 7. 5.–10. 5. 2017.
Souhrn
Důsledkem těžké intoxikace oxidem uhelnatým (CO) je hypoxemické a histotoxické poškození. Účinkem CO na myokard vznikají tranzitorní globální i segmentární poruchy kinetiky levé či obou komor srdečních a je popisován proarytmogenní efekt. Stresová kardiomyopatie je charakteristická dočasnými lokalizovanými poruchami kinetiky, nejčastěji v oblasti apikálních segmentů levé komory srdeční, méně časté jsou izolované poruchy kinetiky středních či bazálních segmentů či postižení obou komor. Předkládáme případ 34letého muže, který byl přijat na Kliniku anesteziologie, resuscitace a intenzivní medicíny (KARIM) LF a FN Plzeň po intoxikaci oxidem uhelnatým v suicidálním pokusu. Echokardiograficky byla v úvodu zjištěna těžká systolická dysfunkce obou srdečních komor. Levá komora srdeční vykazovala akinezu středních segmentů a částečně zachovanou kinetiku apikálních a bazálních segmentů. Přes rozvoj těžkého kardiogenního šoku byl stav terapeuticky zvládnut umělou plicní ventilací, normobarickou oxygenoterapií a dočasnou léčbou katecholaminy. Do 2 týdnů se kompletně reparovala systolická funkce obou komor a nedošlo k trvalé hypoxické lézi centrální nervové soustavy. Stav připouští možnost souběhu toxické kardiomyopatie při otravě oxidem uhelnatým s tako-tsubo kardiomyopatií jako somatického důsledku dlouhodobé zátěže, která mohla vést až k suicidálnímu pokusu. Literární data naznačují, že stresová i toxická kardiomyopatie po otravě CO se často vyskytují současně, neboť jejich patofyziologické mechanizmy se do určité míry překrývají. Obě klinické jednotky mají po překlenutí akutní fáze dobrou prognózu.
Klíčová slova:
kardiogenní šok – kardiomyopatie – oxid uhelnatý – sebevražda – tako-tsubo kardiomyopatie
Úvod
Oxid uhelnatý (CO) je bezbarvý nedráždivý plyn bez zápachu, lehčí než vzduch, který vzniká při nedokonalém spalování sloučenin uhlíku a je součástí každého kouřového plynu [1]. Váže se na hemoglobin s přibližně 240krát vyšší afinitou než kyslík, což vede ke snížení krevní přenosové kapacity pro kyslík a vyvolává tkáňovou hypoxii. CO též působí přímo histotoxicky [2]. Nejvíce zranitelné jsou orgány s nejvyšší spotřebou kyslíku v organizmu, tj. srdce a mozek. Oxid uhelnatý zaujímá první místo mezi náhodnými otravami v Evropě (ročně 5 000–8 000 postižených ve Francii, 25 000 ve Velké Británii) i v USA (30 000–56 000 ošetřených) [1,2]. V České republice incidence po prudkém poklesu v 80. a 90. letech opět od počátku 21. století mírně stoupá a celkové množství případů ročně je odhadováno na 1 000–1 500 [1].
Popis případu
34letý muž byl nalezen náhodným kolemjdoucím. Seděl v autě, od výfuku byla zavedena hadice do kabiny automobilu. Svědkem byl vytažen a přivezen na interní ambulanci místně příslušné nemocnice. Odtud byl transportován rychlou zdravotnickou službou na Emergency FN Plzeň a do péče ho převzala Klinika anesteziologie, resuscitace a intenzivní medicíny (KARIM). Nejprve byla zahájena neinvazivní ventilace. Pro supraventrikulární tachykardii s frekvencí 220/min byl podán amiodaron s restaurací sinusového rytmu. Bedside analyzátorem byl změřen podíl karbonylhemoglobinu (COHb) 39 % a hladina laktátu > 15 mmol/l. Bylo pokračováno v neinvazivní ventilaci, při které se nemocný začal postupně navracet k vědomí. Při neinvazivní ventilaci se 100% koncentrací O2 hodnota COHb měřená stejnou metodou poklesla na 29 %. Postupně byla zlepšena kvalita vědomí natolik, že pacient vyhověl jednoduché výzvě. Byly odebrány vzorky pro vstupní laboratorní vyšetření, acidóza byla korigována bikarbonátem. Během desítek minut se u pacienta začal rozvíjet výrazný psychomotorický neklid a bylo nutno přistoupit k sedaci propofolem a zajištění dýchacích cest endotracheální intubací s napojením na umělou plicní ventilaci. Dále došlo k progresi oběhové nestability, byla nasazena léčba noradrenalinem ve stoupajících dávkách. Bylo provedeno CT vyšetření mozku a plic, bez patologického nálezu. První registrované 12svodové EKG ukazuje sinusovou tachykardii s elevacemi ST ve svodech V1–3 (obr. 1), s rychlou regresí změn po eliminaci CO. Echokardiograficky byla zjištěna těžce hypokinetická levá komora srdeční s ejekční frakcí cca 20 % se známkami výrazně sníženého srdečního výdeje (obr. 2 a obr. 3). Invazivní monitorace hemodynamiky metodou PiCCO (Pulse Contour Cardiac Output) měřila srdeční index (CI) 1,0 l/min/m2 s nízkým tepovým indexem (SVI) 9 ml/stah/m2. Byla zahájena inotropní podpora dobutaminem s postupným zlepšením stavu hemodynamiky a nárůstem CI na 2,5 l/min/m2. Hladina laktátu klesla na 9 mmol/l, myoglobin kulminoval na hodnotě 18 000 μg/l, high sensitive troponin T na hodnotě 420 ng/l. Během úvodního managementu nebylo s ohledem na šokový stav únosné zahájit hyperbarickou oxygenoterapii. Při postupné stabilizaci hemodynamiky došlo k normalizaci laktátu a poklesu kardiospecifické laboratoře. Kontrolní ECHO po 24 hod zobrazilo perzistující akinezu středních segmentů levé komory a mírnou obnovu kinetiky bazálních a apikálních segmentů s ejekční frakcí levé komory asi 25 %.
Obr. 1. Obr. 1. Křivka EKG při přijetí 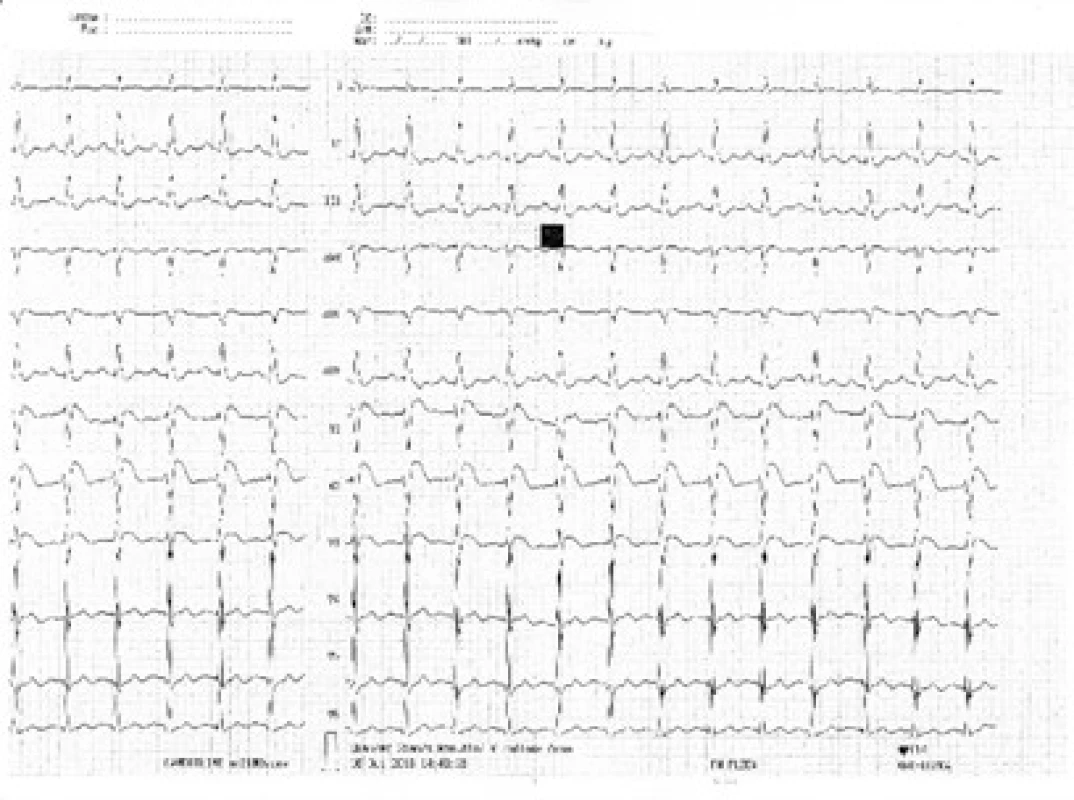
Obr. 2. Úvodní echokardiografické vyšetření – apikální 4dutinová projekce v enddiastole 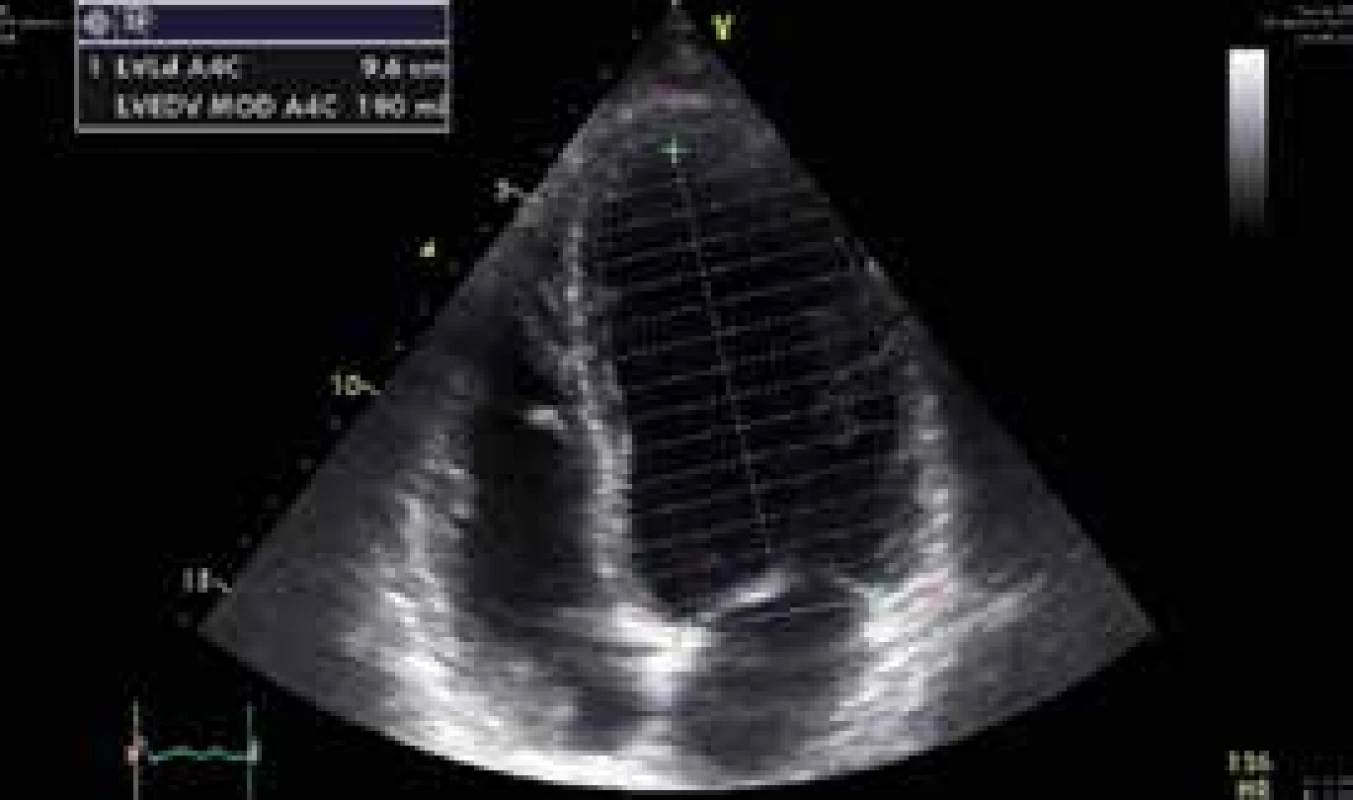
Obr. 3. Apikální 4dutinová projekce v endsystole s měřením ejekční frakce levé komory Simpsonovou metodou 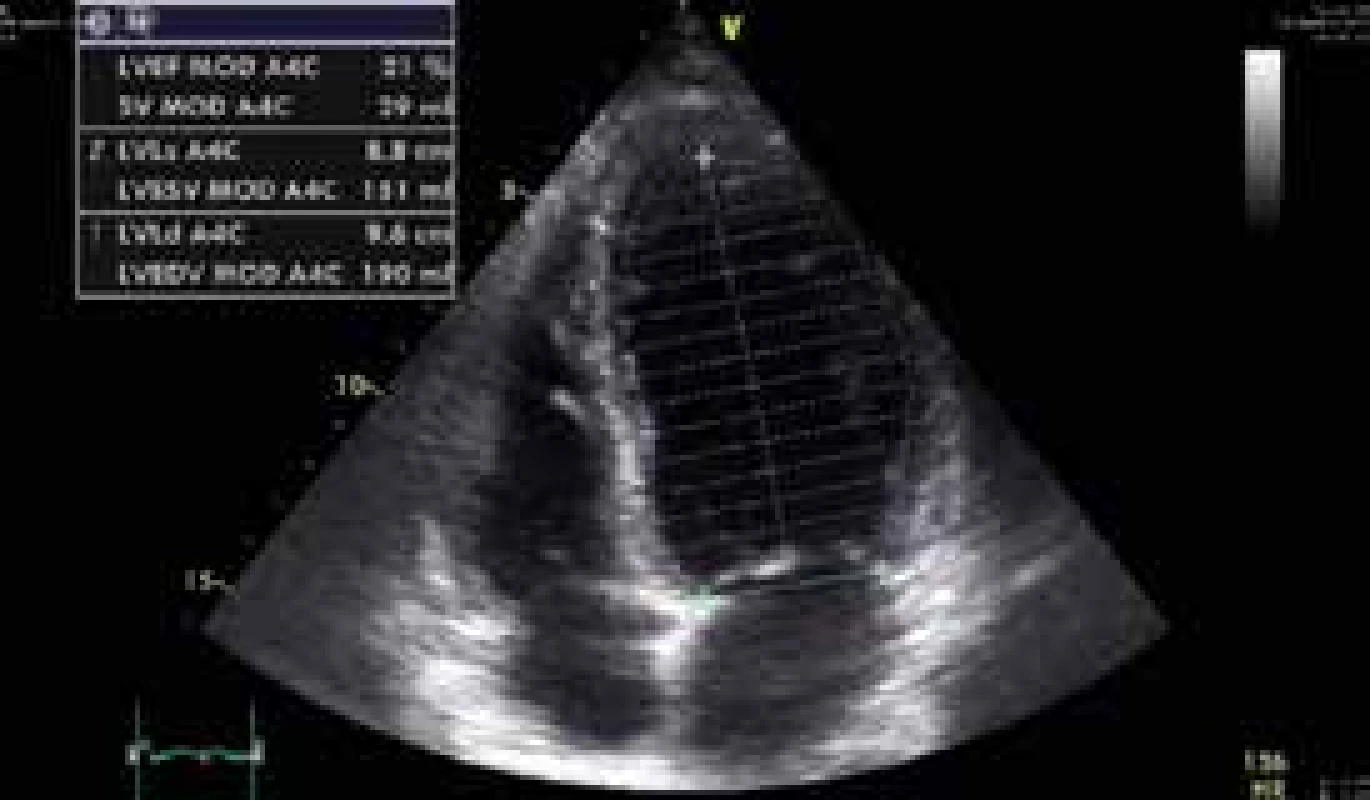
Další průběh: 3. den byla ukončena farmakologická sedace a nemocný se probral ke kvalitnímu vědomí. Byl vyšetřen neurologem s téměř normálním neurologickým nálezem. Bylo možné zahájit enterální nutrici. 4. den byl nemocný při uspokojivém stavu vědomí a dobré svalové síle a klesající oběhové podpoře nekomplikovaně extubován. 5. den bylo provedeno kontrolní neurologické vyšetření potvrzující prakticky normální nález, jen s mírně zpomaleným psychomotorickým tempem. Dále pacienta vyšetřil psychiatr s doporučením anxiolytické léčby a byla mu poskytnuta psychologická pomoc. 6. den byla zcela ukončena léčba katecholaminy a zrušena monitorace hemodynamiky. Dále bylo pokračováno v rehabilitaci včetně dechové. Kontrolní echokardiografické vyšetření 16. den ukázalo již zcela normální systolickou funkci levé komory (obr. 4 a 5). Časné koronarografické vyšetření nebylo indikováno s ohledem na identifikovanou příčinu systolické dysfunkce a její kompletní regresi. Souhrn echokardiografických nálezů připojujeme ve formě smyček na webovém kanále Youtube (obr. 6).
Obr. 4. Echokardiografické vyšetření s odstupem ukazující kompletní reparaci systolické funkce levé komory. Projekce v enddiastole 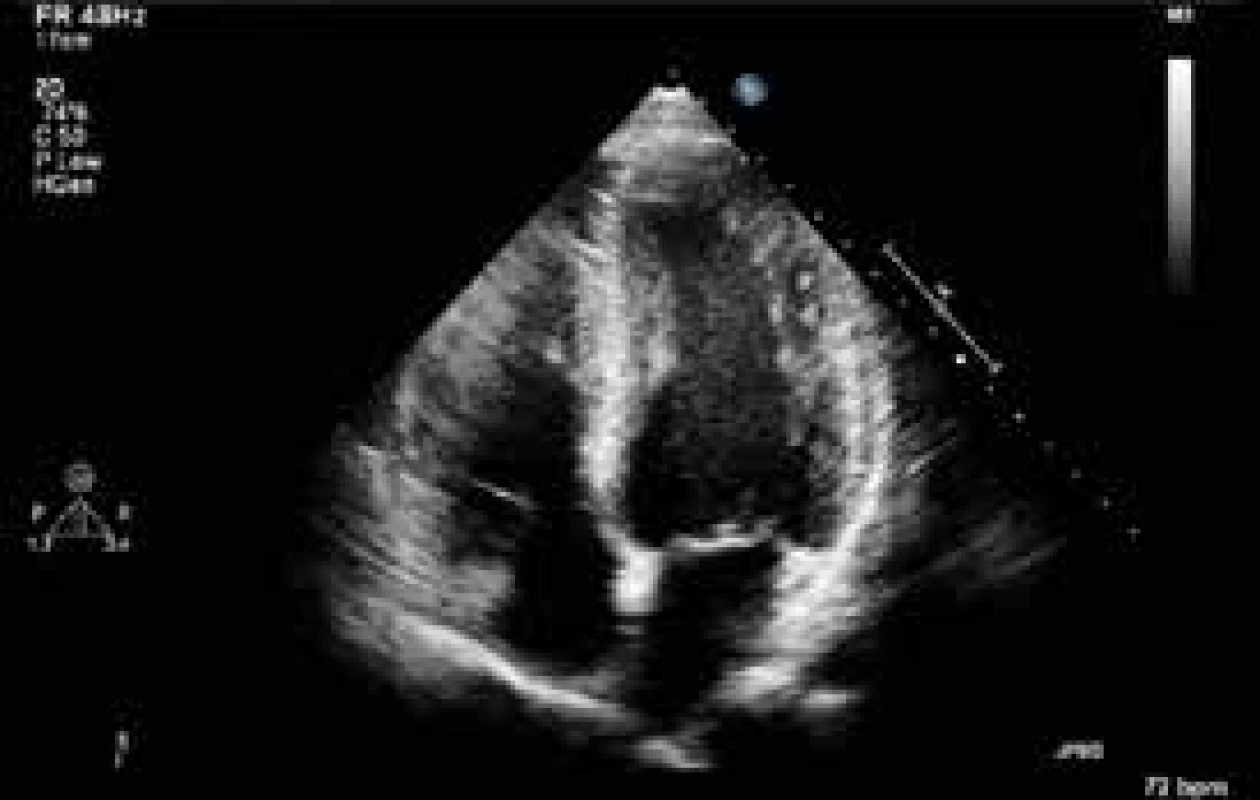
Obr. 5. Zobrazení v endsystole 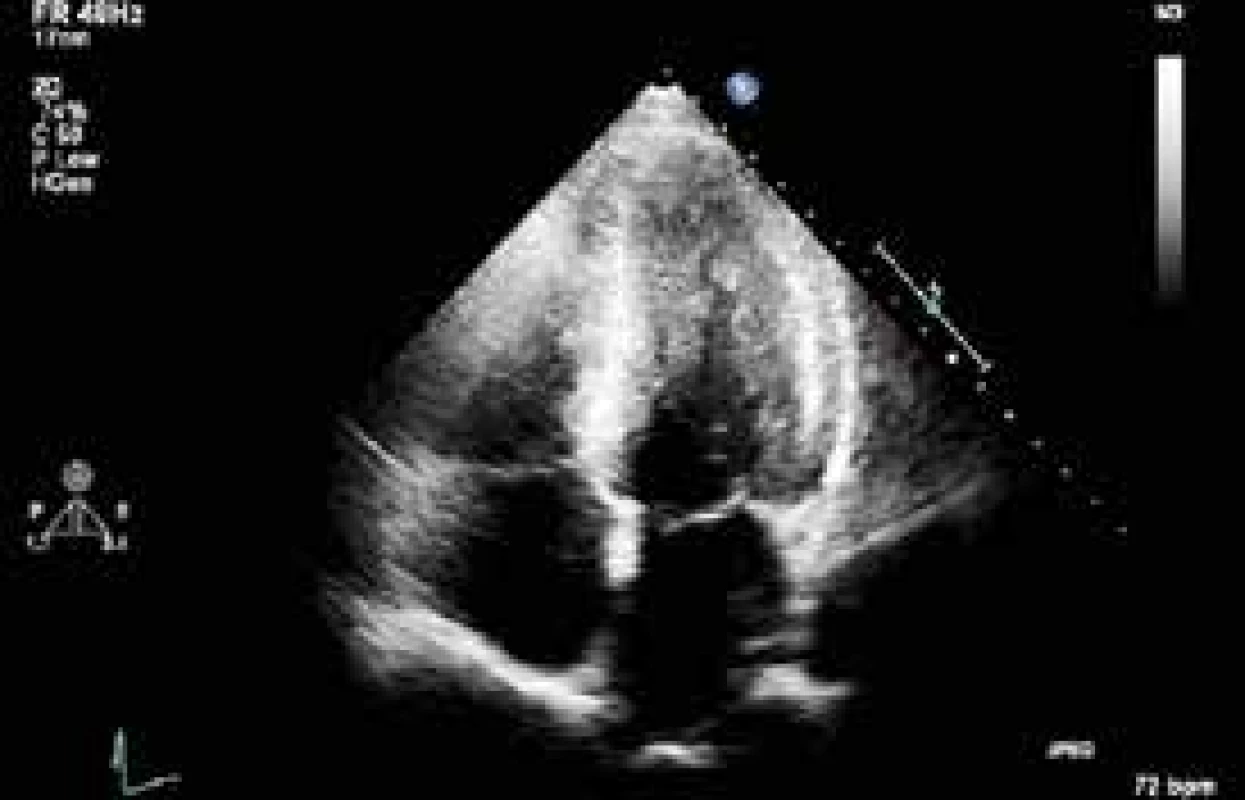
Obr. 6. QR kód odkazující na adresu videa na Youtube sestaveného z echokardiografických smyček. Dostupné z WWW: 
Kontrolní EKG nález na konci pobytu na lůžku intenzivní péče byl již v normě (obr. 7). Nadále byla užívána enterální nutrice + sipping tekutin a pacient mohl být přeložen z lůžka KARIM na interní oddělení místně příslušné nemocnice. Odtud byl pacient po 3 dnech přeložen na Psychiatrické oddělení FN Plzeň, a poté po 3 týdnech propuštěn v psychosomaticky velmi dobře kompenzovaném stavu do ambulantní péče.
Obr. 7. Kontrolní EKG křivka při dimisi 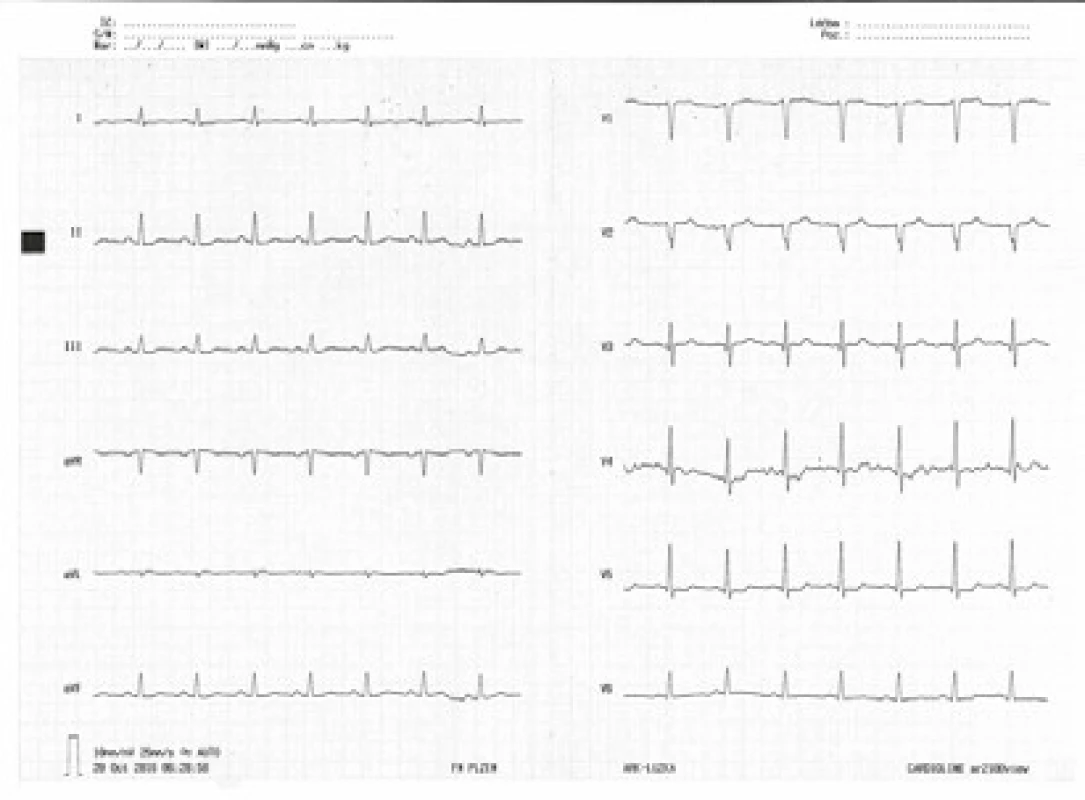
U našeho pacienta byl zvolen léčebný postup normobarickou oxygenoterapií z nutnosti urgentního managementu těžkého kardiogenního šoku a elektrické nestability myokardu. Prohloubení cirkulačního selhání v úvodu si vyžádalo zavedení katecholaminové léčby s rychlou eskalací. V případě selhání inotropní léčby a progresi šokového stavu by byla zvážena mechanická oběhová podpora VA ECMO (Veno-Arteriální Extrakorporální Membránová Oxygenace). Přetrvávající systolická dysfunkce LK při kontrolních echokardiografických vyšetřeních by byla indikací k provedení koronarografie. Farmakoterapii srdečního selhání při stresové či toxické kardiomyopatii je pro absenci robustních dat nutné individualizovat.
Diskuse
Diagnostický a léčebný standard těžké otravy CO [1] preferuje v nemocniční fázi léčby, pokud je to možné, použití hyperbarické oxygenoterapie (HBO) oproti normobarické oxygenoterapii (NBO). Zejména se opírá o výsledky retrospektivních, observačních a historických studií, které prokázaly pozitivní vliv HBO pro prevenci vzniku pozdního neurologického postižení. Studie australských autorů z roku 1999 [3] neprokazující efekt HBO byla kritizována pro mnohé metodologické nedostatky (více než 60 % sebevrahů s kombinací otravy CO, alkoholu a jiných látek, aplikace kyslíku po dobu 3 dnů nebývá klinicky obvyklá, interval od inzultu do zahájení HBO v průměru 9,3 hod, jednoměsíční follow-up u méně než 50 % pacientů). Studie amerických autorů z roku 2002 [4] prokázala význam HBO oproti NBO ve smyslu snížení výskytu pozdního neurologického poškození v 6 týdnech (46 % vs 25 %), 6 i 12 měsících, současně vyhovovala i po metodologické stránce, follow-up v 6 měsících u 77 % pacientů. Post hoc analýza této studie [4] prokázala prospěch u pacientů starších 50 let, se ztrátou vědomí během expozice, s hladinou COHb > 25 % a s výraznou metabolickou acidózou. U ostatních pacientů byla HBO bez rozdílu vůči NBO. Na základě těchto výsledků není v závěrech systémových metaanalýz HBO rutinně favorizována před NBO, zůstává však vyčleněna pro otravy CO se závažnějším průběhem [1]. V letech 2001–2005 absolvovalo v ČR léčbu HBO pouze průměrně 2,5 % pacientů postižených otravou CO s rozdíly závislými na místě bydliště a lokální dostupnosti hyperbarické komory (Plzeň a Ostrava 13 %, Praha 2,9 %) [1].
Kardiovaskulární účinky CO jsou rozmanité. Až u třetiny pacientů se střední až těžkou intoxikací CO se vyvine myokardiální postižení, které může být spojeno se zvýšenou krátkodobou i dlouhodobou mortalitou. Literární zdroje uvádějí četné patofyziologické mechanizmy. Animální studie ozřejmují, že snížená systémová distribuce kyslíku při otravě CO je zpočátku kompenzována zvýšeným srdečním výdejem a zvýšenou extrakcí kyslíku v tkáních až do vyčerpání kompenzačních mechanizmů [5]. Snížená dodávka kyslíku, zvýšená spotřeba a zvýšená kontraktilita myokardu může u pacientů s preexistujícím obstruktivním koronárním onemocněním vyvolat infarkt myokardu 2. typu [6]. Navíc oxidem uhelnatým zprostředkovaná zvýšená produkce volných radikálů je považována za stimulátor koronární vazokonstrikce [7] a CO a ostatní emisní škodliviny jsou rizikovým faktorem pro arteriální a žilní trombózu, pravděpodobně na podkladě vazby CO na hem vázaný na fibrinogen a vytěsňující z této vazby oxid dusnatý (NO) [7]. Volný NO se pak účastní reakcí zvyšujících produkci peroxidových radikálů, a tím vede ke zvýšené agregaci trombocytů [6]. Dalším mechanizmem je působení oxidu uhelnatého na mitochondrie vedoucí k inhibici oxidativní fosforylace a spolu s přímou vazbou CO na myoglobin v myocytech (60krát vyšší afinita k CO než k O2) rezultující v myokardiální dysfunkci s globálními i regionálními poruchami kinetiky, případně i ve vznik infarktu myokardu i přes absenci stenózujícího onemocnění koronárních tepen [7–9]. Jsou popisovány i proarytmogenní účinky CO, v jejichž důsledku na podkladě inhibice oxidativní fosforylace a snížené produkce adenosintrifosfátu (ATP) dochází na narušení rovnováhy iontů Ca2+ s poruchou fyziologických gradientů mezi extracelulárním a intracelulárním prostředím, vedoucím ke zvýšení senzitivity myofilament, zvýšené hladině intracelulárního vápníku v diastole a zvýšení citlivosti k β1-adrenergní stimulaci [10]. Důsledkem působení CO je dále zpomalení repolarizace a prodloužení QT intervalu na EKG [11,12]. Ve studii s komorovými myocyty oxid uhelnatý navodil zvýšení hladiny oxidu dusnatého a prodloužil působení pozdního sodíkového proudu ve fázi 3 akčního potenciálu [12]. Jedna publikovaná kazuistika se týká tranzitorní AV-blokády 1. stupně při relativně mírné náhodné intoxikaci oxidem uhelnatým: po eliminaci noxy převodní porucha kompletně vymizela a nebyla ozřejměna jiná příčina [13]. Obdobně byla publikována kazuistika vzniku tranzitorního bloku levého raménka Tawarova při otravě CO [14]. V obou případech jde o ojedinělá sdělení.
Retrospektivní studie japonských autorů [15] na 626 pacientech intoxikovaných oxidem uhelnatým identifikovala rozvoj CO toxické kardiomyopatie u 19 pacientů, z toho u 6 pacientů se jednalo o klinický nález kompatibilní s diagnózou stresové kardiomyopatie. Ve svém závěru se autoři přiklánějí k dominantnímu patofyziologickému působení vysokých hladin katecholaminů a současně selhání předpokládaných fyziologických bariér, bránících vzniku katecholaminového poškození. V klinických projevech jsou však četné interindividuální rozdíly. Kupříkladu bolest na hrudi je méně četná u CO indukované než stresové kardiomyopatie. Změny ST-úseku nebývají natolik výrazné u stresové jako u CO indukované kardiomyopatie. Dále stresová kardiomyopatie má vyšší prevalenci u postmenopauzálních žen.
Též dle francouzských autorů [16] se u syndromů s tranzitorní dysfunkcí levé komory srdeční uplatňuje individuální variabilita myokardiální perfuze, individuální rozdíly v distribuci adrenergních receptorů v myokardu a rozdíly v metabolizmu katecholaminů. Animální studie amerických autorů [17] týkající se autonomní regulace orgánové vaskulární rezistence při hypoxemii ukázala rozdíl v působení prosté hypoxické hypoxemie a hypoxemie navozené působením CO na karotické a aortální chemoreceptory, sledována byla aferentní stimulace vagových jader těmito receptory.
Jak bylo uvedeno výše, účinky CO na organizmus nespočívají jen v prosté hypoxemii při kompetici CO a O2 o vazebnou kapacitu hemoglobinu. Jedná se pravděpodobně o komplexní mechanizmus, jehož se CO účastní. Budoucí výzkum a další studie mohou přinést více informací.
Kardiomyopatie indukovaná oxidem uhelnatým není zatím zavedenou klinickou jednotkou.
Stresová či tako-tsubo kardiomyopatie je onemocnění myokardu, které je dle převládajícího konsenzu způsobené vysokou hladinu katecholaminů na podkladě působení nejrůznějších stresorů. Projevem tohoto onemocnění jsou dočasné, převážně segmentární poruchy kinetiky jedné či obou srdečních komor s apikální predominancí. Nonuniformity ložiskových poruch kinetiky jsou vysvětlovány nerovnoměrným rozložením beta-receptorů v myokardu.
Oxidem uhelnatým navozená kardiomyopatie má po překlenutí akutní fáze dobrou dlouhodobou prognózu [15]. Tako-tsubo kardiomyopatie v ročním sledování v souboru pacientů českých autorů [18] vykazovala mortalitu 14,9 %.
Závěr
Náš případ mladého, zdravého muže stiženého otravou CO v sebevražedném pokusu, který díky okamžitému zahájení adekvátní léčby a svým velmi dobrým biologickým rezervám byl schopen návratu do běžného života bez trvalých následků, popisuje vznik akutního srdečního selhání s rozvojem těžkého kardiogenního šoku, v němž bylo dominantním mechanizmem toxické působení CO na myokard. Okolnosti, za kterých k intoxikaci došlo, nutily pomýšlet i na podíl stresem indukované kardiomyopatie. Patofyziologické mechanizmy obou typů srdečního postižení se dle literárních dat do určité míry překrývají.
Oxid uhelnatý patří mezi nejčastější příčiny otrav. Zatím není dostupné žádné specifické antidotum. Hyperbarická oxygenoterapie zůstává nadále efektivním způsobem léčby. Technologický pokrok a všeobecná osvěta působí jako efektivní prevence a přispěly ke snížení rizika náhodných otrav CO. Do budoucna však nadále zůstává prostor k vyvinutí dalších a účinnějších způsobů léčby. Mohou se objevit např. nefarmakologické postupy facilitující disociaci CO z vazby na hemoglobin nebo farmakologická antidota, která by mohla být podána v terénu, např. molekuly-scavengery CO.
Tato práce byla podpořena projektem Ministerstva zdravotnictví koncepčního rozvoje výzkumné organizace (FN Plzeň, 00669806) a programem podpory rozvoje vědy UK (Progres Q38).
MUDr. Radek Vančata
Komplexní kardiovaskulární centrum – kardiologické oddělení, FN Plzeň, pracoviště Lochotín
Doručeno do redakce 27. 10. 2017
Přijato po recenzi 12. 2. 2018
Zdroje
- Hájek M. Diagnostický a léčebný standard otravy oxidem uhelnatým. Anesteziologie, resuscitace a intenzivní medicína. Referátový výběr z anesteziologie, resuscitace a intenzivní medicíny 2009; 56(6): 393–402.
- Hampson NB, Piantadosi CA, Thom SR et al. Practice recommendations in the diagnosis, management, and prevention of carbon monoxide poisoning. Am J Respir Crit Care Med 2012; 186(11): 1095–1101. Dostupné z DOI: <http://dx.doi.org/10.1164/rccm.201207–1284CI>.
- Scheinkestel CD, Bailey M, Myles PS et al. Hyperbaric or normobaric oxygen for acute carbon monoxide poisoning: a randomised controlled clinical trial. Med J Aust 1999; 170(5): 203–210.
- Weaver LK, Hopkins RO, Chan KJ et al. Hyperbaric oxygen for acute carbon monoxide poisoning. N Engl J Med 2002; 347(14): 1057–1067. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa013121>.
- Smithline HA, Ward KR, Chiulli DA et al. Whole body oxygen consumption and critical oxygen delivery in response to prolonged and severe carbon monoxidy poisoning. Resuscitation 2003; 56(1): 97–104.
- Dziewierz A, Ciszowski K, Gawlikovski T et al. Primary angioplasty in patient with ST-segment elevation myocardial infarction in the settling of intentional carbon monoxide poisoning. J Emerg Med 2013; 45(6): 831–834. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jemermed.2013.05.061>.
- Lippi G, Rastelli G, Meschi T et al. Pathophysiology, clinics, diagnosis and treatment of heart involvement in carbon monoxide poisoning. Clin Biochem 2012; 45(16–17): 1278–1285. Dostupné z DOI: <http://dx.doi.org/10.1016/j.clinbiochem.2012.06.004>.
- Prockop LD, Chichkova RI. Carbon monoxide intoxication: an updated review. J Neurol Sci 2007; 262(1–2): 122–130. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jns.2007.06.037>.
- Tritapepe L, Macchiareli G, Rocco M et al. Functional and ultrastructural evidence of myocardial stunning after acute carbon monoxide poisoning. Crit Care Med 1998; 26(4): 797–801.
- Andre L, Boissiere J, Reboul C et al. Carbon monoxide pollution promotes cardiac remodelling and ventricular arrhytmia in healthy rats. Am J Respir Crit Care Med 2010; 181(6): 587–595. Dostupné z DOI: <http://dx.doi.org/10.1164/rccm.200905–0794OC>.
- Macmillan CS, Wildsmith JA, Hamilton WF Reversible increase in QT dispersion during carbon monoxide poisoning. Acta Anaesthesiol Scand 2001; 45(3): 396–397.
- Dallas ML, Yang Z, Boyle JP et al. Carbon monoxide induces cardiac arrhytmia via induction of the late Na+ current. Am J Respir Crit Care Med 2012; 186(7): 648–656. Dostupné z DOI: <http://dx.doi.org/10.1164/rccm.201204–0688OC>.
- Salih SB, Alenezi H, Alghamdi A. A case of first degree AV block in carbon monoxide poisoning. J Saudi Heart Assoc 2013; 25(4): 255–259. <http://dx.doi.org/10.1016/j.jsha.2013.05.004>.
- Bayramoglu A, Kocak AO, Akbas I et al. Reversible left bundle-branch block due to carbon monoxide poisoning: a case report. Am J Emerg Med 2016; 34(2): 342.e1–3. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ajem.2015.06.034>.
- Jung YS, Lee JS, Min YG et al. Carbon monoxide-induced cardiomyopathy – epidemiology, clinical characteristics and prognosis. Circ J 2014; 78(6): 1437–1444.
- Mikail H, Hess S, Jessel L et al. Takotsubo and Takotsubo-like syndrome: A common neurogenic myocardial stunning pathway? Int J Cardiol 2013; 166(1): 248–250. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ijcard.2012.09.116>.
- Fitzgerald RS, Deghani GA, Kiihl S. Autonomic regulation of organ vascular resistances during hypoxemia in the cat. Auton Neurosci 2013; 174(1–2): 21–30. Dostupné z DOI: <http://dx.doi.org/10.1016/j.autneu.2012.11.005>.
- Kuběna P, Bohatá Š, Maňoušek J et al. Takotsubo kardiomyopatie, klinické zkušenosti s onemocněním a jednoletá prognóza pacientů. Vnitř Lék 2015; 61(7–8): 619–625.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Kontroverze v léčbě dnyČlánek Z odborné literatury
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2018 Číslo 7-8- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
- Genetický podklad a screening familiární hypercholesterolémie
- Metabolit živočišné stravy produkovaný střevní mikroflórou zvyšuje riziko závažných kardiovaskulárních příhod
-
Všetky články tohto čísla
- Má význam zabývat se nízkosacharidovou a ketogenní dietou u osob s diabetem? Editorial
- Hadím jedem indukovaná koagulopatie – editorial
- Skotský model dávkování vankomycinu a monitorování jeho hladin zlepšuje účinnost i bezpečnost léčby vankomycinem
- Mezenchymální kmenové buňky a léčba diabetu 1. typu
- Jak diagnostikovat sarkoidózu srdce?
- Budúcnosť farmakologickej liečby nealkoholovej steatoheptitídy z pohľadu kľúčových patofyziologických mechanizmov
- Nízkosacharidová strava v léčbě diabetes mellitus
- Kontroverze v léčbě dny
- Funkce endotelu, její vztah k arteriální hypertenzi a možnosti její modulace
- Srdeční postižení u suicidální intoxikace oxidem uhelnatým s rysy toxické i stresové kardiomyopatie: kazuistika
- Trimeresurus albolabris (štrkáčovec bieloústy) – hlásenie uhryznutia: kazuistika
-
Za prof. MUDr. Václavem Zamrazilem, DrSc.
*28. 9. 1936 – †27. 6. 2018 -
Odešel prof. MUDr. Jaroslav Rybka, DrSc
*21. 11. 1931 – †3. 7. 2018 - Příspěvek ke článkům v publikaci
- Spironolakton v léčbě hypertenze: opomíjená molekula
- Z odborné literatury
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Nízkosacharidová strava v léčbě diabetes mellitus
- Spironolakton v léčbě hypertenze: opomíjená molekula
- Mezenchymální kmenové buňky a léčba diabetu 1. typu
- Kontroverze v léčbě dny
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



