Infarkt myokardu u pacienta s metabolickým syndromem a prokázaným syndromem obstrukční spánkové apnoe
Acute myocardial infarction in a male patient with metabolic syndrome and obstructive sleep apnea syndrome
A casuistic of a male, obese smoker, to whom the syndrom of obstructive sleep apnea (OSA) was diagnosed at his age of 32 years, was suffering from acute myocardial infarction at his 50 years. The patient had fulfilled all criteria of metabolic syndrome during time of acute heart attack: visceral obesity, arterial hypertension, mixed dyslipidemia, and type 2 diabetes mellitus. He was never examined by routine screening and then not treated. This patient ranked to the very high total cardiovascular risk subjects before the acute event occured. The growing evidence suggests that OSA may contribute to the metabolic derangements that characterized the metabolic syndrome and high cardiovascular risk. It follows that after syndrome OSA determination, standard risk factors for metabolic syndrome and atherosclerotic cardiovascular disease should be asessed and start preventive lifestyle recommendations and treatment.
Keywords:
myocardial infarction – obstructive sleep apnea syndrome – metabolic syndrome
Autori:
Jan Peterka; Hana Rosolová
Pôsobisko autorov:
II. interní klinika UK, LF v Plzni a Fakultní nemocnice Plzeň
Vyšlo v časopise:
Vnitř Lék 2020; 66(1): 44-48
Kategória:
Kazuistika
Súhrn
Je popsána kazuistika muže, obézního kuřáka, kterému byl v jeho 32 letech diagnostikován syndrom obstrukční spánkové apnoe (OSA) a který dostal v 50 letech akutní infarkt myokardu. Tento pacient splňoval v době akutní srdeční příhody všechna kritéria metabolického syndromu (MS); měl viscerální obezitu, arteriální hypertenzi, smíšenou dyslipidemii a diabetes mellitus (DM) 2. typu. Nebyl nikdy preventivně vyšetřen, a tedy ani léčen. Tento pacient měl velmi vysoké celkové kardiovaskulární riziko již před infarktem myokardu. Předpokládá se, že syndrom OSA může různou měrou přispívat k rozvoji jednotlivých složek MS a vysokému celkovému riziku pro aterosklerotická kardiovaskulární onemocnění (ASKVO). Z kazuistiky vyplývá, že při diagnostice spánkové apnoe by se měly vyšetřit základní rizikové faktory pro MS a ASKVO a měla by být včas zahájena prevence a léčba.
Klíčová slova:
infarkt myokardu – metabolický syndrom – syndrom obstrukční spánkové apnoe
Úvod
Mezi základní rizikové faktory pro ASKVO patří hypercholesterolemie, kouření, arteriální hypertenze, diabetes mellitus (DM) a obezita abdominálního (viscerálního) typu, která je často součástí metabolického syndromu (MS). Tento syndrom je definovaný jako přítomnost 3 nebo více z pěti základních rizikových faktorů charakterizujících osobu s inzulinovou rezistencí: zvětšený obvod pasu u muže ≥ 102 cm, u žen ≥ 88 cm, zvýšený krevní tlak ≥ 130/85 mm Hg nebo antihypertenzní léčba, aterogenní dyslipidemie (triglyceridy (TG) ≥ 1,7 mmol/l) nebo HDL‑cholesterol u mužů < 1,0 mmol/l a u žen < 1,3 mmol/l nebo hypolipidemická léčba a porucha glukózového metabolismu (hraniční lačná glykemie: 5,6–6,9 mmol/l nebo porušená glukózová tolerance nebo již přítomný DM) nebo antidiabetická terapie (1). Pacienti s MS mají 3× vyšší riziko rozvoje ASKVO a 5× vyšší riziko rozvoje DM 2. typu (2). Pacienti s MS trpí velmi často také syndromem OSA, který zvyšuje aktivitu sympatického nervového systému, často se podílí na rozvoji arteriální hypertenze a dalšími mechanismy může zvyšovat celkové kardiovaskulární riziko, jak prokazují některé studie. Je popisováno, že již samotný syndrom OSA může přinést komplikace metabolické, kardiovaskulární a cerebrovaskulární (3).
Popis případu
Pacient, 50letý muž, přichází na příjmovou ambulanci interní kliniky pro tlakové bolesti na hrudi typu stenokardie s anamnézou trvání dvou hodin od jejich vzniku.
Z rodinné anamnézy pacienta: matka léčena pouze pro DM 2. typu, otec zemřel mlád, okolnosti úmrtí pacient neznal. Dvě děti pacienta jsou doposud zcela zdrávy.
Pacient byl dlouhodobý kuřák (20 cigaret/den od 14 let věku). V 32 letech prodělal laserovou uvuloplastiku (LAUP) pro syndrom OSA, kontrolní spánková monitorace po operaci tehdy prokázala významné zlepšení obtíží, nadále však v poradně pro poruchy spánku nebyl sledován. Dále prodělal appendektomii v mládí. Pacient doposud neužíval chronicky žádnou medikaci.
Při vstupním fyzikálním vyšetření byl pacient bledý, opocený, bez cyanózy či dušnosti, anikterický, na plicích a srdci s fyziologickým poslechovým nálezem. Dolní končetiny měl bez otoků, s pulzacemi patrnými do periferie.
Hodnota vstupního tlaku krve byla 170/120 mm Hg, puls 80/min, SpO2 98%, BMI 33,2 kg/m2 , obvod pasu 110 cm.
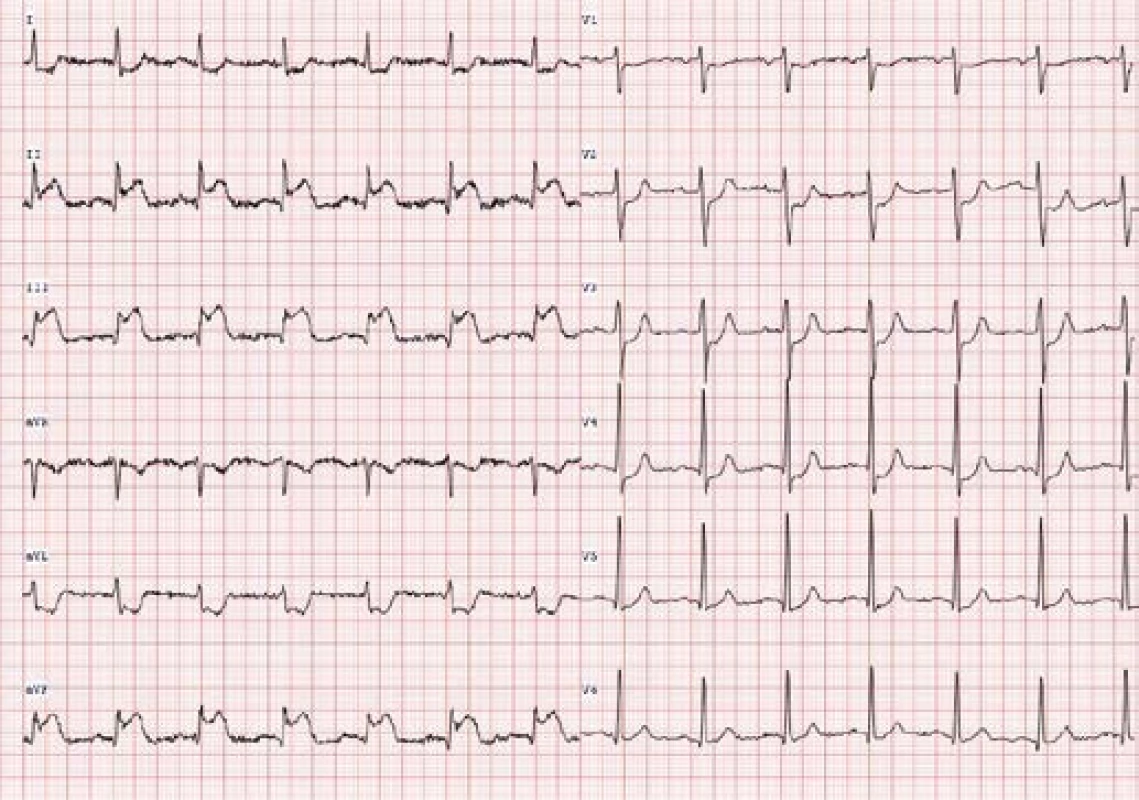
Na vstupním EKG byl obraz akutního infarktu myokardu s ele‑ vacemi ST úseků na spodní stěně s kontralaterálními ST depresemi, tj. depresemi ST na přední stěně levé komory (Obr. 1).
Hodnota vstupního vysoce senzitivního troponinu T (hsTnT) byla 24 ng/l. Lipidogram: celkový cholesterol 6,83 mmol/l, TG 3,16 mmol/l, LDL‑cholesterol 4,46 mmol/l, HDL‑cholesterol 0,93 mmol/l, nonHDL‑ cholesterol 5,9 mmol/l. Glykemie 9,6 mmol/l, Na 139 mmol/l, K 3,6 mmol/l, Cl 104 mmol/l, urea 6,6 mmol/l, kreatinin 108 µmol/l.
Okamžitě byla pacientovi podána iniciální kombinovaná antitrombotická a antikoagulační terapie při akutním koronárním syndromu (acetylsalicylová kyselina v dávce 500 mg a heparin v dávce 5000 IU intravenózně, ticagrelol v dávce 180 mg perorálně). Ještě před převozem pacienta na invazivní kardiologii k provedení koronární revaskularizace došlo k zástavě oběhu při komorové fibrilaci, a tak byla zahájena rozšířená resuscitace s defibrilací komor. Po resuscitaci se na EKG rozvinula AV blokáda 3. stupně.
Při urgentním koronarografickém vyšetření byl prokázán trombotický uzávěr pravé koronární tepny, byla provedena angioplas‑ tika a implantován lékový stent, byl intravenózně podán Integrilin (eptifibatid) v dávce 21,6 mg. Další hodnoty hsTnT byly 591 ng/l (za 2 hodiny od 1. náběru) a 2 134 ng/l (za 6 hodin od 2. náběru); včasný zákrok vedl k relativně malému vzestupu hodnoty hsTnT, a tedy výrazně omezenému rozsahu myokardiální nekrózy.
Echokardiografické vyšetření prokázalo hypokinezi baze spodní stěny a přilehlé části septa, ostatní myokard měl dobrou kinetiku, levá komora měla dysfunkci charakteru restrikce a ejekční frakci 50 %.
Na skiagramu hrudníku nebyl pleurální výpotek, nález na plicích a mediastinu byl fyziologický.
Opakovaně byly za hospitalizace registrovány hodnoty systolického krevního tlaku přes 140/90 mm Hg. Dále byla opakovaně zjišťována lačná glykemie ≥ 7 mmol/l, a tak byla stanovena diagnóza DM 2. typu.
Byla zahájena intenzivní statinová terapie (atorvastatin v denní dávce 80 mg), zavedeno antihypertenzivum ze skupiny inhibitorů ACE (perindopril arginin v denní dávce 5 mg).
V dalším průběhu hospitalizace byl pacient oběhově stabilní, bez převodních poruch rytmu či komorových arytmií, nicméně kontinuální EKG monitorace prokázala opakované bradykardie v nočních hodinách s poklesem tepové frekvence až ke 40 tepům za minutu. Vzhledem k suspektní souvislosti nočních bradykardií s apnoickým pauzami ve spánku byla doplněna limitovaná polygrafie, která prokázala těžkou formou syndromu OSA s AHI (apnoe‑hypopnoe index udávající počet apnoí a hypopnoí za hodinu spánku) 39,4/h (Obr. 2). V Epworthské škále spavosti (ESS) dosáhl pacient skóre 3 z 24 bodů. Pro poruchy dýchání ve spánku byla pacientovi navržena další vyšetření a event. léčba syndromu spánkové apnoe přetlakovým dýcháním (PAP). Pacient však další vyšetřování odmítl. Devátý den hospitalizace byl pacient propuštěn do ambulantní péče.
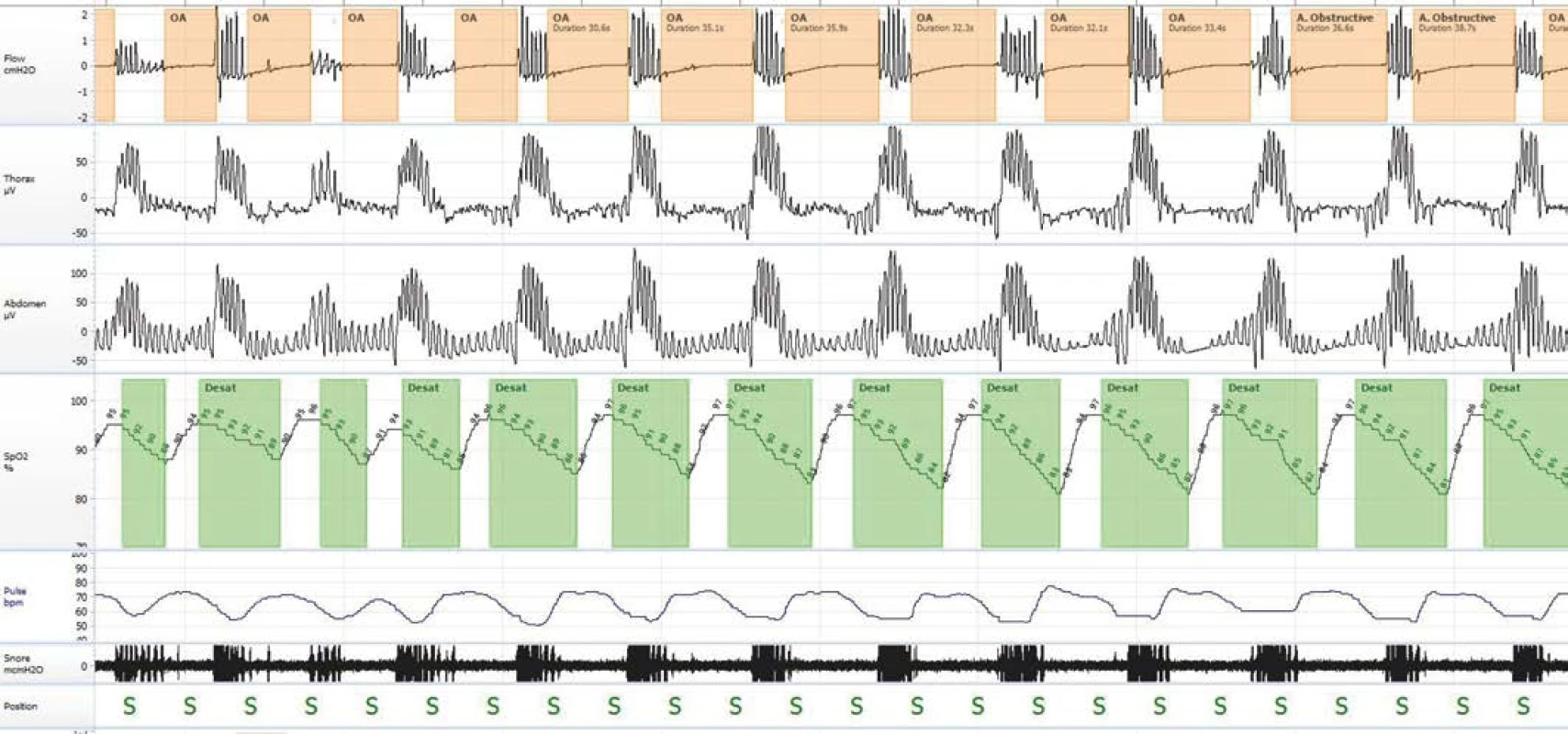
V ambulantním režimu byla s krátkým odstupem od hospitalizace doplněna kontrolní 24hodinová EKG monitorace. Byly nalezeny noční asystolické pauzy s maximem 7,8 sekundy a pokles tepové frekvence na 18 tepů za minutu, a proto byl pacientovi posléze implantován dvoudutinový trvalý kardiostimulátor (TKS). Léčbu syndromu spánkové apnoe si, ani po opakovaném vysvětlení jeho významu, pacient nadále nepřál.
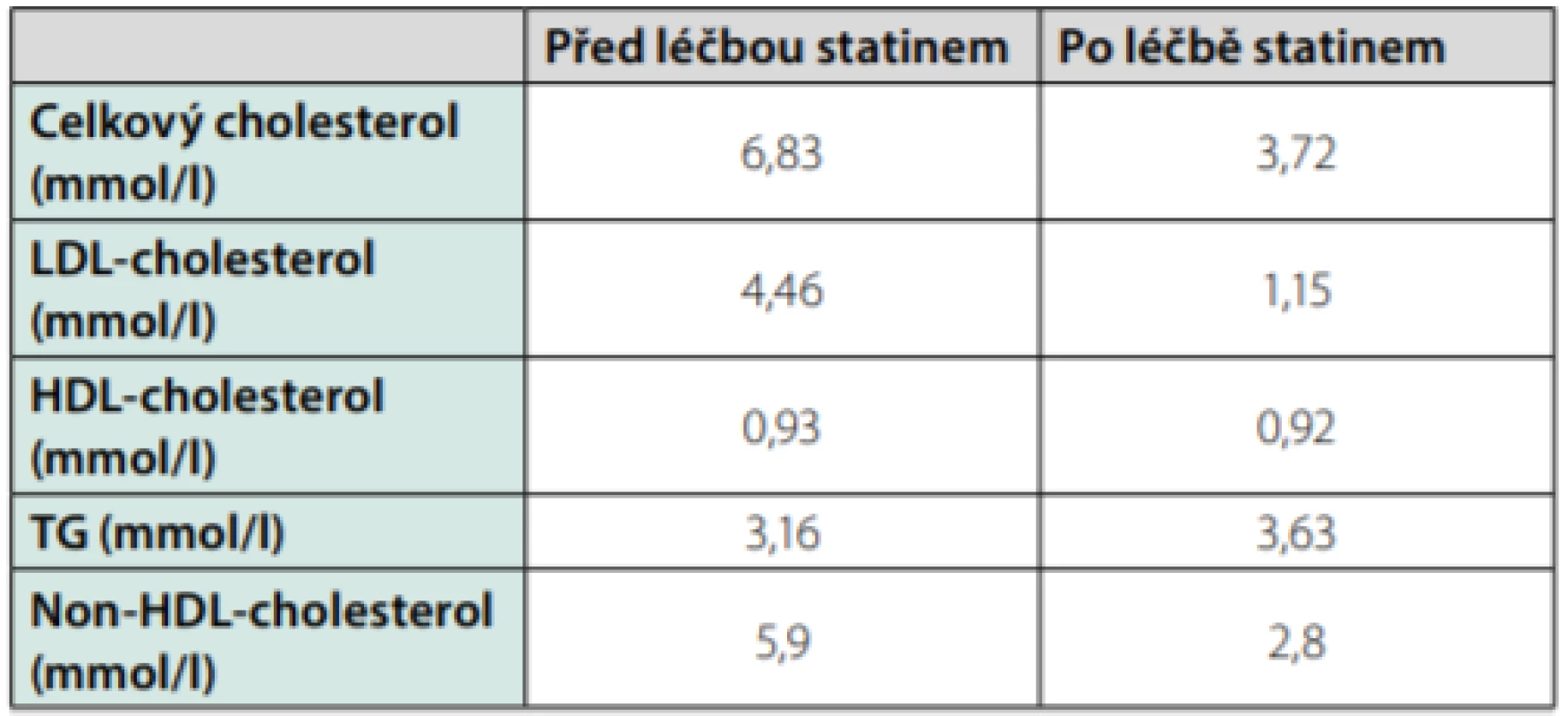
Lipidogram se po léčbě atorvastatinem 80 mg denně zlepšil (Tab. 1), LDL‑cholesterol poklesl o více než 50 % výchozí hodnoty a jeho hodnota splnila doporučovaný cílový limit pod 1,4 mmol/l; přetrvávala však aterogenní dyslipidemie (TG 3,63 mmol/l, HDL‑cholesterol 0,92 mmol/l) typická pro DM 2. typu, a proto byl nasazen do kombinace se statinem fenofibrát. Sekundárním cílem pro léčbu této dyslipidemie je u pacienta v sekundární prevenci ASKVO non‑HDL‑cholesterol pod 2,2 mmol/l nebo apolipoprotein B pod 0,65 g/l (4).
Diskuze
Dosud ničím neléčený 50letý obézní muž, silný dlouholetý kuřák, kterému již v jeho 32 letech byl prokázán syndrom OSA, dostal akutní infarkt myokardu spodní stěny. Bohužel po provedení uvuloplastiky v jeho 32 letech pro syndrom OSA již dále nedocházel do spánkové laboratoře a nikdy se u něho údajně neprovedla žádná preventivní vyšetření. Přitom se jednalo o velmi vysoce rizikového pacienta již před náhlou srdeční příhodou. Pacientovi byl zjištěn během hospitalizace DM i arteriální hypertenze a také splňoval všechna kritéria MS. Tento pacient by jistě profitoval z pravidelné a včasné léčby dyslipidemie, hypertenze i DM 2. typu. V případě dyslipidemie měla být terapie (podle aktuálních ESC/EAS doporučení z roku 2019) vedena k identickým cílovým hodnotám jako u pacientů v sekundární prevenci ASKVO; tedy jeho koncentrace LDL‑cholesterolu měla dosahovat cílové hodnoty pod < 1,4 mmol/l, což by splňovalo podmínky redukce LDL‑cholesterolu o minimálně 50 %. Zanechání kouření, léčba hypertenze a redukce hmotnosti jsou změny, o kterých bylo opakovaně prokázáno, že snižují nejen KV riziko, ale i riziko vzniku DM 2. typu. Dalším tzv. faktorem modifikujícím KV riziko je u pacienta právě přítomnost MS a syndromu OSA. Kumulace všech těchto rizikových faktorů a chorob bez preventivního zásahu vedla k předčasnému vzniku náhlé kardiovaskulární příhody, k infarktu myokardu. Právě preventivní prohlídky u praktických lékařů by měly zajistit identifikaci vysoce rizikových pacientů pro ASKVO i pro DM. Také dispenzarizace ve spánkové laboratoři, která byla pacientovi nabídnuta, ale kterou odmítl, mohla pomoci ke včasnému odhalení dalších rizikových faktorů.
Syndrom OSA byl diagnostikován pacientovi již před 18 lety. Je to nejčastější forma poruchy dýchání ve spánku a v literatuře je často spojována s celou řadou KVO zahrnujících arteriální hypertenzi, cévní mozkovou příhodu, ischemickou chorobu srdeční, srdeční selhání či fibrilaci síní. Dospělí pacienti s OSA mají jednak zvýšené riziko rozvoje KVO, jednak přítomnost OSA zhoršuje průběh KVO již přítomných (5). Podle nejnovějších dat o prevalenci spánkové apnoe se může středně těžká až těžká porucha dýchání ve spánku objevit až u poloviny mužů a čtvrtiny žen. Mezi hlavní rizikové faktory spojené s výskytem poruch dýchání ve spánku patří věk, mužské pohlaví, obvod krku, chrápání, hodnota indexu BMI, hodnota waist‑hip ratio (poměr pas/boky) především u žen, deprese a užívání antidepresiv, benzodiazepinů a alkoholu (6). Patofyziologickým podkladem OSA je kolaps horních dýchacích cest (HCD) ve spánku. Reflexně sice dojde k obnovení tonu svalstva HCD s obnovením dýchání, nicméně toto je provázeno probuzením, a tak je spánek fragmentován. Důsledkem tohoto cyklicky se opakujícího děje jsou opakované hypoxie a hyperkapnie, aktivace sympatického nervového systému a stresové osy, zvýšení nitrohrudního tlaku, oxidační stres a aktivace zánětlivé odpovědi. Spánek není pro pacienta osvěžující, vstává unavený, je nadměrně ospalý, a proto usíná během dne.
Řada observačních studií prokazuje asociaci mezi OSA a rizikem výskytu arteriální hypertenze, jež byla ostatně jednou z pacientových komorbidit. Zavedením léčby přetlakovým dýcháním se může toto riziko snížit. Na přítomnost OSA je vhodné pomýšlet zvláště u rezistentních hypertoniků, tj. u pacientů s přetrvávajícími hodnotami tlaku krve ≥ 140/90 mm Hg navzdory podávání nejméně trojkombinace antihypertenziv včetně diuretika v maximálních tolerovaných dávkách. Podle některých studií je prevalence OSA u pacientů s rezistentní hypertenzí velmi vysoká (kolem 70 %). Zavedení léčby OSA kontinuálním přetlakovým dýcháním (CPAP) je spojováno s relativně skromným, ale přesto pozitivním vlivem na redukci krevního tlaku při ambulantním 24hodinovém monitorování (7). U rezistentních hypertoniků s OSA se prokazuje po zavedení léčby CPAP statisticky poměrně významný pokles diastolického, respektive i středního tlaku krve, především ale může zavedení léčby CPAP vést k nočnímu poklesu tlaku (dippingu) (8). Je známo, že nepřítomnost dippingu je významným nezávislým rizikovým faktorem ASKVO. Nutno ovšem podotknout, že data pocházejí ze studií poměrně malého rozsahu a většinou s neověřenou adherencí k léčbě CPAP. Výše uvedené teorie bude vhodné ověřit dalším výzkumem.
Ve vztahu k výše popsané pacientově bradykardii s vazbou na poruchy spánku je vhodné zmínit, že kromě často diskutované asociace OSA se vznikem (9) či rekurencí fibrilace síní (10) se tento syndrom může spojovat i s dalšími arytmiemi. Je však nutno podotknout, že OSA a fibrilace síní společně sdílejí mnoho rizikových faktorů (11). Simantirakis et al. publikovali malou studii zahrnující pacienty se středně těžkou a těžkou OSA, u kterých byly noční bradykardické epizody a srdeční pauzy příznivě ovlivněny zavedením terapie CPAP (12). Přítomnost OSA je ostatně považována za rizikový faktor náhlé srdeční smrti (13).
Syndrom OSA je spolu s obezitou řazen mezi tzv. faktory modifikující KV riziko. Prospektivní kohortová studie z roku 2002 popisuje vzájemný vztah mezi obezitou a OSA, kdy byl 10% nárůst hmotnosti pacienta spojen s šestinásobně vyšší pravděpodobností rozvoje středně těžké až těžké OSA (14). Taktéž u diabetiků 2. typu je uváděna vysoká prevalence poruch dýchání ve spánku. Foster et al. ve studii publikované v roce 2009 udává u obézních diabetiků 2. typu více než 86% prevalenci dosud nediagnostikovaného OSA (15). Diskutuje se řada potenciálních mecha‑ nismů, kterými přítomnost OSA, respektive fyziologický stres vyvolaný spánkovou fragmentací a intermitentní hypoxemií, může vést k rozvoji inzulinové rezistence. Uvažuje se o vlivu oxidativního stresu, aktivace sympatického nervového systému, stresové osy a aktivace zánětlivých drah s uplatněním interleukinu 6 a tumor nekrotického faktoru alfa (IL-6 a TNF‑α), dále pak změn v profilu adipokinů (leptin, adiponectin) (16). Bude nutno ověřit, zda je OSA opravdu nezávislým rizikovým faktorem pro rozvoj inzulinové rezistence, respektive DM 2. typu, či zda jsou obě choroby vzájemně propojeny prostřednictvím jednotícího prvku, jímž je obezita.
Studie SAVE (The Sleep Apnea Cardiovascular Endpoints study) je doposud nejdůležitější studií, která se zabývala účinkem terapie OSA pomocí CPAP na kardiovaskulární morbiditu a mortalitu u pacientů trpících OSA (17). Studie sledovala po průměrnou dobu 3,7 roku 2 717 pacientů s prokázaným KVO či cerebrovaskulárním onemocněním. Primární složený cíl studie (kardiovaskulární úmrtí, infarkt myokardu, cévní mozkové příhody, hospitalizace pro nestabilní anginu pectoris, srdeční selhání či tranzitorní ischemická ataka) nebyl ovlivněn pomocí CPAP. Výsledky studie jsou do jisté míry překvapivé a v mnohém působí zklamání nad předpokládaným benefitem ze zavedení léčby CPAP na ASKVO. Nutno ovšem uvést, že pacienti v CPAP rameni studie používali CPAP průměrně pouze 3,3 hodiny/noc, navíc byli zahrnuti i pacienti, kteří předčasně ukončili léčbu pomocí CPAP. Některé předchozí studie podstatně menšího rozsahu přinášely ve srovnání se studií SAVE výsledky zcela opačné. Nabízí se tak otázka, zda zavedení terapie CPAP u OSA ve fázi již rozvinutých strukturálních změn na myokardu i cévní stěně není již bez potenciálu tyto změny a jejich důsledky účinně zvrátit.
Závěr
Nediagnostikované a neléčené choroby: smíšená dyslipidemie, arteriální hypertenze, kouření, obezita a DM byly příčinami předčasné aterosklerózy a dovedly 50letého pacienta k předčasné a život ohrožující náhlé srdeční příhodě. Přítomný MS a syndrom OSA jistě přispěly k dalšímu navýšení rizika vzniku této příhody. Z této kazuistiky vyplývá, že u pacientů s prokázaným syndromem OSA má být provedeno preventivní vyšetření základních rizikových faktorů pro ASKVO a DM. Na druhé straně u pacientů s prokázaným ASKVO, MS nebo DM 2. typu by se mělo uvažovat o možném syndromu OSA jako časté komorbiditě, a to přestože není zatím dostatek důkazů, že OSA je samostatným nezávislým rizikovým faktorem pro tyto choroby. Snížení denní spavosti a únavy po zavedení terapie OSA vede nejen k pozitivnímu ovlivnění kvality života pacientů s OSA, ale i k redukci rizika dopravních nehod a jiných úrazů způsobených následky OSA. Zda včasná a dostatečná léčba pacientů s OSA pomocí CPAP sníží i kardiometabolické riziko těchto pacientů, je třeba dále zkoumat.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Jan Peterka,
II. interní klinika UK, LF v Plzni a Fakultní nemocnice Plzeň,
E. Beneše 13,
305 99 Plzeň
Cit. zkr: Vnitř Lék 2020; 66(1): 44–48
Článek přijat redakcí: 7. 11. 2019
Článek přijat k publikaci: 9. 1. 2020
Zdroje
1. Alberti KG, Eckel RH, Grundy SM et al. Harmonizing the Metabolic Syndrome: a Joint Interim Statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation 2009; 120: 1640–1645.
2. Rosolová H. Metabolický syndrom a jeho význam v primární prevenci nemocí s častým výskytem v populaci. CorVasa 2011; 53: 249–252.
3. Gottlieb DJ, Yenokyan G, Newman AB et al. Prospective study of obstructive sleep apnea and incident coronary heart disease and heart failure: the Sleep Heart Health Study. Circulation. 2010; 122: 352–360.
4. Mach E, Baigent C, Catapano AL et al. TaskForceMembers: 2019 ESC/EAS Guidelines‑ forthe management of dyslipidaemias: lipid modification to reduce cardiovascular risk. The Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and European Atherosclerosis Society (EAS). European Heart Journal (2019): 1–78.
5. Tietjens JR, Claman D, Kezirian EJ et al. Obstructive Sleep Apnea in Cardiovascular Disease: A Review of the Literature and Proposed Multidisciplinary Clinical Management Strategy. J Am Heart Assoc. 2019; 8(1): e010440.
6. Heinzer R, Vat S, Marques‑Vidal P et al. Prevalence of sleep‑disordered breathing in the general population: the HypnoLaus study. Lancet Respir Med. 2015;3(4):310–318
7. Mansukhani MP, Covassin N, Somers VK. Apneic Sleep, Insufficient Sleep, and Hy‑ pertension. Hypertension. 2019; 73: 744–756
8. Martínez‑García M, Capote F, Campos‑Rodríguez F et al. Effect of CPAP on Blood Pressure in Patients With Obstructive Sleep Apnea and Resistant Hypertension: The HIPAR‑ CO Randomized Clinical Trial. JAMA. 2013; 310(22): 2407–2415.
9. Gami AS, Hodge DO, Herges RM et al.Obstructive sleep apnea, obesity, and the risk of incident atrial fibrillation J. Am Coll Cardiol 2007; 49: 565–571.
10. Kanagala R, Murali NS, Friedman PA et al. Obstructive sleep apnea and the recu‑ rrence of atrial fibrillation. Circulation. 2003; 107: 2589–2594.
11. Zhang L, Hou Y, Po SS. Obstructive Sleep Apnoea and Atrial Fibrillation. Arrhythm Electrophysiol Rev. 2015; 4(1): 14–18.
12. Simantirakis EN, Schiza SI, Marketou ME et al. Severe bradyarrhythmias in patients with sleep apnoea: the effect of continuous positive airway pressure treatment: a long‑term evaluation using an insertable loop recorder. Eur Heart J. 2004; 25: 1070–1076.
13. Gami AS, Olson EJ, Shen WK et al. Obstructive sleep apnea and the risk of sudden cardiac death: a longitudinal study of 10,701 adults. J Am Coll Cardiol. 2013; 62(7): 610–616.
14. Peppard PE, Young T, Palta M et al. Longitudinal study of moderate weight change and sleep‑disordered breathing. JAMA. 2000; 284(23): 3015–3021.
15. Foster GD, Sanders MH, Millman R et al. Obstructive sleep apnea among obese pati‑ ents with type 2 diabetes. Diabetes Care. 2009; 32(6): 1017–1019.
16. International Diabetes Federation. The IDF Consensus Statement on Sleep Apnoea and Type 2 Diabetes. Dostupné z WWW:https://www.idf.org/e‑library/consensus‑statements/62idf‑consensus‑statement‑on‑sleep‑apnoea‑and‑type-2-diabetes.html
17. McEvoy RD, Antic NA, Heeley E et al. CPAP for Prevention of Cardiovascular Events in Obstructive Sleep Apnea. N Engl J Med 2016; 375: 919–931.
Štítky
Diabetológia Endokrinológia Interné lekárstvoČlánok vyšiel v časopise
Vnitřní lékařství

2020 Číslo 1
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Role praktického lékaře v péči o pacienta s familiární hypercholesterolémií
- Pleiotropní účinky statinů na kardiovaskulární systém
Najčítanejšie v tomto čísle
- Sarkopenická obezita – aktuální přehled problematiky
- Chronický stres, psychická nepohoda a deprese zvyšují četnost infekčních, autoimunitních, ale i maligních nemocí
- Odešel velký člověk a lékař prof. MUDr. Vítězslav Kolek, DrSc., FCCP
- Bolesti a deformace dolní čelisti – projev fibrózní dysplazie čelisti
