-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Osteoporóza u pacientov s diabetes mellitus
Osteoporosis in diabetes mellitus patients
Diabetes mellitus (DM) is currently a pandemic problem, and the number of diabetic patients is constantly increasing. There are known and established diabetic complication but it is also comorbidities associated with DM cannot be forgotten. One of these is osteoporosis and osteoporotic fractures. In diabetic patients, the fractures are usually 2 to 6 times higher. In management of diabetes we should screen also the risk of osteoporosis and fractures. From a diabetic point of view, optimum glycaemic control should be achieved, however, we should take into account the effect of antidiabetic agents on bone. In this summary data on the diagnosis and treatment of osteoporosis in patients with DM as well as on the effect of antidiabetic agents on bone are presented.
Keywords:
diagnosis – diabetes mellitus – treatment – osteoporosis
Autori: Peter Jackuliak; Magdaléna Kovářová; Martin Kužma; Juraj Payer
Pôsobisko autorov: V. interná klinika Lekárskej fakulty UK a UN Bratislava
Vyšlo v časopise: Vnitř Lék 2021; 67(5): 291-295
Kategória:
Súhrn
Diabetes mellitus (DM) je v súčasnosti pandemický problém, počet pacientov neustále narastá. Popri známych komplikáciách DM nemožno zabúdať ani na komorbidity, ktoré sa u pacientov s DM vyskytujú. Jednou z nich sú aj osteoporóza a osteoporotické fraktúry. U diabetikov sa fraktúry vyskytujú 2 až 6-násobne častejšie. V rámci manažmentu diabetika je nutné cielene po riziku osteoporózy a zlomenín pátrať, ako aj následne prijať adekvátne preventívne a liečebné opatrenia. Z diabetologického hľadiska je nutné dosiahnuť optimálnu glykemickú kompenzáciu, avšak s ohľadom na efekt antidiabetík na kosť. V uvedenom prehľade sú uvedené údaje o problematike diagnostiky a liečby osteoporózy u pacientov s DM, ako aj o efekte antidiabetík na kosť.
Klíčová slova:
diagnostika – osteoporóza – liečba – diabetes mellitus
V posledných rokoch sa závažným problémom u diabetes mellitus (DM) 1. typu aj 2. typu stala fragilita kostí, riziko osteoporózy a osteoporotických fraktúr (1). U pacientov s DM 1. typu je 2 až 6násobne vyššie riziko osteoporotickej fraktúry než u nediabetickej populácie (2). Dve novšie metaanalýzy, ktoré hodnotili riziko zlomenín u pacientov s DM (zahŕňali 27 300 diabetikov respektíve 6 995 272 diabetikov) preukázali relatívne riziko (RR) zlomeniny bedrového kĺbu pre DM 1. typu v porovnaní so zdravou populáciou 3,78 (2) respektíve 5,76 (3). U DM 2. typu sa zistilo tiež zvýšené riziko zlomenín bedrového kĺbu s RR 1,11 u mužov a 1,18 u žien v porovnaní s osobami v rovnakom veku bez DM (4). Podľa inej analýzy, skoro polovica pacientov s DM 1. typu malo aspoň 1 faktúru po diagnostikovaní DM (5). Väčšie riziko fraktúr je najmä u pacientov s BMI < 30 kg/m2 v porovnaní s obéznymi jedincami (6), u pacientov s trvaním DM 2. typu viac ako 10 rokov, nízkou fyzickou aktivitou, vyšším vekom, na liečbe inzulínom (7). Dôležitým rizikovým faktorom je zvýšené riziko pádov (8, 9).
Tab. 1. Vplyv DM a prediabetes na kosť (1) 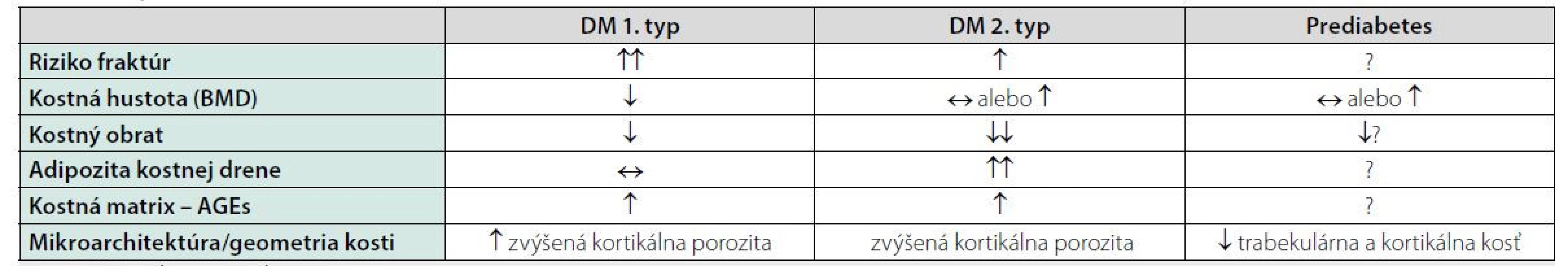
Vysvetlivky: ↑ zvýšenie, ↓ zníženie, ↔ bez zmeny (oproti kontrole), ? neznáme zmeny; AGEs = Advanced glycation endproducts (koncové produkty neenzymatickej glykácie) Patogenéza kostných zmien u diabetikov je komplexná. Diabetes ovplyvňuje kostný metabolizmus viacerými mechanizmami (10). Diabetici majú zníženie počtu a alterované funkcie osteoblastov. Taktiež je prítomná porucha diferenciácie osteoblastov – kmeňové bunky (MSC – Mesenchymal stem cells) sa diferencujú na adipocyty, čo vedie k adipozite kostnej drene, kde adipocyty produkujú zápalové cytokíny a chemokíny. V dôsledku toho sa akumulujú pro-inflamačné M1 makrofágy v kostnej dreni. Porucha osteocytov vedie k zvýšenej expresii sklerostínu, inhibítoru osteoblastov a RANKL. Je tiež zvýšený FGF-23 (Fibroblast growth factor 23) čo podmieňuje aj tvorbu aktívneho D-hormónu. Zníženie počtu EPC (endothelial progenitor cells) vedie k zníženej permeabilite ciev, čo podmieňuje mikrohypoxiu kosti. Zvýšenie AGEs (Advanced glycation end products) v dôsledku metabolickej (de)kompenzácie tiež negatívne alteruje kostnú matrix, čo vyúsťuje do väčšej kortikálnej porozity.
Diagnostika osteoporózy u diabetikov
V rámci diagnostiky osteoporózy u pacientov s DM sú dnes už vypracované algoritmy (Obr. 1), ktoré sú zosumarizovaním súčasných poznatkov o tzv. diaporóze. Jeden z posledných a teda najaktuálnejších je odporúčanie tzv. Bone and Diabetes Working Group pri medzinárodnej nadácii osteoporózy t. j. IOF (International Osteoporosis Foundation), ktorá pod vedením prof. S. Ferrariho vypracovala guidelines „Diagnosis and management of bone fragility in diabetes: an emerging challenge“ (11).
Obr. 1. Algoritmus manažmentu osteoporózy u pacienta s diabetes mellitus (11) 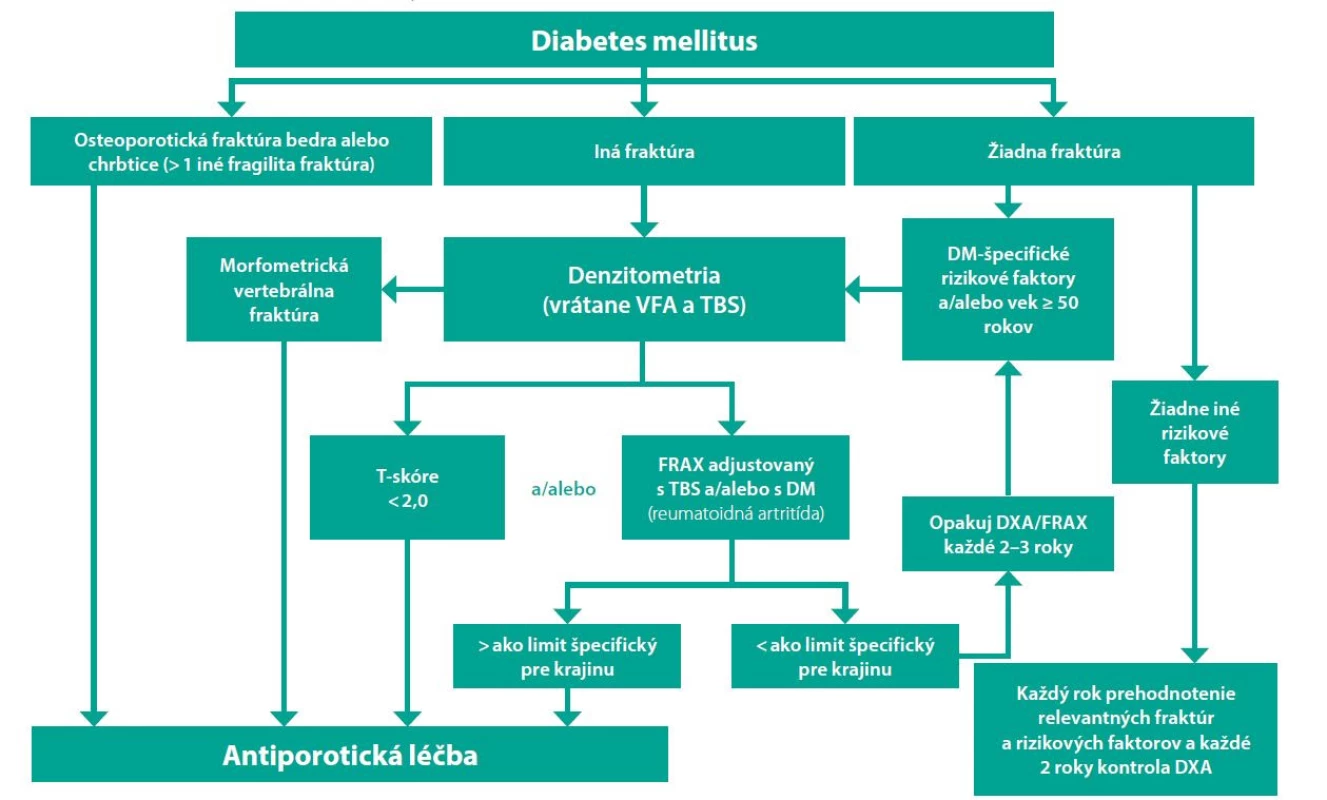
DM-špecifické rizikové faktory: trvanie DM > 5 rokov; liečba DM inzulínom, glitazónmi, inhibítormi SGLT-2; neuspokojivá glykemická kompenzácia s HbA1c > 7% DCCT; mikrovaskulérne komplikácie t. j. periférna a autonómna neuropatia, retinopatia, nefropatia
Vysvetlivky: VFA – Vertebral Fracture Assessment, TBS – Trabecular Bone Score (trabekulárne kostné skóre); DM – diabetes mellitus; FRAX – Fracture Risk Assessment ToolV rámci diagnostiky osteoporózy, najmä diabetikov s DM 2. typu, je dôležité okrem hodnotenia kvantity kostnej hmoty hodnotiť aj jej kvalitu, najmä využitím nových modalít ako je TBS (trabekulárne kostné skóre) (12–14). Pri hodnotení len BMD sa diskutuje o znížení prahu T-skóre na -2,0 SD, ako hodnoty keď treba iniciovať antiporotickú terapiu (15). Pri využití nástroja FRAX je riziko hlavne u DM 2. typu podhodnotené a preto sa odporúča označiť za rizikový faktor „reumatoidná artritída“, pretože riziko pri DM 2. typu a pri reumatoidnej artritíde je porovnateľné (16, 17).
Manažment osteporózy u diabetikov
Pri liečbe diabetika z osteologického hľadiska je nutné brať do úvahy dva základné pohľady – akú antiporotickú liečbu treba zvoliť a ako liečiť samotný diabetes mellitus. O efekte antiporotík u diabetikov sa vie len málo. Väčšina údajov pochádza len z reálnej klinickej praxe. V klinických štúdiách je málo prác, ktoré cielene porovnávali efekt antiporotík u diabetikov. Prehľad používaných antiporotík a údajov o ich efekte u pacientov s DM uvádza tabuľka 2.
Tab. 2. Liečba osteoporózy u pacientov s diabetes mellitus 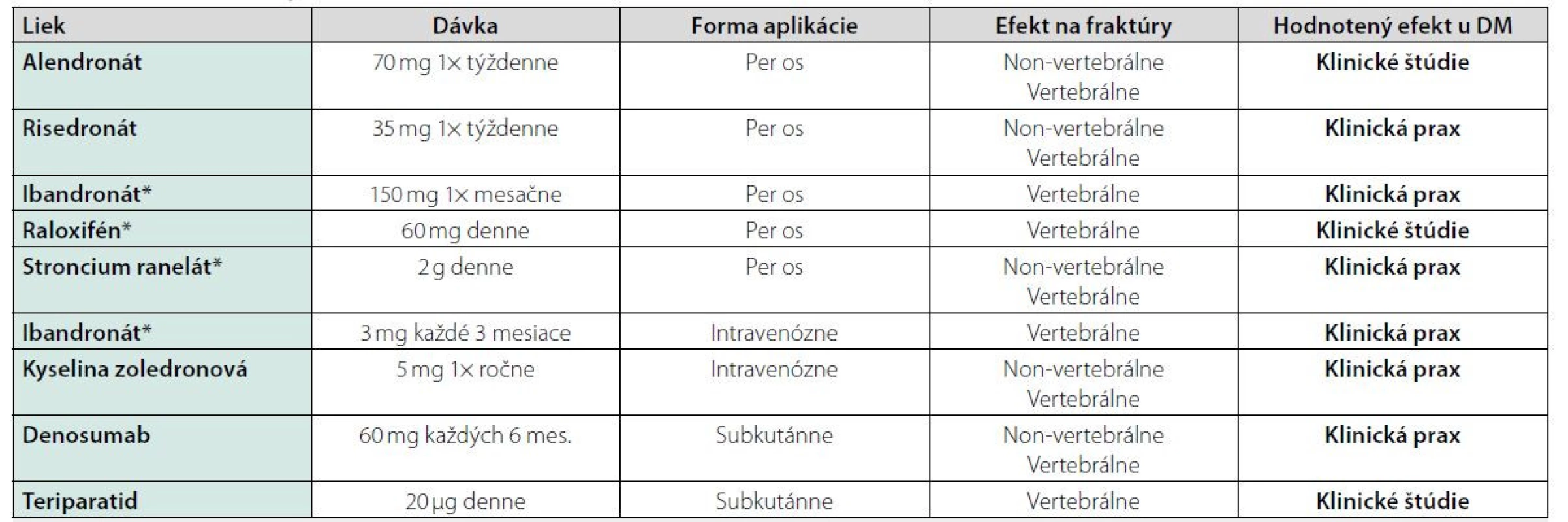
*Len u postmenopauzálnych žien Efekt alendronátu u diabetikov sledovala štúdia kolektívu Keegan T a kol. (18). Využili údaje zo štúdie FIT (Fracture Intervention Trial) (19). Trojročná liečba alendronátom bola u pacientok s DM 2. typu spojená so zvýšením BMD o 6,6 % v LS oblasti, 2,4 % v oblasti bedra (hip). Na druhej strane existujú aj štúdie, ktoré efekt alendronátu na zmenu BMD nepreukázali. Jednalo sa ale len o malú kohortu postmenopauzálnych žien (vek 67,6 ± 7,3 rokov) s dlhším trvaním DM 2. typu (12,8 ± 6,8 rokov) (20).
Liečba rizedronátom u diabetikov bola analyzovaná z kombinovaných údajov troch klinických štúdií III. fázy. Jeho efekt na BMD nebol rozdielny u diabetikov versus nediabetickej populácie. Pokles kostných markerov (NTX, CTX, BAP) bol u diabetikov o niečo menší, ale štatistickú významnosť nedosiahol (21).
Efekt raloxifénu u diabetikov bol nepriamo sledovaný univariatnou analýzou 30 rizikových faktorov vertebrálnych zlomenín v štúdii MORE (Multiple Outcomes of Raloxifene Evaluation). Napriek menšiemu množstvu pacientov bol raloxifén efektívnejší u pacientov s DM 2. typu versus bez DM (p = 0,04) (22).
Účinok osteoanabolickej liečby teriparatidom sledovala štúdia DANCE (Direct Analysis of Nonvertebral Fracture in the Community Experience Study). Podobne ako v nediabetickej populácii aj u pacientov s DM došlo v priebehu liečby k redukcii incidencie non-vertebrálnych fraktúr, vzostupu BMD, zníženiu bolestí chrbta (23). Podobné efekty teriparatidu na klinické fraktúry u diabetikov po 6 mesiacoch liečby potvrdila aj štúdia Real-World Effectiveness of Teriparatide (24).
Vzhľadom na patofyziológiu osteoporózy u diabetikov, kde sa zdôrazňuje inhibícia formácie, aktivity a prežívania osteoklastov, by vzhľadom na svoj mechanizmu mal byť účinný aj denosumab. Relevantné štúdie venujúce sa efektu denusomabu u diabetikov ale chýbajú a sú len čiastkové údaje o jeho efektivite u DM (25). Práve prebieha intervenčná štúdia (ClinicalTrials.gov Identifier: NCT03457818) na efekt denosumabu u pacientov s DM 2. typu. Výsledky by mohli byť známe v lete 2021.
Základom manažmentu diabetických komplikácií a teda aj kostných diabetických komplikácií je dosiahnutie optimálnej glykemickej kompenzácie. Mnohé účinné antidiabetiká môžu však ovplyvňovať kostný metabolizmus a to pozitívne, ale aj negatívne (26, 27). Za posledné roky narastá počet údajov o vplyve antidiabetík na kostnú hustotu a riziko fraktúr (Tabuľka 3) (28–30). Problémom v klinickej praxi na hodnotenie efektu antidiabetík na kosť je fakt, že veľká väčšina pacientov má kombinovanú antidiabetickú liečbu (31).
Tab. 3. Efekt antidiabetík na kostný metabolizmus (32–34) 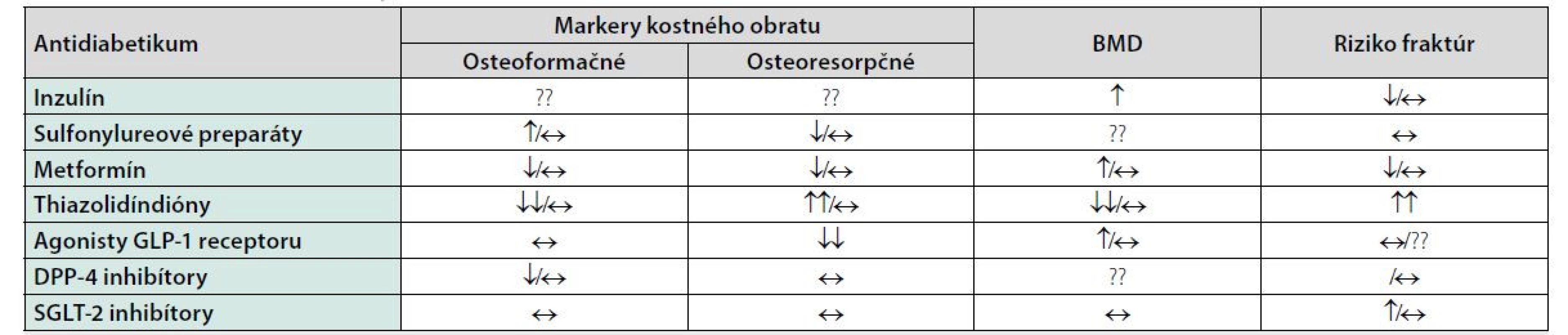
Vysvetlivky: ?? neznámy efekt; ↑ zvýšenie; ↓ zníženie; ↔ neutrálny vplyv (nevedie k zmene) Metformín, ako základný liek manažmentu DM 2. typu, má dokázané, že zvyšuje proliferáciu a diferenciáciu osteoblastov a potencuje tvorbu kolagénu typu 1. Na druhej strane inhibuje diferenciáciu adipocitov (35, 36). Početné štúdie preukázali benefitný pro-osteogénny vplyv metvormínu in vitro (37, 38). Analýza Rochester kohorty potvrdila že metformín dokáže znížiť riziko fraktúr u pacientov s DM 2. typu (HR 0,7) (37).
Metha kol. na kongrese ADA 2014 prezentoval prvé údaje o tom, že liečba sulfonylureovými preparátmi zvyšuje riziko fraktúr. Retrospektívne analyzoval údaje z registra MORE (Medical Outcomes for Effectiveness and Economics), pričom výskyt fraktúr bol u 6,8 % všetkých pacientov užívajúcich metformín, u 10,9 % pacientov užívajúcich glitazóny a u 9,7 % pacientov užívajúcich sulfonylureové preparáty. V porovnaní s metformínom mali sulfonylureové preparáty zvýšené riziko fraktúr (HR 1.09, p = 0.0054) (39, 40).
Glitazóny (tiazolidíndióny) zvyšujú adipozitu kosti, znižujú aromatázovú aktivitu, potencujú diferenciáciu osteoklastov, čo všetko vedie k zvýšenému odbúravaniu kostnej hmoty (41, 42). Meta-analýza dlhodobého efektu glitazónov na kosť potvrdila zníženie kostnej hustoty u žien (ale nie u mužov) tak u rosiglitazónu ako aj u pioglitazónu (42).
Štúdie preukázali že agonisty GLP-1 receptoru ale aj iné inkretíny (GIP a GLP-2) môžu mať pozitívny efekt – antiresorpčný a osteoanabolický. Mechanizmus zahŕňa rôzne metabolické cesty – Wnt/beta-catenin, OPG/RANKL (Osteoprotegerin/Receptor activator of nuclear factor kappa-B ligand) či pôsobenie sklerostínu (43). Metaanalýza 28 štúdií o efekte inhibítorov DPP-4 na kosť preukázala 40% redukciu fraktúr u pacientov liečených inhibítormi DPP-4 v porovnaní s placebom či inými antidiabetikami (44).
Inhibíciou nátrium-glukózového kotransportéra-2 vzhľadom na ovplyvnenie tubulárnych mechanizmov sa predpokladalo že zasiahnu aj do kalcium-fosfátového metabolizmu. Prvé štúdie s dapagliflozínom nepreukázali zmeny hladín sérového kalcia či vitamínu D, avšak mierny vzostup hladín magnézia, fosfátov a parathormónu (45, 46). Dapagliflozín nemal žiadny vplyv na zmeny markerov kostného obratu u postmenopauzálnych žien (47). Avšak nedávno publikované práce preukázali zvýšený výskyt fraktúr pri užívaní canagliflozínu (48, 49).
Liečba inzulínom u nedostatočne glykemicky kompenzovaných pacientov s DM 1. typu viedla aj k zlepšeniu kostnej hustoty a markerov kostného obratu (50). V priebehu posledných rokov bol dokázaný vplyv inzulínu a IGF-1 v procese diferenciácie osteoblastov (51, 52). Inzulín ale zasahuje aj do mnohých iných metabolických cyklov, ktoré súvisia s kostným metabolizmom, napr. Wnt/β-catenin signalizácia či metabolizmus BMP-2 (51). Avšak niektoré štúdie potvrdili zvýšený výskyt vertebrálnych fraktúr u pacientov s DM 2. typu liečených inzulínom (53). Treba si ale uvedomiť, že pacienti s DM 2. typu liečení inzulínom sú väčšinou pacienti s dlhším trvaním DM a/alebo diabetickými komplikáciami. Inzulinoterapia je asociovaná aj s vyšším výskytom hypoglykemických epizód, ktoré zvyšujú riziko pádov, a tým prispievajú k zvýšenému riziku fraktúr (54, 55). Na druhej strane zlepšenie glykemickej kompenzácie dosiahnutej inzulinoterapiou viedlo k zlepšeniu diabetických komplikácií a k redukcii pádov (56).
Záver
Osteoporóza a osteoporotické fraktúry sú závažným problémom diabetikov. V rámci komplexného manažmentu diabetes mellitus treba cielene po rizikových pacientoch pátrať, včas ich identifikovať a následne správne manažovať (Obr. 2). Z hľadiska diabetológie je nutné dosiahnuť optimálnu glykemickú kompenzáciu, pričom volíme antidiabetiká s pozitívnym či neutrálnym efektom na kosť (metformín, gliptíny a agonisti GLP-1 receptorov). Z pohľadu osteológie sú glitazóny a sulfonylureové preparáty rizikové, podobne aj pri gliflozínoch je riziko fraktúr zvýšené. Inzulinoterapia je benefitná hlavne u diabetikov s DM 1. typu, kde prevažuje pozitívny osteoanabolický efekt inzulínu. U diabetikov s DM 2. typu má význam hlavne s cieľom dosiahnuť optimálnu glykemickú kompenzáciu, avšak netreba zabúdať na riziko hypoglykémií, ktoré môžu zvyšovať riziko pádov.
Obr. 2. Algoritmus liečby diabetika s osteoporózou 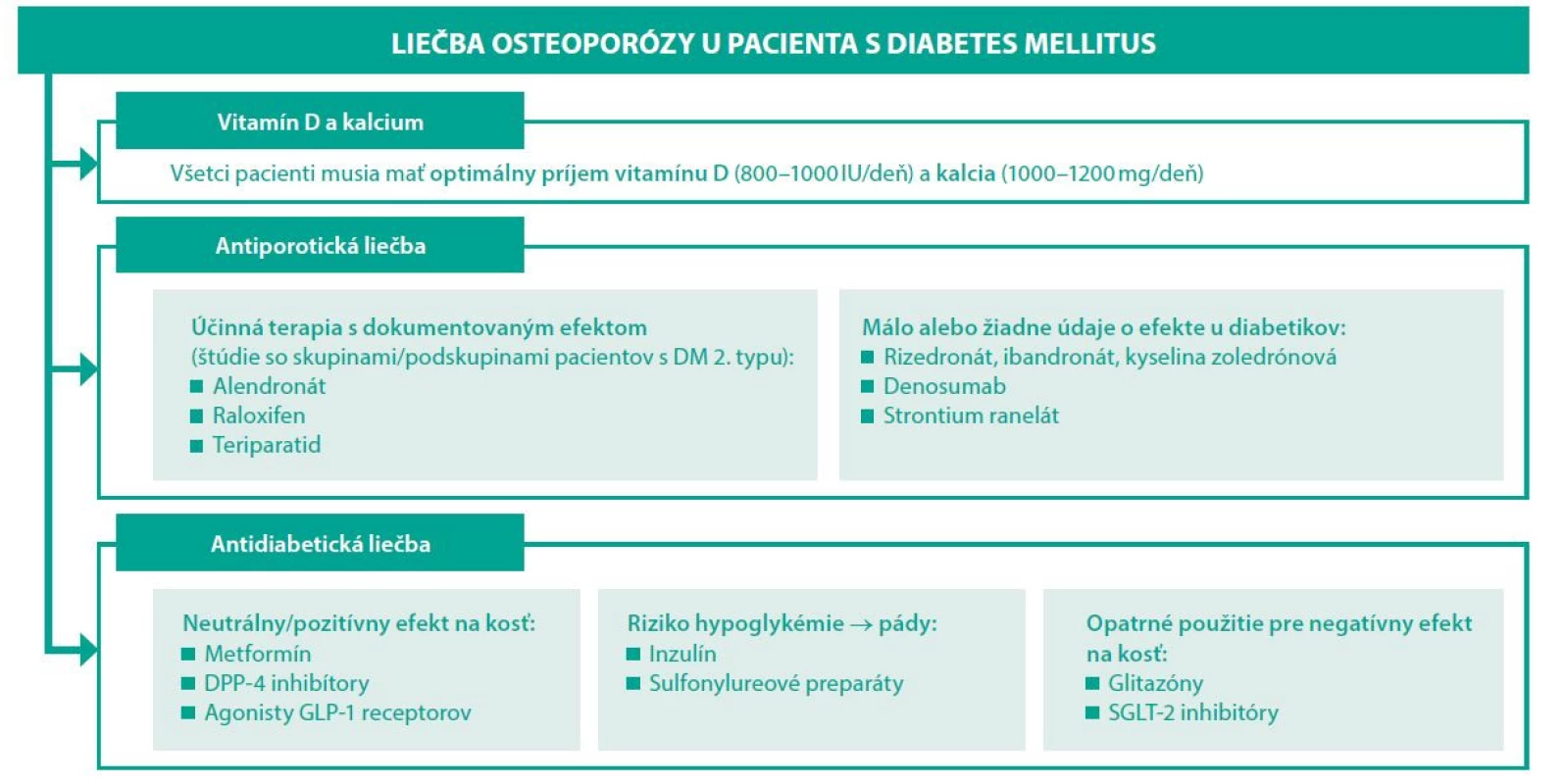
KORESPONDENČNÍ ADRESA AUTORA:
doc. MUDr. Peter Jackuliak, PhD., MPH, FEFIM
V. interná klinika LFUK a UNB Ružinovská 6, 826 06 Bratislava
Cit. zkr: Vnitř Lék 2021; 67(5): 291–295
Článek přijat redakcí: 21. 6. 2021
Článek přijat po recenzích: 28. 6. 2021
Zdroje
1. Costantini S, Conte C. Bone health in diabetes and prediabetes. World J Diabetes, 2019. 10(8): p. 421–445.
2. Shah VN, Shah CS, Snell-Bergeon JK. Type 1 diabetes and risk of fracture: meta-analysis and review of the literature. Diabetic medicine: a journal of the British Diabetic Association, 2015; 32(9): p. 1134–1142.
3. Fan Y et al. Diabetes mellitus and risk of hip fractures: a meta-analysis. Osteoporos Int, 2016; 27(1): p. 219–228.
4. Lipscombe LL et al. The risk of hip fractures in older individuals with diabetes: a population - based study. Diabetes Care, 2007; 30(4): p. 835–841.
5. Dhaliwal R et al. Determinants of fracture in adults with type 1 diabetes in the USA: Results from the T1D Exchange Clinic Registry. J Diabetes Complications, 2018; 32(11): p. 1006–1011.
6. Moayeri A et al. Fracture risk in patients with type 2 diabetes mellitus and possible risk factors: a systematic review and meta-analysis. Ther Clin Risk Manag, 2017; 13: p. 455–468.
7. Wang H et al. Diabetes mellitus and the risk of fractures at specific sites: a meta-analysis. BMJ Open, 2019; 9(1): p. e024067.
8. Maurer MS, Burcham J, Cheng H. Diabetes mellitus is associated with an increased risk of falls in elderly residents of a long-term care facility. J Gerontol A Biol Sci Med Sci, 2005; 60(9): p. 1157–1162.
9. Patel S et al. Risk factors for fractures and falls in older women with type 2 diabetes mellitus. Calcif Tissue Int, 2008; 82(2): p. 87–91.
10. Picke A et al. Update on the impact of type 2 diabetes mellitus on bone metabolism and material properties. Endocrine connections, 2019; 8(3): p. R55–R70.
11. Ferrari SL et al. Diagnosis and management of bone fragility in diabetes: an emerging challenge. Osteoporosis International, 2018; 29(12): p. 2585–2596.
12. Leslie WD et al. TBS (trabecular bone score) and diabetes-related fracture risk. J Clin Endocrinol Metab, 2013; 98(2): p. 602–609.
13. Ebrahimpur M et al. Effect of diabetes on BMD and TBS values as determinants of bone health in the elderly: Bushehr Elderly Health program. Journal of Diabetes & Metabolic Disorders, 2019; 18(1): p. 99–106.
14. Jackuliak P et al. Good long-term glycemic compensation is associated with better trabecular bone score in postmenopausal women with type 2 diabetes. Physiol Res, 2019; 68(Suppl 2): p. S149–s156.
15. Schwartz AV et al. Association of BMD and FRAX score with risk of fracture in older adults with type 2 diabetes. Jama, 2011; 305(21): p. 2184–2192.
16. Leslie WD et al. Type 2 diabetes and bone. J Bone Miner Res, 2012; 27(11): p. 2231–2237.
17. Giangregorio LM et al. FRAX underestimates fracture risk in patients with diabetes. J Bone Miner Res, 2012; 27(2): p. 301–308.
18. Keegan TH et al. Effect of alendronate on bone mineral density and biochemical markers of bone turnover in type 2 diabetic women: the fracture intervention trial. Diabetes Care, 2004; 27(7): p. 1547–1553.
19. Cummings SR et al. Effect of alendronate on risk of fracture in women with low bone density but without vertebral fractures: results from the Fracture Intervention Trial. Jama, 1998; 280(24): p. 2077–2082.
20. Dagdelen S et al. Influence of type 2 diabetes mellitus on bone mineral density response to bisphosphonates in late postmenopausal osteoporosis. Advances in Therapy, 2007; 24(6): p. 1314–1320.
21. Inoue D et al. Efficacy and Safety of Risedronate in Osteoporosis Subjects with Comorbid Diabetes, Hypertension, and/or Dyslipidemia: A Post Hoc Analysis of Phase III Trials Conducted in Japan. Calcified Tissue International, 2016; 98(2): p. 114–122.
22. Johnell O et al. Associations Between Baseline Risk Factors and Vertebral Fracture Risk in the Multiple Outcomes of Raloxifene Evaluation (MORE) Study. Journal of Bone and Mineral Research, 2004; 19(5): p. 764–772.
23. Schwartz AV et al. Teriparatide in patients with osteoporosis and type 2 diabetes. Bone, 2016; 91: p. 152–158.
24. Langdahl BL et al. Real-world effectiveness of teriparatide on fracture reduction in patients with osteoporosis and comorbidities or risk factors for fractures: Integrated analysis of 4 prospective observational studies. Bone, 2018; 116: p. 58–66.
25. Zebaze R et al. Denosumab Reduces Cortical Porosity of the Proximal Femoral Shaft in Postmenopausal Women With Osteoporosis. J Bone Miner Res, 2016; 31(10): p. 1827–1834.
26. Hayakawa N, Suzuki A. Diabetes mellitus and osteoporosis. Effect of antidiabetic medicine on osteoporotic fracture. Clin Calcium, 2012; 22(9): p. 1383–1390.
27. Jackuliak P et al. Effect of antidiabetic treatment on bone. Physiol Res, 2019; 68(Suppl 2): p. S107–s120.
28. Paul T, Thomas N. Impact of oral antidiabetic agents on bone metabolism. Indian Journal of Medical Research, 2015; 141(4): p. 385–388.
29. McCarthy AD, Cortizo AM, Sedlinsky C. Metformin revisited: Does this regulator of AMP-activated protein kinase secondarily affect bone metabolism and prevent diabetic osteopathy. World Journal of Diabetes, 2016; 7(6): p. 122–133.
30. Gilbert MP, Pratley RE. The Impact of Diabetes and Diabetes Medications on Bone Health. Endocrine Reviews, 2015; 36(2): p. 194–213.
31. Vestergaard P et al. Relative fracture risk in patients with diabetes mellitus, and the impact of insulin and oral antidiabetic medication on relative fracture risk. Diabetologia, 2005; 48(7): p. 1292–1299.
32. Schwartz AV. Diabetes and Metabolism of Bone, in ENDO 2017: Meet-The-Professor Endocrine Case Management, J. Leahy and A. Danoff, Editors. 2017: Washington DC. p. 63–65.
33. Palermo A et al. Oral anti-diabetic drugs and fracture risk, cut to the bone: safe or dangerous? A narrative review. Osteoporos Int, 2015; 26(8): p. 2073–2089.
34. Lecka-Czernik B. Safety of Anti-Diabetic Therapies on Bone. Clinical Rev Bone Miner Metab., 2013; 11(1): p. 49-58.
35. Molinuevo MS et al. Effect of metformin on bone marrow progenitor cell differentiation: In vivo and in vitro studies. Journal of Bone and Mineral Research, 2010; 25(2): p. 211–221.
36. Sundararaghavan V et al. Diabetes and bone health: latest evidence and clinical implications. Therapeutic Advances in Musculoskeletal Disease, 2017; 9(3): p. 67–74.
37. Melton LJ et al. Fracture risk in type 2 diabetes: update of a population-based study. J Bone Miner Res, 2008; 23(8): p. 1334–1342.
38. Russo GT et al. Fracture Risk in Type 2 Diabetes: Current Perspectives and Gender Differences. International Journal of Endocrinology, 2016; 2016: p. 1615735.
39. Mehta S. Comparative Safety of Oral Antidiabetic Therapy on Risk of Fracture in Patients with Diabetes, in American Diabetes Association 2014 Scientific Sessions; 2014: p. 165-OR.
40. Medscape Sulfonylureas May Up Fracture Risk in Diabetes, Along With TZDs. 2014.
41. Mieczkowska A et al. Thiazolidinediones induce osteocyte apoptosis by a G protein - coupled receptor 40-dependent mechanism. J Biol Chem, 2012; 287(28): p. 23517–23526.
42. Loke YK, Singh S, Furberg CD. Long-term use of thiazolidinediones and fractures in type 2 diabetes: a meta-analysis. Canadian Medical Association Journal, 2009; 180(1): p. 32–39.
43. Ceccarelli E et al. Beyond Glycemic Control in Diabetes Mellitus: Effects of Incretin - -Based Therapies on Bone Metabolism. Frontiers in Endocrinology, 2013; 4(73): p. 1–12.
44. Monami M et al. Dipeptidyl peptidase-4 inhibitors and bone fractures: a meta-analysis of randomized clinical trials. Diabetes Care, 2011; 34(11): p. 2474–2476.
45. Nauck MA et al. Dapagliflozin Versus Glipizide as Add-on Therapy in Patients With Type 2 Diabetes Who Have Inadequate Glycemic Control With Metformin: A randomized, 52-week, double-blind, active-controlled noninferiority trial. Diabetes Care, 2011; 34(9): p. 2015–2022.
46. List JF et al. Sodium-Glucose Cotransport Inhibition With Dapagliflozin in Type 2 Diabetes. Diabetes Care, 2009; 32(4): p. 650–657.
47. Ljunggren Ö et al. Dapagliflozin has no effect on markers of bone formation and resorption or bone mineral density in patients with inadequately controlled type 2 diabetes mellitus on metformin. Diabetes, Obesity and Metabolism, 2012; 14(11): p. 990–999.
48. Kohan DE et al. Long-term study of patients with type 2 diabetes and moderate renal impairment shows that dapagliflozin reduces weight and blood pressure but does not improve glycemic control. Kidney International, 2014; 85(4): p. 962–971.
49. Watts NB et al. Effects of Canagliflozin on Fracture Risk in Patients With Type 2 Diabetes Mellitus. The Journal of Clinical Endocrinology and Metabolism, 2016; 101(1): p. 157–166.
50. Campos Pastor MM et al. Intensive insulin therapy and bone mineral density in type 1 diabetes mellitus: a prospective study. Osteoporos Int, 2000; 11(5): p. 455–459.
51. Fowlkes JL et al. Contributions of the Insulin/Insulin-Like Growth Factor-1 Axis to Diabetic Osteopathy. Journal of diabetes & metabolism, 2011; 1(3): p. S1-003.
52. Zhukouskaya VV et al. Bone Health in Type 1 Diabetes: Where We Are Now and How We Should Proceed. Advances in Endocrinology, 2014; 2014: p. 12.
53. Kanazawa I et al. Relationships between serum adiponectin levels versus bone mineral density, bone metabolic markers, and vertebral fractures in type 2 diabetes mellitus. Eur J Endocrinol, 2009; 160(2): p. 265–273.
54. Chandran M. Diabetes Drug Effects on the Skeleton. Calcified Tissue International, 2017; 100(2): p. 133–149.
55. Ferrari S. Diabetes and Bone. Calcif Tissue Int, 2017; 100(2): p. 107–108.
56. Quandt SA et al. Predictors of Falls in a Multiethnic Population of Older Rural Adults With Diabetes. The journals of gerontology. Series A, Biological sciences and medical sciences, 2006; 61(4): p. 394–398.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2021 Číslo 5- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Endokrinológia, zaostrené na osteoporózu
- Kostní nemoc při selhání ledvin – renální i non-renální komponenta
- Výskyt osteoporózy u pacientov na substitučnej liečbe hypokorticizmu u Addisonovej choroby
- Osteoporóza u mužů: podceňovaná a neléčená
- Osteoporóza u premenopauzálnych žien
- Osteoporóza u pacientov s diabetes mellitus
- Vzácné trombotické komplikace vyvolané vakcinací proti SARS-CoV-2
- Role zánětu a imunity u aterosklerózy a možné způsoby jejich ovlivnění
- Karcinoidový syndróm – diagnostika a manažment
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Osteoporóza u premenopauzálnych žien
- Vzácné trombotické komplikace vyvolané vakcinací proti SARS-CoV-2
- Karcinoidový syndróm – diagnostika a manažment
- Osteoporóza u mužů: podceňovaná a neléčená
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



