-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Difuzní alveolární hemoragie jako život ohrožující manifestace nově diagnostikované granulomatózy s polyangiitidou navazující na infekci covid-19 – kazuistika
Diffuse alveolar hemorrhage as a life ‑ threatening manifestation of newly diagnosed granulomatosis with polyangiitis following COVID-19 infection – a case report
A case report of a patient with newly diagnosed granulomatosis with polyangiitis (GPA) after undergoing COVID-19 (Coronavirus Disease 2019) is discussed. GPA is one of the ANCA-associated vasculitis, which is characterized by the presence of autoantibodies against cytoplasmic enzymes neutrophils (Anti Neutrophil Cytoplasmatic Antibodies). It is a vasculitis that mainly affects small blood vessels, leading to damage to the kidneys, lungs, and upper respiratory tract, including the paranasal sinuses and orbits. This disease can result in an acute life-threatening condition. Such complications include diffuse alveolar hemorrhage (DAH), a condition characterized by blood leakage from the pulmonary vessels into the alveoli, often leading to acute vital signs and even respiratory failure. DAH can have many causes – autoimmune diseases including vasculitides as well as non-immunological causes. Early and adequate comprehensive therapy including immunosuppressive treatment (cyclophosphamide/rituximab and glucocorticoids) can be life-saving.
Keywords:
plasmapheresis – Cyclophosphamide – granulomatosis with polyangiitis – diffuse alveolar hemorrhage
Autori: Pavlína Kostelníková 1; Martina Skácelová 1; Martin Špíšek 2; Miroslav Šimíček 3; Pavel Horák 1
Pôsobisko autorov: III. interní klinika – nefrologická, revmatologická a endokrinologická, FN Olomouc a LF UP Olomouc 1; Interní oddělení, Nemocnice AGEL Valašské Meziříčí, a. s. 2; Plicní ambulance, Nemocnice AGEL Valašské Meziříčí, a. s. 3
Vyšlo v časopise: Vnitř Lék 2022; 68(5): 290-294
Kategória:
doi: https://doi.org/10.36290/vnl.2022.062Súhrn
Je popsána kazuistika pacientky s nově diagnostikovanou granulomatózou s polyangiitidou (GPA) po prodělání infekce covid-19 (Coronavirus Disease 2019). GPA náleží mezi ANCA‑asociované vaskulitidy, ty se vyznačují přítomností autoprotilátek proti cytoplazmatickým enzymům neutrofilů (Anti Neutrophil Cytoplasmatic Antibodies). Jedná se o vaskulitidu postihující zejména malé cévy vedoucí k postižení ledvin, plic a horních dýchacích cest včetně paranazálních dutin a orbit. Toto onemocnění může vyústit ve stav akutně ohrožující životní funkce. Mezi takovéto komplikace náleží difuzní alveolární hemoragie (DAH), což je stav vyznačující se únikem krve z plicních cév do alveolů, nezřídka vede k akutnímu ohrožení životních funkcí až respiračnímu selhání. DAH může mít mnoho příčin – autoimunitní choroby včetně vaskulitid i neimunologickou etiologii. Včasná a adekvátní komplexní terapie včetně imunosupresivní léčby (cyklofosfamid/rituximab a glukokortikoidy) může být život zachraňující.
Klíčová slova:
plazmaferéza – granulomatóza s polyangiitidou – cyklofosfamid – difuzní alveolární hemoragie
Úvod
Vaskulitidy jsou heterogenní skupinou onemocnění, která je způsobena zánětem cévní stěny. ANCA‑asociované vaskulitidy (AAV) se vyznačují přítomností autoprotilátek proti cytoplazmatickým enzymům neutrofilů (Anti Neutrophil Cytoplasmatic Antibodies), které stimulují neutrofily k zánětlivé reakci vedoucí k poškození tkáně. Zánětlivá reakce probíhá bez přispění imunokomplexů. Autoprotilátky bývají zaměřeny proti serinové proteináze 3 (c‑ANCA) nebo myeloperoxidáze (p‑ANCA). Mezi zástupce AAV náleží granulomatóza s polyangiitidou (GPA), eosinofilní granulomatóza s polyangiitidou (EGPA) a mikroskopická polyangiitida (MPA).
Granulomatóza s polyangiitidou (GPA) je vaskulitida vyznačující se přítomností protilátek proti proteináze 3 (PR3), c‑ANCA, postihuje zejména malé cévy. Je typická triádou příznaků – nekrotizující vaskulitidou postihující hlavně malé cévy v plicích; srpkovitou fokálně‑segmentální nekrotizující glomerulonefritidou (GN) a nekrotizujícími granulomy nejčastěji v horních cestách dýchacích, které mohou destruovat kostěné struktury orbit či nosu. Tato choroba může být doprovázena řadou dalších projevů, jako je postižení očních struktur a centrálního i periferního nervového systému, střev, pankreatu a kůže či celkové příznaky. Incidence onemocnění je kolem 7 až 12 případů na 1 milion za rok se zvyšující se tendencí. Prevalence je v Evropě od 20 do 150 pacientů na 1 milion obyvatel s vyšším zastoupením v severských zemích (1).
Současná klasifikační kritéria GPA jsou dána doporučením ACR (American College of Rheumatology, Americká revmatologická kolej) / EULAR (The European Alliance of Associations for Rheumatology, Evropská liga proti revmatismu) z roku 2022 a jsou následující: epistaxe, nazální krusty nebo ucpaný nos (+3); postižení chrupavky (+2); převodní nebo senzorineurální ztráta sluchu (+1); pozitivita ANCA nebo PR3 (+5); plicní uzly, hmota nebo kavitace (+2); granulom nebo obraz tzv. giant cell na biopsii (+2); zánět nebo konsolidace nosních/paranazálních dutin (+1); pauci‑imunitní GN (+1); pozitivita perinukleární ANCA nebo antimyeloperoxidázy (-1); a počet eosinofilů ≥ 1 × 109/litr (-4). Klasifikační kritéria splňuje pacient s kumulativním skóre ≥ 5 bodů (2).
Difuzní alveolární hemoragie (DAH) je stav vyznačující se únikem krve z plicních cév do alveolů, nezřídka vede k akutnímu ohrožení životních funkcí až respiračnímu selhání. DAH může mít mnoho příčin. Například Bradna a kol. zkoumali soubor 32 pacientů s DAH, z toho u 18 šlo o vaskulitidy, dalšími příčinami byly Sjögrenův syndrom, systémová sklerodermie, syndrom s anti‑GBM protilátkami (Goodpasterův syndrom) nebo rychle progredující GN. Plicní hemoragie byla prvním projevem onemocnění u třetiny ze sledovaných pacientů (3). Prevalence DAH napříč vaskulitidami je různá; od 0–4 % u EGPA přes 8–18 % u GPA až po 12–29 % u MPA. Pro srovnání prevalence DAH u systémového lupusu je 2–5 %, zatímco u Goodpasterova syndromu je až 10 % (4, 5).
Tento stav nevzniká pouze při vaskulitidách či autoimunitních chorobách. Z neimunologických příčin lze uvést například aspirace cizích těles či tekutin, infekce (chřipka, covid-19 (6–8)), nádory plic a plicní metastázy, poruchy koagulace (trombocytopenie, diseminovaná intravaskulární koagulopatie), srdeční selhání, vliv toxinů a některých léků.
K diagnostice DAH může napomoci klinický obraz hemoptýzy a dušnosti. Laboratorně bývá nález anemizace. Dle výsledků studie od Quadrelli S. a kol. zahrnující 39 pacientů s prokázaným imunitně zprostředkovaným DAH se hemoptýza vyskytovala pouze u 30 nemocných (76,9 %), zatímco anemizace s poklesem hemoglobinu o 10 až 30 g/l u 100 % (9). Radiografický obraz je charakterizován nálezem bilaterálních infiltrací, CT či HRCT (výpočetní tomografie, výpočetní tomografie s vysokým rozlišením) nálezem opacit mléčného skla (Ground‑glass opacity, GGO), který může svědčit nejen pro zvýšenou alveolární náplň, ale také například pro fibrózu či neoplazii. Invazivní diagnostickou metodou je bronchoskopie s bronchoalveolární laváží (BAL).
Prognosticky je DAH vždy vcelku závažnou manifestací. Úmrtnost za hospitalizace je bez ohledu na etiologii DAH vysoká, udávaná od 20 až do 100 % (10). Například dle studie 39 pacientů hospitalizovaných pro imunitně zprostředkovanou DAH z roku 2018 byla úmrtnost za hospitalizace 28,2 % (11). Česká studie ze stejného roku zjistila u 32 pacientů celkovou nemocniční mortalitu srovnatelnou, a to 27,3 % (3).
Prezentace případu
U 43leté pacientky došlo asi měsíc před hospitalizací krátce po prodělání onemocnění covid-19 s lehkým průběhem (bronchitida) k rozvoji únavy, slabosti, subfebrilií a pocitu celkové schvácenosti. Začala pociťovat občasné migrující bolesti malých i velkých kloubů, za několik dní se objevil rozsev kožních vaskulitických eflorescencí, a to především na dolních končetinách (Obr. 1). Asi po 14 dnech pociťovala pomalu progredující dušnost a později zpozorovala hemoptýzu.
Obr. 1. Rozsev kožních vaskulitických eflorescencí na dolních končetinách 43leté nemocné s granulomatózou s polyangiitidou a difuzní alveolární hemoragií (archiv autorky) 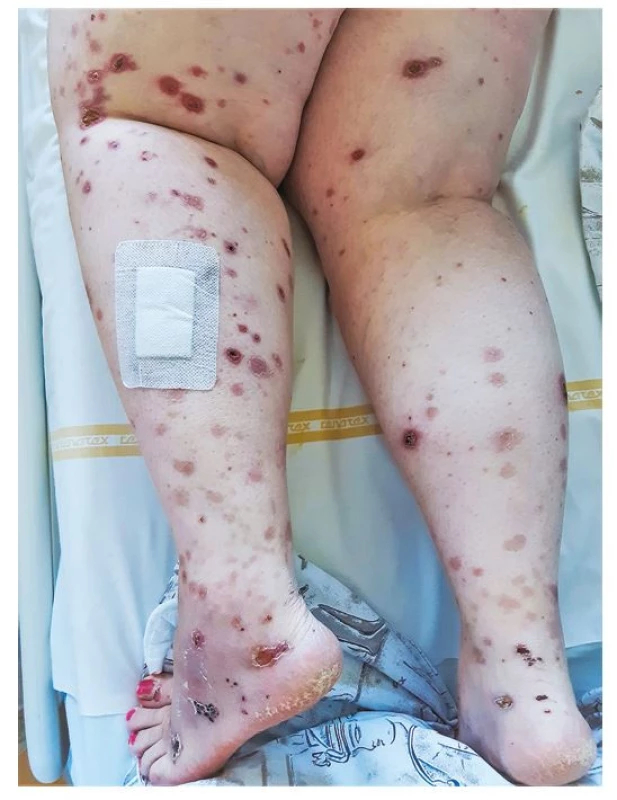
Nemocná je nekuřačka, trpí významnou obezitou s BMI (Body Mass Index) 47 kg/m2 a před hospitalizací se dlouhodobě léčila s diabetem mellitem II. typu (terapie perorálními antidiabetiky), arteriální hypertenzí a dyslipidemií. Neměla anamnézu revmatického, plicního či imunitně mediovaného onemocnění.
Vzhledem k nálezům byla pacientka hospitalizována na interním oddělení ve spádovém zdravotnickém zařízení a bylo provedeno radiografické vyšetření plic, kde byl zásadním nálezem výrazný, avšak nespecifický obraz masivní bilaterální infiltrace. Proto bylo indikováno vyšetření plic pomocí HRCT, které prokázalo rozsáhlou přítomnost opacit mléčného skla v centrálních částech plic s relativním ušetřením periferních oblastí, což imponovalo jako obraz DAH. Byla vyloučena plicní embolizace, diferenciálně diagnosticky byl radiologem zvažován alveolární edém, ARDS (Acute Respiratory Distress Syndrome, syndrom akutní dechové tísně) či pneumonie při Pneumocystis jirovecii a byly provedeny všechny potřebné laboratorní testy. Pacientka byla zaléčená empirickou antibiotickou terapií (Cefotaxim, Klarithromycin), pro výraznou anemizaci bylo nutno aplikovat erymasu a byla zahájena kortikoterapie (40 mg methylprednisolonu 3× denně). Vzhledem k progresi stavu a ohrožení životních funkcí při zhoršujícím se obrazu respiračního selhávání s výraznou dušností byla pacientka přeložena na JIP naší kliniky (Obr. 2 a 3).
Obr. 2. Radiografické vyšetření plic pacientky s nálezem masivní bilaterální infiltrace (archiv autorky a Kliniky radiologie FN Olomouc) 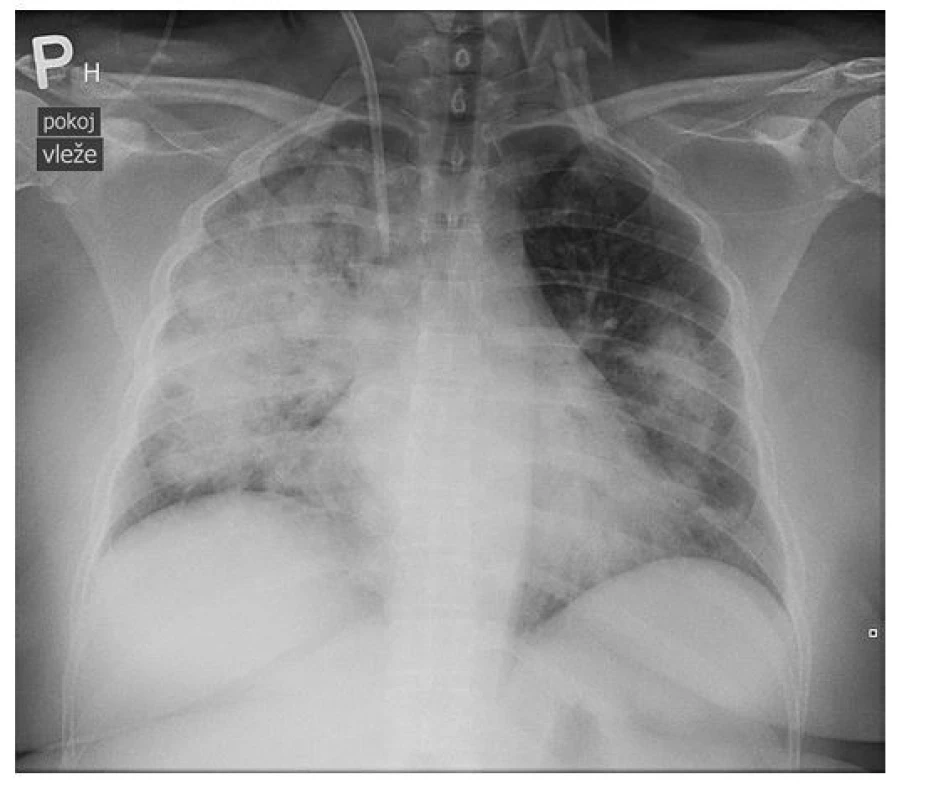
Obr. 3. HRCT plic pacientky s průkazem rozsáhlé přítomnosti opacit mléčného skla v centrálních částech plic s relativním ušetřením periferních oblastí imponující jako obraz difuzní alveolární hemoragie (archiv autorů a Radiodiagnostického oddělení Nemocnice AGEL Valašské Meziříčí) 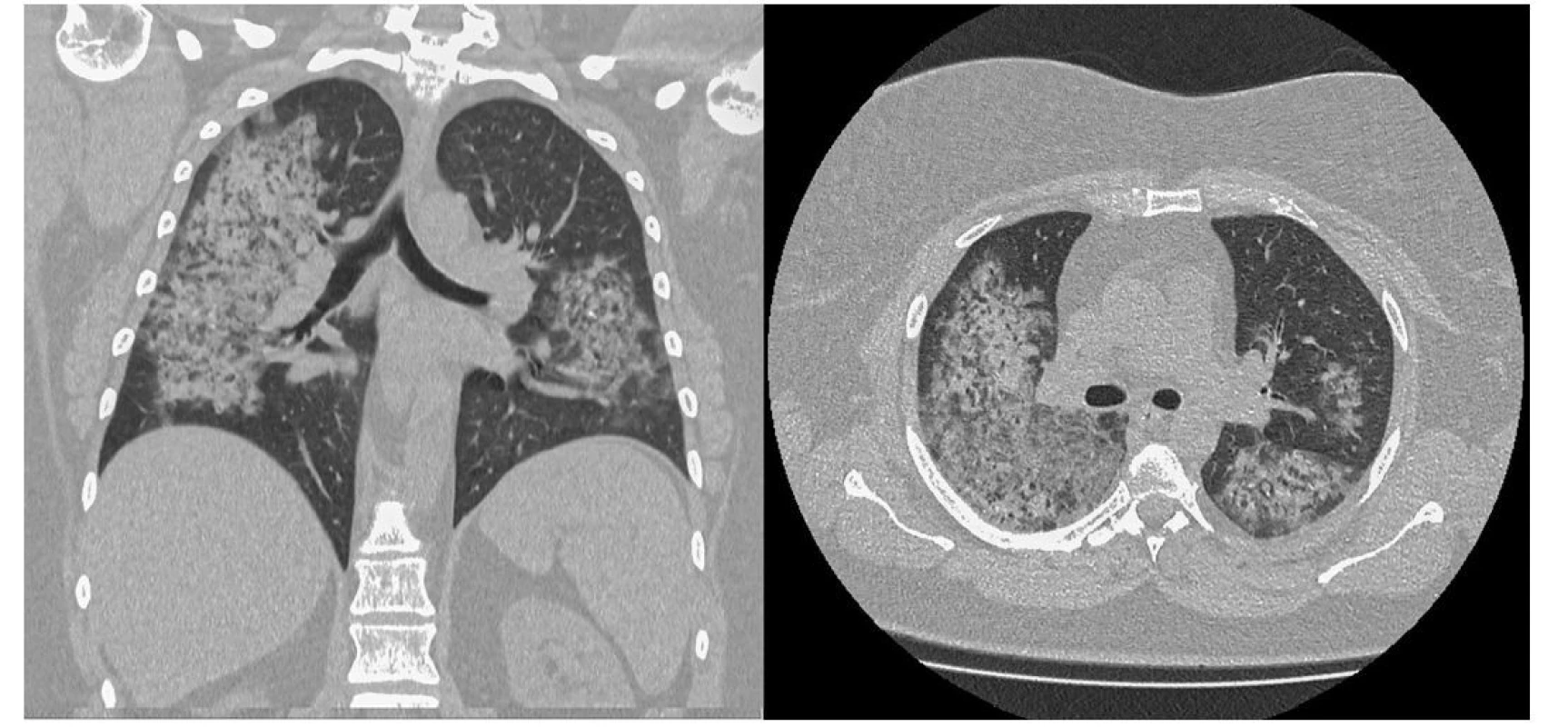
Ve vstupních laboratorních výsledcích (Tab. 1) dominoval nález elevace CRP (C‑reaktivní protein), dále anémie, hematurie a proteinurie. Renální funkce nebyly významně postiženy. Byla zjištěna silná pozitiva ANCA protilátek (protilátky proti proteináze 3). Vzhledem k závažné alteraci stavu nebylo indikováno bioptické vyšetření ledviny ani bronchoskopie s laváží (BAL).
Tab. 1. Souhrn významných laboratorních nálezů a jejich vývoje u nemocné s granulomatózou s polyangiitidou a difuzní alveolární hemoragií 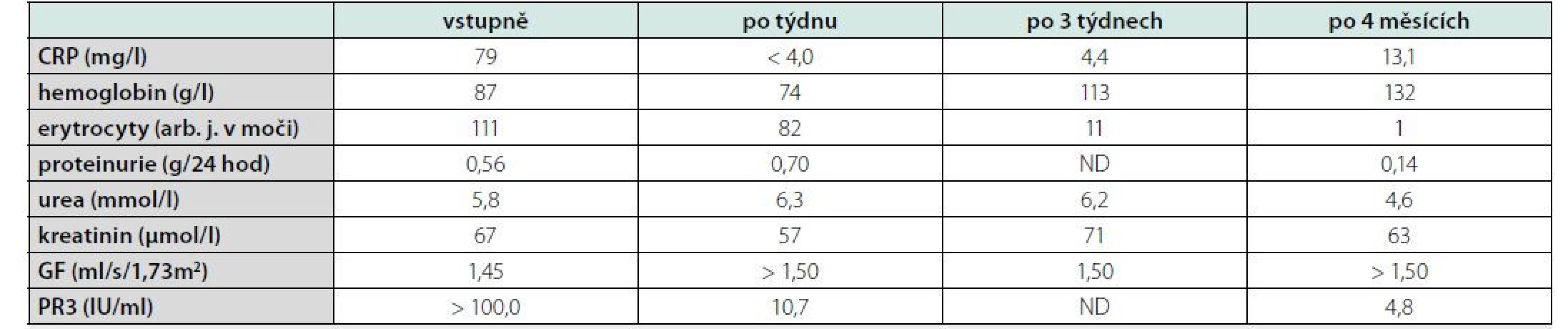
CRP = C-reaktivní protein, GF = glomerulární filtrace, PR3 = protilátky proti proteináze 3, ND = neprovedeno U pacientky s hypoxickým respiračním selháním s nutností zahájení vysokoprůtokové nosní oxygenoterapie (High ‑ flow Nasal Oxygenotherapy, HFNO) byly prováděny výměnné plazmaferézy s náhradou, kterých bylo celkem 7. Dále byla zahájena infuzní terapie vysokodávkovými pulzy glukokortikoidů (1000 mg methylprednisolonu denně po dobu tří po sobě následujících dnů) a byl podán první intravenózní pulz cyklofosfamidu (CFA) v dávce 10 mg/kg, tj. 1300 mg, v krytu mesnou a antiemetiky. Byla poskytována komplexní podpůrná péče spočívající v podávání antibiotické terapie nasedajícího respiračního infektu, transfuzní terapii anémie, oxygenoterapii, analgetické terapii a expektorans. Včasně bylo také započato s rehabilitační péčí.
Po několika dnech intenzivní péče došlo postupně k regresi jak klinických příznaků respiračního postižení, tak rentgenového nálezu. Také kožní vaskulitické změny postupně ustupovaly. Pacientka byla stabilní, kardiopulmonálně kompenzovaná a po týdnu byla přeložena na standardní lůžkové oddělení, kde bylo pokračováno v podávání kortikoterapie perorálně v dávce 60 mg prednisonu denně. Dále bylo pokračováno v nastavené podpůrné terapii a intenzivní rehabilitaci. V odstupu 14 dní od podání prvního pulzu cyklofosfamidu byl podán druhý pulz CFA. Před propuštěním nemocné bylo naplánováno pokračování pulzní terapie CFA v 3týdenních intervalech s postupnou redukcí dávek prednisonu dle klinického stavu. Pacientka byla zajištěna profylaktickou terapií kotrimoxazolem.
Po 4 měsících (po podání 6. pulzu CFA) bylo provedeno kontrolní CT vyšetření (Obr. 4) s nálezem kompletní regrese nálezu patrného na vstupním vyšetření. Vývoje laboratorních parametrů ukazuje tabulka 1. Po ukončení terapie CFA byl nasazen mykofenolát mofetil v dávce 2000 mg denně jako udržující imunosupresivní terapie. Pacientka bude nadále ambulantně sledována.
Obr. 4. Kontrolní HRCT plic pacientky po 4 měsících s nálezem kompletní regrese nálezů patrných na vstupním vyšetření (archiv autorky a Kliniky radiologie FN Olomouc) 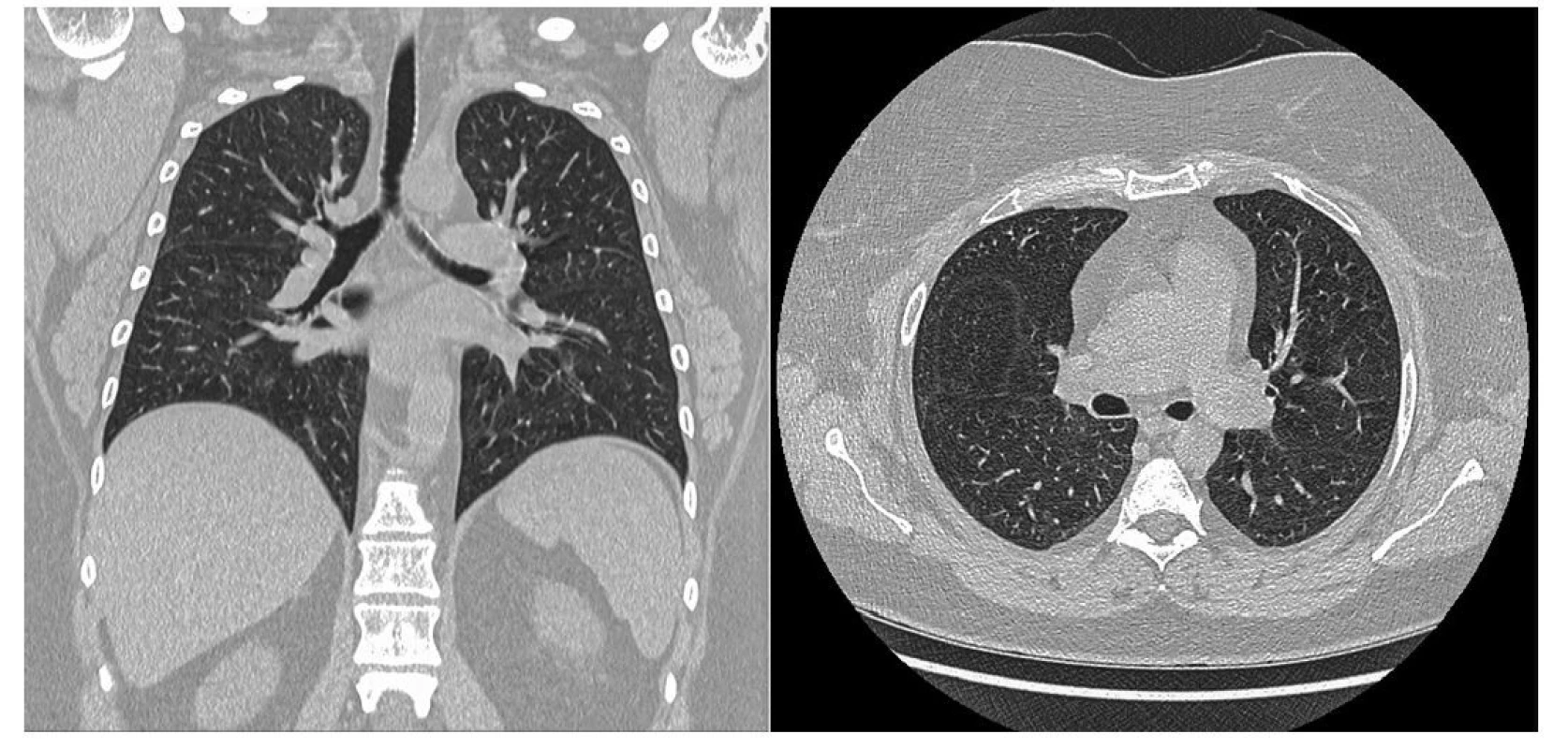
Diskuze
Dle doporučení EULAR (The European Alliance of Associations for Rheumatology, Evropská liga proti revmatismu) a ERA‑EDTA (Renal Association and European Dialysis and Transplant Association, Evropská asociace pro choroby ledvin a Evropská asociace pro dialýzu a transplantaci ledvin) spočívá terapie DAH při AAV v komplexní léčbě s využitím vysokých dávek glukokortikoidů, cyklofosfamidu, plazmaferézy a rituximabu (12).
Recentně se pokusila o srovnání terapeutických možností závažných forem AVV randomizovaná studie PEXIVAS (Plasma Exchange and Glucocorticoids in Severe ANCA‑Associated Vasculitis, Plazmaferéza a glukokortikoidy v léčbě ANCA‑asociovaných vaskulitid s těžkým průběhem). Jedním ze vstupních kritérií byla rovněž přítomnost difuzní alveolární hemoragie (13).
V úvodu studie byla všem pacientům podána úvodní imunosupresivní terapie intravenózním či perorálním cyklofosfamidem nebo rituximabem. Všichni pacienti byli první týden léčeni intravenózní terapií metylprednisonem v dávce 1 až 3 g denně. Následně bylo celkem 704 pacientů randomizováno do 4 skupin s přihlédnutím k adjustaci úvodní imunosupresivní léčby. Pacienti byli rozděleni podle toho, zda podstoupili terapii plazmaferézami v dávce odpovídající 60 ml albuminu na kg (n = 352), či nikoliv (kontrolní skupina) (n = 352). Kromě toho byli také rozděleni podle toho, zda jim byla podávána standardní (n = 351), či redukovaná (n = 353) terapie perorálními glukokortikoidy. Pacienti byli tedy celkově náhodně rozděleni na 4 skupiny v poměru 1 : 1 : 1 : 1 na ty, kteří podstoupili terapii plazmaferézami a pokračovali se standardní dávkou perorálních glukokortikoidů (a), podstoupili terapii plazmaferézami a pokračovali se sníženými dávkami perorálních glukokortikoidů (b), nepodstoupili terapii plazmaferézami a pokračovali v režimu standardních dávek perorálních glukokortikoidů (c) nebo nepodstoupili terapii plazmaferézami a pokračovali v režimu snížených dávek perorálních glukokortikoidů (d) (13).
Výsledky u pacientů s redukovanou dávkou perorálních glukokortikoidů (b + d) byly srovnatelné se standardní dávkou (a + c), tzn. že redukovaná dávka nebyla méně účinná ve srovnání se standardní, ale závažných infekcí bylo v skupině s redukovanou dávkou během ročního sledování méně než ve skupině s terapií standardní dávkou. Pacientů s DAH, kteří podstoupili terapii plazmaferézou, bylo ve studii 191, výsledek nedosáhl statistické významnosti, i když trend vedl k lepším výsledkům než u pacientů, kteří terapii plazmaferézou nepodstoupili (14).
Dle komentáře ke studii PEXIVAS se jeví diskutabilní zařazení snížení glomerulární filtrace do zařazovacích kritérií studie namísto výsledku renální biopsie, což neumožnilo odlišit akutní či chronické ledvinné poškození (15).
Doporučení terapeutického protokolu podání intravenózního CFA dle ACR (American College of Rheumatology, Americká revmatologická kolej) z roku 2021 spočívá v přerušovaném podávání 15 mg/kg každé 2 týdny ve 3 dávkách, následně pak 15 mg/kg každé 3 týdny v počtu nejméně 3 dávek u dospělých pacientů (16).
Rawal a kol. s úspěchem využili metod extrakorporální membránové oxygenace (ECMO) u akutního život ohrožujícího případu pacienta s DAH asociovaného s GPA (17). Baker a kol. zase prokázali přínos intrapulmonální aplikace rekombinantního faktoru VII v souboru 6 pacientů s DAH bez asociace s AVV (18).
Recentně nabývá významu asociace vzniku DAH a AAV s proděláním onemocnění covid-19, který má mnoho různých komplikací včetně stavů souvisejících s narušením imunitního systému. Kazuistiku dvou imunokompromitovaných pacientů s covidem-19, kteří rozvinuli obraz DAH na podkladě aktivní infekce, popisuje Löffler a kol. (6), autoimunitní příčina DAH zde byla zvažována, diskutována a zavrhnuta. Vážný a život ohrožující stav nakonec u jednoho z pacientů vedl k úmrtí. Byl také prezentován případ pacientky s přetrvávající hemoptýzou po prodělání covid-19, u které se vyvinul obraz DAH spíše de novo vzniklou AAV (infekčně podmíněnou) než přímým poškozením krevních cév infekcí (7). Dále lze zmínit rovněž publikovanou kazuistiku o možné souvislosti mezi infekcí covid-19 a de novo vzniklou AAV projevující se závažným plicně‑renálním syndromem vedoucím k trvalé závislosti na dialyzační terapii. Dle autorů naznačuje stále více důkazů možnou souvislost mezi infekcí covid-19 a vznikem AAV, byť příčinnou souvislost prokázat zatím nelze. Autor doporučuje zvýšené podezření na de novo vzniklou AAV u pacientů s aktivní nebo nedávnou infekcí covid-19, pokud se u nich objeví GN a/nebo DAH (8).
Závěr
DAH náleží mezi akutní život ohrožující stavy s nejasnou prognózou, kdy včasná a adekvátní komplexní terapie může být život zachraňující. Často bývá komplikací revmatologických onemocnění – vaskulitid či systémových onemocnění pojiva. K diagnostice může napomoci typický klinický obraz v kombinaci s laboratorními výsledky a typickými nálezy zobrazovacích metod. Komplexní terapie se opírá o základnu spočívající v imunosupresivní terapii. Použití plazmaferézy je u DAH opřeno o doporučení EULAR/ERA‑EDTA (12). Studie PEXIVAS však ukazuje, že přínos plazmaferézy není ve všech případech zcela jednoznačný (13). Pro zvládnutí akutní ataky je důležité tuto léčbu poskytnout neodkladně, protože úmrtnost tohoto stavu je stále vysoká (3, 10, 11). Některá pozorování poukazují na možnost vztahu mezi prodělanou infekcí covid-19 a závažnou manifestací ANCA‑asociované vaskulitidy (7, 8).
Podpořeno MZ ČR RVO FNOL-0098892 a grantem IGA_LF_2022_03.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Pavlína Kostelníková
III. interní klinika – nefrologická, revmatologická a endokrinologická, FN Olomouc
I. P. Pavlova 6, 779 00 Olomouc
Cit. zkr: Vnitř Lék. 2022;68(5):290-294
Článek přijat redakcí: 28. 6. 2022
Článek přijat po recenzích: 11. 7. 2022
Zdroje
1. Comarmond C, Cacoub P. Granulomatosis with polyangiitis (Wegener): Clinical aspects and treatment. J Autoimmun. 2014;13(8):1121-1125. Dostupné z DOI:<https://https://doi.org/10.1016/j.autrev.2014. 08. 017>.
2. Robson JC, Grayson PC, Ponte C et al. 2022 American College of Rheumatology/European Alliance of Associations for Rheumatology Classification Criteria for Granulomatosis With Polyangiitis. Arthritis Rheumatol. 2022;74(3):393-399. Dostupné z DOI: <https://doi/10.1002/art.41986>.
3. Bradna P, Maňák J, Soukup T et al. Difuzní alveolární hemoragie – akutní, život ohrožující stav v revmatologii. Vnitř Lék. 2018;64 : 169-172. Dostupné z DOI: <https://doi:10.36290/vnl.2018.025>.
4. Krause ML, Cartin‑Ceba R, Specks U et al. Update on diffuse alveolar hemorrhage and pulmonary vasculitis. Immunol Allergy Clin North Am. 2012;32(4):587-600. Dostupné z DOI: <https://doi:10.1016/j.iac.2012. 08. 001>.
5. Panikkath D, Gadwala S, Mills B et al. Diffuse alveolar hemorrhage. Southwest respir crit care chron. 2015;3(9):19-27. Dostupné z WWW: <https://pulmonarychronicles.com/index.php/pulmonarychronicles/article/view/186>.
6. Löffler C, Mahrhold J, Fogarassy P. Two Immunocompromised Patients With Diffuse Alveolar Hemorrhage as a Complication of Severe Coronavirus Disease 2019. Chest. 2020;158(5):e215–e219. Dostupné z DOI: <https://doi:10.1016/j.chest.2020. 06. 051>.
7. Wang E, Lee T, Sharma P et al. The Perfect Storm: Diffuse Alveolar Hemorrhage after SARS‑COV-2 Infection. Chest. 2021;160(4):A1212-A1213. Dostupné z DOI: <https://doi:10.1016/j.chest.2021. 07. 1114>.
8. Madanchi N, Stingo FE, Patrick KC et al. Possible Association Between COVID-19 Infection and De Novo Antineutrophil Cytoplasmic Antibody‑Associated Vasculitis. Cureus. 2021;13(12). Dostupné z DOI:<https://doi:10.7759/cureus.20331>.
9. Quadrelli S, Dubinsky D, Solis M et al. Immune diffuse alveolar hemorrhage: Clinical presentation and outcome. Respir Med. 2017;129 : 59-62. Dostupné z DOI: <https://doi:10.1016/j.rmed.2017. 06. 003>.
10. De Prost N, Parrot A, Picard C et al. Diffuse alveolar haemorrhage: factors associated with in‑hospital and long‑term mortality. Eur Respir J. 2010;35(6):1303-1311. Dostupné z DOI:<https://doi10.1183/09031936.00075309>.
11. Nasser M, Cottin V. Alveolar Hemorrhage in Vasculitis (Primary and Secondary). Semin Respir Crit Care Med. 2018;39(4):482-493. Dostupné z DOI: <https://doi:10.1055/s-0038-1668533>.
12. Yates M, Watts RA, Bajema IM et al. EULAR/ERA‑EDTA recommendations for the management of ANCA‑associated vasculitis. Ann Rheum Dis. 2016;75(9):1583–1594. Dostupné z DOI: <https://doi:10.1136/annrheumdis-2016–209133>.
13. Walsh M, Merkel PA, Peh CA et al. Plasma Exchange and Glucocorticoids in Severe ANCA‑Associated Vasculitis. N Engl J Med. 2020;382(7):622-631. Dostupné z DOI: <https://doi:10.1056/NEJMc2004843>.
14. Čertíková Chábová V. Plazmaferéza a glukokortikoidy u těžké ANCA asociované vaskulitidy. Postgraduální nefrologie. 2020;18(1):21-23. Dostupné z WWW: <https://www.postgradualninefrologie. cz/cislo‑xviii-1/plazmafereza‑a‑glukokortikoidy‑u‑tezke‑anca‑asociovane‑vaskulitidy/>.
15. Derebail VK, Falk RJ. ANCA‑Associated Vasculitis – Refining Therapy with Plasma Exchange and Glucocorticoids. N Engl J Med. 2020;382 : 671-673. Dostupné z DOI: <https://doi:10.1056/NEJMe1917490>.
16. Chung SA, Langford CA, Maz M et al. 2021 American College of Rheumatology/Vasculitis Foundation Guideline for the Management of Antineutrophil Cytoplasmic Antibody–Associated Vasculitis. Arthritis Care Res. 2021;79(8):1088-1105. Dostupné z DOI: <https://doi:10.1002/acr.24634>.
17. Rawal G. ECMO Rescue Therapy in Diffuse Alveolar Haemorrhage: A Case Report with Review of Literature. J Clin Diagnostic Res. 2016;10(6):10-11. Dostupné z DOI: <https://doi:10.7860/JCDR/2016/20649.7969>.
18. Baker MS, Diab KJ, Carlos G et al. Intrapulmonary Recombinant Factor VII as an Effective Treatment for Diffuse Alveolar Hemorrhage: A Case Series. J Bronchology Interv Pulmonol 2016;23(3):255-258. Dostupné z DOI: <https://doi:10.1097/LBR.0000000000000286>.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2022 Číslo 5- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Hlavní téma – Aktuality v revmatologii
- Léčba obrovskobuněčné arteriitidy – současnost a otevírající se možnosti
- Co nového v léčbě systémového lupus erytematodes?
- Novinky v léčbě axiálních spondyloartritid
- Časná diagnostika systémové sklerodermie
- Difuzní alveolární hemoragie jako život ohrožující manifestace nově diagnostikované granulomatózy s polyangiitidou navazující na infekci covid-19 – kazuistika
- Co je nového v doporučeních ESC 2021 pro kardiovaskulární prevenci?
- Proč brát vážně orgánové poškození u hypertenze?
- Zánět a vaskulární onemocnění
- Time in range: nový parametr v diabetologii
- Co je nového v Doporučených postupech ESC 2020 pro diagnostiku a léčbu akutních koronárních syndromů bez ST elevací?
- Diferenciální diagnostika bolestí zad
- Entresto (sakubitril-valsartan) získalo prestižní mezinárodní Galénovu cenu za nejlepší farmaceutický produkt pro rok 2022
- XXXIX. dny mladých internistů v Martině
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Diferenciální diagnostika bolestí zad
- Časná diagnostika systémové sklerodermie
- Co je nového v doporučeních ESC 2021 pro kardiovaskulární prevenci?
- Co nového v léčbě systémového lupus erytematodes?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



