-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Dnešní pohled na dědičné trombofilie
Today's view of hereditary thrombophilia
Venous thromboembolism (VTE) is still a serious medical problem with the non-decreasing incidence of new cases despite prophylaxis in risky situations. It is a multifactorial disease, in which the hereditary component is also significantly involved. The aim of the current research is to search for new polymorphisms that are involved in thrombogenesis in addition to classical thrombophilia (deficiency of natural coagulation inhibitors and FVL and FII prothrombin mutations). The article provides an overview of the results of already performed genome-wide association studies of VTE and their use for the calculation of the so-called polygenic risk score, which could be used for individualized prevention of VTE after standardization of the method.
Keywords:
thrombophilia – Venous thromboembolism – genome‑wide association studies – polygenic risk score – individualized prevention
Autori: Jan Kvasnička 1,2; Zuzana Kovářová-Kudrnová 1; Zuzana Zenáhlíková 1; Radka Brzežková 1; Sylvie Šťastná 1; Petra Bobčíková 1; Tomáš Kvasnička 1
Pôsobisko autorov: Trombotické centrum Ústavu klinické biochemie a laboratorní diagnostiky, Praha 1; 1. interní klinika, Všeobecná fakultní nemocnice a 1. lékařská fakulta Univerzity Karlovy, Praha 2
Vyšlo v časopise: Vnitř Lék 2022; 68(8): 488-492
Kategória:
doi: https://doi.org/10.36290/vnl.2022.105Súhrn
Žilní tromboembolismus (ŽTE) představuje stále závažný medicínský problém s neklesajícím výskytem nových případů i přes prováděnou profylaxi v rizikových situacích. Jedná se o multifaktoriální onemocnění, na kterém se výrazně podílí i dědičná složka. Cílem stávajícího výzkumu je vyhledávání nových polymorfismů, které se mimo klasických trombofilií (deficitu přirozených inhibitorů koagulace a mutací FVL a FII protrombinu) podílejí na trombogenezi. V článku je podán přehled o výsledcích již provedených celogenomových asociačních studií ŽTE a jejich použití pro výpočet tzv. polygenního skóre rizika, které by po standardizaci metody mohlo být používáno pro individualizovanou prevenci ŽTE.
Klíčová slova:
trombofilie – žilní tromboembolismus – celogenomové asociační studie – polygenní skóre rizika – individualizovaná prevence
Úvod
Přibližně 500 000 lidí každoročně v Evropě umírá na komplikace žilního tromboembolismu (ŽTE), a to navzdory skutečnosti, že této poruše lze zabránit vhodnou profylaxí. Výskyt ŽTE je stále poměrně vysoký, se 148 případy žilní trombózy a 95 případy plicní embolie na 100 000 jedinců, které se vyskytují každý rok (1). Je to 3. nejvíce se vyskytující onemocnění cévního systému a nejčastější příčiny smrti (2). Incidence nových případů žilního tromboembolismu (TEN) je asi 0,75–2,69, ale u starších osob (≥ 70 let) již 2–7 na 1000 obyvatel za 1 rok (3). Celoživotní riziko ŽTE je také poměrně vysoké (4) a odhaduje se, že v průběhu života postihne v různých formách své manifestace až 9 % populace (5). Přes publikovaná doporučení k profylaxi ŽTE a jejich provádění se však zatím incidence ŽTE významně nezměnila. Souvisí to pravděpodobně se zvyšováním výskytu obezity, rakoviny a se stárnutím populace (6). Uvedená data o incidenci ŽTE však ještě určitě změní k horšímu současná celosvětová epidemie virovou infekcí SARS‑CoV - 2, s vysokým počtem komplikací ŽTE u hospitalizovaných nemocných osob. Jejich výskyt zde neovlivnila ani používaná vakcinace. Zjištěné 90denní absolutní riziko žilní tromboembolie bylo 9,5 % (95 % CI, 9,2 %–9,7 %) u pacientů s covidem-19 před dostupností vakcíny a 10,9 % (95 % CI,10,6 % –11,1 %) v době dostupnosti vakcíny, tedy stejné (7). ŽTE byla u nemocných s covidem-19 také spojená až s 23% mortalitou (8). Průběh ŽTE však není stacionární a její dynamiku nemusí ovlivnit ani podaná antikoagulační terapie. Po akutní žilní trombóze dochází u mnoha pacientů k tzv. potrombotickému syndromu, který se klinicky projevuje různým stupněm chronické žilní nedostatečnosti. Její hlavní příčinou je kombinace přetrvávající žilní obstrukce a insuficience žilních chlopní. Nejzávažnější komplikací akutního stadia žilní trombózy je však plicní embolizace. Její udávaná incidence je přibližně 100 na 100 000 obyvatel za rok. Symptomatických nefatálních plicních embolizací se vyskytuje přibližně 20 na 100 000 obyvatel/rok. Fatální embolizace, které byly prokázány při sekci, jsou uváděny v počtu 5 případů na 100 000 osob. Další velmi závažnou komplikací proběhlé embolizace do plicního řečiště je tzv. chronická tromboembolická plicní hypertenze (CTEPH), ke které dochází s určitým časovým odstupem u 2–4 % pacientů postižených akutní plicní embolií. Udávaná incidence CTEPH v populaci je asi 2–6 případů a prevalence 26–38 případů na milion obyvatel za rok. Bez léčby je prognóza CTEPH závažná, kdy podle historických údajů dosahuje po 5 letech úmrtnosti až v 70–90 % (9–11). Ke komplikacím plicní embolzace se nyní ještě řadí tzv. postpulmonální syndrom, projevující se po skončení antikoagulační léčby jako nová, nebo progresivní dyspnoe a intolerance fyzické zátěže během cvičení. Není vyloučeno, že za perzistenci trombotických reziduí v plicních cévách zde opět odpovídá opakovaná, klinicky němá trombotická embolizace (12). Po prvé epizodě ŽTE dochází totiž až v 31 % k jejímu opakování (13). Po skončení antikoagulační léčby se pak vyšší počet rekurencí pozoruje po tzv. nevyprovokovaných ŽTE (14), což zde vede k tendenci prodlužovat antikoagulační léčbu (15). Důvodem je i zvýšení mortality (až o 34 %) pozorované u nemocných s recidivou ŽTE (17).
Cílem účinné taktiky ke snížení incidence a komplikací ŽTE, včetně její rekurence, může být do budoucna jen individualizovaná prevence. Samotné onemocnění je však považováno za onemocnění multifaktoriální (18) s mnoha získanými, ale také s dědičnými rizikovými faktory (19) a s rozdílným výskytem mezi jednotlivými etniky (20). Familiární výskyt ŽTE byl sice popsán již v roce 1905 Briggsem, ale teprve když Dahlbäck v roce 1993 popsal rodinný výskyt rezistence na aktivovaný protein C bylo jasné, že mezi rizikové faktory ŽTE budou rovněž řazeny i genetické faktory (citováno dle 19). Cílem tohoto článku je podat přehled o vývoji poznatků o dědičných trombofiliích v evropské populaci, které se podílejí v etiopatogenezi ŽTE a jejich využití v klinické praxi.
Klasické trombofilie
Trombofilie je definována jako získaná nebo dědičná dispozice k hyperkoagulaci, která vede ke zvýšenému riziku trombogeneze. Mannuci a spol. (20) mezi tzv. klasické trombofilie zahrnují dědičný deficit, nebo dysfunkci přirozených inhibitorů koagulace antitrombinu, proteinu C a proteinu S, rezistenci na aktivovaný protein C při mutaci faktoru V Leiden (rs6025) a mutaci faktoru II protrombinu (protrombin G20210A, rs1799963). K nim jsou zařazeny i krevní skupiny AB0 systému, kde osoby s nálezem antigenu A nebo B, jejichž skupina je označována jako „non O“, mají vyšší hladinu von Willebrandova faktoru (vWF) a F VIII než osoby s krevní skupinou 0.
1. Deficit nebo dysfunkce antitrombinu (dále AT)
Dědičný deficit AT byl popsán Egebergem již v roce 1965 (21). Nevyskytuje se často, v populaci jen asi u 0,02 % osob, ale výše rizika vzniku ŽTE je zde vysoká. Odhadem je toto riziko u osob s deficitem AT asi 10× vyšší než u osob s jeho normální hladinou. U pacientů s hlubokou žilní trombózou je pak deficit AT nacházen asi v 1 % případů. Rozeznávají se 2 typy: Deficit AT I. typu s redukcí funkce i antigenu AT a deficit AT II. typu, kde je prokazován jen funkční defekt. Tento II. typ deficitu AT se pak dále dělí do 3 podskupin. Na tzv. RS typ s mutacemi, které vedou k jeho dysfunkci v reaktivním místě (RS), HBS typ s mutacemi, které způsobí dysfunkci vazby AT s heparinem (HBS) a PE typ s mutacemi vyvolávající pleiotropní efekt. Gen AT (SERPINC1) je lokalizován na 1. chromozomu (q23–25), má 7 exonů a 6 intronů. Dosud bylo popsáno asi 90 mutací AT.
2. Deficit nebo dysfunkce proteinu C (dále PC)
Kongenitální deficit PC byl u nemocných s ŽTE byl poprvé popsán Griffinem a spol. v r. 1981 (22). Zatím je známo asi 160 mutací genu PC (PROC), z nichž některé mohou být i klinicky němé. U osob s deficitem PC má být riziko žilní trombózy opět asi 10× zvýšeno. V populaci je deficit PC nalézán u asi 0,2–0,4 % osob a u 3 % nemocných s ŽTE. V počátku léčby dikumarolovými antikoagulancii se může projevit paradoxní trombotizací, která je spojena s ischemickou nekrózou kůže (tzv. dikumarolová nekróza).
3. Deficit, nebo dysfunkce proteinu S (dále PS)
Dědičný deficit PS byl poprvé popsán v Schwarzem a spol. v roce 1984 (23). Je nalézán u asi 1–5 % nemocných se žilní trombózou. PS se účastní inhibice koagulace jako neenzymatický kofaktor v systému aktivovaného PC (APC), kde zvyšuje jeho schopnost degradovat aktivované F Va a F VIIIa. Inhibice F VIIIa s APC však vyžaduje nejen zapojení aktivovaného PS, ale i funkčnost FV, který zde de facto spolupůsobí jako kofaktor APC. Za normálních okolností se v plazmě 70 % PS vyskytuje ve vázané formě s bílkovinným nosičem C4 složky komplementu (C4BP). Deficit PS je možné dělit na 3 různé subtypy. I. typ deficitu PS je charakterizován poklesem jak antigenu PS, tak funkční aktivity. II. typ deficitu PS způsobí dysfunkci inhibice koagulace, ale hladinu antigenu PS má normální. III. typ deficitu PS je spojen jen s nižší hladinou volného PS v krevní plazmě. Relativně často se ještě vyskytuje varianta zvaná PS Heerlen (S460P), která je vyvolána mutací genu PS (PROS 1). Ta způsobí, že nedochází ke glykosylaci v místě 458 N‑konce molekuly PS. Je řazena k III. typu deficience PS a v populaci se vyskytuje u asi 0,5–0,8 % osob. Způsobí pokles hladiny volného PS, danou vyšší afinitou PS Heerlen k C4BP (24).
4. Mutace FV Leiden (dále FVL)
Poprvé byla popsána v roce Bertinou a spol v r. 1994 (25). Vyvolává rezistenci na aktivovaný protein C a podle místa objevu se nazývá Leidenská. Při syntéze FV zde dochází k záměně aminokyseliny argininu v pozici 506 za glutamin (rs 6025), která způsobí, že FVL je rezistentní vůči štěpení aktivovaným proteinem C. K trombofilii přispívá i to, že tato mutace FVL není způsobilá podílet se spolu s PS na inaktivaci aktivovaného F VIIIa. K dalším genetickým mutacím FV se také řadí tzv. haplotyp HR2. Je způsoben mutací A4070G v exonu 13 genu FV, který způsobí záměnu His (R1 alela) za Arg (R2 alela) v místě 1299 B domény. Tato záměna je odpovědna za snížení hladiny FV, kdy pokles k 20 % normálu způsobí mimo jiné i rezistenci na aktivovaný protein C. Syndrom APC rezistence se projevuje sklonem k žilním, méně často k arteriálním trombózám. U nositelů FVL sice vzniká až 7× vyšší riziko hluboké žilní trombózy a 4–5× větší riziko její rekurence, ale u osob s heterozygotní formou dochází k trombózám patrně jen tehdy, když se k tomuto defektu přidruží i další rizika. Těmi jsou např. pooperační stav, léčba estrogeny, patologické těhotenství, obezita, imobilizace aj. Vzniklé žilní trombózy zde také většinou nejsou provázeny plicní embolií (tzv. FV Leiden paradox).
Způsobí ji bodová mutace v 3–UTR (v nepřepisované oblasti) mRNA protrombinu (26), která u postižených jedinců vyvolá zvýšení produkce protrombinu (> 130 %), a tím i dispozici ke srážení krve. Výskyt mFII (rs1799963) se v populaci pohybuje mezi 1–2 %. U nemocných s již vzniklou žilní trombózou je pak mutace protrombinu zjišťována asi v 6 %. U heterozygotních nositelů mFII se riziko vzniku žilní trombózy zvyšuje asi 2–3krát.
Podle výše rizika ŽTE byly dosud osoby s nálezy deficitů AT, PC anebo PS řazeny do skupiny trombofilií s vysokým rizikem a nosiči FVL nebo mFII do skupiny trombofilií s nízkým rizikem ŽTE (9). Původní odhady o vysokém, až 5–10. násobném zvýšení rizika ŽTE u deficitů AT, PC a PS však byly zjištěny v rodinných studiích u osob se sníženou hladinou v krevní plazmě. Podle Manderstena a spol. (27) je ale jejich genetické riziko ŽTE mnohem nižší. V kohortě 29 387 dospělých osob (60 % žen) středního až staršího věku (od 41 do 73 let) provedli sekvenaci jejich exomů a zjistili, že genetické riziko 68 variant genů PROC, PROS1 a SERPINC1 dosahovalo úrovně ohrožení ŽTE (hazard ratio, dále HR) 1,6. To se již příliš nelišilo od nálezu u nosičů heterozygotní varianty FVL (HR 1,8) a mFII (HR 1,6). Dalším zajímavým nálezem bylo, že výskyt klasických trombofilií představuje riziko vzniku ŽTE i pro lidi starší nebo středního věku.
Celogenomové asociační studie (dále GWAS, z angl. genome‑wide association study)
Od roku 2008 začaly být nově publikovány výsledky studií, které již zahrnovaly vyšetření desítek až stovek tisíc známých jednonukleotidových polymorfismů (dále SNP, z angl. single nucleotide polymorfism) v kohortách několika tisíců jedinců, kteří prodělali ŽTE, a kontrolních osob, které ŽTE neměly. K tomuto účelu již byla použita nová vyšetřovací technologie, nazvaná DNA microarray, nebo také analýza genové exprese s DNA čipy (28). V současnosti jsou tyto DNA čipy vyráběny již průmyslově různými firmami jako Agilent Technologies™, Illumina™ aj. Pro grafický výstup GWAS je po statistickém vyhodnocení vytvářen tzv. „Manhattanský graf“, kde každá tečka představuje SNP, osa x ukazuje chromozomy, kde se nachází každý SNP, a osa y ukazuje hodnotu SNP, který se váže k ŽTE. Přitom je pro korekci zvolena prahová hodnota významnosti (většinou odpovídající p < 5 × 10-8), která pak vydělí oblasti, kde se vyskytují důležité kauzální geny. Zároveň bývá v grafu barevně odlišen nově identifikovaný lokus, který je významně spjat s rizikem onemocnění. Prvá GWAS, analyzující spojitost více než 19 682 SNP ovlivňujících tvorbu koagulačních faktorů s ŽTE (29), byla publikována po sloučení výsledků studií provedených v různých evropských oblastech. Byly to studie LETS (vyšetření 443 osob s ŽTE a 453 kontrol v Holandsku) se studiem MEGA-1 (vyšetření souboru 1 398 pacientů s ŽTE a 1 757 kontrol) a MEGA-2 (vyšetření 1 314 pacientů s ŽTE a 2 877 kontrol) které byly provedeny ve Francii. Její výsledky byly v následných letech ještě konfirmovány s dalšími GWAS (30), které ale nepotvrdily dříve nalezenou spojitost ŽTE s některými SNP (GP6, CYP4V2 aj.). Při postupném zvyšování počtu detekovaných SNP a účastníků v nových GWAS (31) pak byly objeveny ještě další významné genetické asociace s ŽTE. Kritériem jejich výběru však již byl požadavek, aby alely spojované s ŽTE dosáhly při provedení GWAS statistické významností OR ≥ 1,2 (OR, odds ratio, poměr šancí). To mimo FVL, mFII a polymorfismů AB0 („non O“) splnily jen další nově objevené polymorfismy genu fibrinogenu gama (FGG) a genu F11 (31). Frekvenci uvedených rizikových alel spojených s výskytem ŽTE a jejich O.R., které byly zjištěny v registru Trombotického centra VFN Praha, uvádíme v tabulce č. 1.
Tab. 1. Frekvence rizikových alel spojených s výskytem ŽTE u osob z registru Trombotického centra VFN Praha 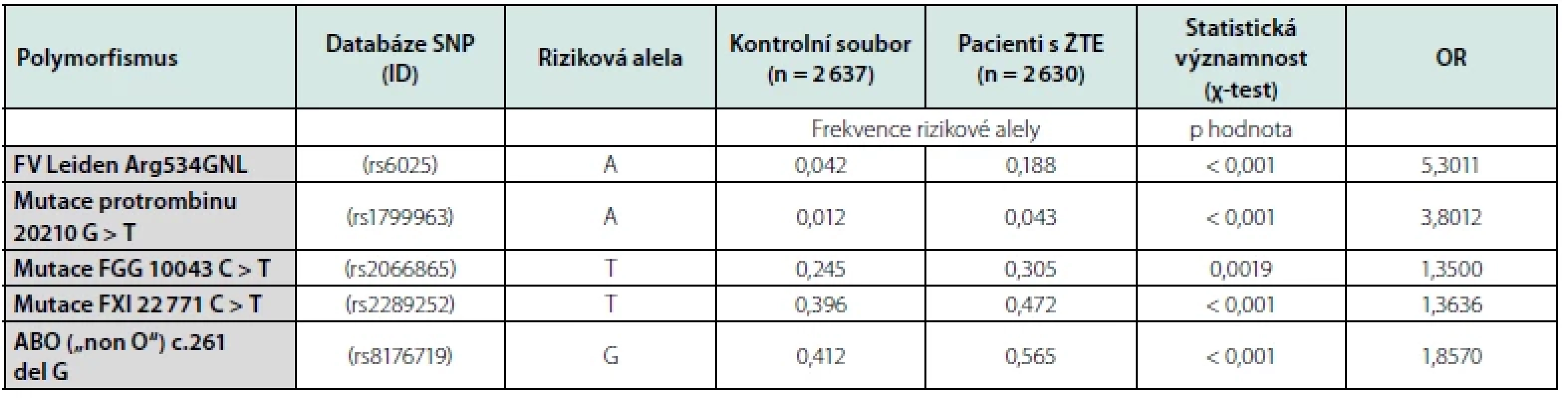
V roce 2019 pak byly publikovány ještě další dvě velké studie GWAS. Lindstrom a spol. (32) zde meta‑analyzovali nálezy 12 923 718 SNP u 30 234 pacientů s ŽTE a u 172 122 kontrol a celkem zjistili 34 nezávislých genetických asociací s ŽTE, z nichž 14 bylo popsáno nově. Klarin et al. (33) testovali s využitím dat z rozsáhlých studií Million Veteran Program a UK Biobank také asi 13 milionů variant sekvencí DNA v souboru 26 066 osob s ŽTE a u 624 053 kontrol a tyto nálezy dále ještě konfirmovali u 17 672 osob s ŽTE a u 167 295 kontrol. Identifikovali zde 22 nových replikovaných lokusů spojených s ŽTE a navíc prokázali i jejich určité spojitosti s arteriální trombogenezou. Další prováděná GWAS pak měla za cíl zjistit genetické vazby ŽTE nejen s polymorfismy genů koagulačních faktorů, ale také s geny dalších systémů, které se podílejí na trombogeneze. To je krevních destiček, zánětu, erytrocytů aj. Jejich přehled je uveden B. Zöllerem et al. (34). Vedle GWAS prezentují i výsledky některých dalších genetických metod použitých k důkazu dědičnosti ŽTE, jako jsou transkriptomové asociační studie (TWAS) nebo sekvenování celého exomu (whole‑exome sequencing, WES) aj. Zmiňují zde i význam použití nových metod jako sekvenace nové generace (NGS) nebo techniky HighThroughput Nucleotide Sequencing (HTS), kterou nyní použili i olomoučtí výzkumníci Vrtel, Slavík et al. (35). Ty by totiž měly v blízké budoucnosti nabízet přesné genomické informace získané rychle a levně. Stávající GWAS totiž i přes zařazení milionů dalších SNP a zvyšování souboru vyšetřovaných osob zachycují mimo nálezu polymorfismů F2, F5, F11, FGG a v ABO („non O“) již jen většinou varianty s omezenou prediktivní sílou.
Polygenní skóre rizika ŽTE
Prokázat prediktivní význam i těch „méně významných“variant se však nakonec může podařit při statistickém výpočtu tzv. polygenního rizikového skóre (PRS). Prvé sdělení o komplexním využití zjištěných polymorfismů z GWAS k předpovědi rizika vzniku ŽTE publikovali de Haan HG et al. (35). Provedli poměrně jednoduchý výpočet, kdy k vytvoření rizikového skóre použili data z GWAS MARTHA, FARIVE a LETS. Dokázali, že čím více bylo nalezeno „rizikových“ SNP spojených s ŽTE, tím vyšší bylo skóre rizika vzniku žilní trombózy. Došli až k nálezu více než 20násobného rozdílu mezi jedinci, u kterých nebyla zjištěna ani jedna riziková alela, a těmi, u kterých bylo zjištěno všech 31 rizikových alel. Rozhodování o výši rizika zde pak ještě zkombinovali doplněním o tzv. negenetické rizikové skóre, které vytvořili na základě zjištění známých rizikových faktorů (chirurgický zákrok, hormonální kontracepce, těhotenství, hospitalizace a cestování). Tím odhad pravděpodobnosti vzniku ŽTE ještě navýšili. K podobným výsledkům však místo vyšetření všech uvedených 31 SNP nakonec docházejí i při použití 5 nejdůležitějších z nich, to je polymorfismů F2, F5, F11, FGG a ABO. Stanovení těchto 5 nejdůležitějších polymorfismů se pak ještě osvědčilo při stanovení skóre rizika rekurence ŽTE (36). V případě nálezu 5 mutací bylo zjištěno, že po prodělané HŽT může během dalších 6 let dojít k opakování ŽTE u až 20,3 % vyšetřených osob.
V současné době se však ke kombinovanému výpočtu PRS používají již mnohem složitější statistické metody, zejména Coxův regresní model proporcionálních rizik. Ten k výpočtu PRS použili i Kolin et al. (37), kdy hodnotili výši rizika ŽTE z nálezu 36 rizikových SNP. Mezi ně zařadili i „méně významné“ varianty získané po provedení GWAS, ve které použili genetická data a údaje o výskytu klinických rizikových faktorů (vyšší věk, pohlaví, tělesná hmotnost, rakovina, kouření a zlomeniny končetin), která převzali z database UK Biobank (ta zahrnuje 502 536 účastníků). Účastníci studie měli signifikantně zvýšené riziko ŽTE, pokud byli vystaveni jak vysokému klinickému riziku ŽTE (vypočtený poměr proporciální úrovně ohrožení, subhazard ratio (SHR) byl 4,37), tak i vysokému genetickému riziku ŽTE (SHR 3,02). Kombinovaný model, skládající se jak z klinických, tak i genetických složek pak pravděpodobnost určení rizika ŽTE ještě zvýšil. Autoři studie z toho vyvozují, že PRS mohou v populaci identifikovat ještě další jedince s rizikem vzniku ŽTE na které by se nepřišlo, pokud by k odhadu rizika byly použity pouze výsledky stanovení mutací s nálezy vyššího OR a mohou být použita k individualizované prevenci.
Závěr
Lákavé příležitosti stanovit PRS po genetickém vyšetření více mutací najednou se však dnes bohužel ujímají i některé komerčně zaměřené genetické laboratoře a za úplatu slibují jeho výpočet pro určení rizika dispozice k různým závažným chorobám, včetně ŽTE. Domníváme se však, že mnohačetné stanovení i „méně rizikových“ SNP a poté výpočet PRS k volbě individualizované prevence ŽTE je zatím třeba posuzovat mnohem střízlivěji. Byly totiž již popsány rozdílné závěry z PRS stanovených po vyšetření osob s několika závažnými chorobami (s rakovinou prsu, hypertenzí nebo s demencí), a to i přes použití kontrolovaných dat z uváděné UK Biobanky (38). Důvodem k opatrné skepsi je také kritizovaná nejednotnost matematických modelů používaných k výpočtu PRS a nedostatek jejich standardizace a kontroly (39). Do jejich dořešení by tedy mělo být vyšetřování velkého množství SNP najednou a stanovení PRS stále jen předmětem vědeckého výzkumu.
Vypracováno za podpory vědeckých projektů Ministerstva zdravotnictví ČR No.: NT 11176-5 a RVO VFN 64 165 a zkráceně předneseno jako Čepelákova přednáška dne 18. 11. 2021 na 8. národním kongresu ČSTH, Praha.
KORESPONDENČNÍ ADRESA AUTORA:
prof. MUDr. Jan Kvasnička, DrSc,
Trombotické centrum
Ústav klinické biochemie a laboratorní diagnostiky VFN Praha
U Nemocnice 499/2, 128 08 Praha 2
Cit. zkr: Vnitř Lék. 2022;68(8):488-492
Článek přijat redakcí: 22. 9. 2022
Článek přijat po recenzích: 17. 10. 2022
Zdroje
1. Cohen AT, Agnelli G, Anderson FA et al. Venous thromboembolism (VTE) in Europe. The number of VTE events and associated morbidity and mortality. Thromb Haemost. 2007;98(4):756-64.
2. Heit JA, Spencer FA, White RH. The epidemiology of venous thromboembolism. J Thromb Thrombolysis. 2016;41(1):3-14.
3. ISTH Steering Committee for World Thrombosis Day. Thrombosis: a major contributor to the global disease burden. J Thromb Haemost 2014;12(10):1580-90.
4. Bell EJ, Lutsey PL, Basu S et al. Lifetime risk of venous thromboembolism in two cohort studies. Am J Med. 2016;129 339: e19-e26
5. Arnesen, CAL, Veres K, Horváth‑Puhó E et al. Estimated lifetime risk of venous thromboembolism in men and women in a Danish nationwide cohort: impact of competing risk of death. Eur J Epidemiol. 2022;37 : 195-203.
6. Heit JA, Ashrani A, Crusan DJ et al. Reasons for the persistent incidence of venous thromboembolism. Thromb Haemost 2017;117(2):390-400.
7. Lo Re V 3rd, Dutcher SK, Connolly JG et al. Association of COVID-19 vs influenza with risk of arterial and venous thrombotic events among hospitalized patients. JAMA 2022; 328(7):637-651.
8. Malas MB, Naazie IN, Elsayed N et al. Thromboembolism risk of COVID-19 is high and associated with a higher risk of mortality: A systematic review and meta‑analysis. EClinicalMedicine 2020;29 : 100639.
9. Hirnerová J, Karetová D, Malý R et al. Akutní žilní trombóza: současný stav prevence, diagnostiky a léčby (aktualizovaná verze 2020). Doporučený postup České angiologické společnosti. Available from: http://www.angiology.cz.
10. Rokyta R, Hutyra M, Jansa P. Doporučené postupy Evropské kardiologické společnosti (ESC) pro diagnostiku a léčbu akutní plicní embolie, verze 2019. Stručný přehled vypracovaný Českou kardiologickou společností. Cor Vasa. 2020;62 : 154-182.
11. Humbert M, Kovacs G, Hoeper MM et al. 2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Heart J. 2022; DOI:10.1093/eurheartj/ehac237.
12. Klok FA, Ageno W, Ay C et al. Optimal follow‑up after acute pulmonary embolism: a position paper of the European Society of Cardiology Working Group on Pulmonary Circulation and Right Ventricular Function, in collaboration with the European Society of Cardiology Working Group on Atherosclerosis and Vascular Biology, endorsed by the European Respiratory Society. Eur Heart J. 2022;43(3):183-189.
13. Kyrle PA, Kammer M, Eischer L et al. The long‑term recurrence risk of patients with unprovoked venous thromboembolism: an observational cohort study. J Thromb Haemost. 2016;14(12):2402-2409.
14. Jiménez D, Díaz G, Marín E et al. The risk of recurrent venous thromboembolism in patients with unprovoked symptomatic deep vein thrombosis and asymptomatic pulmonary embolism. Thromb Haemost. 2006;95(3):562-566.
15. Kearon C. Extended anticoagulation for unprovoked venous thromboembolism: a majority of patients should be treated. J Thromb Thrombolysis. 2011;31(3):295-300.
16. Barco S, Corti M, Trinchero A et al. Survival and recurrent venous thromboembolism in patients with first proximal or isolated distal deep vein thrombosis and no pulmonary embolism. J Thromb Haemost. 2017;15(7):1436-1442.
17. Rosendaal F. Venouds thrombosis: a multicausal disease. Lancet. 199;353 : 1167-1173.
18. Margaglione M, Grandone E. Population genetics of venous thromboembolism. A narrative review. Thromb Haemost. 2011;105(2):221-31.
19. Zöller B, Li X, Ohlsson H et al. Family history of venous thromboembolism as a risk factor and genetic research tool. Thromb Haemost. 2015;114(5):890-900.
20. Mannucci PM, Franchini M. Classic thrombophilic gene variants. Thromb Haemost. 2015;114(5):885-9.
21. Egeberg O. Inherited antithrombin deficiency causing thrombophilia. Thromb.Diath. Haemorrh 1965;13 : 516-530.
22. Griffin JH, Evatt B, Zimmerman TS et al. Deficiency of protein C in congenital thrombotic disease. J Clin Invest 1981;68 : 1370-1373.
23. Schwartz, HP, Fisher M, Hopmeier P et al. Plasma protein S deficiency in familal thrombotic disease. Blood. 1984;64 : 1297-1300.
24. Giri TK, Yamazaki T, Sala N et al. Deficient APC ‑ cofactor activity of protein S Heerlen in degradation of factor Va Leiden: a possible mechanism of synergism between thrombophilic risk factors. Blood. 2000;96 : 523-531.
25. Bertina RM, Koeleman BP, Koster T et al. Mutation in blood coagulation factor V associated with resistance to activated protein C. Nature. 1994;369 : 64-67.
26. Poort SR, Rosendaal FR, Reitsma PH et al. A common genetic variation in the 3’ - untranslated region of the prothrombin gene is associated with elevated plasma prothrombin levels and an increase in venous thrombosis. Blood. 1996;88 : 3698-3703.
27. Manderstedt E, Lind‑Halldén C, Halldén C et al. Classic thrombophilias and thrombotic risk among middle‑aged and older adults: a population‑based cohort study. J Am Heart Assoc. 2022;11(4): e023018. DOI: 10.1161/JAHA.121.023018.
28. Manolio TA:Genomewide association studies and assessment of the risk of disease. N Engl J Med. 2010;363 : 166-76.
29. Bezemer ID, Bare LA, Doggen CJ et al. Gene variants associated with deep vein thrombosis. JAMA 2008; 299 : 1306-1314.
30. Trégouët DA, Heath S, Saut N et al. Common susceptibility alleles are unlikely to contribute as strongly as the FV and ABO loci to VTE risk: results from a GWAS approach. Blood 2009;113(21):5298-5303.
31. Tang W, Teichert M, Chasman DI et al. A genome‑wide association study for venous thromboembolism: the extended cohorts for heart and aging research in genomic epidemiology (CHARGE) consortium. Genet Epidemiol. 2013;37(5):512-521.
32. Lindström S, Wang L, Smith EN et al. Genomic and transcriptomic association studies identify 16 novel susceptibility loci for venous thromboembolism. Blood. 2019;134 (19):1645-1657.
33. Klarin D, Busenkell E, Judy R et al. Genome‑wide association analysis of venous thromboembolism identifies new risk loci and genetic overlap with arterial vascular disease. Nat Genet. 2019;51(11):1574-1579.
34. Zöller B, Svensson PJ, Dahlbäck B et al. Genetic risk factors for venous thromboembolism. Expert Rev Hematol. 2020;13(9):971-981.
35. Vrtel P, Slavik L, Vodicka R et al. Detection of unknown and rare pathogenic variants in antithrombin, protein C and protein S deficiency using high‑throughput targeted sequencing. Diagnostics (Basel) 2022;12(5):1060. DOI: 10.3390 /diagnostics12051060.
36. de Haan HG, Bezemer ID, Doggen CJ et al. Multiple SNP testing improves risk prediction of first venous thrombosis. Blood. 2012;120(3):656-663.
37. van Hylckama Vlieg A, Flinterman LE, Bare LA et al. Genetic variations associated with recurrent venous thrombosis. Circ Cardiovasc Genet. 2014;7(6):806-13.
38. Kolin DA, Kulm S, Elemento O. Prediction of primary venous thromboembolism based on clinical and genetic factors within the U.K. Biobank. Sci Rep. 2021;11(1):21340. Erratum in: Sci Rep. 2021;11(1):23364.
39. Clifton L, Collister JA, Liu X et al. Assessing agreement between different polygenic risk scores in the UK Biobank. Sci Rep. 2022;12(1):12812.
40. Choi SW, Mak TS, O‚Reilly PF. Tutorial: a guide to performing polygenic risk score analyses. Nat Protoc. 2020;15(9):2759-2772.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2022 Číslo 8- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Hlavní téma – Hematologie
- Dnešní pohled na dědičné trombofilie
- Venózní tromboembolismus u antifosfolipidového syndromu
- Vybrané závažné „hematologické“ syndromy u dospělých pacientů v intenzivní péči
- Vývoj léčby žilní trombózy od pijavic k mechanické trombektomii
- Tradiční a nové biomarkery kongesce u srdečního selhání
- Alergenová imunoterapie v léčbě alergického eozinofilního astmatu
- Plicní střádání
- Porucha kognitivních funkcí a hrozba pandemie demence aneb cesta hypertoniků k nesoběstačnosti
- Antitrombotická léčba a digestivní endoskopie
- Jak dobře jsme léčili hypertenzi v posledních 25 letech?
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Vybrané závažné „hematologické“ syndromy u dospělých pacientů v intenzivní péči
- Dnešní pohled na dědičné trombofilie
- Alergenová imunoterapie v léčbě alergického eozinofilního astmatu
- Antitrombotická léčba a digestivní endoskopie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



