Rychle progredující glomerulonefritidy (srpkovité glomerulonefritidy)
Rapidly progressive glomerulonephritides (crescentic glomerulonephritides)
Rapidly progressive glomerulonephritides (RPGN) are the most severe form of the nephritic syndromes. In this case, glomerular injury is so acute that irreversible renal failure develops over the course of a few days to weeks. RPGN usually presents as proteinuria < 3g/ day, hematuria with dysmorphic red blood cells and/ or red cell casts, with or without signs of systemic vasculitis. A specific finding upon kidney biopsy is a crescent formation in more than 70% of glomeruli. The most common diseases presenting as RPGN are ANCA‑associated vasculitides, Goodpasture’s disease (anti‑renal nephritis), and the much less common immunocomplex glomerulonephritides. Treatment includes glucocorticoids, cyclophosphamide and novel therapies including targeted treatment (rituximab), sometimes in combination with plasma exchange.
Keywords:
rapidly progressive glomerulonephriti – pulmorenal syndrome – crescents – renal failure – cyclophosphamide – plasma exchange
:
O. Zakiyanov 1,2; J. Vachek 1,3; V. Tesař 1
:
Klinika nefrologie VFN a 1. LF UK v Praze
1; Ústav lékařské biochemie a laboratorní diagnostiky VFN a 1. LF UK v Praze
2; Farmakologický ústav 1. LF UK v Praze
3
:
Kardiol Rev Int Med 2014, 16(1): 62-66
:
Internal Medicine
Rychle progredující glomerulonefritidy (RPGN) jsou nejzávažnější formou nefritického syndromu. Bez terapie dochází k ireverzibilní ztrátě funkce ledvin v řádu dnů až týdnů. RPGN se obvykle manifestuje proteinurií pod 3 g/ d, hematurií s dysmorfními erytrocyty a často erytrocytárními válci. RPGN se může vyskytovat samostatně nebo jako součást systémového onemocnění. Specifickým nálezem v renální biopsii je postižení více než 70 % glomerulů srpky. Nejčastějšími stavy projevujícími se jako RPGN jsou ANCA ‑ asociované vaskulitidy, antirenální nefritida, méně často se vyskytují imunokomplexové glomerulonefritidy. Základem terapie jsou glukokortikoidy, cyklofosfamid a novější imunosupresiva, nejnověji i biologická léčba (rituximab), někdy v kombinaci s plazmaferézou.
Klíčová slova:
rychle progredující glomerulonefritidy – pulmorenální syndrom – srpky – renální selhání – cyklofosfamid – plazmaferéza
Úvod
Pojem rychle progredující glomerulonefritidy (RPGN) je klinickým označením pro heterogenní skupinu proliferativních glomerulonefritid, které jsou charakterizovány postižením většiny glomerulů (více než 70 %) srpky a zpravidla rychlou progresí během několika dnů (maximálně týdnů) do terminálního selhání ledvin. Tento histologický nález se vyskytuje u 2 – 5 % pacientů, kteří se podrobili renální biopsii.
V roce 1982 Davies et al jako první pozorovali přítomnost autoprotilátek proti cytoplazmě neutrofilů (ANCA) u osmi pacientů s pauciimunní rychle progredující glomerulonefritidou a systémovou vaskulitidou [1]. V roce 1984 Hall et al učinili stejné zjištění u pacientů s vaskulitidou malých tepen [2]. Pro RPGN je příznačná přítomnost srpků (crescents). Synonymem pro RPGN je označení srpkovité glomerulonefritidy.
Srpky mohou vznikat při každém závažnějším poškození glomerulární kapilární stěny, které umožňuje průnik proteinů (fibrinogenu) a buněk (monocytů) do Bowmanova prostoru. Mohou se tedy s různou frekvencí objevovat u většiny chronických glomerulopatií. Časné srpky jsou epitelové, pak fibrotizují. Při jejich vzniku se uplatňuje proliferace epitelových buněk, průnik monocytů (makrofágů) a aktivace koagulace – přeměna fibrinogenu na fibrin. Produkce kolagenu je velmi rychlá a srpky se pak mění v obliterační, tím dochází k zániku glomerulů. V bioptickém vzorku pozorujeme proliferaci, fokální nekrózy a jizvení glomerulů – jde o obraz fokálně segmentální nekrózy. V principu je zřejmě na začátku glomerulární trombóza, která ale není téměř nikdy v biopsii zachycena. Následuje vznik nekrózy, kterou také zachytíme málokdy, dalším stadiem je vznik epitelového srpku s postupnou fibrotizací.
Současně je přítomna v různé míře intersticiální fibrotizace, v jejíž patogenezi se uplatňují neutrofily, T lymfocyty a monocyty. Postupně se rozvíjí difuzní intersticiální fibróza a atrofie [3].
Klasifikace RPGN je založena na imunofluorescenčním vyšetření renální tkáně (získané biopsií) a sérologickém vyšetření. RPGN rozdělujeme na tři typy (tab.1): 1. RPGN s protilátkami proti bazální membráně (GBM) glomerulů (anti‑GBM nefritida, antirenální nefritida) (10 % všech RPGN), 2. heterogenní skupina glomerulonefritid s granulárními depozity imunoglobulinů (imunokomplexový typ), kde vznik srpků komplikuje průběh primární endokapilární proliferativní glomerulonefritidy (asi 10 – 20 % všech RPGN), 3. renální mikroskopická vaskulitida s negativní nebo chudou (pauciimunní) imunofluorescencí a protilátkami proti cytoplazmě neutrofilních leukocytů (ANCA) – ANCA asociované (70 – 80 % všech RPGN) [4,5].
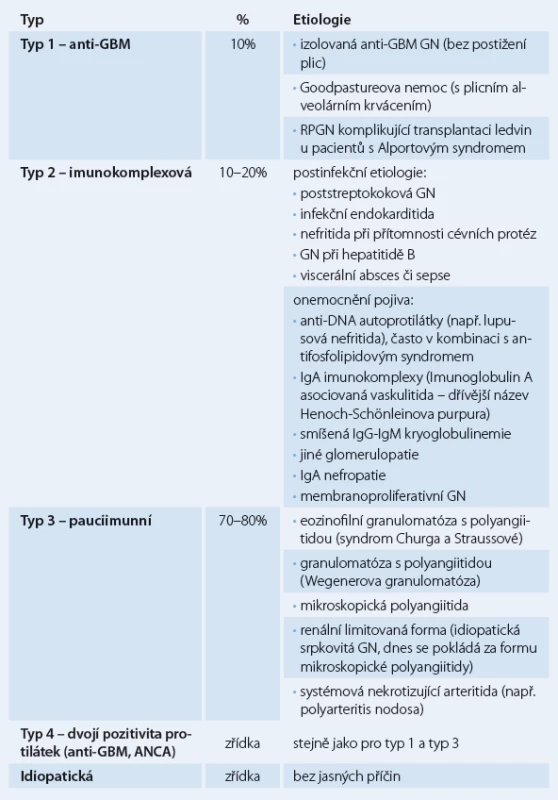
RPGN 1. typu s protilátkami proti bazální membráně může vzniknout v časové souvislosti s respirační expozicí tabákovému kouři, po virové infekci horních cest dýchacích nebo následkem jiných nox, které poškozují kolagen alveolů a spouštějí tvorbu protilátek proti kolagenu. Protilátky proti kolagenu typu IV zkříženě reagují s bazální membránou (protilátky reagují proti glomerulární a alveolární bazální membráně, protože většina jiných bazálních membrán neobsahuje alfa 3 řetězec kolagenu IV), dále fixují komplement a spouštějí buňkami zprostředkovanou zánětlivou odpověď v ledvinách a také obvykle v plicích. Pojmenování Goodpastureova nemoc je kombinací antirenální glomerulonefritidy a alveolárního krvácení při pozitivitě anti‑GBM protilátek. Glomerulonefritida bez alveolárního krvácení se nazývá anti‑GBM glomerulonefritida. Tito pacienti však mohou být ohroženi později vzniklým masivním alveolárním krvácením, i proto je nutná následná imunosupresivní terapie. Imunofluorescenční vyšetření renálních tkání ukazuje lineární umístění IgG depozit [6].
RPGN 2. typu (imunokomplexová glomerulonefritida) může komplikovat četné infekční choroby, choroby pojiva a také průběh primárních glomerulonefritid. Imunofluorescenčně prokážeme nespecifická granulární depozita [7,8].
RPGN 3. typu (pauciimunní glomerulonefritida) je charakteristická nepřítomností imunokomplexů (nebo jen jejich slabou pozitivitou) či nepřítomností depozit komplementu při imunofluorescenci. Více než 90 % pacientů má zvýšený titr ANCA protilátek (proti proteináze ‑ 3 nebo myeloperoxidáze) a známky systémové vaskulitidy [9].
RPGN 4. typu mají příznaky jak RPGN 1. typu, tak i 3. typu, tj. současné pozitivní anti‑GBM a ANCA protilátky. Jsou vzácné.
Idiopatické RPGN jsou také vzácné. Označujeme tak imunokomplexové glomerulonefritidy podobné RPGN 2. typu, kde však není zřejmá infekční příčina, onemocnění pojiva nebo onemocnění glomerulů. Označujeme tak i pauciimunní glomerulonefritidy charakteru RPGN 3. typu, kde však nejsou prokazatelné ANCA protilátky.
Na tomto místě je třeba připomenout novou klasifikaci vaskulitid podle konsenzu konference v Chapel Hill z roku 2012, která nahradila dosud užívanou klasifikaci z roku 1994. Základní princip dělení na vaskulitidy malých, středních a velkých cév zůstal i v nové klasifikaci zachován (tab. 2). Hlavní změny v názvosloví se týkají především dělení vaskulitid malých cév, které byly nově rozděleny na vaskulitidy ANCA ‑ asociované a vaskulitidy imunokomplexové. Kde to bylo možné, bylo snahou nahradit eponymická pojmenování vaskulitid systematickým názvoslovím (např. Wegenerova granulomatóza se nově nazývá granulomatóza s polyangiitidou, syndrom Churga ‑ Straussové je eozinofilní granulomatóza s polyangitidou a Henoch ‑ Schönleinova purpura je nyní IgA vaskulitida) [10,11].
![Dělení vaskulitid podle konsensu konference v Chapel Hill z roku 2012 [10].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/f4a1f7e455e9b85bb58fc54dbf643191.png)
Klinický obraz
Klinický obraz je nespecifický – slabost, vyčerpání, váhový úbytek, febrilie, nauzea, zvracení, anorexie, artralgie a bolesti břicha. Část nemocných může mít symptomy podobné postreptokokové glomerulonefritidě projevující se makroskopickou hematurií. Právě mikroskopické hematurii je třeba věnovat velkou pozornost. U pacienta s nejasným plicním nálezem by přítomnost mikrohematurie měla vést k podezření na AAV nebo Goodpastureovu nemoc. Kolem 50 % pacientů má otoky a chřipkové příznaky. Během čtyř týdnů od počátku nemoci se většinou rozvíjí oligurie. Nefrotický syndrom je přítomen u 10 – 30 % pacientů. Hypertenze není obvyklá a většinou není závažná. U pacientů s pulmorenálním syndromem (při pozitivitě anti GBM nebo ANCA) zjišťujeme dušnost, kašel a přítomnost plicního krvácení, které se může projevit hemoptýzou nebo se při RTG vyšetření prokáží difuzní alveolární infiltráty charakteru mléčného skla (ground glass).
Diagnostická kritéria
- progresivní renální selhávání během týdnů až měsíců (jde o přirozený průběh onemocnění, nelze užít ke stanovení diagnózy – již při každém nejasném zvýšení kreatininu je nutné pomýšlet na možnost RPGN a pátrat po dalších kritériích),
- nefritický močový sediment (aktivní močový sediment – mikroskopická hematurie, proteinurie, válce),
- sérologické vyšetření,
- renální biopsie.
Suspekce na diagnózu RPGN by měla vyvstat u pacientů s akutním poškozením ledvin a dysmorfními erytrocyty v močovém sedimentu, případně s erytrocytárními válci. Je nutné vyšetřit sérový kreatinin, krevní obraz, moč chemicky a sediment, doplnit sérologické testy. Podezření na RPGN je absolutní indikací k biopsii ledviny. Sérologické vyšetření a renální biopsie potvrdí diagnózu.
Sérový kreatinin je prakticky vždy zvýšen, hematurie je přítomna vždy a erytrocytární válce jsou častým nálezem. Močový sediment s mnoha elementy – leukocyty, dysmorfními erytrocyty a granulárními a voskovými válci – je častý. Dalším nálezem je proteinurie pod 3 g/ den.
V červeném krevním obraze je anemie a leukocytóza. Sérologické testování zahrnuje vyšetření anti‑GBM protilátek, antistreptolysin O protilátek (ASLO), anti‑DNA protilátek, kryoglobulinů a ANCA protilátek (anti‑MPO, anti‑PR3). Vyšetření hladin složek komplementu (C3, C4) může také pomoci u imunokomplexové RPGN, u níž bývá hypokomplementemie.
Renální biopsii je třeba provést co nejdříve u všech pacientů s močovým nálezem či zhoršenou renální funkcí, pokud není diagnóza zcela jasná i bez biopsie (u systémového postižení u AAV). Hlavním nálezem u všech typů RPGN je fokální epitelová proliferace, velké množství neutrofilů, což je základem pro tvorbu srpků, které nakonec vyplní Bowmanova pouzdra ve > 70 % glomerulů. Glomerulus se obvykle jeví jako hypocelulární a dále kolabuje. Nekrózy uvnitř kliček a tvorba srpků jsou ve stanovení diagnózy hlavním vodítkem. Při všech těchto nálezech je nutné vzít v úvahu možnost vaskulitidy.
Imunofluorescenční vyšetření se liší podle typu RPGN
Při anti‑GBM nemoci (typ 1) je hlavním nálezem lineární pozitivní imunofluorescence IgG podél bazální membrány, často je doprovázena lineární a někdy i granulární depozicí C3. U imunokomplexové RPGN (typ 2) nacházíme při imunofluorescenci difuzní, nerovnoměrné IgG a C3 depozita v mezangiu. U pauciimunní RPGN (typ 3) je velmi chudá imunofluorescence bez přítomnosti depozit. Nález fibrinu uvnitř srpků je častý. U dvojité pozitivity RPGN (typ 4) je lineární pozitivita GBM (podobná typu 1). U idiopatické RPGN mají někteří pacienti imunní komplexy (podobné typu 2), u jiných bývá chudá negativní imunofluorescence a absence depozit (podobně jako u typu 3).
Prognóza
Spontánní remise RPGN je vzácná a 80 – 90 % pacientů progreduje bez léčby do stadia konečného selhání ledvin obvykle do šesti týdnů, nejpozději do šesti měsíců od propuknutí nemoci. Prognóza se zlepšuje při časné terapii [12,13,15]. Prognóza RPGN závisí na základním onemocnění, které vedlo k postižení ledvin. U části pacientů s pauciimunní RPGN se sice vyvine remise, ale nedojde u nich ke zlepšení renální funkce. Kolem 40 % non‑respondérů potřebuje dialyzační léčbu a úmrtnost je u nich kolem 33 % během čtyř let od stanovení diagnózy. Naopak z respondérů potřebuje dialyzační léčbu méně než 20 % pacientů, úmrtnost je kolem 3 % [17]. Pacienti s dvojitou pozitivitou mají prognózu mírně lepší než pacienti s anti‑GBM nemocí, ale závažnější než pacienti s pauciimunní RPGN.
V případě AAV je prognóza quoad vitam značně variabilní, renální prognóza závisí na histologickém nálezu. U anti‑GBM nefritidy je renální prognóza při přítomnosti pokročilých změn špatná, hlavně z důvodu postižení glomerulů srpky v jedné době, šance na zlepšení renálních změn je malá. Anti‑GBM glomerulonefritida však prakticky nerelabuje.
U imunokomplexových glomerulonefritid závisí prognóza na histologickém nálezu, převažují‑li sklerotické změny, je z renálního hlediska špatná [12 – 14]. Pacienti, u kterých dojde k restituci renálních funkcí po RPGN, mají reziduální histologické změny hlavně v glomerulech, přítomna je hypercelularita s menším zastoupením sklerotizace kapilárních kliček a epitelií a menší fibróza intersticia [18].
S relativně příznivou renální prognózou jsou spojeny:
- anti‑GBM glomerulonefritida, pokud je léčba zahájena včas, tj. před objevením se oligurie a zvýšením hladiny sérového kreatininu < 600 µmol/ l [16],
- systémový lupus erythematosus,
- granulomatóza s polyangitidou.
Pro spíše nepříznivou prognózu svědčí:
- věk > 60 let,
- oligurické renální selhání,vyšší hladina sérového kreatininu,
- obliterující srpky ve > 75 % glomerulů,
- absence odpovědi na léčbu u pacientů s pauciimunní RPGN.
Léčba
Vzhledem k povaze onemocnění představují základní léčbu imunosupresiva, někdy v kombinaci s plazmaferézou. Režimy a výběr imunosupresiv záleží na základním onemocnění. Symptomatická léčba zahrnuje náhradu funkce ledvin. V dnešní době, kdy je bez problémů dostupná dialyzační léčba, pacienti umírají většinou na infekci nebo z kardiálních příčin.
Léčba v indukční fázi zahrnuje:
- kortikosteroidy,
- cyklofosfamid, alternativně u některých pacientů mykofenolát ‑ mofetil,
- plazmaferézy u pacientů s pulmorenálním syndromem, zvláště při plicním krvácení a selhání ledvin,
- u některých pacientů je indikována biologická léčba (rituximab [19,20] je dnes rovnocennou léčbou první volby, zcela výjimečně je indikován alemtuzumab, který není pro tuto diagnózu registrován, užíván je jen na specializovaných pracovištích),
- výběr terapie záleží na konkrétním průběhu onemocnění (tíže postižení, věk, renální a jaterní funkce a další faktory). Je vhodné, aby pacienti s RPGN byli léčeni v centrech s odpovídajícími zkušenostmi a možností plazmaferéz, biologické léčby, řešení komplikací, účasti ve studiích atd.
K udržovací terapii se užívají:
- kortikosteroidy se snahou o podávání co nejnižších účinných dávek,
- azathioprin, alternativně mykofenolát ‑ mofetil,
- metotrexát,
- deoxyspergualin (v rámci salvage therapy na specializovaných pracovištích),
- u vybraných pacientů biologická léčba (rituximab),
- podpůrná a doplňující medikace (vitamin D, vápník, cotrimoxazol k prevenci pneumocystové pneumonie, antimykotika, antivirotika aj.).
Léčba závisí na konkrétním typu onemocnění. Je třeba ji zahájit neodkladně, nejlépe při hladině sérového kreatininu < 450 µmol/ l, dokud podle nálezu nejsou postiženy všechny glomeruly, resp. dokud nejsou přítomny organizované srpky, fibróza intersticia a atrofické tubuly. Léčba je méně úspěšná, je‑li onemocnění pokročilé. U starších pacientů je spojena s častějšími komplikacemi, např. ve smyslu častějších infekcí.
Základní schéma léčby představuje kombinace kortikosteroidů a cyklofosfamidu. U imunokomplexových a pauciimunních RPGN podáváme někdy vstupně steroidy v dávce 0,25 – 0,5 g intravenózně, jednou denně celkem 3 – 5 dnů a dále nasazujeme perorální prednison v dávce 1 mg/ kg/den. Pulzní léčba intravenózním cyklofosfamidem v rámci indukční léčby se zahajuje dávkou 15 mg/ kg, dávkování je nutné event. upravit s ohledem na věk a renální funkci, obvyklé je podání šesti pulsů během tří měsíců. Dnes již málo užívanou alternativou je perorální cyklofosfamid v dávce 1,5 – 2 mg/ den. Pulzní léčba má výhodu v podobě nižší kumulativní dávky a menšího množství nežádoucích účinků včetně leukopenie a infekce než perorální léčba při srovnatelné účinnosti. Prednison, cyklofosfamid a plazmaferézy jsou v léčbě anti‑GBM GN užívány se snahou minimalizovat tvorbu protilátek, podávají se i při nevratném postižení ledvin s cílem minimalizovat orgánové postižení vlivem autoprotilátek – především plic. Při této léčbě obvykle dochází ke zlepšení (znovuobnovení nezávislé) renální funkce [21].
U anti‑GBM nefritidy se doporučuje plazmaferéza v režimu výměny 3 – 4 litrů plazmy po dobu 14 dnů. Plazmaferézy lze také doporučit pro léčbu imunokomplexové RPGN a ANCA asociované RPGN s plicním krvácením nebo závažnou renální dysfunkcí (sérový kreatinin > 500 µmol/ l nebo závislost na dialýze). Plazmaferézy jsou účinné z důvodu rychlého odstranění volných protilátek, intaktních imunokomplexů a mediátorů zánětu (např. fibrinogen, komplement) [14].
Transplantace ledviny je možná u všech typů RPGN. Riziko relapsu AAV i anti‑GBM ve štěpu je nízké, problémem může být perzistující extrarenální aktivita nebo extrarenální relaps AAV. Riziko relapsu se zmenšuje v čase. Při anti‑GBM nefritidě by titry anti‑GBM protilátek měly být negativní přinejmenším 12 týdnů před transplantací. U pacientů s pauciimunní RPGN je vyžadována remise alespoň šest měsíců před transplantací, titr ANCA protilátek by měl být co nejnižší.
Doručeno do redakce: 22. 1. 2014
Přijato po recenzi 3. 2. 2014
MU Dr. PhDr. Oskar Zakiyanov
www.vfn.cz
zoskar@post.cz
Sources
1. Davies DJ, Moran JE, Niall JF et al. Segmental necrotising glomerulonephritis with antineutrophil antibody: possible arbovirus aetiology? Br Med J (Clin Res Ed) 1982; 285 : 606.
2. Hall JB, Wadham BM, Wood CJ et al. Vasculitis and glomerulonephritis: a subgroup with an antineutrophil cytoplasmic antibody. Aust N Z J Med 1984; 14 : 277 – 278.
3. Tesař V, Shück O et al. Klinická nefrologie: Grada Avicenum: Praha 2006.
4. Little MA, Pusey CD. Rapidly progressive glomerulonephritis: current and evolving treatment strategies. J Nephrol 2004; Suppl 8: S10 – S19.
5. Jennette JC. Rapidly progressive crescentic glomerulonephritis. Kidney Int 2003; 63 : 1164 – 1177.
6. Hellmark T, Segelmark M. Diagnosis and classification of Goodpasture's disease (anti‑GBM). J Autoimmun 2014. doi: 10.1016/ j.jaut.2014.01.024.
7. Alpers CE, Smith KD. Cryoglobulinemia and renal disease. Curr Opin Nephrol Hypertens 2008; 17 : 243 – 249. doi: 10.1097/ MNH.0b013e3282f8afe2.
8. D'Cruz D. Renal manifestations of the antiphospholipid syndrome. Curr Rheumatol Rep 2009; 11 : 52 – 60.
9. Berden A, Göçeroglu A, Jayne D et al. Diagnosis and management of ANCA associated vasculitis. BMJ 2012; 344: e26. doi: 10.1136/ bmj.e26.
10. Jennette JC, Falk RJ, Bacon PA et al. 2012 revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheum 2013; 65 : 1 – 11. doi: 10.1002/ art.37715.
11. Ciferská H, Vachek J. Ledvinné manifestace u revmatických chorob. Revmatologie 2013; 5 : 63 – 69.
12. Little MA, Nazar L, Farrington K. Outcome in glomerulonephritis due to systemic small vessel vasculitis: effect of functional status and non‑vasculitic co ‑ morbidity. Nephrol Dial Transplant 2004; 19 : 356 – 364.
13. Eisenberger U, Fakhouri F, Vanhille P et al. ANCA ‑ negative pauci ‑ immune renal vasculitis: histology and outcome. Nephrol Dial Transplant 2005; 20 : 1392 – 1399.
14. Levy JB, Turner AN, Rees AJ et al. Long‑term outcome of anti‑glomerular basement membrane antibody disease treated with plasma exchange and immunosuppression. Ann Intern Med 2001; 134 : 1033 – 1042.
15. Couser WG. Basic and translational concepts of immune ‑ mediated glomerular diseases. J Am Soc Nephrol 2012; 23 : 381 – 399. doi: 10.1681/ ASN. 2011030304.
16. Tang W, McDonald SP, Hawley CM et al. Anti‑glomerular basement membrane antibody disease is an uncommon cause of end‑stage renal disease. Kidney Int 2013; 83 : 503 – 510. doi: 10.1038/ ki.2012.375.
17. Tang W, Bose B, McDonald SP et al. The outcomes of patients with ESRD and ANCA‑associated vasculitis in Australia and New Zealand. Clin J Am Soc Nephrol 2013; 8 : 773 – 780. doi: 10.2215/ CJN.08770812.
18. Chen YX, Chen N. Pathogenesis of rapidly progressive glomerulonephritis: what do we learn? Contrib Nephrol 2013; 181 : 207 – 215. doi: 10.1159/ 000348633.
19. Jones RB, Tervaert JW, Hauser T et al. Rituximab versus cyclophosphamide in ANCA‑associated renal vasculitis. N Engl J Med 2010; 363 : 211 – 220. doi: 10.1056/ NEJMoa0909169.
20. Stone JH, Merkel PA, Spiera R et al. Rituximab versus cyclophosphamide for ANCA‑associated vasculitis. N Engl J Med 2010; 363 : 221 – 232. doi: 10.1056/ NEJMoa0909905.
21. Jindal KK. Management of idiopathic crescentic and diffuse proliferative glomerulonephritis: evidence‑based recommendations. Kidney Int Suppl 1999; 70: S33 – S40.
Labels
Paediatric cardiology Internal medicine Cardiac surgery CardiologyArticle was published in
Cardiology Review

2014 Issue 1
-
All articles in this issue
- Beneficial use of transcranial Doppler ultrasound in invasive treatment of carotid artery disease
- Permanent cardiac pacing in terms of the new European recommendations from 2013
- Cardiohepatic syndrome in patients with chronic heart failure
- Prognostic significance of liver enzyme elevations in acute coronary syndromes
- Development of kidney function parameters in patients with advanced heart failure treated with levosimendan – retrospective analysis
- Deep venous thrombosis and pulmonary embolism associated with hormonal contraceptives use
- More arguments for conservative treatment of coronary artery disease in chronic form
- Complex nursing care documentation for short-term hospitalization of patients indicated for permanent pacemaker implantation
- Chronic kidney disease – a new classification and therapy
- Drug therapy in chronic kidney disease
- Acute kidney injury
- Rapidly progressive glomerulonephritides (crescentic glomerulonephritides)
- Selected renal diseases in pregnancy
- Urinary tract infections
- Cardiology Review
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Acute kidney injury
- Selected renal diseases in pregnancy
- Rapidly progressive glomerulonephritides (crescentic glomerulonephritides)
- Drug therapy in chronic kidney disease

