Nežádoucí účinky biologické léčby v revmatologii
Adverse effects of biological therapy in rheumatology
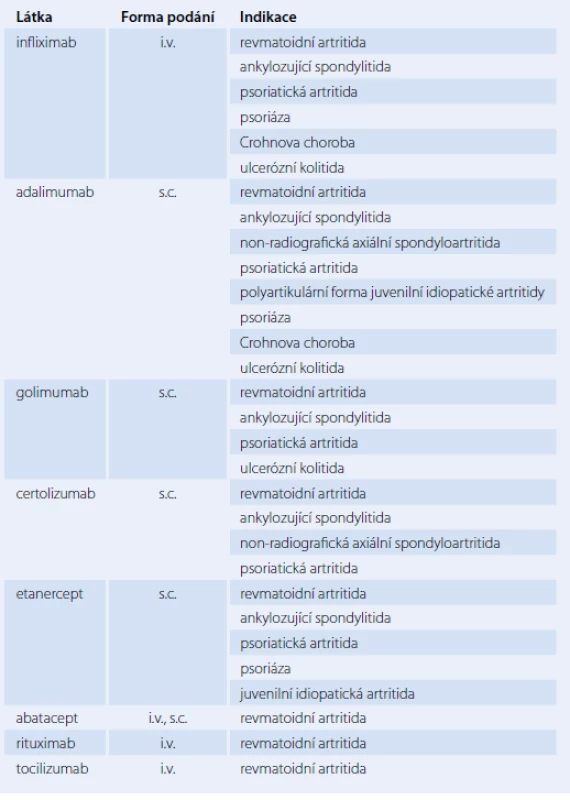
Biological therapy represents the most efficient approach in the management of inflammatory rheumatic diseases. It has significantly improved the prognosis of rheumatic patients as welland their quality of their life. TNFα inhibitors (infliximab, adalimumab, golimumab, certolizumab, etanercept), abatacept, rituximab and tocilizumab are currently registered for the treatment of rheumatoid arthritis in the Czech Republic. Most of the TNFα inhibitors are also registered also for spondyloarthritides (ankylosing spondylitis, psoriatic arthritis, non-radiographic spondyloarthritis). The Ssignificant anti-inflammatory effect on the immune system reactions network may also induce various undesirable effects, including serious adverse events. The benefit of biological treatment is significantly higher than the risk of potential adverse events,; nevertheless, it is very important to know their spectrum (infections; pulmonary, cardiovascular, neurological, haematological diseases etc.), diagnose them actively, and treat or prevent them. Safety monitoring of biological treatment follows the guidelines of professional societies.
Key words:
biological treatment – adverse effects – infliximab – adalimumab – golimumab – certolizumab – etanercept – abatacept – rituximab – tocilizumab – inflammatory rheumatic diseases
:
M. Olejárová
:
Revmatologický ústav a Revmatologická klinika 1. LF UK, Praha
:
Kardiol Rev Int Med 2014, 16(5): 426-430
:
Internal Medicine
Biologická léčba představuje nejúčinnější způsob léčby zánětlivých revmatických onemocnění. Významně zlepšila prognózu nemocných se zánětlivými revmatickými chorobami, stejně tak jako kvalitu jejich života. Pro léčbu revmatoidní artritidy jsou v současné době v České republice registrovány inhibitory TNFα (infliximab, adalimumab, golimumab, certolizumab, etanercept) a dále abatacept, rituximab a tocilizumab. Většina inhibitorů TNFα je též registrována pro spondyloartritidy (ankylozující spondylitida, psoriatická artritida, neradiografická spondyloartritida). Výrazný protizánětlivý zásah do sítě reakcí imunitního systému může vyvolat i různé nežádoucí účinky, včetně závažných. Přínos biologické terapie vysoce převyšuje riziko případných nežádoucích účinků, nicméně je třeba znát jejich spektrum (infekce, nemoci plicní, kardiovaskulární, neurologické, hematologické aj.), aktivně je vyhledávat a léčit, případně jim předcházet. Při sledování bezpečnosti biologické léčby jednotlivými léky se řídíme doporučenými postupy odborných společností.
Klíčová slova:
biologická léčba – nežádoucí účinky – infliximab – adalimumab – golimumab – certolizumab – etanercept – abatacept – rituximab – tocilizumab – zánětlivá revmatická onemocnění
Biologickou léčbu lze bezesporu označit za přelomový objev v terapii zánětlivých revmatických onemocnění. Její podstatou je eliminace různých aktivních látek a blokáda jejich působení biologickou cestou, tedy pomocí monoklonální protilátky, receptoru pro danou molekulu a jejich dalších modifikací. Monoklonální protilátka namířená např. proti cytokinu se na něj naváže a inaktivuje jej. Druhý typ biologické léčby využívá synteticky vyrobeného receptoru daného cytokinu navázaného na fragment imunoglobulinu, který se na příslušný cytokin naváže a inhibuje jeho další působení.
Hlavní úlohu při rozvoji revmatoidní artritidy, ale také ankylozující spondylitidy, psoriatické artritidy aj. hraje tumor nekrotizující faktor α (TNFα), cytokin s velmi širokým spektrem prozánětlivých účinků [1]. Byl detekován v synoviální tkáni u revmatoidní artritidy, v sakroiliakálních skloubeních u spondyloartritid, ale také v psoriatických placích či střevní sliznici u idiopatických střevních zánětů [1]. Jeho blokáda vede velmi rychle k poklesu klinické zánětlivé aktivity, k poklesu reaktantů akutní fáze, dlouhodobá léčba navíc zpomaluje progresi revmatoidní artritidy i některých dalších revmatických onemocnění. Proto jsou inhibitory TNFα v současné době nejpočetnější a nejrozšířenější skupinou biologik v revmatologii.
V patogenezi revmatoidní artritidy se uplatňuje i řada jiných cytokinů a buněk; další prostředky biologické léčby RA jsou namířeny např. proti interleukinu 6, CD20+ buňkám, kostimulačním molekulám aj.
Biologický zásah do cytokinové sítě a kaskády imunologických reakcí však může vyvolat mimo žádoucího protizánětlivého působení také další reakce, jež mohou vést k různým nežádoucím účinkům. Jejich výskyt je relativně nízký a jen mírně převyšuje riziko nežádoucích účinků spojených s léčbou syntetickými chorobu modifikujícími léky RA (metotrexát apod.) a dá se jim v některých případech účinně předcházet. Nicméně řada vedlejších účinků může mít vážný dopad na zdraví pacientů, proto je třeba, aby lékař, který biologickou léčbu podává, byl s jejími riziky dobře obeznámen stejně tak jako s možnostmi prevence a doporučenými postupy pro sledování bezpečnosti léčby. Rámcově by měli být o možných nežádoucích účincích biologik seznámeni i lékaři dalších specializací, kteří o revmatiky pečují nebo jejichž oborů se nežádoucí účinky týkají (interna, neurologie, hematologie, pneumologie, infektologie aj.).
Nežádoucí účinky anti‑TNF léčby
Nežádoucí účinky léčby inhibitory TNFα jsou prostudovány nejlépe. Na základě rozsáhlých klinických studií, klinických zkušeností a dostupnosti dat z národních registrů je bezpečnostní profil inhibitorů TNFα dobře charakterizován [2 – 6]. Výskyt nežádoucích účinků po jednotlivých anti‑TNF preparátech je obdobný a předpokládá se, že většina nežádoucích účinků souvisí s blokádou TNFα, a představuje tedy společný účinek celé třídy anti‑TNF léčiv, ačkoli jejich frekvence může být u různých preparátů odlišná.
Krátkodobé nežádoucí účinky zahrnují různé postinfuzní reakce a kožní reakce v místě aplikace, bývají zpravidla mírné a většinou nevedou k přerušení léčby. Oproti tomu dlouhodobá léčba inhibitory TNFα může být provázena řadou závažných nežádoucích účinků, jež mohou zhoršit zdravotní stav pacienta, vzácně mohou mít i letální průběh.
Jedná se zejména o zvýšené riziko infekcí včetně závažných bakteriálních, virových a mykotických infektů a tuberkulózy. Vzácněji se vyskytují příhody neurologické, hematologické, kardiovaskulární a plicní, diskutuje se též o zvýšeném riziku malignit v průběhu terapie. Indukce syntézy autoprotilátek a některé další laboratorní abnormality nebývají klinicky závažné.
Infekce. Vyskytují se při léčbě inhibitory TNFα častěji. Výskyt závažných infekcí je při srovnání s pacienty dlouhodobě léčenými chorobu modifikujícími léky (např. metotrexátem) mírně zvýšen, podle recentní metaanalýzy je riziko 1,1 – 1,8 [7]. Častější jsou v prvním roce léčby [2 – 4]. Mohou se vyskytnout různé závažné bakteriální infekce (kůže, měkkých tkání a kloubů), granulomatózní infekce (listerióza, nokardióza) a infekce oportunní, včetně mykotických či protozoárních [2 – 4]. Popisuje se též herpes zoster a reaktivace chronické hepatitidy B. U hepatitidy C riziko exacerbace pravděpodobně zvýšeno není.
Léčba inhibitory TNFα nesmí být proto podávána pacientům se závažnými infekcemi; v tomto případě je třeba léčbu přerušit a její další podávání zvážit až po kompletním zhojení infekce. Rizikové pacienty je třeba pravidelně kontrolovat.
Tuberkulóza. TNFα se významně podílí na aktivní obraně proti mykobakteriím (tvorba a udržování granulomu), a proto je anti‑TNF terapie prokazatelně spojena s vyšším rizikem tuberkulózy [5 – 8]. Riziko vzniku tuberkulózy je pravděpodobně vyšší u monoklonálních protilátek než u etanerceptu, což je dáno rozdíly ve farmakokinetice jednotlivých inhibitorů TNFα [9]. Svědčí proto i data z registrů, např. podle amerického registru FDA se odhaduje výskyt tuberkulózy na 9/ 100 000 pro etanercept a 24/ 100 000 pro infliximab, přičemž v obecné americké populaci se vyskytuje s frekvencí přibližně 6/ 100 000. Prokazatelné zvýšené riziko tuberkulózy uvádí i metaanalýza EULAR [7].
V souvislosti s terapií inhibitory TNFα se vyskytují převážně mimoplicní manifestace, jež mohou postihovat meningy, pleuru, peritoneum, svaly, páteř a klouby.
Předpokládá se proto, že se ve většině případů jedná o reaktivaci latentní tuberkulózní infekce [8]. K manifestaci tuberkulózy dochází zpravidla v prvních měsících léčby inhibitory TNFα. U všech pacientů podstupujících anti‑TNF léčbu musí být proto proveden screening latentní tuberkulózy (klinické vyšetření, RTG plic, tuberkulinový test, Quantiferon) a v případě pozitivních nálezů je třeba pneumologické vyšetření, event. antituberkulózní léčba. Avšak ani pečlivě provedený screening nedokáže vzniku, resp. reaktivaci tuberkulózy zabránit úplně, proto je třeba věnovat případným příznakům tuberkulózy při sledování nemocných patřičnou pozornost a aktivně je vyhledávat.
Nádorová onemocnění. Pacienti s revmatoidní artritidou mají obecně zvýšené riziko některých malignit, zejména lymfomů, toto riziko dále zvyšuje souběžná terapie některými imunosupresivy (cyklofosfamid, azatioprin). Z mechanizmu účinku TNFα by riziko zvýšeného výskytu malignit mohlo být teoreticky rovněž zvýšeno. Podle metaanalýzy klinických studií z roku 2006 se u pacientů s RA léčených inhibitory TNFα vyskytují častěji nemelanomové kožní nádory a nádory plic u kuřáků [10]. Nicméně většina prospektivních sledování a dat z registrů nemocných na anti‑TNF toto riziko neprokázala. Nová metaanalýza klinických studií i dat z registrů biologické léčby publikovaná v letošním roce však zvýšené riziko nádorových onemocnění, lymfomů ani nemelanomových kožních nádorů neprokázala, mírně zvýšené však může být riziko maligního melanomu (HR 1,5) [7].
Podstatně vyšší je však riziko malignit u pacientů s Crohnovou chorobou léčených imunosupresivy a inhibitory TNFα, u nichž byla pozorována zvýšená incidence lymfomů, leukemií, melanomů i některých solidních nádorů.
Léčba inhibitory TNFα je proto kontraindikována u nemocných, kteří mají v anamnéze v posledních pěti letech nádorové onemocnění, zejména lymfom, dále je kontraindikována u pacientů léčených cyklofosfamidem nebo azathioprinem, opatrnosti je třeba i u nemocných s delší anamnézou zhoubného nádoru a u kuřáků.
Chronická kardiální insuficience. Vyšší dávky infliximabu (10 mg/ kg) mohou zhoršovat chronickou městnanou srdeční nedostatečnost a zvyšovat mortalitu u těchto nemocných; anti‑TNF léčba se proto nedoporučuje nemocným s kardiálním selháváním s NYHA III ‑ IV a pacientům s ejekční frakcí nižší než 50 %. Nekomplikovaná arteriální hypertenze či stabilizovaná ischemická choroba srdeční kontraindikaci terapie inhibitory TNFα nepředstavují [1].
Autoimunitní syndromy. U nemocných léčených inhibitory TNFα se často objevují autoprotilátky (antinukleární protilátky či anti‑dsDNA protilátky), k vývoji klinicky manifestního systémového lupus erythematodes však zpravidla nedochází. Pokud dojde k rozvoji „lupus‑like“ syndromu, je třeba léčbu ukončit, což samo o sobě vede k ústupu symptomů, specifická léčba obvykle nutná není. Samotná pozitivita protilátek obvykle nepředstavuje v klinické praxi závažnější problém a po ukončení léčby se titr autoprotilátek zpravidla vrací k normálu [1].
Hematologické poruchy (aplastické anémie a pancytopenie) jsou velmi vzácné, léčbu je třeba v těchto případech přerušit.
V průběhu léčby může dojít i ke zvýšení jaterních aminotransferáz, zvláště při současném podávání dalších, potenciálně hepatotoxických látek (např. imunosupresiv).
Neurologická onemocnění. Vzácně byla u nemocných léčených anti‑TNF terapií popsána centrální a periferní demyelinizační onemocnění. Může se jednat o myelitidy, neuritidy optiku či roztroušenou sklerózu. Po vysazení léčby může tato symptomatologie u části nemocných ustoupit. Léčba inhibitory TNF by proto neměla být podávána osobám s anamnézou demyelinizačního onemocnění a neuritidy optiku. Pokud se během léčby objeví neobvyklé neurologické obtíže (parestezie, poruchy vidění, zmatenost, sfinkterové poruchy, poruchy rovnováhy, chůze apod.), je vhodné léčbu přerušit a pacienta odeslat k neurologickému vyšetření k vyloučení event. demyelinizačního onemocnění, včetně MRI mozku a míchy, vyšetření evokovaných potenciálů a likvoru [1].
Plicní postižení. Vzácné případy paradoxní manifestace sarkoidózy byly pozorovány zejména u pacientů se spondyloartritidami léčených etanerceptem. Příčina není jasná, souvisí zřejmě s nedostatečnou inhibicí cytokinové aktivity, která dostačuje pro tvorbu granulomu. Ukončení terapie inhibitory TNFα vede většinou ke zlepšení.
Kožní nežádoucí účinky jsou vzácné, v průběhu terapie inhibitory TNFα se mohou objevit různé psoriáziformní exantémy, paradoxně se popisuje i exacerbace nebo nová manifestace psoriázy, zejména u AS. Je určitý rozdíl mezi oběma typy inhibitorů TNFα – zatímco monoklonální protilátky mohou indukovat novou manifestaci psoriázy, etanercept vede spíše k exacerbaci preexistujícího onemocnění [1].
Crohnova choroba. U etanerceptu byla u pacientů s AS pozorována nová manifestace Crohnovy choroby. Na rozdíl od monoklonálních protilátek (infliximab, adalimumab) není etanercept u Crohnovy choroby účinný a s ohledem na známé odlišnosti ve farmakodynamice ve srovnání s monoklonálními protilátkami lze jeho úlohu při vzniku tohoto onemocnění připustit.
Doporučení pro sledování bezpečnosti léčby inhibitory TNFα
Bezpečnostní opatření při podání biologických léků začínají již před zahájením léčby při řádném respektování kontraindikací terapie anti‑TNF, které se odvíjejí od jejich nežádoucích účinků. Absolutní kontraindikací léčby je přecitlivělost na preparát či jeho části, aktivní i latentní tuberkulóza, závažné infekce, oportunní infekce, středně těžké nebo těžké srdeční selhání (NYHA III/ IV), nádorová onemocnění v anamnéze před méně než pěti lety a přítomnost neurodegenerativního onemocnění [11].
Laboratorní vyšetření je vhodné provést před zahájením léčby anti‑TNF, poté po dvou týdnech, dále pak v měsíčních intervalech a od 3. – 6. měsíce je možné laboratorní kontroly provádět každé tři měsíce. Z laboratorních testů provádíme krevní obraz, včetně diferenciálního rozpočtu leukocytů, jaterní aminotransferázy, kreatinin a močový sediment. Pokud pacient dostává souběžnou terapii metotrexátem či jiným DMARD, řídí se kontroly podle této léčby. Vhodné jsou kontroly v intervalech 8 – 12 týdnů.
Před zahájením léčby inhibitory TNFα se doporučuje provést screening na přítomnost virové hepatitidy A, B a C. U pacientů s prokázanou hepatitidou A, B nebo C je třeba provést dále kvantitativní stanovení virové DNA či RNA [11].
Screening latentní tuberkulózy. Podle mezinárodních doporučení, z nichž vycházejí také doporučení ČRS, je třeba provést tuberkulinový test, test produkce interferonu γ (Quantiferon TB ‑ Gold test), RTG hrudníku a odebrat pečlivou rodinnou a osobní anamnézu z hlediska výskytu TBC a možného kontaktu s touto chorobou. Vždy před zahájením anti‑TNF terapie by měl být konzultován pneumolog, s výjimkou kompletně negativních nálezů. Kontrolní vyšetření pneumologem je vhodné po třech a dvanácti měsících. Obecně je doporučena maximální opatrnost a na možnost TBC je třeba myslet při každé návštěvě nemocného.
Pacienta s latentní tuberkulózou je třeba přeléčit izoniazidem (INH) nebo jinými antituberkulotiky dle doporučení pneumologa [11].
Nežádoucí účinky a rizika léčby dalších biologických léků v revmatologii
Abatacept
Abatacept je inhibitor kostimulace při prezentaci antigenu, jedná se o rekombinantní fúzovaný protein sestávající z extracelulární části lidského CTLA ‑ 4 a Fc části lidského IgG1. Působí tedy zejména v časných fázích rozvoje RA. Aplikuje se formou i.v. infuzí nebo subkutánně.
Jeho bezpečnostní profil je příznivý. Mohou se vyskytnout infuzní reakce, které jsou častější v prvním roce léčby. Výskyt infekcí je při léčbě abataceptem přijatelný a v porovnání s infliximabem je spíše nižší. Nebylo prokázáno zvýšené riziko oportunních infekcí či tuberkulózy, specificky ale bylo u abataceptu popsáno zvýšené riziko infekcí dýchacích cest u nemocných s chronickou obstrukční plicní nemocí. Zvýšený výskyt malignit či závažných hematologických či neurologických účinků u abataceptu popsán nebyl; výskyt některých nádorů byl při srovnání s běžnou populací s RA spíše snížen. Autoimunitní onemocnění nejsou častá; byla zaznamenána manifestace psoriázy, častěji se však jednalo o relaps nežli o indukci psoriázy de novo. Mohou se objevit i různé autoprotilátky bez výraznějších klinických konsekvencí [7,12]
Léčba by neměla být zahájena v případě aktivní infekce. Doporučuje se provést standardní klinické a laboratorní vyšetření, vhodný je i screening tuberkulózy, přestože její riziko zvýšeno není, stejně jako u hepatitid B a C [11].
Rituximab
Rituximab je monoklonální protilátka namířená proti molekule CD20 na B buňkách. Po jeho podání dochází k hluboké depleci B buněk v periferní krvi. Aplikuje se v sérii dvou i.v. infuzí. Snižuje aktivitu RA, lze jej užít i mimo registrované indikace u závažných forem systémového lupusu.
Po podání rituximabu se mohou vyskytnout různé infuzní reakce, většinou mírné, častější jsou po první infuzi. Jejich frekvenci lze snížit i.v. premedikací glukortikoidy.
Při léčbě může být mírně zvýšen počet závažných infekcí, zvláště u pacientů s nízkými hladinami imunoglobulinů. Nebyl ale pozorován vzestup oportunních infekcí, tuberkulózy či reaktivace virových infekcí. Infekční komplikace jsou pravděpodobně častější při prolongované depleci B lymfocytů (více než tři roky) a při poklesu IgM a IgG. Dlouhodobé zkušenosti ukazují, že rizikovými faktory infekčních komplikací jsou chronická plicní onemocnění, chronická onemocnění srdce, extraartikulární manifestace RA a nízké hladiny IgG před léčbou. Léčba rituximabem může vést k reaktivaci hepatitidy B, u hepatitidy C riziko pravděpodobně zvýšeno není. Zvýšené riziko tuberkulózy popsáno nebylo [13].
Výskyt nádorových onemocnění při léčbě rituximabem zvýšen není, rituximab je z tohoto důvodu vhodnou alternativou biologické léčby u pacientů s malignitou v anamnéze [7].
U pacientů léčených rituximabem byly popsány vzácné případy progresivní multifokální encelopatie (PML), zejména při současné léčbě dalšími imunosupresivy. Podle kanadského registru je riziko PML u rituximabu ze všech terapeutických monoklonálních protilátek nejvyšší [14]. Jedná se sice o vzácnou, ale velmi závažnou komplikaci s mortalitou 80 – 100 %, proto je třeba její případné projevy (zmatenost, motorická slabost, parézy, poruchy řeči, poruchy vidění) aktivně vyhledávat a včas konzultovat s neurologem.
Hematologické abnormality jsou zřídkavé, může se vyskytnout neutropenie. Léčba by měla být v těchto případech do stanovení příčiny přerušena.
Bezpečnostní opatření při dlouhodobé léčbě zahrnují běžné klinické vyšetření se zaměřením na souběžná chronická onemocnění (např. kardiovaskulární, plicní), chronické či rekurentní infekce, dále standardní laboratorní vyšetření včetně hladin imunoglobulinů, sérologii hepatitidy B a C, vhodný je i rentgen plic. Screening latentní TBC nutný není, ale vhodný je. Při závažných souběžných chorobách (aktivní infekce, kardiální insuficience s NYHA 4) je léčba rituximabem kontraindikována. Klinické a laboratorní kontroly probíhají zprvu v měsíčních intervalech a dále v intervalech tří měsíců, u pacientů s nízkými hladinami IgG se doporučuje sledování jejich hladin [11]
Tocilizumab
Tocilizumab je monoklonální protilátka namířená proti interleukinu 6, který má celou řadu prozánětlivých funkcí. Podává se v i.v. infuzi a vede ke snížení aktivity RA i zpomalení její progrese.
Při podání tocilizumabu se mohou vyskytnout infuzní reakce (bolest hlavy, kožní reakce a změny krevního tlaku) zpravidla mírného a přechodného charakteru.
Nejčastěji zaznamenaným nežádoucím účinkem dlouhodobé léčby jsou infekce, především pneumonie, infekce močových cest a gastroenteritida. Jejich výskyt se zvyšuje s dávkou podaného léku. Závažné infekce se popisují asi ve 4 %, výskyt oportunních infekcí a tuberkulózy zvýšen není. Rizikovými faktory infekcí jsou vyšší věk, delší trvání onemocnění, nadváha, přítomnost závažných souběžných onemocnění (diabetes, chronická obstrukční plicní nemoc) a současná léčba glukokortikoidy. Tocilizumab inhibuje syntézu C reaktivního proteinu v játrech, a proto mohou být jeho hladiny i u závažných infekcí nízké nebo zvýšené jen mírně, což může diagnózu infekcí komplikovat [15].
Výskyt malignit při léčbě tocilizumabem zvýšen není, z hematologických abnormalit lze pozorovat přechodnou neutropenii, která se obvykle upraví i přes pokračování léčby. Závažné neutropenie se popisují asi u 4 % nemocných.
Během léčby tocilizumabem může u části nemocných docházet k mírnému, přechodnému zvýšení jaterních aminotransferáz, zvýšení nad trojnásobek normy se pozoruje asi u 6 % pacientů léčených současně MTX.
Vzácně byly popsány v průběhu léčby tocilizumabem případy perforace gastrointestinálního traktu, zpravidla u pacientů s divertikulitidou léčených NSA a glukokortikoidy [15].
V průběhu léčby tocilizumabem bylo pozorováno zvýšení hladin lipidů – LDL a HDL cholesterolu, zpravidla na začátku léčby. Průměrně dochází ke zvýšení o cca 10 – 20 %. Celkové kardiovaskulární riziko pravděpodobně zvýšeno není, nicméně další studie v tomto smyslu probíhají.
Bezpečnostní opatření. Mimo běžné klinické vyšetření zaměřené na infekce, kardiovaskulární, plicní a jaterní onemocnění je potřeba pátrat po projevech divertikulitidy. Laboratorní vyšetření zahrnují běžné hematologické a biochemické vyšetření, včetně lipidogramu, a screening virových hepatitid a tuberkulózy [11].
Závěr
Biologická léčba je v současné době nejúčinnějším prostředkem terapie revmatoidní artritidy a dalších zánětlivých revmatických onemocnění, jako je ankylozující spondylitida, nonradiografická axiální spondyloartritida a psoriatická artritida. Nežádoucí účinky této léčby se na rozdíl od syntetických, chorobu modifikujících léků a imunosupresiv odehrávají ve sféře imunologické. Obecně je u biologické léčby mírně zvýšeno riziko infekcí, včetně závažných, toto riziko však není u všech prostředků biologické léčby stejné. Zvýšené riziko tuberkulózy představuje společný vedlejší efekt terapie inhibitory TNFα, u ostatních přípravků toto riziko popsáno nebylo. Biologická léčba pravděpodobně nezvyšuje globální riziko vzniku malignit u populace s revmatickými chorobami, nelze vyloučit mírně zvýšené riziko maligního melanomu. U ostatních nádorů, včetně lymfomů, nádorů plic a nemelanomových kožních nádorů zatím zvýšené riziko v souvislosti s biologickou léčbou popsáno nebylo. Některé prostředky, zejména inhibitory TNFα, mohou zhoršovat kardiální insuficienci, u této populace pacientů jsou proto kontraindikovány. Terapie tocilizumabem může ovlivňovat hladiny lipidů v séru, celkově zvýšené kardiovaskulární riziko však u tohoto typu terapie prokázáno nebylo. Vzácně se mohou vyskytnout hematologické a neurologické abnormality včetně závažných onemocnění, jako je PML. Nicméně celková rizika biologické léčby zdaleka nepřevyšují benefit terapie, tedy snížení aktivity a progrese základního revmatického onemocnění. Je proto třeba případné nežádoucí účinky dobře znát, aktivně je vyhledávat a léčit, a pokud je to možné, tak jim i předcházet.
Práce byla podpořena Výzkumným záměrem MZ ČR č. 00023728.
Doručeno do redakce: 8. 10. 2014
Přijato po recenzi: 17. 10. 2014
MUDr. Marta Olejárová, CSc.
www.revma.cz
olejarova@revma.cz
Sources
1. Olejárová M. Biologická léčba v revmatologii. Praha: Mladá Fronta 2010.
2. Askling J, Fored CM, Brandt L et al. Time ‑ dependent increase in risk of hospitalisation with infection among Swedish RA patients treated with TNF antagonists. Ann Rheum Dis 2007; 66 : 1339 – 1344.
3. Listing J, Strangfeld A, Kary S et al. Infections in patients with rheumatoid arthritis treated with biologic agents. Arthritis Rheum 2005; 52 : 3403 – 3412.
4. Curtis JR, Patkar N, Xie A et al. Risk of serious bacterial infections among rheumatoid arthritis patients exposed to tumor necrosis factor alfa antagonists. Arthritis Rheum 2007; 56 : 1125 – 1133.
5. Dixon WG, Hyrich KL, Watson KD et al. Drug‑specific risk of tuberculosis in patients with rheumatoid arthritis treated with anti‑TNF therapy: results from the British Society for Rheumatology Biologics Register (BSRBR). Ann Rheum Dis 2010; 69 : 522 – 528. doi: 10.1136/ ard.2009.118935.
6. Askling J, Fored CM, Brandt L et al. Risk and case characteristics of tuberculosis in rheumatoid arthritis associated with tumor necrosis factor antagonists in Sweden. Arthritis Rheum 2005; 52 : 1986 – 1992.
7. Ramiro S, Gaujoux ‑ Viala C, Nam JL et al. Safety of synthetic and biological DMARDs: a systematic literature review informing the 2013 update of the EULAR recommendations for management of rheumatoid arthritis. Ann Rheum Dis 2014; 73 : 529 – 535. doi: 10.1136/ annrheumdis ‑ 2013 ‑ 204575.
8. Gómez ‑ Reino JJ, Carmona L, Angel Descalzo M. Risk of tuberculosis in patients treated with tumor necrosis factor antagonists due to incomplete prevention of reactivation of latent infection. Arthritis Rheum 2007; 57 : 756 – 761.
9. Tubach F, Salmon D, Ravaud P et al. Biobadaser Group. Risk of tuberculosis is higher with anti‑tumor necrosis factor monoclonal antibody therapy than with soluble tumor necrosis factor receptor therapy: The three‑year prospective French research axed on tolerance of biotherapies registry. Arthritis Rheum 2009; 60 : 1884 – 1894. doi: 10.1002/ art.24632.
10. Bongartz T, Sutton AJ, Sweeting MJ et al. Anti‑TNF antibody therapy in rheumatoid arthritis and the risk of serious infections and malignancies: systematic review and meta‑analysis of rare harmful effects in randomized controlled trials. JAMA 2006; 295 : 2275 – 2285.
11. Vencovský J et al. Bezpečnost biologické léčby – doporučení České revmatologické společnosti. Čes Revmatol 2009; 3 : 146 – 160.
12. Atzeni F, Sarzi ‑ Puttini P, Mutti A et al. Long‑term safety of abatacept in patients with rheumatoid arthritis. Autoimmun Rev 2013; 12 : 1115 – 1117. doi: 10.1016/ j.autrev.2013.06.011.
13. Faurschou M, Jayne DR. Anti‑B cell antibody therapies for inflammatory rheumatic diseases. Annu Rev Med 2014; 65 : 263 – 278. doi: 10.1146/ annurev ‑ med ‑ 070912 ‑ 133235.
14. Keene DL, Legare C, Taylor E et al. Monoclonal antibodies and progressive multifocal leukoencephalopathy. Can J Neurol Sci 2011; 38 : 565 – 571.
15. Tanaka T, Hishitani Y, Ogata A. Monoclonal antibodies in rheumatoid arthritis: comparative effectiveness of tocilizumab with tumor necrosis factor inhibitors. Biologics 2014; 8 : 141 – 153. doi: 10.2147/ BTT.S37509.
Labels
Paediatric cardiology Internal medicine Cardiac surgery CardiologyArticle was published in
Cardiology Review

2014 Issue 5
-
All articles in this issue
- Kidneys and heart failure
- Treatment of anemia and iron deficiency from the hematologist’s perspective
- Treatment of anaemia and iron deficiency in chronic heart failure
- Treatment of sideropenic anemia in gastroenterology
- Treatment of iron deficiency anaemia from the nephrologist’s point of view
- Aerobic and specific inspiratory muscle training in patients with chronic heart failure
- The profile of patients with acute heart failure managed in pre‑hospital setting
- Rupture of a sinus of Valsalva aneurysm as an unusual cause of chest pain – case report
- Conclusions of the PARADIGM‑ HF study
- Osteoporosis diagnosis and treatment
- Antiphospholipid syndrome – diagnostics, manifestation and treatment
- Systemic sclerosis
- Biologics in the treatment of rheumatoid arthritis
- Adverse effects of biological therapy in rheumatology
- Heart failure and COPD – Review Article
- Heart failure and diabetes mellitus
- Cardiology Review
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Treatment of anemia and iron deficiency from the hematologist’s perspective
- Antiphospholipid syndrome – diagnostics, manifestation and treatment
- Adverse effects of biological therapy in rheumatology
- Systemic sclerosis
