Hemolytický index jako nástroj ke stanovení volného hemoglobinu v plazmě
Hemolysis index as a tool for determination of free hemoglobin in plasma.
Objective:
Implementation of a laboratory test of free hemoglobin in plasma into routine laboratory practice using a calculation method based on hemolysis index (HI). The test should be available 24/7 and quality control of this method should be ensured.
Design:
Original Article.
Settings:
Institute for Clinical and Experimental Medicine, Vídeňská 1958/9, 140 21 Praha 4
Materials and methods:
The method was calibrated using in-house calibration standards. The patients’ samples were compared to a spectrophotometric method according to Fairbanks [1] and to the HI-based method (measured on the automated analyzer Cobas 6000, Roche) using the Passing-Bablok regression. The external quality assessment (EQA) samples (INSTAND e.V.) and the in-house internal quality control (IQC) samples, prepared just as the calibration standards, were measured in the same way. Yields relative to target (or theoretical) hemoglobin plasma concentrations were calculated for the both types of samples.
Results:
The linear regression equation for calculation of free hemoglobin in plasma [free Hb (mg/l) = 11.41*HI+21.1] was obtained by calibration. This formula was utilized to compare patients’ samples to the Fairbanks procedure [1] using Passing-Bablok regression (intercept 45.9 mg/L; slope 1.28). Recovery of the Fairbanks method [1] relative to the target values of the EQA samples was 100.8 %. Recovery of the HI-based method was only 71.1%. The HI-based method correlated with theoretical concentration of hemoglobin; the spectrophotometric method by Fairbanks [1] did not.
Conclusion:
The free hemoglobin calculation method utilizing HI values is an easy-to-use, low-cost and fast method that can be available to clinical departments 24/7. The results are sufficient for timely identification of intravascular hemolysis. There are discrepant results of compared methods in patient samples, but we do not consider the bias as significant because of higher limit for organs damage (up 400 mg/l), which is caused by mechanical hemolysis. However, the EQA samples correlate only with the Fairbanks method [1], due to different matrix properties of these samples, and therefore cannot be used for the HI-based method. Ensuring traceability between spectrophotometrically measured EQA samples and the HI-based method by means of patients’ samples has been the only option for trueness verification of the implemented method so far.
Keywords:
free hemoglobin, hemolysis index, hemolysis.
Authors:
J. Komrsková 1; Z. Kubíček 1; J. Franeková 1,2; A. Jabor 1,2
Authors‘ workplace:
Pracoviště laboratorních metod, Institut klinické a experimentální medicíny, Praha
1; 3. lékařská fakulta UK, Praha
2
Published in:
Klin. Biochem. Metab., 26, 2018, No. 4, p. 173-177
Overview
Cíl studie:
Zavedení laboratorního vyšetření volného hemoglobinu v plazmě do rutinního provozu laboratoře pomocí výpočtové metody založené na hodnotě hemolytického indexu (HI), které může být k dispozici klinickým oddělením po 24 hodin denně. Zajištění řízení kvality této metody.
Typ studie:
původní práce.
Název a sídlo pracoviště:
Institut klinické a experimentalní medicíny, Vídeňská 1958/9, 140 21, Praha 4
Materiál a metody:
Kalibrace metody pomocí in-house kalibračních standardů, porovnání pacientských vzorků Passing-Bablokovou regresí mezi spektrofotometrickou metodou dle Fairbankse [1] a metodou založenou na hemolytických indexech (HI) měřených na automatickém analyzátoru Cobas 6000 (Roche). Kromě pacientských vzorků byly stejným způsobem proměřeny vzorky externího hodnocení kvality (INSTAND e.V.) a in-house vzorky interní kontroly kvality (IKK), které byly zhotovené stejným způsobem jako kalibrační standardy. Pro oba typy vzorků byla spočítána výtěžnost vzhledem k cílovým (popř. teoretickým) koncentracím hemoglobinu v plazmě.
Výsledky:
Kalibrací byla získána rovnice lineární regrese pro výpočet volného hemoglobinu v plazmě [volný Hb (mg/l) = 11,41*HI+21,1]. Tento výpočtový vztah byl použit pro porovnání pacientských vzorků s postupem dle Fairbankse [1] pomocí Passing-Bablokovy regrese (intercept 45,9 mg/l; slope 1,28). Recovery metody dle Fairbankse [1] vztažená k cílovým hodnotám externího hodnocení kvality byla 100,8 %; metoda dle hemolytických indexů vykazovala recovery pouze 71,1 %. S teoretickou koncentrací hemoglobinu korelovala metoda založená na výpočtu z HI, spektrofotometrická metoda dle Fairbankse [1] nikoliv.
Závěr:
Výpočet ke stanovení volného hemoglobinu využívající hodnoty hemolytického indexu je snadno proveditelná, levná a rychlá metoda, jejíž výsledky postačují k včasnému záchytu intravaskulární hemolýzy a díky své rychlosti a jednoduchosti může být dostupná klinickým oddělením nepřetržitě. Metoda vykazuje na porovnaných pacientských vzorcích plazmy vychýlení vůči metodě dle Fairbankse [1], které nepovažujeme za signifikantní při měření volného hemoglobinu v plazmě jako důsledku mechanického poškození erytrocytů (rozhodovací limit pro orgánové poškození od 400 mg/l). Pro tuto metodu (HI) ovšem nelze použít vzorky externího hodnocení kvality (EHK), které korelují pouze s metodou dle Fairbankse [1], kvůli jiným vlastnostem matrice těchto vzorků. Zajištění návaznosti mezi spektrofotometricky proměřenými vzorky externího hodnocení kvality a metodou založenou na měření HI pomocí pacientských vzorků je tedy prozatím jedinou možností, jak ověřit pravdivost zavedené metody.
Klíčová slova:
volný hemoglobin, hemolytický index, hemolýza.
Úvod
Volný hemoglobin v plazmě stoupá po vyčerpání kapacity hemoglobin-haptoglobinového komplexu, což se děje nejčastěji při hemolytických anémiích, posttransfuzních reakcích nebo také při hemolýze vzniklé mechanicky - u pacientů s implantovanou srdeční podporou. Hemolýzu, která může vzniknout také in vitro lze pozorovat u řady preanalytických chyb, jako například při nešetrném odběru krve (krev volně nevykapává do zkumavky), nesprávném transportu (zejm. potrubní pošta, sanita) či pozdní centrifugaci. Fyziologicky se volný hemoglobin v plazmě téměř nevyskytuje, referenční rozmezí se udává menší než 20 mg/l [2]. Intravaskulární hemolýza může vést k akutnímu i chronickému jaternímu, renálnímu či vaskulárnímu poškození, proto je potřeba ji včas diagnostikovat [3]. V současnosti není komerčně dostupná metoda pro stanovení volného hemoglobinu, která by byla lehce proveditelná v běžné laboratorní praxi a byla dostupná klinickým oddělením po 24 hodin denně a zároveň splňovala základní kritéria pro řízení kontroly kvality.
Hemolytické indexy, měřené dnes již standardně na automatických analyzátorech, využívají při měření výpočet provedený na základě změřené absorbance při různých vlnových délkách (600/570 nm - Cobas 6000, Roche). Tento hemolytický index představuje semikvantitativní odhad hladiny hemolýzy ve vzorku, tj. hodnota indexu 300 odpovídá přibližné koncentraci hemoglobinu 3000 mg/l [4].
Cílem práce bylo optimalizovat rychlou, jednoduchou, levnou a spolehlivou metodu ke stanovení volného hemoglobinu, která bude založena na výpočtu z hodnoty hemolytického indexu vzorku, porovnat ji s nejznámější popsanou metodou založenou na spektrofotometrickém měření, uvést ji tak do nepřetržitého provozu laboratoře a zajistit její externí a interní kontrolu kvality.
Materiál a metody
Metoda stanovení volného hemoglobinu v plazmě byla zavedena dle Petrova et al. [5], hemolyzát pro přípravu kalibračních standardů byl připraven dle Goyal a Basak [6].
Příprava hemolyzátu, kalibračních standardů a vzorků IKK
Pro přípravu kalibračních standardů dle Goyal a Basak [6] byl nejprve připraven hemolyzát tak, že čerstvě odebraná krev do zkumavky s Lithium heparinem byla centrifugována (3 minuty, 4000 g), plazma odsáta a byl odebrán 1 ml erytrocytů, který byl následně dvakrát promyt pomocí fyziologického roztoku. Krvinky byly dále hemolyzovány přidáním 1 ml destilované vody a následně byl hemolyzát zamražen při -20 °C po dobu 24 hodin. Po rozmražení a vytemperování na laboratorní teplotu byl hemolyzát centrifugován 15 minut při 4000 g. Poté byla změřena koncentrace hemoglobinu v hemolyzátu v triplikátu (ABL 800, Radiometer). Dvojkovou ředicí řadou bylo z hemolyzátu připraveno šest standardů. Standard č. 1 byl připraven naředěním hemolyzátu 40x, standard č. 2 naředěním hemolyzátu 80x atd. Smícháním standardu č. 1 a 2 v poměru 1 : 1 byl připraven standard č. 7. Hemolyzát byl ředěn nehemolytickou, neikterickou a nelipemickou plazmou. Ve všech standardech včetně hemolyzátu byl dále stanoven hemolytický index (Cobas 6000, Roche).
Lineární regresí (Microsoft Office Excel 2007) byla získána závislost hodnot HI standardů na teoretických hodnotách koncentrace hemoglobinu, které byly získané výpočtem z koncentrace hemoglobinu v hemolyzátu (průměr 3 hodnot). Rovnice regrese byla poté využita k výpočtu volného hemoglobinu v plazmě z naměřené hodnoty HI.
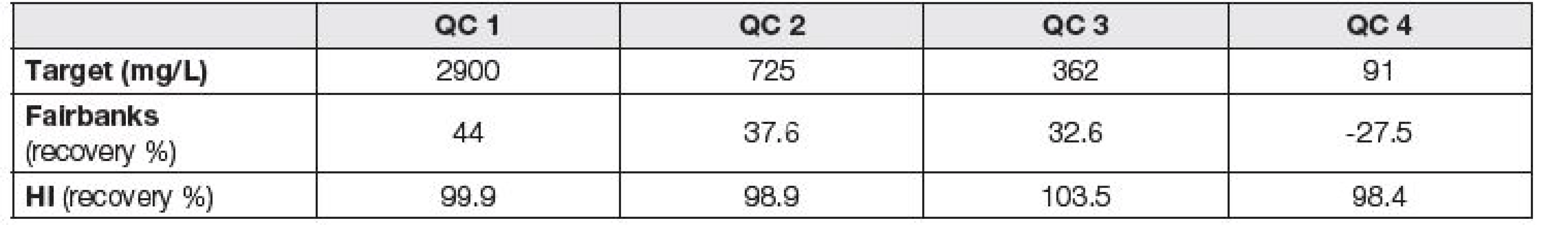
Stejným způsobem jako kalibrační standardy byly připraveny i 4 in house vzorky pro interní kontrolu kvality. Naředěním hemolyzátu o koncentraci hemoglobinu 116 g/l nehemolytickou, neikterickou a nelipemickou plazmou 40x, 160x, 320x a 1280x byly získány vzorky, jejichž koncentrace volného hemoglobinu po změření na ABL 800 (Radiometer) byly: 2900 mg/l, 725 mg/l, 362 mg/l a 91 mg/l.
Porovnání pacientských a kontrolních vzorků
Před porovnáváním vzorků byla nejprve ověřena přesnost spektrofotometru (Halo-DB, Dynamica) proměřením cyklu externího hodnocení kvality FOT/17 (SEKK s.r.o.). Pro ověření námi získané rovnice pro stanovení volného hemoglobinu v plazmě bylo provedeno porovnání vzorků plazmy (n=39) pomocí Passing-Bablokovy regrese (MedCalc Statistical Software, version 17.2, MedCalc Software bvba, Ostend, Belgium) mezi spektrofotometrickou metodou a metodou výpočtu z HI (Cobas 6000, Roche). Vzorky byly proměřeny spektrofotometricky metodou dle Fairbankse [1] při vlnových délkách 415 nm, 450 nm a 700 nm (Halo-DB, Dynamica). Tato metoda využívá ředění vzorku 1 : 10 pomocí 0,1 g/l Na2CO3. Stejným způsobem jako vzorky plazmy bylo proměřeno šest vzorků externího hodnocení kvality (INSTAND e.V.) a čtyři námi zhotovené kontroly pro interní kontrolu kvality, které byly připraveny stejným způsobem jako kalibrační standardy. Pro spektrofotometrické měření byly vždy použity jednorázové plastové kyvety (optická dráha 1 cm) a hodnoty absorbance byly porovnány k 0,1 g/l Na2CO3. Z koncentrací hemoglobinu získaných oběma metodami byla spočítána výtěžnost vzhledem k cílovým hodnotám (cHb/cHbtarget *100).
Výsledky
Průměrná koncentrace hemoglobinu v námi připraveném hemolyzátu byla 116 g/l, naměřená hodnota hemolytického indexu byla 8868. Teoretická koncentrace hemoglobinu v in-house standardech byla: S1 = 2,9 g/l; S2 = 1,45 g/l; S3 = 0,73 g/l; S4 = 0,36 g/l; S5 = 0,18 g/l; S6 = 0,09 g/l; S7 = 2,2 g/l. Po změření HI standardů byla vytvořena závislost hodnot hemolytického indexu na koncentraci hemoglobinu ve standardech (obr. 1). Z regrese byla získána rovnice pro výpočet volného hemoglobinu:
Volný Hb (mg/l) = 11,41*HI+21,1
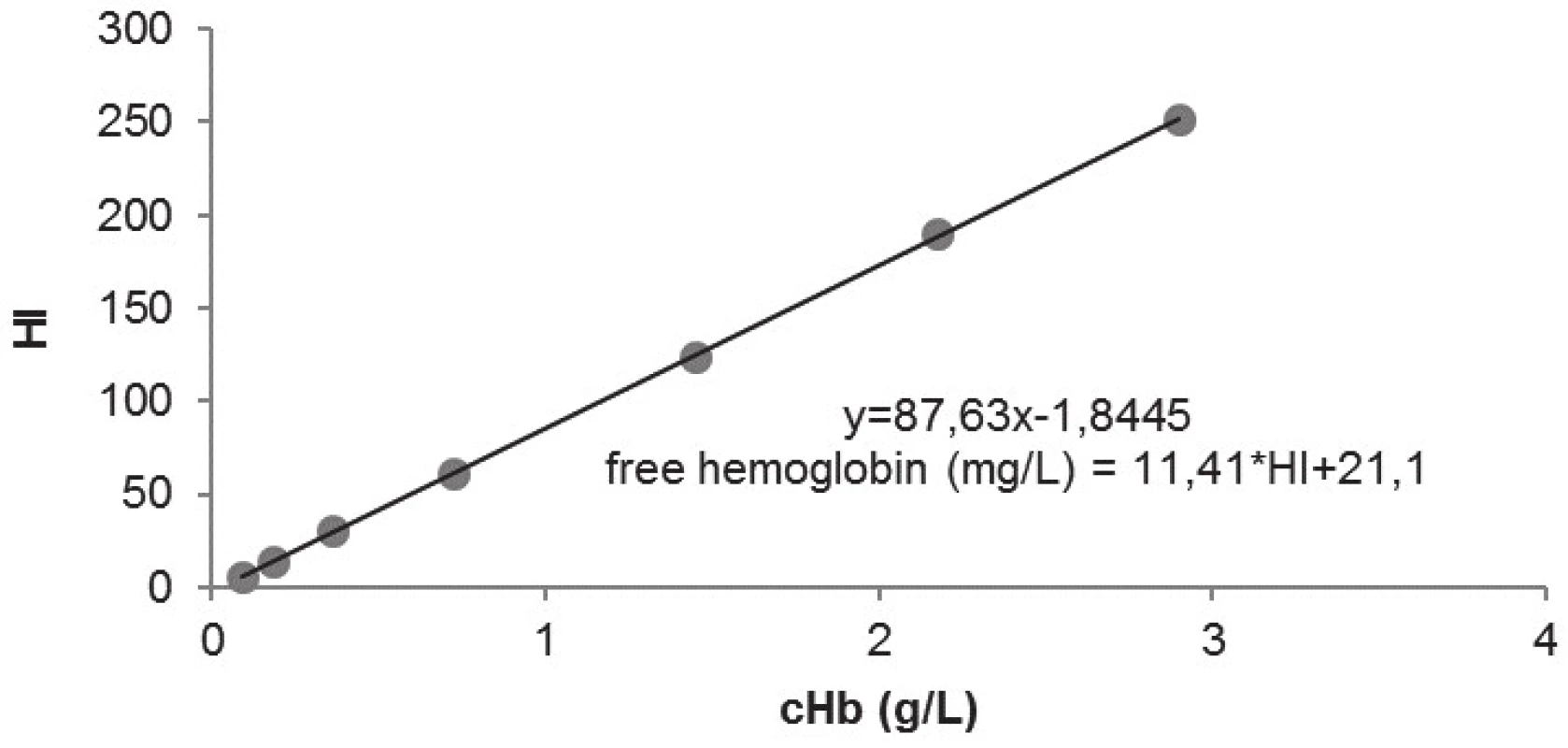
Prověření spektrofotometru pomocí cyklu FOT/17 (SEKK s.r.o.) bylo provedeno na třech vlnových délkách (395 nm, 512 nm, 678 nm) s odchylkou od cílových hodnot absorbancí 0 až 8 %.
Získaný početní vztah byl ověřen porovnáním celkem 39 vzorků plazmy (zředěné 11x 0,1 g/l Na2CO3,) se spektrofotometrickým měřením při vlnových délkách specifických pro metodu dle Fairbankse [1] (415 nm, 450 nm, 700 nm). U neředěného vzorku plazmy byl dále změřen HI na analyzátoru Cobas 6000. Koncentrace volného hemoglobinu v plazmě vypočítané z HI byly v průměru o 30 % vyšší v porovnání s metodou dle Fairbankse, z Passing-Bablokovy regrese (Obr. 2) je patrná signifikantní systematická i proporcionální odchylka [intercept 45,9 (95 % CI 36,3 až 61,4); slope 1,28 (95 % CI 1,2 až 1,4)]. Kromě pacientských vzorků byly dále zmíněnými dvěma metodami měřeny vzorky externího hodnocení kvality (INSTAND e.V. Haematology 16-Free Haemoglobin). Ze získaných hodnot byla spočítána výtěžnost vzhledem k cílové hodnotě udávané dle INSTAND e.V. pro skupinu stanovení o třech vlnových délkách (Tabulka 1).
![Method comparism of free hemoglobin, measured according
to Fairbanks [1] and HI-based method.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/643054d986116567bec4a2d2d263e8de.jpeg)
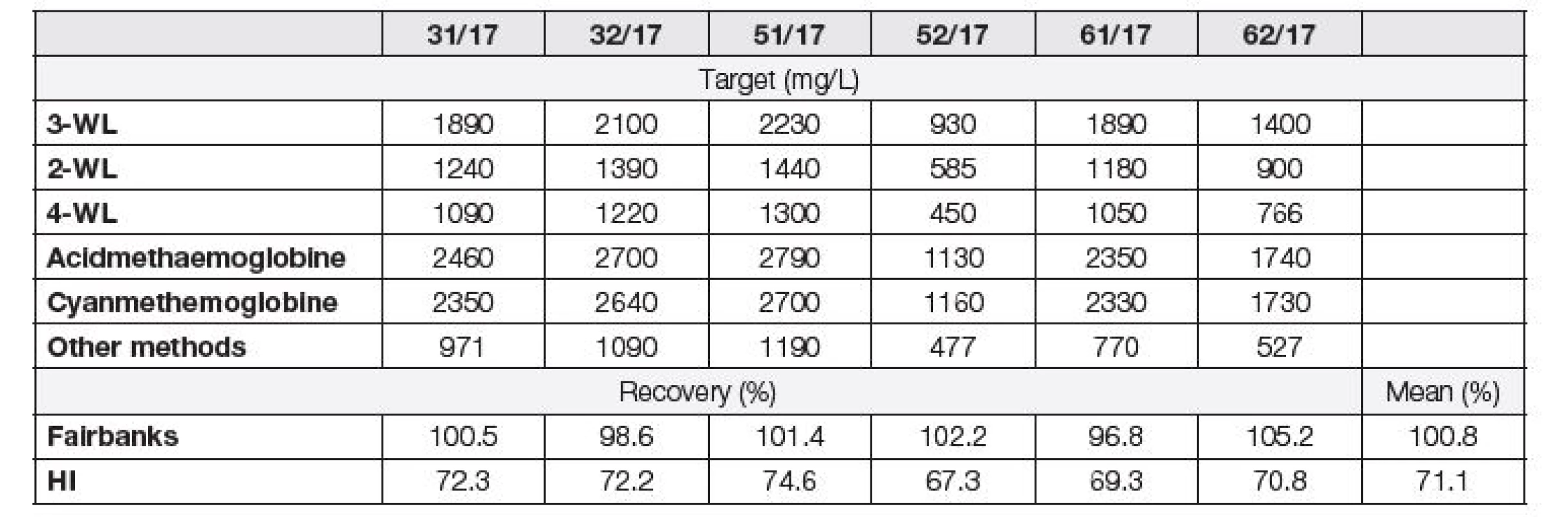
U metody dle Fairbankse [1] byla shoda s udávanou cílovou hodnotou u vzorků INSTAND e.V. (průměrná recovery 100,8 %). Metoda založená na výpočtu koncentrace hemoglobinu z HI vykazovala v průměru pouze 71,1 % výtěžnost vzhledem k cílové hodnotě, což je v souladu s Petrova et al. [5]. Dále byly stejným způsobem jako vzorky INSTAND e.V. proměřeny in-house vzorky IKK. Recovery (%) u obou metod vzhledem k teoretické hodnotě hemoglobinu v in-house vzorcích IKK je uvedena v Tabulce 2. V námi měřených koncentracích volného hemoglobinu v plazmě (QC1-QC4) dosahovala metoda dle HI recovery v průměru 100,2 %. Koncentrace hemoglobinu získané metodou dle Fairbankse [1] s teoretickými hodnotami koncentrace hemoglobinu v plazmě nekorelovaly (recovery 22 %).
Diskuse
Stanovení volného hemoglobinu v plazmě se používá jako marker akutní a chronické hemolýzy, např. u hemolytických anémií, či u pacientů s implantovanou srdeční podporou. Volný hemoglobin vzniká fyziologicky degradací červených krvinek. Během procesu fagocytózy erytrocytu retikulo-endoteliálním systémem se dostává malé množství hemoglobinu do plazmy, který se naváže na haptoglobin a je transportován zpět do retikulo-endoteliálního systému, kde je katabolizován [2]. Po vyčerpání haptoglobinového systému dochází k nárůstu volného hemoglobinu v plazmě, který je ledvinami filtrován, což může vést k hemoglobinurií a k akutnímu selhání ledvin jakožto následku poškození tubulů [7].
Podstatnou roli při stanovení volného hemoglobinu v plazmě hraje preanalytická fáze, tj. správná technika odběru (bez násilné aspirace krve), vhodný odběrový materiál (EDTA, lithium heparin), správný objem krve ve zkumavce, transport (nepoužívat potrubní poštu) a co nejrychlejší centrifugace. V případě nedodržení některé z těchto podmínek preanalytické fáze může dojít k in vitro hemolýze, a tím k falešnému zvýšení koncentrace volného hemoglobinu v plazmě.
V současnosti je popsáno několik optických metod ke stanovení volného hemoglobinu v plazmě, které jsou prováděny při měření dvou či tří vlnových délek (při absorpčních maximech hemoglobinu) za použití různých korekčních faktorů, které eliminují vliv interference bilirubinem a triglyceridů [2]. Popsány jsou také metody imunonefelometrické za využití polyklonálního antiséra [8]. Dále jsou popsány i spektrofotometrické metody založené na derivaci spektra, jejichž výhodou je nižší citlivost vůči interferujícím látkám [9].
Požadavky na metodu pro stanovení volného hemoglobinu v plazmě v naší laboratoři byly především: jednoduchá proveditelnost, časová a finanční nenáročnost, možnost měření více vzorků najednou, spotřeba malého objemu vzorku bez jakékoliv úpravy, dostupnost po 24 hodin denně.
Námi vybraná optické metoda dle Fairbankse [1] pro porovnání s metodou založenou na výpočtu z hemolytického indexu využívá hodnoty absorbance při 415 nm, 450 nm a 700 nm. Výhodou této i ostatních spektrofotometrických metod zůstává jednoznačně jejich přesnost, nicméně mezi nevýhody patří i příprava vzorku, obsluha spektrofotometru a nemožnost přímého napojení na laboratorní informační systém.
Dostupné vzorky externího hodnocení kvality (INSTAND e.V.-Haematology 16 – Free Haemoglobin) dělí účastníky do šesti skupin dle principu stanovení (měření při dvou-, třech-, čtyřech vlnových délkách, metoda acidmethemoglobinová, kyanomethemoglobinová a skupina jiných postupů), kde jsou pro každou skupinu odlišné vztažné hodnoty (viz Tabulka 1). Vzorky jsou určeny pro spektrofotometrické stanovení volného hemoglobinu metodami využívajícími především absorpční maximum hemoglobinu při 415 nm, a nikoliv spektrofotometrická stanovení zahrnující vlnové délky 540 nm a 577 nm (dle HI či dle Cripps [10], Porter [11], Shinowara [12] aj.), které jsou typické pro absorpční maxima oxyhemoglobinu, jehož přítomnost ve vzorcích EHK při spektrofotometrickém stanovení volného hemoglobinu interferuje [13]. Je proto nutné zajistit návaznost mezi spektrofotometrickou metodou využívající absorpční maximum při 415 nm s metodou založenou na hemolytických indexech pomocí porovnání pacientských vzorků plazmy. Porovnání pacientských vzorků Passing-Bablokovou regresí změřených metodou dle Fairbankse [1] a metodou založenou na HI vykazuje vychýlení (intercept 45,9; slope 1,28 mg/l), které nepovažujeme za klinicky významné vzhledem k rozhodovacímu limitu pro orgánové poškození z důvodu hemolýzy vzniklé mechanicky (od 400 mg/l).
Závěr
Metoda ke stanovení volného hemoglobinu v plazmě pomocí výpočtu se v praxi projevila jako rychlá, bezproblémová metoda s funkční IKK i EHK, která klinikům slouží k posouzení závažnosti orgánových poškození způsobených intravaskulární hemolýzou.
Autoři prohlašují, že nejsou ve střetu zájmů.
Do redakce došlo 30. 5. 2018
Adresa pro korespondenci:
RNDr. Jitka Komrsková
Oddělení klinické biochemie
Pracoviště laboratorních metod
Institut klinické a experimentální medicíny
Vídeňská 1958/9
140 21 Praha
e-mail: jitka.komrskova@ikem.cz
Sources
1. Fairbanks, V. F., Ziesmer, S. C., O’Brien, P. C. Me-thods for measuring plasma hemoglobin in micromolar concentration compared. Clin. Chem. 1992, 38(1), p. 132-40.
2. Thomas, L. Clinical Laboratory Diagnostics: Use and Assessment of Clinical Laboratory Results. Frankfurt am Main: TH-Books, 1998, 1527 s. ISBN 3-9805215-4-0.
3. Schaer, D. J., Buehler, P. W., Alayash, A. I., Belcher, J. D., Vercellotti, G. M. Hemolysis and free hemoglobin revisited: exploring hemoglobin and hemin scavengers as a novel class of therapeutic proteins. Blood 2013, 121(8), p. 1276-84.
4. COBI-CD, Compendium of Background Information, Roche Diagnostics, verze 1.0.
5. Petrova, D. T., Cocisiu, G. A., Eberle, C., et al. Can the Roche hemolysis index be used for automated determination of cell-free hemoglobin? A comparison to photometric assays. Clin. Biochem. 2013, 46(13-14), p. 1298-301.
6. Goyal, M. M., Basak, A. Estimation of plasma haemoglobin by a modified kinetic method using o-tolidine. Indian J Clin. Biochem. 2009, 24(1), 36-41.
7. Silbernagl, S., Despopoulos, A. Atlas fyziologie člověka. Praha: Grada, 2016, 448 s. ISBN 978-80-247-4271-7
8. Lammers, M., Gressner, A. M. Immunonephelometric quantification of free haemoglobin. J Clin. Chem. Clin. Biochem. 1987, 25(6), p. 363-7.
9. Fořtová, H., Kodíček, M., Spalová, H. Praktické možnosti stanovení nízkých koncentrací hemoglobinu v plazmě. Klin. Biochem. Metab. 1993, 1(22), No. 2, p. 79-83.
10. Cripps, C. M. Rapid method for the estimation of plasma haemoglobin levels. J Clin. Pathol. 1968, 21(1), p. 110-2.
11. Porter, G. A. Spectrophotometric method for quantitative plasma hemoglobin resulting from acute hemolysis. J Lab. Clin. Med. 1962, 60, p. 339-48.
12. Shinowara, G. Y. Spectrophotometric studies on blood serum and plasma; the physical determination of hemoglobin and bilirubin. Am. J Clin. Pathol. 1954, 24(6), p. 696-710.
13. INSTAND Program of External Quality Assessment. Schemes in Medical Laboratories. Düsseldorf, Germany: INSTAND e.V., 2018, 140 s. Dostupný z WWW: https://www.instand-ev.de/fileadmin/uploads/Ringversuche/INSTAND_Katalog_2018_EN.pdf
Labels
Clinical biochemistry Nuclear medicine Nutritive therapistArticle was published in
Clinical Biochemistry and Metabolism

2018 Issue 4
-
All articles in this issue
- Biologické účinky oxidu uhelnatého
- Hyponatrémie – frekvence, příčiny, patobiochemie, klinika a terapie
- Volné lehké řetězce a páry těžkých a lehkých řetězců imunoglobulinů ve vztahu k morbiditě pacientů před transplantací jater a v potransplantačním období
- Hemolytický index jako nástroj ke stanovení volného hemoglobinu v plazmě
- Ověření referenčního rozmezí volného trijodtyroninu v séru na analyzátoru Architect ci 16200
- Urolitiáza - efekt terapie indapamidem – kazuistika
- Realimentační syndrom po paleodietě
- Clinical Biochemistry and Metabolism
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Hyponatrémie – frekvence, příčiny, patobiochemie, klinika a terapie
- Hemolytický index jako nástroj ke stanovení volného hemoglobinu v plazmě
- Realimentační syndrom po paleodietě
- Urolitiáza - efekt terapie indapamidem – kazuistika
