Vzťah medzi sérovou hladinou karboanhydrázy IX, hypoxiou a rádiorezistenciou nádorov hlavy a krku
Relation between Carbonic Anhydrase IX Serum Level, Hypoxia and Radiation Resistance of Head and Neck Cancers
Background:
Hypoxia of locally advanced head and neck cancers is one of the main causes of their radiation resistance that presents clinically as a persistence of residual tumor disease after radiation therapy. Therefore, detection of tumor hypoxia could be an important predictor of treatment efficacy. Carbonic anhydrase IX (CA IX) is a protein, coded by a homonymous gene, the expression of which increases in tumor tissues at hypoxic conditions. Hence, CA IX represents an endogenic marker of tumor hypoxia, identifiable in tumor tissues, and its soluble extracellular domain can also be detected in body fluids of the patient. The primary endpoint of this study was to explore whether a correlation exists between CA IX serum level and the residual tumor disease after therapy. The secondary endpoint was to find out how the serum concentration of CA IX changes during the course of fractionated radiation therapy.
Materials and Methods:
The presented prospective monocentric clinical study evaluated a population of 30 patients with locally advanced squamous cell head and neck cancers, treated by radiation therapy or concurrent chemo ‑ radiation therapy with a curative intent. The serum concentration of the soluble form of CA IX was examined from a venous blood sample, using sandwich enzyme‑linked immunosorbent assay (ELISA). The blood samples were obtained before the treatment initiation, in the middle of radiation therapy, at the time of finishing radiation therapy and six weeks after the treatment completion.
Results:
We found a substantial variability in the CA IX levels measured in the examined population, ranging 0 – 1,696 pg/ ml. We found no significant changes in the mean value of CA IX concentration during the course of radiation therapy and after the treatment completion. In 11 patients (36.7%), the treatment resulted in complete remission of the disease. In these patients, lower average pre‑treatment levels of CA IX were noted when compared to patients with persistence of residual tumor disease (37.57 vs 77.47; p = 0.154).
Conclusion:
The results indicate that serum level of CA IX in patients with locally advanced head and neck cancers does not change significantly during the course of fractionated radiation therapy. The relation between CA IX serum level and residual tumor disease after radiation therapy requires verification on a larger population of patients.
Key words:
head and neck cancer – hypoxia – carbonic anhydrase IX – radiation therapy – residual tumor
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Submitted:
10. 2. 2014
Accepted:
4. 3. 2014
Authors:
V. Rosenberg 1; S. Pastoreková 2; M. Zaťovičová 2; P. Slezák 3; I. Waczulíková 4; J. Švec 5
Authors‘ workplace:
Oddelenie radiačnej onkológie, FNsP J. A. Reimana Prešov, Slovensko
1; Virologický ústav SAV, Bratislava, Slovensko
2; Ústav simulačného a virtuálneho medicínskeho vzdelávania, LF UK v Bratislave, Slovensko
3; Oddelenie biomedicínskej fyziky, Fakulta matematiky, fyziky a informatiky UK v Bratislave, Slovensko
4; Vysoká škola zdravotníctva a sociálnej práce sv. Alžbety, Bratislava, Slovensko
5
Published in:
Klin Onkol 2014; 27(4): 269-275
Category:
Original Articles
Overview
Východiská:
Hypoxia lokálne pokročilých karcinómov hlavy a krku je jednou z hlavných príčin ich rádiorezistencie, ktorá sa klinicky manifestuje perzistenciou reziduálnej nádorovej choroby po liečbe rádioterapiou. Detekcia nádorovej hypoxie teda môže byť dôležitým prediktorom efektivity liečby. Karboanhydráza IX (carbonic anhydrase IX – CA IX) je proteín, kódovaný rovnomenným génom, ktorého expresia sa v nádorových tkanivách za hypoxických podmienok zvyšuje. CA IX preto predstavuje endogénny marker nádorovej hypoxie, identifikovateľný v nádorových tkanivách a jeho rozpustnú extracelulárnu doménu je možné detekovať aj v telesných tekutinách pacienta. Primárnym cieľom tejto štúdie bolo zistiť, či existuje korelácia medzi sérovou hladinou CA IX a reziduálnou nádorovou chorobou po liečbe. Sekundárnym cieľom bolo zistiť, ako sa mení sérová hladina CA IX počas frakcionovanej rádioterapie.
Materiál a metódy:
Táto prospektívna monocentrická klinická štúdia hodnotila súbor 30 pacientov s lokálne pokročilými skvamocelulárnymi karcinómami hlavy a krku, liečených rádioterapiou alebo konkomitantnou chemorádioterapiou s kuratívnym zámerom. Sérová koncentrácia rozpustnej formy CA IX sa vyšetrovala z venóznej krvi pomocou sendvičovej enzýmovej imunoanalýzy (ELISA) pred zahájením rádioterapie, v polovici rádioterapie, pri skončení rádioterapie a šesť týždňov po jej ukončení.
Výsledky:
Zistili sme výraznú variabilitu nameraných hladín CA IX v sledovanej populácii v rozsahu 0 – 1 696 pg/ ml. Významné zmeny v strednej hodnote koncentrácie CA IX sme v priebehu rádioterapie a po nej nezistili. U 11 pacientov (36,7 %) sa liečbou dosiahla kompletná remisia ochorenia. U týchto pacientov sme zaznamenali v priemere nižšie predliečebné hodnoty CA IX v porovnaní s pacientmi s perzistenciou reziduálnej nádorovej choroby (37,57 vs 77,47; p = 0,154).
Záver:
Naše výsledky ukazujú, že sérová hladina CA IX sa u pacientov s lokálne pokročilými nádormi hlavy a krku v priebehu frakcionovanej rádioterapie významne nemení. Zistený vzťah medzi sérovou hladinou CA IX a reziduálnou nádorovou chorobou po rádioterapii je potrebné potvrdiť na väčšom súbore pacientov.
Kľúčové slová:
nádory hlavy a krku – hypoxia – karboanhydráza IX – rádioterapia – reziduálny nádor
Východiská
Úvod
I keď nádory hlavy a krku tvoria len asi 5 % všetkých zhubných nádorov, starostlivosť o pacientov s týmto ochorením predstavuje závažný medicínsky a spoločenský problém.
V oblasti hlavy a krku sa nachádzajú zložité orgány, zabezpečujúce základné vitálne funkcie, akými sú dýchanie a príjem potravy, ale aj reč, mimika a sociálne interakcie. Závažnosť tohto problému podčiarkuje aj skutočnosť, že až 60 % pacientov má v čase diagnózy lokálne pokročilé ochorenie, spôsobujúce rôzne anatomické deformity a funkčné defekty. Hlavnou príčinou mortality týchto pacientov však, na rozdiel od väčšiny iných nádorov, nie sú vzdialené metastázy, ale lokálna perzistencia alebo rekurencia ochorenia po primárnej liečbe. Miera lokoregionálneho zlyhania liečby v týchto pokročilých štádiách dosahuje 70 – 80 % [1]. Liečba týchto pacientov je navyše sama o sebe často mutilujúca, zhoršuje kvalitu ich života a významne zvyšuje psychosociálnu záťaž [2].
Rádioterapia, či už samostatná alebo potencovaná cytostatickou alebo biologickou liečbou, je ťažiskovou liečebnou modalitou lokálne pokročilých nádorov hlavy a krku. Lokoregionálne zlyhanie liečby sa preto typicky manifestuje perzistenciou rádiorezistentnej reziduálnej nádorovej choroby.
Nádorová hypoxia ako príčina rádiorezistencie nádorov hlavy a krku
Aby mohli solídne nádory rásť, potrebujú si vytvoriť svoje vlastné krvné zásobenie.
Neoangiogenéza nádorov však zvyčajne zaostáva za rýchlosťou pribúdania nových nádorových buniek. Novo vytvorené, morfologicky a funkčne abnormálne cievy nie sú schopné pokryť zvyšujúcu sa spotrebu živín a kyslíka expandujúcou nádorovou masou. Uvedené faktory zapríčiňujú vznik mikroregionálnych oblastí vnútri nádoru, ktoré sú nedostatočne zásobené živinami a kyslíkom, vzniká kyslé prostredie, obsahujúce hypoxické nádorové bunky, ktoré sú však (aspoň po obmedzený čas) schopné prežívať aj v týchto nepriaznivých podmienkach [3].
Vnímavosť tkanív voči účinkom ionizujúceho žiarenia výrazne závisí od množstva kyslíka, ktoré sa v nich nachádza. Kyslík pôsobí ako rádiosenzibilizátor, prostredníctvom interakcie s voľnými radikálmi, vytvorenými ionizujúcim žiarením, mechanizmom chemickej fixácie poškodenia DNA. Rádiosenzibilizujúci účinok kyslíka, vyjadrený pomocou hodnoty pomeru zosilňujúceho účinku kyslíka (OER) pre fotónové žiarenie používané v klinickej praxi, predstavuje 2,5 – 3 - násobné zosilnenie rádiobiologického účinku žiarenia vplyvom kyslíka v porovnaní so stavom bez prítomnosti kyslíka [4].
Viaceré klinické štúdie, skúmajúce efektivitu rádioterapie u pacientov so skvamocelulárnymi karcinómami hlavy a krku, potvrdili horšiu lokoregionálnu kontrolu a kratšie prežívanie u pacientov s hypoxickými nádormi v porovnaní s dobre okysličenými nádormi [5 – 8]. Okrem rádiorezistencie, indukuje nádorová hypoxia expresiu génov nádorových buniek, ktoré spôsobujú zvýšenú agresivitu týchto nádorov, manifestujúcu sa genetickou instabilitou, stratou apoptotického potenciálu, zvýšeným metastatickým potenciálom a rezistenciou voči chemoterapii [9 – 11].
Meranie hypoxie nádorov hlavy a krku
Identifikácia a kvantifikácia miery nádorovej hypoxie môže mať nielen prognostický význam, ale môže byť aj prediktorom efektivity liečby rádioterapiou a jedným z kľúčových faktorov determinujúcich výber najvhodnejšieho liečebného postupu. Na rozdiel od relatívne jednoduchých experimentálnych podmienok, využívajúcich tkanivové kultúry a laboratórne zvieratá, meranie hypoxie nádorov v klinickej praxi je oveľa zložitejšie a naráža na mnohé technické, ale aj etické úskalia.
Priame meranie nádorovej hypoxie pomocou Eppendorfovej kyslíkovej elektródy
Princípom tejto metódy je priame meranie parciálneho tlaku kyslíka v rôznych oblastiach nádoru pomocou špeciálnych ihlových elektród, ktoré sa zasúvajú do nádorového tkaniva. Pomo-cou Eppendorfovej kyslíkovej elektródy sa podarilo dokázať vzťah medzi predliečebnou hypoxiou lokálne pokročilých skvamocelulárnych karcinómov hlavy a krku a lokálnym zlyhaním liečby rádioterapiou u týchto pacientov [7]. Obdobné výsledky boli publikované aj v ďalšej štúdii, hodnotiacej objem hypoxických oblastí lokálne pokročilých nádorov hlavy a krku liečených rádioterapiou alebo chemorádioterapiou. Táto štúdia potvrdila horšie celkové prežívanie (overall survival – OS) u pacientov s relatívne veľkým objemom oblastí nádorovej hypoxie [10].
Aj keď priame meranie parciálneho tlaku kyslíka pomocou Eppendorfovej elektródy sa v súčasnosti považuje za akýsi „zlatý štandard“, táto metodika so sebou nesie aj mnohé obmedzenia. Hlavnou nevýhodou, obmedzujúcou jej používanie v klinickej praxi, je invazivita. Priame meranie elektródou je tiež obmedzené na anatomicky prístupné lokalizácie nádorov. Veľkosť elektródy je rádovo 10 – 100 - násobne väčšia ako je veľkosť nádorových buniek, čo znemožňuje meranie hypoxie na bunkovej úrovni. Stav okysličenia je teda možné merať len v určitom veľmi obmedzenom objeme a v obmedzenom čase. To znemožňuje sledovanie dynamiky nádorovej hypoxie a reoxygenácie nádorových tkanív v priebehu frakcionovanej rádioterapie. Zásadnou nevýhodou je aj to, že neumožňuje rozlíšiť, či ide o viabilné, klonogénne hypoxické bunky alebo o oblasť nekrózy [12,13].
Markery nádorovej hypoxie
Markery nádorovej hypoxie predstavujú exogénne alebo endogénne látky, umožňujúce identifikáciu a v ideálnom prípade aj kvantifikáciu nádorovej hypoxie.
Exogénne markery nádorovej hypoxie sú látky, arteficiálne podávané pacientovi, ktoré sa v hypoxickom nádorovom prostredí bioreduktívne metabolizujú a viažu sa na biologické makromoleluly. Takto naviazaný marker je možné kvantitatívne identifikovať v bioptickej vzorke nádorového tkaniva pomocou imunohistochemického farbenia, alebo in vivo, pomocou pozitrónovej emisnej tomografie, jednofotónovej emisnej počítačovej tomografie alebo magnetickej rezonančnej spektroskopie. Typickým predstaviteľom tejto skupiny sú nitroimidazolové rádiosenzibilizátory. Hlavnou prekážkou širšieho klinického využitia exogénnych markerov nádorovej hypoxie je však invazivita tejto metodiky. Medzi ďalšie problémy patrí dostupnosť a reprezentatívnosť bioptickej vzorky, časová a finančná náročnosť špecializovaných zobrazovacích vyšetrení, ako aj ich nízka špecificita a senzitivita [13].
Za endogénne markery nádorovej hypoxie možno označiť biologické molekuly, zúčastňujúce sa na odpovedi nádorových buniek na hypoxiu. Ide o zvýšenú expresiu endogénnych proteínov, ktoré sú detekovateľné v bioptických vzorkách, alebo vo vzorkách krvi, moču alebo iných telesných tekutín. Ich najväčšou výhodou je odstránenie invazivity, nevyhnutne spojenej s podávaním exogénnych látok. Medzi najviac skúmané endogénne bunkové proteíny v tejto súvislosti patrí najmä hypoxiou indukovateľný faktor 1α (HIF ‑ 1α), enzým karboanhydráza IX (CA IX), prenášač glukózy 1 (GLUT1) a osteopontín [14,15].
Karboanhydráza IX ako endogénny marker nádorovej hypoxie
Karboanhydrázy sú fyziologicky dôležité enzýmy, ktoré katalyzujú reverzibilnú hydratáciu oxidu uhličitého na hydrogénuhličitan: CO2 + H2O ↔ HCO3– + H+. Podieľajú sa na respirácii, udržiavaní acidobázickej rovnováhy a transporte iónov [16]. Karboanhydráza IX (carbonic anhydrase IX – CA IX) je transmembránový metaloproteín obsahujúci zinok. Je kódovaný rovnomenným génom CA IX, nachádzajúcim sa na 9. ľudskom chromozóme. Jeho expresia sa za hypoxických podmienok výrazne zvyšuje a je pravdepodobne jedným z faktorov, umožňujúcim prežívanie nádorových buniek v hypoxickom prostredí udržiavaním stabilného intracelulárneho pH [17,18]. Hlavným spoločným mechanizmom regulácie génov indukovateľných hypoxiou je transkripčný faktor – hypoxiou indukovateľný faktor 1 (HIF ‑ 1). Jedným z génov závislých od HIF (podjednotky HIF ‑ 1α) je CA IX. Expresia CA IX sa pozorovala u mnohých typov nádorov, vrátane nádorov hlavy a krku, krčka maternice, pažeráka, pľúc, prsníka, hrubého čreva a konečníka. Vo všeobecnosti sa vysoká expresia zaznamenala u skvamocelulárnych karcinómov. Typicky sa pozoruje v perinekrotických oblastiach, čo zodpovedá distribúcii hypoxie, zapríčinenej obmedzenou difúziou [19,20]. Expresia CA IX signifikantne koreluje s úrovňou hypoxie, nameranou u nádorov krčka maternice pomocou ihlových elektród [21], alebo inkorporovaním chemického markera hypoxie – pimonidazolu [22]. Zistila sa tiež súvislosť s nekrózou, mikrovaskulárnou denzitou a pokročilým štádiom ochorenia u karcinómov hlavy a krku [18]. Zvýšená expresia CA IX v nádorových tkanivách bola tiež spojená so signifikantne zníženou mierou kompletných remisií po liečbe lokálne pokročilých skvamocelulárnych karcinómov hlavy a krku chemorádioterapiou [23].
Častá prítomnosť hypoxie v solídnych nádoroch, ktorá je spojená s aktiváciou HIF ‑ 1, vysvetľuje vysoký výskyt expresie CA IX proteínu u mnohých typov nádorov. Výnimku predstavujú svetlobunkové karcinómy obličiek, u ktorých je CA IX exprimovaná v dôsledku konštitučne aktivovanej signálnej cesty HIF v nádoroch s defektným von ‑ Hippel ‑ Lindauovým proteínom (VHL) a nesúvisí s hypoxiou, čo potvrdzuje aj difúzny vzorec expresie tohto proteínu u obličkových karcinómov [17].
Rozpustná forma CA IX
Zvýšenú expresiu CA IX v nádorovom tkanive je možné jednoducho detekovať pomocou imunohistochemického vyšetrenia bioptickej vzorky. Takýto prístup sa však v klinickej praxi spája s mnohými negatívami. V prvom rade, biopsia sama o sebe predstavuje invazívny zákrok. Takýmto vyšetrením je navyše možné hodnotiť iba tie oblasti nádoru, ktoré sú dobre prístupné pre odber bioptického materiálu. Expresia endogénnych markerov hypoxie v bioptickej vzorke môže odrážať mieru hypoxie v určitom malom objeme tkaniva v určitom krátkom časovom období. Stav okysličenia odobratej vzorky nádorového tkaniva rozhodne nemusí odrážať stav okysličenia celej nádorovej masy. Pre nedostatočnú efektivitu rádioterapie pritom stačí malý okrsok klonogénnych hypoxických rádiorezistentných buniek. Sledovanie dynamiky nádorovej hypoxie a reoxygenácie tkanív počas frakcionovanej rádioterapie pomocou opakovaných biopsií je v klinickej praxi tiež nemysliteľné.
Uvedené negatíva by bolo možné prekonať vyšetrovaním rozpustnej formy CA IX. Rozpustná forma CA IX, detekovateľná v sére a v telesných tekutinách pacienta predstavuje proteín, uvoľňovaný z povrchu buniek proteolytickým odštepovaním extracelulárnej časti transmembránového proteínu CA IX. Túto rozpustnú extracelulárnu doménu CA IX je možné ľahko detekovať v telesných tekutinách pacienta, pomocou metódy ELISA alebo metódou Western blot. Rozpustná forma CA IX sa rýchlo odstraňuje z krvi vylučovaním nezmeneného proteínu do moču a jeho proteolytickou degradáciou [24]. Dôležitým poznatkom je, že v podmienkach hypoxie zostáva rýchlosť bazálneho uvoľňovania extracelulárnej domény CA IX nezmenené, a preto zvýšené množstvo CA IX zaznamenané v extracelulárnom priestore a v telesných tekutinách odráža jeho zvýšenú tvorbu v hypoxických bunkách [25].
Ciele štúdie
Primárnym cieľom štúdie bolo zistiť, či existuje korelácia medzi sérovou hladinou CA IX a reziduálnou nádorovou chorobou nádorov hlavy a krku po liečbe radikálnou rádioterapiou. Sekundárnym cieľom bolo zistiť, ako sa mení sérová hladina CA IX počas frakcionovanej rádioterapie.
Materiál a metódy
Charakteristika sledovaného súboru pacientov
Do tejto prospektívnej monocentrickej klinickej štúdie bolo v období od júna 2011 do januára 2013 zaradených 30 dospelých pacientov (29 mužov a 1 žena) vo veku 50 – 80 rokov s histologicky verifikovanými lokálne pokročilými skvamocelulárnymi karcinómami hlavy a krku III. – IV.B klinického štádia, definovaného podľa 7. vydania TNM klasifikácie zhubných nádorov [26], primárne liečených na Oddelení radiačnej onkológie FN J. A. Reimana v Prešove radikálnou rádioterapiou s kuratívnym zámerom. Všetci pacienti boli liečení konvenčne frakcionovanou externou rádioterapiou v celkovej dávke 70 Gy aplikovanej v 35 frakciách počas siedmich týždňov na lineárnom urýchľovači. Rádioterapia bola aplikovaná buď samostatne, alebo konkomitantne so systémovou liečbou, ktorú predstavovala buď chemoterapia cisplatinou, alebo cielená biologická liečba cetuximabom. Rozhodnutie o aplikácii a výbere konkomitantnej systémovej liečby bolo ponechané na ošetrujúcom lekárovi a záviselo výlučne od klinického stavu pacienta, nezávisle od jeho zaradenia do štúdie. Pacienti boli do štúdie zaraďovaní prospektívne, v poradí v akom prišli na ambulanciu Oddelenia radiačnej onkológie. Všetci pacienti pred zaradením do tejto štúdie boli náležite poučení a podpísali informovaný súhlas. Štúdia bola vopred schválená lokálnou etickou komisiou.
Odber a vyšetrovanie biologického materiálu
Všetkým sledovaným pacientom sa za aseptických podmienok odoberalo po 10 ml venóznej krvi z periférnej žily do štandardnej skúmavky, určenej na biochemické vyšetrenie krvného séra. Vzorky krvi sa následne centrifugovali pri 4 000 otáčkach za minútu počas 10 minút. Získané krvné séra boli zmrazené a dočasne uskladnené pri teplote – 20 °C. Následne boli v zmrznutom stave na suchom ľade transportované na miesto vyšetrenia do Virologického ústavu Slovenskej akadémie vied v Bratislave. Odbery krvi sa robili bezprostredne pred zahájením rádioterapie, v polovici liečby rádioterapiou (t.j. medzi 3. a 4. týždňom liečby), pri ukončení rádioterapie a pri prvej kontrole, ktorá nasledovala šesť týždňov po ukončení rádioterapie.
Vyšetrovanie sérovej koncentrácie rozpustnej formy CA IX sa robilo pomocou metódy ELISA, za použitia komerčne dostupného systému firmy R&D systems, Inc., USA, katalógové číslo DY2188.
Hodnotenie liečebnej odpovede
Rozsah nádorového postihnutia sa hodnotil pred liečbou a šesť týždňov po ukončení liečby rádioterapiou, a to na základe otorinolaryngologického vyšetrenia, doplneného endoskopickými a zobrazovacími vyšetreniami podľa klinickej situácie, najmä ultrasonografiou, počítačovou tomografiou a magnetickou rezonanciou. V prípade nejednoznačného nálezu sa robilo bioptické vyšetrenie.
Štatistická analýza
Vývoj hladiny CA IX v čase bol analyzovaný Skillings ‑ Mackovým testom. Ide o zovšeobecnenie Friedmanovho testu na prípad chýbajúcich meraní [27]. Rozdiely v strednej hodnote CA IX medzi dvoma skupinami boli analyzované nepárovým t‑testom po predchádzajúcej logaritmickej transformácii dát. Hypotézy boli testované na hladine významnosti α = 5 %. Na analýzu dát bol použitý software StatsDirect 3.0.95 a Microsoft Excel 2010.
Výsledky
Do štúdie bolo zaradených spolu 30 pacientov s nádormi hlavy a krku. Pacienti s nádormi nosohltana, nosa a prínosových dutín neboli do štúdie zaraďovaní. Početné zastúpenie jednotlivých anatomických lokalít stratifikáciu podľa TNM dokumentuje tab. 1.
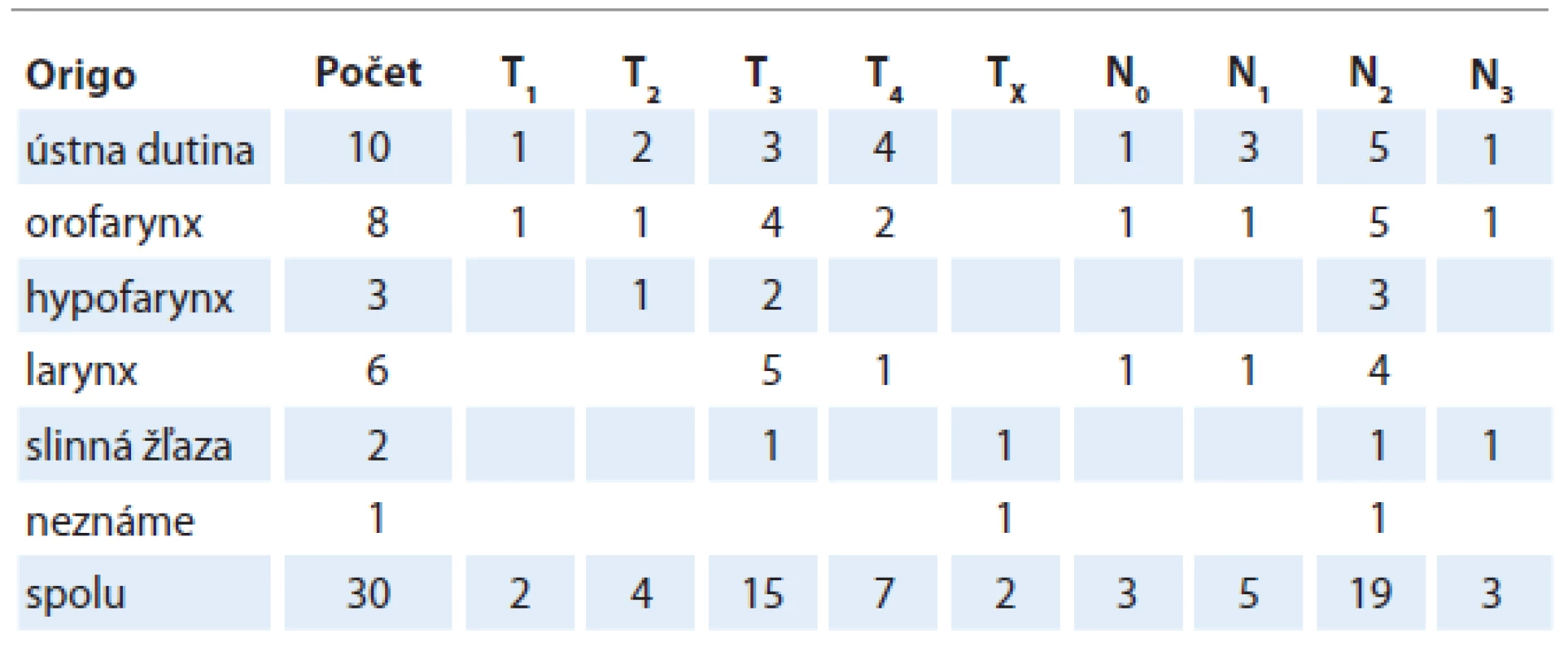
Konkomitantne cetuximab dostávalo 16 pacientov (53,3 %), 11 pacientov (36,7 %) dostávalo konkomitantne cisplatinu a 3 pacienti (10 %) boli liečení samostatnou rádioterapiou, 28 pacientov (93,3 %) dokončilo rádioterapiu v plánovanej dávke a čase. Iba 20 z týchto pacientov (71,4 %) sa však dostavilo na všetky plánované kontroly a odbery krvi v predpísaných časových intervaloch. U všetkých 30 pacientov však bolo možné vyhodnotiť prítomnosť či neprítomnosť reziduálnej nádorovej choroby po liečbe a asociovať ju s hladinou CA IX pred liečbou.
Analýzou získaných výsledkov sme zistili, že existuje výrazná interindividuálna variabilita medzi hodnotami sérových hladín CA IX medzi pacientmi s nádormi hlavy a krku. Namerané hodnoty CA IX v sérach sa pohybovali od 0 do 1 696 pg/ ml. Naproti tomu, zmeny koncentrácie CA IX počas liečby u jednotlivých pacientov (intraindividuálna variabilita) boli štatisticky nesignifikantné – teda bez jednoznačného trendu stúpania alebo klesania koncentrácie (p = 0,56; Skillings ‑ Mackov test) (graf 1).

Jedenásť pacientov (36,7 %) dosiahlo po liečbe kompletnú remisiu ochorenia. U týchto pacientov sme zaznamenali posun k nižším predliečebným hodnotám CA IX v porovnaní s pacientmi s perzistujúcou reziduálnou nádorovou chorobou. Aj keď tento rozdiel vzhľadom na malý počet pacientov nedosiahol štatistickú významnosť (p = 0,154), 95% CI medziskupinového rozdielu v stredných hodnotách zasahuje do klinicky zaujímavej oblasti ( – 18,7 – 98,7) (graf 2).

Zmeny koncentrácií CA IX po liečbe rádioterapiou oproti východiskovým hodnotám neboli štatisticky významné a nekorelovali s efektivitou rádioterapie (p = 0,36). Nezistila sa ani súvislosť medzi zmenou koncentrácie CA IX a konkomitantne podávanou systémovou liečbou (p > 0,05).
Diskusia
Nádorová hypoxia je jedným z kľúčových mechanizmov rezistencie nádorov na rádioterapiu. Súvislosť medzi hypoxiou nádorov hlavy a krku a ich rádiorezistenciou bola preukázaná viacerými klinickými štúdiami, vrátane priameho merania hypoxie pomocou Eppendorfovej kyslíkovej elektródy [7]. Takéto meranie však naráža na mnohé praktické prekážky a možnosti jeho klinického využitia sú veľmi obmedzené.
Z imunohistochemických štúdií vyplýva, že zvýšená expresia CA IX v nádorových tkanivách sa spája s hypoxiou a so zvýšenou agresivitou a invazivitou nádorov [9 – 11]. Expresia CA IX v bioptickej vzorke inoperabilného tumoru ale poskytuje informácie len o určitom veľmi malom objeme nádorového tkaniva, a to v konkrétnom čase biopsie. Malígne nádory sú však výrazne heterogénne a stav ich oxygenácie sa v priebehu rádioterapie mení. Vyšetrovanie koncentrácie rozpustnej formy (extracelulárnej domény) CA IX v krvnom sére metodikou ELISA naproti tomu predstavuje jednoduché, neinvazívne a v klinickej praxi opakovane uskutočniteľné vyšetrenie. Namerané koncentrácie CA IX v sére by mali tiež odrážať stav expresie v celej nádorovej mase.
Na základe dostupných informácií z biomedicínskych databáz konštatujeme, že ide o vôbec prvú prácu, skúmajúcu sérovú koncentráciu rozpustnej formy CA IX u pacientov s nádormi hlavy a krku. Ide tiež o prvú prácu, sledujúcu dynamiku sérovej koncentrácie CA IX počas liečby rádioterapiou.
Publikované informácie týkajúce sa významu sérových hladín CA IX u pacientov s neobličkovými karcinómami sú veľmi obmedzené. Štúdia, hodnotiaca súbor 31 pacientok s karcinómami vulvy liečených chirurgicky, zistila významne horšie bezrelapsové prežívanie u pacientok s vysokou sérovou hladinou CA IX pred operáciou. Vysoká hladina CA IX v sére stanovovaná metódou ELISA tiež významne korelovala s vysokou expresiou CA IX v nádorovom tkanive, hodnotenou imunohistochemicky [28]. Naproti tomu, štúdia skúmajúca predoperačné hladiny CA IX v sére 46 pacientok s karcinómami krčka maternice liečených chirurgicky, nezistila žiadnu koreláciu medzi sérovými hladinami CA IX a imunohistochemicky hodnotenou expresiou CA IX v nádorovom tkanive. Nepotvrdil sa ani prognostický význam zvýšenej sérovej hladiny CA IX pred operáciou, aj keď vysoká expresia CA IX v nádorovom tkanive bola spojená s pokročilým štádiom ochorenia, vysokou invazivitou a nízkou diferenciáciou nádorov [29]. Tí istí autori v inej práci, sledujúcej sérové hladiny CA IX u 37 pacientok s epitelovými karcinómami ovárií pred operáciou, po operácii, počas adjuvantnej chemoterapie a po nej, nezistili žiadne signifikantné zmeny hladín CA IX v sére počas tejto liečby, ani súvislosť s prognózou ochorenia, či hladinou markera CA 12 - 5 [30]. Údaje, týkajúce sa koncentrácií CA IX v sére pacientov s nádormi hlavy a krku, neboli doteraz publikované. Rovnako nie sú známe informácie, týkajúce sa sérových hladín CA IX u ľudí bez malígneho ochorenia.
Záver
V tejto štúdii sme zistili, že existuje výrazná interindividuálna variabilita medzi sérovými koncentráciami CA IX u pacientov s lokálne pokročilými inoperabilnými nádormi hlavy a krku. Napriek relatívne malému počtu sledovaných pacientov sme zaznamenali tendenciu k vyšším hodnotám sérových hladín CA IX u pacientov s lokálnou perzistenciou reziduálnej nádorovej choroby po liečbe rádioterapiou. Sérovú koncentráciu CA IX je preto možné označiť za potenciálny prediktívny marker hypoxie a rádiorezistencie nádorov hlavy a krku. Vyžaduje si to však overenie formou klinickej štúdie na väčšom súbore pacientov. Táto problematika si rozhodne zaslúži ďalšiu pozornosť.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Viktor Rosenberg
Oddelenie radiačnej onkológie
FNsP J. A. Reimana Prešov
Hollého 14
080 01 Prešov
Slovensko
e-mail: viktorrosenberg@gmail.com
Obdrženo: 10. 2. 2014
Přijato: 4. 3. 2014
Sources
1. Šlampa P, Petera J. Radiační onkologie. 1. vyd. Praha: Galén 2007 : 457.
2. Bencová V. Komunikácia ako súčasť suportívnej terapie v onkológii. Klin Onkol 2013; 26(3): 195 – 200.
3. Joiner M, van der Koegel A. Basic clinical radiobiology. 4th ed. London: Hodder Arnold 2009 : 375.
4. Halperin EC, Perez CA, Brady LW et al. Perez and Brady‘s principles and practice of radiation oncology. 5th ed. Philadelphia: Lippincott Williams & Wilkins 2008 : 2106.
5. Brizel DM, Dodge RK, Clough RW et al. Oxygenation of head and neck cancer: changes during radiotherapy and impact on treatment outcome. Radiother Oncol 1999; 53(2): 113 – 117.
6. Gatenby RA, Kessler HB, Rosenblum JS et al. Oxygen distribution in squamous cell carcinoma metastases and its relationship to outcome of radiation therapy. Int J Radiat Oncol Biol Phys 1988; 14(5): 831 – 838.
7. Nordsmark M, Overgaard M, Overgaard J. Pretreatment oxygenation predicts radiation response in advanced squamous cell carcinoma of the head and neck. Radiother Oncol 1996; 41(1): 31 – 39.
8. Nordsmark M, Bentzen SM, Rudat V et al. Prognostic value of tumor oxygenation in 397 head and neck tumors after primary radiation therapy. An international multi‑center study. Radiother Oncol 2005; 77(1): 18 – 24.
9. Isa AY, Ward TH, West CM et al. Hypoxia in head and neck cancer. Br J Radiol 2006; 79(946): 791 – 798.
10. Stadler P, Becker A, Feldmann HJ et al. Influence of the hypoxic subvolume on the survival of patients with head and neck cancer. Int J Radiat Oncol Biol Phys 1999; 44(4): 749 – 754.
11. Teicher BA. Hypoxia and drug resistance. Cancer Metastasis Rev 1994; 13(2): 139 – 168.
12. Raleigh JA, Dewhirst MW, Thrall DE. Measuring tumor hypoxia. Semin Radiat Oncol 1996; 6(1): 37 – 45.
13. Gunderson LL, Tepper JE. Clinical radiation oncology. 3rd ed. Philadelphia: Saunders 2012 : 1638.
14. Vordermark D, Brown JM. Endogenous markers of tumor hypoxia predictors of clinical radiation resistance? Strahlenther Onkol 2003; 179(12): 801 – 811.
15. Hoogsteen IJ, Marres HA, Bussink J et al. Tumor microenvironment in head and neck squamous cell carcinomas: predictive value and clinical relevance of hypoxic markers. A review. Head Neck 2007; 29(6): 591 – 604.
16. Parkkila S. Significance of pH regulation and carbonic anhydrases in tumour progression and implications for diagnostic and therapeutic approaches. BJU Int 2008; 101 (Suppl 4): 16 – 21. doi: 10.1111/ j.1464 ‑ 410X.2008.07643.x.
17. Pastoreková S, Parkkila S, Závada J. Tumor‑associated carbonic anhydrases and their clinical significance. Adv Clin Chem 2006; 42 : 167 – 216.
18. Beasley NJ, Wykoff CC, Watson PH et al. Carbonic anhydrase IX, an endogenous hypoxia marker, expression in head and neck squamous cell carcinoma and its relationship to hypoxia, necrosis, and microvessel density. Cancer Res 2001; 61(13): 5262 – 5267.
19. Bussink J, Kaanders JH, van der Kogel AJ. Tumor hypoxia at the micro‑regional level: clinical relevance and predictive value of exogenous and endogenous hypoxic cell markers. Radiother Oncol 2003; 67(1): 3 – 15.
20. Ivanov S, Liao SY, Ivanova A et al. Expression of hypoxia ‑ inducible cell ‑ surface transmembrane carbonic anhydrases in human cancer. Am J Pathol 2001; 158(3): 905 – 919.
21. Loncaster JA, Harris AL, Davidson SE et al. Carbonic anhydrase (CA IX) expression, a potential new intrinsic marker of hypoxia: correlations with tumor oxygen mea-surements and prognosis in locally advanced carcinoma of the cervix. Cancer Res 2001; 61(17): 6394 – 6399.
22. Airley RE, Loncaster J, Raleigh JA et al. GLUT ‑ 1 and CA IX as intrinsic markers of hypoxia in carcinoma of the cervix: relationship to pimonidazole binding. Int J Cancer 2003; 104(1): 85 – 91.
23. Koukourakis MI, Giatromanolaki A, Sivridis E et al. Hypoxia ‑ regulated carbonic anhydrase ‑ 9 (CA9) relates to poor vascularization and resistance of squamous cell head and neck cancer to chemoradiotherapy. Clin Cancer Res 2001; 7(11): 3399 – 3403.
24. Závada J, Závadová Z, Zaťovičová M et al. Soluble form of carbonic anhydrase IX (CA IX) in the serum and urine of renal carcinoma patients. Br J Cancer 2003; 89(6): 1067 – 1071.
25. Zaťovičová M, Sedláková O, Švastová E et al. Ectodomain shedding of the hypoxia‑induced carbonic anhydrase IX is a metalloprotease ‑ dependent process regulated by TACE/ ADAM17. Br J Cancer 2005; 93(11): 1267 – 1276.
26. Sobin LH, Gospodarowicz MK, Wittekind C. TNM Classification of malignant tumours. 7th ed. Chichester: Wiley ‑ Blackwell 2010 : 336.
27. Skillings JH, Mack GA. On the use of a Friedman ‑ type statistic in balanced and unbalanced block designs. Technometrics 1981; 23(2): 171 – 177.
28. Kock L, Mahner S, Choschzick M et al. Serum carbonic anhydrase IX and its prognostic relevance in vulvar cancer. Int J Gynecol Cancer 2011; 21(1): 141 – 148. doi: 10.1097/ IGC.0b013e318204c34f.
29. Woelber L, Kress K, Kersten JF et al. Carbonic anhydrase IX in tumor tissue and sera of patients with primary cervical cancer. BMC Cancer 2011; 11 : 12. doi: 10.1186/ 1471 ‑ 2407 ‑ 11 ‑ 12.
30. Woelber L, Mueller V, Eulenburg C et al. Serum carbonic anhydrase IX during first‑line therapy of ovarian cancer. Gynecol Oncol 2010; 117(2): 183 – 188. doi: 10.1016/ j.ygyno.2009.11.029.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2014 Issue 4
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Paraneoplastická vaskulitída u pacientky s karcinómom krčku maternice
- Akupunktura v léčbě symptomů onkologického onemocnění v západním světě
- Dendritické buněčné vakcíny proti nemalobuněčnému karcinomu plic – nová terapeutická alternativa
- Pacient s Cowdenovým syndromem způsobeným mutací v genu PTEN (archiv 2. LF UK a FN v Motole)
- Předpokládaná účinnost HPV vakcinace v profylaxi nongenitálních karcinomů
- Analýza nákladů na 1. linii léčby metastatického kolorektálního karcinomu při podání režimů s bevacizumabem – data z reálné klinické praxe v České republice
- Screening rizika malnutrice versus ukazatelé nutričního stavu a systémové zánětlivé odpovědi u pacientů s nově diagnostikovaným karcinomem plic
- Vzťah medzi sérovou hladinou karboanhydrázy IX, hypoxiou a rádiorezistenciou nádorov hlavy a krku
- Brazilský příběh mutace p53 R337H
- Vliv anakinry na cytokinové profily a profily lymfocytů/ monocytů u pacienta s Erdheim-Chesterovou nemocí
- Pozitronová emisní tomografie kombinovaná s počítačovou tomografií pro diagnózu synchronních nádorů
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Brazilský příběh mutace p53 R337H
- Akupunktura v léčbě symptomů onkologického onemocnění v západním světě
- Paraneoplastická vaskulitída u pacientky s karcinómom krčku maternice
- Screening rizika malnutrice versus ukazatelé nutričního stavu a systémové zánětlivé odpovědi u pacientů s nově diagnostikovaným karcinomem plic
