Protinádorové zbraně imunitního systému
Anti‑tumour Weapons of the Immune System
Background:
Immune system is principally capable to recognize and eliminate tumor cells, using several mechanisms (phagocytes, antibodies, NK-cells, cytotoxic T‑lymphocytes). These immune weapons are usually not sufficiently efficient as tumor cells are mostly evaluated by the immune system as too similar to normal cells and the tumor microenvironment is very immunosuppressive.
Conclusion:
Recent marked progress in elucidation of mechanisms underlying the relationships between the immune system and tumor cells made it possible to develop a number of very promising immunotherapeutic approaches, including monoclonal antibodies recognizing tumor antigens, antibodies blocking T ‑ cell inhibitory receptors, bispecific antibody constructs, in vitro expansion and stimulation of tumor specific T‑lymphocytes, chimeric antigenic receptors expressed in T ‑ cells or dendritic cell‑based vaccines. Immunotherapy of neoplastic diseases is apparently becoming reality.
Key words:
tumor antigens – immunological surveillance – immunotherapy – monoclonal antibodies – macrophages – lymphocyte activation – NK-cells – T‑lymphocytes regulatory
This study was supported by the grant GACR No. P302-12-G101.
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted:
27. 7. 2015
Accepted:
25. 8. 2015
Authors:
V. Hořejší
Authors‘ workplace:
Ústav molekulární genetiky AV ČR, v. v. i.
Published in:
Klin Onkol 2015; 28(Supplementum 4): 15-22
Category:
Generals
doi:
https://doi.org/10.14735/amko20154S15
Overview
Východiska:
Imunitní systém je principiálně schopen rozpoznávat a eliminovat nádorové buňky. Používá k tomu řadu mechanizmů (fagocyty, protilátky, NK buňky, cytotoxické T lymfocyty). Tyto zbraně imunitního systému však většinou nejsou dostatečně účinné, protože nádorové buňky bývají imunitním systémem vyhodnoceny jako příliš podobné buňkám normálním a protože nádorové prostředí je silně imunosupresivní.
Cíl:
Cílem tohoto článku je podat velmi stručně základní přehled o buněčných a molekulárních mechanizmech používaných imunitním systémem v boji proti nádorovým onemocněním a jejich využití pro vývoj moderních terapeutických přístupů.
Závěr:
Recentní výrazný pokrok v poznání mechanizmů vztahů mezi imunitním systémem a nádorovými buňkami umožnil vývoj nových imunoterapeutických přístupů zahrnujících monoklonální protilátky rozeznávající nádorové antigeny, protilátky blokující inhibiční receptory T lymfocytů, bispecifické protilátkové konstrukty, pomnožení a stimulaci nádorově specifických T lymfocytů in vitro, chimérické antigenní receptory exprimované v T lymfocytech či vakcíny založené na dendritických buňkách. Zdá se, že imunoterapie nádorových onemocnění se skutečně stává realitou.
Klíčová slova:
nádorové antigeny – imunitní dozor – imunoterapie – monoklonální protilátky – makrofágy – aktivace lymfocytů – NK buňky – regulační T lymfocyty
Úvod
Imunitní systém by měl organizmus chránit před různými nebezpečími vnějšího i vnitřního původu. Stěžejní význam má samozřejmě obrana proti infekčním onemocněním, ale imunitní systém likviduje i jiná nebezpečí – např. odstraňuje poškozené a odumírající buňky. Výrazné ohrožení představují samozřejmě také buňky nádorové. Ty se více nebo méně liší od normálních buněk, ze kterých vznikly, a proto by teoreticky měly být rozpoznány imunitními mechanizmy a eliminovány. Obecně ovšem platí, že imunitní mechanizmy jsou v obraně proti nádorům ve srovnání s mechanizmy antiinfekčními poměrně neúčinné. To je způsobeno přílišnou podobností nádorových buněk buňkám normálním, takže je imunitní systém víceméně toleruje, ba dokonce chrání jako normální tkáně. Krom toho jsou nádorové buňky vybaveny řadou mechanizmů, jimiž se útokům imunitních zbraní úspěšně brání. Pokud jsou tyto problémy překonány, může imunitní systém zapojit do boje proti nádorům v zásadě všechny zbraně, které používá třeba v boji proti virovým infekcím.
Nádorové antigeny
Základním předpokladem reakce imunitního systému s nádorovými buňkami je existence povrchových antigenů, které by umožnily imunitnímu systému jejich rozpoznání. Jsou známy dva typy nádorových antigenů: antigeny specifické pro nádory (tumor ‑ specific antigens – TSA) a antigeny asociované s nádory (tumor‑associated antigens – TAA) [1].
Mezi TSA patří molekuly, které se na normálních buňkách vůbec nevyskytují, jako např.:
- Komplexy HLA (human leucocyte antigen) molekul I. třídy (hlavně HLA‑A, HLA‑B) s abnormálními fragmenty buněčných proteinů (produkty mutovaných genů, resp. produkty abnormálního štěpení normálních proteinů v nádorové buňce). Takovéto TSA jsou typické pro chemicky indukované nádory a pro některé leukemie asociované s chromozomálními translokacemi, které produkují specifický abnormální protein (např. fúzní protein Bcr ‑ Abl vznikající přepisem fúzního genu na tzv. filadelfském chromozomu, produktu translokace mezi chromozomy 9 a 22).
- Komplexy HLA molekul s fragmenty proteinů onkogenních virů (u nádorů vyvolaných viry, jako je polyoma virus, SV40, EBV).
- Abnormální formy glykoproteinů; glykosylace, zejména sialylace (tj. připojování molekul kyseliny sialové na konce oligosacharidových řetězců) povrchových glykoproteinů mnohých nádorových buněk je odlišná od buněk normálních.
- Idiotopy myelomů a lymfomů; tyto druhy nádorových buněk odvozených od B, resp. T lymfocytů mají na povrchu klonotypické antigenně specifické receptory BCR, resp. TCR, jejichž vazebná místa jsou unikátními antigenními strukturami.
TAA nejsou výlučně specifické pro nádorové buňky, ale nacházejí se i na některých normálních buňkách, většinou původem velmi odlišných od příslušných buněk nádorových. Tyto TAA, popř. jejich solubilní formy uvolňované z povrchu nádorových buněk slouží jako užitečné diagnostické markery.
Mezi nejznámější TAA patří např.:
- Onkofetální antigeny přítomné na (resp. v) normálních embryonálních buňkách, v postnatálním období mizí a objevují se pouze na některých nádorových buňkách. Patří sem α ‑ fetoprotein (AFP) sekretovaný hepatomy a karcinoembryonální antigen (CEA) produkovaný buňkami karcinomu tlustého střeva.
- některé melanomové antigeny (MAGE ‑ 1, Melan ‑ A), které jsou silně exprimovány na melanomových buňkách, v menším množství na normálních melanocytech nebo jiných buňkách (testikulární tkáně).
- Antigen ERBB2 – receptor růstového faktoru epiteliálních buněk, který je v malém množství přítomen na normálních epiteliálních buňkách; na buňkách některých karcinomů mléčné žlázy je exprimován silně.
- Adhezivní molekula epiteliálních buněk EPCAM (silná exprese na metastázách karcinomů).
- Diferenciační antigeny leukemických buněk, které jsou přítomny na normálních buňkách vývojové řady leukocytů v těch diferenciačních stadiích, z nichž jsou leukemické buňky odvozeny. Nejznámější je povrchový antigen akutních lymfoblastických leukemií CALLA (common acute lymphoblastoid leukaemia antigen; CD10), charakteristický antigen pre‑B buněk.
Protinádorové imunitní mechanizmy
Vzhledem k tomu, že maligní buňky jsou odvozeny od buněk normálních, sdílejí s nimi většinu povrchových antigenů, které jsou ovšem imunitním systémem tolerovány jako organizmu vlastní. Pokud je však abnormalita nádorových buněk imunitním systémem rozpoznána, mohou se na boji s nimi podílet v zásadě všechny hlavní imunitní mechanizmy: nespecifické (neutrofilní granulocyty, aktivované makrofágy, NK buňky) i antigenně specifické (opsonizační protilátky aktivující komplement, aktivující fagocytózu a buněčnou cytotoxicitu; zánětlivé Th1 a cytotoxické ( Tc) buňky).
Imunitní dozor
Klasickým pojmem nádorové imunologie je „imunitní dozor“, tj. hypotéza, že nádorově transformované buňky ve tkáních běžně vznikají a jsou průběžně eliminovány imunitním systémem [2]. U pacientů s poruchami specifické buněčné imunity (vrozené, resp. získané imunodeficience) bývá výrazně zvýšeno zvláště riziko nádorů vyvolaných viry. To ukazuje, že antigenně specifické imunitní mechanizmy kontrolují přinejmenším tento druh nádorů, resp. spíše primární virová onemocnění, která nakonec mohou v některých buňkách vyústit i v nádorové přeměny. U imunodeficientních jedinců existuje však i poněkud zvýšené riziko vzniku spontánních a chemicky indukovaných nádorů (bez virové etiologie). To bylo prokázáno také ve studiích s geneticky modifikovanými zvířaty, jimž chybí nebo nefungují T, B, NK nebo NK T lymfocyty [3].
Aktivované makrofágy
Důležitou funkcí makrofágů je odstraňování (fagocytóza) pozůstatků odumřelých normálních i nádorových buněk a někdy i aktivní zabíjení abnormálních buněk (hlavně ve spolupráci s opsonizačními protilátkami). Makrofágy se také podílejí na vzniku zánětlivých reakcí a jsou významnými producenty několika cytokinů, což se komplikovaným způsobem uplatňuje při interakci imunitního systému s nádory.
Existují nejméně dva typy aktivovaných makrofágů. Pod vlivem prozánětlivého cytokinu interferonu ‑ γ (IFN‑γ) vznikají makrofágy typu M1 produkující hlavně interleukin‑12 (IL‑12), které efektivně fagocytují a degradují zbytky odumřelých buněk a imunokomplexy v místě poškození tkání a umí i likvidovat pohlcené mikroorganizmy. Krom toho jimi produkovaný IL‑12 podporuje další rozvoj zánětlivého procesu, protože stimuluje T lymfocyty a NK buňky.
Naproti tomu pod vlivem cytokinů IL‑4 a IL‑13 vznikají z klidových makrofágů buňky typu M2, jejichž hlavní funkcí je napomáhat hojení a regeneraci tkání poškozených poraněním nebo mikrobiální infekcí; produkují hlavně protizánětlivé cytokiny IL‑10 a TGF‑β.
Makrofágy obvykle ve značném množství infiltrují nádory a jejich role je zde spíše negativní, jelikož bývají hlavně typu M2. Imunitní systém v tomto případě zjevně nepatřičně vyhodnocuje nádorovou tkáň jako poškozenou, zraněnou, které je potřeba pomoci. Makrofágy asociované s nádory tak dosti výrazně podporují růst nádorů, angiogenezi, ale i schopnost buněk primárního nádoru metastazovat [4]. pacienti s nádory silně infiltrovanými makrofágy mívají horší prognózu než ti s infiltrací slabou.
Podobný protektivní účinek mají také makrofágům poněkud podobné, tzv. myeloidní tlumivé buňky (myeloid ‑ derived suppressor cells – MDSC), které infiltrují nádory a potlačují v nich protinádorové imunitní mechanizmy [5].
NK buňky
NK buňky (natural killer – „přirozený zabíječ“) byly popsány jako lymfocyty, které jsou schopny rychle (bez předchozí stimulace, proliferace a diferenciace) zabíjet některé nádorové a virově infikované buňky, a to mechanizmy velmi podobnými těm, které používají i cytotoxické T lymfocyty (Tc, viz níže) [6]. Na rozdíl od T a B lymfocytů nemají NK buňky antigenně specifické receptory; abnormální buňky (nádorové a některé virově infikované) rozeznávají podle toho, že mají na povrchu abnormálně málo HLA molekul I. třídy (HLA‑A, -B, -C) a krom toho mají na svém povrchu zvýšené množství povrchových proteinů rozeznávaných jejich aktivačními receptory, mezi které patří molekuly zvané NKG2D, CD94, NKp46, NKp44 či NKp30. Signály poskytnuté těmito receptory aktivují NK buňky k vylití obsahu jejich cytoplazmatických cytotoxických granulí na kontaktovanou nádorovou buňku. Podobně působí i signalizace přes aktivační Fc receptor CD16. Ten interaguje s Fc částmi protilátkových molekul navázaných na povrch nádorových buněk a následně spouští degranulaci NK buněk. Tento mechanizmus je znám jako ADCC (antibody ‑ dependent cellular cytotoxicity) [7].
Protilátky
Protilátky se v protinádorové obraně uplatňují především tak, že se navazují na povrchové nádorové antigeny (typu TSA či TAA), tím je opsonizují, a tak umožňují jejich napadání fagocyty (makrofágy M1, neutrofilní granulocyty) či NK buňkami (mechanizmus ADCC – viz výše). Uplatňovat se může také aktivace komplementu: protilátky některých izotypů navázané na povrch nádorové buňky mohou aktivovat klasickou cestu komplementu, což přispívá k opsonizaci, chemotaxi fogocytů, rozvoji zánětlivé reakce a finálně i k osmotické lýze membranolytickým komplexem komplementu. Vazba protilátek na určité povrchové receptory může vyvolat v takto napadené nádorové buňce i její apoptotickou smrt. Zásadně důležité je, že pro vznik kvalitních vysokoafinních protilátek proti nádorovým antigenům nestačí, aby tyto nádorové antigeny byly rozpoznány specifickými B lymfocyty pomocí jejich antigenně specifických receptorů (B ‑ cell receptor – BCR). Nezbytná je spolupráce těchto B lymfocytů s pomocnými T lymfocyty, které jim dodávají nepostradatelné kostimulační signály. Proto je nutné, aby nádorové antigeny (resp. jejich peptidové fragmenty navázané na HLA proteiny) byly těmto pomocným buňkám předkládány zpravidla prostřednictvím zralých dendritických buněk (viz níže).
T lymfocyty
K nejdůležitějším imunitním protinádorovým zbraním patří cytotoxické T lymfocyty (Tc) [8]. Ty rozeznávají pomocí svých antigenně specifických receptorů (T-cell receptor – TCR) buňky infikované viry nebo jinými intracelulárními parazity, popř. buňky jinak abnormální (poškozené stresem, některé nádorové buňky) a ničí je mechanizmy závislými na bezprostředním těsném kontaktu mezi Tc a napadanou buňkou nebo prostřednictvím sekretovaných produktů.
Imunitní odpovědi založené na Tc (ale i na jiných typech T lymfocytů a de facto i na B lymfocytech spolupracujících s pomocnými T lymfocyty) jsou zahajovány v lymfatických uzlinách tak, že příslušné antigenně specifické T lymfocyty musí nejprve rozeznat komplexy HLA proteinů I., resp. II. třídy s antigenními peptidy (např. fragmenty virových proteinů nebo produktů onkogenů) na povrchu aktivovaných, zralých buněk prezentujících antigen (antigen presenting cell – APC), které musí mít patřičné adhezivní molekuly a kostimulační molekuly (ligandy několika kostimulačních receptorů T lymfocytů, z nichž nejdůležitější je CD28). Takovými APC mohou být hlavně dendritické buňky, případně také makrofágy nebo aktivované B lymfocyty. Tyto APC pohltí příslušné antigeny, které pocházejí z infikovaných, nádorových nebo stresovaných buněk, rozštěpí je na peptidové fragmenty, které pak vystaví na svém povrchu v komplexu s HLA molekulami. Pokud prekurzorový T lymfocyt rozezná takovýto antigen na povrchu jiných buněk, které nemají stimulační vlastnosti profesionálních APC (typicky naprostá většina nádorových buněk), dostane pouze první signál (přes svůj TCR) a žádný kostimulační signál. To ji utlumí, nebo u ní dokonce navodí apoptotickou smrt. Dojde‑li tedy k prvnímu kontaktu s antigenem na povrchu kvalitní APC, prekurzory Tc začnou proliferovat a diferencovat na klon zralých efektorových cytotoxických buněk (Tc). Poruchy účinné prezentace nádorových antigenů T lymfocytům jsou jednou z hlavních příčin selhávání imunitní obrany proti nádorům.
Zralé efektorové Tc jsou roznášeny krevním oběhem do tkání, kde mohou začít působit – tedy např. zabíjet nádorové buňky, které mají na svém povrchu správné komplexy HLA proteinů s fragmenty nádorových antigenů. Takovéto zralé Tc jsou už k aktivaci cytotoxických mechanizmů stimulovány pouze jedním signálem (přes TCR, kostimulační signál přes CD28 už není potřebný).
Tc podobně jako NK buňky používají tři druhy cytotoxických mechanizmů:
- V cytoplazmě zralých Tc se nachází množství cytotoxických granulí (specializovaných lysozomů), které obsahují protein perforin a proteázy zvané granzymy. Poté, co Tc lymfocyt rozezná pomocí adhezivních molekul a TCR „vadnou“ buňku, obsah granulí se uvolňuje do úzké štěrbiny mezi oběma buňkami (dochází k „degranulaci“), perforin vytváří v plazmatické membráně napadené buňky póry, kterými do buňky proniknou molekuly granzymů. Ty pak spustí kaskády reakcí kulminující v apoptotickou smrt takto zasažené buňky.
- Na povrchu Tc se nachází protein zvaný Fas‑ligand (FasL). FasL se váže na „apoptotický receptor“ Fas (CD95) přítomný na povrchu mnoha různých typů buněk, včetně buněk nádorových. Interakce FasL s receptorem Fas aktivuje v napadené buňce apoptotické mechanizmy.
- Oba předešlé způsoby vyžadují individuální kontakt cílové buňky s cytotoxickým lymfocytem. Tc používají k zabíjení cílových buněk také své sekretované produkty, zejména cytokin lymfotoxin (LT, TNF‑β), který působí podobně jako FasL (indukuje apoptózu).
Kromě buněk Tc se v protinádorových imunitních reakcích uplatňují jako pomocné buňky také subpopulace Th1 a Th17, které produkují řadu prozánětlivých cytokinů (např. IL‑2, IFN ‑ γ, IL‑6, IL‑17) a podporují vyzrávání Tc.
Imunitní mechanizmy tlumící protinádorové reakce
Pro průběh protinádorových imunitních reakcí má zásadní význam existence několika typů mechanizmů, které imunitní reakce tlumí. Ty jsou obecně důležité proto, aby imunitní odpovědi nebyly provázeny příliš intenzivními sebepoškozujícími imunopatologickými reakcemi. V případě protinádorových odpovědí jsou ale tyto „bezpečnostní pojistky“ příčinou obvykle nedostatečné účinnosti protinádorových imunitních mechanizmů.
První typ tlumivých mechanizmů je založen na několika inhibičních receptorech na povrchu aktivovaných T lymfocytů, především molekulách zvaných CTLA ‑ 4 a PD ‑ 1. Ty se vážou na ligandy (CD80 a CD86 v případě CTLA ‑ 4, PD ‑ L1 a PD-L2 v případě PD ‑ 1), které se vyskytují na površích různých buněk, včetně APC a mnohých nádorových buněk. Interakce mezi inhibičními receptory a jejich ligandy vede prostřednictvím dobře prozkoumaných mechanizmů k utlumení aktivace T lymfocytů.
Další velmi důležitý mechanizmus negativní regulace imunitních odpovědí je založen na několika typech tzv. regulačních T lymfocytů (Treg) [9]. Tyto buňky jsou schopny potlačovat aktivity jiných efektorových T lymfocytů, ale i některých dalších buněk imunitního systému. Nejlépe prozkoumány jsou tzv. přirozené regulační CD4+ T lymfocyty (Treg), které vznikají v thymu, tvoří zhruba 5 % krevních lymfocytů a nesou „autoreaktivní“ TCR. Na rozdíl od jiných autoreaktivních T lymfocytů však vlastní tkáně nejen nenapadají, ale naopak potlačují autoimunitní reakce. Mechanizmy jejich působení jsou založeny hlavně na produkci tlumivých cytokinů (IL‑10, TGF‑β), ale působí také přímým kontaktem s jinými buňkami. Defekty Treg vedou ke vzniku autoimunitních onemocnění. Podobné tlumivé vlastnosti má zřejmě malá, dosud méně dobře prostudovaná subpopulace CD8+ T lymfocytů, pravděpodobně odpovídající buňkám dříve zvaným supresorové, resp. tlumivé T lymfocyty (Ts) [10]. Buňky Treg velmi účinně tlumí protinádorové imunitní mechanizmy, protože nádorové buňky jsou jimi rozpoznávány jako buňky vlastní, zasluhující ochrany.
Důležitý tlumivý účinek mají také výše zmíněné makrofágy typu M2 a buňky MDSC zmíněné výše (odstavec Aktivované makrofágy).
Mechanizmy odolnosti nádorů vůči imunitnímu systému
Různé typy nádorových buněk se liší způsoby, kterými se mohou vyhnout útoku imunitního systému [11]. Řada mechanizmů úniku je analogická s únikovými mechanizmy infekčních mikroorganizmů. Nejdůležitější z nich jsou:
- Nádorové buňky jsou značně variabilní (vznik mutantních forem, které ztratily nádorový antigen a stávají se pro imunitní systém „neviditelnými“).
- Mnohé nádory produkují faktory inhibující T lymfocyty i jiné imunitní buňky (rozpustné formy nádorových antigenů odvržené z povrchu, cytokiny s inhibičním účinkem, např. TGF‑β, IL‑10).
A jak již bylo uvedeno výše, nádorové buňky navíc nefungují jako profesionální APC a naopak využívají působení regulačních (tlumivých) T lymfocytů (Treg), makrofágy typu M2 a MDSC, které chrání nádory podobně jako normální tkáně.
Možnosti imunoterapie nádorů
Dá se říci, že jako více či méně perspektivní se dnes jeví využití prakticky všech výše uvedených známých zbraní imunitního systému, a to jak jednotlivých, tak v kombinaci s konvenčnějšími postupy.
„Nespecifická“ stimulace imunitních mechanizmů
Empirické zkušenosti již dávno indikovaly, že v některých případech intenzivní anti‑infekční imunitní reakce mohou být provázeny regresí nádorů. To vedlo k pokusům vyprovokovat takovouto protinádorovou reakci pomocí úmyslně navozeného horečnatého infekčního onemocnění; výsledky této nebezpečné metody byly sice sporné, ale některé její aspekty jsou dále rozvíjeny [12]. Na podobném principu je založena i schválená metoda instilační imunoterapie povrchových nádorů močového měchýře pomocí nálevů obsahujících oslabené živé mykobakterie (BCG). Tento postup vede zřejmě k aktivaci několika typů imunocytů, které více či méně úspěšně likvidují nádorové buňky [13].
Pozoruhodné je, že některá chemoterapeutika (např. imatinib mesylát, cyklofosfamid, antracykliny, 5 - fluorouracil) i určité režimy ozařování mají překvapivě imunostimulační účinky – nádorové buňky hynou jejich působením „imunogenním způsobem“. Ten je charakterizován hlavně stresovou reakcí endoplazmatického retikula a prezentací intracelulárních molekul „signálů nebezpečí“ [14].
Potlačení makrofágů typu M2 a buněk MDSC asociovaných s nádory
Je nasnadě, že ke zvýšení úspěšnosti terapie nádorových onemocnění by mohlo přispět odstranění makrofágů typu M2 (a buněk MDSC) z nádorů, resp. jejich nahrazení makrofágy typu M1 [15]. Jednou možnou cestou je zabránit infiltraci nádorů krevními monocyty, jež se v nádorové tkáni přemění v makrofágy M2. Toho lze dosáhnout pomocí protilátek blokujících chemokin (chemotaktický cytokin) CCL2 produkovaný nádorovými buňkami, který vábí monocyty. V experimentálním myším modelu to skutečně vede k výraznému potlačení rozsevu primárního nádoru mléčné žlázy. Neočekávanou komplikací však bylo, že po skončení protilátkové terapie se nejen rychle obnovil metastatický proces, ale dokonce byl ještě intenzivnější – důvodem zřejmě byla snaha nádorových buněk kompenzovat ztrátu funkčního CCL2 jeho zvýšenou produkcí [16].
Poněkud paradoxní komplikací standardních terapií nádorových onemocnění může být to, že nádorové buňky odumírající v důsledku radio ‑ či chemoterapie apoptoticky výrazně stimulují makrofágy přítomné v nádoru a v jeho blízkosti k posílení jejich M2 charakteru, tedy k posílení jejich vlastností podporujících růst nádoru. Je tedy pravděpodobné, že mnohé terapie nádorů vyvolávají dva protichůdné mechanizmy – na jedné straně navozují žádoucí apoptotickou smrt nádorových buněk, ale na druhé straně těm odolnějším vytvářejí paradoxně lepší podmínky pro další růst. Pokud by se podařilo nějakým způsobem zamezit oné nežádoucí interakci apoptotických nádorových buněk s makrofágy, mohlo by to významně zvýšit účinnost některých terapeutických metod [17].
Protilátky proti některým TSA nebo TAA
V současné době se rutinně používá řada protinádorových monoklonálních protilátek a ve fázi preklinického výzkumu nebo klinických studií je celá řada dalších. Mechanizmy jejich působení zahrnují většinu fyziologických funkcí protilátek, jako je blokování receptorů růstových faktorů nádorových buněk, opsonizace, aktivace fagocytů a NK buněk prostřednictvím Fc ‑ receptorů (mechanizmus zvaný ADCC, tedy „antibody ‑ dependent cellular cytotoxicity“), aktivace komplementu, indukce apoptózy.
Pro klinické použití je nutné, aby terapeutické monoklonální protilátky (obvykle primárně myšího původu) byly genetickými manipulacemi maximálně „humanizovány“, tedy aby byly strukturně co nejpodobnější protilátkám lidským. Tím se minimalizuje imunogennost těchto preparátů v organizmu pacienta. Komplikací je možnost poškození normálních tkání (monoklonální protilátka je obvykle zaměřena proti TAA) a imunoselekce rezistentních variant nádorových buněk.
Poměrně úspěšně se klinicky používají (většinou v kombinaci s jinými terapeutickými prostředky) zejména např. následující monoklonální protilátky (v závorce příslušný antigen a onemocnění) [18 – 20]:
- trastuzumab, pertuzumab (ERBB2; karcinom prsu),
- rituximab, tositumomab (CD20; lymfomy),
- alemtuzumab (CD52; chronická lymfocytická leukemie),
- bevacizumab (VEGF; metastatický karcinom tlustého střeva, v kombinaci s jinými léčivy i některé jiné druhy nádorů; je třeba poznamenat, že zde se nejedná o nádorový antigen, ale o růstový faktor),
- cetuximab, panitumumab (EGFR; kolorektální karcinom).
Kromě samotných monoklonálních protilátek je možno použít i jejich konjugátů s účinnými toxiny (konjugáty se nazývají imunotoxiny) nebo radioizotopy (radioimunotoxiny). Příkladem je gemtuzumab ozogamicin (konjugát monoklonální protilátky proti antigenu myeloidních buněk CD33 s cytostatikem kalicheamycinem) použitelný k léčbě myeloidních leukemií nebo tositumomab ‑ 131I (konjugát monoklonální protilátky proti antigenu B lymfocytů CD20 s radioizotopem 131I). U těchto preparátů protilátka zanese toxin či radioizotop specificky do místa nádoru, čímž se snižuje nespecifické postižení zdravých tkání.
Protilátky blokující tlumivé receptory T lymfocytů
Jako neobyčejně perspektivní se v poslední době jeví použití monoklonálních protilátek blokujících tlumivé receptory T lymfocytů, především CTLA ‑ 4 a PD ‑ 1. Tento přístup vede k „odblokování“ nádorově specifických T lymfocytů a výraznému zvýšení jejich protinádorové aktivity. Schváleny, resp. v pokročilých fázích testování jsou např. následující preparáty této třídy (v závorce příslušný cílový inhibiční receptor a onemocnění) [21]:
- ipilimumab, tremelimumab (CTLA ‑ 4; karcinomy, melanomy, lymfomy),
- pembrolizumab, nivolumab (PD ‑ 1; karcinomy, melanomy, lymfomy, glioblastomy).
Krom toho probíhá řada klinických testů ověřujících potenciál monoklonálních protilátek proti PD ‑ L1 nebo proti dalšímu inhibičnímu receptoru LAG3 a ještě více preklinických studií zaměřených na řadu dalších potenciálně nadějných povrchových receptorů T lymfocytů (TIM3/ CD366, CD200, TIGIT, BTLA/ CD272, B7 - H3/ CD272, B7 - H5/ VISTA) [21].
Bispecifické protilátkové konstrukty
Jako nadějné se jeví také použití uměle konstruovaných bispecifických monoklonálních protilátek, jejichž jedno vazebné místo rozeznává nádorový antigen a druhé se váže na některou molekulu na povrchu T či NK buněk (CD3, CD2, CD16). Takovéto konstrukty (nazývané často bispecific T ‑ cell engagers – BiTEs) jsou schopny přivést do těsného kontaktu nádorové buňky s velkým počtem T lymfocytů nebo NK buněk, přičemž tyto efektorové buňky nemusí být vybaveny receptory specificky rozpoznávajícími cokoli na povrchu nádorové buňky. Poněkud překvapivě stačí, aby takovýto uměle navozený kontakt mezi nádorovou buňkou a „nespecifickým“ lymfocytem plně aktivoval jeho cytotoxické mechanizmy vedoucí k likvidaci napadené nádorové buňky. Původní nepříliš účinné konstrukty byly založeny na spojení celých monoklonálních protilátek, případně jejich Fab fragmentů. Optimální výsledky byly v poslední době dosaženy teprve s konstrukty složenými z minimálních Fv fragmentů příslušných monoklonálních protilátek (tj. fragmentů skládajících se z variabilních domén těžkého a lehkého řetězce, které vytvářejí specifické vazebné místo) spojených flexibilním linkerem 20 aminokyselin (sekvence GGGGSGGGGSGGGGSGGGGS). Prvním preparátem tohoto typu schváleným FDA (pro léčbu refraktorní akutní lymfoblastické leukemie) je blinatumomab – konstrukt skládající se z Fv fragmentu monoklonální protilátky rozpoznávající povrchový protein normálních i maligních B lymfocytů CD19 a Fv fragmentu monoklonální protilátky vážící CD3 podjednotku antigenně specifického receptoru T lymfocytů (obr. 1) [22].
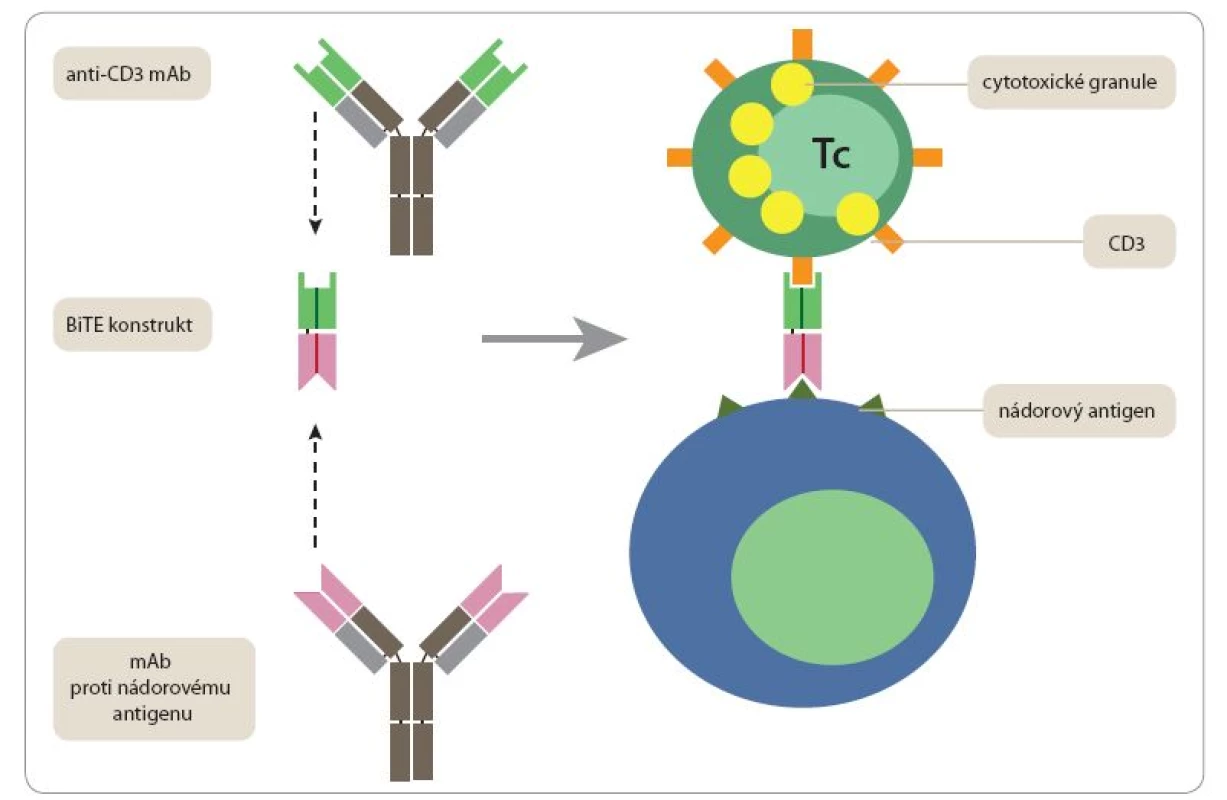
Adoptivní T buněčné terapie
Tento přístup spočívá v namnožení a aktivaci pacientových T lymfocytů ex vivo a vrácení zpět nitrožilní infuzí [23]. Lymfocyty se získávají z krve nebo přímo z infiltrátu nádoru. V prvním případě jde o tzv. LAK buňky (lymphokine activated killers), v druhém o TIL (tumor infiltrating lymphocytes) buňky. LAK buňky se získají stimulací směsi T a NK buněk pacienta in vitro cytokiny (hlavně IL‑2); předpokládá se, že se tím aktivují i utlumené nádorově specifické buňky. Takto stimulované buňky se vrátí zpět do krevního oběhu pacienta a v některých případech alespoň zčásti potlačí růst nádoru. Podobně je tomu u buněk TIL; v tomto případě se však izolují lymfocyty, které infiltrovaly do nádoru (získají se z chirurgicky odstraněného nádoru). Takové buňky by měly být nádorově specifické a pravděpodobně utlumené stykem s nádorem, který neposkytuje kostimulační signály; stimulace cytokiny in vitro může tento defekt částečně napravit.
Chimérické antigenní receptory
Imunitní systém obsahuje sice obrovské množství klonů lymfocytů, ale jen nepatrný zlomek z nich nese receptory vážící nádorové antigeny. To spolu s malou imunogenností nádorů způsobuje nedostatečnou přirozenou protinádorovou účinnost imunitního systému.
Pomocí moderních molekulárně‑biologických metod lze ovšem vybavit velký počet T lymfocytů receptory žádoucí specificity. Genetické konstrukty kódující takové receptory jsou vytvořeny z úseků DNA kódujících antigenně specifické Fab nebo Fc fragmenty monoklonálních protilátek a genových úseků kódujících transmembránové a intracelulární signalizační části vhodných imunoreceptorů (TCR, CD28, CD40, CD137) (obr. 2). Po vnesení takového umělého genu do T lymfocytů pacienta a jejich namnožení in vitro získáme prakticky libovolně velký počet cytotoxických lymfocytů rozpoznávajících zvolený povrchový antigen nádorových buněk. Ty na svém povrchu stabilně exprimují produkty vneseného genetického konstruktu, tzv. chimérické antigenní receptory (CAR), které fungují v principu stejně jako normální antigenně specifické receptory, avšak jejich specifita je definovaná protilátkovou částí a jejich signalizační intracelulární části jsou mnohem účinnější, než je tomu u přirozených jednoduchých receptorů (obr. 3).
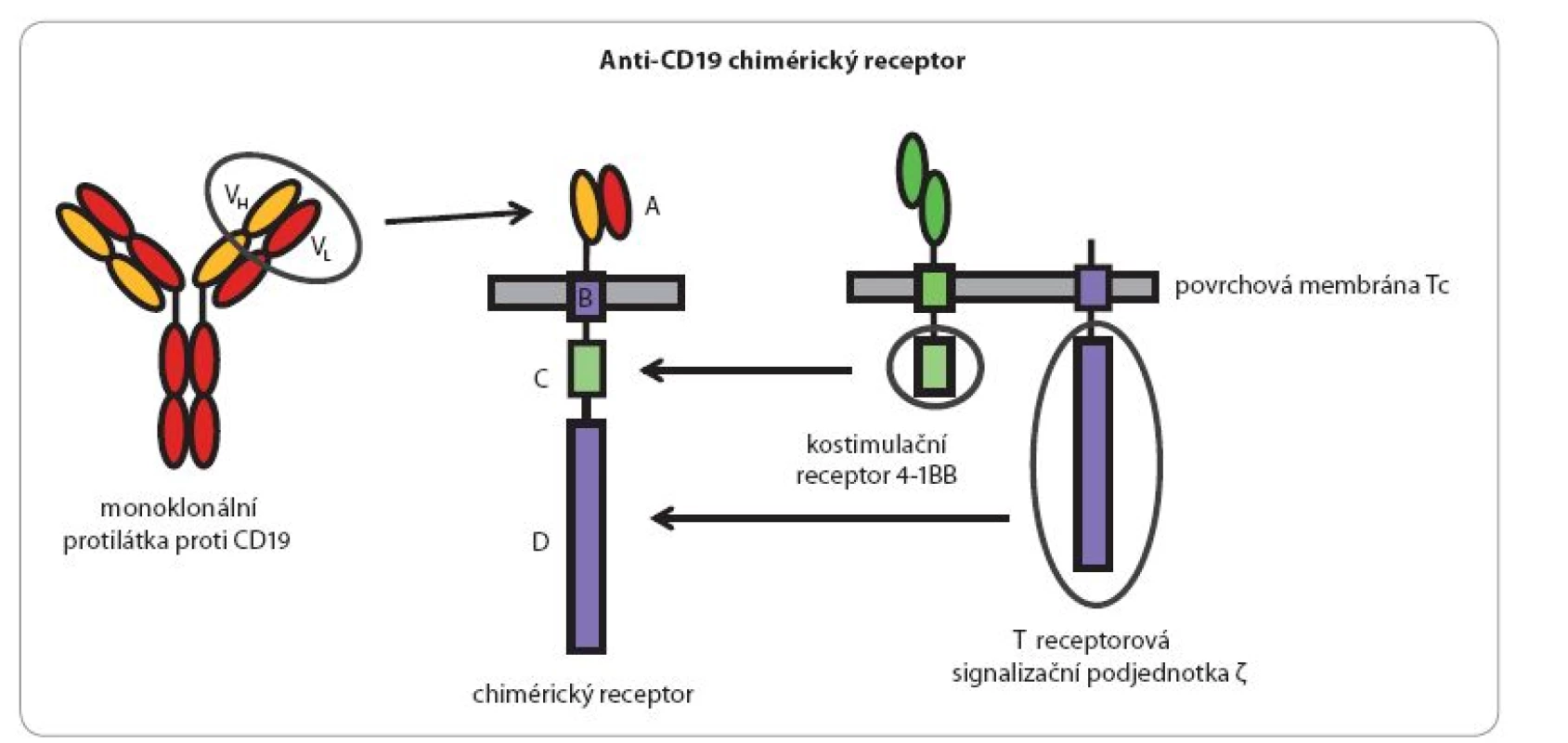
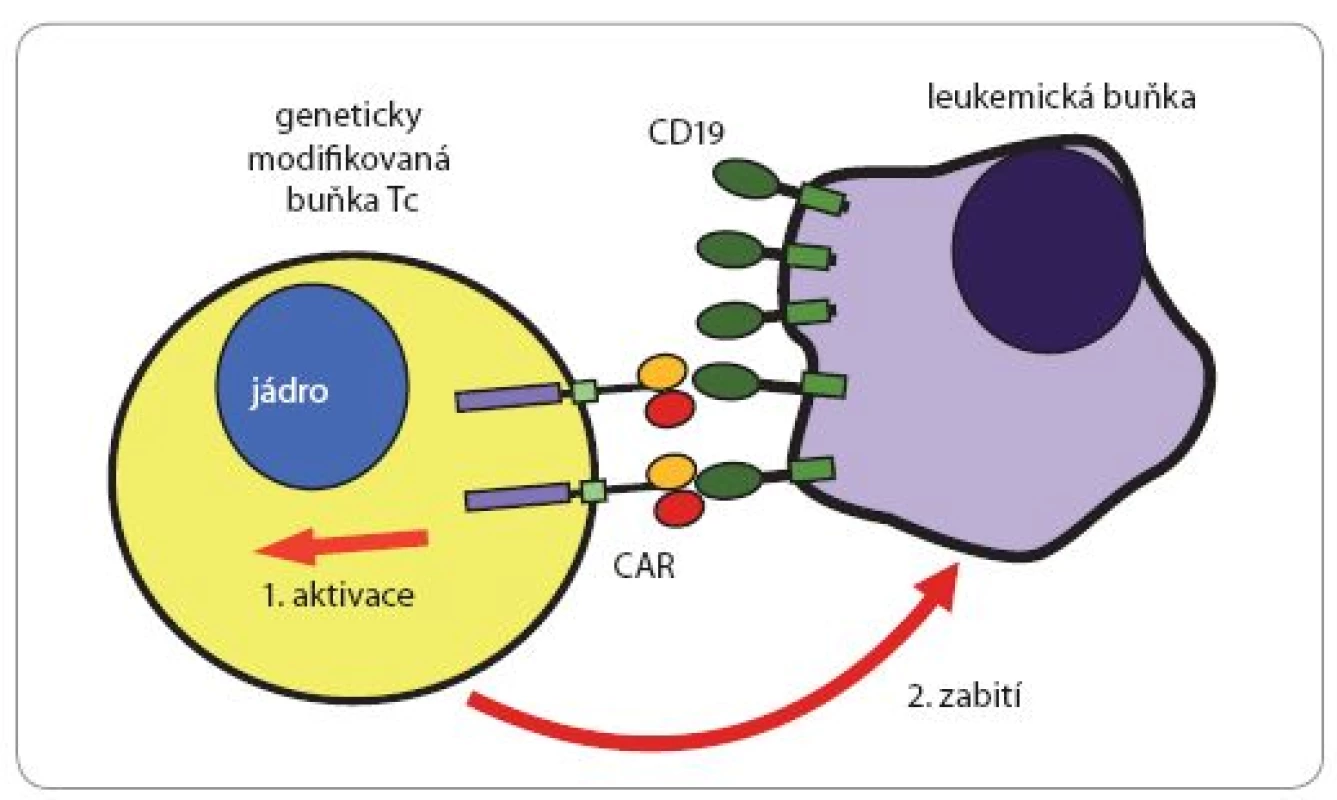
Tento postup založený na chimérických receptorech rozeznávajících povrchový glykoprotein B lymfocytů a lymfomů CD19 byl v několika modifikacích použit s velmi nadějnými výsledky v klinických studiích u pacientů s hematologickými malignitami (leukemie a lymfomy) odvozených z B lymfocytů [24]. Při této terapii samozřejmě dochází také k likvidaci normálních B lymfocytů, a tím k protilátkovému deficitu, který lze ale snadno řešit podáváním imunoglobulinů.
Nádorové vakcíny
Po identifikaci peptidů rozeznávaných nádorově specifickými klony T lymfocytů určitého pacienta lze pomocí těchto synteticky připravených peptidů in vitro (samozřejmě v přítomnosti buněk prezentujících antigen) nebo in vivo stimulovat protinádorové T lymfocyty, a tím docílit účinné odpovědi. Nevýhodou je HLA restrikce (tj. použitelnost pouze u pacientů s vhodnými alelickými formami HLA molekul) a obecně malá imunogennost peptidů. Tento přístup byl použit v mnoha desítkách malých klinických studií s poměrně skromnými výsledky [25]. Jinou možností je využití dendritických buněk kultivovaných s nádorovými antigeny (ve formě prostého lyzátu nádoru, apoptotických nádorových buněk nebo purifikovaného antigenu, je‑li znám) jakožto účinných buněk prezentujících antigen [26,27]. Dendritické buňky se v potřebném množství obvykle připravují z krevních monocytů působením směsi vhodných cytokinů (GM CSF, IL‑4). Ty se po inkubaci s nádorovými antigeny injikují pacientovi, v němž pak stimulují jeho T lymfocyty k protinádorové odpovědi. Doposud jediným případem takovéto vakcíny použitelné v praxi je Sipuleucel ‑ T schválený pro terapii karcinomu prostaty. Řada dalších obdobných vakcín je ve fázi II – III klinických zkoušek u pacientů s melanomem nebo karcinomem prostaty či ledvin a zkouší se u celé řady dalších nádorových onemocnění.
Kromě uvedených dvou typů nádorových vakcín již mnoho let probíhá testování řady dalších experimentálních přístupů, jako jsou např. DNA ‑ vakcíny (expresních vektory (bakteriální, virové, plazmidové) nesoucí gen kódující nádorový antigen) či vakcíny založené na geneticky modifikovaných nádorových buňkách exprimujících kostimulační molekuly a cytokiny stimulující T lymfocyty. Tato tematika svým rozsahem dalece překračuje rámec tohoto stručného přehledu. Aktuální přehled o stavu probíhajících vakcinačních klinických studií podává recentní přehledný článek [26].
Závěr
Snahy o imunoterapii nádorových onemocnění prošly dlouholetým vývojem ve vlnách střídajících optimizmus s pesimizmem. Nyní jsme ve fázi velkého optimizmu – zdá se, že na základě důkladného poznání řady základních imunitních mechanizmů a jejich regulace v posledních 20 letech mohou některé imunoterapeutické postupy již velmi brzy přinést alespoň u některých onemocnění skutečný průlom a do značné míry přinejmenším účinně doplnit, ne‑li částečně nahradit standardní metody, jako je chemoterapie a radioterapie. Zdá se jisté, že poznatky získané z velkého počtu probíhajících klinických studií v příštích letech významně posílí význam imunoterapeutických přístupů v klinické onkologii.
Práce byla realizována v rámci grantu GAČR č. P302-12-G101.
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
prof. RNDr. Václav Hořejší, CSc.
Ústav molekulární genetiky AV ČR, v. v. i.
Vídeňská 1083
142 20 Praha 4
e-mail: vaclav.horejsi@img.cas.cz
Obdrženo: 27. 7. 2015
Přijato: 25. 8. 2015
Sources
1. Vigneron N. Human tumor antigens and cancer immunotherapy. Biomed Res Int. In press 2015.
2. Klener P, Otahal P, Klener P et al. Immunotherapy approaches in cancer treatment. Curr Pharm Biotechnol 2015; 16(9): 771 – 781.
3. Dunn GP, Old LJ, Schreiber RD. The immunobiology of cancer immunosurveillance and immunoediting. Immunity 2004; 21(2): 137 – 148.
4. Chanmee T, Ontong P, Konno K et al. Tumor‑associated macrophages as major players in the tumor microenvironment. Cancers (Basel) 2014; 6(3): 1670 – 1690. doi: 10.3390/ cancers6031670.
5. Marvel D, Gabrilovich DI. Myeloid derived suppressor cells in the tumor microenvironment: expect the unexpected. J Clin Invest 2015; 125(9): 3356 – 3364. doi: 10.1172/ JCI80005.
6. Moretta L, Montaldo E, Vacca P et al. Human natural killer cells: origin, receptors, function, and clinical applications. Int Arch Allergy Immunol 2014; 164(4): 253 – 264. doi: 10.1159/ 000365632.
7. Wang W, Erbe AK, Hank JA et al. NK cell ‑ mediated antibody ‑ dependent cellular cytotoxicity in cancer immunotherapy. Front Immunol 2015; 6 : 368. doi: 10.3389/ fimmu.2015.00368.
8. Coulie PG, Van den Eynde BJ, van der Bruggen P et al. Tumour antigens recognized by T lymphocytes: at the core of cancer immunotherapy. Nat Rev Cancer 2014; 14(2): 135 – 146. doi: 10.1038/ nrc3670.
9. Nishikawa H, Sakaguchi S. Regulatory T cells in cancer immunotherapy. Curr Opin Immunol 2014; 27 : 1 – 7. doi: 10.1016/ j.coi.2013.12.005.
10. Li S, Xie Q, Zeng Y et al. A naturally occurring CD8(+)CD122(+) T ‑ cell subset as a memory‑like Treg family. Cell Mol Immunol 2014; 11(4): 326 – 331. doi: 10.1038/ cmi.2014.25.
11. Vinay DS, Ryan EP, Pawelec G et al. Immune evasion in cancer: mechanistic basis and therapeutic strategies. Semin Cancer Biol. In press 2015.
12. Tsung K, Norton JA. Lessons from Coley‘s toxin. Surg Oncol 2006; 15(1): 25 – 28.
13. Ingersoll MA, Albert ML. From infection to immunotherapy: host immune responses to bacteria at the bladder mucosa. Mucosal Immunol 2013; 6(6): 1041 – 1053. doi: 10.1038/ mi.2013.72.
14. Adkins I, Fucikova J, Garg AD et al. Physical modalities inducing immunogenic tumor cell death for cancer immunotherapy. Oncoimmunology 2015; 3(12): e968434.
15. De Palma M, Lewis CE. Macrophage regulation of tumor responses to anticancer therapies. Cancer Cell 2013; 23(3): 277 – 286. doi: 10.1016/ j.ccr.2013.02.013.
16. Bonapace L, Coissieux MM Wyckoff J et al. Cessation of CCL2 inhibition accelerates breast cancer metastasis by promoting angiogenesis. Nature 2014; 515(7525): 130 – 133. doi: 10.1038/ nature13862.
17. Ford CA, Petrova S, Pound JD et al. Oncogenic properties of apoptotic tumor cells in aggressive B cell lymphoma. Curr Biol 2015; 25(5): 577 – 588. doi: 10.1016/ j.cub.2014.12.059.
18. Weiner LM, Surana R, Wang S. Monoclonal antibodies: versatile platforms for cancer immunotherapy. Nat Rev Immunol 2010; 10(5): 317 – 327. doi: 10.1038/ nri2744.
19. Redman JM, Hill EM, Al Deghaither D et al. Mechanisms of action of therapeutic antibodies for cancer. Mol Immunol 2015; 67(2 Pt A): 25 – 45. doi: 10.1016/ j.molimm.2015.04.002.
20. Weiner GJ. Building better monoclonal antibody‑based therapeutics. Nat Rev Cancer 2015; 15(6): 361 – 370. doi: 10.1038/ nrc3930.
21. Turnis ME, Andrews LP, Vignali DA. Inhibitory receptors as targets for cancer immunotherapy. Eur J Immunol 2015; 45(7): 1892 – 1905. doi: 10.1002/ eji.201344413.
22. Suryadevara CM, Gedeon PC, Sanchez ‑ Perez L et al. Are BiTEs the „missing link“ in cancer therapy? Oncoimmunology 2015; 4(6): e1008339.
23. Rosenberg SA, Restifo NP. Adoptive cell transfer as personalized immunotherapy for human cancer. Science 2015; 348(6230): 62 – 68. doi: 10.1126/ science.aaa4967.
24. Dotti G, Gottschalk S, Savoldo B et al. Design and development of therapies using chimeric antigen receptor ‑ expressing T cells. Immunol Rev 2014; 257(1): 107 – 126. doi: 10.1111/ imr.12131.
25. Pol J, Bloy N, Buqué A et al. Trial Watch: Peptide‑based anticancer vaccines. Oncoimmunology 2015; 4(4): e974411.
26. Melero I, Gaudernack G, Gerritsen W et al. Therapeutic vaccines for cancer: an overview of clinical trials. Nat Rev Clin Oncol 2014; 11(9): 509 – 524. doi: 10.1038/ nrclinonc.2014.111.
27. Palucka K, Banchereau J. Cancer immunotherapy via dendritic cells. Nat Rev Cancer 2012; 12(4): 265 – 277. doi: 10.1038/nrc3258.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2015 Issue Supplementum 4
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Imunoterapie u bronchogenního karcinomu a její perspektivy
- Immunoscore a jeho prediktivní hodnota u kolorektálního karcinomu
- Imunitní systém u pacientů s nádory hlavy a krku
- Imunoterapie uroteliálního karcinomu močového měchýře – od BCG vakcín k cílené imunoterapii
- Nežádoucí účinky moderní imunoterapie a jejich řešení v klinické praxi
- Terapeutický efekt a tolerance ipilimumabu u metastatického maligního melanomu v dětském věku – kazuistika
- Historie imunoterapie – od Coley toxinů ke kontrolním bodům imunitní reakce
- Protinádorové zbraně imunitního systému
- Úloha regulačních T buněk v protinádorové imunitní odpovědi
- Únikové strategie nádorů pozornosti imunitního systému
- Role imunoterapie v dětské onkologii
- Chimérický antigenní receptor T lymfocytů – genová terapie budoucnosti u nádorových onemocnění?
- Význam imunogenní buněčné smrti v protinádorové imunitě
- Význam imunitního systému a možnosti imunoterapie u maligního melanomu
- Imunoterapie renálního karcinomu
- Význam imunitního systému a možnosti imunoterapie u karcinomu prostaty
- Dosavadní zkušenosti a perspektivy imunoterapie bronchogenního karcinomu
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Nežádoucí účinky moderní imunoterapie a jejich řešení v klinické praxi
- Imunoterapie uroteliálního karcinomu močového měchýře – od BCG vakcín k cílené imunoterapii
- Únikové strategie nádorů pozornosti imunitního systému
- Význam imunogenní buněčné smrti v protinádorové imunitě
