Role imunoterapie v dětské onkologii
Role of Immunotherapy in Pediatric Oncology
Background:
Currently, most children with cancer can be cured with standard therapy (surgery, chemotherapy, radiotherapy). The only limiting factor is its severe acute toxicity and late adverse events. In pediatric oncology, immunotherapy has been delayed but the initial clinical trials of immunotherapy show a good tolerance and promising results, especially in the setting of refractory or recurrent high-risk tumors. In this article, we will discuss a current situation in pediatric oncology, what immunotherapies are being tested in the clinical practice, from monoclonal antibodies, check point inhibitors to tumor vaccines, T-lymphocytes with chimeric antigen receptors, cytokines and innate immunity.
Conclusion:
Immunotherapy is a promising treatment modality for children and adolescents with recurrent high-risk cancer with potential to improve both survival and quality of life. The challenge of developing immunotherapies in pediatric oncology remains – age barriers for using new drugs and a limited number of pediatric clinical studies.
Key words:
pediatric cancer – immunotherapy – monoclonal antibodies – vaccines – cell therapy – cytokines
The author declares she has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted:
24. 8. 2015
Accepted:
16. 9. 2015
Authors:
V. Bajčiová
Authors‘ workplace:
Klinika dětské onkologie LF MU a FN Brno
Published in:
Klin Onkol 2015; 28(Supplementum 4): 38-43
Category:
Generals
doi:
https://doi.org/10.14735/amko20154S38
Overview
Východiska:
V současnosti lze standardní léčbou (operací, chemoterapií a radioterapií) vyléčit většinu onkologicky nemocných dětí. Limitujícím faktorem zůstává její těžká akutní toxicita a pozdní následky. V dětské onkologii má imunoterapie jisté zpoždění, ale iniciální klinické studie s imunoterapií prokazují její dobrou toleranci a slibné výsledky, především u refrakterních a rekurentních nádorů vysokého rizika. V článku předkládáme současnou situaci v dětské onkologii, které způsoby imunoterapie jsou testovány v klinické praxi, od monoklonálních protilátek a inhibitorů kontrolních bodů až po nádorové vakcíny, T lymfocyty exprimující chimerické antigenní receptory, cytokiny a vrozenou imunitu.
Závěr:
Imunoterapie je slibnou léčebnou modalitou pro děti a dospívající s rekurentními nádory vysokého rizika s potenciálem zlepšit nejen celkové přežívání, ale i kvalitu života. Problémem rozvoje imunoterapie v dětské onkologii zůstává věková bariéra při zavádění nových léků a limitovaný počet dětských klinických studií.
Klíčová slova:
dětské nádory – imunoterapie – monoklonální protilátky – vakcíny – buněčná terapie – cytokiny
Úvod
Léčebné úspěchy dosažené v dětské onkologii v posledních 20 letech patří mezi jedny z největších v éře moderní medicíny, pět let přežívá více než 85 % pacientů. Tento úspěch byl dosažen nejen zavedením systémové chemoterapie a multimodální léčby, ale i zlepšením podpůrné péče a organizací péče s centralizací do dětských onkologických center [1].
Nicméně u 15 – 20 % dětí stále nedokážeme zvrátit nepříznivý průběh nemoci (neuroblastomy vysokého rizika, metastatické sarkomy měkkých tkání a kostí, vysoce rizikové nádory CNS) [2 – 4]. Pro tyto nádory je nutné hledat nové možnosti a strategie léčby.
Limitujícím faktorem standardní léčby zůstává toxicita chemo a radioterapie a její pozdní následky, které mohou vést nejen ke snížení kvality života, ale i předčasným úmrtím u „vyléčeného“ dětského onkologického pacienta.
Zavedení imunoterapie do léčby zhoubných onemocnění v dětském věku má ve srovnání s onkologií dospělého věku zpoždění několik let, s výjimkou transplantace kmenových buněk hematopoézy. Tento časový skluz je způsoben odlišnými, tzv. dětskými typy nádorů, jejich nízkou incidencí a vysokou efektivitou standardní onkologické léčby.
Specifika nádorů dětského věku
Dětské typy nádorů mají ve srovnání s onkologií dospělého věku několik specifických odlišností. Kromě incidence a etiologie jsou rozdílné i nejčastější histologické typy nádorů (převažují embryonální typy nádorů a nádory z pojivových tkání, karcinomy jsou raritní), výrazně agresivnější je jejich biologické chování s rychlým růstem a metastatickým šířením.
Z pohledu imunologie se dětské typy nádorů liší od nádorů dospělého věku ve třech oblastech:
a) Exprese glykoproteinů MHC třídy I u dětských nádorů
Ve srovnání s nádory dospělého věku jsou informace stran exprese molekul MHC třídy I (major histocompatibility complex) u nádorů dětského typu limitovány [5,6]. U neuroblastomu vysokého rizika je exprese MHC třídy I nízká [6]. U Ewingova sarkomu je přítomna pouze částečná exprese MHC třídy I, u metastatických forem nádoru exprese chybí úplně [6]. U meduloblastomu je vyšší exprese MHC třídy I spojena s horší prognózou, což je v rozporu s ostatními typy nádorů [6]. Rozporné informace jsou i u špatně diferencovaného rhabdomyosarkomu, kde je exprese MHC třídy I negativní [6].
b) Mutační analýza dětských typů nádorů
Pediatrické typy nádorů mají ve srovnání s nádory dospělého typu nižší mutační nálož, nízkou frekvenci bodových somatických mutací a variabilní počet genových/ chromozomálních alterací. Antigenní heterogenita dětských nádorů je při nízké genetické nestabilitě ve srovnání s nádory dospělého věku nižší [7].
c) Nádorové mikroprostředí dětských nádorů
Jedním z hlavních rozdílů mezi dospělými a pediatrickými typy nádorů je typ nádorového mikroprostředí a typ imunitních nádor infiltrujících buněk. U dospělých převažují dendritické buňky a T lymfocyty. Jejich typ, počet, lokalizace (centrální nebo marginální) je součástí imunitního prognostického skóre u mnoha nádorů [5]. U pediatrických nádorů převažuje infiltrace tumor asociovanými makrofágy (TAM) a myeloidními buňkami (myeloid derived supressor cells – MDSC).
- M2 makrofágy jsou lokalizovány v hypoxických částech nádorové tkáně. Vysoká infiltrace TAM má prognostický význam u Ewingova sarkomu, neuroblastomu a osteosarkomu [3,8].
- MDSC v dětských solidních nádorech inhibují aktivitu T lymfocytů. MDSC lze ovlivnit dvojím způsobem – buď umožnit jejich diferenciaci podáním all‑trans cis retinové kyseliny, nebo způsobit jejich inhibici podáním COX‑2 inhibitorů [4].
- Exprese PD ‑ L1 (programmed death ligand) je asociována s horší prognózou. U nádorů dětského věku nebyly dosud provedeny systematické studie exprese PD ‑ L1. U neuroblastomu byla nalezena PD ‑ L1 exprese u nádorových linií, ale ne ve vzorku nádoru. U Wilmsova nádoru byla exprese PD ‑ L1 v korelaci s agresivním průběhem a rekurencí nádoru u příznivého histologického podtypu. Žádná exprese PD ‑ L1 nebyla prokázána u pediatrického B-non Hodgkinova lymfomu (B ‑ NHL), ale naopak až 80 % anaplastického velkobuněčného lymfomu mělo expresi PD ‑ L1 pozitivní [8,9]. Přítomná pozitivní exprese PD ‑ L1 byla až v 70 % nádorových buněk u dětských sarkomů měkkých tkání, kde byla asociována s vyšším klinickým stadiem, vyšším stupněm malignity a horší prognózou (tab. 1) [9].
![Exprese PD-L1 u pediatrických typů nádorů [10].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/6e094cd0db969b71028f92eea04f4213.jpg)
Imunoterapie v dětské onkologii
Významné objevy v biologii nádorů a pokroky v technologiích vedly v posledních letech k dramatickému rozvoji protinádorové imunoterapie jako specifické léčebné modality [10,11]. Imunologické metody v boji proti nádoru se zaměřují na:
- a) zvýšení imunogenicity nádorových buněk, čímž je dělají rozpoznatelné pro efektorové buňky imunitního systému;
- b) aktivaci imunitního systému nositele nádor ‑ asociovanými cílovými antigeny;
- c) potlačení nádor ‑ asociovaných supresorických buněk [10].
Mezi faktory limitující efekt imunoterapie patří heterogenita cílových antigenů a nepoměr mezi objemem nádoru a relativním nedostatkem efektorových buněk v nádoru. V dětské onkologii imunoterapie zatím nepatří mezi základní léčebné modality [12].
Monoklonální protilátky
Mechanizmus účinku monoklonálních protilátek (monoclonal antibody – mAb) je založen na blokování povrchových signálních receptorů, a tím jejich funkční neutralizaci. Pro efektivní cílenou léčbu mAb musí být splněny dvě podmínky – povrchový antigen musí být nádor specifický a jeho exprese na povrchu nádorové buňky musí být dostatečně vysoká [10]. Mezi další mechanizmy účinku mAb s protinádorovým účinkem patří cytolýza cestou aktivace komplementu, aktivace na protilátkách závislé buněčné cytotoxicity, zmírnění nádorem indukované imunosuprese (aktivace vlastních imunitních buněk nositele zablokováním CTLA-4 molekuly či PD ‑ 1) a „non‑tumor“ cíle v heterogenní tkáni nádoru (stromální fibroblasty, VEGF či již dříve zmiňované TAM) [3,10,13].
Ve snaze o zvýšení protinádorového účinku mAb při současném pokroku v technologiích je možné navázání prakticky jakékoliv látky na mAb. Vznikají tak tzv. konjugované mAb, které fungují jako nosiče pro aktivní látku, která je na ně navázána. Jde např. o cytotoxické látky (gemtuzumab ozogamicin u refrakterní akutní myeloidní leukemie –AML), toxiny (pseudomonádový exotoxin u akutní lymfoblastická leukemie – ALL, ricin u Hodgkinova lymfomu), cytokiny (anti‑disialogangliosid GD2/ IL‑2) nebo radioizotopy (EF8 - 131J konjugát s GD2) [2,4,10,13].
Bispecifické mAb jsou protilátky s duální specificitou (rozeznávají dva rozdílné antigeny). Navazují doménu na povrchu nádorových buněk na doménu, která aktivuje receptor na efektorové imunitní buňce. Anti‑CD19/ anti‑CD3 bispecifická mAb (blinatumomab) zprostředkuje interakci mezi CD19+ na leukemických blastech a CD3+ na T lymfocytech. V souboru devíti dětských pacientů s relapsem B buněčné ALL (B-ALL) po alogenní transplantaci až 67 % z nich dosáhlo klinické remise po blinatumomabu. V současnosti je plánována klinická studie fáze III u dětských pacientů s relabovanou B ‑ ALL [2,4,14].
Rituximab je chimerická mAb (anti‑-CD20) na povrchu B lymfocytů. V dětské onkologii je součástí kombinované imunochemoterapie. Rituximab je součástí klinických studií indukční fáze léčby 1. linie u B ‑ NHL, zralé B ‑ ALL. Rituximab je součástí léčby 1. linie u dětí i dospělých u posttransplantační lymfoproliferace. Stejná je jeho role v 1. linii léčby opsoklonus ‑ myoklonus syndromu (OMA) u neuroblastomu [2 – 4,10,13].
Bevacizumab (anti‑VEGF mAb) je součástí léčby metastatických sarkomů měkkých tkání, metastatického Ewingova sarkomu, studie fáze III léčby nádorů CNS vysokého rizika (embryonální supratentoriální nádory, high‑grade gliomy). Rovněž je efektivní u low ‑ grade gliomů u dětí s neurofibromatózou typ I [13]. Bevacizumab v kombinaci s metronomickou léčbou dosáhl významné terapeutické odpovědi u refrakterních a rekurentních solidních nádorů dětského věku a u nádorů s vysokým rizikem časného relapsu.
Denosumab (anti‑RANKL mAb) je indikován u refrakterních, progredujících a metastatických obrovskobuněčných nádorů kostí, ve studii fáze II byla dosažena terapeutická odpověď až v 86 % [15].
Nimotuzumab (humanizovaná mAb anti‑EGFR) je testován u difuzních gliomů mozkového kmene a gliomů mozku velmi vysokého rizika.
Figitumumab (plně humanizovaná IgG2 mAb proti IGF‑1R) prokázala v klinické studii fáze I objektivní odpověď u Ewingova sarkomu [4]. Specifickým problémem v dětské onkologii může být fakt, že i normální zdravý dětský organizmus potřebuje pro svůj růst IGF růstovou dráhu.
Monoklonální protilátka proti gangliosidu G2 je indikována u neuroblastomu vysokého rizika po autologní transplantaci hematopoetických kmenových buněk (auto HSCT; 1. generace anti‑GD2) nebo spolu s navázanými růstovými faktory či interleukinem ‑ 2 (IL‑2; 2. generace anti‑GD2, chimerická mAb dinutuximab) ve stadiu minimální reziduální nemoci (minimal residual disease – MRD). Randomizovaná klinická studie fáze III u pacientů s neuroblastomem vysokého rizika po autologní HSCT s následným použitím isotretinoidu a dinutuximabu prokázala signifikantní prodloužení přežití bez příhody (eventfree survival – EFS: 66 vs. 46 %) a celkového přežití (overall survival – OS: 86 vs. 75 %) ve srovnání s pacienty bez použití dinutuximabu. V současnosti je k dispozici již 3. generace anti‑GD2 terapeutik ve formě CARs (chimeric antigene receptors). National Cancer Institut (NCI) aktuálně registruje 18 otevřených klinických studií s anti‑GD2 mAb [2 – 4,10].
Přehled mAb používaných v dětské onkologii je uveden v tab. 2.
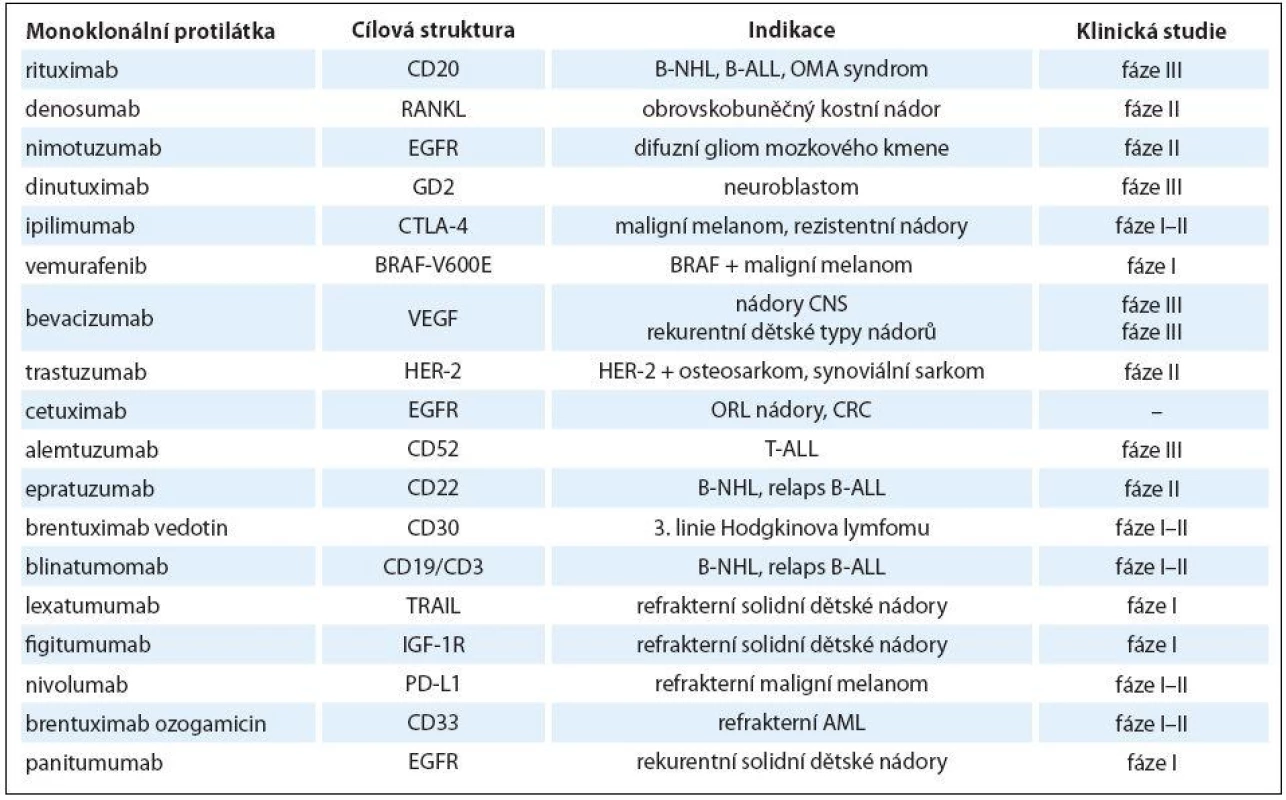
V ČR jsou pro děti a dospívající kromě IgG2 a anti‑GD2 všechny ostatní mAb dostupné dle paragrafu 16 zákona č. 48/ 1997 Sbírky.
Inhibitory imunologických kontrolních bodů (check pointů)
Check points inhibitory jsou imunoterapeutika blokující povrchové molekuly exprimované na T lymfocytech, které přenášejí inhibující signály a umožňují tak únik nádoru z imunologického dohledu. Rozdíly v nádorovém mikroprostředí u dětských nádorů by mohly vést k domněnce, že blokáda imunologických check pointů v dětské onkologii nemá terapeutický význam.
Ipilimumab (anti‑CTLA-4) je v dětské onkologii součástí studie fáze II v léčbě metastatického maligního melanomu a rezistentních solidních nádorů dětského věku po předchozím potvrzení léčebné odpovědi studie fáze I u 24 % pacientů s refrakterním/ relabujícím nádorem. Aktuálně jsou otevřeny v USA a Evropě tři klinické studie fáze II u dětí s pokročilým maligním melanomem a v USA i jiných rezistentních nádorů dětského věku. Pro všechny je limitem věk nad 12 let [4,8,10,13,16]. V ČR je ipilimumab dostupný pro děti a dospívající pod 18 let věku ve velmi přísně indikovaných případech dle paragrafu 16 zákona č. 48/ 1997 Sbírky ve vybraných dětských onkologických centrech (Praha, Brno).
V posledním roce je velká pozornost věnována protilátkám proti receptoru PD ‑ 1 (programmed death receptor-1) – plně humanizované mAb nivolumab, pembrolizumab a lambrolizumab. Cílem je zesílit protinádorovou odpověď T lymfocytů narušením interakce mezi inhibičním receptorem PD ‑ 1 na T lymfocytech a PD ‑ L1 exprimovaným na nádorových buňkách. V dětské onkologii je v přípravě studie fáze I a II u progredujících dětských typů nádorů exprimujících PD ‑ L1 [4,8,9]. V ČR je anti‑PD ‑ 1 mAb pembrolizumab dostupný pouze ve velmi přísně indikovaných případech v rámci specifického léčebného programu ve vybraných dětských onkologických centrech (Praha, Brno).
Buněčná imunoterapie
- a) Adoptivní T buněčná terapie (transfer ex vivo expandovaných tumor infiltrujících lymfocytů – TILs) zatím nenašel v dětské onkologii použití. Vysvětlením může být rozdíl v nádorovém mikroprostředí dětských nádorů s nízkým počtem TILs [2].
V dětské onkologii je buněčná imunoterapie realizována především třemi způsoby:
- b) Alogenní transplantace kmenových buněk hematopoezy, GvL efekt
Představuje jednu z nejstarších metod buněčné imunoterapie v dětské onkologii v léčbě rezistentních/ relabujících hematologických malignit. Graft versus leukemia (GvL) efekt zprostředkován dárcovskými cytotoxickými T lymfocyty je typickým příkladem imunitní reakce, která dokáže eradikovat chemorezistentní leukemické buňky. GvL je závislý na typu leukemie (chronická myeloidní leukemie (CML) > akutní myeloidní leukemie (AML) > akutní lymfoblastická leukemie (ALL)), buněčnosti a množství T lymfocytů ve štěpu (T deplece štěpu je spojena s vyšším rizikem relapsu), přítomnosti reakce štěpu vůči hostiteli (graft versus host disease – GvHD), objemu nádoru u hostitele v čase převodu a správném načasování transplantace. Nejlepší GvL efekt je dosažen ve stadiu MRD [2,3,16].
Obdobnou metodou je infuze T lymfocytů dárce (donor lymphocyte infusion – DLI). V současnosti probíhají klinické studie s haploidentickou SCT s KIR ‑ mismatched NK buňkami u dětských leukemií i solidních nádorů [2,3,10,16].
- c) Protinádorové vakcíny
Imunologická tolerance indukovaná nádorovými antigeny není absolutní a lze ji překonat specifickou imunizací antigen prezentujícími buňkami (APC buňky). V dětské onkologii proběhla celá řada nerandomizovaných single arm klinických studií s použitím protinádorových vakcín u rekurentních solidních nádorů (rekurentní high‑grade gliomy mozku, melanom, sarkomy měkkých tkání, neuroblastom vysokého rizika, Ewingův sarkom) se závěrem – podání je bezpečné, ale nádorové regrese bylo dosažena pouze zřídka. Problematický je rovněž pomalý imunologický efekt vakcíny u proliferačně vysoce aktivních nádorů dětského věku. Optimální načasování podání protinádorové vakcíny je opět ve stadiu MRD po ukončení intenzivní léčby.
Nádorové vakcíny v dětské onkologii zatím nejsou součástí standardní léčby. Aktuálně probíhá v USA pod hlavičkou NCI 14 klinických pediatrických studií fáze I a II s použitím protinádorové vakcíny [2,4].
V ČR v současnosti proběhlo schválení SÚKL pediatrické pilotní klinické studie „Kombinovaná protinádorová terapie s autologní vakcínou z dendritických buněk produkujících interleukin‑12 u dětských a adolescentních pacientů s progredujícími, relabujícími nebo primárně metastatickými malignitami vysokého rizika“ Kliniky dětské onkologie LF MU a FN Brno.
- d) CARs T lymfocyty
Velmi slibnou terapeutickou metodou je imunoterapie založená na T lymfocytech exprimujících CARs. Předběžné výsledky prokazují klinický terapeutický efekt CARs nejenom ve stadiu MRD, ale i při měřitelné nádorové mase.
Problémem při výrobě a následném použití CARs T lymfocytů v dětské onkologii je nízká incidence dětských nádorů, složitost a finanční náročnost přípravy, která vede k použití CARs pouze v několika specializovaných centrech v USA [4].
V dětské onkologii byly jako potenciální cíle identifikovány antigeny CD19 a GD ‑ 2. Klinická studie fáze I s použitím CD19 - CARs u B ‑ ALL refrakterní na standardní léčbu prokázala 66,7% dosažení kompletní remise, a u 60 % pacientů dokonce vymizela MRD. Další studie potvrdila dosažení remise až u 90 % pacientů. Rovněž byl potvrzen přechod CD19 - CARs přes hematoencefalickou bariéru a vymizení CNS leukemické infiltrace [2,4,14].
Klinická studie fáze I s první generací CARs proti GD2 prokázala u 27 % těžce předléčených pacientů s neuroblastomem a aktivní nemocí dosažení kompletní remise [4].
V ČR je tento typ imunoterapie pro dětskou onkologii zatím nedostupný.
Kombinovaná imunoterapie
Fakt tzv. imunogenní buněčné smrti (immunogenic cell death – ICD) využívá stereotaktická radiochirurgie (SRS). Použití radioterapie a SRS jako imunomodulační metody podporuje fakt, že ozáření navodí v nádorovém mikroprostředí změny typické pro zánětlivé procesy (zvýšením exprese MHC I. třídy na nádorových buňkách se zvýší jejich rozpoznatelnost imunitním systémem). Poškození nádorových buněk vede ke zvýšené infiltraci nádorové tkáně efektorovými imunitními buňkami. Dochází k poškození endoteliálních buněk cév v nádoru a zvýšení permeability cévní stěny, což vede ke hromadění efektorových T buněk [17].
Ve snaze o dosažení maximálního klinického efektu lze kromě radioterapie použít kombinaci imunoterapie s dalšími formami protinádorové léčby (kombinace/ sekvenční podání různých typů imunoterapie, kombinace imunoterapie a chemoterapie, kombinace imunoterapie a cílené biologické léčby).
Aktivace vrozené imunity
Imunoterapie v podobě aktivace vrozené imunity je v dětské onkologii teprve v začátcích. V dospělé onkologii je nejdéle používaným způsobem aktivace vrozené imunity aplikace BCG vakcíny u karcinomu močového měchýře. V dětské onkologii probíhá klinická studie fáze I s BCG a antiidiotypovou mAb A1G4 u progredujících neuroblastomů vysokého rizika [16].
MTP ‑ PE (lipidový muramyl tripeptid fosfatyletanolamin, mifamurtid) aktivuje monocyty a makrofágy, jeho efekt tedy záleží na počtu makrofágů v nádoru. Podání MTP ‑ PE u lokalizovaného osteosarkomu vedlo ke zlepšení pětiletého OS (53 % v ramenu s MTP ‑ PE vs. 40 % v ramenu bez MTP ‑ PE). Výsledky studie fáze III u osteosarkomu s plicními metastázami prokázaly prodloužení intervalu PFS, ale nebylo dosaženo statisticky významného prodloužení OS [3,16,18]. V ČR je dostupný pro pacienty s osteosarkomem dle paragrafu 16 zákona 48/ 1997 Sbírky.
Cytokiny a růstové faktory
Cytokiny hrají kritickou roli v regulaci imunitního systému – stimulují imunitní odpověď proti cizorodému antigenu a regulují odpověď nositele ve spektru od cytotoxické po imunotolerantní reakci.
- a) Interferon α (IFN-α), především jehopegylovaná forma, je v dětské onkologii součástí léčby devastujících progredujících hemangiomů, plexiformních neurofibromů u dětí s neurofibromatózou typu I. Je součástí standardní léčby 1. linie u maligního melanomu, obrovskobuněčného nádoru kostí nebo neuroendokrinních nádorů [3,4,16]. Rovněž je součástí imunoterapie relapsu Hodgkinova lymfomu po autologní HSCT. Recentně vyhodnocené rameno s pegylovaným IFN-α v rámci studie EURAMOS nevedlo ke zlepšení výsledků u metastatického osteosarkomu.
- b) Interleukin‑2 (IL‑2) nesplnil očekávaný efekt u dětských typů nádorů [3]. U neuroblastomu vysokého rizika po autologní SCT spolu s anti‑GD ‑ 2 mAb a GM‑CSF prokázal zlepšení a prodloužení PFS [13].
- c) GM‑CSF u akutních leukemií může zvyšovat senzitivitu blastů a tím zvyšovat cytotoxický efekt chemoterapie. Klinická studie s inhalací GM‑CSF u plicních metastáz osteosarkomu nesplnila svá očekávání [3,16].
- d) Tumor necrosis faktor α (TNF-α) – jistý efekt TNF-α je popsán u rekurentního metastatického Ewingova sarkomu, Wilmsova nádoru nebo sarkomů měkkých tkání. Použití v dětské onkologii limituje jeho systémová toxicita [3,4,16].
Závěr
Od prvního využití mechanizmů imunitního systému v léčbě nádorů dětského věku (Coleyův toxin v roce 1922) uběhlo již 93 let. Současná protinádorová léčba dětských nádorů je sice efektivní ve většině případů, ale za vysokou cenu akutní toxicity a pozdních následků.
Význam imunoterapie v dětské onkologii kromě slibného terapeutického efektu potencuje její dobrá tolerance, absence pozdní toxicity a urychlení rekonstituce imunitního systému po absolvování standardní cytotoxické onkologické léčby. V dětské onkologii se standardní léčbou podaří dostat většinu nádorů do stadia MRD, kdy je efekt imunoterapie nejprokazatelnější. Proto klinické studie s použitím tzv. konsolidační imunoterapie, především u solidních dětských nádorů vysokého rizika, jsou v nejbližších letech nezbytné.
Autorka deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Viera Bajčiová, CSc.
Klinika dětské onkologie
LF MU a FN Brno
Černopolní 9
625 00 Brno
e-mail: vbajciova@fnbrno.cz
Obdrženo: 24. 8. 2015
Přijato: 16. 9. 2015
Sources
1. Bajčiová V. Využití imunoterapie v dětské onkologii. Onkológia 2014; 9(1): 34 – 38.
2. Mackall CL, Merchant MS, Fry TJ. Immune‑based therapies for childhood cancer. Nat Rev Oncol 2014; 11(12): 693 – 703. doi: 10.1038/ nrclinonc.2014.177.
3. Mackall CL, Arceci RJ. Immunotherapeutic targeting in children. Medscape reference, Drugs, Disease and Procedures, March 2012 [online]. Available from: http:/ emedicine.medscape.com/ article/ 991158 - overview.
4. Capitini CHM, Otto M, DeSantes B. Immunotherapy in pediatric malignancies: current status and future perspectives. Future Oncol 2014; 10(9): 1659 – 1678. doi: 10.2217/ fon.14.62.
5. Galon J, Mlecnik B, Bindea G et al. Towards the introduction of the „immunoscore“ in the classification of malignant tumours. J Pathol 2014; 232(2): 199 – 209. doi: 10.1002/ path.4287.
6. Haworth KB, Leddon JL, Chen CHZ et al. Going back to class I: MHC and immunotherapies for childhood cancer. Pediatr Blood Cancer 2015; 62(4): 571 – 576. doi: 10.1002/ pbc.25359.
7. Vogelstein B, Papadopoulos N, Velculesa V et al. Cancer genome landscape. Science 2013; 339(6127): 1546 – 1558. doi: 10.1126/ science.1235122.
8. Marabelle A, Gray J. Tumor ‑ targeted and immune - targeted monoclonal antibodies:going from passive to active immunotherapy. Pediatr Blood Cancer 2015; 62(8): 1317 – 1325. doi: 10.1002/ pbc.25508.9. van Dam L, de Zwart VM, Meyer ‑ Wentrup FA. The role of programmed cell death ‑ 1 (PD ‑ 1) and its ligands in pediatric cancer. Pediatr Blood Cancer 2015; 62 : 190 – 197. doi: 10.1002/ pbc.25284.
10. Wayne AS, Capitini CHM, Mackall CL. Immunotherapy of childhood cancer: from biologic understanding to clinical application. Curr Opin Pediatr 2010; 22(1): 2 – 11. doi: 10.1097/ MOP.0b013e3283350d3e.
11. Hatina J. Imunologie nádorů – současný stav a poznatky z 1. mezinárodní konference základní a klinické imunogenomiky. Část II – protinádorová imunoterapie. Klin Onkol 2005; 18(4): 126 – 133.
12. Eckschlager T. Má imunoterapie své místo v současné dětské onkologii? Klin Onkol 2003; 16 (Suppl 1): 125 – 126.
13. Grupp SA, Verneris M, Sondel PM et al. Immunotherapy for pediatric cancer. Biol Blood Marow Transplant 2008; 14 (Suppl 1): 33 – 43. doi: 10.1016/ j.bbmt.2007.10.014.
14. Suzuki M, Curran KJ, Cheung NK. Chimeric antigen receptors and bispecific antibodies to retarget T cells in pediatric oncology. Pediatr Blood Cancer 2015; 62(8): 1326 – 1336. doi: 10.1002/ pbc.25513.
15. Thomas DM. RANKL, denosumab, and giant cell tumor of bone. Curr Opin Oncol 2012; 24(4): 397 – 403. doi: 10.1097/ CCO.0b013e328354c129.
16. Capitini CHM, Mackall CI, Wayne AS. Immune‑based therapeutics for pediatric cancer. Expert Opin Biol Ther 2010; 10(2): 163 – 178. doi: 10.1517/ 14712590903431022.
17. Finkelstein SE, Tiimerman R, McBride WH et al. The confluence of stereotactic ablative radiotherapy and tumor imunology. Clin Dev Imunol 2011; 2011 : 439752. doi: 10.1155/ 2011/ 439752.
18. Chou AJ, Kleinerman ES, Krailo MD et al. Addition of muramyl tripeptide to chemotherapy for patients with newly diagnosed metastatic osteosarcoma: a report from the Children’s Oncology Group. Cancer 2009; 115(22): 5339 – 5348. doi: 10.1002/ cncr.24566.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2015 Issue Supplementum 4
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Imunoterapie u bronchogenního karcinomu a její perspektivy
- Immunoscore a jeho prediktivní hodnota u kolorektálního karcinomu
- Imunitní systém u pacientů s nádory hlavy a krku
- Imunoterapie uroteliálního karcinomu močového měchýře – od BCG vakcín k cílené imunoterapii
- Nežádoucí účinky moderní imunoterapie a jejich řešení v klinické praxi
- Terapeutický efekt a tolerance ipilimumabu u metastatického maligního melanomu v dětském věku – kazuistika
- Historie imunoterapie – od Coley toxinů ke kontrolním bodům imunitní reakce
- Protinádorové zbraně imunitního systému
- Úloha regulačních T buněk v protinádorové imunitní odpovědi
- Únikové strategie nádorů pozornosti imunitního systému
- Role imunoterapie v dětské onkologii
- Chimérický antigenní receptor T lymfocytů – genová terapie budoucnosti u nádorových onemocnění?
- Význam imunogenní buněčné smrti v protinádorové imunitě
- Význam imunitního systému a možnosti imunoterapie u maligního melanomu
- Imunoterapie renálního karcinomu
- Význam imunitního systému a možnosti imunoterapie u karcinomu prostaty
- Dosavadní zkušenosti a perspektivy imunoterapie bronchogenního karcinomu
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Nežádoucí účinky moderní imunoterapie a jejich řešení v klinické praxi
- Imunoterapie uroteliálního karcinomu močového měchýře – od BCG vakcín k cílené imunoterapii
- Únikové strategie nádorů pozornosti imunitního systému
- Význam imunogenní buněčné smrti v protinádorové imunitě
