Možnosti využití p63 v bioptické diagnostice
Possible Usage of p63 in Bioptic Diagnostics
Background:
The p63 transcription factor is a p53 homologue; however, its role in development and oncogenesis is more unambiguous than that of p53. TP63 encodes a variety of N-and C-terminal isoforms with different expression patterns and functions. The most frequently studied are N-terminal variants DNp63 (p40) and TAp63. p40 is a characteristic basal or myopithelial cell marker of stratified epithelium and it partakes in the regulation of proliferation and differentiation. The TAp63 isoform is more expressed in the suprabasal cell layer but is also expressed in primary oocytes, lymphocytes and stromal cells. It induces apoptosis and plays a role in the maintenance of genome integrity. The role of each isoform differs also in tumor progression. p40 is generally considered to behave as an oncoprotein in the regulation of cancer stem cells, while TAp63 expression is associated with a better prognosis.
Aim:
Nuclear expression of p63 is a widely used as a diagnostic marker in the clinical pathology of a spectrum of malignancies, mostly lung squamous cell carcinomas and urogenital tract carcinomas; however, it also used during examination of breast (BC) and prostate carcinoma bioptic samples. However, cytoplasmic or extracellular p63 expression is observed in neoplastic cells when the 4A4 antibody is used. This mini-review briefly summarizes the possibilities and pitfalls of p63 usage, particularly when it is used in bioptic diagnostics of BC and prostate carcinoma and highlights the potential applications of isoform specific p40 and TAp63 antibodies. It also describes other clinical usages of p63, for instance in the histogenetical classification of tumors.
Key words:
p63 – DNp63 (p40) – TAp63 – breast carcinoma – prostate carcinoma
This work was supported by the project MEYS – NPS I – LO1413.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Accepted: 17. 8. 2018
:
Galoczová Michaela; Nenutil Rudolf; Coates Philip; Vojtěšek Bořivoj
:
Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno
:
Klin Onkol 2018; 31(Supplementum 2): 27-31
:
Reviews
prolekare.web.journal.doi_sk:
https://doi.org/10.14735/amko20182S27
Východiska:
Transkripční faktor p63 je homologem p53, nicméně jeho role ve vývoji a onkogenezi není tak jednoznačná. Gen TP63 kóduje množství N-a C-koncových izoforem proteinu, jejichž exprese a funkce se navzájem liší. Nejlépe prostudované jsou N-koncové varianty DNp63 (p40) a TAp63. p40 je charakteristickým markerem bazálních nebo myoepiteliálních buněk víceřadých epitelů a podílí se na regulaci proliferace a diferenciace. TAp63 izoforma je více exprimována v buňkách suprabazální vrstvy a kromě epitelů také v primárních oocytech, lymfocytech a stromálních buňkách, je schopná indukovat apoptózu a hraje roli v udržování genomové integrity. Role jednotlivých izoforem se liší také v nádorové progresi, kdy p40 je obecně považována za onkoprotein zapojený do regulace nádorových kmenových buněk, zatímco exprese TAp63 je spojována s lepší prognózou onemocnění.
Cíl:
Jaderná exprese p63 je markerem používaným v klinické patologii k diagnostice různých typů malignit, nejčastěji dlaždicobuněčného karcinomu plic či karcinomů urogenitálního traktu, svou roli hraje také ve vyšetření bioptických vzorků karcinomu prsu (breast carcinoma – BC) a prostaty (prostate carcinoma – PC). U neoplastických buněk lze však při použití protilátky 4A4 pozorovat expresi p63 také v cytoplazmě či v extracelulárním materiálu. Tento přehledový článek stručně shrnuje možnosti a nástrahy použití p63 v bioptické diagnostice, zejména u BC a PC, poukazuje také na potenciál využití specifických protilátek proti izoformám p40 a TAp63. Zabývá se rovněž dalším klinickým využitím p63 v histogenetické klasifikaci nádorů.
Klíčová slova:
p63 – DNp63 (p40) – TAp63 – karcinom prsu – karcinom prostaty
Úvod
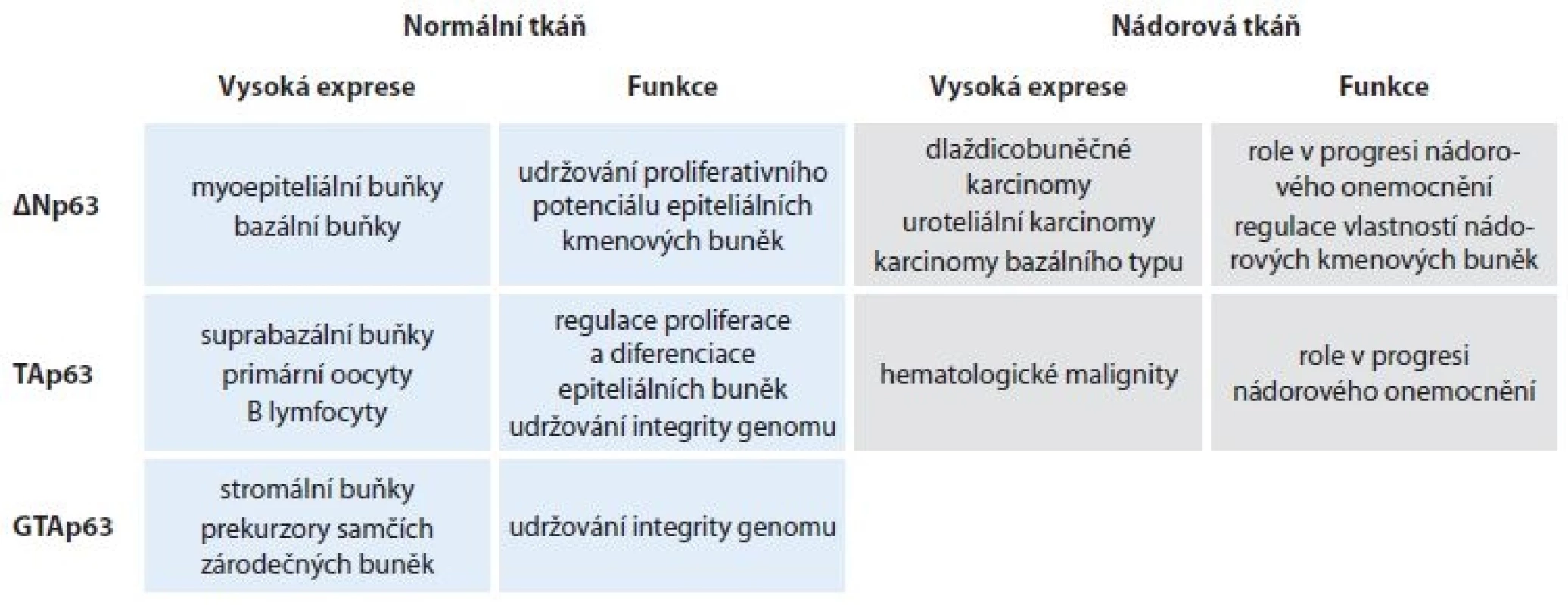
Protein p63 patří do rodiny transkripčního faktoru a nádorového supresoru p53, kam se kromě p53 řadí také p73. Tyto proteiny navzájem vykazují vysokou sekvenční homologii a sdílejí stejnou doménovou strukturu, což jim umožňuje navzájem interagovat či vázat se na transkripční cíle ostatních členů rodiny. Role jednotlivých proteinů se ve vývoji tkání a onkogenezi liší, odlišná je dokonce i funkce jednotlivých izoforem. Gen TP63 kóduje nejméně 10 různých izoforem p63. Transkripce ze dvou různých promotorů umožňuje vznik dvou N-koncových izoforem, plnodélkové TAp63 a N-koncově zkrácené DNp63 izoformy, která bývá rovněž označována jako p40 a postrádá N-koncovou transkripčně aktivační doménu. Alternativním sestřihem pak vznikají C-koncové varianty (a, b, g, d, e) [1,2]. Převládající izoformou v tkáních je p40, která je exprimovaná ve vysoké míře v bazálních a myoepiteliálních buňkách vrstevnatého dlaždicového a žláznatého epitelu různých orgánů [3] a je také známa pro svou roli v udržování proliferativního potenciálu epiteliálních kmenových buněk [4,5]. S mírou buněčné diferenciace exprese p40 klesá. TAp63 se naopak vyskytuje v bazálních epiteliálních buňkách pouze zřídka, vyšší expresi lze pak pozorovat v buňkách umístěných suprabazálně, což naznačuje odlišnou roli obou izoforem v průběhu diferenciace [6]. Exprese TAp63 je také charakteristická pro jádra primárních oocytů [7], byla detekována v lymfocytech a stromálních buňkách [8]. Nedávno byla popsána nová izoforma GTAp63 vyskytující se u prekurzorů samčích zárodečných buněk, kde přispívá k udržování integrity genomu [9]. Z hlediska onkogeneze je TAp63 obecně považována za nádorový supresor díky schopnosti indukovat zástavu buněčného cyklu a apoptózu [10], zatímco p40 vykazuje vlastnosti onkoproteinu a její vysoká exprese je charakteristická zejména pro dlaždicobuněčné karcinomy [11], uroteliální karcinomy [12] a karcinomy bazálního typu [13–15]. O p40 se také diskutuje jako o markeru nádorových kmenových buněk u různých typů nádorových onemocnění [16]. Nicméně TAp63 se rovněž může chovat jako onkoprotein a bylo prokázáno, že je převládající izoformou u některých typů hematologických malignit [17] (tab. 1). O jednotlivých C-koncových izoformách p63 se ví zatím pouze málo, což je také způsobeno komerční nedostupností specifických protilátek (s výjimkou p63a a g), současné studie však naznačují jejich rozdílné funkce [18,19]. V bioptické diagnostice se využívá průkaz p63, event. cíleně průkaz p40 dvěma základními způsoby. V první řadě se jedná o znázornění myoepitelií nebo bazálních buněk s cílem zhodnotit invazivitu, nebo obecněji malignitu léze. Dalším použitím je průkaz p40 jako markeru diferenciace nádoru směrem k víceřadému epitelu nebo k jeho histogenetickému zařazení.
Průkaz myoepitelií nebo bazálních buněk
U normální tkáně mléčné žlázy je jaderná exprese p63 charakteristickým markerem myoepiteliálních buněk, zatímco luminální buňky jsou p63 negativní. Použití p63 v nádorové patologii odstartovala celá řada studií zaměřených na duktální karcinom in situ (DCIS), které navrhly použití přítomnosti myoepiteliálních buněk k odlišení invazivních a neinvazivních lézí [20,21]. Myoepiteliální buňky tvoří v nenádorové mléčné žláze souvislou vrstvu lemující epiteliální stranu bazální membrány. U karcinomů in situ jsou myoepiteliální buňky zachovány, příp. mírně redukovány v hustotě. Kompletní absence myoepitelií pak svědčí pro invazivní charakter léze [20].
Podrobnější studie zaměřené na charakteristiky myoepiteliálních buněk v in situ karcinomech duktálního, ale rovněž lobulárního (lobular carcinoma in situ – LCIS) a papilárního typu nebo intraduktálních papilomů prokazují alteraci imunofenotypu ve smyslu snížené exprese některých markerů, p63 však má relativně nejvyšší citlivost [22–24]. Vzhledem k dále diskutovaným skutečnostem o jeho expresi v invazivních nádorech je však jeho specificita částečně omezena a ve sporných případech se doporučuje vždy použití dvou markerů, zejména doplnění průkazu p63 o barvení kalponinu [24,25]. Dalšími používanými markery myoepiteliálních buněk jsou CD10, myozin těžkého řetězce hladkého svalstva (smooth muscle myosin heavy chain – SMMHC) či cytokeratiny 5/6, a to často spolu s p63 jako součástí různých protilátkových koktejlů [25–27]. U vzácných epiteliálně-myoepiteliálních karcinomů prsu (breast carcinoma – BC), jako jsou myoepiteliální karcinomy [28] či adenoidně cystické karcinomy [29], však myoepiteliální p63 pozitivní buňky tvoří součást nádoru.
Nicméně ne všechny neoplastické buňky běžných karcinomů jsou p63 negativní. Mimo jadernou lokalizaci bylo imunohistochemické barvení p63 u řady invazivních BC pozorováno také v cytoplazmě neoplastických buněk, ovšem pouze ve studiích využívajících nejčastěji používanou anti-p63 protilátku klon 4A4 [13,30–32]. Ve srovnání s 4A4 je pak p40 protilátka s výhradně jaderným barvením považována za více specifickou [33]. Jelikož ale bývá cytoplazmatická exprese p63 v literatuře často zmiňována, bude jí věnován prostor také v této publikaci.
Mezi nádory charakteristické vysokou jadernou expresí p63 patří zejména karcinomy bazálního typu 2 (basal like 2 – BL2) patřící do skupiny triple negativních BC (TNBC), které jsou negativní pro estrogenový (ER), progesteronový (PR) receptor a také receptor typu 2 pro lidský epidermální růstový faktor (human epidermal growth factor receptor 2 – HER2) [34]. U TNBC bazálního typu byla pozorována rovněž vyšší exprese p63 v cytoplazmě ve srovnání s nebazálními typy [13]. Jadernou expresi p63 lze nalézt také u malého procenta ER+ karcinomů [35,36].
Z pohledu histologické klasifikace BC byla jaderná exprese p63 navržena jako specifický marker metaplastických karcinomů [37]. Nicméně p63 pozitivní je také relativně vysoké procento medulárních a atypických medulárních karcinomů [38]. V literatuře lze nalézt rovněž případy p63 pozitivních maligních fyloidních či sarkomatoidních nádorů [39]. Jaderná i cytoplazmatická exprese byla pozorována u některých invazivních mikropapilárních [40] a také u sekrečních karcinomů, kde byl p63 pozitivní také intraluminální sekretovaný materiál [31,41]. Příkladem karcinomu s atypickou expresí p63 je s těhotenstvím spojený BC. Myoepiteliální buňky u tohoto onemocnění vykazují sníženou jadernou expresi p63, zatímco asociované epiteliální buňky jsou pozitivní pro cytoplazmatickou expresi tohoto proteinu. Aberantní cytoplazmatická exprese p63 zde zřejmě přispívá k zvýšení invazivity a agresivity epiteliálních buněk [30,32].
Při použití 4A4 protilátky je zapotřebí počítat se skutečností, že rozpoznává všechny izoformy p63 a navíc vykazuje křížovou reaktivitu s p73 [8]. Specificita cytoplazmatického barvení touto protilátkou je také předmětem diskuzí. Vzhledem k odlišným funkcím jednotlivých izoforem p63 a p73 v nádorové progresi se jeví použití izoformově specifických monoklonálních protilátek jako lepší diagnostický nástroj. Studie hodnotící specificitu a citlivost p40 jako markeru myoepiteliálních buněk ve srovnání s 4A4 ukazují, že použití obou protilátek je srovnatelné [42–44]. Nicméně např. u TNBC použití protilátek specifických proti jednotlivým variantám p63 ukázalo, že zatímco exprese p40 asociuje s metaplastickými a medulárními karcinomy a s bazálním buněčným fenotypem, exprese TAp63 koreluje s expresí androgenového receptoru (AR), nemutovaným BRCA1/2 statusem a pozitivitou PTEN. TAp63 pozitivní nádory navíc vykazují lepší celkové přežití [45].
Jaderná exprese p63 je v klinické praxi používána také jako marker bazálních buněk prostaty. Bazální buňky prostaty podobně jako myoepiteliální buňky prsu tvoří souvislou vrstvu podél bazální membrány pod vrstvou luminálních buněk. V prostatě se navíc vyskytuje ještě jeden buněčný typ, buňky neuroendokrinní, které jsou spolu s luminálními buňkami p63 negativní [46,47]. p63 pozitivní bazální buňky lze nalézt u benigní prostatické hyperplazie (BPH), u prekancerózní prostatické intraepiteliální neoplazie (PIN) a v adenóze prostaty. Většina karcinomů prostaty (prostate carcinoma – PC) je ovšem p63 negativní [48]. Proto je také negativita p63 používána k odlišení dobře diferencovaných invazivních karcinomů v punkčních biopsiích, nejčastěji v rámci protilátkového koktejlu spolu s alfa-metylacyl racemázou (AMACR) a cytokeratiny o vysoké molekulové hmotnosti (high molecular weight cytokeratins – CK HMW, 34be12) [49]. V literatuře lze však najít i kazuistiky p63 pozitivních invazivních PC. Existují vzácné případy PC z bazálních buněk [14,15] a také případy p63 pozitivních adenokarcinomů, které jsou molekulárně odlišné od PC obvyklého typu a také od karcinomů z bazálních buněk a vykazují expresi bazálních i luminálních markerů. Tyto nádory jsou pozitivní při použití 4A4 a většina z nich také při použití p40 protilátky [50,51]. Stejně jako u BC byly u PC rovněž zaznamenány případy cytoplazmatické exprese p63 u neoplastických buněk, exprese tohoto markeru navíc korelovala se zvýšenou mortalitou [52].
Histogenetická klasifikace nádorů
V řadě nádorových lokalit může být průkaz diferenciace karcinomu směrem k víceřadému epitelu klinicky důležitý. Výrazným příkladem je klasifikace nemalobuněčných plicních karcinomů v malých, morfologicky často málo reprezentativních punkčních biopsiích. Pozitivita p40 je zde spolu s negativitou tyroidního transkripčního faktoru 1 (TTF1) a Napsinu A typickým znakem dlaždicobuněčných karcinomů a vylučuje adenokarcinom [53]. Použití p40 specifických protilátek zde značně zlepšuje specificitu diagnózy [54]. V situaci, kdy je k dispozici omezené množství materiálu, je tak možno optimalizovat sekvenci navazujících prediktivních vyšetření, jako jsou mutace receptoru pro epidermální růstový faktor (epidermal growth factor receptor – EGFR) a translokace genu anaplastické lymfomové kinázy (ALK) u adenokarcinomu či exprese ligandu receptoru programované buněčné smrti 1 (programmed death-ligand 1 – PD-L1) u spinocelulárního karcinomu. Obecné rozlišení mezi adenokarcinomem a spinocelulárním nebo uroteliálním karcinomem pomocí barvení p40 je také užitečné zejména při vyšetření morfologicky nezařaditelných nádorů urogenitálního traktu [55]. V patologii slinných žláz se barvení p63 používá k rozlišení acinárního (negativní) a mukoepidermoidního (pozitivní) karcinomu slinných žláz [56]. Rozdíly v expresi p63 mezi intermediárním trofoblastem choriových klků a implantačním trofoblastem mohou být dále využity v diferenciální diagnostice vzácnějších trofoblastických nádorů a případně dalších trofoblastických lézí [57].
Závěr
Imunohistochemické barvení p63, zejména izoformy DNp63 (p40), je v současné době dobře zavedenou metodou bioptické diagnostiky sloužící zejména k průkazu invazivity negativních nádorových lézí v orgánech s víceřadým epitelem (prs, prostata) a k upřesnění histogenetické klasifikace karcinomů (plíce, urogenitální trakt). Potenciál průkazu p63, příp. jeho specifických izoforem v souvislosti s možnou úlohou v biologii nádorových kmenových buněk nebo jako prediktivního markeru na své možné naplnění teprve čeká.
Práce byla podpořena projektem MŠMT – NPU I – LO1413.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Michaela Galoczová
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7 656 53 Brno
e-mail: michaela.galoczova@mou.cz
Přijato: 17. 8. 2018
Sources
1. Yang A, Kaghad M, Wang Y et al. p63, a p53 homolog at 3q27-29, encodes multiple products with transactivating, death-inducing, and dominant-negative activities. Mol Cell 1998; 2 (3): 305–316.
2. Mangiulli M, Valletti A, Caratozzolo MF et al. Identification and functional characterization of two new transcriptional variants of the human p63 gene. Nucleic Acids Res 2009; 37 (18): 6092–6104. doi: 10.1093/nar/gkp674.
3. Kurita T, Cunha GR, Robboy SJ et al. Differential expression of p63 isoforms in female reproductive organs. Mech Dev 2005; 122 (9): 1043–1055. doi: 10.1016/j.mod.2005.04.008.
4. Chakrabarti R, Wei Y, Hwang J et al. DNp63 promotes stem cell activity in mammary gland development and basal-like breast cancer by enhancing Fzd7 expression and Wnt signalling. Nat Cell Biol 2014; 16 (10): 1004–1015, 1001–1013. doi: 10.1038/ncb3040.
5. Pignon JC, Grisanzio C, Geng Y et al. p63-expressing cells are the stem cells of developing prostate, bladder, and colorectal epithelia. Proc Natl Acad Sci U S A 2013; 110 (20): 8105–8110. doi: 10.1073/pnas.1221216110.
6. Nylander K, Vojtesek B, Nenutil R et al. Differential expression of p63 isoforms in normal tissues and neoplastic cells. J Pathol 2002; 198 (4): 417–427. doi: 10.1002/path.1231.
7. Suh EK, Yang A, Kettenbach A et al. p63 protects the female germ line during meiotic arrest. Nature 2006; 444 (7119): 624–628. doi: 10.1038/nature05337.
8. Nekulova M, Holcakova J, Nenutil R et al. Characterization of specific p63 and p63-N-terminal isoform antibodies and their application for immunohistochemistry. Virchows Arch 2013; 463 (3): 415–425. doi: 10.1007/s00428-013-1459-4.
9. Beyer U, Moll-Rocek J, Moll UM et al. Endogenous retrovirus drives hitherto unknown proapoptotic p63 isoforms in the male germ line of humans and great apes. Proc Natl Acad Sci U S A 2011; 108 (9): 3624–3629. doi: 10.1073/pnas.1016201108.
10. Guo X, Keyes WM, Papazoglu C et al. TAp63 induces senescence and suppresses tumorigenesis in vivo. Nat Cell Biol 2009; 11 (12): 1451–1457. doi: 10.1038/ncb1988.
11. Hu H, Xia SH, Li AD et al. Elevated expression of p63 protein in human esophageal squamous cell carcinomas. Int J Cancer 2002; 102 (6): 580–583. doi: 10.1002/ijc.10739.
12. Ud Din N, Qureshi A, Mansoor S. Utility of p63 immunohistochemical stain in differentiating urothelial carcinomas from adenocarcinomas of prostate. Indian J Pathol Microbiol 2011; 54 (1): 59–62. doi: 10.4103/0377-4929.77326.
13. Kamarlis RK, Lubis MN, Hernowo BS et al. Immunoexpression of P63 and SOX2 in triple-negative breast cancers, Indonesia. F1000Res 2017; 6 : 1780. doi: 10.12688/f1000research.12671.2.
14. Chang K, Dai B, Kong Y et al. Basal cell carcinoma of the prostate: clinicopathologic analysis of three cases and a review of the literature. World J Surg Oncol 2013; 11 (1): 193. doi: 10.1186/1477-7819-11-193.
15. Ali TZ, Epstein JI. Basal cell carcinoma of the prostate: a clinicopathologic study of 29 cases. Am J Surg Pathol 2007; 31 (5): 697–705. doi: 10.1097/01.pas.0000213395.42075.86.
16. Nekulova M, Holcakova J, Coates P et al. The role of p63 in cancer, stem cells and cancer stem cells. Cell Mol Biol Lett 2011; 16 (2): 296–327. doi: 10.2478/s11658-011-0009-9.
17. Alexandrova EM, Moll UM. Role of p53 family members p73 and p63 in human hematological malignancies. Leuk Lymphoma 2012; 53 (11): 2116–2129. doi: 10.3109/10428194.2012.684348.
18. Boldrup L, Coates PJ, Gu X et al. DeltaNp63 isoforms differentially regulate gene expression in squamous cell carcinoma: identification of Cox-2 as a novel p63 target. J Pathol 2009; 218 (4): 428–436. doi: 10.1002/path.2560.
19. Li N, Li H, Cherukuri P et al. TA-p63-gamma regulates expression of DeltaN-p63 in a manner that is sensitive to p53. Oncogene 2006; 25 (16): 2349–2359. doi: 10.1038/sj.onc.1209270.
20. Wang X, Mori I, Tang W et al. p63 expression in normal, hyperplastic and malignant breast tissues. Breast Cancer 2002; 9 (3): 216–219.
21. Werling RW, Hwang H, Yaziji H et al. Immunohistochemical distinction of invasive from noninvasive breast lesions: a comparative study of p63 versus calponin and smooth muscle myosin heavy chain. Am J Surg Pathol 2003; 27 (1): 82–90.
22. Hill CB, Yeh IT. Myoepithelial cell staining patterns of papillary breast lesions: from intraductal papillomas to invasive papillary carcinomas. Am J Clin Pathol 2005; 123 (1): 36–44.
23. Wang Y, Jindal S, Martel M et al. Myoepithelial cells in lobular carcinoma in situ: distribution and immunophenotype. Hum Pathol 2016; 55 : 126–134. doi: 10.1016/j.humpath.2016.05.003.
24. Rohilla M, Bal A, Singh G et al. Phenotypic and functional characterization of ductal carcinoma in situ-associated myoepithelial cells. Clin Breast Cancer 2015; 15 (5): 335–342. doi: 10.1016/j.clbc.2015.01.004.
25. med.stanford.edu. [online]. Ductal carcinoma in situ of the breast. Available from: http: //surgpathcriteria.stanford.edu/breast/dcis/differentialdiagnosis.html.
26. Reisenbichler ES, Ross JR, Hameed O. The clinical use of a P63/cytokeratin7/18/cytokeratin5/14 antibody cocktail in diagnostic breast pathology. Ann Diagn Pathol 2014; 18 (6): 313–318. doi: 10.1016/j.anndiagpath.2014.08.007.
27. Pavlakis K, Zoubouli C, Liakakos T et al. Myoepithelial cell cocktail (p63+SMA) for the evaluation of sclerosing breast lesions. Breast 2006; 15 (6): 705–712. doi: 10.1016/j.breast.2005.11.005.
28. Liao KC, Lee WY, Chen MJ. Myoepithelial carcinoma: a rare neoplasm of the breast. Breast Care (Basel) 2010; 5 (4): 246–249. doi: 10.1159/000313982.
29. Mastropasqua MG, Maiorano E, Pruneri G et al. Immunoreactivity for c-kit and p63 as an adjunct in the diagnosis of adenoid cystic carcinoma of the breast. Mod Pathol 2005; 18 (10): 1277–1282. doi: 10.1038/modpathol.3800423.
30. Hsiao YH, Su YA, Tsai HD et al. Increased invasiveness and aggressiveness in breast epithelia with cytoplasmic p63 expression. Int J Biol Sci 2010; 6 (5): 428–442.
31. Choi J, Kim D, Koo JS. Secretory carcinoma of breast demonstrates nuclear or cytoplasmic expression in p63 immunohistochemistry. Int J Surg Pathol 2012; 20 (4): 367–372. doi: 10.1177/1066896912440506.
32. Xu Z, Wang W, Deng CX et al. Aberrant p63 and WT-1 expression in myoepithelial cells of pregnancy-associated breast cancer: implications for tumor aggressiveness and invasiveness. Int J Biol Sci 2009; 5 (1): 82–96.
33. Alomari AK, Glusac EJ, McNiff JM. p40 is a more specific marker than p63 for cutaneous poorly differentiated squamous cell carcinoma. J Cutan Pathol 2014; 41 (11): 839–845. doi: 10.1111/cup.12388.
34. Lehmann BD, Pietenpol JA. Identification and use of biomarkers in treatment strategies for triple-negative breast cancer subtypes. J Pathol 2014; 232 (2): 142–150. doi: 10.1002/path.4280.
35. Hanker L, Karn T, Ruckhaeberle E et al. Clinical relevance of the putative stem cell marker p63 in breast cancer. Breast Cancer Res Treat 2010; 122 (3): 765–775. doi: 10.1007/s10549-009-0608-6.
36. Matos I, Dufloth R, Alvarenga M et al. p63, cytokeratin 5, and P-cadherin: three molecular markers to distinguish basal phenotype in breast carcinomas. Virchows Arch 2005; 447 (4): 688–694. doi: 10.1007/s00428-005-0010-7.
37. Koker MM, Kleer CG. p63 expression in breast cancer: a highly sensitive and specific marker of metaplastic carcinoma. Am J Surg Pathol 2004; 28 (11): 1506–1512.
38. Matkovic B, Juretic A, Separovic V et al. Immunohistochemical analysis of ER, PR, HER-2, CK 5/6, p63 and EGFR antigen expression in medullary breast cancer. Tumori 2008; 94 (6): 838–844. doi: 10.1089/jpm.2016.0362.
39. Cimino-Mathews A, Sharma R, Illei PB et al. A subset of malignant phyllodes tumors express p63 and p40: a diagnostic pitfall in breast core needle biopsies. Am J Surg Pathol 2014; 38 (12): 1689–1696. doi: 10.1097/PAS.0000000000000301.
40. Yamaguchi R, Tanaka M, Kondo K et al. Characteristic morphology of invasive micropapillary carcinoma of the breast: an immunohistochemical analysis. Jpn J Clin Oncol 2010; 40 (8): 781–787. doi: 10.1093/jjco/hyq056.
41. Bratthauer GL, Saenger JS, Strauss BL. Antibodies targeting p63 react specifically in the cytoplasm of breast epithelial cells exhibiting secretory differentiation. Histopathology 2005; 47 (6): 611–616. doi: 10.1111/j.1365-2559.2005.02282.x.
42. Kim SK, Jung WH, Koo JS. p40 (DNp63) expression in breast disease and its correlation with p63 immunohistochemistry. Int J Clin Exp Pathol 2014; 7 (3): 1032–1041.
43. Aghazadeh S, Yazdanparast R. Activation of STAT3/HIF-1a/Hes-1 axis promotes trastuzumab resistance in HER2-overexpressing breast cancer cells via down-regulation of PTEN. Biochim Biophys Acta 2017; 1861 (8): 1970–1980. doi: 10.1016/j.bbagen.2017.05.009.
44. Sailer V, Lüders C, Kuhn W et al. Immunostaining of ∆Np63 (using the p40 antibody) is equal to that of p63 and CK5/6 in high-grade ductal carcinoma in situ of the breast. Virchows Arch 2015; 467 (1): 67–70. doi: 10.1007/s00428-015-1766-z.
45. Coates PJ, Nenutil R, Holcakova J et al. p63 isoforms in triple-negative breast cancer: DNp63 associates with the basal phenotype whereas TAp63 associates with androgen receptor, lack of BRCA mutation, PTEN and improved survival. Virchows Arch 2018; 472 (3): 351–359. doi: 10.1007/s00428-018-2324-2.
46. Signoretti S, Pires MM, Lindauer M et al. p63 regulates commitment to the prostate cell lineage. Proc Natl Acad Sci U S A 2005; 102 (32): 11355–11360. doi: 10.1073/pnas.0500165102.
47. Signoretti S, Waltregny D, Dilks J et al. p63 is a prostate basal cell marker and is required for prostate development. Am J Pathol 2000; 157 (6): 1769–1775. doi: 10.1016/S0002-9440 (10) 64814-6.
48. Parsons JK, Gage WR, Nelson WG et al. p63 protein expression is rare in prostate adenocarcinoma: implications for cancer diagnosis and carcinogenesis. Urology 2001; 58 (4): 619–624.
49. Humphrey PA. Diagnosis of adenocarcinoma in prostate needle biopsy tissue. J Clin Pathol 2007; 60 (1): 35–42. doi: 10.1136/jcp.2005.036442.
50. Tan HL, Haffner MC, Esopi DM et al. Prostate adenocarcinomas aberrantly expressing p63 are molecularly distinct from usual-type prostatic adenocarcinomas. Mod Pathol 2015; 28 (3): 446–456. doi: 10.1038/modpathol.2014.115.
51. Osunkoya AO, Hansel DE, Sun X et al. Aberrant diffuse expression of p63 in adenocarcinoma of the prostate on needle biopsy and radical prostatectomy: report of 21 cases. Am J Surg Pathol 2008; 32 (3): 461–467. doi: 10.1097/PAS.0b013e318157020e.
52. Dhillon PK, Barry M, Stampfer MJ et al. Aberrant cytoplasmic expression of p63 and prostate cancer mortality. Cancer Epidemiol Biomarkers Prev 2009; 18 (2): 595–600. doi: 10.1158/1055-9965.EPI-08-0785.
53. Rekhtman N, Ang DC, Sima CS et al. Immunohistochemical algorithm for differentiation of lung adenocarcinoma and squamous cell carcinoma based on large series of whole-tissue sections with validation in small specimens. Mod Pathol 2011; 24 (10): 1348–1359. doi: 10.1038/modpathol.2011.92.
54. Bishop JA, Teruya-Feldstein J, Westra WH et al. p40 (DNp63) is superior to p63 for the diagnosis of pulmonary squamous cell carcinoma. Mod Pathol 2012; 25 (3): 405–415. doi: 10.1038/modpathol.2011.173.
55. Houghton O, McCluggage WG. The expression and diagnostic utility of p63 in the female genital tract. Adv Anat Pathol 2009; 16 (5): 316–321. doi: 10.1097/PAP. 0b013e3181b507c6.
56. Sams RN, Gnepp DR. P63 expression can be used in differential diagnosis of salivary gland acinic cell and mucoepidermoid carcinomas. Head Neck Pathol 2013; 7 (1): 64–68. doi: 10.1007/s12105-012-0403-2.
57. Zhang HJ, Xue WC, Siu MK et al. P63 expression in gestational trophoblastic disease: correlation with proliferation and apoptotic dynamics. Int J Gynecol Pathol 2009; 28 (2): 172–178. doi: 10.1097/PGP.0b013e3181895 55b.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2018 Issue Supplementum 2
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Variability in the Solid Cancer Cell Population and Its Consequences for Cancer Diagnostics and Treatment
- Mitochondrial Processes in Targeted Cancer Therapy
- Ferroptosis as a New Type of Cell Death and its Role in Cancer Treatment
- Possible Usage of p63 in Bioptic Diagnostics
- Importance of Membrane Proteins in the Treatment of Tumor Diseases and the Possibilities of Their Further Study
- Effect of DNA Methylation on the Development of Cancer
- The Role of HSP70 in Cancer and its Exploitation as a Therapeutic Target
- The Role of HSF1 Protein in Malignant Transformation
- HDM2 and HDMX Proteins in Human Cancer
- Prima-1 and APR-246 in Cancer Therapy
- Acetylsalicylic Acid and its Potential for Chemoprevention of Colorectal Carcinoma
- Expression and Functional Characterization of miR-34c in Cervical Cancer
- Current Methods of microRNA Analysis
- Proteogenomic Platform for Identification of Tumor Specific Antigens
- Circulating Myeloid-Derived Suppressor Cell Subsets in Patients with Colorectal Cancer – Exploratory Analysis of Their Biomarker Potential
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Effect of DNA Methylation on the Development of Cancer
- Ferroptosis as a New Type of Cell Death and its Role in Cancer Treatment
- Possible Usage of p63 in Bioptic Diagnostics
- Current Methods of microRNA Analysis
