Rozšířený transnazální endoskopický přístup k nádorům lebeční spodiny a očnice
Extended Transnasal Endoscopic Approach for Skull Base Tumors and Tumors of the Orbit
Aim:
The aim of the paper was to evaluate our experience with the extended endoscopic transnasal approach in resection of tumors of the skull base and orbit, as an alternative to the transcranial microscopic approach.
Material and methods:
Between April 2009 and September 2011, 13 patients underwent surgery using the extended transnasal endoscopic approach. The surgery was to treat meningioma in two patients, craniopharyngioma in five patients, epidermoid cyst in one patient, lymphoma of the pterygopalatine fossa in one patient and tumors of the orbit in four patients (histologically these were neurofibroma, leiomyoma, metasthasis and optic glioma).
Results:
Radical excision was achieved in eight patients in total. Of these, two patients had meningioma, three patients had craniopharyngioma, one patient had epidermoid cyst and two patients had orbital tumors. Partial resection, biopsy or decompression of the orbit and optic canal was performed in the remaining patients. Postoperative cerebrospinal fluid leak requiring transnasal endoscopic reoperation occurred in three patients and three patients experienced transient diabetes insipidus.
Conclusion:
The extended endoscopic transnasal approach is an alternative method for resection of tumors of the skull base and orbit. At present, this technique should be indicated as the first-choice method for resections of medial orbital tumors. Long-term results are required before a conclusion on the advantage of endoscopic approach over the transcranial microscopic approach of the skull base tumors can be made.
Key words:
skull base – orbit – endoscopy – transnasal surgery – craniopharyngioma – meningioma
Authors:
R. Lipina 1; P. Matoušekihash2 2,3 2,3
Authors‘ workplace:
Neurochirurgická klinika FN Ostrava
1; ORL klinika FN Ostrava
2; LF Ostravské univerzity
3
Published in:
Cesk Slov Neurol N 2012; 75/108(3): 326-332
Category:
Original Paper
Overview
Cíl:
Cílem práce je zhodnotit zkušenosti s rozšířeným transnazálním endoskopickým přístupem k resekci nádorů lebeční spodiny a očnice jako alternativou k mikrochirurgickému transkraniálnímu přístupu.
Soubor a metodika:
V době od dubna 2009 do září 2011 jsme operovali 13 pacientů s použitím rozšířeného transnazálního endoskopického přístupu. U dvou pacientů se jednalo o meningeom, u pěti pacientů o kraniofaryngeom, jeden pacient byl operován pro epidermoidní cystu, jeden pacient pro lymfom pterygopalatinní jámy a čtyři pacienti pro tumor očnice, histologicky se jednalo o neurofibrom, leiomyom, metastázu a gliom optiku.
Výsledky:
Radikální resekce bylo dosaženo celkem u osmi pacientů. Z hlediska typu nádoru pak u dvou pacientů s meningeomem, u tří pacientů s kraniofaryngeomem, u pacienta s epidermoidní cystou a u dvou pacientů s nádorem očnice. U zbylých pacientů byla provedena parciální exstirpace, biopsie nebo dekomprese orbity a optického kanálu. U tří pacientů se vyskytla pooperační likvorea s nutností transnazální endoskopické revize a u tří pacientů se objevil přechodný diabetes insipidus.
Závěr:
Rozšířený transnazální endoskopický přístup představuje alternativní metodu resekce nádorů lebeční spodiny a očnice. V dnešní době by měl být indikován jako metoda první volby pro nádory očnice mediální lokalizace. Až dlouhodobé výsledky ukáží, ve kterých indikacích bude preferován před transkraniální mikroskopickou technikou i pro nádory lebeční spodiny.
Klíčová slova:
lebeční spodina – orbita – endoskopie – transnazální chirurgie – kraniofaryngeom – meningeom
Úvod
Transnazální endoskopický přístup k selární oblasti byl poprvé popsán v roce 1992 Jankowskim [1], k jeho rutinnímu rozšíření pak přispěli zejména Jho a Carrau [2] a Cappabianca et al [3]. Tento přístup patří mezi nové techniky, které se postupně rozšiřují na pracovištích v České republice. Tvoří alternativu k mikroskopickému přístupu transkraniálnímu i transnazálnímu, které lze také využít k dosažení nádorů v selární oblasti, a je užíván zejména k resekci adenomů hypofýzy. Se zvládnutím této techniky, společně s technologickým rozvojem a spoluprací s otorinolaryngology se začal endoskopický přístup používat i pro resekci dalších patologií, lokalizovaných i mimo oblast selární krajiny. Tento endoskopický přístup, který nazýváme rozšířený transnazální endoskopický přístup (RTEP), je možné využít k exstirpaci zejména extraaxiálních nádorů, jako jsou meningeomy a kraniofaryngeomy, ale i pro jiné patologie v oblasti lebeční spodiny a očnice, přičemž některá renomovaná centra jsou schopna endoskopicky obsáhnout prakticky celou oblast lebeční spodiny [4–8]. V článku prezentujeme naše zkušenosti s RTEP a náš pohled na jeho indikaci.
Soubor a metodika
V době od dubna 2009 do září 2011 bylo na Neurochirurgické klinice FN Ostrava provedeno celkem 13 výkonů rozšířeným transnazálním endoskopickým přístupem u pacientů s nádory v oblasti lebeční spodiny a v oblasti očnice.
U všech pacientů bylo předoperačně provedeno oční vyšetření se zhodnocením perimetru, u pacientů, kde měl nádor vztah k hypofýze či hypothalamu, pak bylo provedeno endokrinologické vyšetření, aby byla vyloučena dysfunkce hypothalamo-hypofyzární osy.
Všichni pacienti byli také předoperačně vyšetřeni pomocí magnetické rezonance (MR) a počítačové tomografie (CT) mozku, nálezy byly pak sfúzovány a použity pro peroperační bezrámovou navigaci (Medtronic, Stealth Station). Operace byly prováděny pomocí endoskopu 4 mm s přímou nebo 30° optikou, s integrovaným proplachem a s použitím videořetězce s vysokým rozlišením (Bbraun).
Pacienti byli operováni v celkové anestezii operačním týmem, který se skládal z neurochirurga a otorinolaryngologa.
V případě nejčastějšího přístupu transtuberkulárního/transplanárního je operace prováděna binostrálně tak, aby bylo možno využít výhody čtyřručního operování. Na začátku operace je resekována střední skořepa, a to na straně, kde operuje neurochirurg, což je většinou vpravo. Resekci střední skořepy rutinně nevyužíváme při resekcích adenomů hypofýz, v případě rozšířeného přístupu je však větší manévrovací prostor nutný pro mikrochirurgické operování. Zároveň je otorinolaryngologem připraven nazoseptální lalok ze sliznice septa, na straně resekované skořepy, s ponecháním vaskulární stopky a do konce operace je uložen do oblasti nazofaryngu.
Poté je otevřen sfenoidální sinus s resekcí zadní části septa tak, aby bylo operační pole zpřístupněno oboustranně, a je resekováno případné intrasfenoidální septum. Dalším krokem je otevření zadních čichových sklípků tak, aby byl vizualizováno planum sfenoidale dle plánovaného rozsahu přístupu.
Po dokončení přístupu otorinolaryngologem (obr. 1) pokračuje neurochirurg s frézováním a odštípáním selární oblasti, přední části tuberkula sedla a planum sfenoidale dle rozsahu nádoru. Poté následuje durotomie s bazí k přednímu interkavernóznímu splavu, který koagulujeme nebo stavíme jeho krvácení hemostatickým materiálem (Surgical fibrilar). Při samotné resekci nádoru pak užíváme i ultrasonoaspirátor k vnitřní dekompresi v případě meningeomů či solidních porcí kraniofaryngeomů, dále je nádor odstraňován použitím mikrochirurgické techniky (obr. 2).
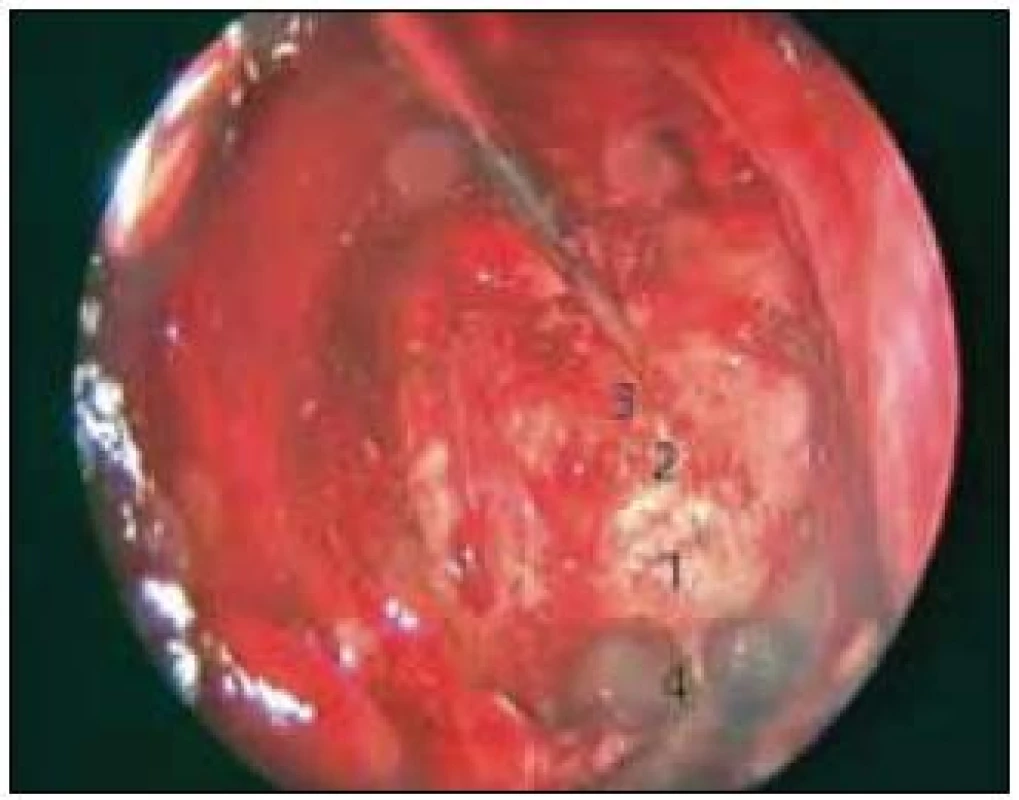

Při uzavírání durálního používáme různé techniky (tab. 1), u posledních čtyř pacientů jsme pak použili sendvičový uzávěr tvrdé pleny náhradou tvrdé pleny (Duraform) nebo fasciovým štěpem z vnitřní a zevní strany a celou oblast defektu jsme překryli předem připraveným nazoseptálním lalokem a zajistili na okrajích tkáňovým lepidlem (obr. 3). Na konci výkonu pak pod endoskopickou kontrolou vkládáme kompresivní tamponádu k nazoseptálnímu laloku a ponecháváme ji pět dní. Zatímco u prvních čtyř operací jsme používali Foleyho katétr, nyní preferujeme samoexpanzivní oboustrannou tamponádu (Merocel).
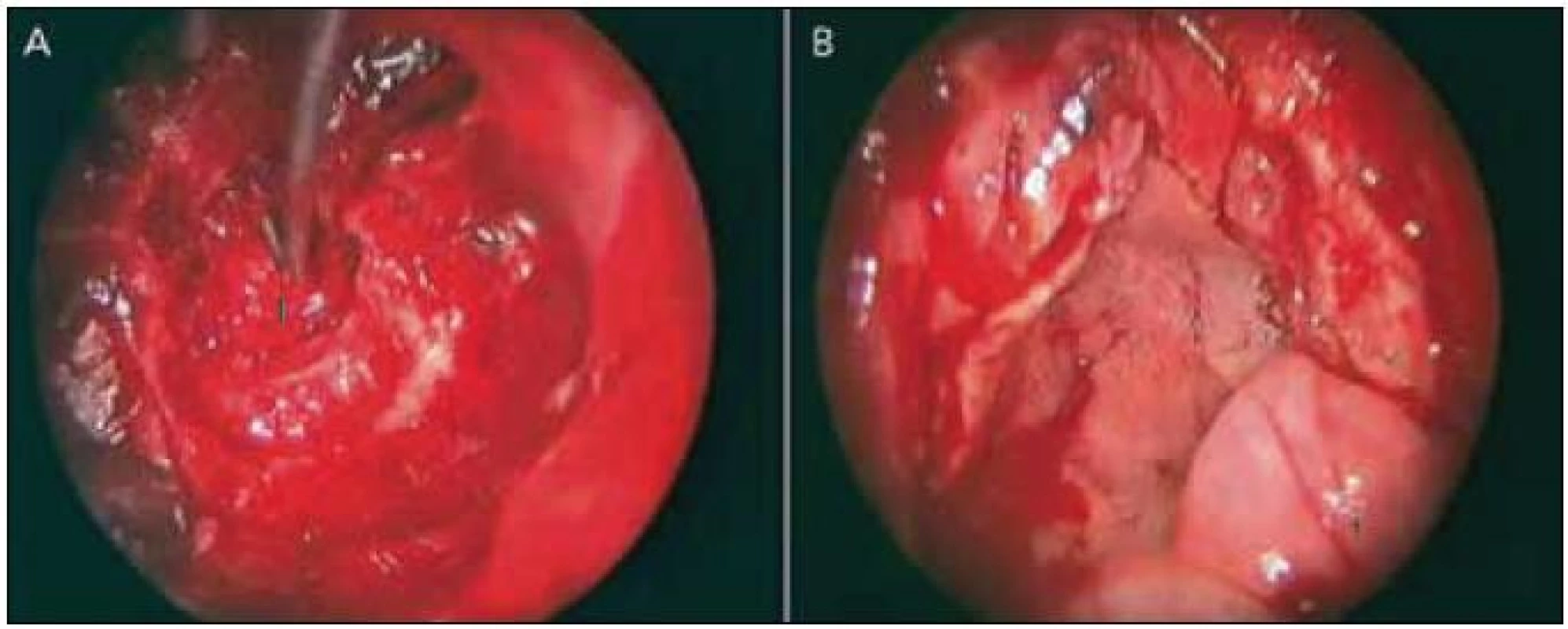
Standardně zavádíme předoperačně zevní lumbální drenáž a ponecháváme ji do odstranění tamponády.
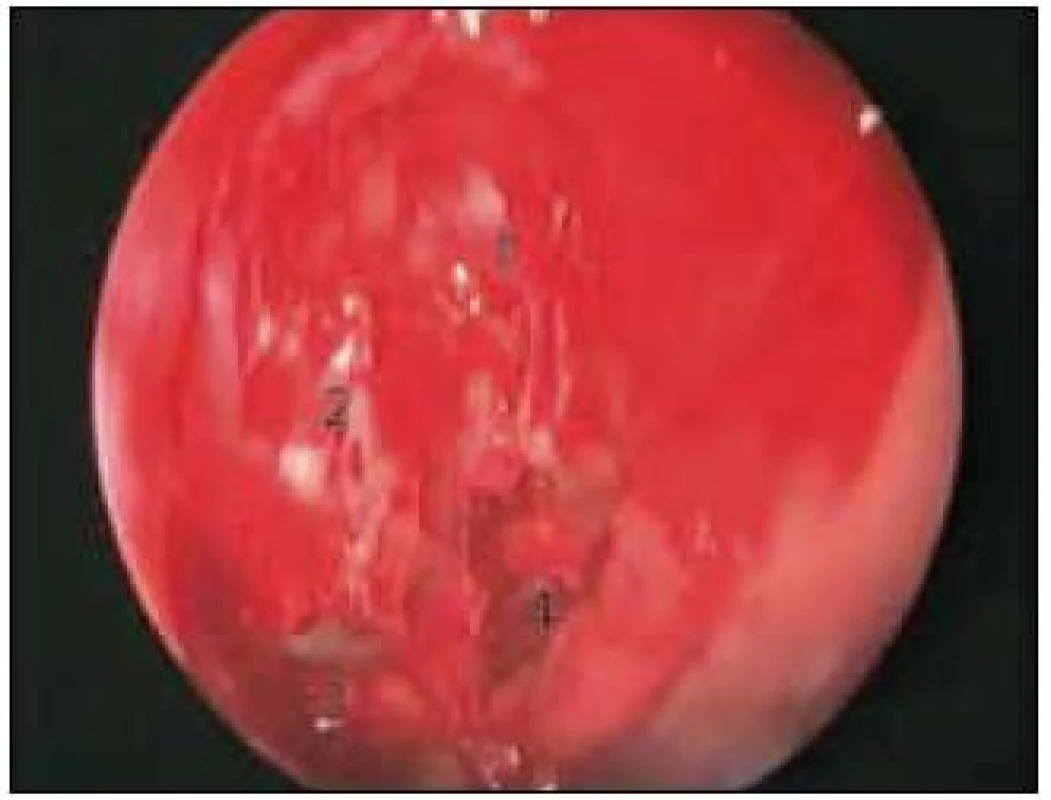
V případě transethmoidálního a transmaxilárního koridoru užíváme mononostrální přístup, a to na straně léze. V případě přístupu do očnice je resekována střední skořepa pro zvětšení manipulačního prostoru a je otevřen sfenoidální sinus ze strany léze, bez nutnosti resekce zadní strany přepážky. Dále jsou otevřeny čichové sklípky a rozšířen vstup do čelistní dutiny, čímž je umožněn přístup k dolní a vnitřní stěně orbity a dále přístup k průběhu optického nervu, je-li třeba až k chiazmatu (obr. 4). Po resekci lamina papyracea a protětí periorbity je proveden samotný výkon. Pokud není při exstirpaci postupováno až k optickému kanálu, není samozřejmě třeba řešit likvoreu. Na konci operace vkládáme jednostrannou tamponádu Merocelem, který odstraňujeme první pooperační den.
Pacienti jsou po operaci sledováni na JIP, propouštíme je pak domů při vyloučení likvorey a úpravě event. hormonální dysbalance, což platí zejména pro kraniofaryngeomy. Po propuštění domů je pacient kontrolován otorinolaryngologem za dva týdny a dále dle potřeby. MR mozku standardně probíhá v odstupu tří měsíců po operaci a pacienti jsou zhodnoceni s aktuálním nálezem perimetru a v případě potřeby i endokrinologickým vyšetřením.
Výsledky
Rozšířeným transnazálním endoskopickým přístupem bylo operováno celkem 13 pacientů, z toho dva pro meningeom, pět pacientů pro kraniofaryngeom (dva pacienti již byli v minulosti operováni transkranálním přístupem), jeden pacient pro epidermoidní cystu, jeden pacient pro nádor v oblasti fossa pterygopalatina a čtyři pacienti pro nádor očnice, kde se jednalo o jednoho pacienta s leiomyomem, jednoho pacienta s metastázou, dalšího pacienta s neurofibromem a dětského pacienta s gliomem optiku.
Radikální resekce byla provedena u osmi pacientů (dva pacienti s meningeomem, tři pacienti s kraniofaryngeomem a dva pacienti s tumorem očnice). Parciální resekce byla vykonána u dvou pacientů s kraniofaryngeomem, kde po operaci došlo k ústupu chiazmatického syndromu, a dále u jednoho pacienta s nádorem očnice, kde je ponecháno reziduum stacionární. U jednoho pacienta s gliomem optiku byla provedena jen dekomprese orbity a optického kanálu. Pacientovi s nádorem v oblasti fossa pterygopalatina byla z transmaxilárního přístupu provedena biopsie. Vzhledem k nálezu lymfomu následovala pak onkologická, resp. hematologická léčba. U pacientů s nádory očnice předoperačně dominovala v klinice jednostranná porucha vizu a protruze bulbu u všech čtyř pacientů. U tří pacientů po radikální, resp. parciální resekci došlo k úplné normalizaci jak vizu, tak úpravě protruze. U dětského pacienta po dekompresi očnice došlo jen k úpravě protruze bulbu, vizus zůstal stacionární. U ostatních pacientů s lézí lokalizovanou v oblasti supraselární byl předoperačně dominujícím příznakem chiazmatický syndrom (osm pacientů) a hypopituitarizmus (pět pacientů). U jednoho pacienta s kraniofaryngeomem byla přítomna hypothalamická obezita. Po operaci došlo k úplné úpravě perimetru u pěti pacientů a ke zlepšení nálezu u zbylých tří pacientů. Všichni pacienti s předoperačním hypopituitarizmem byli i po operaci na substituční terapii.
Mortalita byla v našem souboru nulová. Zaznamenali jsme šest komplikací u celkem čtyř pacientů. U tří pacientů jsme řešili pooperační likvoreu. Všichni pacienti byli reoperováni stejným endoskopickým transnazálním přístupem s provedením plastiky s užitím náhrady tvrdé pleny (Duraform) a tkáňového lepidla (Tissucol) nebo adhezivního materiálu (Tachosil). U tří pacientů došlo k přechodnému zhoršení hormonálních funkcí ve smyslu diabetes insipidus, u jednoho z nich byla nutná trvalá medikace desmopresinem i po propuštění, nyní je již vysazena.
V našem souboru jsme nezaznamenali pooperační zhoršení zraku. Přehled pacientů je v tab. 1.
Diskuze
S rozvojem transnazální endoskopické chirurgie pro adenomy hypofýzy se postupně začaly objevovat práce popisující rozšířený endoskopický přístup, tj. nejen k samotnému tureckému sedlu, ale také k okolním oblastem a postupně k celé oblasti lebeční spodiny. Tento přístup umožňuje resekci i intradurálně lokalizovaných nádorů, převážně meningeomů a kraniofaryngeomů [4–10].
Samotné rozšířené přístupy jsou rozdělovány podle více hledisek. Autoři Schwartz et al [11] užívají rozdělení podle koridoru nosní dutiny, kterou se přistupuje k lézi. Kassam et al [4,5] proti tomu volí dělení podle části lebeční spodiny, kterou přistupujeme k operované oblasti a zároveň podle směru rozšíření přístupu v sagitální nebo koronární rovině. Bez ohledu na použitou klasifikaci rozšířených přístupů platí obecně, že je smyslem a účelem najít takovou trajektorii k nitrolebnímu nádoru, která umožňuje nádor bezpečně odstranit za kontroly okolních neurovaskulárních struktur, přitom však s jejich minimální manipulací.
Transnazální endoskopický přístup je dnes obecně metoda první volby při resekcích adenomů hypofýzy, přestože je mikroskopický transsfenoidální přístup stále, a se srovnatelnými výsledky, používán [12–15]. Naproti tomu RTEP pro intrakraniální léze lebeční spodiny je nadále jen alternativa mikrochirurgického přístupu z kraniotomie a jeho indikace se na různých pracovištích liší, a to od úplného zamítnutí až po entuziazmus v užívání RTEP pro všechny dostupné léze [16,17]. Při srovnání RTEP a mikroskopického přístupu z kraniotomie najdeme argumenty pro použití obou přístupů.
Výhodou transnazálního endoskopického přístupu ve srovnání s kraniotomií a mikroskopicky kontrolovanou operací je nepřítomnost operační jizvy, rychlejší rekonvalescence pacientů a větší přístup i viditelnost v operované oblasti. Není nutná retrakce mozku a ve většině případů ani manipulace s neurovaskulárními strukturami, které jsou nádorem vytlačeny dorzálně či kraniálně. Dále je to alternativa přímého přístupu k origu nádoru, což platí zejména u meningeomů, s možností časné devaskularizace a resekce durálního i kostního origa nádoru (tab. 2).
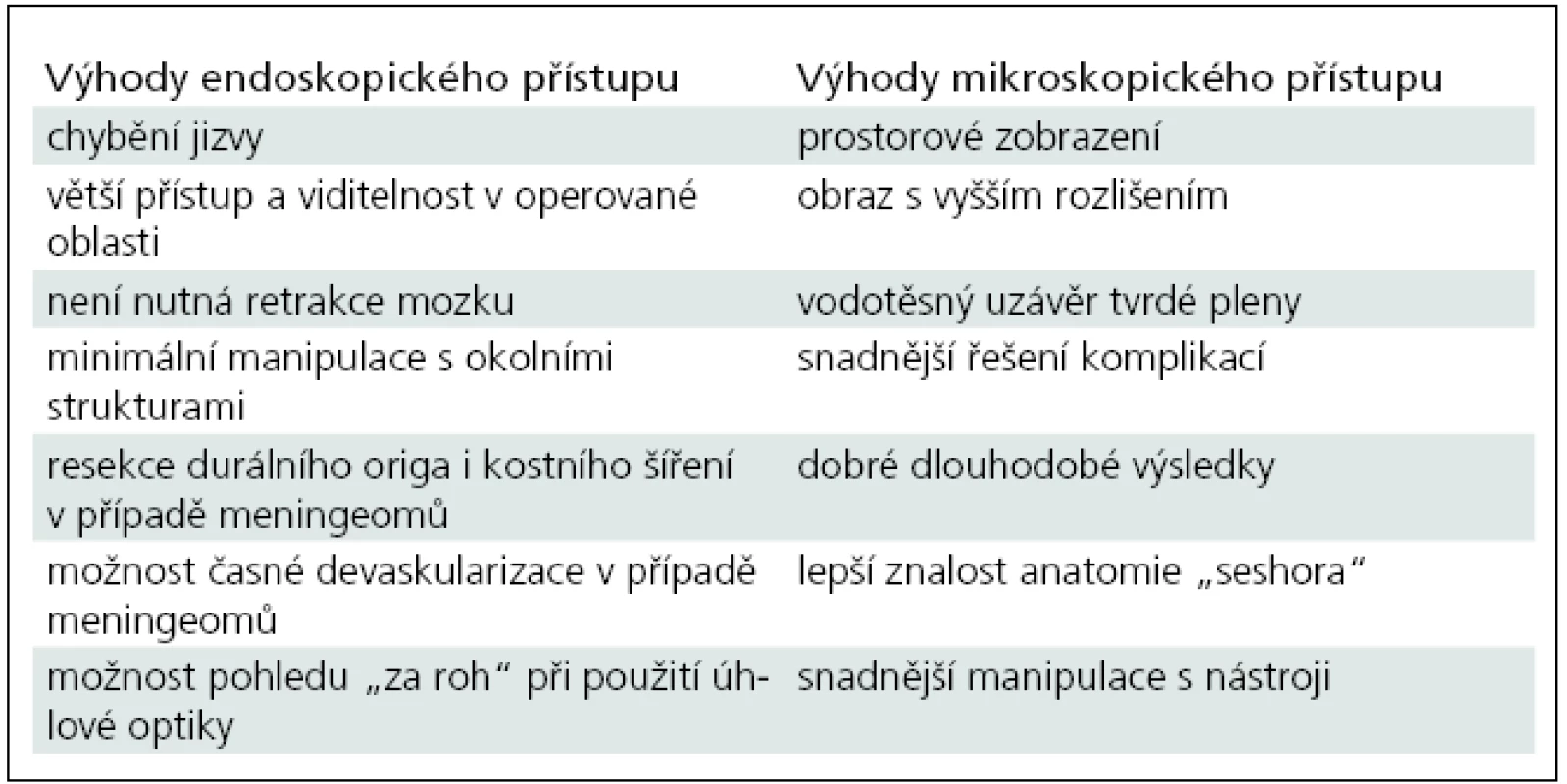
Nevýhodou RETP naopak zůstává v současné době a na většině pracovišť možnost „jen“ 2D zobrazení a také horšího vizuálního rozlišení endoskopu (a to i v případě videořetězce s vysokým rozlišením) ve srovnání s mikroskopickým zobrazením. První nevýhodu lze částečně eliminovat aktivní spoluprací asistence, která změnou vzdálenosti a rotací optiky umožňuje získat alespoň „mentální prostorové zobrazení“ operačního pole. Asi největší nevýhodou je pak omezená možnost řešení peroperačních komplikací, zejména cévního poranění. Tento problém se ostatně týká obecně i ventrikulární endoskopie. My jsme takovou situaci nezaznamenali, v literatuře jsou nicméně tyto komplikace popsány [18–22]. Při cévním poranění je doporučováno ošetření bipolární koagulací či klipem, nebo řešení tamponádou pomocí hemostatického materiálu a urgentním endovaskulárním zákrokem [7,18,22]. Dle literárních údajů se intrakraniální cévní poranění u transnazálních endoskopických výkonů obecně vyskytuje v 0,3–0,68 % [18,19,22], v případě rozšířených endoskopických přístupů pak v 1,1–10 % [21,22]. Další nevýhodou RETP je pak obtížné uzavření velkého durálního defektu. Tyto dvě poslední popsané nevýhody hrají dle našeho názoru hlavní roli v rezervovaném přístupu mnoha pracovišť k endoskopické technice v těchto indikacích a jejich vyřešení je pak hlavní výzvou do budoucna. Naproti tomu „očekávanější“ infekční komplikace po operaci v otevřených likvorových prostorách přes dutinu nosní, kde nelze zajistit dokonalou sterilitu, jsou dle literatury nízké, uváděné mezi 1–2 % [7,22]. V našem souboru se infekční komplikace nevyskytla. Permanentní morbidita a mortalita RTEP je ve velkých souborech pacientů uváděna v 2,6 % [22].
V našem souboru máme z rozšířených přístupů zkušenosti s transtuberkulárním//transplanárním přístupem, transmaxilárním přístupem a transethmoidálním přístupem do očnice. Pokud se týká vlastního rozšířeného transnazálního endoskopického přístupu, je nutno zdůraznit, že zatím stále i na našem pracovišti zůstává jen alternativou k otevřenému mikroskopickému přístupu. Jeho indikace je obecně ovlivněna více faktory: zkušenost pracoviště s endoskopickou technikou, charakter a lokalizace nádoru, předchozí intrakraniální výkony, komorbidita pacienta.
V našem souboru jsme použili RETP pro resekci meningeomů, kraniofaryngeomů, epidermoidní cysty, tumorů očnice a tumoru infratemporální jámy. Rozšířený přístup transselární/transtuberkulární používáme i pro některé makroadenomy hypofýzy s výraznou supra/preselární propagací a přístup transcribriformní a transfrontální pak pro primární či sekundární nádory paranazálních dutin s šířením do lebeční spodiny, při kombinaci endoskopie a kraniotomie. Tito pacienti však nebyli předmětem tohoto článku.
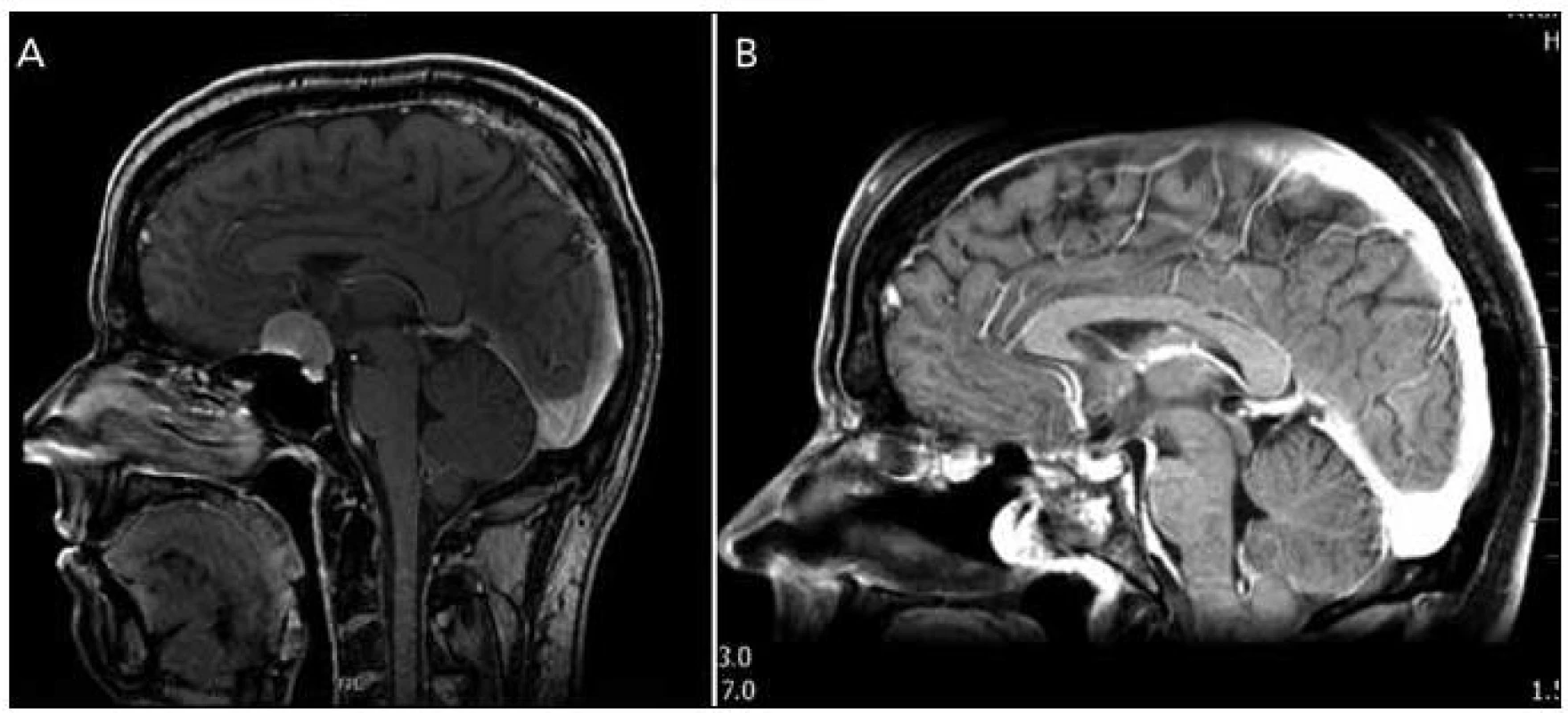
Dle našich, zatím malých, zkušeností se nám nejvhodnějším kandidátem pro RETP jeví pacienti s meningeomem v oblasti planum sfenoidale a/nebo tubercullum sellae, bez laterálního šíření (obr. 5). Zvláště pokud je možno nádor oddělit od arachnoidey, je operace nekomplikovaná a vzhledem k odstranění cévního zásobení během přístupu je i přehledná, s minimálním krvácením, což umožňuje bezpečnou identifikaci zejména chiazmatu a komplexu přední mozkové arterie při resekci. Výhodou je také možnost odstranění jak durální, tak i případné kostní infiltrace meningeomem. Jsme si však vědomi, že právě meningeomy v uvedené lokalizaci jsou hraniční indikací pro RTEP, a to právě pro relativní „jednoduchost“ jejich odstranění supraorbitálním, subfrontálním či pteryonálním přístupem s velmi dobrými výsledky a minimálními komplikacemi [23,24]. Z tohoto důvodu je pak některými autory endoskopický přístup pro meningeomy této lokalizace zcela odmítán [16]. V literatuře lze najít práce srovnávající oba přístupy. Podle prací více autorů (de Divitiis et al [25], Fatemi et al [26] a Kitano et al [27]) je radikalita resekce srovnatelná u obou přístupů, u transnazálně řešených pacientů je pak nižší výskyt pooperačního zhoršení vizu, které se po transkraniálních operacích uvádí mezi 7 a 12 % [17]. Naopak je vyšší incidence pooperační pituitární dysfunkce u endoskopicky operovaných pacientů a očekávaně je pak vyšší riziko pooperační likvorey, které se pohybuje v rozmezí 16–40 % [25–28]. Van Gompel et al v metaanalýze 69 endoskopicky resekovaných meningeomů pak uvádějí radikální resekci u 76 % pacientů a výskyt pooperační likvorey u 32 % pacientů [17]. Nutno však zdůraznit, že práce obsahují malé soubory a krátkou dobu sledování a také zahrnují i pacienty z počátků rozšíření endoskopie, kdy ve výsledcích hraje roli ještě malá zkušenost pracovišť, což ovlivňuje zejména incidenci pooperační likvorey.
V případě kraniofaryngeomů je situace odlišná. Kraniofaryngeomy, přestože se jedná o histologicky benigní léze, jsou většinou obtížně řešitelné jakýmkoli přístupem. Neurochirurg je vždy v dilematu mezi radikální resekcí s rizikem hypothalamického postižení nebo subtotální resekcí s rizikem recidivy nádoru. Pro indikaci RETP je velmi důležitá lokalizace kraniofaryngeomu k chiazmatu, hypothalamu, 3. komoře, cévním strukturám a v neposlední řadě ke stopce hypofýzy. Většina klasifikací kraniofaryngeomů byla vytvořena pro výběr vhodného mikroskopického přístupu [29,30]. Klasifikace dle Šteňa et al [30–32] umožňuje nejen výběr vhodného přístupu, ale dle vztahu tumoru k hypothalamu a 3. komoře i stanovit míru bezpečné radikality resekce. Tato klasifikace dělí kraniofaryngeomy dle lokalizace na: intraselární a supraselární, supraselární extraventrikulární, intraventrikulární a extraventrikulární a intraventrikulární. Klasifikace pro indikaci endoskopického přístupu publikovaná Kassamem et al [33] se zaměřuje na lokalizaci kraniofaryngeomu vzhledem ke stopce hypofýzy a rozděluje kraniofaryngeomy na typy: I. preinfundibulární, II. transinfundibulární, III. retroinfundibulární (IIIa) s propagací do 3. komory, IIIb) s propagací do interpedunkulární cisterny), IV. izolovaný ve 3. komoře. K transnazální endoskopické resekci jsou doporučeny typy I, II a III, s různými modifikacemi přístupu pro každý typ. Intraventrikulární lokalizace, typ IV, je pak k transnazálnímu endoskopickému přístupu kontraindikován.
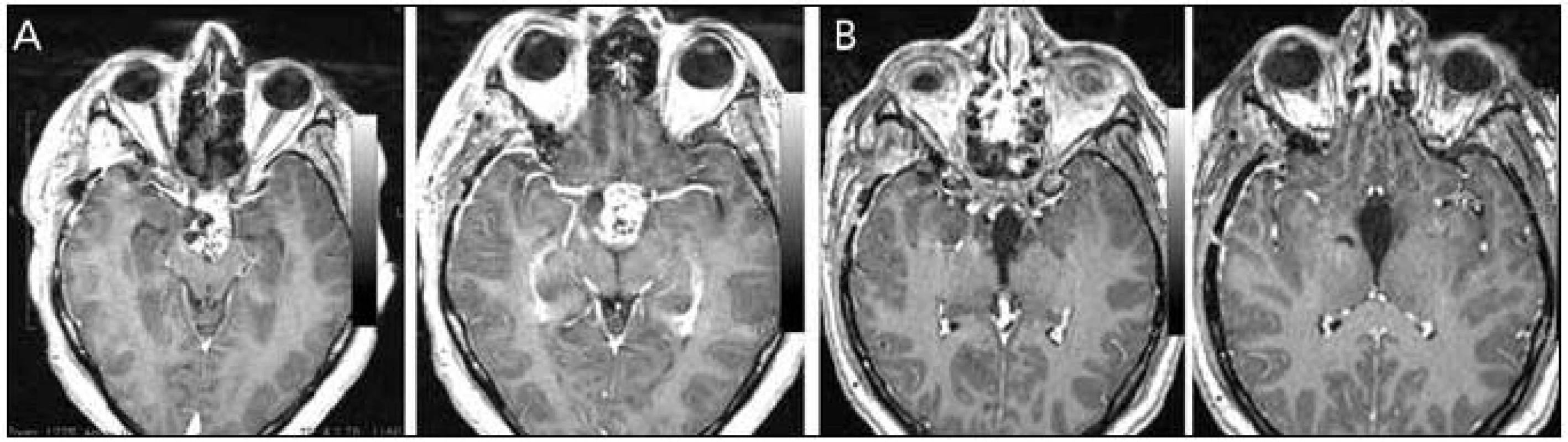
Endoskopické odstranění kraniofaryngeomu je dle našeho názoru technicky obtížnější ve srovnání s meningeomem nebo lézemi jako epidermoidní cysta a v našem souboru jsme radikální resekce dosáhli u tří z pěti pacientů. Z hlediska klasifikace dle Kassama se jednalo o typ I, II a III, čili doporučované k transnazálnímu endoskopickému přístupu (obr. 6). V literatuře najdeme jen málo prací srovnávajících endoskopický transnazální a transkraniální přístup. V práci Stamm et al vyznívá porovnání transkraniálního mikroskopického a endoskopického přístupu srovnatelně co do radikality resekce a pooperačního zlepšení endokrinních funkcí, lépe pro endoskopický přístup, pokud jde o výskyt pooperačních hypothalamických dysfunkcí a pooperačního zlepšení vizu [34]. Problémem opět zůstává vyšší incidence pooperační likvorey.
U lézí v oblasti očnice je výběr operačního přístupu určován lokalizací léze. V případě lézí lokalizovaných mediálně, apikálně či mediokaudálně je endoskopický transethmoidální přístup metodou volby, jež umožňuje dekompresi optiku a resekci nádoru. Očnice je obecně mezioborová záležitost a na našem pracovišti je vždy řešena spoluprací mezi očním chirurgem, otorinolaryngologem a neurochirurgem. Vzhledem k obtížnosti přístupu k lézím mediální části orbity či pterygopalatinní jámy jinou než transnazální cestou, je u těchto nádorů indikace endoskopického transnazálního přístupu, podle nás, jednoznačná.
Uzavření durálního defektu je pak samostatnou částí operace, která významně ovlivňuje procento komplikací a musí jí být věnována stejná pozornost jako samotné resekci tumoru. V literatuře najdeme práce s vysokou incidencí pooperační likvorey s nutností operační revize, která dosahuje 14,5 až 40 % [25,26,28,35]. Publikované práce stejných pracovišť po získání zkušeností a změně způsobu uzávěru defektu však ukazují výrazné snížení pooperační likvorey pod 6 % [22,35]. Bylo popsáno několik metod k uzávěru durálního defektu za užití tukového štěpu, fasciového štěpu, sendvičové techniky a nazoseptálního laloku [36,37]. Každá metoda má své zastánce i odpůrce, stejně jako rutinní užívání zevní lumbální drenáže po výkonu. V našem souboru máme počet pooperačních likvorejí vysoký, 23 %, resp. po vyloučení pacientů s lézí očnice a pterygopalatinní jámy, kde je likvorea nepravděpodobná, je procento likvorejí v našem souboru 37,5 %. Vyzkoušeli jsme více technik, nicméně u posledních pacientů a se zvládnutou technikou nazoseptálního laloku, kterou jsme použili u posledních čtyř pacientů, se pooperační likvorea objevila u jednoho pacienta. U něho nebylo možné peroperačně zavést zevní lumbální drenáž, kterou jinak u těchto pacientů užíváme standardně. Jistě má vliv i „křivka učení“ při uzavírání defektu v našem malém souboru. Je třeba také zdůraznit, že ač je likvorea potenciálně nebezpečnou komplikací, v pooperačním období bývá vždy objevena okamžitě, pacient je pod clonou antibiotik a samotná reoperace není časově ani technicky náročná. Dle našeho názoru tak vyšší incidence likvorey není kontraindikací RTEP.
Při indikaci RTEP v dnešní době hraje roli i kosmetická stránka operace. Pacienti samozřejmě preferují operaci mozku „bez jizvy“. Toto hledisko miniinvazivní endoskopický přístup splňuje. Je však také třeba zdůraznit, že miniinvazivita neznamená jen „chybění kožního řezu“. I z malého přístupu, nebo možná právě z malého přístupu a při nedostatku zkušeností, je možné způsobit závažné komplikace jak intranazální, tak intrakraniální a těžké poškození pacienta. K minimalizaci komplikací preferujeme na našem pracovišti předoperační, peroperační i pooperační spolupráci neurochirurga a otorinolaryngologa. Konečná indikace k operaci je však vždy v rukou neurochirurga a v dnešní době bude individuální dle zkušeností pracoviště. Až dlouhodobé výsledky, nejlépe z prospektivních studií, ukáží, zda a v jakých indikacích bude v budoucnosti RTEP obecně preferován před transkraniální mikroskopickou technikou.
Závěr
RTEP je nově se rozvíjející technika, která do neurochirurgické praxe přináší další možnost odstraňování často obtížně lokalizovaných nádorů v oblasti lebeční spodiny a očnice. Její výhodou je zcela jistě pacienty vnímaná miniinvazivita, tj. chybění kožního řezu a z neurochirurgického pohledu pak minimální manipulace s mozkovou tkání a neurovaskulárními strukturami během výkonu. V případě nádorů očnice by RTEP měl být dnes metodou první volby při resekci nádorů mediální lokalizace. V případě nádorů lebeční spodiny jejímu plnému rozšíření zatím brání poměrně vysoké procento komplikací, zejména pooperační likvorey a také obtížné řešení peroperačních komplikací. Po vyřešení těchto problémů se, dle našeho názoru, může RTEP stát plnohodnotnou náhradou standardního mikrochirurgického transkraniálního přístupu.
MUDr. Radim Lipina, Ph.D.
Neurochirurgická klinika
FN Ostrava
17. listopadu 1790
708 52 Ostrava-Poruba
e-mail: radim.lipina@gmail.com
Přijato k recenzi: 17. 10. 2011
Přijato do tisku: 28. 11. 2011
Sources
1. Jankowski R, Auque J, Simon C, Marchal JC, Hepner H, Wayoff M. Endoscopic pituitary surgery. Laryngoscope 1992; 102(2): 198–202.
2. Jho HD, Carrau RL. Endoscopic endonasal transsphenoidal surgery: experience with fifty patients. J Neurosurg 1997; 87(1): 44–51.
3. Cappabianca P, Alfieri A, de Divitiis E. Endoscopic endonasal transsphenoidal approach to the sella: towards functional endoscopic pituitary surgery (FEPS). Minim Invasive Neurosurg 1998; 41(2): 66–73.
4. Kassam A, Snyderman CH, Mintz A, Gardner P, Carrau RL. Expanded endonasal approach: the rostrocaudal axis. Part I. Crista galli to the sella turcica. Neurosurg Focus 2005; 19(1): E3.
5. Kassam A, Snyderman CH, Mintz A, Gardner P, Carrau RL. Expanded endonasal approach: the rostrocaudal axis. Part II. Posterior clinoids to the foramen magnum. Neurosurg Focus 2005; 19(1): E4.
6. Kassam A, Gardner P, Snyderman CH, Mintz A, Carrau R. Expanded endonasal approach: fully endoscopic, completely transnasal approach to the middle third of the clivus, petrous bone, middle cranial fossa, and infratemporal fossa. Neurosurg Focus 2005; 19(1): E6.
7. Snyderman CH, Pant H, Carrau RL, Prevedello D, Gardner P, Kassam AB. What are the limits of endoscopic sinus surgery? The expanded endonasal approach to the skull base. Keio J Med 2009; 58(3): 152–160.
8. Laufer I, Anand VK, Schwartz TH. Endoscopic, endonasal extended transsphenoidal, transplanum transtuberculum approach for resection of suprasellar leasions. J Neurosurg 2007; 106(3): 400–406.
9. Frank G, Pasquini E, Mazzatenta D. Extended transsphenoidal approach. J Neurosurg 2001; 95(5): 917–918.
10. Zada G, Kelly DF, Cohen P, Wang C, Swerdloff R. Endonasal transsphenoidal approach for pituitary adenomas and other sellar laesions: an asessment of efficacy, safety, and patients impressions. J Neurosurg 2003; 98(2): 350–358.
11. Schwartz TH, Fraser JF, Brown S, Tabaee A, Kacker A, Anand VK. Endoscopic cranial base surgery: Clasification of operative approaches. Neurosurgery 2008; 62(5): 991–1005.
12. Náhlovský J, Česák T, Látr I, Čáp J, Žižka J, Krajina A. Komplikace transsfenoidálních operací u našich nemocných – příčiny, řešení. Cesk Slov Neurol N 2004; 67/100(2): 112–119.
13. Sameš M, Vachata P, Saur K, Budíková M. Přímý transnazální miniinvazivní přístup pro mikrochirurgickou resekci adenomů hypofýzy. Cesk Slov Neurol N 2005; 68/101(5): 337–341.
14. Higgins TS, Courtemanche CH, Karakla D, Strasnick B, Singh RV, Koen JL et al. Analysis of transnasal endoscopic versus transseptal microscopic approach for excision of pituitary tumors. Am J Rhinol 2008; 22(6): 649–652.
15. Goudakos JK, Markou KD, Georgalas C. Endoscopic versus microscopic trans-sphenoidal pituitary surgery: a systematic review and meta-analysis. Clin Otolaryngol 2011; 36(3): 212–220.
16. Fahlbusch R, Gerganov VM. Comment on Endonasal versus transcranial resection. Neurosurg Focus 2011; 30(5): E16.
17. Van Gompel JJ, Frank G, Pasquini E, Zoli M, Hoover J, Lanzino G. Expanded endonasal endoscopic resection of anterior fossa meningiomas: report of 13 cases and meta-analysis of the literature. Neurosurg Focus 2011; 30(5): E15.
18. Cavallo LM, Briganti F, Cappabianca P, Maiuri F, Valente V, Tortora F et al. Hemorrhagic vascular complications of endoscopic transsphenoidal surgery. Minim Invasive Neurosurg 2004; 47(3): 145–50.
19. Cappabianca P, Cavallo LM, Colao A, de Divitiis E. Surgical complications associated with the endoscopic endonasal transsphenoidal approach for pituitary adenomas. J Neurosurg 2002; 97(2): 293–298.
20. Fatemi N, Dusick JR, de Paiva Neto MA, Kelly DF. The endonasal microscopic approach for pituitary adenomas and other parasellar tumors: a 10-year experience. Neurosurgery 2008; 63 (4 Suppl 2): 244–256.
21. de Divitiis E, Cappabianca P, Cavallo LM, Esposito F, Divitiis O, Messina A. Extended endoscopic transsphenoidal approach for extrasellar craniopharyngiomas. Neurosurgery 2007; 61 (ONS Suppl 2): 219–228.
22. Kassam AB, Prevedello DM, Carrau RL, Snyderman CH, Thomas A, Gardner P et al. Endoscopic endonasal skull base surgery: analysis of complications in the authors’ initial 800 patients. J Neurosurg 2011; 114(6): 1544–1568.
23. Reisch P, Perneczky A. Ten-year experience with supraorbital subfrontal approach through an eyebrow incision. Neurosurgery 2005; 57 (4 Suppl): 242–255.
24. Nakamura M, Roser F, Struck M, Vorkapic P, Samii M. Tuberculum sellae meningiomas: clinical outcome considering different surgical approaches. Neurosurgery 2006; 59(5): 1019–1029.
25. de Divitiis E, Esposito F, Cappabianca P, Cavallo LM, de Divitiis O. Tuberculum sellae meningiomas: high route or low route? A series of 51 consecutive cases. Neurosurgery 2008; 62(3): 556–563.
26. Fatemi N, Dusick JR, de Paiva Neto MA, Malkasian D, Kelly DF. Endonasal versus supra-orbital keyhole removal of craniopharyngiomas and tuberculum sellae meningiomas. Neurosurgery 2009; 64 (5 Suppl 2): 269–286.
27. Kitano M, Taneda M, Nakao Y. Postoperative improvement in visual function in patients with tuberculum sellae meningiomas: results of the extended transsphenoidal and transcranial approaches. J Neurosurg 2007; 107(2): 337–346.
28. Gardner PA, Kassam AB, Thomas A, Snyderman CH, Carrau RL, Mintz AH et al. Endoscopic endonasal resection of anterior cranial base meningiomas. Neurosurgery 2008; 63(1): 36–52.
29. Samii M, Samii A. Surgical management of craniopharyngiomas. In: Schmidek HH (ed). Operative Neurosurgical Techniques: Indications, Methods and Results. Philadelphia: W.B. Saunders, 2000 : 489–502.
30. Šteňo J. Microsurgical topography of craniopharyngiomas. Acta Neurochir Suppl (Wien) 1985; 35 : 94–100.
31. Šteňo J, Bízik I, Šteňo A, Matejčík V. Craniopharyngiomas in children: how radical should the surgeon be? Childs Nerv Syst 2011; 27 : 41–54.
32. Steno J, Malácek M, Bízik I. Tumor-third ventricular relationships in supradiaphragmatic craniopharyngiomas: correlation of morphological, magnetic resonance imaging, and operative findings. Neurosurgery 2004; 54(5): 1051–1060.
33. Kassam AB, Gardner PA, Snyderman CH, Carrau RL, Mintz AH, Prevedello DM. Expanded endonasal approach, a fully endoscopic transnasal approach for the resection of midline suprasellar craniopharyngiomas: a new classification based upon the infundibulum. J Neurosurg 2008; 108(4): 715–28.
34. Stamm AC, Vellutini E, Balsalobre L. Craniopharyngioma. Otolaryngol Clin North Am 2011; 44(4): 937–952.
35. Kassam A, Thomas A, Carrau RL, Snyderman CH, Vescan A, Prevedello D, Mintz A, Gardner P. Endoscopic reconstruction of the cranial base using a pedicled nasoseptal flap. Neurosurgery 2008; 63 (ONS Suppl 1): 44–52.
36. Kassam A, Carrau RL, Snyderman CH, Gardner P, Mintz A. Evolution of reconstructive techniques following endoscopic expanded endonasal approaches. Neurosurg Focus 2005; 19(1): E8.
37. Hadad G, Bassagasteguy L, Carrau RL, Mataza JC, Kassam A, Snyderman CH et al. A novel reconstructive technique after endoscopic expanded endonasal approaches: vascular pedicle nasoseptal flap. Laryngoscope 2006; 116(10): 1882–1886.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2012 Issue 3
- Memantine Eases Daily Life for Patients and Caregivers
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Advances in the Treatment of Myasthenia Gravis on the Horizon
-
All articles in this issue
- Chirurgická léčba revmatického postižení kraniocervikálního přechodu
- Konformačně specifické protilátky a diagnostika prionových chorob
- Low back pain a deprese – vzájemný vztah
- Neurosyfilis
- Diagnostika a možnosti léčby Niemann-Pickovy choroby typ C
- Asociace polymorfizmů v genu pro matrix metalloproteinázu-2 a tkáňový inhibitor metalloproteinázy-2 s roztroušenou sklerózou
- Neurofyziologická diagnostika poškození loketního nervu v oblasti lokte
- Rozšířený transnazální endoskopický přístup k nádorům lebeční spodiny a očnice
- Stanovení mozečkové dominance podle asymetrie svalového tonu končetin
- Operační léčba syndromu tarzálního tunelu
- Zadní interhemisférický prekuneální/transspleniální přístup k intrinsickým mozkovým lézím
- Atypický paraneoplastický neurologický syndrom – kazuistika
- Oboustranná léze n. phrenicus manifestující se jako ortopnoe – kazuistiky tří případů
- Alzheimerova nemoc probíhající pod obrazem kortikobazální degenerace – kazuistika
- Adherence k léčbě u pacientů se schizofrenií
- Tau protein a anti-tau protilátky u pacientů s roztroušenou sklerózou
- Vzorec posturálnych zmien v súvislosti so symetrickou vibráciou krčných svalov
- Neurenterická cysta kraniocervikální junkce – kazuistika
- Rozsáhlý epidurální absces cervikotorakální páteře řešený kombinovaným přístupem – kazuistika
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Neurosyfilis
- Operační léčba syndromu tarzálního tunelu
- Oboustranná léze n. phrenicus manifestující se jako ortopnoe – kazuistiky tří případů
- Diagnostika a možnosti léčby Niemann-Pickovy choroby typ C
