Terapia pokročilých štádií Parkinsonovej choroby invazívnymi postupmi
Invasive Methods in the Treatment of Advanced Parkinson’s Disease
Advanced stages of Parkinson‘s disease are accompanied by a broad scale of motor and non-motor complications which negatively impact patients’ quality of life. The therapeutic influence of these complications resulting from the neurodegenerative nature of the underlying disease and are additionally caused by long-term use of dopaminergic treatment, represents a serious clinical problem. Recently, the therapeutic strategy has been focused on continuous dopaminergic stimulation to achieve the balanced control of symptoms. With disease progression and drug-induced complications conventional pharmacological procedures often fail to control clinical symptoms. Alternative methods rise to the forefront of therapeutic interest as they play an important role in the treatment of advanced Parkinson‘s disease. These options include: deep brain stimulation, subcutaneous application of apomorphine and levodopa/carbidopa intestinal gel therapy. Correct patient selection, consideration of specific non-motor symptoms and potential risks accompanying individual treatment modalities, significantly contribute to the selection of most appropriate procedure.
Key words:
Parkinson’s disease – motor complications of advanced Parkinson’s disease – non-motor complications – continuous dopaminergic stimulation – levodopa/carbidopa intestinal gel – apomorphine – deep brain stimulation – DBS
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
:
K. Gmitterová 1; M. Minár 1; Z. Košutzká 1; P. Valkovič 1,2
:
II. Neurologická klinika LF UK a UN Bratislava
1; Inštitút normálnej a patologickej fyziológie, Slovenská akadémia vied, Bratislava
2
:
Cesk Slov Neurol N 2017; 80/113(5): 503-516
:
Minimonography
prolekare.web.journal.doi_sk:
https://doi.org/10.14735/amcsnn2017503
Pokročilé štádiá Parkinsonovej choroby sú sprevádzané širokou škálou motorických i nemotorických komplikácií, ktoré závažnou mierou negatívne vplývajú na kvalitu života pacientov. Terapeutické ovplyvnenie týchto komplikácii, ktoré nielen vyplývajú z neurodegeneratívnej povahy základného ochorenia, ale sú podmienené i dlhodobým užívaním dopaminergnej liečby, predstavuje v klinickej praxi závažný problém. Liečebná stratégia sa v poslednom období upriamuje na zabezpečenie kontinuálnej dopaminergnej stimulácie, cieľom ktorej je dosiahnuť vyrovnanú kontrolu symptómov. S progresiou ochorenia a liekmi indukovaných komplikácií konvenčné farmakologické postupy často v tomto smere zlyhávajú. Do popredia terapeutického záujmu sa dostávajú iné, alternatívne spôsoby liečby, ktoré zohrávajú dôležitú úlohu pri liečbe prejavov Parkinsonovej choroby u pacientov v pokročilých štádiách ochorenia. Medzi tieto postupy patrí hĺbková mozgová stimulácia, subkutánne kontinuálne podávanie apomorfínu a liečba intestinálnym gélom levodopa/carbidopa. Správna selekcia pacientov, zohľadnenie prítomnosti špecifických nemotorických symptómov a potenciálnych rizík sprevádzajúcich jednotlivé liečebné modality sa významnou mieru podieľa na výbere najvhodnejšieho postupu.
Kľúčové slová:
Parkinsonova choroba – neskoré hybné komplikácie – nemotorické príznaky – kontinuálna dopaminergná stimulácia – levodopa/carbidopa intestinálny gél – apomorfín – hĺbková mozgová stimulácia – DBS
Úvod
Parkinsonova choroba (Parkinson’s disease; PD) je časté progresívne neurodegeneratívne ochorenie prejavujúce sa motorickými symptómami, ako sú bradykinéza, rigidita, pokojový tremor a strata posturálnych reflexov [1]. PD sa prejavuje i širokou paletou nemotorických ťažkostí, neuropsychiatrických symptómov a autonómnou dysfunkciou [2]. Incidencia v populácii kolíše medzi 8 a 18 na 100 000/rok. Prevalencia v populácii sa pohybuje okolo 0,3 % a zvyšuje sa s vekom. Medzi chronickými ochoreniami je PD považovaná za veľkú terapeutickú výzvu, nakoľko výrazne ovplyvňuje i kvalitu života a zvyšuje náklady na ošetrovateľskú starostlivosť [3].
Patologicky je charakterizovaná progresívnou degeneráciou a stratou dopaminergných neurónov v substancia nigra pars compacta s následným deficitom dopamínu (DA).
Náhrada dopamínu levodopou sa ukázala byť efektívnou v zvládaní prejavov ochorenia [4]. Aj napriek zlepšeniu farmakologického ovplyvnenia klinických prejavov a objaveniu novších postupov v liečbe ostáva levodopa i vzhľadom na jej efektivitu, tolerabilitu a nízku cenu liečbou voľby u všetkých štádií PD [5,6]. Často nevyhnutná je však kombinácia preparátov levodopy s dopamínovými agonistami (pramipexol, ropinirol, rotigotín), inhibítormi katechol-O-metyltransferázy (COMT) (entakapon, tolkapon) alebo inhibítormi monoamino oxidázy-B (MAO-B) (rasagilín) [7 – 9]. Amantadín ako blokátor NMDA (N-metyl-D-asparagové kyseliny) receptorov nachádza využitie i v liečbe skorých štádií ochorenia. Infúzna aplikácia sa však tiež preukázala ako efektívna adjuvantná liečba pokročilých štádií PD najmä pozitívnym ovplyvnením „on-off“ fluktuácií i dyskinéz [10]. Liečba pokročilých štádií PD si vyžaduje komplexné riešenie mnohých aspektov ochorenia a okrem medikamentóznej liečby prejavov ochorenia by sa nemalo zabúdať ani na cielenú rehabilitačnú, nutričnú i psychosociálnu starostlivosť.
I napriek vysokej efektivite levodopy sa v súvislosti s jej dlhodobým užívaním ako i následnej progresii ochorenia objaví celý rad komplikácií, čo výrazne limituje farmakologické možnosti liečby a negatívne vplýva na kvalitu života pacienta [11,12].
Motorické komplikácie, ako sú často nepredvídateľné „on/off“ fluktuácie (stavy dobrej hybnosti striedajúce sa so stuhnutosťou a nedostatočnou hybnosťou súvisiace s kolísaním plazmatickej hladiny levodopy) a objavenie sa L-dopou indukovaných dyskinéz, sú súčasťou pokročilého štádia u väčšiny pacientov [13]. Medzi najčastejšie komplikácie patria fluktuácie hybnosti, ako napr. „wearing-off“ fenomén, ktorý sa dáva do súvisu so skráteným trvaním a zníženou účinnosťou jednotlivých dávok dopaminergnej liečby, prejavujúci sa tzv. end of dose efektom (znížená účinnosť liečby pri poklese hladiny L-dopy). Dyskinézy majú najčastejšie choreoatetoidný alebo dystonický ráz. Podľa závislosti ich objavenia sa v súvislosti s liečbou sa rozdeľujú na „peak of dose“ dyskinézy, ktoré spolu s „on“ dystóniou odrážajú najvyššiu plazmatickú hladinu liečby. Bifázické dyskinézy sa objavujú na začiatku a konci účinku dávky L-dopa a predstavujú závažný terapeutický problém. „Off“ dystónia je prejavom poklesu terapeutickej hladiny L-dopa. Dyskinézy sú najviac obťažujúce komplikácie ochorenia a ich minimalizácia predstavuje jeden z hlavných terapeutických cieľov liečby pokročilých štádií PD.
Nemotorické komplikácie prejavujúce sa širokou paletou kognitívnych, behaviorálnych či autonómnych porúch sú tiež komplexnou súčasťou pokročilých štádií PD. Zahŕňajú napr. depresiu, apatiu či poruchu kontroly impulzov [2,14]. Anxieta, nadmerné potenie, kognitívne poruchy či únava ako i poruchy spánku sú najčastejšie popisované nemotorické fluktuácie predstavujúce závažný terapeutický problém [2,11,12].
V pokročilých štádiách ochorenia býva stav pacienta neadekvátne kompenzovateľný konvenčnou liečbou a často kolíše medzi „off“ stavom, ktorý je charakterizovaný motorickými i nemotorickými ťažkosťami, a stavom „on“ so zlepšením symptómov, nezriedka však s prítomnosťou závažných mimovôľových pohybov. Dosiahnutie stavov dobrej hybnosti bez prítomnosti dyskinéz je neraz zložité.
Mechanizmus vzniku komplikácií nie je úplne objasnený. Pokračujúca neurodegenerácia a dlhodobé užívanie vysokých dávok dopaminergnej liečby sú predpokladané príčiny ich vzniku [15]. Klinické a laboratórne dôkazy svedčia o tom, že L-dopa indukuje motorické komplikácie v dôsledku nefyziologického pôsobenia na dopaminergné receptory [16]. Intermitentné dávkovanie perorálnej liečby, vyprázdňovanie žalúdka a variabilná jejunálna absorpcia ako i krátky biologický polčas L-dopa (60 – 90 min) vedú k výkyvom plazmatickej hladiny L-dopa [17,18]. Variabilita plazmatickej hladiny je prenášaná do nefyziologickej striatálnej koncentrácie dopamínu, ktorá pulzatilnou stimuláciou dopamínových receptorov vedie k rozvoju širokej palety motorických a nemotorických komplikácií [7,12,16,19,20]. Z toho dôvodu sa všeobecne platná liečebná stratégia v poslednom období upriamuje na dosiahnutie kontinuálnej dopaminergnej stimulácie. Tým by sa prispelo ku klinickému benefitu so stabilnou kontrolou príznakov ochorenia počas dňa a zároveň oddialil nástup motorických fluktuácií a dyskinéz. Daný postup však farmakologickou cestou často nie je realizovateľný a je potrebné zvážiť iné liečebné možnosti.
S progresiou ochorenia a liekmi indukovaných komplikácií naberajú na význame alternatívne spôsoby liečby, ktoré zohrávajú dôležitú úlohu pri liečbe prejavov PD u vybranej skupiny pacientov [21]. Medzi tieto postupy patria hĺbková mozgová stimulácia (Deep Brain Stimulation; DBS), subkutánne kontinuálne podávanie apomorfínu a liečba intestinálnym gélom levodopa/carbidopa.
Hĺbková mozgová stimulácia
Hĺbková mozgová stimulácia (DBS) predstavuje efektívnu neuromodulačnú liečbu pokročilých štádií PD. DBS je neurochirurgická metodika zahŕňajúca stereotaktickú implantáciu stimulačných elektród do špecifickej oblasti mozgu, čím sa docieli modulácia, resp. prerušenie abnormálnej patologickej aktivity stimulovanej oblasti. To vedie k zlepšeniu motorických funkcií a ústupu komplikácií [22]. Prvé míľniky novodobej stereotaktickej chirurgickej liečby siahajú do prvej polovice 50. rokov 20. storočia, kedy boli vyvinuté rôzne typy prevažne ablatívnych procedúr zamerané predovšetkým na liečbu pohybových ochorení a zmiernenie psychiatrických symptómov. Po zavedení L-dopy do liečby PD v 60. rokov 20. storočia táto liečba dočasne pozastavila éru ablatívnej chirurgie. Objavenie L-dopou indukovaných komplikácií a identifikácia refraktérnych symptómov ochorenia opäť naštartovalo rozvoj neurochirurgických postupov. V roku 1987 francúzsky neurochirurg Benabid realizoval výkon vysokofrekvenčnej hĺbkovej mozgovej stimulácie, čím otvoril novú etapu liečby PD [23]. Za posledné dve dekády zaznamenali neuromodulačné metodiky renesanciu nielen v liečbe pohybových, ale i neuropsychiatrických ochorení.
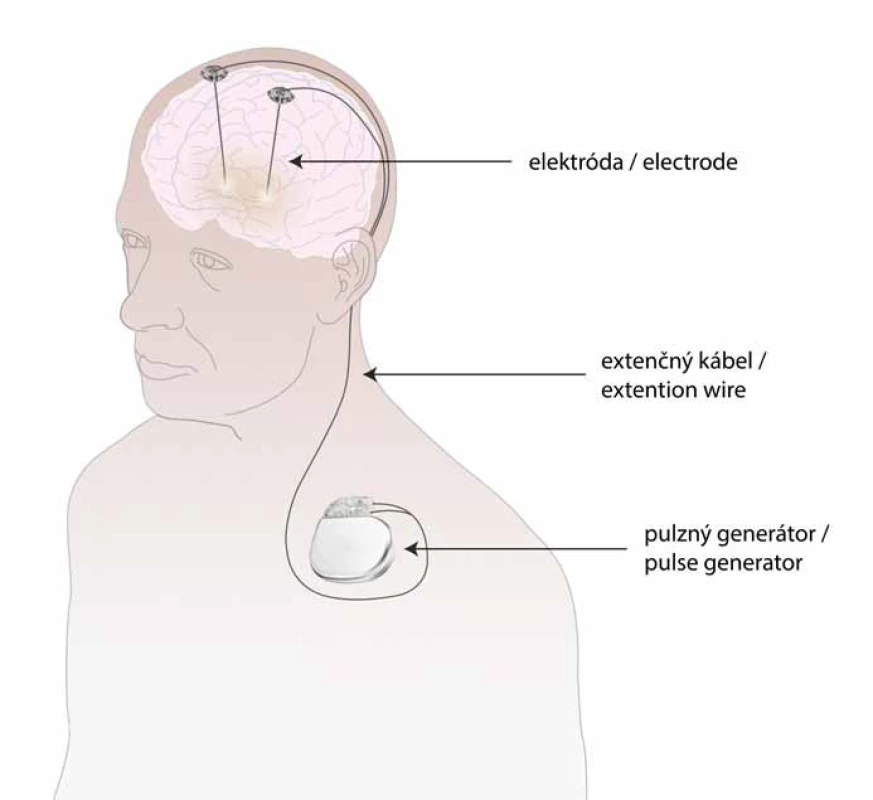
Najčastejšie využívané ciele konvenčnej DBS sú nucleus subthalamicus (STN) a vnútorný segment globus pallidus (GPi). Najnižší pomer rizík sa pozoroval pri obojstrannej stimulácii (obr. 1) [24]. Stimulácia oblasti STN alebo GPi nahradila vo väčšine prípadov implantáciu elektród do oblasti ventrálneho intermediálneho jadra thalamu (ViM). ViM-DBS však ostáva metódou voľby u pacientov s farmakorezistentným tremorom [21].
Viacero klinických štúdií s upriamením sa na vplyv liečby na motorické symptómy potvrdilo signifikantné zlepšenie trasu, rigidity i bradykinézy u pacientov po bilaterálnej STN-DBS i GPi-STN v porovnaní s konvenčnou liečbou [25 – 30]. Najvýraznejším prínosom je redukcia trvania a závažnosti „off“ stavov o 25–68 %, ako i zlepšenie motorických symptómov počas trvania „off“ stavu. Vplyv DBS na motorické prejavy sa prejavil poklesom skóre v škále UPDRS III o 20–70 % [25,27,28,30]. Výsledky prác poukazujú tiež na subjektívne zlepšenie trvania „off” stavov vrátane „off“ dystónie ako i závažnosti a trvania „on“ dyskinéz v porovnaní s perorálnou liečbou [25–28]. Zlepšenie stavu zároveň umožnilo zníženie dopaminergnej liečby o 30 – 68 % [26,28,31].
Práce porovnávajúce jednotlivé ciele implantácie preukázali, že stimulácia STN-DBS i GPi-DBS je rovnako efektívna v zvládnutí motorických symptómov a dyskinéz a potvrdila sa i efektivita liečby z dlhodobého hľadiska. Avšak zistila sa diskrepancia v postihnutí kognitívnych, behaviorálnych a afektívnych symptómov [30,32–35]. Výsledky metananalytického zhodnotenia štúdii u viac ako 1600 pacientov poukazujú na výraznejšie postihnutie psychomotorického tempa, pamäte, exekutívnych funkcií a celkového kognitívneho postihnutia u pacientov s STN-DBS [35]. Z neuropsychologického hľadiska sú však obe metodiky relatívne dobre tolerovateľné a nepreukázal sa rozdiel vo výskyte depresívnej symptomatiky [35]. Pacienti s implantáciou DBS do oblasti STN preukázali signifikantné zníženie dopaminergnej liečby po výkone v porovnaní s GPi-DBS, u ktorých však bola pozorovaná lepšia kontrola axiálnej symptomatiky vrátane reči a prehĺtania [30,34,36,37]. Preukázalo sa i pozitívne ovplyvnenie chronickej bolesti asociovanej s PD u pacientov s STN-DBS [38].
Tieto odlišnosti kladú dôraz na potrebu dôsledného posúdenia klinického stavu pacientov indikovaných na DBS ako i nutnosť zohľadnenia nemotorických symptómov.
Údaje o efekte DBS na ovplyvnenie prejavov súvisiacich s poruchou kontroly impulzov i dopamín dysregulačného syndrómu sa líšia [39 – 41]. Pozitívny vplyv liečby bol pozorovaný najmä v súvislosti s docielenou redukciou dopaminergnej liečby [39].
Stimulácia daných štruktúr okrem klinického benefitu na zlepšenie motorických príznakov ochorenia viedla i k zlepšeniu kvality života v porovnaní s medikamentóznou liečbou o 18–46 % [25,29,30,42,43]. Zlepšenie kvality života vyjadrené škálou PDQ-39 sa preukázalo byť výraznejšie pri GPi-DBS ako u STN-DBS [30,44].
V mnohých prípadoch však konvenčná DBS nie je dostatočne efektívna v liečbe, resp. môže prispieť i k zhoršeniu symptómov, ktoré nereagujú na podávanie L-dopy, ako sú napr. poruchy chôdze a stability viazané na „on“ stavy či dysartria a dysfágia; determinanty závažnou mierou ovplyvňujúce kvalitu života [45,46]. Pacienti s kamptokormiou či levodopa refraktérnymi poruchami chôdze a freezingom, avšak so zachovanými posturálnymi reflexami lepšie profitujú zo zásahov do oblasti pedunkolopontínneho jadra (PPN) a substancia nigra so zlepšením sa posturálnych symptómov PD [47–50]. V súčasnosti je daná liečba dostupná len v špecializovaných centrách v zahraničí. Do popredia záujmu sa posledné roky dostávajú nové stimulačné technológie a ciele implantácie sledujúce rozšírenie klinického použitia a zlepšenia efektivity DBS. Súčasné práce potvrdzujú bezpečnosť a efektivitu neuromodulačných techník u širokého spektra ochorení, ako napr. u epilepsie [51], chronickej bolesti [52] či refraktérnych behaviorálnych porúch a depresie [53,54].
DBS je metódou voľby u pacientov v pokročilých štádiách PD, avšak vzhľadom na dobrý efekt sa uvažuje, či by nemala byť indikovaná už vo včasných štádiách ochorenia, a tak potenciálne napomôcť k spomaleniu vývoja motorických komplikácií [55 – 57].
V súčasnosti sa indikácia k DBS posúva už do stredne pokročilých štádií PD; v prípade, že motorické komplikácie závažným spôsobom pacienta limitujú vo vykonávaní bežných aktivít i napriek optimalizovanej liečbe [29,58]. V súčasnosti prebiehajú viaceré randomizované štúdie porovnávajúce efekt DBS liečby u pacientov v skorých štádiách PD bez prítomnosti motorických fluktuácií a demencie so skupinou medikamentózne liečených pacientov. Výsledky doterajších prác preukázali prínos DBS v skorých štádiách so spomalením vývoja neskorých komplikácii a zlepšením kvality života [29,59 – 61]. Narastá i počet dôkazov o efektivite a bezpečnosti DBS u staršej populácie pacientov [62,63]. To podporuje predpoklad, že samotný vek by nemal predstavovať primárnu kontraindikáciu chirurgickej liečby u inak vhodných kandidátov.
Klasická DBS elektróda spočíva v zavedení kvadrupolárnej elektródy s cylindrickými platina/ irídium kontaktmi na cieľové miesto. Elektróda je extenčnými káblami prepojená s implantovaným pulzným generátorom, ktorý je zdrojom stimulácie a tvorby kontinuálneho elektrického napätia okolo aktívnych kontaktov elektród (obr. 1, 2). Konvenčný pulzný generátor je vybavený batériou, ktorej životnosť je 3–25 rokov v závislosti od stimulačných parametrov s možnosťou voľby nabíjateľného príslušenstva [64]. Elektrické parametre pre chronickú stimuláciu sú nastavené počas DBS programovania, ktorého cieľom je zapojenie optimálnej polarity, amplitúdy, šírky a frekvencie pulzov, za účelom dosiahnutia maximálneho klinického benefitu. Najčastejšie je využívaná monopolárna alebo bipolárna stimulácia s variabilnou kombináciou aktívnych kontaktov [65]. Klasická stimulácia je často spojená s vedľajšími účinkami v dôsledku stimulácie okolitých štruktúr či simultánneho prerušenia reziduálnej fyziologickej aktivity stimulovaných okruhov [66]. Novšie prístupy s použitím elektród umožňujúcich presné tvarovanie elektrického poľa rozličnými smermi [67,68] vedú k rozšíreniu terapeutického okna a minimalizácii nežiaducich účinkov (obr. 2).
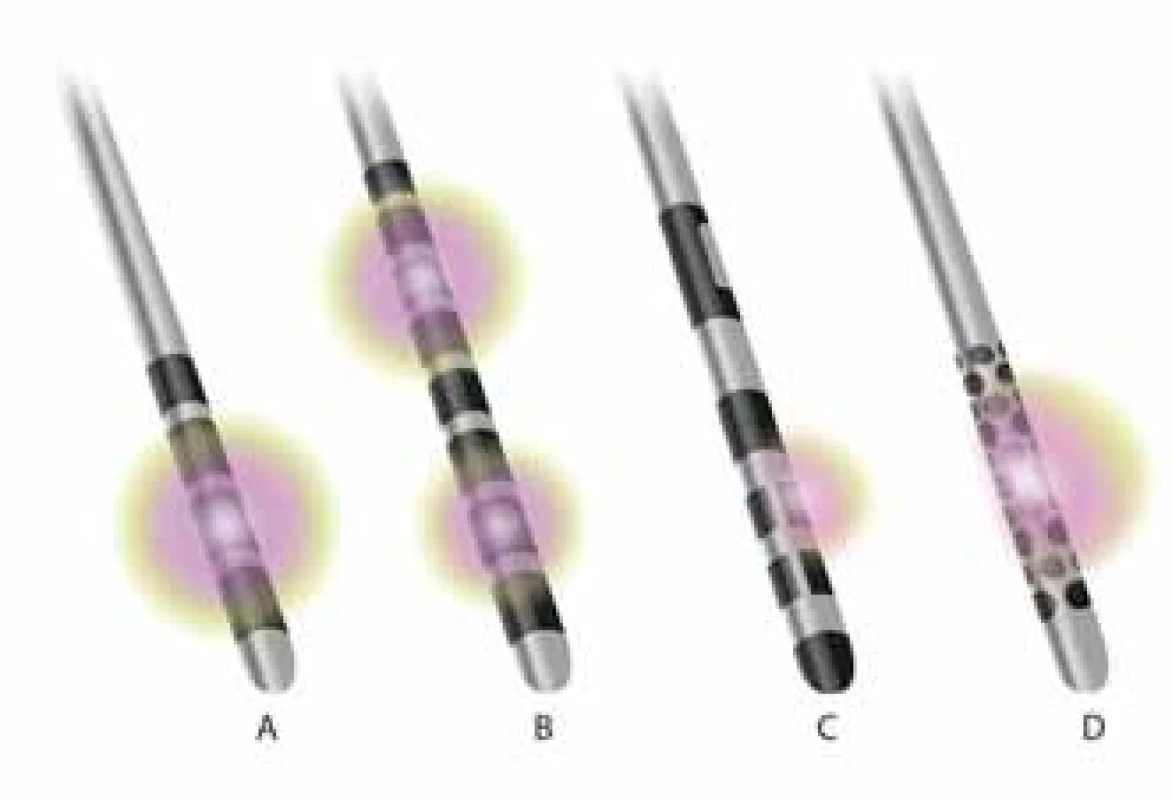
Presný mechanizmus pôsobenia DBS nie je i napriek vzrastajúcim poznatkom spoľahlivo objasnený. Inhibičná teória predpokladá, že DBS tlmí lokálnu neuronálnu aktivitu v stimulovanej oblasti [69,70]. Sporným bodom tejto hypotézy ostáva objasnenie mechanizmu efektu GPi-DBS na dystóniu, pri ktorej je pozorovaná znížená aktivita výbojov [71,72]. Diskutuje sa o možných mechanizmoch, ako napr. blokáda depolarizácie, inaktivácia napäťových kanálov a aktivácia inhibičnej aferentácie [73,74]. Vzostup GABA-ergnej inhibície a súčasnej redukcie glutamátovej aktivity sa považujú za hlavné mechanizmy účinku DBS [74,75]. Niekoľko prác podporuje „excitačnú hypotézu“ pôsobenia DBS vychádzajúcu z pozorovaní vzostupu excitačných neurotransmiterov v oblasti stimulácie [76,77]. Elektrická stimulácia počas STN-DBS indukuje vzostup v krvnom prietoku v GPi a motorickom kortexe [78]. Zmeny v regionálnom krvnom prietoku, aktivácia glutamátergnej excitácie a faktorov stimulujúcich neurogenézu sa tiež považujú za možné mechanizmy účinku [78 – 80]. V súčasnosti sa dostáva do popredia teória prerušenia abnormálneho informačného toku – „disrupčná teória“, ktorá vysvetľuje mechanizmus DBS cestou blokovania patologických mechanizmov v oblasti bazálnych ganglií, thalamu a kortexu, čo má za následok normalizáciu fungovania globálnych funkčných okruhov [81 – 83]. Stimulácia moduluje aktivitu motorického kortexu a rozpojenie jeho oscilácií medzi STN [84]. Abnormálne zvýšená aktivita STN vedie k abnormálnej aktivite GPi, čo spôsobuje inhibíciu thalamokortikálnych okruhov a kmeňových motorických projekcií [85,86]. Prerušenie tejto aktivity cestou blokády informačného toku cez GPi a STN môže klinické symptómy zmierniť. Vzhľadom na komplexnosť pôsobenia sa na výslednom efekte terapie podieľa zapojenie viacerých funkčných okruhov [87].
Tradičné metódy DBS implantácie zahŕňajú detailné MR zobrazenie mozgu na zameranie cieľovej oblasti stimulácie. Stereotaktické zameranie umožňuje určiť presnú anatomickú lokalizáciu vybraného cieľa a určenie minimálne invazívnej trajektórie zavedenia podľa triplanárnych koordinátov. Presné umiestnenie elektródy je jedným z kľúčových faktorov určujúcich terapeutickú efektivitu. Niektoré skupiny určujú cieľ zavedenia implantácie na základe neurozobrazovacích metodík. Vzhľadom na nepresnosti zobrazenia, možnosti posunu stereotaktického rámu i posunu mozgových štruktúr v dôsledku odtoku likvoru však väčšina centier využíva perioperatívnu neurofyziologickú verifikáciu cieľa. Pre tieto účely sa využíva perioperačná mikroelektróda snímajúca elektrickú aktivitu neurónov v sledovanej oblasti (Microelectrode Recording; MER). Počet mikroelektród a technika verifikácie cieľa varíruje v závislosti od centier. MER napomáha v určení správnej pozície elektródy a zohľadňuje individuálnu anatomickú variáciu. I keď bolo zaznamenané mierne zvýšené riziko krvácania počas MER, starostlivé plánovanie a sekvenčný perioperačný monitoring toto riziko minimalizujú [88,89].
Následným krokom je makrostimulácia cieľa, ktorá umožňuje priame sledovanie efektu stimulácie na zlepšenie symptómov ako i záchyt stimuláciou indukovaných vedľajších účinkov. Tieto techniky vyžadujú „awake“ postup s nutnosťou spolupráce pacienta. Neurozobrazovacie techniky s MER a klinickou odozvou na stimuláciu umožňujú adekvátnu kontrolu pozície elektródy.
Nové techniky s priamym zobrazením cieľov stimulácie s použitím „real-time“ metodík uľahčujúcich perioperačnú navigáciu sú vo vývoji. Ich využitie perspektívne eliminuje nutnosť realizácie stereotaktickej MR navigácie a MER, zvyšuje presnosť umiestnenia elektródy a znižuje riziko komplikácií [90,91]. Vysoko rozlišovacie zobrazenia ako i metódy rekonštrukčného zobrazenia a kvantitatívneho mapovania predstavujú sľubnú metódu v zlepšení zamerania a ohraničenia cieľa [92].
Terapeutický úspech DBS závisí nielen od presného umiestnenia elektródy, ale i od možnosti optimalizácie stimulačných parametrov. Programovanie je dynamický proces umožňujúci prispôsobenie parametrov podľa stimulačného cieľa a ovplyvňovaných symptómov (napr. tremor vyžaduje iné parametre ako chôdza).
Multicieľová stratégia stimulácie, technika „záchranných navádzačov” a „interleaving DBS“ predstavujú potenciálne prístupy v prípade neadekvátneho zvládnutia symptómov konvenčnými postupmi [93,94].
DBS je dobre tolerovateľná liečba a riziko komplikácií je relatívne nízke. Objavenie sa stimuláciou podmienených nežiaducich účinkov sa popisuje asi u 13 % pacientov [95,96]. Vedľajšie účinky stimulácie, ako sú parestézie, hyperkinézy, dystonické kontrakcie či potenie, bývajú prechodnou komplikáciou zvyčajne nezávažného rázu a sú zvládnuteľné úpravou stimulačných parametrov alebo sprievodnej liečby [95,96].
Medzi najčastejšie komplikácie súvisiace s operačným výkonom patrí intrakraniálne krvácanie s incidenciou 1,9 %, epileptické kŕče, perioperačne vzniknutá bradykardia/ hypotenzia, aspiračná pneumónia, hĺbková venózna trombóza a pľúcna embólia [25,34,97]. Incidencia infekcie v mieste rany kolíše od 0–15 % [31,98–100]. Výskyt komplikácií súvisiacich s elektródami (migrácia, zalomenie) je relatívne nízky (5 %) [96,101].
Porucha kontroly impulzov a dopamín dysregulačný syndróm sú taktiež popísané komplikácie spojené s DBS [39–41]. Podľa najnovších prác sa zaznamenalo ich zlepšenie v súvislosti s DBS, pravdepodobne v súvislosti s redukciou dávok liečby po zmiernení príznakov [41,102].
Benefit konvenčnej DBS s kontinuálnou stimuláciou môže byť prekrytý nežiaducimi účinkami a nastavenie parametrov nezaručuje dlhodobé udržanie efektu; nerešpektuje progresiu ochorenia či efekt súbežne užívanej liečby. To môže mať negatívny vplyv na efektivitu liečby a vyžadovať opakovanú úpravu stimulačných parametrov [103]. V súčasnosti sa presadzuje teória o DBS „ušitej na mieru“ podľa individuálnych potrieb pacienta umožňujúca zmenu stimulačných parametrov podľa objektívnych parametrov [104]. Tento typ stimulácie sa nazýva adaptívna DBS (aDBS). Ide o vysokofrekvenčnú stimuláciu s pravidelnými interpulzatívnymi intervalmi, ktorá i napriek celkovo kratšej dobe stimulácie v porovnaní s konvenčnou DBS preukázala lepšiu efektivitu [105,106]. Systém aDBS má za cieľ „uzavretie okruhov” na základe interpretácie elektrofyziologickej aktivity cieľových oblastí a následnej spätnej regulácie dodávania terapeutických stimulov [107,108]. Ako najefektívnejší biofyzikálny signál sa ukázalo byť meranie neurálnej aktivity snímaním lokálnych poľových potenciálov (Local Field Potentials; LFP’s). Deplécia dopamínu spôsobená PD vyvoláva trvalú nízkofrekvenčnú osciláciu v motorickom okruhu bazálnych ganglií, čo sa ukazuje ako relevantný parameter spätnej väzby aDBS [107,109]. Motorické prejavy PD ako bradykinéza a rigidita sú vo vzťahu k tejto aktivite [110]. Dopaminergná liečba a vysokofrekvenčná DBS túto abnormálnu aktivitu tlma [111,112]. Súčasné štúdie i napriek limitáciám preukázali, že individuálna optimalizácia stimulačných parametrov by mohla zlepšiť efektivitu DBS, kvalitu života ako i predĺženie životnosti batérie [95,105,106,109].
Záver týchto štúdii poukazuje na fakt, že DBS predstavuje efektívnu metódu v liečbe pokročilých štádií PD, ktorá napomáha k zmierneniu motorických symptómov a zlepšeniu kvality života pacientov. Je dobre tolerovateľná a riziko komplikácií je relatívne nízke. Klinický fenotyp a neuropsychiatrický profil sú kľúčové faktory rozhodujúce v zvolení najlepšieho cieľa. V posledných rokoch sa presadzuje koncept liečby prispôsobenej individuálnym potrebám pacienta a liečba sa posúva už do skorších štádií ochorenia. Novšie postupy sú zamerané na vývoj dokonalejších stimulačných a zobrazovacích technológii s cieľom zlepšiť klinickú efektivitu a bezpečnosť liečby bez aktivácie nežiaducich účinkov.
Levodopa/carbidopa intestinálny gél
Intravenózna a intraduodenálna forma podávania vodného roztoku L-dopy bola prvýkrát vyvinutá vo Švédsku v prvej polovici 90. rokov 20. storočia a neskôr vytvorila cestu k vytvoreniu vysoko koncentrovaného gélu [113–115]. Levodopa/carbidopa intestinálny gél (LCIG) je systém liečby vyvinutý na preklenutie limitácií perorálnej liečby. Gél je cestou perkutánnej endoskopickej gastrojejunostómie (PEG/J) frakcionovane dopravovaný priamo do tenkého čreva za pomoci prenosnej pumpy (obr. 3). Celková denná dávka LCIG liečby, ktorá je počas dňa dodávaná pumpou v 16 hod kontinuálnom intervale (obvykle od 6.00 – 22.00 hod), pozostáva z rannej bolusovej dávky; kontinuálnej dávky a extra dávky podávanej na základe individuálnych potrieb pacienta.
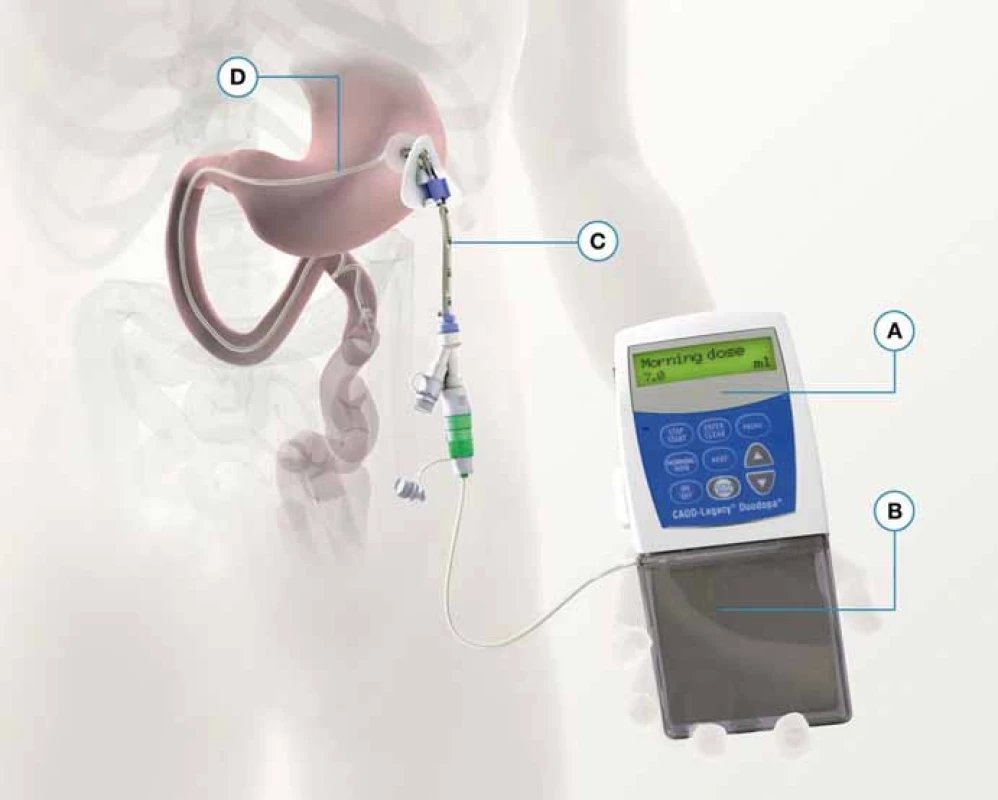
Tento spôsob dodávania liečby obchádza žalúdočnú pasáž a zároveň kontinuálnym dávkovaním redukuje plazmatickú fluktuáciu hladiny L-dopa v priebehu podávania v porovnaní s orálnymi formami [116,117]. LCIG je prevažne aplikovaná ako monoterapia, formy L-dopa preparátov s postupným uvoľňovaním, resp. dopamínoví agonisti slúžia na preklenutie nočného stavu.
V súčasnosti je daná liečba schválená na použitie vo viac ako 40 krajinách.
Cielovú skupinu tvoria pacienti s PD so zachovanou odpoveďou na levodopu v pokročilých štádiách ochorenia, ktorí trpia ťažkými motorickými fluktuáciami a/alebo dyskinézami pri konvenčnej liečbe. Dôkaz o efektivite liečby pred prevedením samotnej internalizácie PEG/ J systému sa u pacienta v špecializovaných centrách na Slovensku verifikuje počas titračnej fázy, počas ktorej je liečba dodávaná do jejuna cestou endoskopicky zavedenej nazojejunálnej sondy. Po schválení liečby zdravotnou poisťovňou (6–8 týždňov) je pacient hospitalizovaný za účelom zavedenia PEG/J systému [118].
Aktuálne publikovaná metaanalýza randomizovaných kontrolovaných štúdií porovnávajúca efekt LCIG s inými liečebnými postupmi sa zamerala na zhodnotenie vplyvu liečby na široké spektrum symptómov. Hodnotené boli motorické domény vyjadrené „on/off“ stavom a prítomnosťou dyskinéz, nemotorické symptómy, kvalita života pacientov ako i bezpečnosť liečby [119].
Práce hodnotiace vplyv liečby na motorické symptómy preukázali signifikantný pokles trvania „off“ stavov a predĺženia stavov dobrej hybnosti ako i pokles závažnosti a trvania dyskinéz u LCIG v porovnaní so štandardnou perorálnou liečbou [116,119–122]. LCIG liečba poskytuje zlepšenie motorických fluktuácií o 50–64 % a dyskinéz o 47–59 % [121,122]. Redukcia času strávenom v off stave je tak výraznejšia ako redukcia trvania dyskinéz, ktoré však zvyčajne pacienti tolerujú lepšie ako off stavy [6]. Vplyv liečby na motorické symptómy vyjadrené v skóre UPDRS III preukázal v súvislosti s LCIG liečbou pokles o 13–80 % [119,122,123,125,126,130].
Výsledky metaanalýzy i napriek odlišnostiam dizajnu hodnotených štúdií poukazujú i na zlepšenie nemotorických symptómov v súvislosti s liečbou LCIG [119].
Spomedzi nemotorických symptómov sa ako najkonzistentnejšie javia výsledky poukazujúce na pozitívny efekt liečby v ovplyvnení spánku/ únavy, gastrointestinálnych a urologických ťažkostí [121,123–126]. Efektivita LCIG v porovnaní s apomorfínom preukázala signifikantné zlepšenie skóre hodnotiaceho nemotorické symptómy ochorenia (NMSS) u oboch skupín pacientov. LCIG preukázala lepší efekt v doménach spánok/únava, gastrointestinálne a urologické symptómy, kým apomorfín dosiahol lepší benefit u domény nálada/apatia [126].
Bolo pozorované i zlepšenie depresívnej symptomatiky a prejavov súvisiacich s poruchou kontroly impulzov či dopamín dysregulačného správania [123,124,127]. Údaje o vplyve liečby na kognitívne funkcie nie sú jednotné a chýbajú i adekvátne kontrolované štúdie. Podľa niektorých prác liečba výraznejšie neovplyvňuje kognitívne funkcie [124,128], avšak bolo zaznamenané i mierne zhoršenie demencie [129].
Súčasné práce preukázali i pozitívne a dlhodobé ovplyvnenie kvality života pacientov s LCIG (vyjadrenej prevažne v poklese skóre škály PDQ-39) o 20–40 % v porovnaní s konvenčnou liečbou [121,122,124,126,129,130].
I napriek úskaliam hodnotenia údajov a odlišnosti v metodológii vyhodnocovaných štúdií ako i limitovanému počtu prospektívnych štúdií so zameraním na vyhodnotenie bezpečnosti liečby sa preukázalo, že nežiaduce účinky súvisiace najmä so zavedením PEG/J sú časté [119,121,123,131]. Najrozsiahlejšia prospektívna práca zaznamenala 76% výskyt komplikácii, ktoré súviseli s internalizáciou systému [131]. Závažné komplikácie v súvislosti so zavedením PEG/ J sa vyskytli u 17 % pacientov, pričom najvyšší výskyt komplikácií bol registrovaný počas prvého mesiaca liečby. Najčastejšie komplikácie boli: dislokácia PEJ sondy (8 %); iritácia, granulácia či zápal v oblasti stómie (10 %); obštrukcia intestinálnej sondy (9 %). V zriedkavých prípadoch mali i fatálne následky (perforácia čreva, peritonitída, aspiračná pneumónia), pričom ich frekvencia výskytu u LCIG sa neodlišovala od výskytu v ostatnej populácii [132]. Výskyt nežiaducich účinkov bez súvisu s PEG/ J výkonom a technickým zariadením je porovnateľný s výskytom u pacientov na perorálnej liečbe. Polyneuropatia ako možná komplikácia liečby LCIG bola zaznamenaná u 6 % pacientov [131]. Predpokladá sa podiel hypovitaminózy B12 a/alebo folátov, ktorých hladina by mala byť počas liečby pravidelne monitorovaná [133,134].
Viacero prác potvrdilo klinickú efektivitu liečby z krátkodobého i dlhodobého hľadiska [123,124,129,130] a preukázalo i benefit kontinuálneho 24 hod režimu podávania liečby [135].
Nízky vek a absencia kognitívnych/ behaviorálnych symptómov sú považované za validné prediktory dobrého efektu liečby LCIG [58,129]. Dané faktory však pozitívne ovplyvňujú i efektivitu ostatných postupov (s.c. apomorfín, DBS), a preto je správna selekcia pacientov pri rozhodovaní o ďalšej liečbe dôležitá. Následná titrácia a pravidelné sledovanie pacientov zohrávajú dôležitú úlohu v ďalšom manažmente pacienta.
V súčasnosti narastá počet prác potvrdzujúcich efektivitu LCIG liečby na zvládnutie motorických fluktuácií a zlepšenia kvality života. Z hľadiska zhodnotenia vplyvu liečby na nemotorické aspekty PD ako i dlhodobej bezpečnosti liečby sú potrebné ďalšie štúdie.
Apomorfín
Apomorfín predstavuje efektívnu symptomatickú liečbu pokročilých štádií PD. Patrí medzi najstaršie látky využívané v medicíne a prvotne našiel svoje využitie v liečbe psychiatrických ochorení. Jeho použitie v liečbe PD je limitované nepriaznivým farmakodynamickým profilom a viacerými sprievodnými nežiaducimi účinkami [136]. S nástupom éry liečby levodopou sa jeho použitie dostalo do úzadia. S nárastom limitácií použitia a poznaním komplikácií súvisiacich s dlhodobou liečbou L-dopou sa obnovila nová éra vývoja modernejších postupov využitia apomorfínu kladúca na zreteľ zlepšenie jeho biodostupnosti. Aktuálnou farmakologickou výzvou je najmä vývoj preparátov, aplikácia ktorých by poskytovala vyrovnanejší klinický efekt ako L-dopa. V súčasnosti sa v liečbe pokročilých štádií PD využíva najmä forma kontinuálneho podávania apomorfínu a intermitentná (bolusová) aplikácia injekcie [136 – 141].
Apomorfín pôsobí ako neselektívny dopamínový agonista na všetkých DA receptoroch. Vyznačuje sa silne lipofilnými vlastnosťami, čo umožňuje jeho pasívny prechod cez hematoencefalickú bariéru [142]. To vedie k rýchlemu vzostupu koncentrácie v mozgu a jeho rapídnemu nástupu účinku. Acidita limituje absorpciu apomorfínu cez sliznice a spôsobuje výraznú iritáciu slizníc, čo obmedzuje i praktické využitie [137,142]. Novšie technológie a analýza chemických vlastností pomáha vo vývoji nových a stabilnejších aplikačných foriem. Apomorfín má rýchly nástup účinku a krátke trvanie efektu (T1/2 30–60 min). Na jeho metabolizme sa čiastočne podieľa i enzým katechol-O-metyl transferáza (COMT), ktorá degraduje L-dopa, a preto súbežné podávanie týchto preparátov môže predĺžiť dobu účinku apomorfínu [143].
Staršie štúdie s použitím apomorfínu preukázali efektivitu jeho použitia v liečbe príznakov PD, avšak užívanie bolo spojené s výraznými nežiaducimi účinkami [144]. S rozvojom injekčných subkutánnych foriem podávania sa liečba opäť dostala do objektu záujmu [145]. Pacienti s PD mali rovnakú odpoveď na podanie apomorfínu so zlepšením sa motorických symptómov ako po podaní L-dopa [146].
Najčastejšie sa v klinickej praxi využívajú preparáty založené na subkutánnej aplikácii liečby pri „add-on” liečbe spolu s L-dopa preparátmi, ktorých cieľom je prerušenie „off“ stavov. Preparáty na sublinguálnu a nazálnu aplikáciu sú vo vývoji a boli publikované prvé práce v tejto oblasti so sľubnými výsledkami [147,148].
Najčastejší spôsob použitia apomorfínu je podávanie pomocou kontinuálnej subkutánnej aplikácie za pomoci prenosnej a ľahko ovládateľnej pumpy. Pumpa dodáva liečbu z napojeného rezervoára cestou tenkého katétra, ktorý je prostredníctvom tenkej ihly fixovaný v podkoží (obr. 4). Po premedikácii domperidonom sa podľa individuálnych potrieb a tolerancie dávkovacej schémy liečby postupne vytitrujú parametre dávkovania až do dosiahnutia optimálneho efektu. Počas titračnej fázy sa postupne redukuje súbežná dopaminergná liečba v závislosti od klinického efektu. Liečba funguje zvyčajne v 12–14 hod dennom režime, čo si u väčšiny pacientov vyžaduje medikamentózne prekrytie nočných stavov perorálnou/transdermálnou cestou [141]. Ranné zapnutie systému sa často zaháji i so súčasným podaním rannej bolusovej dávky, ktorá docieli rýchly nástup liečebného efektu. Možné je tiež dodatočné „záchranné“ podávanie bolusu v priebehu dňa počas nástupu „off“ stavov pumpou ako i pomocou jednorazovej aplikácie liečby apomorfínovým perom [137,141,149].

Väčšina štúdii preukázala jeho efektivitu v redukcii „off“ stavov ako i prejavov viazaných na „off“ periódy, ako napr. ranná dystónia, dysfágia a bolestivé „off“ stavy [150–152]. Zároveň sa ukázal byť efektívny v akútnej liečbe „off“ epizód a preukázal i signifikantné zlepšenie v UPDRS skóre v porovnaní s placebom. Zlepšenie UPDRS skóre bolo počas liečby apomorfínom porovnateľné s efektom L-dopa [126,152–154].
Štúdie, ktoré analyzovali bezpečnostný profil intermitentnej aplikácie subkutánneho apomorfínu v liečbe „off“ periód, preukázali jeho bezpečnosť. Najčastejšie nežiaduce účinky spojené s jeho aplikáciou boli nauzea, zvracanie, synkopa, somnolencia, halucinácie, zívanie a lokálna reakcia v mieste vpichu [149,155].
Nežiaduce účinky, ako synkopa a zvracanie, sú častými sprievodnými účinkami liečby, ktoré majú prechodný ráz súvisiaci najmä so zahájením liečby, avšak značnou mierou vplývajú na compliance pacientov [155]. Domperidon je silný D2 antagonista neprechádzajúci hematoencefalickou bariérou a jeho súčasné podávanie redukuje periférne nežiaduce účinky apomorfínu bez oslabenia liečebného efektu a preferuje sa jeho nasadenie pred zahájením liečby apomorfínom [156,157].
Viaceré dlhodobé štúdie preukázali, že liečba apomorfínom bola spojená s redukciou trvania „off“ stavov o 50–85 % ako i trvania dyskinéz [58,137,152,154,158–160]. Užívaná liečba zároveň viedla k redukcii dávky súbežne užívanej dopaminergnej liečby [137,139,141,152].
I keď sa apomorfín väčšinou podáva ako „add on” liečba k súbežne užívanej L-dope, viaceré štúdie poukázali i na adekvátny efekt monoterapie, najmä z hľadiska redukcie „peak on dose” dyskinéz [141,158]. Limitovaný počet štúdií porovnával efekt liečby oproti LCIG, pričom sa popísala nižšia frekvencia trvania i závažnosti dyskinéz v porovnaní s LCIG [126,161].
Klinická štúdia (AM IMPAKT) skúmala použitie subkutánnej bolusovej injekcie u pacientov s predĺženým ranným nástupom účinku perorálnej L-dopa liečby. Výsledky poukázali, že subkutánna injekcia je rýchlejšia (7–14 min) v nástupe iniciálneho „on“ stavu v porovnaní s perorálnou liečbou L-dopa [162]. Variácia časových údajov v dobe nástupu môže byť podmienená viacerými faktormi, ako miesto aplikácie a individuálna variabilita [137,139,149].
I napriek limitovaným údajom na priamy efekt liečby apomorfínom na nemotorické prejavy ochorenia existujú práce o pozitívnom ovplyvnení nemotorických symptómov [152,163–165] ako i zlepšení sa kvality života o 12–30 % [140,155]. Liečba apomorfínom priniesla v porovnaní s konvenčnou liečbou najmä pozitívne ovplyvnenie domén spánok/únava, nálada/apatia a nadmerné potenie [140].
Riziko neuropsychiatrických komplikácií podľa niektorých autorov môže byť vyššie ako pri liečbe LCIG [127]. Súčasné štúdie skúmajúce vplyv apomorfínu a LCIG na neuropsychiatrické symptómy preukázali dobrý bezpečnostný profil oboch modalít a nepreukázal sa ani závažnejší vplyv na zhoršenie halucinatórnej symptomatiky [126,165].
Kontinuálna subkutánna infúzia je spojená s rozvojom kožných nodulov pri dlhodobej terapii. Incidencia týchto kožných komplikácií môže byť redukovaná správnou hygienou kože a použitím novších technológií ihiel ako i spôsobu zavedenia [137]. Teflonová kanyla zavedená do podkožia pod 45° uhlom redukuje výskyt nodulov a kožnej iritácie [141,161].
U pacientov s refraktérnymi motorickými fluktuáciami a dermálnymi komplikáciami pri klasickej aplikácii sa sledoval i efekt intravenóznej cesty podania liečby [166]. I keď sa preukázal pokles „off“ stavov pri intravenóznej ceste aplikácie, liečba bola spojená so závažnými nežiaducimi účinkami a rozvojom intravaskulárnej trombózy [142,166]. Perorálne podávaná liečba nie je vzhľadom na nepriaznivé farmakodynamické vlastnosti apomorfínu dostatočne efektívna [167]. Novšie formy sublinguálnych preparátov na báze gélových prúžkov s lepším profilom tolerancie z hľadiska iritácie slizníc sú aktuálne vo fáze klinického skúšania a výsledky súčasne publikovaných prác sú optimistické, prinášajúce víziu sľubnej cesty liečby [143,147,148]. Niektoré práce poukázali na potenciálne využitie apomorfínu v liečbe „restless legs syndrómu“ a komatóznych stavov [168,169].
Potenciálny antioxidatívny efekt so schopnosťou vychytávania voľných radikálov nastolili rad otázok ohľadne neuroprotektívneho efektu apomorfínu. V posledných rokoch sa tiež stáva objektom vedeckého záujmu na poli neurodegenerácie. Apomorfín zvyšuje aktivitu degradačných enzýmov v CNS podieľajúcich sa na degradácii intracelulárneho beta amyloidu a schopnosti blokády tvorby hyperfosforylovaných foriem tau proteínu, čo otvorilo cestu skúmaniu jeho terapeutického využitia i v oblasti liečby demencií [170,171].
Subkutánna aplikácia apomorfínu predstavuje efektívnu „add-on“ liečbu motorických prejavov pokročilých štádií PD s rýchlym nástupom účinku. Jeho použitie je sprevádzané početnými nežiaducimi účinkami, ktoré sú v praxi zvládnuteľné. Súčasný výskum v tejto oblasti sa zameriava najmä na vývoj vhodnejších foriem aplikácie a minimalizáciu nežiaducich účinkov.
Vzhľadom na chýbanie relevantných klinických štúdii týkajúcich sa najmä vzájomného porovnania jednotlivých liečebných postupov konsenzus expertov vypracoval odporučenia k menežmentu liečby pokročilých štádií PD. Vypracované prístupy k riešeniu klinicky dôležitých bodov u PD sú založené prevažne na dlhodobých klinických skúsenostiach a opierajú sa predovšetkým o údaje randomizovaných, placebom kontrolovaných štúdií, aj keď pre mnohé motorické a najmä nemotorické fenomény adekvátne štúdie chýbajú [58]. Cieľom odporúčaní je poskytnúť odpovede na najdôležitejšie otázky týkajúce sa správneho menežmentu liečby s prihliadnutím na zohľadnenie relevantných klinických oblastí [58].
Aké sú indikácie a kontraindikácie liečby pokročilými modalitami?
Pokročilé liečebné modality by mali byť zvažované u pacientov s motorickými fluktuáciami a/alebo dyskinézami, ktoré nie sú zvládnuteľné optimalizovanou dopaminergnou medikáciou (L-dopa, dopamínoví agonisti, inhibítory MAO-B, inhibítory COMT).
Liečba pokročilými modalitami by sa mala zvažovať u pacientov, u ktorých:
- dávkovanie L-dopa preparátov ≥ 5× denne (nie je relevantné, ak je dosiahnutá adekvátna kontrola symptómov a liečba je dobre tolerovaná);
- trvanie „off“ času > 1–2 hod počas dňa i napriek optimalizovanej liečbe;
- sú „off“ stavy závažného rázu, čo je rozhodujúcejšie ako celkové trvanie „off“ stavov.
- motorické fluktuácie sú sprevádzané závažnými a refraktérnymi dyskinézami;
- pacienti spĺňajúci dané kritéria sú indikovaní na liečbu i pri trvaní ochorenia < 4 roky.
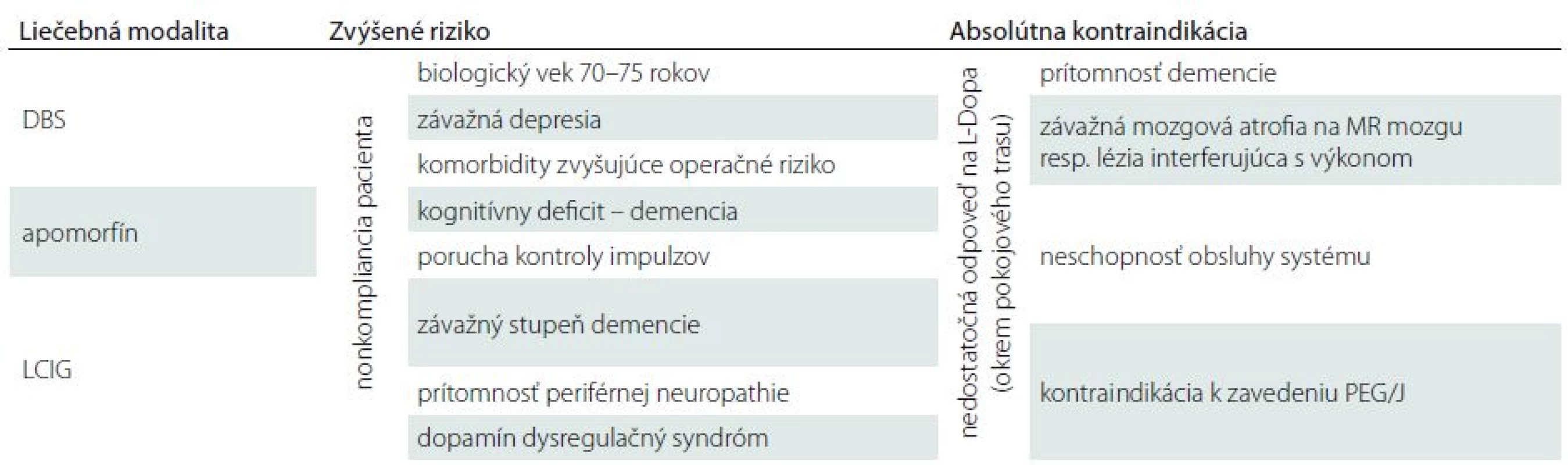
Nedostatočná odpoveď na L-dopa (okrem liečby pokojového trasu pomocou DBS) predstavuje vylučovacie kritérium pre všetky liečebné možnosti. V prípade intolerancie či kontraindikácie perorálnej liečbe preparátmi s obsahom L-dopa/ carbidopa (napr. glaukóm so zatvoreným uhlom, feochromocytóm, akútna cievna príhoda a i.) je potrebné zvážiť iné modality ako LCIG. Prehľad kontraindikácií k jednotlivým liečebným modalitám je zobrazený v tab. 1.
Aký je efekt jednotlivých postupov na motorické fluktuácie a dyskinézy?
Efekt na redukciu „off“ stavov a dyskinéz je porovnateľný u všetkých modalít, pričom najlepšie je efekt dokumentovaný pri DBS [26].
Aký je efekt liečebných modalít na nemotorické prejavy ochorenia?
Prítomnosť nemotorických symptómov, ktoré nie sú viazané na fluktuácie, nie je indikáciou na liečbu pokročilými modalitami. Prítomnosť špecifických nemotorických prejavov môže napomôcť pri individuálnom výbere liečby.
- Liečba apomorfínom priniesla v porovnaní s konvenčnou liečbou pozitívne ovplyvnenie domén spánok/ únava, nálada/ apatia a nadmerné potenie [140].
- LCIG preukázala pozitívny efekt na zlepšenie kardiovaskulárnych, gastrointestinálnych, urogenitálnych a sexuálnych funkcií a tiež zlepšenie spánku [125,126,172]. Bolo pozorované zlepšenie sa depresívnej symptomatiky a poruchy kontroly impulzov v súvislosti s LCIG [123,125,127]. Riziko neuropsychiatrických komplikácii môže byť vyššie u liečby apomorfínom ako LCIG [127].
Zlepšenie kvality života je porovnateľné u oboch liečebných modalít [126,155]. Údaje o efekte DBS na ovplyvnenie prejavov súvisiacich s poruchou kontroly impulzov i dopamín dysregulačného syndrómu sú však nejednoznačné [39,41].
Ako ovplyvňuje indikáciu k liečbe kognitívna dysfunkcia, posturálna instabilita a pády?
Kognitívna dysfunkcia a posturálna instabilita môžu kolidovať s benefitom liečby [173]. Nutné je dôkladné individuálne posúdenie rizík/benefitu liečby. Predpokladom dobrého efektu modalít v liečbe porúch rovnováhy/ chôdze, resp. kognitívnych fluktuácií (napr. koncentrácie) je zachovaná L-dopa responzibilita príznakov alebo viazanosť porúch chôdze na prítomnosť dyskinéz [39,139]. Hodnotenie kognitívnych funkcií by malo byť realizované v „on“ i „off“ stave za účelom posúdenia ich súvislosti s aktuálnou liečbou.
- STN-DBS je dobre tolerovaná u kognitívne zdravých pacientov. Vzhľadom na preukázané riziko zhoršenia sa kognitívnych funkcií s DBS sa liečba u pacientov s kognitívnym postihnutím neodporúča [32,34, 35,39].
- U pacientov starších ako 70 rokov je STN-DBS spojená s rizikom zhoršenia posturálnych symptómov [39].
- LCIG a/alebo s.c apomorfín môžu byť po zvážení rizík indikované i u pacientov s kognitívnym postihnutím [39,139].
Aké sú nežiaduce účinky a riziká spojené s liečbou pokročilými modalitami?
I napriek limitácii hodnotenia štúdií ponúkajúcich údaje o bezpečnosti a tolerabilite jednotlivých možností liečby má každý druh liečby svoje špecifiká súvisiace s technickým vybavením a príslušenstvom ako i samotným postupom zavedenia [58,122,131,158]. Prehľad najčastejších komplikácií jednotlivých liečebných postupov je uvedený v tab. 2.
![Prehľad najčastejších komplikácií spojených s jednotlivými liečebnými postupmi [124].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/cd5ce6249e6aa10c9bdac8ec7c7b77cc.jpg)
Ktoré faktory indikujú výber jednotlivých modalít liečby?
Nedostatočná kontrola motorických symptómov je najčastejšou príčinou rozhodovania o zmene liečby; potenciálny podiel prítomnosti špecifických nemotorických symptómov a zohľadnenie potenciálnych rizík sprevádzajúcich jednotlivé modality liečby môže významnou mieru prispieť k výberu najvhodnejšieho postupu (tab. 3). Cieľom liečby je dosiahnuť dostatočnú a vyrovnanú kontrolu symptómov. Rozhodovanie o liečbe by malo zobrať do úvahy i súbežnú medikáciu, komorbiditu, vek a preferencie pacienta. Nevyhnutnou súčasťou je zhodnotiť reálne očakávania pacienta a individuálny prístup pacienta k liečbe.
![Vplyv prítomnosti symptómov PD pri výbere liečby [58].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/8d62ec4efa4277d7d4b7c8882cd0ce25.jpg)
- U pacientov mladších ako 70 rokov bez súbežnej komorbidity môže byť zvolený ktorýkoľvek spôsob liečby.
- U pacientov starších ako 70 rokov s kognitívnym postihnutím a/ alebo pri prítomnosti iných kontraindikácií k DBS je indikovaná liečba LCIG alebo apomorfínom. DBS je indikovaná ako druholíniová liečba (v prípade adekvátneho kognitívneho stavu a neprítomnosti mozgovej atrofie na MR mozgu).
Randomizované, kontrolované štúdie porovnávajúce efekt DBS a pumpových modalít na motorické i nemotorické prejavy ako i kvalitu života pacientov nie sú dostupné.
Každý liečebný modus je spojený s vedľajšími účinkami a komplikáciami ako i špecifikami z hľadiska technického zariadenia. Pacient musí byť o obsluhe systému ako i zvládania potenciálnych technických porúch zariadenia detailne inštruovaný a poučený o zvládaní stavu v prípade zlyhania liečby. Kvalita života a zlepšenie stavu pacienta by mala byť prvoradým a kľúčovým parametrom voľby liečebnej modality, avšak treba zohľadniť i finančnú nákladnosť liečby [174,175].
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Karin Gmitterová, PhD.
II. neurologická klinika LF UK a UN Bratislava
Limbová 5
833 05 Bratislava
Slovenská republika
e-mail: gmitterova.karin@gmail.com
Přijato k recenzi: 28. 11. 2016
Přijato do tisku: 19. 1. 2017
MUDr. Karin Gmitterová, PhD.
Karin Gmitterová promovala na LF UK v Bratislave v roku 2003. Následne nastúpila na dennú formu doktorandského štúdia na pracovisko II. neurologickej kliniky LF UK v Bratislave, kde pôsobí i v súčasnosti na pozícii odborného asistenta. V roku 2008 obhájila dizertačnú prácu na tému „Kognitívne poruchy pri Parkinsonovej chorobe“ a v roku 2009 získala špecializáciu v odbore neurológia. V roku 2006 získala vedecký grant (DAAD) na pracovisku neurologickej kliniky UMG, Georg-August Universität, Göttingen v Nemecku pod vedením prof. I. Zerr, s ktorým až do súčasnosti aktívne vedecky spolupracuje. Vo vedeckej sfére sa venuje najmä na diagnostiku neurodegeneratívnych ochorení. Podieľa sa na výukovej činnosti študentov LF UK v Bratislave.
Prednáša na domácich a zahraničných vedeckých podujatiach a je autorkou viacerých domácich a zahraničných publikácií.
Sources
1. Jankovic J. Parkinson’s disease: clinical features and diagnosis. J Neurol Neurosurg Psychiatry 2008;79(4):368 – 76. doi: 10.1136/ jnnp.2007.131045.
2. Kurčová S, Menšíková K, Kaiserová M, et al. Premotorické a non-motorické príznaky Parkinsonovej choroby – taxonómia, klinická manifestácia a neuropatologické koreláty. Cesk Slov Neurol N 2016;79/ 112(3):255 – 70. doi: 10.14735/ amcsnn2016255.
3. Lee A, Gilbert RM. Epidemiology of Parkinson’s disease. Neurol Clin 2016;34(4):955 – 65. doi: 10.1016/ j.ncl.2016.06.012.
4. Cotzias GC, Van Woert MH, Schiffer LM. Aromatic amino acids and modification of parkinsonism. N Engl J Med 1967;276(7):374 – 9. doi: 10.1056/ NEJM196702162760703.
5. Hauser RA. Levodopa: past, present and future. Eur Neurol 2009;62(1):1 – 8. doi: 10.1159/ 000215875.
6. Olanow CW, Agid Y, Mizuno Y, et al. Levodopa in the treatment of Parkinson’s disease: current controversies. Mov Disord 2004;19(9):997 – 1005. doi: 10.1002/ mds.20243.
7. LeWitt PA. Levodopa therapy for Parkinson’s disease: Pharmacokinetics and pharmacodynamics. Mov Disord 2015;30(1):64 – 72. doi: 10.1002/ mds.26082.
8. Cibulcik F, Benetin J, Kurca E, et al. Effects of rasagiline on freezing of gait in Parkinson’s disease - an open-label, multicenter study. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2016;160(4):549 – 552. doi: 10.5507/ bp.2016.023.
9. Kaňovský P, Farníková K. Farmakoterapie pokročilé Parkinsonovy nemoci ve světle doporučených postupů. Neurol Prax 2010;11(4):241 – 5.
10. Růzicka E, Streitová H, Jech R, et al. Amantadine infusion in treatment of motor fluctuations and dyskinesias in Parkinson’s disease. J Neural Transm (Vienna) 2000; 07(11): 1297 – 306.
11. Witjas T, Kaphan E, Azulay JP, et al. Nonmotor fluctu-ation in Parkinson’s disease: frequent and disabling. Neurology 2002;59(3):408 – 13.
12. Storch A, Schneider CB, Wolz M, et al. Nonmotor fluctuations in Parkinson disease: severity and correlation with motor complications. Neurology 2013;80(9):800 – 9. doi: 10.1212/ WNL.0b013e318285c0ed.
13. Ahlskog JE, Muenter MD. Frequency of levodopa-related dyskinesias and motor fluctuations as estimated from the culumative literature. Mov Disord 2001;16(3):448 – 58.
14. Weintraub D, David AS, Evans AH, et al. Clinical spectrum of impulse control disorders in Parkinson’s disease. Mov Disord 2015;30(2):121 – 7. doi: 10.1002/ mds. 26016.
15. Grandas FJ, Galiano ML, Tabernero C. Risk factors for levodopa-induced dyskinesias in Parkinson’s disease. J Neurol 1999;246(12):1127 – 33.
16. Olanow CW, Obeso JA, Stocchi F. Continuous dopamine-receptor treatment of Parkinson’s disease: scientific rationale and clinical implications. Lancet Neurol 2006;5(8):677 – 87.
17. Nutt JG, Woodward WR, Beckner RM, et al. Effect of peripheral catechol-O-methyltransferase inhibition on the pharmacokinetics and pharmacodynamics of levodopa in parkinsonian patients. Neurology 1994;44(5):913 – 9.
18. Hardoff R, Sula M, Tamir A, et al. Gastric emtying time and gastric motility in patients with Parkinson’s disease. Mov Disord 2001;16(6):1041 – 7.
19. Miller DW, Abercrombie ED. Role of high-affinity dopamine uptake and impulse activity in the appearance of extracellular dopamine in striatum after administration of exogenous L-DOPA: studies in intact and 6-hydroxydopamine-treated rats. J Neurochem 1999;72(4):1516 – 22.
20. Bibbiani F, Constantini LC, Patel R, et al. Continuous dopaminergic stimulation reduces risk of motor complications in parkinsonian primates. Exp Neurol 2005;192(1):73 – 8.
21. Fox HC, Katzenschlager R, Lim SY, et al. The movement disorder society evidence-based medicine review update: treatments for the motor symptoms of Parkinson’s disease. Mov Disord 2011;26(Suppl 3):S2 – 41. doi: 10.1002/ mds.23829.
22. Kahan J, Mancini L, Urner M, et al. Therapeutic subthalamic nucleus deep brain stimulation reverses cortico-thalamic coupling during voluntary movements in Parkinson’s disease. PLoS one 2012;7(12):e50270. doi: 10.1371/ journal.pone.0050270.
23. Benabid AL, Pollak P, Louveau A, et al. Combined (thalamotomy and stimulation) stereotactic surgery of the VIM thalamic nucleus for bilateral Parkinson disease. Appl Neurophysiol 1987;50(1 – 6):344 – 6.
24. Tasker RR. Ablative therapy for movement disorders. Does thalamotomy alter the course of Parkinson’s disease? Neurosurg Clin N Am 1998;9(2):375 – 80.
25. Deuschl G, Schade-Brittinger C, Krack P, et al. A randomized trial of deep-brain stimulation for Parkinson’s disease. N Engl J Med 2006;355(9):896 – 908.
26. Deuschl G, Agid Y. Subthalamic neurostimulation for Parkinson’s disease with early fluctuations: balancing the risks and benefits. Lancet Neurol 2013;12(10):1025 – 34. doi: 10.1016/ S1474-4422(13)70151-0.
27. Okun MS, Gallo BV, Mandybur G, et al. Subthalamic deep brain stimulation with a constant-current device in Parkinson’s disease: an open-label randomized controlled trial. Lancet Neurol 2012;11(2):140 – 9. doi: 10.1016/ S1474-4422(11)70308-8.
28. Williams A, Gill S, Varma T, et al. Deep brain stimulation plus best medical therapy versus best medical therapy alone for advanced Parkinson’s disease (PD SURG trial): a randomized, open-label trial. Lancet Neurol 2010;9(6):581 – 91. doi: 10.1016/ S1474-4422(10)70093-4.
29. Schuepbach WM, Rau J, Knudsen K, et al. Neurostimulation for Parkinson’s disease with early motor complications. N Engl J Med 2013;368(7):610 – 22. doi: 10.1056/ NEJMoa1205158.
30. Xie CL, Shao B, Chen J, et al. Effects of neurostimulation for advanced Parkinson’s disease patiens on motor symptoms: A multiple-treatments metaanalysas of randomized controlled trials. Sci Rep 2016;6 : 25285. doi: 10.1038/ srep25285.
31. Krahulik D, Nevrly M, Otruba P, et al. Deep Brain Stimulation in Olomouc-Techniques, Electrode Locations, and Outcomes. Cesk Slov Neurol N 2014;77/ 110(1):54 – 8.
32. Rothlind JC, York MK, Carlson K, et al. Neuropsychological changes following deep brain stimulation surgery for Parkinson’s disease: comparison of treatment at pallidal and subthalamic targets versus best medical therapy. J Neurol Neurosurg Psychiatry 2015;86(6):622 – 9. doi: 10.1136/ jnnp-2014-308119.
33. Anderson VC, Burchiel KJ, Hogarth P, et al. Pallidal vs subthalamic nucleus deep brain stimulation in Parkinson disease. Arch Neurol 2005;62(4):554 – 60.
34. Follett KA, Weaver FM, Stern M, et al. Pallidal versus subthalamic deep-brain stimulation for Parkinson’s disease. N Engl J Med 2010;362(22):2077 – 91. doi: 10.1056/ NEJMoa0907083.
35. Combs HL, Folley BS, Berry DT, et al. Cognition and Depression Following Deep Brain Stimulation of the Subthalamic Nucleus and Globus Pallidus Pars Internus in Parkinson’s Disease: A Meta-Analysis. Neuropsychol Rev 2015;25(4):439 – 54. doi: 10.1007/ s11065-015-9302-0.
36. Odekerken VJ, van Laar T, Staal MJ, et al. Subthalamic nucleus versus globus pallidus bilateral deep brain stimulation for advanced Parkinson’s disease (NSTAPS study): a randomised controlled trial. Lancet Neurol 2013;12(1):37 – 44. doi: 10.1016/ S1474-4422(12)70264-8.
37. Martinez-Ramirez D, Hu W, Bona AR, et al. Update on deep brain stimulation in Parkinson’s disease. Transl Neurodegener 2015;4 : 12. doi: 10.1186/ s40035-015-0034-0.
38. Jung YJ, Kim HJ, Jeon BS, et al. An 8-Year Follow-upon the Effect of Subthalamic Nucleus Deep BrainStimulation on Pain in Parkinson Disease. JAMA Neurol. 2015;72(5):504 – 10. doi: 10.1001/ jamaneurol.2015.8.
39. Volkmann J, Albanese A, Antonini A, et al. Selecting deep brain stimulation or infusion therapies in advanced Parkinson’s disease: an evidence-based review. J Neurol 2013;260(11):2701 – 14. doi: 10.1007/ s00415-012-6798-6.
40. Samuel M, Rodriguez-Oroz M, Antonini A, et al. Impulse Control Disorders in Parkinson’s Disease: Management, Controversies, and Potential Approaches. Mov Disord 2015;30(2):150 – 9. doi: 10.1002/ mds.26099.
41. Merola A, Romagnolo A, Rizzi L, et al. Impulse control behaviors and subthalamic deep brain stimulation in Parkinson’s disease. J Neurol 2017;264(1):40 – 48. doi: 10.1007/ s00415-016-8314-x.
42. Metmann LV, O’Leary ST. Role of surgery in the treatment of motor complications. Mov Disord 2005;20(S11):S45 – 56.
43. Baláž M, Bočková M, Bareš M, et al. Kvalita života po hluboké mozkové stimulaci u pacientů s pokročilou Parkinsonovou nemocí. Cesk Slov Neurol 2011;74(5): 564 – 8.
44. Xu F, Ma W, Huanf Y, et al. Deep brain stimulation of pallidal versus subthalamic for patients with Parkinson’s disease: a meta-analysis of controlled clinical trials. Neuropsychiatr Dis Treat 2016; 12 : 1435 – 1444. doi: 10.2147/ NDT.S105513.
45. St George RJ, Carlson – Kuhta P, Nutt JG, et al. The effect of deep brain stimulation randomized by site on balance in Parkinson’s disease. Mov Disord 2014;29(7):949 – 53. doi: 10.1002/ mds.25831.
46. St George RJ, Nutt JG, Burchiel KJ, et al. A meta-regression of the long-term effects of deep brain stimulation on balance and gait in PD. Neurology 2010;75(14):1292 – 9. doi: 10.1212/ WNL.0b013e3181f61329.
47. Plaha P, Gill SS. Bilateral deep brain stimulation of the pedunculopontine nucleus for Parkinson’s disease. Neuroreport 2005;16(17):1883 – 7.
48. Thevathasan W, Cole MH, Graepel CL, et al. A spatiotemporal analysis of gait freezing and the impact of pedunculopontine nucleus stimulation. Brain 2012;135(Pt 5):1446 – 54. doi: 10.1093/ brain/ aws039.
49. Chieng LO, Madahavan K, Wang MY. Deep brain stimulation as a treatment for Parkinson’s disease related to camptocormia. J Clin Neurosci 2015;22(10):1555 – 61. doi: 10.1016/ j.jocn.2015.05.018.
50. Weiss D, Walach M, Meisner C, et al. Nigral stimulation for resistant axial motor impairment in Parkinson’s disease? A randomized controlled trial. Brain 2013;136 (Pt 7):2098 – 108. doi: 10.1093/ brain/ awt122.
51. Gooneratne IK, Green AL, Dugan P, et al. Comparing neurostimulation technologies in refractory focal-onset epilepsy. J Neurol Neurosurg Psychiatry 2016;87(11):1174 – 82. doi: 10.1136/ jnnp-2016-313297.
52. Boccard SG, Pereira EA, Aziz TZ. Deep brain stimulation for chronic pain. J Clin Neurosci 2015;22(10):1537 – 43. doi: 10.1016/ j.jocn.2015.04.005.
53. Schrock LE, Mink JW, Woods DW, et al. Tourette syndrome deep brain stimulation: a rewiew and updated recommendations. Mov Disord 2015;30(4):448 – 71. doi: 10.1002/ mds.26094.
54. Accolla EA, Aust S, Merkl A, et al. Deep brain stimulation of the posterior gyrus rectus region for treatment resistant depression. J Affect Disord 2016;194 : 33 – 7. doi: 10.1016/ j.jad.2016.01.022.
55. Vedam-Mai V, Gardner B, Okun MS, et al. Increased precursor cell proliferation after deep brain stimulation for Parkinson’s disease: a human study. PLoS One 2014;9(3):e88770. doi: 10.1371/ journal.pone.0088770.
56. Spieles-Engemann AL, Behbehani MM, Collier TJ, et al. Stimulation of the rat subthalamic nucleus is neuroprotective following significant nigral dopamine neuron loss. Neurobiol Dis 2010;39(1):105 – 15. doi: 10.1016/ j.nbd.2010.03.009.
57. Wallace BA, Ashkan K, Heise CE, et al. Survival of midbrain dopaminergic cells after lesion or deep brain stimulation of the subthalamic nucleus in MPTP-treated monkeys. Brain 2007;130 : 2129 – 2145.
58. Odin P, Ray-Chaudhury K, Slevin JT, et al. Collective physician perspectives on non-oral medication approaches for the management of clinically relevant unresolved issues in Parkinson’s disease: consensus from an international survey and discussion program. Parkinsonism Relat Disord 2015;21(10):1133 – 44. doi: 10.1016/ j.parkreldis.2015.07.020.
59. Charles D, Konrad PE, Neimat JS, et al. Subthalamic nucleus beep brain stimulation in early stage Parkinson’s disease. Parkinsonism Relat Disord 2014;20(7):731 – 7. doi: 10.1016/ j.parkreldis.2014.03.019.
60. Hacker M, Tonascia J, Turchan M, et al. Deep brain stimulation may reduce the relative risk of clinically important worsening in early stage Parkinson’s disease. Parkinsonism Relat Disord 2015;21(10):1177 – 83. doi: 10.1016/ j.parkreldis.2015.08.008.
61. Ngoga D, Mitchell R, Kausar J, et al. Deep brain stimulation improves survival in severe Parkinson’s disease. J Neurol Neurosurg Psychiatry 2014;85(1):17 – 22. doi: 10.1136/ jnnp-2012-304715.
62. DeLong MR, Huang KT, Gallis J, et al. Effect of advancing age on outcomes of deep brain stimulation for Parkinson’s disease. JAMA Neurol 2014;71(10):1290 – 5. doi: 10.1001/ jamaneurol.2014.1272.
63. Chiou SM. Benefits of subthalamic stimulation for elderly patients aged 70 years or older. Clin Neurol Neurosurg 2016;149 : 81 – 6. doi: 10.1016/ j.clineuro.2016.07.028.
64. Waln O, Shahed-Jimenez J. Rechargeable deep brain stimulation implantable pulse generators in movement disorders: patient satisfaction and conversion parameters. Neuromodulation 2014;17(5):425 – 30. doi: 10.1111/ ner.12115.
65. Volkmann J, Moro E, Pahwa R. Basic algorithms for the programming of deep brain stimulation in Parkinson’s disease. Mov Disord 2006;21(Suppl 14):S284 – 9.
66. Chen CC, Brücke C, Kempf F. Deep brain stimulation of the subthalamic nucleus: a two-edged sword. Curr Biol 2006;16(22):952 – 3.
67. Connolly AT, Vetter RJ, Hetke JF, et al. A Novel Lead Design for Modulation and Sensing of Deep Brain Structures. IEEE Trans Biomed Eng 2016;63(1):148 – 57. doi: 10.1109/ TBME.2015.2492921.
68. Contarino MF, Bour LJ, Verhagen R, et al. Direc-tional steering: a novel approach to deep brain stimulation. Neurology 2014;83(13):1163 – 9. doi: 10.1212/ WNL.0000000000000823.
69. Benazzouz A, Gao DM, Ni ZG, et al. Effect of high-frequency stimulation of the subthalamic nucleus on the neuronal activities of the substantia nigra pars reticulata and ventrolateral nucleus of the thalamus in the rat. Neuroscience 2000;99(2):289 – 95.
70. Lafreniere-Roula M, Kim E, Hutchinson WD, et al. High-frequency microstimulation in human globus pallidus and substantia nigra. Exp Brain Res 2010;205(2):251 – 61. doi: 10.1007/ s00221-010-2362-8.
71. Weinberger M, Hutchinson WD, Alavi M, et al. Oscillatory activity in the globus pallidus internus: comparison between Parkinsons’s disease and dystonia. Clin Neurophysiol 2012;123(2):358 – 68. doi: 10.1016/ j.clinph.2011.07.029.
72. Chen CC, Kuhn AA, Hoffmann KT, et al. Oscillatory pallidal focal field potential activity correlates with involuntary EMG in dystonia. Neurology 2006;66(3):418 – 20.
73. Shin DS, Samoilova M, Cotic M, et al. High frequency stimulation or elevated K+ depresses neuronal activity in the rat entopeduncular nucleus. Neuroscience 2007;149(1):68 – 86.
74. Chiken S, Nambu A. High-frequency pallidal stimulation disrupts information flow through the pallidum by GABAergic inhibition. J Neurosci 2013;33(6):2268 – 80. doi: 10.1523/ JNEUROSCI.4144-11.2013.
75. Yan N, Chen N, Zhu H, et al. High-frequency stimulation of nucleus accumbens changes in dopaminergic reward circuit. PLoS one 2013;8(11):e79318. doi: 10.1371/ journal.pone.0079318.
76. Hashimoto T, Elder CM, Okun MS, et al. Stimulation of the subthalamic nucleus changes the firing pattern of pallidal neurons. J Neurosci 2003;23(5):1916 – 23.
77. Stefani A, Fedele E, Galati S, et al. Subthalamic stimulation activates internal pallidus: evidence from cGMP microdialysis in PD patients. Ann Neurol 2005;57(3):448 – 52.
78. Karimi M, Golchin N, Tabbal SD, et al. Subthalamic nucleus stimulation-induced regional blood flow responses correlate with improvement of motor signs in Parkinson disease. Brain 2008;131(Pt 10):2710 – 9. doi: 10.1093/ brain/ awn179.
79. Vedam-Mai V, van Battum EY, Kamphuis W, et al. Deep brain stimulation and the role of astrocytes. Mol Psychiatry 2012;17(2):124 – 31. doi: 10.1038/ mp.2011.61.
80. Li Q, Ke Y, Chan DC, et al. Therapeutic deep brain stimulation in parkinsonian rats directly influences motor cortex. Neuron 2012;76(5):1030 – 41. doi: 10.1016/ j.neuron.2012.09.032.
81. Little S, Brown P. What brain signals are suitable for feedback control of deep brain stimulation in Parkinson’s disease? Ann NY Acad Sci 2012;1265 : 9 – 24. doi: 10.1111/ j.1749-6632.2012.06650.x.
82. Anderson TR, Hu B, Iremonger K, et al. Selective attenuation of afferent synaptic transmission as a mechanism of thalamic deep brain stimulation-induced tremor arrest. J Neurosci 2006;26(3):841 – 50. doi: 10.1523/ JNEUROSCI.3523-05.2006.
83. Kringelbach ML, Green AL, Aziz TZ. Balancing the brain: resting state networks and deep brain stimulation. Front Integr Neurosci 2011;5 : 8. doi: 10.3389/ fnint.2011.00008.
84. de Hemptinne C, Swann NC, Ostrem JL, et al. Therapeutic deep brain stimulation reduces cortical phase-amplitude coupling in Parkinson’s disease. Nat Neurosci 2015;18(5):779 – 86. doi: 10.1038/ nn.3997.
85. Smith Y, Wichmann T. The cortico-pallidal projection: an additional route for cortical regulation of the basal ganglia circuitry. Mov Disord 2015;30(3):293-5. doi: 10.1002/ mds.26095.
86. Brown P. Oscillatory nature of human basal ganglia activity: relationship to the pathophysiology of Parkinson’s disease. Mov Disord 2003;18(4):357 – 63.
87. Henderson JM. “Connectomic surgery”: diffusion tensor imaging (DTI) tractrography as a targeting modality for surgical modulation of neural networks. Front Integr Neurosci 2012;6 : 15. doi: 10.3389/ fnint.2012.00015.
88. Xiaowu H, Xiufeng J, Xiaoping Z, et al. Risks of intracranial hemorrhage in patients with Parkinson’s disease receiving deep brain stimulation and ablation. Parkinsonism Relat Disord 2010;16(2):96 – 100. doi: 10.1016/ j.parkreldis.2009.07.013.
89. Zibetti M, Romagnolo A, Crobeddu E, et al. Does intraoperative microrecording really increase the risk of hemorrhagic complications in deep brain stimulation? Brain Stimul 2014;7(6):911 – 2. doi: 10.1016/ j.brs.2014.07.037.
90. Larson PS, Starr PA, Bates G, et al. An optimized system for interventional magnetic resonance imaging-guided stereotactic surgery: preliminary evaluation of targeting accuracy. Neurosurgery 2012;70(1 Suppl. Operative):95 – 103. doi: 10.1227/ NEU.0b013e31822f4a91.
91. Ostrem JL, Ziman N, Galifianakis NB, et al. Clinical outcomes using ClearPoint interventional MRI for deep brain stimulation lead placement in Parkinson’s disease. J Neurosurg 2016;124(4):908 – 16. doi: 10.3171/ 2015.4.JNS15173.
92. He N, Ling H, Ding B, et al. Region-specific disturbed iron distribution in early idiopathic Parkinson’s disease measured by quantitative susceptibility mapping. Hum Brain Mapp 2015;36(11):4407 – 20. doi: 10.1002/ hbm.22928.
93. Oyama G, Foote KD, Hwynn N, et al. Rescue leads: a salvage technique for selected patients with a suboptimal response to standard DBS therapy. Parkinsonism Relat Disord 2011;17(6):451 – 5. doi: 10.1016/ j.parkreldis.2011.03.009.
94. Miocinovic S, Khemani P, Whiddon R, et al. Outcomes, management, and potential mechanisms of interleavig deep brain stimulation settings. Parkinsonism Relat Disord 2014;20(12):1434 – 7. doi: 10.1016/ j.parkreldis.2014.10.011.
95. Timmermann L, Jain R, Chen L, et al. Multiple-source current steering in subthalamic nucleus deep brain stimulation for Parkinson’s disease (the VANTAGE study): a non-randomized, prospective, multicenter, open-label study. Lancet Neurol 2015;14(7):693 – 701. doi: 10.1016/ S1474-4422(15)00087-3.
96. Urgošík D, Jech R, Růžička E. Hluboká mozková stimulace u nemocných s extrapyramidovými poruchami pohybu – stereotaktická procedura a intraoperační nálezy. Cesk Slov Neurol 2011;74/ 107(2):175 – 186.
97. Voges J, Hilker R, Bötzel K, et al. Thirty days complication rate following surgery performed for deep-brain-stimulation. Mov Disord 2007;22(10):1486 – 9.
98. Fenoy AJ, Simpson RK. Management of device-related wound complications in deep brain stimulation surgery. J Neurosurg 2012;116(6):1324 – 32. doi: 10.3171/ 2012.1.JNS111798.
99. Bhatia R, Dalton A, Richards M, et al. The incidence of deep brain stimulator hardware infection: the effect of change in antibiotic prophylaxis regimen and review of the literature. Br J Neurosurg 2011;25(5):625 – 31. doi: 10.3109/ 02688697.2011.566384.
100. Chan DT, Zhu XL, Yeung JH, et al. Complications of deep brain stimulation: a collective review. Asian J Surg 2009;32(4):258 – 63. doi: 10.1016/ S1015-9584(09)60404-8.
101. Fernandez FS, Alvarez Vega MA, Antuna Ramos A, et al. Lead fractures in deep brain stimulation during long-term follow-up. Parkinsons Dis 2010;2010 : 409356. doi: 10.4061/ 2010/ 409356.
102. Amami P, Dekker I, Piacentini S, et al. Impulse control behaviours in patients with Parkinson’s disease after subthalamic deep brain stimulation: de novo cases and 3-year follow-up. J Neurol Neurosurg Psychiatry 2015;86(5):562 – 4. doi: 10.1136/ jnnp-2013-307214.
103. Kupsch A, Tagliati M, Vidailhet M, et al. Early postoperative management of DBS in dystonia: programming, response to stimulation, adverse events, medication changes, evaluations, and troubleshooting. Mov Disord 2011;26(Suppl 1):S37 – 53. doi: 10.1002/ mds.23624.
104. Galati S, Stefani A. Deep brain stimulation of the subthalamic nucleus: All that glitters isn’t gold? Mov Disord 2015;30(5):632 – 7. doi: 10.1002/ mds.26149.
105. Little S, Pogosyan A, Neal S. Adaptive deep brain stimulation in advanced Parkinson disease. Ann Neurol 2013;74(3):449 – 57. doi: 10.1002/ ana.23951.
106. Rosa M, Arlotti M, Ardolino G. Adaptive deep brain stimulation in a freely moving Parkinsonian patient. Mov Disord 2015;30(7):1003 – 5. doi: 10.1002/ mds.26241.
107. Hirschmann J, Ozkurt TE, Butz M. Differential modulation of STN-cortical and cortico-muscular coherence by movement and levodopa in Parkinson’s disease. Neuroimage 2013;68 : 203 – 13. doi: 10.1016/ j.neuroimage.2012.11.036.
108. Beuter A, Lefaucheur JP, Modolo J. Closed-loop cortical neuromodulation in Parkinson’s disease: an alternative to deep brain stimulation? Clin Neurophysiol 2014;125(5):874 – 85. doi: 10.1016/ j.clinph.2014.01.006.
109. Grahn PJ, Mallory GW, Khurram OU, et al. A neurochemical closed-loop controller for deep brain stimulation: toward individualized smart neuromodulation therapies. Front Neurosci 2014;8 : 169. doi: 10.3389/ fnins.2014.00169.
110. Little S, Pogosyan A, Kuhn AA, et al. Beta band stability over time correlates with Parkinsonian rigidity and bradykinesia. Exp Neurol 2012;236(2):383 – 8. doi: 10.1016/ j.expneurol.2012.04.024.
111. Bronte-Stewart H, Barberini C, Koop MM, et al. The STN beta-band profile in Parkinson’s disease is stationary and shows prolonged attentuation after deep brain stimulation. Exp Neurol 2009;215(1):20 – 8. doi: 10.1016/ j.expneurol.2008.09.008.
112. Whitmer D, de Solages C, Hill BC, et al. High frequency deep brain stimulation attenuates subthalamic and cortical rhythms in Parkinson’s disease. Front Hum Neurosci 2012;6 : 155. doi: 10.3389/ fnhum.2012.00155.
113. Shoulson I, Glaubiger GA, Chase TN. On-off response. Clinical and biochemical correlations during oral and intravenous levodopa administration in Parkinsonian patients. Neurology 1975;25(12):1144 – 8.
114. Kurlan R, Rubin AJ, Miller C, et al. Duodenal delivery of levodopa for on-off fluctuations in parkinsonism: preliminary observations. Ann Neurol 1986;20(2):262 – 5.
115. Bredberg E, Nilsson D, Johansson K, et al. Intraduodenal infusion of a water-based levodopa dispersion for optimisation of the therapeutic effect in severe Parkinson’s disease. Eur J Clin Pharmacol 1993;45(2):117 – 22.
116. Nyholm D, Askmark H, Gomes-Trolin C, et al. Optimizing levodopa pharmacokinetics: intestinal infusion versus oral sustained-release tablets. Clin Neuropharmacol 2003;26(3):156-63.
117. Nyholm D, Odin P, Johansson A, et al. Pharmacokinetics of leveodopa, carbidopa, and 3-O-methyldopa following 16-hour jejunal infusion of levodopa-carbidopa intestinal gel in advanced Parkinson’s disease patients. AAPS J 2013;15(2):316 – 23. doi: 10.1208/ s12248-012-9439-1.
118. Klempíř J, Havránková P, Jech R. Terapie Parkinsonovy nemoci levodopou v kontinuální enterální infuzi. Neurol Prax 2015;16(2):84 – 88.
119. Wirdefeldt K, Odin P, Nyholm D. Levodopa-Carbidopa Intestinal Gel in Patients with Parkinson’s disease: A Systematic Review. CNS Drugs 2016;30(5):381 – 404. doi: 10.1007/ s40263-016-0336-5.
120. Nyholm D, Nilsson Remahl AI, Dizdar N, et al. Duodenal levodopa infusion monotherapy vs oral polypharmacy in advanced Parkinson disease. Neurology 2005;64(2):216 – 23.
121. Olanow CW, Kieburtz K, Odin P, et al. Continuous intrajejunal infusion of levodopa-carbidopa intestinal gel for patients with advanced Parkinson’s disease: a randomised, controlled, double-blind, double-dummy study. Lancet Neurol 2014;13(2):141 – 9. doi: 10.1016/ S1474-4422(13)70293-X.
122. Fernandez HH, Standaert DG, Hauser RA, et al. Levodopa-carbidopa intestinal gel in advanced Parkinson’s disease: final 12-month, open-label results. Mov Disord 2015;30(4):500 – 9. doi: 10.1002/ mds.26123.
123. Antonini A, Yegin A, Preda C, et al. Global long-term study on motor and non-motor symptoms and safety of levodopa-carbidopa intestinal gel in routine care of advanced Parkinson’s disease patients; 12-month interim outcomes. Parkinsonism Relat Disord 2015;21(3):231 – 5. doi: 10.1016/ j.parkreldis.2014.12.012.
124. Fasano A, Ricciardi L, Lena F, et al. Intrajejunal levodopa infusion in advanced Parkinson’s disease: long-term effects on motor and non-motor symptoms and impact on patient’s and caregiver’s quality of life. Eur Rev Med Pharmacol Sci 2012;16(1):79 – 89.
125. Honig H, Antonini A, Martinez-Martin P, et al. Intrajejunal levodopa infusion in Parkinson’s disease: a pilot multicenter study of effects on nonmotor symptoms and quality of life. Mov Disord 2009;24(10):1468 – 75. doi: 10.1002/ mds.22596.
126. Martinez-Martin P, Reddy P, Katzenschlager R, et al. EuroInf: a multicenter comparative observational study of apomorphine and levodopa infusion in Parkinson’s disease. Mov Disord 2015;30(4):510 – 6. doi: 10.1002/ mds.26067.
127. Todorova A, Samuel M, Brown RG, et al. Infusion therapies and development of impulse control disorders in advanced parkinson disease: clinical experience after 3 years’ follow-up. Clin Neuropharmacol 2015;38(4):132 – 4. doi: 10.1097/ WNF.0000000000000091.
128. Pickut BA, van der Linden C, Dethy S, et al. Intestinal levodopa infusion: the Belgian experience. Neurol Sci 2014;35(6):861 – 6. doi: 10.1007/ s10072-013-1612-5.
129. Caceres-Redondo MT, Carrillo F, Lama MJ, et al. Long-term levodopa/ carbidopa intestinal gel in advanced Parkinson’s disease. J Neurol 2014;261(3):561 – 9. doi: 10.1007/ s00415-013-7235-1.
130. Zibetti M, Merola A, Artusi CA, et al. Levodopa/carbidopa intestinal gel infusion in advanced Parkinson’s disease: a 7 - year experience. Eur J Neurol 2014;21(2):312 – 8. doi: 10.1111/ ene.12309.
131. Lang AE, Rodriguez RL, Boyd JT, et al. Integrated safety of levodopa-carbidopa intestinal gel from prospective clinical trials. Mov Disord 2016;31(4):538 – 46. doi: 10.1002/ mds.26485.
132. Epstein M, Johnson DA, Hawes R, et al. Long-Term PEG-J Tube Safety in Patients With Advanced Parkinson’s disease. Clin Transl Gastroenterol 2016;7:e159. doi: 10.1038/ ctg.2016.19.
133. Muller T, van Laar T, Cornblath DR, et al. Peripheral neuropathy in Parkinson’s disease: levodopa exposure and implications for duodenal delivery. Parkinsonism Relat Disord 2013;19(5):501 – 7. doi: 10.1016/ j.parkreldis.2013.02.006.
134. Mancini F, Comi C, Oggioni GD, et al. Prevalence and features of peripheral neuropathy in Parkinson’s disease patients under different therapeutic regimens. Parkinsonism Relat Disord 2014;20(1):27 – 31. doi: 10.1016/ j.parkreldis.2013.09.007.
135. Nyholm D, Jansson R, Willows T, et al. Long-term 24-hour duodenal infusion of levodopa: outcome and dose requirements. Neurology 2005;65(9):1506 – 7.
136. Hagell P, Odin P, Shing M. Apomorphine in Parkinson’s disease. Bremen: UNI-MED-Verlag 2008.
137. Pietz K, Hagell P, Odin P. Subcutaneous apomorphine in late stage Parkinson’s disease: a long term follow up. J Neurol Neurosurg Psychiatry 1998;65(5):709 – 16.
138. Stacy M, Silver D. Apomorphine for acute treatment of “off” episodes in Parkinson’s disease. Parkinsonism Relat Disord 2008;14(2):85 – 92.
139. Garcia-Ruiz PJ, Sesar Ignacio A, Ares Pensado B, et al. Efficacy of long-term continuous apomorphine infusion in advanced Parkinson’s disease with motor fluctuation: a multicenter study. Mov Disord 2008;23(8):1130 – 6. doi: 10.1002/ mds.22063.
140. Martinez-Martin P, Reddy P, Antonini A, et al. Chronic subcutaneous infusion therapy with apomorphine in advanced Parkinson’s disease compared to conventional therapy: a real life study of non motor effect. J Parkinsons Dis 2011;1(2):197 – 203. doi: 10.3233/ JPD-2011-11037.
141. Todorova A, Martinez-Martin P, Martin A, et al. Daytime apomorphine infusion combined with transdermal rotigotine patch therapy is tolerated at 2 years: a 24 hours treatment option in Parkinson’s disease. Basal Ganglia 2013;3(2):127 – 30.
142. Ribaric S. The pharmacological properties and therapeutic use of apomorphine. Molecules 2012;17(5):5289 – 309. doi: 10.3390/ molecules17055289.
143. Ondo WG, Hunter C, Vuong KD, et al. The pharmacokinetic and clinical effects of tolcapone on a single dose of sublingual apomorphine in Parkinson’s disease. Parkinsonism Relat Disord 2000;6(4):237 – 40.
144. Schwab RS, Amador LV, Lettvin JY. Apomorphine in Parkinson’s disease. Trans Am Neurol Assoc 1951;56 : 251 – 3.
145. Cotzias GC, Papavasiliou PS, Tolosa ES, et al. Treatment of Parkinson’s disease with aporphines. Possible role of growth hormone. N Engl J Med 1976;294(11):567 – 72.
146. D’Costa DF, Abbott RJ, Pye IF, et al. The apomorphine test in parkinsonian syndromes. J Neurol Neurosurg Psychiatry 1991;54(10):870 – 2.
147. Netsomboon K, Partenhauser A, Rohrer JD, et al. Preactivated thiomers for intranasal delivery of apomorphine: in vitro and in vivo evaluation. Eur J Pharm Biopharm 2016;109 : 35 – 42. doi: 10.1016/ j.ejpb.2016.09.004.
148. Hauser RA, Olanow CW, Dzyngel B, et al. Sublingual apomorphine (APL-130277) for the acute conversion of OFF to ON in Parkinson’s disease. Mov Disord 2016;31(9):1366 – 72. doi: 10.1002/ mds.26697.
149. LeWitt PA, Ondo WG, Van Lunen B, et al. Open-label study assessment of safety and adverse effects of subcutaneous apomorphine injections in treating “off” episodes in advanced Parkinson disease. Clin Neuropharmacol 2009;32(2):89 – 93. doi: 10.1097/ WNF.0B013E31816D91F9.
150. Poewe W, Kleedorfer B, Gerstenbrandt F, et al. Subcutaneous apomorphine in Parkinson’s disease. Lancet 1988;1(8591):943.
151. Pollak P, Champay AS, Gaio JM, et al. Subcutaneous administration of apomorphine in motor fluctuations in Parkinson’s disease. Revue Neurol 1990;146(2):116 – 22.
152. Borgemeester RW, Drent M, van Laar T. Motor and non-motor outcomes of continuous apomorphine infusion in 125 Parkinson’s disease patients. Parkinsonism Relat Disord 2016;23 : 17–22. doi: 10.1016/ j.parkreldis.2015.11.013.
153. Dewey RBJ, Hutton JT, LeWitt PA, et al. A randomized, double-blind, placebo-controlled trial of subcutaneously injected apomorphine for parkinsonian off-state events. Arch Neurol 2001;58(9):1385 – 92.
154. Antonini A, Isaias IU, Rodolfi G, et al. A 5-year prospective assessment of advanced Parkinson disease patients treated with subcutaneous apomorphine infusion or deep brain stimulation. J Neurol 2011;258(4):579 – 85. doi: 10.1007/ s00415-010-5793-z.
155. Drapier S, Eusebio A, Degos B, et al. Quality of life in Parkinson’s disease improved by apomorphine pump: the OPTIPUMP cohort study. J Neurol 2016;263(6):1111 – 9. doi: 10.1007/ s00415-016-8106-3.
156. Literature review intermittent subcutaneous apomorphine therapy in Parkinson’s disease. Neurology 2004;62(6 Suppl 4):S12 – 7.
157. Boyle A, Ondo WG. Apomorphine in the Treatment of Parkinson’s disease. CNS Drugs 2015;29(2):83 – 9. doi: 10.1007/ s40263-014-0221-z.
158. Katzenschlager R, Hughes A, Evans A, et al. Continuous subcutaneous apomorphine therapy improves dyskinesias in Parkinson’s disease: a prospective study using single-dose challenges. Mov Disord 2005;20(2):151 – 7.
159. Kaňovsky P, Kubova D, Bareš M, et al. L-DOPA Induced Dyskinesias and the Continuous Subcutaneous Infusions of Apomorphine – Results of Two Years, Prospective Follow-Up. Mov Disord 2002;17:(1):188–91.
160. Kaňovský P, Kubová D, Bareš M, et al. Suppression of L-DOPA induced dyskinesias in advanced Parkinson’s disease by continuous subcutaneous infusions of apomorphine – results of one year, prospective follow-up. Cesk Slov Neurol N 2002;65/ 98(1):9 – 14.
161. Clarke CE, Worth P, Grosset D, et al. Systematic review of apomorphine infusion, levodopa infusion and deep brain stimulation in advanced Parkinson’s disease. Parkinsonism Relat Disord 2009;15(10):728 – 41. doi: 10.1016/ j.parkreldis.2009.09.005.
162. Isaacson S, Ondo WG, Pagan F. Apomorphine Improves Morning Akinesia in Parkinson’s Disease: Interim Analysis of the AM-IMPAKT Trial (P7.072). Neurology 2014;82(10):68 – 9.
163. Todorova A, Chaudhuri KR. Subcutaneous apomorphine and non-motor symptoms in Parkinson’s disease. Parkinsonism Relat Disord 2013;19(12):1073 – 8. doi: 10.1016/ j.parkreldis.2013.08.012.
164. Fernandez-Pajarin G, Sesar A, Ares B, et al. Evaluating the Efficacy of Nocturnal Continuous Subcutaneous Apomorphine Infusion in Sleep Disorders in Advanced Parkinson’s Disease: The APO-NIGHT Study. J Parkinsons Dis 2016;6(4):787 – 92.
165. Borgemeester RW, Lees AJ, van Laar T. Parkinson’s disease, visual hallucinations and apomorphine: A review of the available evidence. Parkinsonism Relat Disord 2016;27 : 35 – 40. doi: 10.1016/ j.parkreldis.2016.04.023.
166. Manson AJ, Hanagasi H, Turner K, et al. Intravenous apomorphine therapy in Parkinson’s disease clinical and pharmacokinetic observations. Brain J Neurol 2001;124(4):331 – 40.
167. LeWitt PA. Subcutaneously administered apomorphine: pharmacokinetics and metabolism. Neurology 2004;62(6 Suppl 4):S8 – 11.
168. Tribl GG, Sycha T, Kotzailias N, et al. Apomorphine in idiopathic restless legs syndrome: an exploratory study. J Neurol Neurosurg Psychiatry 2005;76(2):181 – 5.
169. Fridman EA, Krimchansky BZ, Bonetto M, et al. Continuous subcutaneous apomorphine for severe disorders of consciousness after traumatic brain injury. Brain Inj 2010;24(4):636 – 41. doi: 10.3109/ 02699051003610433.
170. Himeno E, Ohyagi Y, Ma L, et al. Apomorphine treatment in Alzheimer mice promoting amyloid-βdegradation. Ann Neurol 2011;69(2):248 – 56. doi: 10.1002/ ana.22319.
171. Yarnall AJ, Lashley T, Ling H, et al. Apomorphine: A potential modifier of amyloid deposition in Parkinson’s disease? Mov Disord 2016;31(5):668 – 75. doi: 10.1002/ mds.26422.
172. Eggert K, Schrader C, Hahn M, et al. Continuous jejunal levodopa infusion in patients with advaced parkinson disease: practical aspects and outcome of motor and non-motor complications. Clin Neuropharmacol 2008;31(3):151 – 66. doi: 10.1097/ wnf.0b013e31814b113e.
173. Kempster PA, O’Sullivan SS, Holton JL, et al. Relationships between age and late progression of Parkinson’s disease: a clinico-pathological study. Brain 2010;133(Pt 6):1755 – 62. doi: 10.1093/ brain/ awq059.
174. Lundqvist C, Beiske AG, Reiertsen O, et al. Real life cost and quality of life associated with continuous intraduodenal levodopa infusion compared with oral treatment in Parkinson patients. J Neurol 2014;261(12):2438 – 45. doi: 10.1007/ s00415-014-7515-4.
175. Pietzsch JB, Garner AM, Marks WJJ. Cost-Effectiveness of Deep Brain Stimulation for Advanced Parkinson’s Disease in the United Stated. Neuromodulation 2016;19(7):689 – 97. doi: 10.1111/ ner.12474.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2017 Issue 5
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Memantine Eases Daily Life for Patients and Caregivers
-
All articles in this issue
- Invasive Methods in the Treatment of Advanced Parkinson’s Disease
- Gait Neurorehabilitation in Stroke Patients
- Essential Tremor – Is There a New Nosological Concept?
- Leber Hereditary Optic Neuropathy
- Facial Nerve Function after Microsurgical Removal of the Vestibular Schwannoma
- Smoking Prevalence in Group of Central-European Patients with Narcolepsy-cataplexy, Narcolepsy without Cataplexy and Idiopathic Hypersomnia
- Long-term Postoperative Clinical Outcomes after Intramedullary Cavernoma Resection
- Statin-induced Necrotizing Autoimmune Myopathy
- Electrical Stimulation of the Suprahyoid Muscles in Post Stroke Patients with Dysphagia
- Intraventricular Meningiomas – a Retrospective Study on 19 Surgical Cases
- Single Nucleotide Polymorphism p.Val66Met in BDNF Gene in the Czech Population
- Two Cases of CNS Atypical Theratoid Rhabdoid Tumor and Review of Literature
- Thermal Management in Patients Undergoing Elective Spinal Surgery in Prone Position – a Prospective Randomized Trial
- Sub-chronic Intra-hippocampal Aminoguanidine Improves Passive Avoidance Task and Expression of Bcl-2 Family Genes in Diabetic Rats
- Case of Adult Escherichia Coli Meningitis
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Essential Tremor – Is There a New Nosological Concept?
- Leber Hereditary Optic Neuropathy
- Statin-induced Necrotizing Autoimmune Myopathy
- Invasive Methods in the Treatment of Advanced Parkinson’s Disease

