Parietální atrofie na magnetické rezonanci mozku u Alzheimerovy nemoci s pozdním začátkem
Magnetic resonance imaging showing parietal atrophy of the brain in late-onset Alzheimer’s disease
Aim:
Our intention was to assess whether a scoring of parietal atrophy on MRI of the brain using a simple visual assessment named PAS (Parietal Atrophy Score) could be used in the diagnosis of late-onset Alzheimer‘s disease.
Patients and methods:
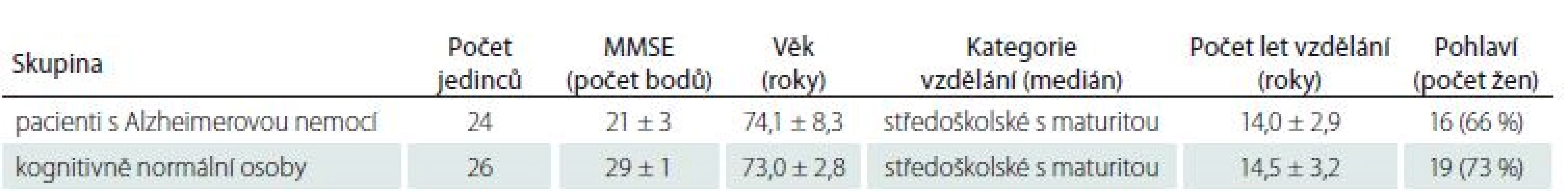
The structure of the parietal lobes was evaluated by our visual scale named PAS, which is based on semiquantitative scoring of atrophy of three structures in the parietal region: sulcus cingularis posterior, precuneus and parietal gyri. Parietal atrophy was assessed in 24 patients with late-onset Alzheimer‘s disease in the stage of mild dementia (Mini-Mental State Examination; MMSE 21 ± 3 points) and 26 age-matched individuals with normal scores on the MMSE (29 ± 1 point).
Results:
We did not find any statistically significant difference in the size of any structure of the right and left parietal lobe according to the PAS visual scale between control individuals and patients with Alzheimer‘s disease (p > 0.05 in all cases).
Conclusion:
During late-onset Alzheimer‘s disease there is no significant reduction of parietal cortex until the stage of mild dementia compared to normal aging. Parietal atrophy evaluated according to the PAS visual scale is not an appropriate marker to be used in the diagnosis of late-onset Alzheimer‘s disease in mild stages.
Key words:
Parietal Atrophy Score – parietal atrophy – magnetic resonance imaging – Alzheimer‘s disease – dementia – aging – sulcus cingularis posterior – precuneus – parietal gyri
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
磁共振成像显示晚发性阿尔茨海默氏症患者大脑顶叶萎缩
目的:
我们的目的是评估大脑MRI上的顶叶萎缩评分是否可以用于晚发性阿尔茨海默病的诊断。
患者和方法:
顶叶的结构是通过我们命名为PAS的视觉量表来评估的,它是基于对顶叶区域萎缩的三个结构的半定量评分:后扣带沟、楔前叶和顶叶回。对24例晚发阿尔茨海默氏症轻度痴呆(微精神状态检查;MMSE 21±3分),年龄匹配者26例,MMSE得分正常(29±1分)。
结果:
对照个体与阿尔茨海默病患者的PAS视觉量表比较,未发现左右顶叶结构大小差异有统计学意义(p > 0.05)。
结论:
在晚发性阿尔茨海默病中,直到轻度痴呆阶段,顶叶皮层与正常年龄相比没有明显的减少。根据PAS视觉量表评估的顶叶萎缩并不适合用于轻度迟发性阿尔茨海默病的诊断。
关键词:
顶叶萎缩评分-顶叶萎缩-磁共振成像-阿尔茨海默氏症-痴呆-衰老-颈沟后-楔前叶-顶叶回
Authors:
D. Šilhán 1,2; I. Ibrahim 3; Jaroslav Tintěra 3; A. Bartoš 1,2
Authors‘ workplace:
Neurologická klinika 3. LF UK a FN Královské Vinohrady, Praha
1; Národní ústav duševního zdraví, Klecany
2; Institut klinické a experimentální medicíny, Praha
3
Published in:
Cesk Slov Neurol N 2019; 82(1): 91-95
Category:
Original Paper
doi:
https://doi.org/10.14735/amcsnn201991
Overview
Cíl:
Naším záměrem bylo posoudit, zda by se při diagnostice Alzheimerovy nemoci s pozdním začátkem dalo využít skórování parietální atrofie na MR mozku pomocí jednoduché vizuální metodiky označené zkratkou PAS (Parietální atrofický skór).
Soubor a metody:
Strukturu parietálních laloků jsme hodnotili námi vyvinutou vizuální škálou PAS, která je založena na semikvantitativním skórování atrofie tří struktur v parietální oblasti: sulcus cingularis posterior, precuneus a parietální gyry. Parietální atrofie byla posuzována u 24 pacientů s Alzheimerovou nemocí s pozdním začátkem ve stadiu mírné demence (Mini-Mental State Examination; MMSE 21 ± 3 body) a 26 věkově vázaných jedinců s normálním výsledkem testu kognitivních funkcí (MMSE 29 ± 1 bod).
Výsledky:
Podle vizuální škály PAS nebyl prokázán statisticky významný rozdíl ve velikosti žádné z hodnocených struktur pravého ani levého parietálního laloku mezi pacienty s Alzheimerovou nemocí a kontrolními jedinci (ve všech případech p > 0,05).
Závěr:
Během Alzheimerovy nemoci s pozdním začátkem nedochází do stadia mírné demence k výraznějšímu úbytku parietální kůry, než by odpovídalo běžnému stárnutí. Parietální atrofie hodnocená podle metodiky PAS není vhodným ukazatelem, který by se dal využít při diagnostice počátečních stadií Alzheimerovy nemoci s pozdním začátkem.
Klíčová slova:
Parietální atrofický skór – parietální atrofie – magnetická rezonance – Alzheimerova nemoc – demence – stárnutí – sulcus cingularis posterior – precuneus – parietální gyry
Úvod
Posuzování atrofie mozkových struktur na MR přispívá k diagnostice Alzheimerovy nemoci (AN) [1,2]. Nejčastěji jsou hodnoceny mediotemporální oblast a hipokampus. V tomto regionu se převážně využívá vizuální skórování pomocí medial temporal lobe atrophy score (MTA), které je vhodné pro klinickou praxi podle původní studie [3], nedávného souhrnu [4] nebo našich prvních zkušeností v ČR [5]. Podle řady prací je rychlejší atrofie této oblasti spojena s přechodem mírné kognitivní poruchy do demence u AN [4,6 – 9]. Hipokampus a mediotemporální region ovšem atrofují i v průběhu normálního stárnutí a u jiných demencí, nejvíce u frontotemporální lobární degenerace [10,11]. Nejedná se tedy o specifický ukazatel AN. Proto je třeba zaměřit pozornost i na jiné oblasti mozku, jejichž atrofie může souviset s AN. Kombinace hodnocení více regionů by mohla zvýšit specificitu pro AN [11].
Naším cílem bylo posoudit, zda je právě parietální oblast tím regionem, jehož atrofie souvisí s AN. Důvodem, proč jsme vybrali parietální lalok, bylo to, že funkční zobrazovací metody, jako jsou PET, perfúzní MR a funkční MR, popisují u pacientů s AN poruchy metabolizmu, prokrvení a aktivity v parietální oblasti [12,13]. Zajímalo nás, zda se tyto patologie projeví i na struktuře laloku na MR mozku.
Dalším důvodem našeho zájmu o parietální lalok bylo to, že některé práce poukazují na spojitost mezi parietální atrofií a AN s časným začátkem u jedinců mladších 65 let. Vzácnější AN s časným začátkem se může lišit počínajícími symptomy a také charakteristickým nálezem na MR mozku. U této formy AN je častější výskyt zrakově prostorových a zrakově percepčních poruch v časných stadiích s relativně zachovalou anterográdní epizodickou pamětí, která se zhoršuje až v pokročilejších stadiích choroby [14]. Výsledky některých studií poukazují na častější výskyt parietální atrofie a zachovalé struktury hipokampu u AN s časným začátkem [11,14 – 17]. Klasická AN s pozdním začátkem je podstatně častější, a proto by případný nález patologie v parietální oblasti již v časných stadiích mohl významně podpořit diagnostiku tohoto onemocnění.
Rozhodli jsme se tedy posoudit objem parietálních struktur u klasické AN s pozdním začátkem prostřednictvím námi vytvořené vizuální škály Parietální atrofický skór (PAS), která byla představena v naší předchozí práci jako jednoduchá metoda vhodná pro klinickou praxi [18].
Soubor a metody
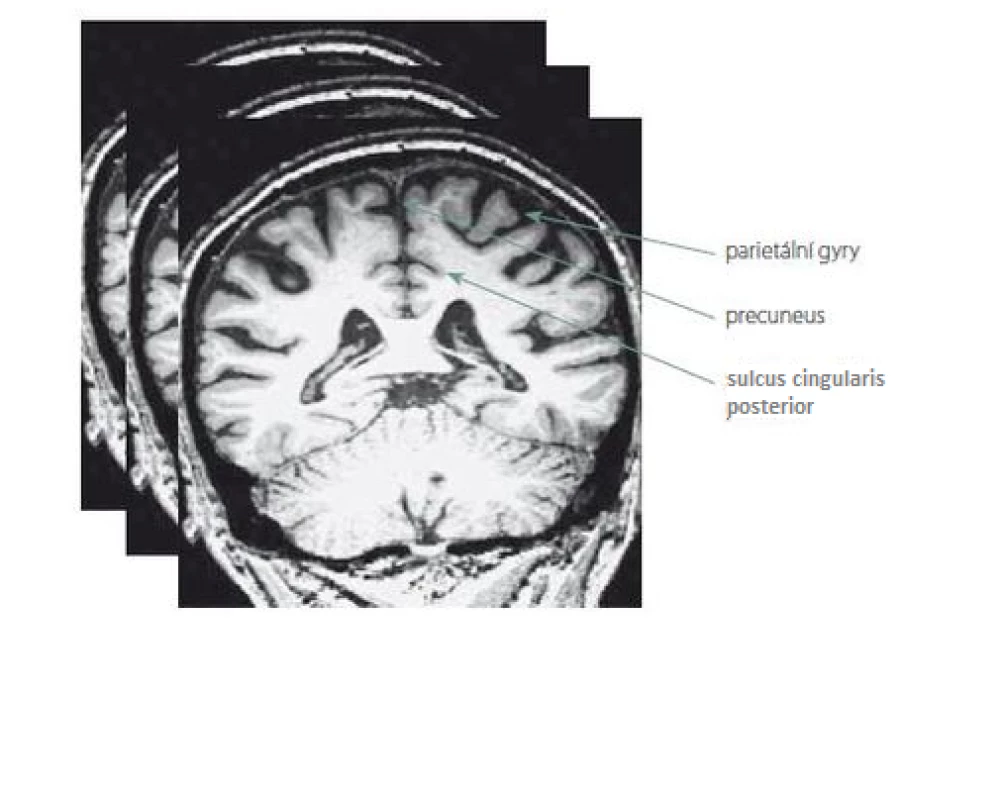
K posouzení parietální atrofie na MR mozku jsme využili námi vytvořenou vizuální škálu PAS, která je založena na skórování objemu tří struktur na T1 vážených koronárních řezech v rozsahu celého parietálního laloku. Jedná se o následující oblasti: sulcus cingularis posterior, precuneus a parietální gyry (obr. 1). Každá struktura byla skórována semikvantitativně ve třech stupních: 0 – bez atrofie, 1 – hraniční nález nebo 2 – významná atrofie. Na základě námi určených kritérií se z jednotlivých stupňů stanovil výsledný skór zvlášť pro pravý a levý lalok (PAS = výsledný skór pravého/levého laloku). Ten může analogicky nabývat hodnot: 0 – lalok bez atrofie, 1 – hraniční nález, 2 – významná atrofie laloku. Nakonec jsme z PAS obou laloků stanovili jeden celkový skór pro celý mozek tzv. PASglob, který může být: 0 – bez atrofie, 1 – hraniční nález, 2 – významná atrofie jednoho laloku nebo 3 – významná atrofie obou laloků. Podrobněji je celá metodika vysvětlena a použita k hodnocení normálního stárnutí v našem předchozím sdělení [18]. Návod k hodnocení PAS jako praktické pomůcky do klinické praxe je uveden v příloze 1 v závěru tohoto sdělení.
Fig. 1. Illustration of the evaluated areas of the parietal lobes, which are scored on multiple T1-weighted coronary MRI images ranging across the entire lobes.
Vizuální škálu PAS jsme použili k hodnocení MR mozků ve skupinách 26 starších osob s normálními kognitivními funkcemi a 24 pacientů s mírnou demencí způsobenou AN s pozdním začátkem podle kritérií National Institute on Aging and Alzheimer’s Association [19]. Tyto dvě skupiny byly vybrány z rozsáhlejší databáze tak, aby se nelišily věkem, vzděláním a pohlavím (tab. 1). MR obrazy posuzoval neurolog (DS) s tříletou zkušeností v oblasti hodnocení mozkové atrofie na MR, který je zároveň hlavním tvůrcem PAS. Při prvním použití této metody na skupině 74 kognitivně zdravých jedinců ve věkovém rozmezí 48 – 87 let bylo zjištěno, že PAS minimálně souvisí s věkem na samé hranici statistické významnosti [18]. Po pěti letech byl u všech kognitivně zdravých osob jejich normální kognitivní statut ověřen dvěma bateriemi – pěti experimentálními krátkými metodami vč. již publikovaných testů POBAV, TEGEST a Testu kreslení hodin se skórováním BaJa [20 – 22] a dále komplexní neuropsychologickou baterií (testy RAVLT, ROCFT, TMT, WAIS-III) [23].
Pro morfologické účely byly použity trojrozměrné MR obrazy T1W-MPRAGE (T1 vážený obraz Magnetization Prepared Rapid Acquisition Gradient Echo) v sagitální rovině na 3T přístroji Siemens Magnetom Trio (Siemens, Erlangen, Německo) s následujícími parametry: velikost voxelu: 0,85 × 0,85 × 0,85 mm3; počet vrstev: 224; repetiční čas (TR)/echo čas (TE): 2 000/ 4,73 ms; inverzní čas (TI): 800 ms; sklápěcí úhel 10° a čas měření (TA): 10 min. Vlastní hodnocení bylo prováděno na MPR rekonstrukcích v koronální rovině s tloušťkou řezu 0,85 mm.
Účastníci podepsali informovaný souhlas s výzkumem, který byl schválen etickými komisemi FN Královské Vinohrady a Psychiatrického centra Praha.
K porovnání proměnných obou skupin byl použit neparametrický Mann-Whitneyho U test v programu Statistica (StatSoft, Inc., Tulsa, OK, USA). Hladina významnosti byla stanovena na p < 0,05.
Výsledky
Tabulka 1 ukazuje demografické údaje a skóry MMSE obou skupin.
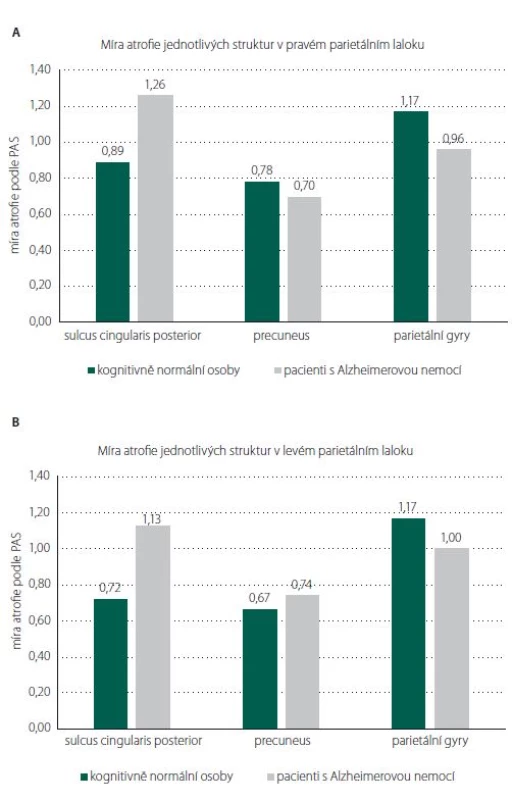
Celkový skór PASglob ani výsledné skóry PAS pravého a levého parietálního laloku se statisticky významně nelišily mezi kognitivně normálními osobami a pacienty s mírnou demencí způsobenou AN s pozdním začátkem. Jak ukazují obr. 2A a B, rozdíl mezi skupinami nebyl prokázán ani v atrofiích jednotlivých struktur obou laloků: sulcus cingularis posterior, precuneus, parietální gyry (ve všech případech p > 0,05). V oblasti sulcus cingularis posterior v levém parietálním laloku byl rozdíl největší, ale opět bez statistické významnosti. Řada kognitivně normálních jedinců měla významnou atrofii bilaterálně (PASglob = 3). Naopak někteří pacienti s AN neměli atrofii parietálního laloku vůbec (PASglob = 0).
Fig. 2. Comparison of atrophy in individual regions (A) of the right and (B) the left parietal
lobe between cognitively normal people and patients with mild dementia due to
late-onset Alzheimer‘s disease. We did not fi nd any difference in atrophy between the two
groups in any of the structures evaluated by the PAS (Parietal Atrophy Score) visual scale.
Diskuze
Podle našich výsledků není atrofie parietálního laloku známkou časných stadií AN s pozdním začátkem. Tento závěr je ve shodě s výsledky několika studií zabývajících se podobnou tématikou, které využily kvantitativní vyhodnocení pomocí voxel-based morfometrie [16,17]. Přidanou hodnotou naší práce je vizuální semikvantitativní přístup v posuzování jednotlivých struktur parietálního laloku, který má větší potenciál se uplatnit v běžné klinické praxi.
Žádná parietální struktura nevykazovala významný rozdíl mezi skupinami. Jediným nadějným kandidátem by podle našich výsledků mohl být sulcus cingularis posterior, kde byl především v levém laloku detekován poměrně zjevný rozdíl v atrofiích (obr. 2A). Otázka je, zda by se zde signifikantní výsledek prokázal při větším počtu jedinců ve skupinách. Na druhou stranu byli jedinci velmi přísně vybíráni do skupin podle podobných sociodemografických charakteristik, abychom možný vliv těchto faktorů odstranili.
Ke shodným výsledkům dospěla i studie využívající podobnou vizuální klasifikaci parietálního laloku tzv. Posterior Atrophy Scale (Koedam scale), která je založena na hodnocení čtyř různých struktur ve třech rovinách MR mozku [24]. Naše jednodušší škála PAS spočívá v posuzování tří struktur pouze v jedné koronární rovině, ve které zároveň probíhá i hodnocení prostřednictvím nejužívanější škály mediotemporální atrofie dle Scheltense [3], což může v klinické praxi znatelně ušetřit čas při využití obou přístupů zároveň.
Zajímavé bude použít metodiku PAS k hodnocení MR mozků u pacientů s AN s časným začátkem a porovnat strukturu jejich parietální oblasti s kognitivně normálními osobami. Některé studie totiž poukazují na častější výskyt parietální atrofie u této formy AN [11,14 – 17].
Důležitou vlastností kvalitních vizuálních škál je jejich vysoká spolehlivost (reliabilita), která vyjadřuje míru shody mezi hodnoceními různých hodnotitelů. Na téma parietální atrofie u AN s časným začátkem a spolehlivosti škály PAS již připravujeme naše další sdělení.

Hlavní výhodou vizuální škály PAS je její jednoduchost a rychlost provedení bez potřeby užití specializovaného softwaru. K jejímu použití postačí prostý zrak, základní povědomí o struktuře mozku na MR a znalost jednoduchých pravidel skórování. Tyto vlastnosti by mohly z hodnocení PAS vytvářet vhodnou pomůcku pro klinickou praxi.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Práce byla podpořena projekty NV18-07-00272, 260388/ SVV/ 2018, PROGRES Q35, „Udržitelnost pro Národní ústav duševního zdraví“, č. LO1611, za finanční podpory MŠMT v rámci Národního programu udržitelnosti I (NPU I) a MZ ČR – RVO „Národní ústav duševního zdraví – NUDZ, IČ: 00023752“.
Poděkování náleží kolektivu pracovníků z AD Centra FN Královské Vinohrady za pomoc při sběru dat.
doc. MUDr. Aleš Bartoš, Ph.D.
Neurologická klinika 3. LF UK
a FN Královské Vinohrady
Šrobárova 1150/50
100 34 Praha
e-mail: ales.bartos@nudz.cz
Přijato k recenzi: 1. 6. 2018
Přijato do tisku: 19. 12. 2018
Sources
1. Bartoš A, Kukal J. Magnetická rezonance mozku u pacientů s Alzheimerovou chorobou. Psychiatrie 2005; 9 (Suppl 3): 39 – 42.
2. Harper L, Barkhof F, Scheltens P et al. An algorithmic approach to structural imaging in dementia. J Neurol Neurosurg Psychiatry 2014; 85(6): 692 – 698. doi: 10.1136/ jnnp-2013-306285.
3. Scheltens P, Leys D, Barkhof F et al. Atrophy of medial temporal lobes on MRI in probable Alzheimers disease and normal aging: diagnostic-value and neuropsychological correlates. J Neurol Neurosurg Psychiatry 1992; 55(10): 967 – 972.
4. Ten Kate M, Barkhof F, Boccardi M et al. Task Force for the Roadmap of Alzheimer’s Biomarkers. Clinical validity of medial temporal atrophy as a biomarker for Alzheimer’s disease in the context of a structured 5-phase development framework. Neurobiol Aging 2017; 52 : 167 – 182. doi: 10.1016/ j.neurobiolaging.2016.05.024.
5. Bartoš A, Zach P, Diblíková F et al. Vizuální kategorizace mediotemporální atrofie na MR mozku u Alzheimerovy nemoci. Psychiatrie 2007; 11 (Suppl 3): 49 – 52.
6. Liu Y, Paajanen T, Zhang Y et al. Analysis of regional MRI volumes and thicknesses as predictors of conversion from mild cognitive impairment to Alzheimer‘s disease. Neurobiol Aging 2010, 31(8): 1375 – 1385. doi: 10.1016/ j.neurobiolaging.2010.01.022.
7. Fennema-Notestine C, McEvoy LK, Hagler DJ et al. Structural neuroimaging in the detection and prognosis of pre-clinical and early AD. Behav Neurol 2009; 21(1): 3 – 12. doi: 10.3233/ BEN-2009-0230.
8. Jack CR, Shiung MM, Gunter JL et al. Comparison of different MRI brain atrophy rate measures with clinical disease progression in AD. Neurology 2004; 62(4): 591 – 600.
9. Vemuri P, Jack CR. Role of structural MRI in Alzheimer’s disease. Alzheimers Res Ther 2010; 2(4): 23. doi: 10.1186/ alzrt47.
10. Pol LA, Hensel A, Flier WM et al. Hippocampal atrophy on MRI in frontotemporal lobar degeneration and Alzheimer‘s disease. J Neurol Neurosurg Psychiatry 2006; 77(4): 439 – 442. doi: 10.1136/ jnnp.2005.075341.
11. Harper L, Fumagalli GG, Barkhof F et al. MRI visual rating scales in the diagnosis of dementia: evaluation in 184 post-mortem confirmed cases. Brain 2016; 139(Pt 4): 1211 – 1225. doi: 10.1093/ brain/ aww005.
12. Hu WT, Wang Z, Lee VM et al. Distinct cerebral perfusion patterns in FTLD and AD. Neurology 2010, 75(10): 881 – 888. doi: 10.1212/ WNL.0b013e3181f11e35.
13. Landau SM, Harvey D, Madison CM et al. Associations between cognitive, functional, and FDG-PET measures of decline in AD and MCI. Neurobiol Aging 2011; 32(7): 1207 – 1218. doi: 10.1016/ j.neurobiolaging.2009.07.002.
14. Lehmann M, Koedam EL, Barnes J et al. Posterior cerebral atrophy in the absence of medial temporal lobe atrophy in pathologically-confirmed Alzheimer’s disease. Neurobiol Aging 2012; 33(3): 627.e1 – 627.e12. doi: 10.1016/ j.neurobiolaging.2011.04.003.
15. Frisoni GB, Pievani M, Testa C et al. The topography of grey matter involvement in early and late onset Alzheimer‘s disease. Brain 2007; 130(Pt 3): 720 – 730. doi: 10.1093/ brain/ awl377.
16. Ishii K, Kawachi T, Sasaki H et al. Voxel-based morphometric comparison between early - and late-onset mild Alzheimer‘s disease and assessment of diagnostic performance of Z score images. Am J Neuroradiol 2005; 26(2): 333 – 340.
17. Shiino A, Watanabe T, Kitagawa T et al. Different atrophic patterns in early - and late-onset Alzheimer‘s disease and evaluation of clinical utility of a method of regional z-score analysis using voxel-based morphometry. Dement Geriatr Cogn Disord 2008; 26(2): 175 – 186. doi: 10.1159/ 000151241.
18. Šilhán D, Ibrahim I, Tintěra J et al. Parietální atrofický skór na magnetické rezonanci mozku u normálně stárnoucích osob. Cesk Slov Neurol N 2018; 81/ 114(4): 414 – 419. doi: 10.14735/ amcsnn2018414.
19. McKhann GM, Knopman DS, Chertkow H et al. The diagnosis of dementia due to Alzheimer‘s disease: recommendations from the National Institute on Aging-Alzheimer‘s Association workgroups on diagnostic guidelines for Alzheimer‘s disease. Alzheimers Dement 2011; 7(3): 263 – 269. doi: 10.1016/ j.jalz.2011.03.005.
20. Bartoš A. Netestuj, ale POBAV: písemné záměrné Pojmenování OBrázků A jejich Vybavení jako krátká kognitivní zkouška. Cesk Slov Neurol N 2016; 79/ 112(6), 671 – 679.
21. Bartoš A. Test gest (TEGEST) k rychlému vyšetření epizodické paměti u mírné kognitivní poruchy. Cesk Slov Neurol N 2018; 81/ 114(1): 37 – 44. doi: 10.14735/ amcsnn201837.
22. Bartoš A, Janoušek M, Petroušová R et al. Tři časy Testu kreslení hodin hodnocené BaJa skórováním u časné Alzheimerovy nemoci. Cesk Slov Neurol N 2016; 79/ 112(4): 406 – 412.
23. Bartoš A, Raisová M. Testy a dotazníky pro vyšetřování kognitivních funkcí, nálady a soběstačnosti. Praha: Mladá fronta 2015.
24. Koedam EL, Lehman M, Van der Flier WM et al. Visual assessment of posterior atrophy development of a MRI rating scale. Eur Radiol 2011; 21(12): 2618 – 2625. doi: 10.1007/ s00330-011-2205-4.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2019 Issue 1
- Memantine Eases Daily Life for Patients and Caregivers
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Advances in the Treatment of Myasthenia Gravis on the Horizon
-
All articles in this issue
- Ketogenní dieta – účinná nefarmakologická léčba dětské a adolescentní epilepsie
- Vieme dobre diagnostikovať dyskinetickú formu DMO? ÁNO
- Sub signum coma – súčasný pohľad na chronické poruchy vedomia
- Chronický subdurální hematom
- Iatrogenizácia pacientov so psychogénnymi neepileptickými záchvatmi – možné východiská
- Genetika neurodegenerativních demencí v deseti bodech – co může neurolog očekávat od molekulárního genetika?
- Lehká mozková poranění – konsenzuální odborné stanovisko České neurologické společnosti ČLS JEP
- Evokované potenciály vyvolané kontaktním teplem – vliv fyziologických proměnných
- Laboratorní účinnost kyseliny acetylsalicylové v sekundární prevenci ischemických cévních mozkových příhod
- Parietální atrofie na magnetické rezonanci mozku u Alzheimerovy nemoci s pozdním začátkem
- Transkraniální magnetická stimulace u hraniční poruchy osobnosti – série kazuistik
- Změny v expresi TNFα a microRNA-15b u experimentálního modelu subarachnoidálního krvácení
- Raschova analýza dotazníku Q-LES-Q-SF na podkladě odpovědí pacientů s neuropatickou bolestí
- Oligoklonální IgG a volné lehké řetězce – srovnání izoelektrické fokusace v agarózovém a polyakrylamidovém gelu
- Nové možnosti ultrazvuku v predikci výskytu bolesti dolní části zad u dospívajících mužů – pilotní studie
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Lehká mozková poranění – konsenzuální odborné stanovisko České neurologické společnosti ČLS JEP
- Chronický subdurální hematom
- Oligoklonální IgG a volné lehké řetězce – srovnání izoelektrické fokusace v agarózovém a polyakrylamidovém gelu
- Ketogenní dieta – účinná nefarmakologická léčba dětské a adolescentní epilepsie
