Oligoklonální IgG a volné lehké řetězce – srovnání izoelektrické fokusace v agarózovém a polyakrylamidovém gelu
Authors:
D. Zeman 1,2; P. Kušnierová 1; P. Hradílek 2; M. Čábal 2; O. Zapletalová 2
Authors‘ workplace:
Ústav laboratorní diagnostiky, FN Ostrava
1; Neurologická klinika FN Ostrava
2
Published in:
Cesk Slov Neurol N 2019; 82(1): 68-75
Category:
Original Paper
doi:
https://doi.org/10.14735/amcsnn201968
Overview
Cíl:
Porovnání izoelektrické fokusace v agarosovém a polyakrylamidovém gelu pro detekci oligoklonálních pásů imunoglobulinu G (o-IgG) a oligoklonálních volných lehkých řetězců (oligoclonal free light chains; o-fLC).
Soubor a metody:
Detekce oligoklonálních pásů byla provedena v sérii 106 (o-IgG), resp. 48 (o-fLC) konsekutivních párových vzorků likvorů a sér. Pro srovnání obou metod a shody mezi hodnotícími byla použita statistika kappa.
Výsledky:
Při rozdělení nálezů na negativní a pozitivní byly rozdílně hodnoceny jen tři vzorky (2,8 %) pro o-IgG, tři vzorky (6,2 %) pro o-fLC kappa a jediný vzorek (2,1 %) pro o-fLC lambda. V těchto diskrepantních případech byl pozorován rozdíl nejvýše tří pásů. Shoda mezi hodnotícími pro o-fLC byla velmi dobrá (κ = 0,906–1,000).
Závěry:
Přestože polyakrylamidový gel může být teoreticky výhodnější vzhledem k menší velikosti pórů a lepšímu rozlišení, naše výsledky byly jak pro o-IgG, tak pro o-fLC velmi podobné jako při separaci v agarózovém gelu. Obě metody hodnotíme jako dobře použitelné a rozdíly mezi nimi byly omezeny na hraničně pozitivní případy.
Klíčová slova:
mozkomíšní mok – volné lehké řetězce – imunoglobulin G – izoelektrická fokusace –agaróza – polyakrylamid
Úvod
Detekce oligoklonálních pásů imunoglobulinu G (o-IgG) je hlavním testem používaným k průkazu intratékální protilátkové odpovědi u chronických zánětlivých onemocnění CNS, zejména u RS [1]. Přestože v recentních pracích bylo doporučeno nahradit detekci o-IgG snadnější kvantifikací volných lehkých řetězců (free light chains; fLC) typu kappa (free kappa light chains; fKLC) [2,3], nabyla detekce o-IgG formálního významu pro diagnózu RS v recentní revizi McDonaldových diagnostických kritérií [4]. Bude tedy pravděpodobně nadále prováděna vždy, kdy je pro podporu diagnózy RS požadováno vyšetření likvoru.
Kromě zvýšení koncentrace fKLC v likvoru mohou být senzitivním markerem intratékálního zánětu také oligoklonální fKLC (o-fKLC). Tento test se ukázal jako nepatrně senzitivnější než o-IgG [5–7]. V současnosti však není dostupné žádné srovnání metod pro detekci oligoklonálních fLC (o-fLC). Tento test je používán vzácně vzhledem ke své větší pracnosti, zejména ve srovnání s novými automatizovanými kvantitativními metodami. U RS byla popsána také intratékální syntéza fLC typu lambda (free lambda light chains;fLLC) a přestože je nacházena vzácněji než intratékální syntéza IgG a fKLC [5,7,8], recentní studie ukazují, že současná analýza fKLC a fLLC může mít prognostický význam [9–11].
Detekce o-fLC získala mezi klinickými lékaři zasílajícími vzorky do naší laboratoře značnou popularitu, kterou neztrácí ani po zavedení kvantitativní analýzy fLC. Po obdržení informace o ukončení výroby elektroforetického přístroje Multiphor II (GE Healthcare Life Sciences, Buckinghamshire, Velká Británie) jsme proto hledali adekvátní náhradu a zvolili jsme přístroj EDC Flatbed Professional (Electrophoresis Development and Consulting, Tübingen, Německo). Následně jsme se rozhodli vyzkoušet použití výrobcem dodávaných polyakrylamidových gelů (PAG) pro separaci o-IgG a o-fLC. Zaměřili jsme se také na vyhodnocení shody výsledků o-fLC mezi dvěma hodnotícími.
Soubor a metodika
Vzorky
V konsekutivních párových vzorcích likvorů a sér byly detekovány o-IgG (n = 106) a o-fLC (n = 48) podle požadavků klinického lékaře. U pacientů zaslaných k vyšetření z jiných nemocnic nebyla k dispozici žádná klinická data. Pacienti sledovaní na našem pracovišti s dostupnými klinickými daty (n = 42) byli diagnostikováni jako RS (n = 12, šest z nich po klinicky izolovaném syndromu [CIS] podle poslední revize McDonaldových diagnostických kritérií), CIS (n = 3, nesplňující diagnostická kritéria RS), jiná zánětlivá onemocnění CNS (po jednom případu herpetické encefalitidy, meningoencefalitidy způsobené virem varicella zoster a neuromyelitis optica), zánětlivá onemocnění periferního nervového systému (po jednom případu akutní zánětlivé demyelinizační polyneuropatie, multifokální motorické neuropatie a paraproteinemické neuropatie), nezánětlivá onemocnění nervového systému (demence, n = 4; vertigo, n = 2; migréna, n = 2; kryptogenní polyneuropatie, n = 2; a po jednom případu psychózy, CMP, Parkinsonovy nemoci, stenózy páteřního kanálu, cervikální myelopatie a steroidní myopatie) nebo jako symptomatické kontroly (n = 5).
Detekce oligoklonálních pásů IgG a volných lehkých řetězců
Pro detekci o-IgG po separaci izoelektrickou fokusací (IEF) v agarózovém gelu s následnou imunofixací (IF) byl použit komerční kit Hydragel 9 CSF Isofocusing Kit (Sebia, Evry Cedex, Francie) na přístroji Hydrasys (Sebia, Evry Cedex, Francie) podle instrukcí výrobce. IEF v PAG byla provedena v komerčně dostupných gelech pH 6-11 40S (EDC, Tübingen, Německo) na přístroji EDC Flatbed Professional (EDC, Tübingen, Německo) (krok 1 : 500 V, 25 mA, 10 W, 20 min; krok 2 : 1350 V, 25 mA, 22 W, 90 min; krok 3 : 1750 V, 20 mA, 26 W, 20 min). Vzorky likvorů a sér byly naředěny na 10 mg/ l IgG 0,1% NaCl a do jamek v gelu bylo aplikováno po 10 μl. K imunodetekci byla použita senzitivní metoda alkalickou fosfatázou značené anti-IgG protilátky, jež byla popsána v práci Sádabou et al [12]. Po kapilárním blottingu (50 min) byla membrána 45 min blokována 3% hovězím sérovým albuminem (Serva Electrophoresis, Heidelberg, Německo) a poté inkubována s alkalickou fosfatázou značenou kozí protilátkou proti Fc části lidského IgG (Bio-Rad, Praha, Česká republika) po dobu 75 min. K barevné reakci byl použit substrát BCIP/ NBT (Vector Laboratories, Burlingame, USA).
Izoelektrická fokusace v agarózovém gelu pro průkaz o-fLC byla provedena na přístroji Multiphor II (GE Healthcare Life Sciences, Helsinky, Finsko) dříve popsaným postupem [7,8]. IEF v PAG byla provedena v gelech pH 3-10 na přístroji Flatbed Professional za podmínek doporučených výrobcem (krok 1 : 500 V, 12 mA, 10 W, 30 min; krok 2 : 1 700 V, 12 mA, 18 W, 90 min; krok 3 : 2 000 V, 8 mA, 20 W, 30 min). Pro oba typy separace byly vzorky sér ředěny 1/ 80 0,7% NaCl a na gel bylo aplikováno 7 μl likvorů a ředěných sér. Následná blotovací a imunodetekční procedura byla identická jako v případě IEF v agarózovém gelu.
Hodnocení o-IgG bylo provedeno jedním z autorů, zatímco o-fLC byly hodnoceny nezávisle dvěma autory za účelem posouzení shody. IgG pásy v likvoru bez protějšku v séru nebo jasně výraznější v likvoru než v séru byly považovány za intratékálně syntezované; pásy výrazně slabší v séru oproti likvoru nebyly brány v potaz při klasifikaci nálezů do typů 1–5. Pásy fLC byly považovány za intratékálně syntezované pouze v případě, že neměly žádný sérový protějšek, neboť v tomto testu nejsou v párových vzorcích likvorů a sér aplikována stejná množství fLC. Byly hodnoceny počty a procenta diskrepantně klasifikovaných nálezů; pro posouzení shody mezi metodami a mezi hodnotícími byly použity chí-kvadrát test a statistika kappa. Pro porovnání počtu intratékálně syntezovaných pásů byly použity Spearmanův korelační koeficient, vážená kappa a Wilcoxonův test. Ke statistickým analýzám byl využit statistický program MedCalc, verze 18.5 (MedCalc Software bvba, Ostend, Belgie).
Stanovení albuminu, IgG a volných lehkých řetězců
Albumin a IgG v likvoru a séru byly měřeny na nefelometru BN ProSpec (Siemens Healthcare, Praha, Česká republika). fLC byly kvantifikovány turbidimetricky na analyzátoru SPAPLUS kity certifikovanými pro měření v likvoru a séru (LK016.L.S and LK018.L.S) (The Binding Site, Birmingham, Velká Británie).
Souhlas etické komise
Všichni pacienti sledovaní v naší nemocnici podepsali informovaný souhlas. Studie byla schválena etickou komisí nemocnice jako součást projektu Likvorové biomarkery roztroušené sklerózy (č. j. 400/ 2017).
Výsledky
Oligoklonální IgG
Srovnání bylo provedeno ve 106 konsekutivních vzorcích. Výsledky jsou uvedeny v tab. 1 a reprezentativní příklad na obr. 1. Celkem tři vzorky (2,8 %) byly klasifikovány neshodně. Počty intratékálně syntezovaných IgG pásů v těchto případech uvádí tab. 2.

† alespoň dva intratékálně syntezované o-IgG pásy
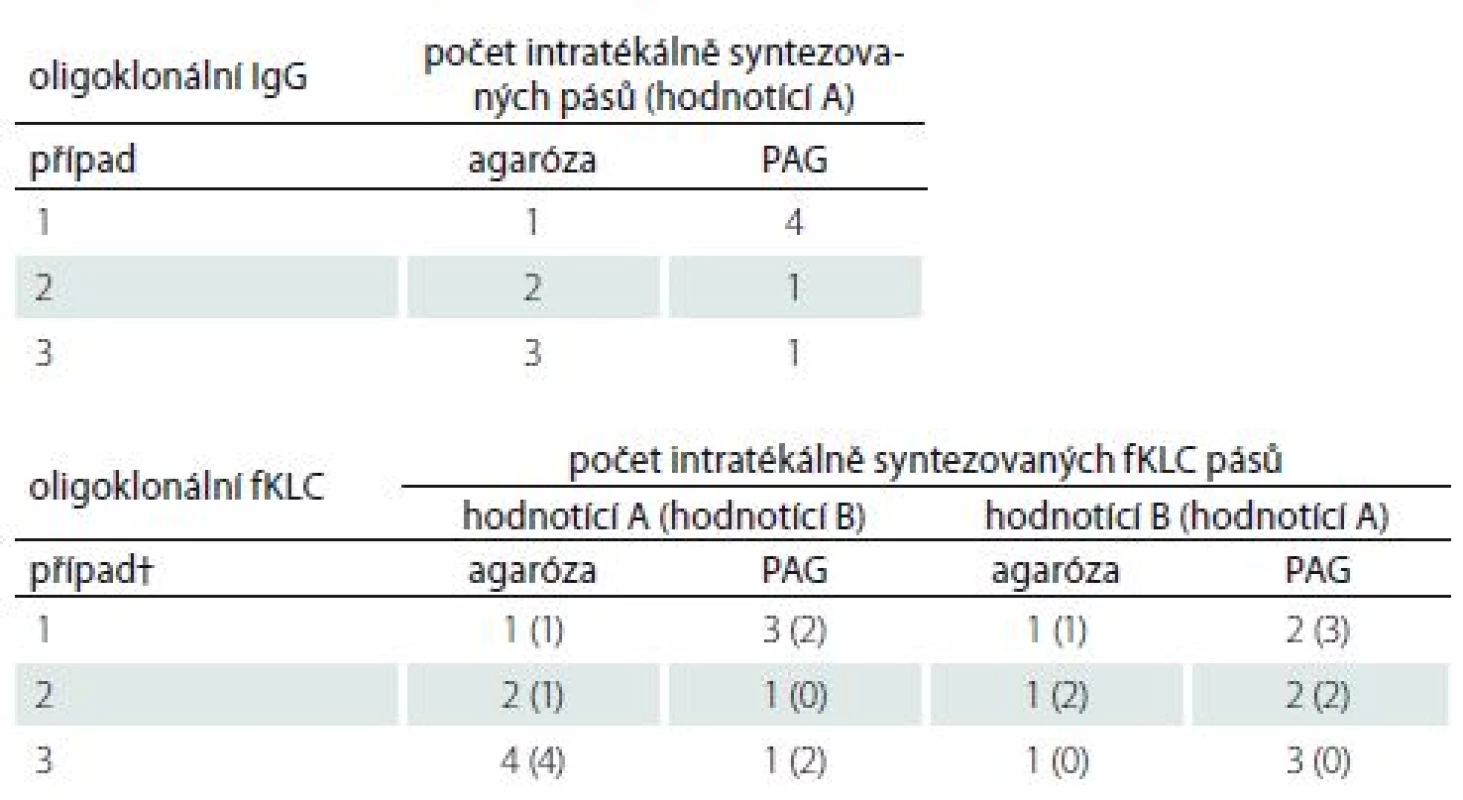
Jediný intratékálně syntezovaný IgG pás byl nalezen v 7/ 106 (6,6 %) vzorcích při použití IEF v agaróze s následnou imunofixací. Na PAG IEF/ imunoblotting (IEF/IB) nebyl ve čtyřech z těchto případů nalezen žádný pás, ve dvou případech byl identifikován rovněž jeden pás a v jednom případě byly zjištěny čtyři pásy.
Na PAG IEF/ IB byl jediný intratékálně syntezovaný IgG pás nalezen v 10 případech (9,4 %). Na IEF/ IF nebyl v šesti z těchto případů nalezen žádný pás, ve dvou případech byl nalezen rovněž jediný pás a v dalších dvou případech byly nalezeny dva, resp. tři pásy. Příklad takového hraničního výsledku je uveden na obr. 2.
Porovnali jsme také výsledky podrobnější klasifikace nálezu do typů 1–5 podle dvou konsenzuálních doporučení [13,14]. Shody bylo dosaženo u 75 vzorků (70,8 %). Hodnota κ činila 0,503, což znamená jen průměrnou shodu. Typ 1 při použití jedné z obou metod byl hodnocen jako typ 4 při použití alternativní metody v 19 případech; analogické neshodné hodnocení typů 2 a 3 přispělo dalšími osmi neshodně klasifikovanými výsledky. . Detailní výsledky jsou uvedeny v tab. 3.
Počet intratékálně syntezovaných IgG pásů byl porovnán pomocí Spearmanova korelačního koeficientu (ρ = 0,861; 95% interval spolehlivosti [confidence interval; CI] 0,802–0,903; p < 0,0001) a vážené κ (0,795; 95% CI 0,7432–0,8473). Výsledky indikují dobrou shodu mezi metodami. Wilcoxonovým testem nebyl zjištěn žádný systematický rozdíl mezi metodami v počtu intratékálně syntezovaných IgG pásů (16 kladných a 17 záporných diferencí; p = 0,8442).
Oligoklonální fLC
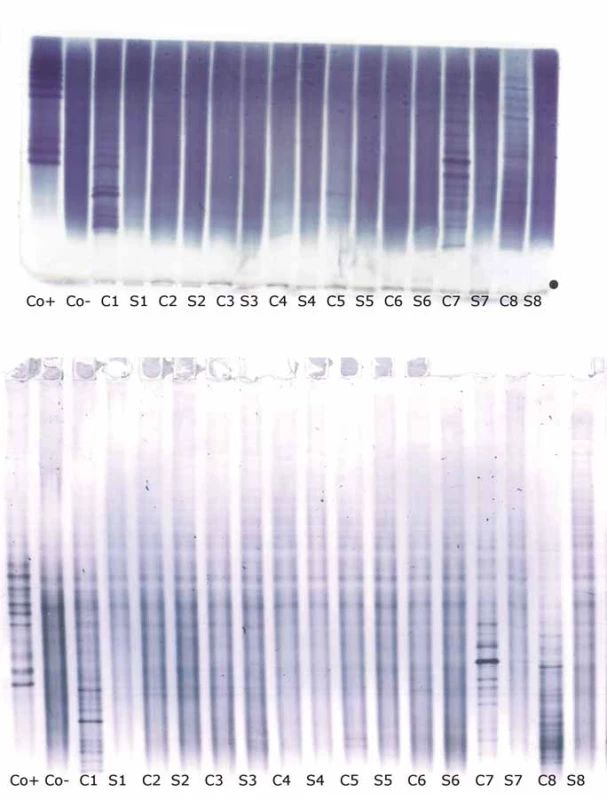
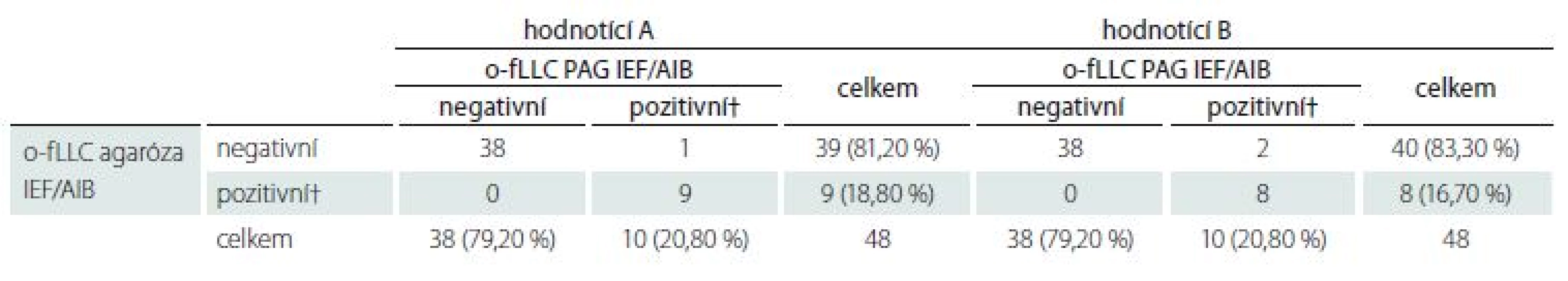
Detekce o-fLC byla provedena ve 48 vzorcích.Výsledky uvádí tab. 4 a 5 a reprezentativní příklad je na obr. 3. Bylo dosaženo výborné shody jak mezi metodami, tak mezi hodnotícími (κ = 0,9064 a 0,9091 pro o-fKLC v agaróze a PAG; 0,9286 a 1,000 pro o-fLLC v agaróze a PAG).
A) Shodné výsledky v agaróze a PAG IEF/AIB. V C1, C2 a C3 jsou jasně pozitivní oligoklonální fKLC, ale jen v C2 jsou jasně pozitivní oligoklonální fLLC. Ve vzorku C1 byly nalezeny dva slabé fLLC pásy při PAG IEF/AIB, zatímco hodnocení při agarózové IEF/IF bylo neshodné (dva pásy – hodnotící A, jeden pás – hodnotící B). Vzorek C4 je negativní.
AIB – afinitní imunoblotting; C1–4 – párové vzorky nativních likvorů; C1d – likvor 1 ředěný 1/10 (jen pro fKLC); Co+ – pozitivní kontrola (monoklonální volné lehké řetězce [Bio-Rad – AbD Serotec, Praha, ČR] ředěné na 0,25 a 0,10 mg/l pro fKLC a 1,0; 0,5; 0,25 a 0,10 mg/l pro fLLC); Co– – negativní kontrola (preparát intravenózního imunoglobulinu G ředěný na koncentraci 250 mg/l IgG); fKLC – volné lehké řetězce typu
kap pa; fLLC – volné lehké řetězce typu lambda; IEF – izoelektrická fokusace; IF – imunofi xace; PAG – polyakrylamidový gel; S1–4 – párové vzorky nativních sér ředěných 1/80 (kromě S1 vedle nativního C1, který byl pro analýzu fKLC ředěn 1/20) B) Příklad diskrepantního výsledku oligoklonální fLLC mezi agarózou a PAG IEF/AIB. V C1 jsou četné fKLC pásy, zatímco slabé fLLC pásyjsou tu patrné pouze na PAG IEF/AIB (dva pásy – hodnotící A, tři pásy – hodnotící B). Co+ je zde naředěna na 0,25 a 0,10 mg/l pro fKLC a 1,0 a 0,25 mg/l pro fLLC. AIB – afinitní imunoblotting; fKLC – volné lehké řetězce typu kappa; fLLC – volné lehké řetězce typu lambda; IEF – izoelektrická fokusace; PAG – polyakrylamidový gel
![Oligoklonální volné lehké řetězce.<br>
A) Shodné výsledky v agaróze a PAG IEF/AIB. V C1, C2 a C3 jsou jasně pozitivní oligoklonální fKLC, ale jen v C2 jsou jasně pozitivní oligoklonální fLLC. Ve vzorku C1 byly nalezeny dva slabé fLLC pásy při PAG IEF/AIB, zatímco hodnocení při agarózové IEF/IF bylo neshodné (dva pásy – hodnotící A, jeden pás – hodnotící B). Vzorek C4 je negativní.
AIB – afinitní imunoblotting; C1–4 – párové vzorky nativních likvorů; C1d – likvor 1 ředěný 1/10 (jen pro fKLC); Co+ – pozitivní kontrola (monoklonální volné lehké řetězce [Bio-Rad – AbD Serotec, Praha, ČR] ředěné na 0,25 a 0,10 mg/l pro fKLC a 1,0; 0,5; 0,25 a 0,10 mg/l pro fLLC); Co– – negativní kontrola (preparát intravenózního imunoglobulinu G ředěný na koncentraci 250 mg/l IgG); fKLC – volné lehké řetězce typu
kap pa; fLLC – volné lehké řetězce typu lambda; IEF – izoelektrická fokusace; IF – imunofi xace; PAG – polyakrylamidový gel; S1–4 – párové vzorky nativních sér ředěných 1/80 (kromě S1 vedle nativního C1, který byl pro analýzu fKLC ředěn 1/20) B) Příklad diskrepantního výsledku oligoklonální fLLC mezi agarózou a PAG IEF/AIB. V C1 jsou četné fKLC pásy, zatímco slabé fLLC pásyjsou tu patrné pouze na PAG IEF/AIB (dva pásy – hodnotící A, tři pásy – hodnotící B). Co+ je zde naředěna na 0,25 a 0,10 mg/l pro fKLC a 1,0 a 0,25 mg/l pro fLLC. AIB – afinitní imunoblotting; fKLC – volné lehké řetězce typu kappa; fLLC – volné lehké řetězce typu lambda; IEF – izoelektrická fokusace; PAG – polyakrylamidový gel](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/d01da542129afb336d21d080480ca8cf.jpeg)

AIB – afi nitní imunoblotting; o-fKLC – oligoklonální volné lehké řetězce typu lambda; IEF – izoelektrická fokusace; PAG – polyakrylamidový gel
AIB – afinitní imunoblotting; o-fLLC – oligoklonální volné lehké řetězce typu lambda; IEF – izoelektrická fokusace; PAG – polyakrylamidový gel
![Oligoklonální volné lehké řetězce.
A) Shodné výsledky v agaróze a PAG IEF/AIB. V C1, C2 a C3 jsou jasně pozitivní oligoklonální fKLC, ale jen v C2 jsou jasně pozitivní oligoklonální fLLC. Ve vzorku C1 byly nalezeny dva slabé fLLC pásy při PAG IEF/AIB, zatímco hodnocení při agarózové IEF/IF bylo neshodné (dva pásy – hodnotící A, jeden pás – hodnotící B). Vzorek C4 je negativní.
AIB – afinitní imunoblotting; C1–4 – párové vzorky nativních likvorů; C1d – likvor 1 ředěný 1/10 (jen pro fKLC); Co+ – pozitivní kontrola (monoklonální volné lehké řetězce [Bio-Rad – AbD Serotec, Praha, ČR] ředěné na 0,25 a 0,10 mg/l pro fKLC a 1,0; 0,5; 0,25 a 0,10 mg/l pro fLLC);
Co– – negativní kontrola (preparát intravenózního imunoglobulinu G ředěný na koncentraci 250 mg/l IgG); fKLC – volné lehké řetězce typu kap pa; fLLC – volné lehké řetězce typu lambda; IEF – izoelektrická fokusace; IF – imunofi xace; PAG – polyakrylamidový gel; S1–4 – párové vzorky nativních sér ředěných 1/80 (kromě S1 vedle nativního C1, který byl pro analýzu fKLC ředěn 1/20) B) Příklad diskrepantního výsledku oligoklonální fLLC mezi agarózou a PAG IEF/AIB. V C1 jsou četné fKLC pásy, zatímco slabé fLLC pásy jsou tu patrné pouze na PAG IEF/AIB (dva pásy – hodnotící A, tři pásy – hodnotící B). Co+ je zde naředěna na 0,25 a 0,10 mg/l pro fKLC a 1,0 a 0,25 mg/l pro fLLC.
AIB – afinitní imunoblotting; fKLC – volné lehké řetězce typu kappa; fLLC – volné lehké řetězce typu lambda; IEF – izoelektrická fokusace; PAG – polyakrylamidový gel](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/41370eea486ab375ebda6d42819a028e.jpeg)
Neshodně klasifikovány byly tři vzorky (6,2 %) v případě o-fKLC a jeden vzorek (2,1 %; hodnotící A) resp. dva vzorky (4,2 %; hodnotící B) v případě fLLC. Počet nalezených intratékálně syntezovaných pásů fKLC v těchto diskrepantních případech je uveden v tab. 2. V případě fLLC jediný diskrepantně hodnocený nález nevykazoval žádné pásy fLLC v agarózovém gelu a dva pásy v PAG. Nález jediného intrathekálně syntezovaného pásu fLC byl zaznamenán (v závislosti na hodnotícím a separační metodě) v jednom až čtyřech případech (2,1–8,3 %).
Počet intratékálně syntezovaných pásů byl porovnán pomocí Spearmanova korelačního koeficientu (ρ 0,847–0,978; p <0,0001 pro všechna srovnání) a vážené κ (0,804–0,912). Zjištěné hodnoty indikují velmi dobrou shodu. Je pozoruhodné, že jsme pozorovali vyšší počet intratékálně syntezovaných fKLC pásů při použití PAG ve srovnání s agarózou (Wilcoxonův test, p = 0,0063 a p = 0,0023 pro hodnotícího A, resp. B) a tendenci k vyššímu počtu intratékálně syntezovaných fLLC pásů (Wilcoxonův test signifikantní pouze v případě hodnotícího B, p = 0,0137).
Srovnání s výpočty intratékální syntézy IgG a fLC
Neshodně klasifikovány byly tři vzorky (6,2 %) v případě o-fKLC a jeden vzorek (2,1 %; hodnotící A) resp. dva vzorky (4,2 %; hodnotící B) v případě fLLC. Počet nalezených intratékálně syntezovaných pásů fKLC v těchto diskrepantních případech je uveden v tab. 2. V případě fLLC jediný diskrepantně hodnocený nález nevykazoval žádné pásy fLLC v agarózovém gelu a dva pásy v PAG. Nález jediného intrathekálně syntezovaného pásu fLC byl zaznamenán (v závislosti na hodnotícím a separační metodě) v jednom až čtyřech případech (2,1–8,3 %).
Počet intratékálně syntezovaných pásů byl porovnán pomocí Spearmanova korelačního koeficientu (ρ 0,847–0,978; p <0,0001 pro všechna srovnání) a vážené κ (0,804–0,912). Zjištěné hodnoty indikují velmi dobrou shodu. Je pozoruhodné, že jsme pozorovali vyšší počet intratékálně syntezovaných fKLC pásů při použití PAG ve srovnání s agarózou (Wilcoxonův test, p = 0,0063 a p = 0,0023 pro hodnotícího A, resp. B) a tendenci k vyššímu počtu intratékálně syntezovaných fLLC pásů (Wilcoxonův test signifikantní pouze v případě hodnotícího B, p = 0,0137).
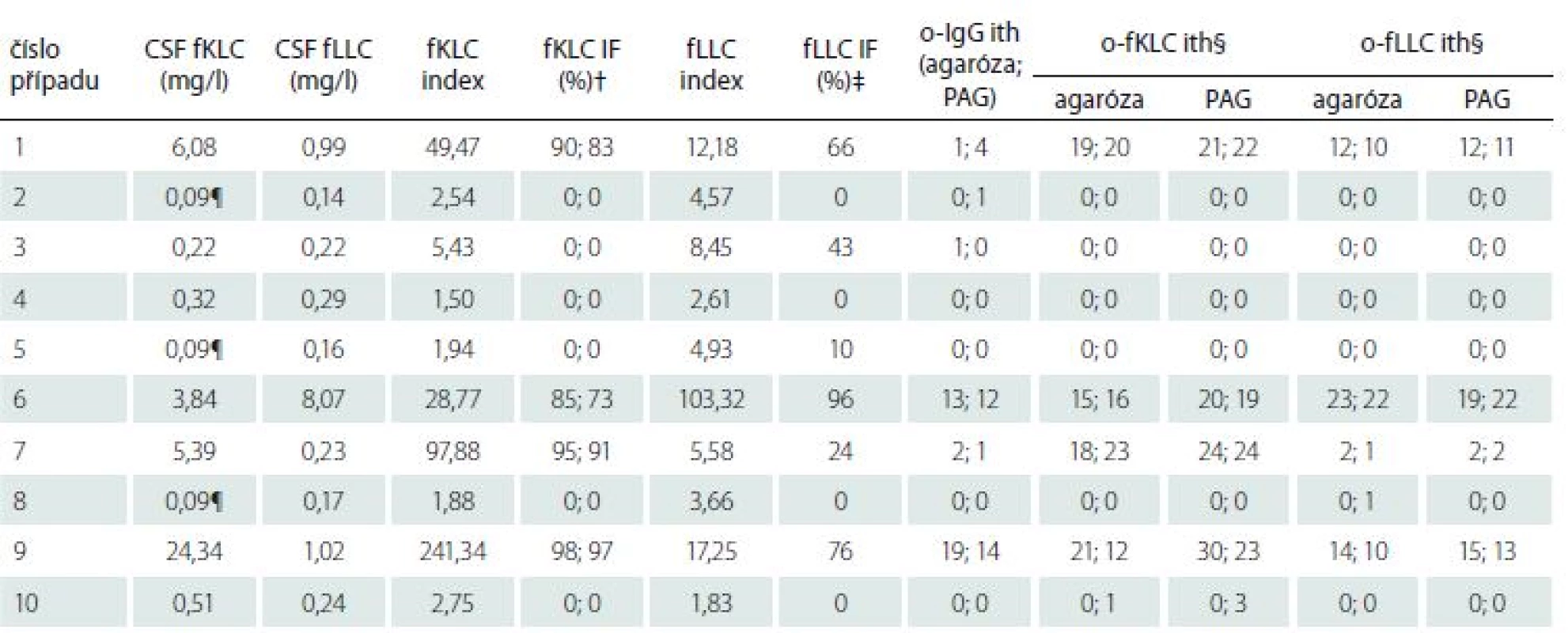
Přestože kvantifikace fLC byla požadována jen u 10 z těchto vzorků, domníváme se, že výsledky jsou dostatečně pozoruhodné, aby byly prezentovány (tab. 5). Při použití cut-off hodnot pro přítomnost intratékální syntézy fLC dříve určených v naší laboratoři (CSF fKLC 0,54 mg/ l; CSF fLLC 0,30 mg/ l; fKLC index 6,07; fLLC index 6,27) jsme nalezli 100% shodu mezi kvalitativními a kvantitativními výsledky pro fKLC, 90% pro CSF fLLC a 80% pro fLLC index. Jeden pacient s normální koncentrací CSF fLLC, ale zvýšeným fLLC indexem neměl žádné intratékálně syntezované fLLC pásy, zatímco jeden pacient s normální koncentrací CSF fLLC a normálním fLLC indexem měl dva intratékálně syntezované fLLC pásy v PAG a jeden (hodnotící B) resp. dva (hodnotící A) slabé pásy při separaci v agaróze. Stojí za zmínku, že oba nelineární výpočtové vztahy pro intratékální syntézu fKLC [18,19] byly 100% shodné s kvalitativním testem, zatímco recentně navržená cut-off hodnota 4,2 pro index fLLC nebo vztah pro výpočet intratékální syntézy fLLC [19] vedl ke třem, resp. dvěma falešně pozitivním výsledkům.
Korelace s klinickými daty
Přestože tato studie nebyla primárně zaměřena na korelaci výsledků o-IgG a o-fLC s klinickými daty, analyzovali jsme výsledky u pacientů s dostupnými klinickými diagnózami (n = 42 pro o-IgG; n = 22 pro o-fLC) jako další test plauzibility našich laboratorních nálezů. Všech 12 pacientů s diagnózou RS mělo pozitivní o-IgG při agarózové IEF/ IF; jeden z nich byl negativní na PAG IEF/ IB (jediný intratékálně syntezovaný IgG pás). Tento pacient vykazoval tři intratékálně syntezované o-IgG pásy při agarózové IEF/ IF, ale měl negativní o-fKLC i o-fLLC. Všichni tři pacienti s diagnózou CIS měli pozitivní o-IgG oběma metodami. U všech 27 pacientů s jinými diagnózami byl o-IgG test negativní. Z šesti pacientů s RS, u kterých byla provedena detekce o-fLC, byly o-fKLC pozitivní v pěti a negativní v jednom případě. Tři z těchto pacientů měli také pozitivní o-fLLC. Oba pacienti s CIS, u nichž byla provedena detekce o-fLC, měli pozitivní o-fKLC i o-fLLC (u jednoho byly o-fLLC patrné jen v PAG; jinak zde bylo dosaženo úplné shody mezi metodami i hodnotícími). Ze 14 pacientů s jinými diagnózami mělo 3–5 pozitivní o-fKLC (max. 5 pásů v PAG a 7 pásů v agaróze u pacienta s multifokální motorickou neuropatií; při použití PAG resp. agarózy byli jeden, resp. dva pacienti klasifikováni rozdílně oběma hodnotícími), ale jen jediný pacient (s diagnózou kryptogenní polyneuropatie) měl pozitivní o-fLLC. Je zajímavé, že při použití vyšší cut-off hodnoty ≥ 6 intratékálně syntezovaných pásů o-fKLC, která byla v literatuře navržena [7], by při separaci v agaróze byl jako pozitivní nález klasifikován jen jeden pacient s jinou diagnózou než RS nebo CIS, ale také jen tři pacienti s RS. Naopak stejná cut-off hodnota aplikovaná na PAG IEF/ AIB zachovala pozitivitu o-fKLC u všech pěti pacientů s RS, zatímco všech 14 pacientů s jinými diagnózami než RS nebo CIS by zůstalo negativních. Shoda mezi hodnotícími byla u těchto vzorků 100%.
Diskuze
Srovnání různých metod separace a specifické detekce o-IgG, které jsou v současnosti používány, bylo publikováno v několika studiích [12,20–23], ale použití IEF v agaróze vs. v polyakrylamidu nebylo v tomto kontextu systematicky studováno. Pro analýzu o-fLC jsme nenalezli ani jednu takovou srovnávací studii.
Zaměřili jsme se na porovnání dvou komerčně dostupných metod pro o-IgG a na porovnání separace o-fLC v agarózovém vs. PAG při použití identické detekční procedury zavedené pro o-fLC [7,8]. Přínos naší studie spatřujeme ve zpracování konsekutivní série vzorků zaslaných k analýze o-IgG a o-fLC, což zamezuje možnému bias a umožňuje také do určité míry odhadnout očekávaný podíl pozitivních vzorků. Nedostatkem studie je absence klinických informací u více než 50 % vyšetřených vzorků. Nicméně korelace mezi různými testy detekujícími intratékální syntézu imunoglobulinů byla velmi dobrá a výsledky v podskupině pacientů se známými diagnózami jsou konzistentní s dřívějšími publikacemi. Proto považujeme naše výsledky za spolehlivé. Přesto musí být klinicko-laboratorní korelace pozorované v naší studii interpretovány s opatrností, neboť výsledky o-IgG a o-fLC byly klinickým lékařům dostupné, a mohly tak ovlivnit jejich diagnostické rozhodování. Ač je nutné pamatovat na to, že intratékální syntéza imunoglobulinů není nálezem specifickým pro konkrétní diagnózu, ale může se vyskytovat u mnoha zánětlivých onemocnění CNS, zdá se, že v neselektované populaci pacientů indikovaných k detekci o-IgG je pozitivita tohoto testu nejen vysoce senzitivním, avšak také poměrně specifickým nálezem pro RS.
K odhalení malých, ale významných rozdílů mezi porovnávanými testy by byl zapotřebí mnohem rozsáhlejší soubor. Hodnocení pomocí statistiky κ nám však umožňuje vyslovit závěr, že bylo dosaženo velmi dobré shody (κ > 0,80) ve všech srovnáních vyjma srovnání klasifikace o-IgG nálezů do typů 1–5. Navíc ojedinělá neshodná hodnocení pozitivity/ negativity nálezu o-IgG i o-fLC byla pozorována pouze v hraničních případech.
Shoda v klasifikaci typu o-IgG nálezu byla vyjádřena méně, ve shodě s předchozími studiemi [20,22,23]. Význam této detailnější klasifikace je diskutován kontroverzně [1,24,25]. Domníváme se, že pouze průměrná shoda v klasifikaci do těchto pěti typů (na rozdíl od velmi dobré shody při jednoduchém hodnocení negativní/ pozitivní) může být hlavním důvodem omezujícím klinickou užitečnost této podrobnější klasifikace.
Je důležité zmínit se o významu hraničních nálezů. Jsou-li laboratoří vydány, mohou přispět k nejistotě a stresu pacienta. Jediný intratékálně syntezovaný pás může představovat „vrchol ledovce“ u monoklonální i oligoklonální odpovědi [25]. V běžné praxi je takový nález považován buď za negativní, nebo za hraniční. Tento výsledek jsme u o-IgG pozorovali v 7, resp. 9 % vzorků, což je incidence vyšší než uváděná v předchozích studiích [26–29]. Přestože takový nález, na rozdíl od jiných autorů [1], hodnotíme jako negativní, ve shodě s výsledky recentní multicentrické studie [29] nález jediného pásu na výsledkovém listu uvádíme. Je-li v těchto případech podezření na RS, doporučuje se pečlivé sledování, neboť se ukázalo, že část těchto pacientů časem vyvine oligoklonální profil [26,27,29]. Jako pozitivní je pro o-IgG i o-fLC hodnocen nález alespoň dvou pásů. V několika publikacích však byl navržen vyšší cut-off tří [30,31] nebo čtyř [3,7,28,32] intratékálně syntezovaných IgG pásů nebo šesti pásů fKLC [7]. Další studie srovnávající současné separační/ detekční metody pro o-IgG a o-fLC by měly zahrnovat srovnání s kvantifikací fLC a zaměřit se více na „kritické vzorky“ s nálezem jednoho nebo několika málo intratékálně syntezovaných pásů.
Studie potvrdila, že výpočtové metody jsou pro průkaz intratékální syntézy IgG méně senzitivní než o-IgG. Ohledně kvantifikace fLC nemůžeme vyslovit určitější závěry vzhledem k malému počtu analyzovaných vzorků. Naše výsledky nicméně naznačují možnost falešně negativních i falešně pozitivních výsledků kvantitativního testu. Kvantifikace fLC pomocí rozdílných reagencií/ přístrojů nemusí poskytovat srovnatelné hodnoty umožňující univerzální použití jediné cut-off hodnoty pro výpočet intratékální syntézy fLC. Diskrepantní výsledky mezi kvantitativními a kvalitativními testy pro fKLC byly publikovány v recentní studii [33]. Přestože se ukázalo, že detekce o-fLC může být nepatrně senzitivnějším testem než o-IgG pro průkaz intratékálního zánětu, může být také méně specifická pro RS než o-IgG [5–8]. Proto souhlasíme s Bayartem et al [33], že testy fLC by měly být používány spíše jako doplněk než jako náhrada za analýzu o-IgG, jejíž klíčové postavení je zakotveno i v doporučeních českých odborných společností [34,35].
Izoelektrická fokusace v polyakrylamidu může být zvlášť výhodná pro menší molekuly fLC vzhledem k menší velikosti pórů gelu. Skutečně jsme pozorovali vyšší počet intratékálně syntezovaných pásů fLC oproti IEF v agaróze. Navíc jsme pozorovali, že v PAG byly pásy fLC rovnější a celkový o-fLC obraz ostřejší než v agaróze, kde jsou pásy často nerovné. Nutno ovšem připustit, že tyto rozdíly nemusí být způsobeny jen separačním médiem, ale také různými programy použitými pro IEF. Tak či onak se tyto malé rozdíly nejeví jako kritické pro konečné kvalitativní zhodnocení výsledků o-fLC.
Uzavíráme tedy s tím, že mezi IEF v agaróze a polyakrylamidu bylo dosaženo velmi dobré shody. Obě metody považujeme za vhodné pro rutinní praxi. Shoda výsledků o-fLC mezi dvěma hodnotícími byla stejně dobrá, jako bylo dříve prokázáno u o-IgG.
Tato práce byla podpořena institucionální podporou Ministerstva zdravotnictví ČR (07/RVO-FNOs/2017).
Rádi bychom poděkovali laborantkám L. Fürstové, I. Faruzelové, R. Malečkové, R. Výtiskové, B. Strakošové a O. Michnové za vynikající technickou spolupráci; prof. D. Stejskalovi, doc. K. Šafarčíkovi a dr. Z. Švagerovi (Ústav laboratorní diagnostiky, FN Ostrava), dr. J. Jurčíkové a dr. K. Vítkové (Útvar náměstka ředitele pro vědu a výzkum, FN Ostrava) za jejich podporu a Mgr. M. Hradecké za jazykovou korekturu.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Ing. MUDr. David Zeman, Ph.D.
Ústav laboratorní diagnostiky FN Ostrava
17. Listopadu 1790
708 52 Ostrava
e-mail: david.zeman@fno.cz
Přijato k recenzi: 4. 10. 2018
Přijato do tisku: 10. 12. 2018
Sources
1. Link H, Huang YM. Oligoclonal bands in multiple sclerosis cerebrospinal fluid: an update on methodology and clinical usefulness. J Neuroimmunol 2006; 180(1–2): 17–28. doi: 10.1016/ j.jneuroim.2006.07.006.
2. Presslauer S, Milosavljevic D, Huebl W et al. Validation of kappa free light chains as a diagnostic biomarker in multiple sclerosis and clinically isolated syndrome: a multicenter study. Mult Scler 2016; 22(4): 502–510. doi: 10.1177/ 1352458515594044.
3. Gurtner KM, Shosha E, Bryant SC et al. CSF free light chain identification of demyelinating disease: comparison with oligoclonal banding and other CSF indexes. Clin Chem Lab Med 2018; 56(7): 1071–1080. doi: 10.1515/ cclm-2017-0901.
4. Thompson AJ, Banwell BL, Barkhof F et al. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurol 2018; 17(2): 162–173. doi: 10.1016/ S1474-4422(17)30470-2.
5. Sindic CJM, Laterre E. Oligoclonal free kappa and lambda bands in the cerebrospinal fluid of patients with multiple sclerosis and other neurological diseases. An immunoaffinity-mediated capillary blot study. J Neuroimmunol 1991; 33(1): 63–72.
6. Goffette S, Schluep M, Henry H et al. Detection of oligoclonal free kappa chains in the absence of oligoclonal IgG in the CSF of patients with suspected multiple sclerosis. J Neurol Neurosurg Psychiatry 2004; 75(2): 308–310.
7. Zeman D, Hradílek P, Kušnierová P et al. Oligoclonal free light chains in cerebrospinal fluid as markers of intrathecal inflammation. Comparison with oligoclonal IgG. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2015; 159(1): 104–113.
8. Zeman D, Kušnierová P, Švagera Z et al. Assessment of intrathecal free light chain synthesis: Comparison of different quantitative methods with the detection of oligoclonal free light chains by isoelectric focusing and affinity-mediated immunoblotting. PloS One 2016; 11(11): e0166556. doi: 10.1371/ journal.pone.0166556.
9. Voortman MM, Stojakovic T, Pirpamer L et al. Prognostic value of free light chains lambda and kappa in early multiple sclerosis. Mult Scler 2017; 23(11): 1496–1505. doi: 10.1177/ 1352458516681503
10. Ganelin-Cohen E, Golderman S, Yeskaraev R et al. Search for new biomarkers of pediatric multiple sclerosis: application of immunoglobulin free light chain analysis. Clin Chem Lab Med 2018; 56(7): 1081–1089. doi: 10.1515/ cclm-2017-0911.
11. Rathbone E, Durant L, Kinsella J et al. Cerebrospinal fluid immunoglobulin light chain ratios predict disease progression in multiple sclerosis. J Neurol Neurosurg Psychiatry 2018; 89(10): 1044–1049. doi: 10.1136/ jnnp-2018-317947.
12. Sádaba MC, González Porqué P, Masjuan J et al. An ultrasensitive method for the detection of oligoclonal IgG bands. J Immunol Methods 2004; 284(1–2): 141–145.
13. Andersson M, Alvarez-Cermeño J, Bernardi G et al. Cerebrospinal fluid in the diagnosis of multiple sclerosis: a consensus report. J Neurol Neurosurg Psychiatry 1994; 57(8): 897–902.
14. Freedman MS, Thompson EJ, Deisenhammer F et al. Recommended standard of cerebrospinal fluid analysis in the diagnosis of multiple sclerosis. A consensus statement. Arch Neurol 2005; 62(6): 865–870. doi: 10.1001/ archneur.62.6.865.
15. Reiber H. Flow rate of cerebrospinal fluid (CSF) – a concept common to normal blood-CSF barrier function and to dysfunction in neurological diseases. J Neurol Sci 1994; 122(2): 189–203.
16. Auer M, Hegen H, Zeileis A et al. Quantitation of intrathecal immunoglobulin synthesis – a new empirical formula. Eur J Neurol 2016; 23(4): 713–721. doi: 10.1111/ ene.12924.
17. Öhman S, Forsberg P, Nelson N et al. An improved formula for the judgement of intrathecally produced IgG in the presence of blood brain barrier damage. Clin Chim Acta 1989; 181(3): 265–272.
18. Presslauer S, Milosavljevic D, Huebl W et al. Kappa free light chains: diagnostic and prognostic relevance in MS and CIS. PLoS One 2014; 9: e89945. doi: 10.1371/ journal.pone.0089945.
19. Hegen H, Milosavljevic D, Schnabl C et al. Cerebrospinal fluid free light chains as diagnostic biomarker in neuroborreliosis. Clin Chem Lab Med 2018; 56(8): 1383–1391. doi: 10.1515/ cclm-2018-0028.
20. Sellebjerg F, Christiansen M. Qualitative assessment of intrathecal IgG synthesis by isoelectric focusing and immunodetection: interlaboratory reproducibility and interobserver agreement. Scand J Clin Lab Invest 1996; 56(2): 135–143.
21. Abraira V, Alvarez-Cermeño JC, Arroyo R et al. Utility of oligoclonal IgG band detection for MS diagnosis in daily clinical practice. J Immunol Methods 2011; 371(1–2): 170–173. doi: 10.1016/ j.jim.2011.06.009.
22. Nováčková L, Zeman D. Detection of oligoclonal IgG bands in cerebrospinal fluid and serum: comparison between commercial immunofixation method and home-made affinity immunoblotting method and evaluation of interobserver agreement. Klin Biochem Metab 2011; 19(4): 229–233.
23. Dlouhy O, Kusnierova P, Kurasova I et al. Chemiluminescent detection of oligoclonal immunoglobulins after isoelectric focusing and affinity-mediated immunoblotting. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2018; 162(2): 107–115.
24. Franciotta D, Lolli F. Interlaboratory reproducibility of isoelectric focusing in oligoclonal band detection. Clin Chem 2007; 53(8): 1557–1558. doi: 10.1373/ clinchem.2007.089052.
25. Gastaldi M, Zardini E, Franciotta D. An update on the use of cerebrospinal fluid analysis as a diagnostic tool in multiple sclerosis. Expert Rev Mol Diagn 2017; 17(1): 31–46.doi: 10.1080/ 14737159.2017.1262260.
26. Davies G, Keir G, Thompson EJ et al. The clinical significance of an intrathecal monoclonal immunoglobulin band. A follow-up study. Neurology 2003; 60(7): 1163–1166.
27. Franciotta D, Zardini E, Lolli F. The clinical significance of an intrathecal monoclonal immunoglobulin band: a follow-up study. Neurology 2004; 62(4): 675–676.
28. Wurster U. The clinical significance of an intrathecal monoclonal immunoglobulin band: a follow-up study. Neurology 2004; 62(7): 1237.
29. Ferraro D, Franciotta D, Bedin R et al. A multicenter study on the diagnostic significance of a single cerebrospinal fluid IgG band. J Neurol 2017; 264(5): 973–978. doi: 10.1007/ s00415-017-8480-5.
30. Bourahoui A, De Seze J, Guttierez R et al. CSF isoelectrofocusing in a large cohort of MS and other neurological diseases. Eur J Neurol 2004; 11(8): 525–529. doi: 10.1111/ j.1468-1331.2004.00822.x.
31. Mayringer I, Timeltaler B, Deisenhammer F. Correlation between the IgG index, oligoclonal bands in the CSF, and the diagnosis of demyelinating diseases. Eur J Neurol 2005; 12(7): 527–530. doi: 10.1111/ j.1468-1331.2005.00997.x.
32. Fortini AS, Sanders EL, Weinshenker BG et al. Cerebrospinal fluid oligoclonal bands in the diagnosis of multiple sclerosis. Am J Clin Pathol 2003; 120(5): 672–675. doi: 10.1309/ EM7K-CQR4-GLMH-RCX4.
33. Bayart JL, Muls N, van Pesch V. Free kappa light chains in neuroinflammatory disorders: complement rather than substitute? Acta Neurol Scand 2018; 138(4): 352–358. doi: 10.1111/ ane.12969.
34. Sobek O, Adam P, Koudelková J et al. Algoritmus vyšetření likvoru v návaznosti na doporučení Sekce neuroimunologie a likvorologie České neurologické společnosti JEP. Cesk Slov Neurol N 2012; 75/ 108(2): 159–163.
35. Mrázová K, Zeman D, Bořecká K. Doporučení k vyšetřování mozkomíšního moku. Klin Biochem Metab 2017; 25(1): 43–47.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2019 Issue 1
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Memantine Eases Daily Life for Patients and Caregivers
-
All articles in this issue
- Ketogenní dieta – účinná nefarmakologická léčba dětské a adolescentní epilepsie
- Vieme dobre diagnostikovať dyskinetickú formu DMO? ÁNO
- Sub signum coma – súčasný pohľad na chronické poruchy vedomia
- Chronický subdurální hematom
- Iatrogenizácia pacientov so psychogénnymi neepileptickými záchvatmi – možné východiská
- Genetika neurodegenerativních demencí v deseti bodech – co může neurolog očekávat od molekulárního genetika?
- Lehká mozková poranění – konsenzuální odborné stanovisko České neurologické společnosti ČLS JEP
- Evokované potenciály vyvolané kontaktním teplem – vliv fyziologických proměnných
- Laboratorní účinnost kyseliny acetylsalicylové v sekundární prevenci ischemických cévních mozkových příhod
- Parietální atrofie na magnetické rezonanci mozku u Alzheimerovy nemoci s pozdním začátkem
- Transkraniální magnetická stimulace u hraniční poruchy osobnosti – série kazuistik
- Změny v expresi TNFα a microRNA-15b u experimentálního modelu subarachnoidálního krvácení
- Raschova analýza dotazníku Q-LES-Q-SF na podkladě odpovědí pacientů s neuropatickou bolestí
- Oligoklonální IgG a volné lehké řetězce – srovnání izoelektrické fokusace v agarózovém a polyakrylamidovém gelu
- Nové možnosti ultrazvuku v predikci výskytu bolesti dolní části zad u dospívajících mužů – pilotní studie
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Lehká mozková poranění – konsenzuální odborné stanovisko České neurologické společnosti ČLS JEP
- Chronický subdurální hematom
- Oligoklonální IgG a volné lehké řetězce – srovnání izoelektrické fokusace v agarózovém a polyakrylamidovém gelu
- Ketogenní dieta – účinná nefarmakologická léčba dětské a adolescentní epilepsie
