Liečba spontánnej baktériovej peritonitídy
Treatment of spontaneous bacterial peritonitis
Spontaneous bacterial peritonitis is a common infection in cirrhotics with a mortality rate of up to 20%. The chain of events that eventually lead to spontaneous bacterial peritonitis begins with liver cirrhosis and chronic liver failure, continues with bacterial overgrowth and translocation followed by infection of the lymph nodes and ascites. Most common etiologically are large intestine bacteria such as E. coli and enterococci, but also streptococcus sp. Despite the relative thorough description of ethiopathogenesis, the specific guidelines for management of this complication were introduced by the European Association for Study of the Liver as late as in 2010. One of the major reasons was the lack of evidence from clinical studies about the treatment of spontaneous bacterial peritonitis. In this article, the reader will find a review of published papers and EASL guidelines about spontaneous bacterial peritonitis treatment, primary and secondary prophylaxis.
Key words:
spontaneous bacterial peritonitis – treatment – review
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Submitted:
28. 2. 2012
Accepted:
17. 3. 2012
Authors:
M. Janičko; E. Veseliny; G. Senajová; P. Jarčuška
Authors‘ workplace:
I. interná klinika Univerzity Pavla Jozefa Šafárika v Košiciach
Published in:
Gastroent Hepatol 2012; 66(4): 298-302
Category:
Hepatology: Review article
Overview
Spontánna baktériová peritonitída je častá infekcia pacientov s cirhózou pečene s mortalitou približne 20 %. K jej vzniku vedie reťaz procesov začínajúca cirhózou a zlyhávaním pečene pokračujúca bakteriálnym prerastaním a črevnou translokáciou a končiaca infekciou regionálnych lymfatických uzlín a ascitu. Najčastejšie etiologické agens sú črevné baktérie, E. coli a enterokoky, ale aj streptococcus sp. Napriek pomerne presne popísanej etiológii boli jednoznačné liečebné odporúčania zavedené Európskou asociáciou pre štúdium pečene až v roku 2010. Jedným z hlavných dôvodov bol nedostatok dôkazov pochádzajúcich z klinických štúdií o liečbe spontánnej baktériovej peritonitídy. V článku uvádzame prehľad publikovanej literatúry a zároveň aj odporúčania európskej asociácie pre štúdium pečene, zamerané na liečbu, primárnu a sekundárnu prevenciu spontánnej baktériovej peritonitídy.
Kľúčové slová:
spontánna baktériová peritonitída – liečba – prehľad
Definícia
Spontánna baktériová peritonitída (SBP) je veľmi častá infekcia pacientov s cirhózou pečene a ascitom. Jej mortalita klesla z 90 % v čase jej popísania na asi 20 % v súčasnosti [3]. Prvé zmienky sa v medicínskej literatúre vyskytujú od roku 1893, avšak samotný termín zaviedol do praxe Conn v roku 1964. Zo samotného názvu vyplýva, že ide o infekciu ascitu bez prítomnosti jednoznačného intraabdominálneho zdroja infekcie [4].
Etiopatogenéza
Kľúčovým procesom pri vzniku SBP je baktériová translokácia, ktorá má za následok prienik črevnej flóry do regionálnych lymfatických uzlín a následne do ascitu [5]. Porucha črevnej motility vytvára vhodné prostredie na premnoženie patologickej črevnej mikroflóry, čo spolu s (ultra)štrukturálnymi zmenami črevnej steny a zlyhaním obranných mechanizmov pečene umožňuje prienik baktérií do mezenteriálnych lymfatických uzlín (obr. 1). Ich prežívanie a ďalšiu propagáciu sprevádzanú epizódami bakteriémie podporuje široký a multifaktoriálny deficit imunity pri cirhóze pečene [6].
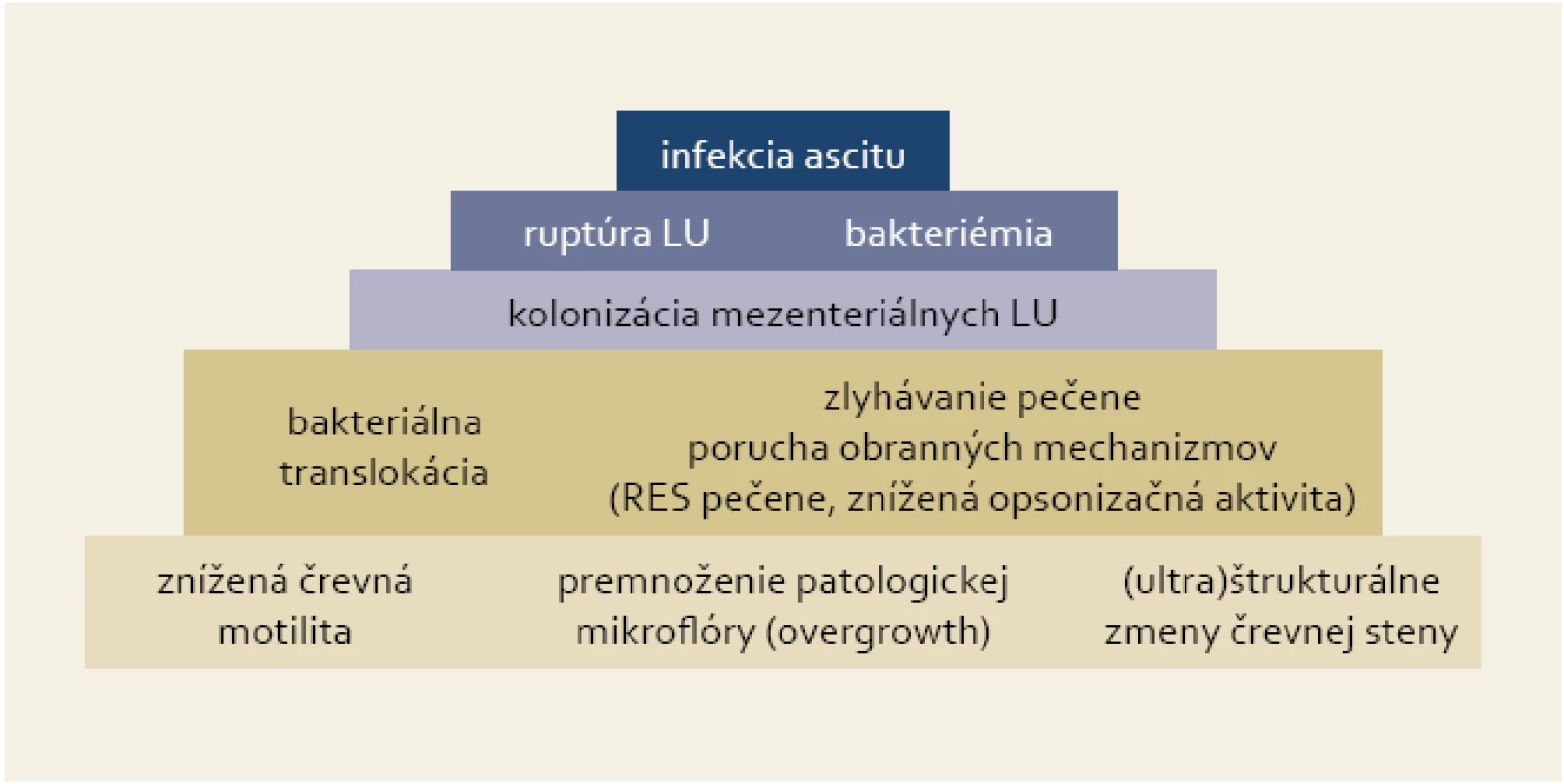
Prevalencia SBP v neselektovanej populácii cirhotikov sa pohybuje od 10–30 %. Približne v polovici prípadov je pacient s infekciou už prijatý do nemocnice, v druhej polovici sa infekcia rozvinie počas hospitalizácie [7].
Konkrétny patogén vyvolávajúci infekciu sa zistí len v cca 40 % prípadov, hoci záchyt sa dá zvýšiť až do 80 %, naočkovaním ascitickej tekutiny do fľaštičiek na odber hemokultúry už pri lôžku. Napriek naočkovaniu ascitu do média pre hemokultúru nebol zistený žiadny patogén v 23 % prípadov [8]. Sľubnou metódou na jednoznačnú identifikáciu patogénu sú molekulárno genetické metódy. V experimente bola prítomnosť bakteriálnej DNA PCR reakciou zachytená kvantitatívne v 100 % prípadov, identifikácia jednotlivých kmeňov takmer vždy dokázala viacnásobnú infekciu [9]. V prípade zachytenia patogénu sa najčastejšie jedná o gram-negatívne baktérie s prevahou E. coli (cca 37 %), alebo gram--pozitívne koky (najmä streptococcus sp., a enterokoky) (cca 20 %). Tieto údaje je potrebné považovať za orientačné, nakoľko sú predpokladané výrazné rozdiely vo vykultivovanej flóre u komunitných pacientov, hospitalizovaných pacientov, pacientov podstupujúcich invazívne výkony a nezanedbateľný je aj geografický faktor. Nedávno publikovaná dánska štúdia udáva výskyt gram-pozitívnych kokov až v 45,9 %, nasledovaných čeľaďou Enterobacteriaceae (31,7 %), výskyt E. coli bol udávaný len v 7,5 % [10]. Navyše až 30 % gram-negatívnych baktérií je zvyčajne rezistentných voči chinolónom (najmä u pacientov podstupujúcich profylaktickú liečbu chinolónmi) a ďalších 30 % voči trimetoprim-sulfametoxazolu. Výskyt rezistencie voči cefalosporínu je v súčasnosti pomerne nízky a nezávisí od profylaxie norfloxacínom [11]. Infekcia gram-pozitívnymi kokmi prevláda u pacientov na profylaktickej terapii norfloxacínom a infekcia týmito patogénmi je častá aj v rámci nozokomiálnej nákazy [11].
Klinický priebeh
Klinická symptomatológia pacientov so SBP je veľmi rôznorodá jednak samotným výskytom príznakom a zároveň aj ich intenzitou. Najčastejšie sú prítomné: 1. lokálne príznaky zápalu peritonea – bolesť brucha, palpačná citlivosť, vracanie, hnačka, ale aj ileus; 2. systémové príznaky infekcie ako hyper alebo hypotermia, triaška, tachykardia a/alebo tachypnoe; 3. zhoršenie hepatálnych funkcií; 4. hepatálna encefalopatia; 5. renálne zlyhanie; 6. krvácanie do gastrointestinálneho traktu; 7. rozvoj sepsy až septického šoku. Veľké percento pacientov je však asymptomatických [3].
Diagnostika
Diagnostika SBP je postavená na punkcii ascitu. Typické biochemické zloženie ascitu pri cirhóze pečene poukazuje na transsudatívny pôvod ascitu s nízkou celularitou, hladinou celkových bielkovín a gradientom sérového a ascitického albumínu viac ako 11 g/l. V prípade infekcie dochádza k zmnoženiu bunkových elementov, najmä neutrofilných granulocytov. V súčasnosti je možné na stanovenie množstva týchto buniek použiť aj automatické bunkové analyzátory, nakoľko medzi ručným a automatickým počítaním bola nájdená silná korelácia [12]. Vzhľadom k nízkej špecificite a vyplývajúcemu vysokému riziku falošne negatívnych výsledkov nie je možné v diagnostike SBP odporučiť použitie rýchlych reagenčných pásikov ako pri vyšetrení moču [3]. Najvyššiu senzitivitu pri diagnostike SBP má hraničná hodnota 250 granulocytov v mm3. Na základe kombinácie cytologického a mikrobiologického vyšetrenia môžeme identifikovať tri druhy spontánnej baktériovej peritonitídy. Klasický typ vyžaduje pozitivitu kultivačného nálezu zároveň s nálezom leukocytózy v ascite. Jeho variantom je leukocytóza v ascite bez záchytu patogénu pri kultivácii – kultivačne negatívny neutrofilový ascites. Nakoľko je klinický priebeh aj mortalita týchto typov podobná, nie sú ani odlišnosti v liečbe. Pri pozitivite kultivačného vyšetrenia ascitu, avšak bez nálezu leukocytózy, hovoríme o tzv. bacterascite. Manažment takéhoto pacienta nie je určený direktívne. Nakoľko však existujú údaje naznačujúce, že prítomnosť bakteriálnej DNA v ascite zhoršuje prognózu pacientov s cirhózou pečene [13], alebo sa môže jednať o predstupeň, SBP je indikovaný opakovaný odber vzorky a pri pozitivite kultivačného nálezu aj antibiotická liečba [7]. V rámci diferenciálnej diagnostiky je nutné vylúčiť sekundárnu peritonitídu získanú v komunite (apendicitída, cholecystitída, perforácia čreva) alebo iatrogénne (pri operácii, paracentéze alebo peritoniálnej dialýze) [14,15].
Liečba
Podľa odporúčaní Európskej asociácie pre štúdium pečene (EASL) je ihneď po zistení leukocytózy (> 250 neutrofilov/mm3) v ascite nutné začať empirickú antibiotickú liečbu [3]. Napriek stupňu odporúčania A1, nie je však z pochopiteľných etických dôvodov realizovaná placebom kontrolovaná štúdia.
V rokoch 1984–2008 bolo realizovaných minimálne 13 štúdií porovnávajúcich efektivitu jednotlivých antibiotík v empirickej liečbe SBP. Prakticky v každej štúdii bola porovnávaná odlišná dvojica antibiotík (najčastejšie aminopenicilíny +/ − klavulanát, chinolóny, cefalosporíny tretej generácie, kolistín, tobramycín), preto je metaanalýza týchto štúdií nerealizovateľná. Napriek tomu, v žiadnej zo štúdií nebol zistený významný rozdiel v mortalite pacientov. V jedinej štúdii, ktorá ako hlavný cieľ sledovala pomer pacientov vyliečených zo SBP, bol zistený benefit cefotaximu oproti kombinácii ampicilín + tobramycín [16], avšak bez odlišnosti v mortalite. V ďalších štúdiách nebol zistený: a) rozdiel v dávke cefotaximu 8 vs 4 mg/d pri sledovaní dĺžky liečby či nežiaducich účinkov [17]; b) v dĺžke trvania liečby 5 vs 10 dní [18]. Na základe týchto dôkazov je liekom voľby cefotaxime 2 g á 12 h i.v. v trvaní 5 dní (stupeň odporúčania A1). Alternatívou je ciprofloxacín p.o. 500 mg á 12 hod po dobu 7 dní (úroveň B1) za predpokladu, že u pacienta je vhodný p.o. príjem a chinolón, nebol užívaný profylakticky. Ampicilín klavulanát i.v. s prechodom na p.o. formu v plnej dávke je tiež vhodný pri empirickej liečbe SBP (úroveň B1). Antibiotická liečba môže byť v prípade potreby upravená po získaní výsledkov kultivačného vyšetrenia. V prípade negatívnej kultivácie je vhodné sledovať terapeutickú odpoveď pri kontrolnej paracentéze po 48 hod od začatia antibiotickej liečby, kedy očakávame pokles hladiny neutrofilov o minimálne 25 % [3].
Prítomnosť infekcie u cirhotického pacienta, s hranične kompenzovanou hepatálnou a renálnou funkciou už za optimálnych podmienok, mnohokrát vedie, prostredníctvom poruchy mikrocirkulácie, k progresii zlyhávania hepatálnej, renálnej funkcie, ale aj zlyhania ďalších orgánov. Z dostupných údajov vyplýva, že infekcia v teréne cirhózy je závažným, nezávislým rizikovým faktorom vzniku ARDS [19], spontánna baktériová peritonitída zapríčiní v zhruba tretine pacientov vznik renálneho zlyhania [20], infekcia môže zapríčiniť manifestáciu alebo zhoršenie hepatálnej encefalopatie [21] a v neposlednom rade sú infekcie jednou z častých príčin akútneho zlyhania pečene nasadajúceho na chronické zlyhávanie (acute on chronic liver failure) [22]. Dôležitou súčasťou liečby je preto, okrem razantnej a cielenej liečby samotnej infekcie, snaha o zmiernenie dôsledkov poruchy mikrocirkulácie a ovplyvnenie systémovej zápalovej odpovede.
Pribúdajú údaje dokumentujúce benefit intravenózneho podávania albumínu pacientom so spontánnou baktériovou peritonitídou. Randomizovaná kontrolovaná štúdia u pacientov (63 pacientov v experimentálnej a 63 v kontrolnej skupine) so SBP liečených cefotaximom ukázala, že albumín (v dávke 1,5 g/kg telesnej hmotnosti pri diagnóze a 1 g/kg po troch dňoch) významne znížil výskyt hepatorenálneho syndrómu prvého typu (30 vs 10 %) a zároveň redukoval hospitalizačnú mortalitu (29 vs 10 %). Na týchto výsledkoch sa podieľal najmä výrazný efekt albumínu vo vysoko rizikovej skupine (definovanej ako pacienti s hodnotami bilirubínu > 68 µmol/l a kreatinínu viac ako 88 µmol/l). Nakoľko bol výskyt HRS v skupine s nízkym rizikom minimálny (7 % v skupine bez albumínu a 0 % v skupine s albumínom), nie je jasné, či je tento pozitívny účinok prítomný aj v tejto skupine [23]. Podobné výsledky priniesla aj aktuálna retrospektívna observačná štúdia, ktorá zahŕňala 216 epizód SBP rozdelených do kategórií pacientov s nízkym rizikom (urea < 11 mmol/L a bilirubín < 68 µmol/L) bez pridania albumínu k liečbe (64 epizód), ďalej pacientov s vysokým rizikom bez pridania albumínu (79 epizód) a pacientov s vysokým rizikom liečených pridaním albumínu (73 epizód). Nemocničná mortalita medzi skupinami bola 3,1 vs 46,8 vs 28,8 % (podľa uvedeného poradia) a trojmesačné prežívanie 93 vs 45 vs 62 %. Dôležitým výsledkom tejto štúdie je skutočnosť, že albumín znižuje mortalitu vysokorizikových pacientov so SBP, avšak táto mortalita je stále vyššia ako u nízkorizikových pacientov, preto zrejme pacienti s nízkym rizikom nevyžadujú doplnok intravenózneho albumínu [24]. Alternatívou k albumínu sú mnohokrát syntetické koloidné roztoky, avšak priame porovnanie hydroxyetyl škrobu s albumínom, na rozdiel od albumínu, nepreukázalo efekt syntetického koloidu na zlepšení cirkulačnej dysfunkcie [25].
Na základe uvedených dôkazov je albumín naďalej preferovaný v liečbe SBP v kombinácii s antibiotikom v odporúčaniach EASL z roku 2010 [3].
Profylaxia
Pre vysoké riziko vzniku alebo recidívy SBP je u určitých, presne špecifikovaných skupín pacientov indikovaná primárna alebo sekundárna profylaxia SBP. Primárna profylaxia je indikovaná u pacientov s
- gastrointestinálnym krvácaním,
- s nízkou hladinou celkových bielkovín v ascite (< 10 g/l).
Sekundárna profylaxia je indikovaná u každého pacienta po prekonanej SBP. Riziko vzniku infekcie u cirhotika s prebiehajúcim gastrointestinálnym krvácaním sa pohybuje od 25–65 %. Efektivita primárnej profylaxie s ohľadom na mortalitu pacientov v týchto podmienkach bola hlavným cieľom metaanalýzy realizovanej skupinou Cochrane Collaboration, ktorá zahŕňala 12 štúdií realizovaných v rokoch 1985–2010, zahŕňajúcich 1 241 pacientov (obr. 2). Podávanie antibiotickej terapie počas krvácania z gastrointestinálneho traktu redukovalo súhrnnú mortalitu v 12 štúdiách o takmer 50 % [1]. Na základe dostupných dôkazov preto EASL odporúča začať u každého pacienta s gastrointestinálnym krvácaním antibiotickú liečbu (stupeň odporúčania A1). Ako vhodné antibiotikum je odporúčaný ceftriaxon v dávke 1 g denne, avšak vhodné je aj p.o. podanie norfloxacínu [3].
![Vplyv antibiotickej liečby na mortalitu pacientov s krvácaním z gastrointestinálneho traktu. Upravené podľa [1].
Fig. 2. Influence of antibiotic treatment on the mortality of patients with gastrointestinal tract bleeding. Adjusted according to [1].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/4a6e58d7faca3984ca19a94b092b6fcb.png)
Pacienti s hladinou bielkovín v ascite nižšou ako 10 g/l majú zvýšené riziko vzniku SBP [26]. Do februára 2009 bolo publikovaných 7 štúdií zahrňajúcich 538 pacientov, porovnávajúcich efektivitu antibiotickej profylaxie voči placebu alebo žiadnej liečbe (obr. 3). Súhrnne mali pacienti zaradení do antibiotikej profylaxie zhruba 5× nižšie riziko vzniku SBP oproti pacientom v kontrolných skupinách. Podobný efekt bol pozorovaný aj pri mortalite pacientov [2], preto je u pacientov s hladinou bielkovín v ascite pod 10 g/l odporúčaná profylaxia norfloxacínom 400 mg/d [3].
![Vplyv antibiotickej liečby na vznik SBP u pacientov s hladinou bielkovín v ascite < 10 g/l. Upravené podľa [2].
Fig. 3. Antibiotic profylaxis outcome in cirrhotics with ascitic protein levels < 10 g/l. Modified according to [2].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/3bb697723fb1fae493561adc06f6f821.png)
Miera rekurencie u pacientov po prekonanej SBP je zhruba 70 % v priebehu jedného roka [27]. Ročné prežívanie týchto pacientov je iba 30–50 %, preto by mal byť každý pacient s cirhózou pečene po prekonaní SBP posúdený v súvislosti so zaradením do transplantačného programu. Sekundárna profylaxia spontánnej baktériovej peritonitídy je odporúčaná na základe jednej placebom kontrolovanej, randomizovanej štúdie porovnávajúcej efektivitu sekundárnej profylaxie SBP u pacientov po prekonaní predchádzajúcej epizódy SBP. Gines et al v tejto štúdii zistili, že norfloxacín 400 mg p.o. redukoval riziko vzniku SBP zo 68 na 20 % [28]. Pacienti po prekonanej SBP majú podľa odporúčaní EASL dostávať profylaktickú antibiotickú liečbu norfloxacínom v dávke 400 mg denne p.o. (stupeň odporúčania A1), alternatívou je aj ciprofloxacín 750 mg p.o. 1× týždenne alebo trimetoprim/sulfametoxazol (stupeň odporúčania A2) [3].
Záver
Spontánna baktériová peritonitída je závažná infekcia pacientov s cirhózou pečene s vysokou pridanou morbiditnou a mortalitnou záťažou. Antibiotická liečba je však dobre účinná a redukuje riziko vzniku SBP, komplikácií a smrti. Tieto skutočnosti sú reflektované aj v odporúčaniach EASL pre manažment ascitu, spontánnej baktériovej peritonitídy a hepatorenálneho syndrómu z roku 2010 (tab. 1).
![Profylaxia spontánnej baktériovej peritonitídy [3].
Tab. 1. Prophylaxis of spontaneous bacterial peritonitis [3].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/9b2e3811b38cf1673806eb850e015f96.png)
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 28. 2. 2012
Přijato: 17. 3. 2012
MUDr. Martin Janičko, PhD.
I. interná klinika UPJŠ v Košiciach
Trieda SNP 1, 040 01 Košice
Martin.janicko@gmail.com
Sources
1. Chavez-Tapia NC, Barrientos-Gutierrez T, Tellez-Avila FI et al. Antibiotic prophylaxis for cirrhotic patients with upper gastrointestinal bleeding. Cochrane database of systematic reviews (Online) 2010(9): CD002907.
2. Cohen MJ, Sahar T, Benenson S et al. Antibiotic prophylaxis for spontaneous bacterial peritonitis in cirrhotic patients with ascites, without gastro-intestinal bleeding. Cochrane database of systematic reviews (Online) 2009(2): CD004791.
3. European Association fo study of the Liver. EASL clinical practice guidelines on the management of ascites, spontaneous bacterial peritonitis, and hepatorenal syndrome in cirrhosis. J Hepatol 2010; 53(3): 397–417.
4. Conn HO. Spontaneous Peritonitis and Bacteremia in Laennec's Cirrhosis Caused by Enteric Organisms. a Relatively Common but Rarely Recognized Syndrome. Ann Intern Med 1964; 60 : 568–580.
5. Guarner C, Runyon BA, Young S et al. Intestinal bacterial overgrowth and bacterial translocation in cirrhotic rats with ascites. J Hepatol 1997; 26(6): 1372–1378.
6. Koulaouzidis A, Bhat S, Saeed AA. Spontaneous bacterial peritonitis. World J Gastroenterol 2009; 15(9): 1042–1049.
7. Rimola A, Garcia-Tsao G, Navasa M et al. Diagnosis, treatment and prophylaxis of spontaneous bacterial peritonitis: a consensus document. International Ascites Club. J Hepatol 2000; 32(1): 142–153.
8. Castellote J, Xiol X, Verdaguer R et al. Comparison of two ascitic fluid culture methods in cirrhotic patients with spontaneous bacterial peritonitis. Am J Gastroenterol 1990; 85(12): 1605–1608.
9. Rogers GB, Russell LE, Preston PG et al. Characterisation of bacteria in ascites-reporting the potential of culture-independent, molecular analysis. Eur J Clin Microbiol Infect Dis 2010; 29(5): 533–541.
10. Novovic S, Semb S, Olsen H et al. First--line treatment with cephalosporins in spontaneous bacterial peritonitis provides poor antibiotic coverage. Scand J Gastroenterol 2012; 47(2): 212–216.
11. Fernández J, Navasa M, Gómez J et al. Bacterial infections in cirrhosis: epidemiological changes with invasive procedures and norfloxacin prophylaxis. Hepatology 2002; 35(1): 140–148.
12. Angeloni S, Nicolini G, Merli M et al. Validation of automated blood cell counter for the determination of polymorphonuclear cell count in the ascitic fluid of cirrhotic patients with or without spontaneous bacterial peritonitis. Am J Gastroenterol 2003; 98(8): 1844–1848.
13. Zapater P, Francés R, González-Navajas JM et al. Serum and ascitic fluid bacterial DNA: a new independent prognostic factor in noninfected patients with cirrhosis. Hepatology 2008; 48(6): 1924–1931.
14. Belghiti J, Durand F. Abdominal wall hernias in the setting of cirrhosis. Semin Liver Dis 1997; 17(3): 219–226.
15. Selgas R, Bajo MA, Jimenez C et al. Peritoneal dialysis in liver disorders. Perit Dial Int 1996; 16 (Suppl 1): S215–S219.
16. Felisart J, Rimola A, Arroyo V et al. Cefotaxime is more effective than is ampicillin-tobramycin in cirrhotics with severe infections. Hepatology 1985; 5(3): 457–462.
17. Rimola A, Salmerón JM, Clemente G et al. Two different dosages of cefotaxime in the treatment of spontaneous bacterial peritonitis in cirrhosis: results of a prospective, randomized, multicenter study. Hepatology 1995; 21(3): 674–679.
18. Runyon BA, McHutchison JG, Antillon MR et al. Short-course versus long-course antibiotic treatment of spontaneous bacterial peritonitis. A randomized controlled study of 100 patients. Gastroenterology 1991; 100(6): 1737–1742.
19. TenHoor T, Mannino DM, Moss M. Risk factors for ARDS in the United States: analysis of the 1993 National Mortality Followback Study. Chest 2001; 119(4): 1179–1184.
20. Salerno F, Gerbes A, Ginés P et al. Diagnosis, prevention and treatment of hepatorenal syndrome in cirrhosis. Gut 2007; 56(9): 1310–1318.
21. Blei AT. Infection, inflammation and hepatic encephalopathy, synergism redefined. J Hepatol 2004; 40(2): 327–330.
22. Sen S, Davies NA, Mookerjee RP et al. Pathophysiological effects of albumin dialysis in acute-on-chronic liver failure: a randomized controlled study. Liver Transpl 2004; 10(9): 1109–1119.
23. Sort P, Navasa M, Arroyo V et al. Effect of intravenous albumin on renal impairment and mortality in patients with cirrhosis and spontaneous bacterial peritonitis. N Engl J Med 1999; 341(6): 403–409.
24. Poca M, Concepción M, Casas M et al. Role of albumin treatment in patients with spontaneous bacterial peritonitis. Clin Gastroenterol Hepatol 2012; 10(3): 309–315.
25. Fernández J, Monteagudo J, Bargallo X et al. A randomized unblinded pilot study comparing albumin versus hydroxyethyl starch in spontaneous bacterial peritonitis. Hepatology 2005; 42(3): 627–634.
26. Guarner C, Solà R, Soriano G et al. Risk of a first community-acquired spontaneous bacterial peritonitis in cirrhotics with low ascitic fluid protein levels. Gastroenterology 1999; 117(2): 414–419.
27. Garcia-Tsao G. Current management of the complications of cirrhosis and portal hypertension: variceal hemorrhage, ascites, and spontaneous bacterial peritonitis. Gastroenterology 2001; 120(3): 726–748.
28. Ginés P, Rimola A, Planas R et al. Norfloxacin prevents spontaneous bacterial peritonitis recurrence in cirrhosis: results of a double-blind, placebo-controlled trial. Hepatology 1990; 12 (4 Pt 1): 716–724.
Labels
Paediatric gastroenterology Gastroenterology and hepatology SurgeryArticle was published in
Gastroenterology and Hepatology

2012 Issue 4
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
-
Kvalita života je důležitým faktorem indikační rozvahy u nemocných s karcinomem pankreatu
Multicentrická prospektivní studie - Nová sekce Diskuzní fórum
- Vleklé dyspepsie: co a jak v běžné praxi
- 44th congress of the European Pancreatic Club (EPC) and PROMED symposium in 2012
- Dulcolax® čípky
- Zácpa na okraji?
- Zácpa a přežívající mýty. Laxativa
- Zácpa a hypofunkce štítné žlázy. Mýtus nebo skutečnost?
- Syndrom solitárního rektálního vředu
- Defekografie
- Radioizotopové vyšetření segmentální pasáže tlustým střevem pomocí 67Ga-citrátu
- Úspěšná léčba pacientky s obstrukčním defekačním syndromem
- Mezenteriálna fibromatóza ako príčina náhlej príhody brušnej
- Doporučený postup pro diagnostiku a léčbu anémie u IBD
-
Dlouhodobé výsledky terapie infliximabem u pacientů s ulcerózní kolitidou
Pokračování studií ACT-1 a ACT-2 - Flexibilní ezofagogastroskopie – jakých nálezů si má všímat gastroenterolog v hypofaryngu a hrtanu?
- Endoskopická polypektomie – jak dosáhnout standardu kvality v roce 2012?
- Liečba spontánnej baktériovej peritonitídy
-
Kvalita života je důležitým faktorem indikační rozvahy u nemocných s karcinomem pankreatu
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Defekografie
- Zácpa a hypofunkce štítné žlázy. Mýtus nebo skutečnost?
- Syndrom solitárního rektálního vředu
- Liečba spontánnej baktériovej peritonitídy
