Neuroendokrinní nádory v gastroenterologické praxi
Neuroendocrine neoplasms in gastroenterologist practice
Gastrointestinal neuroendocrine neoplasms are relatively rare tumors. They are often slow growing tumors derived from the diffuse endocrine system. A number of synonyms have been used for these tumors. Neuroendocrine tumors are now classified according to their site of origin and defined broadly according to their differentiation, whether they are functional or nonfunctional, their proliferative rate in terms of mitotic rate or K-67 labelling index, and their malignant potential. Advances in imaging are 3-phase CT, MRI, double-balloon enteroscopy, capsule endoscopy, and somatostatin receptor imaging. Patients with neuroendocrine tumors should be taken care of by a multidisciplinary team.
Key words:
neuroendocrine neoplasm – neuroendocrine carcinoma – somatostatine receptors – carcinoid syndrome
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Submitted:
26. 10. 2015
Accepted:
22. 1. 2016
:
M. Šachlová
:
Gastroenterologické oddělení, Masarykův onkologický ústav, Brno
:
Gastroent Hepatol 2016; 70(3): 220-225
:
Digestive Endoscopy: Review Article
prolekare.web.journal.doi_sk:
https://doi.org/10.14735/amgh2016csgh.info04
Gastrointestinální neuroendokrinní neoplazie jsou relativně vzácné nádory. Rostou pomalu, histogeneticky jsou odvozeny od endokrinních buněk. V minulosti byly tyto nádory označovány různými názvy. Klasifikujeme je podle uložení, diferenciace, zda jsou funkční, či nefunkční, jaký mají imunohistochemický proliferační index, který se vyjadřuje prostřednictvím Ki-67, a jaký je maligní potenciál. V zobrazovacích metodách bylo dosaženo pokroků v CT, magnetické rezonanci, endosonografii, kapslové endoskopii, balonkové enteroskopii a scintigrafii somatostatinových receptorů/ octreoscanu. Základem péče o pacienta s neuroendokrinními nádory je multidisciplinární péče.
Klíčová slova:
neuroendokrinní neoplazie – neuroendokrinní karcinom – somatostatinové receptory – karcinoidový syndrom
Úvod
Definujícím znakem neuroendokrinních neoplazií (NEN) je endokrinní diferenciace buněk spojená se schopností produkovat, hromadit a uvolňovat biologicky aktivní látky hormonální povahy. Histogeneticky jsou odvozovány od endokrinních buněk gastrointestinálního traktu a Langerhansových ostrůvků pankreatu nebo spíše od prekurzorů těchto buněk. NEN mají odlišné chování v závislosti na embryonálním původu dané lokalizace. NEN je možné klasifikovat podle několika kritérií, podle typu hormonálních produktů jsou klasifikovány především nádory pankreatu.
Gastroenterolog se v zásadě setkává se dvěma situacemi. První situací jsou pacienti s hormonálními projevy NEN, kdy gastroenterolog hledá nádorové ložisko. Druhou situací je při vyšetření zjištěný tumor, který patolog verifikuje jako neuroendokrinní, a následuje další vyšetřovací algoritmus. Tato část textu se zabývá diagnostikou, případně endoskopickou terapií a prognózou NEN, aby usnadnila gastroenterologovi rozhodování. Onkologická léčba není předmětem sdělení.
Diagnostické a zobrazovací metody
Pro diagnostiku je důležité endoskopické vyšetření a biopsie. Při histopatologickém vyšetření je zásadní imunohistochemický průkaz synaptofyzinu a/ nebo chromograninu, event. i hormonálního produktu v nádoru. Nezbytné je stanovení imunohistochemického proliferačního indexu (tj. počtu buněk v buněčném cyklu), který se vyjadřuje procentuálně prostřednictvím indexu Ki-67 nebo pomocí monoklonální protilátky detekující Ki-67 v oblastech s nejvyšší proliferací, tzv. hotspots nádoru, a stanovení mitotického indexu – počtu mitóz na 10 HPF (high power fields). Podle těchto kritérií jsou NEN klasifikovány (tab. 1.) [1]. Kooperativní pracovní skupina pro neuroendokrinní nádory prosazuje tzv. druhé čtení zkušeným patologem.
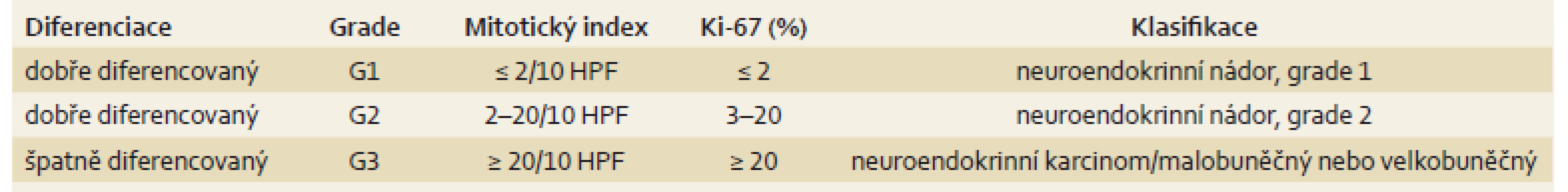
Toto rozdělení má svůj praktický význam, protože dobře diferencované nádory mívají somatostatinové receptory, a proto jsou dobře zobrazitelné na scintigrafii somatostatinových receptorů/ octreoscanu, avšak vzhledem k nižší proliferační aktivitě nebývají zobrazitelné na pozitronové emisní tomografii (PET). Vyšetření je založeno na vazebné afinitě somatostatinových analogů k somatostatinovým receptorům typu 2 a 5. Špatně diferencované nádory dobře akumulují značenou glukózu, proto jsou dobře zobrazitelné na PET, ale nemají somatostatinové receptory.
Z dalších vyšetření je to např. transabdominální ultrasonografie, která se uplatňuje spíše v detekci jaterních metastáz. Endosonografie (EUS) a intraoperační ultrasonografie má vysokou senzitivitu zvláště u nádorů pankreatu. Vysokou senzitivitu mají také dynamická, kontrastem zvýrazněná magnetická rezonance (MR). Z dalších metod má uplatnění bifázické CT vyšetření nebo multidetektorové CT, enteroklýza, balonková enteroskopie či kapslová enteroskopie.
Laboratorní metody
Negativní laboratorní výsledky neznamenají automaticky nepřítomnost nádoru, neboť se mohou uplatňovat některé faktory maskující jeho průkaz. Nefunkční nádory se neprojevují hormonálně podmíněnými syndromy, ale mohou často produkovat řadu polypeptidů, které lze detekovat laboratorně. Řada NEN nevykazuje sekreční aktivitu nebo produkuje látky, které běžně nestanovujeme. Někdy se „funkčnost“ nádoru projeví, až nádorová masa doroste do určitého objemu [2].
Nespecifické markery
Chromogranin A (CgA) je zvýšen u neuroendokrinních nádorů (NET) a jejich metastáz bez ohledu na jejich lokalizaci, senzitivita je 70–95 % a specifita 70–80 %. Zhruba koreluje s nádorovou masou, je nezávislým prediktorem přežití. Je výhodný i tam, kde je jiný marker nespolehlivý nebo se jeho hladiny rychle mění. V praxi je užitečný i u endokrinně nefunkčních nádorů. Může být falešně pozitivní při renální insuficienci a také při užívání inhibitorů protonové pumpy (IPP), ty musejí být alespoň na tři týdny před odběrem vysazeny.
Neuron specifická enoláza zvýšená hladina je známkou rozpadu nádorových buněk a může být indikátorem vyšší malignity.
Choriový gonadotropin může být zvýšený u nemocných s maligními pankreatickými NET.
Specifické humorální markery
Ze specifických humorálních působků a jejich metabolitů se uplatňuje stanovení inzulinu, glukagonu, gastrinu, somatostatinu, vazoaktivního střevního peptidu a kyseliny 5-hydroxyindoloctové (HIOK) v moči, což je metabolit serotoninu. Moč se sbírá 24 hod po dvoudenní dietě bez banánů, avokáda, oříšků a kakaa, je potřeba vynechat i kiwi, ananas, švestky, datle, rajčata a alkohol [2]. Hodnotu HIOK může zvyšovat efedrin, diazepam, fenacetin, paracetamol, laboratorní hodnotu snižují aspirin, heparin, metyldopa nebo tricyklická antidepresiva. Do moči se přidává 10 ml 12,5% HCl.
Endokrinní syndromy (karcinoidový syndrom, syndrom hyperinzulinizmu, hyperglukagonizmu, hypergastrinizmu aj.)
Podle neregulované hormonální nadprodukce se odvíjejí příznaky a klinický obraz.
Karcinoidový syndrom je způsoben nadprodukcí serotoninu. Projevuje se zčervenáním v obličeji a ve výstřihu, průjmovitou stolicí několikrát denně, zvýšeným krevním tlakem a bronchokonstrikcí. Příznaky se mohou vyskytovat i izolovaně. Záchvat může vyprovokovat doušek piva, fyzická námaha, duševní pohnutí nebo tlak na játra. Při delším trvání dochází k subendokardiální fibróze s chlopenními vadami a zmnožení vaziva v dutině břišní [2].
Neuroendokrinní nádory žaludku
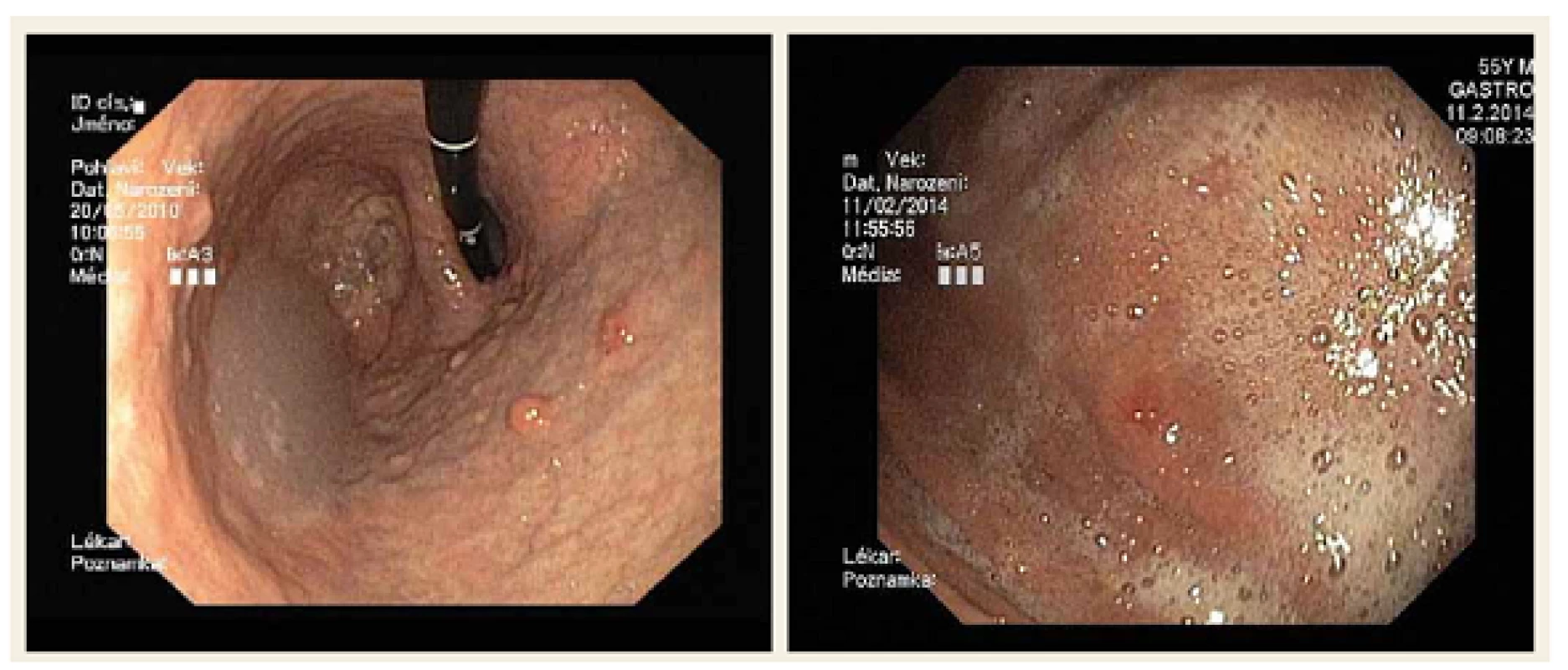
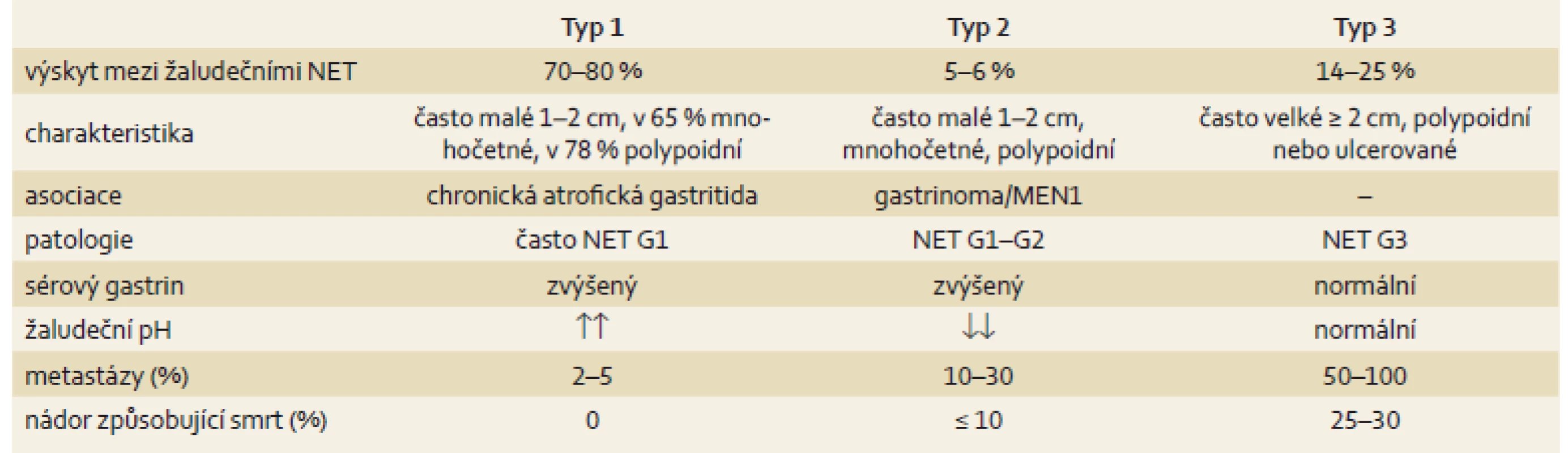
V žaludeční lokalizaci se častěji než nádory z buněk produkujících serotonin vyskytují nádory z buněk enterochromafinním podobných produkující histamin. Prvním typem je NET ve vícečetných drobných ložiscích, která mají vzhled do 5 mm velkých prominencí. Detekované léze se mohou nacházet v náhodných necílených biopsiích (mikrokarcinoid). Jsou rozmístěny převážně ve fundu a těle žaludku. Jsou častější u žen. Nádor souvisí s hypergastrinemií, ke které dochází v rámci chronické autoimunitní gastritidy typu A. NET prakticky nemetastazuje, není hormonálně aktivní. Pacient má někdy pocity plnosti, což může souviset s poruchou vyprazdňování žaludku. Nedostatek HCl způsobuje poruchu vstřebávání vitaminu B12 a železa. Podávání IPP je nevhodné. Má být vyšetřena hladina protilátek antiparietal cell a antiintrinsic factor, které jsou u chronické atrofické gastritidy zvýšené. Vyšetřuje se také přítomnost Helicobacter pylori (obr. 1).
Další typ je velmi vzácný, kdy se NET objevuje v rámci mnohočetné endokrinní adenomatózy ještě s jinými nádory, jako jsou nádory příštítných tělísek a hypofýzy. Vyvíjí se jako reakce na hypergastrinemii v rámci Zollinger-Ellisonova syndromu, často v rámci MEN-1 (mnohočetná neuroendokrinní neoplazie). Má průměr 1 – 2 cm. Podávání IPP je plně indikováno [1,4].
Léčbou první volby u typu 1 a 2 je endoskopická resekce, resp. mukosektomie. U lézí s uzlinovým postižením nebo prorůstajícím do svalové vrstvy je indikace k resekci žaludku. U typu 1 má endoskopická resekce (léze do 1 cm, grading 1) stejné výsledky při observaci bez endoresekce jako endoresekce v první době [3].
Třetí typ představuje sporadický nádor, bývá větší než 2 cm, je polypoidního nebo vředovitého vzhledu. Často se projeví komplikacemi, jako je krvácení z horní části zažívacího traktu, penetrací nebo perforací vředu. Chová se maligně, v histopatologickém vyšetření je vysoké Ki-67, infiltrativní růst. Častěji je zjištěn u mužů starších 50 let. Často recidivuje a tvoří vzdálené metastázy. Hormonální aktivita není obvyklá, vzácně se projevuje atypickým karcinoidovým syndromem z nadprodukce histaminu. Pacienta přivádí k vyšetření bolest, váhový úbytek či chudokrevnost z nedostatku železa (tab. 2).
Diagnostika se opírá o gastroskopický nález a histologické vyšetření. U asymptomatických pacientů jsou nádorové léze zjištěny náhodně. U typu 1 a 2 jsou vhodné dvě biopsie z antra a čtyři z fundu, endoskopické odstranění polypů je dostatečné. Vhodná je EUS před endoskopickou resekcí, má být provedena vždy před endoskopickou resekcí lézí nad 2 cm. EUS má senzitivitu v detekci malých lézí více než 80 %, CT, MR a octreotidový scan jsou vhodná vyšetření pro typ 2 vzhledem k možné souvislosti s mnohočetnou neuroendokrinní neoplazií (MEN). Minimální laboratorní sledování typu 1 a 2 zahrnuje sérový gastrin a CgA. Souvislost může být s autoimunitní tyreoiditidou. Genetické testování je doporučeno při podezření na MEN-1 nebo při mnohočetných tumorech bez přítomnosti atrofické gastritidy [4].
Neuroendokrinní nádory pankreatu
Přibližně 30 – 40 % je hormonálně nefunkčních, což znamená, že se neprojevují hormonálně podmíněnými symptomy. Sekrece některých hormonů nemusí být provázena klinickými příznaky nebo je sérová koncentrace tak nízká, že nezpůsobí vznik symptomů [6].
Imunohistochemicky mohou vykazovat pozitivitu inzulinu nebo pankreatického polypeptidu. Nejčastěji se vyskytují v šesté dekádě, dosahují větších rozměrů, jsou obvykle solitární a ve většině případů se chovají maligně. Vícečetné nádory jsou často spojeny se syndromem MEN-1.
NET pankreatu a také duodena jsou silně vaskularizované a v časné arteriální fázi se zobrazují jako hyperdenzní ložiska. MR se používá spíše jako metoda druhé volby při alergii na kontrastní látku nebo k upřesnění CT nálezu, protože má horší dostupnost a vyšší ekonomickou náročnost. Výtěžnost sonografického vyšetření zvyšuje použití kontrastní látky (CEUS – contrast enhanced ultrasound), význam má i pooperační ultrazvukové vyšetření. EUS dokáže dobře zobrazit slinivku i cévní struktury (arteria a vena lienalis, vena portae, arteria a vena mesenterica superior, truncus coeliacus). Hodnotitelné jsou uzliny v okolí pankreatu, truncus coeliacus, duodena a subhepatální oblasti. Omezujícím faktorem této metody jsou resekční výkony na žaludku a obstrukce v oblasti pyloru. Výhodou této metody je i tenkojehlová biopsie ložiska [5].
Nefunkční NET do 2 cm mají biologické chování benigní a v individuálních případech je možné volit konzervativní postup. V prvním roce je vhodné sledovávání v intervalu třech měsíců, následně od šesti měsíců do tří let, pak individuálně [6].
Funkční nádory pankreatu se označují podle typu hormonálního produktu [7]. Inzulinom je nejčastější nádor Langerhansových ostrůvků. Obvykle jde o solitární malé kulovité ložisko do 2 cm, častěji vykazuje benigní chování. Inzulinomy se vyskytují ve středním věku a častěji u žen. Pokud jsou vícečetné v rámci MEN-1, bývají maligní. Vzácně se NET produkující inzulin může vyskytnout v duodenu, ileu a plíci.
Gastrinom se vyskytuje v tzv. gastrinomovém trojúhelníku (duodenum, hlava pankreatu a hepatoduodenální ligamentum), častěji ve středním věku a u mužů, většinou vykazuje maligní chování.
Nádory pankreatu mohou rovněž produkovat serotonin s karcinoidovým syndromem. Vzácná je produkce glukagonu se zvýšenou hladinou cukru, dále je vzácná produkce somatostatinu (tab. 3).
![Přehled některých neuroendokrinních nádorů pankreatu. Upraveno dle [2,7].
Tab. 3. An overview of some neuroendocrine tumours of the pancreas. Adapted from [2,7].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/9b46372a0caef00ae86f17ebfe182689.png)
Neuroendokrinní nádory duodena
Více než 90 % duodenálních NET je umístěno v proximální části duodena D1 a D2. Asi 20 % duodenálních NET je lokalizováno v oblasti Vaterské papily, kde může být příčinou obstrukčního ikteru nebo recidivujících pankreatitid. Většinou jsou malé velikosti do 1,5 cm, lokalizované na sliznici a podsliznici. Metastazují asi ve 40 – 60 % případů do uzlin, v necelých 10 % do jater [8]. Pacienta přivádí k lékaři dyspepsie, bolest, žloutenka, anémie, průjem nebo známky obstrukce. Symptomy Zollinger-Ellisonova syndromu jsou přítomny asi v 10 % a vzácný je Cushingův syndrom. Periampulární NET jsou často asociovány s Reckling-hausenovou chorobou (obr. 2 a 3).
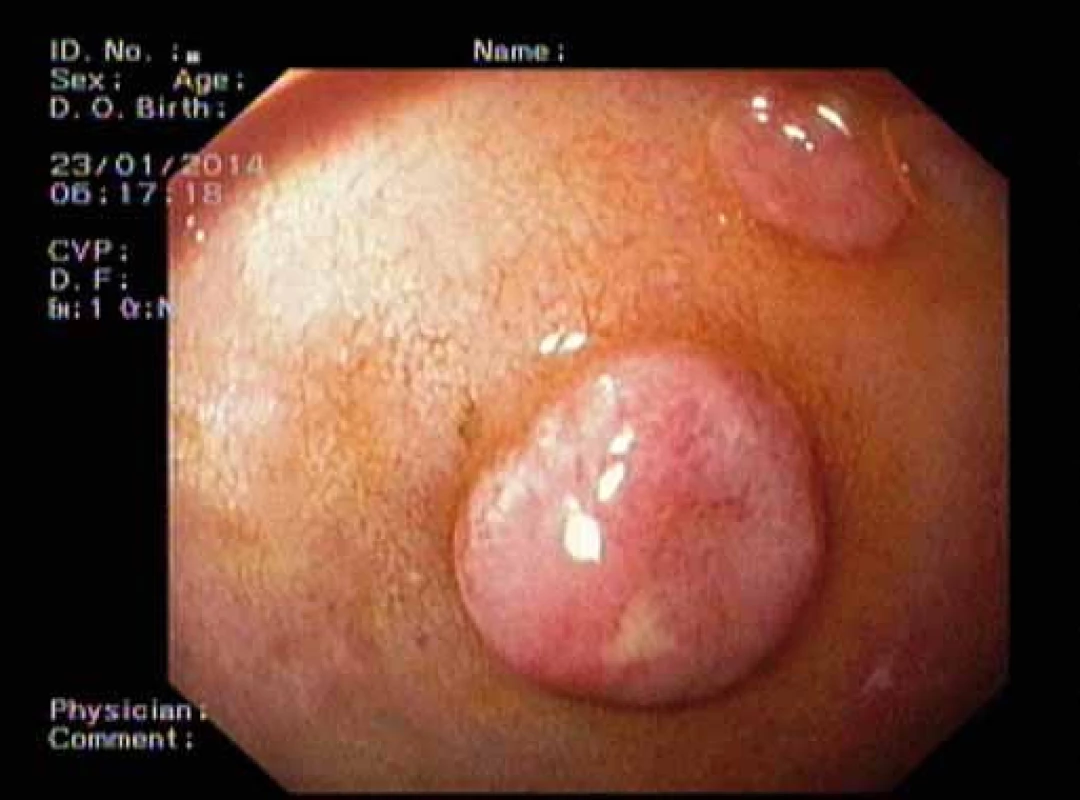
Základní metodou je endoskopické vyšetření vč. EUS před plánovanou resekcí. CT, MR a octreotidový scan jsou metody vhodné ke sledování šíření nemoci. Laboratorně se vyšetřuje CgA, případně sérový gastrin, somatostatin, kortizol, případně HIOK v moči dle symptomů pacienta a imunologického vyšetření bioptického vzorku [9]. Somatostatin, gastrin, CgA, glukagon, inzulin a glukóza jsou vhodné při podezření na syndrom MEN-1. Pacienti s Recklinghausenovou chorobou mohou mít zvýšenou hladinu somatostatinu, CgA a kalcitoninu [4].
Neuroendokrinní nádory tenkého střeva
Gastroenterolog se může setkat s tímto nálezem při vyšetření distálního ilea jako součást kolonoskopie. NET tenkého střeva je téměř vždy maligní. Nejčastěji je lokalizován v distálním ileu nebo v ileocékální oblasti. Velmi často je endokrinně aktivní, zakládá vzdálené metastázy, lokálně recidivuje [10]. Pacient přichází pro bolest břicha, někdy jsou subjektivní příznaky mylně interpretovány jako dráždivý tračník. Dalším znamením mohou být příznaky ischemie střeva a flush [11].
Neuroendokrinní nádory tlustého střeva
Nádory tlustého střeva jsou v době zjištění v 30 – 40 % metastatické, protože nemají žádné hormonální projevy [12]. Metastázy jsou nejčastěji v játrech, v uzlinách, na mezenteriu a peritoneu. Pětileté přežití je kolem 43 – 50 % [13]. Průměrný věk v době diagnózy je 55 – 65 let. Tumory lokalizované v pravostranném tračníku mají horší prognózu. Zvláštní skupinu tvoří NET apendixu viz dále. Nádory v tlustém střevě nebývají multifokální. V rámci mnohočetné adenomatózy se nevyskytují. Je však nutné uvažovat o adenokarcinomu tlustého střeva jako o nádorové duplicitě u osob z karcinomových rodin, zejména u jedinců starších 40 let. Pacienta přivádí k lékaři průjem, bolest břicha, krevní ztráty, hubnutí [14 – 16].
Malé polypy do 1 cm, pokud jsou odstraněny kompletně, nemetastazují a je možné je odstranit endoskopicky. Je vhodné označit místo po polypektomii spotem. Centrální vkleslina nebo ulcerace znamená vyšší maligní potenciál [12].
Neuroendokrinní nádory apendixu
Zvláštní skupinu tvoří NET apendixu, které jsou zjištěny nejčastěji při appendektomii pro zánětlivé změny. Uvádí se incidence asi 3 – 5/ 1 000 appendektomií. Má dobrou prognózu. Lokální onemocnění znamená přežití pět let v 95 – 100 %, regionální postižení v 85 – 100 % a několik případů se vzdálenými metastázami přežití pět let ve 25 %. Extenzivní růst může provázet bolest břicha nebo příznaky střevní obstrukce. Příznaky karcinoidového syndromu jsou vzácné a znamenají přítomnost metastáz. Pokud má nádor velikost do 1 cm, není přítomno prorůstání do subserózy a je provedena R0 resekce, potom není nutná další operace a appendektomie je dostatečným léčebným zákrokem. Většina tumorů je lokalizována ve vrcholu apendixu. Pravostranná hemikolektomie je indikována pro tumory velikosti 1 – 2 cm, ale s pozitivními nebo nejasnými okraji nebo s invazí dle klasifikace ENETS T2, vyšší proliferací grade 2 a/ nebo angioinvazí. Tumory větší než 2 cm jsou indikované k pravostranné hemikolektomii [11].
Rektální neuroendokrinní tumory
Podle dat SEER (Surveillance Epidemiology, and End Results) z let 1992 – 1999 tvoří rektální NET 27,44 % všech NET, což představuje nárůst ve výskytu v porovnání se staršími údaji z let 1973 – 1991, kdy tvořily jen 15,33 % [14,15]. Možnou příčinou je zlepšení diagnostických možností. Průměrný věk zjištění je 56 let. Asi ve 40 % jsou zjištěny náhodně při endoskopickém vyšetření. Někdy se manifestují přítomností krve ve stolici, rektálním syndromem (tenesmy, dyskomfort, bolest), vzácně projevy střevní obstrukce. Endokrinně jsou němé [16]. Rektální tumory jsou obvykle malé polypoidní léze lokalizované asi ve 4 – 20 cm nad linií dentata na přední nebo laterální straně rekta. Vyrůstají z hlouběji uložených částí slizničních žlázek. Mají vzhled hladkých, okrouhlých submukózních uzlů nebo fokálních ložisek, ztluštění submukózy, normální či žlutavé barvy. Jsou velké od několika milimetrů do několika centimetrů.
Malé tumory do 1 cm zřídka metastazují, nádory velikosti 1 – 1,9 cm metastazují do jater v 6 % a endoskopické odstranění nebo transrektální endoskopická mikrochirurgie jsou kurativní léčebné postupy [15,17]. Velké tumory mají maligní potenciál, metastazují do kostí, uzlin nebo jater. Mezi další prognostické faktory patří hloubka invaze, lymfovaskulární invaze a vysoká mitotická aktivita. Rektální tumory s rizikovými prognostickými faktory jsou indikované k přední resekci rekta a následuje sledování i při „kurativní“ resekci [18,19]. Endokrinně jsou němé i metastázy do jater, později se projevují hepatomegalií, bolestmi břicha v horním kvadrantu, nechutenstvím, hubnutím, slabostí. Karcinoidový syndrom nebývá vyjádřen [20]. Pětileté přežití je u lokalizovaného tumoru 87 %, při regionálním postižení 41 %, při vzdálených metastázách 25 %.
Transrektální EUS je užitečná před operací nebo endoskopickém odstranění, vyšetření může ukázat velikost nádoru, hloubku invaze a případné postižení pararektálních lymfatických uzlin [21]. Octreotidový scan může být negativní.
Závěr
NET zažívacího traktu nejsou časté, ale je potřeba na ně při vyšetření pacienta myslet. Hormonální projevy mohou být pestré, ale také žádné. Je potřeba odlišit příznaky neurovegetativní lability od příznaků NET. Důležité je endoskopické vyšetření a dále histologické vyšetření, které hodnotí zkušený patolog. Základem péče o pacienta s NET je multidisciplinární péče, kdy je v týmu chirurg, endokrinolog, gastroenterolog, onkolog, radiodiagnostik a lékař z nukleární medicíny. S některými typy nádorů se běžný gastroenterolog setká jen jednou za život.
Autorka děkuje kolegovi z Masarykova onkologického ústavu, MU Dr. Ivo Novotnému, CSc., za zapůjčení obr. 1 – 3.
Podpořeno MZ ČR - RVO (MOÚ, 00209805).
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 26. 10. 2015
Přijato: 22. 1. 2016
MU Dr. Milana Šachlová, Ph.D., CSc.
Gastroenterologické oddělení
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
sachlova@mou.cz
Sources
1. Sedláčková E. Neuroendokrinní nádory. In: Tomášek J et al (eds). Onkologie – minimum pro praxi. Praha: Axonite 2015 : 237 – 250.
2. Louthan O. Neuroendokrinní nádory. Praha: Grada Publishing 2006 : 22 – 216.
3. Delle Fave G, Kwekkeboom DJ, Van Cutsem E et al. ENETS consensus guidelines for the management of patients with gastroduodenal neoplasms. Neuroendocrinology 2012; 95(2): 74 – 87. doi: 10.1159/ 000335595.
4. Scherübl H, Cadiot G, Jensen RT et al. Neuroendocrine tumor of the stomach (gastric carcinoids) are on the rise: small tumors, small problems? Endoscopy 2010; 42(8): 664 – 671. doi: 10.1055/ s-0030-1255564.
5. Falconi M, Bartsch DK, Eriksson B et al. ENETS consensus guidelines for the management of patients with digestive neuroendocrine neoplasms of the digestive system: well-differentiated pancreatic non-functioning tumors. Neuroendocrinology 2012; 95(2): 120 – 134. doi: 10.1159/ 000335587.
6. Novotný I. Endoskopická retrográdní cholangiopankreatikografie (ERCP) a endoskopická ultrasonografie (EUS). In: Kala Z et al (eds). Nádory podjaterní oblasti. Diagnostika a léčba. Praha: Grada Publishing 2009 : 45 – 55.
7. Jensen TR, Cadiot G, Brandi ML. ENETS Consensus guidelines for the management of patients with digestive neuroendocrine neoplasms: functional pancreatic endocrine tumor syndromes. Neuroendocrinology 2012; 95(2): 98 – 119. doi: 10.1159/ 000335591.
8. Hoffmann KM, Furukawa M, Jensen RT. Duodenal neuroendocrine tumors: classification, functional syndromes, diagnosis and medical treatment. Best Pract Res Clin Gastroenterol 2005; 19(5): 675 – 697.
9. Witzigmann H, Loracher C, Geissler F et al. Neuroendocrine tumours of the duodenum: clinical aspects, pathomorphology and therapy. Langenbecks Arch Surg 2002; 386(7): 525 – 533.
10. Lukáš M. Diagnostické postupy u karcinoidů v gastrointestinální lokalizaci. In: Petruželka L (ed). Karcinoid. Praha: Maxdorf 2004 : 25 – 29.
11. Pape UF, Perren A, Niederle B et al. ENETS consensus guidelines for the management of patients with neuroendocrine neoplasms from the jejuno-ileum and the appendix including goblet cell carcinomas. Neuroendocrinology 2012; 95(2): 135 – 156. doi: 10.1159/ 000335629.
12. Caplin M, Sundin A, Nillson O et al. ENETS consensus guidelines for the management of patients with digestive neuroendocrine neoplasms: colorectal neuroendocrine neoplasms. Neuroendocrinology 2012; 95(2): 88 – 97. doi: 10.1159/ 000335594.
13. Niederle M, Hackl M, Kaserer K et al. Gastroenteropancreatic neuroendocrine tumours: the current incidence and staging based on the WHO and European neuroendocrine tumour society classification: an analysis based on prospectively collected parameters. Endocr Relat Cancer 2010; 17(4): 909 – 918. doi: 10.1677/ ERC-10-0152.
14. Modlin IM, Lye KD, Kidd M. A 5-decade analysis of 13 715 carcinoid tumours. Cancer 2003; 97(4): 934 – 959.
15. Modlin IM, Kidd M, Latich I et al. Current status of gastrointestinal carcinoids. Gastroenterology 2005; 128(6): 1717 – 1751.
16. Louthan O. Neuroendokrinní nádory rekta. Klin Onkol 2009; 22(5): 195 – 201.
17. Kinoshita T, Kanehira E, Omura K et al. Transanal endoscopic microsurgery in the treatment of rectal carcinoid tumor. Surg Endosc 2007; 21(6): 970 – 974.
18. Onozato Y, Kakizaki S, Lizuka H et al. Endoscopic treatment of rectal carcinoid tumors. Dis Colon Rectum 2010; 53(2): 169 – 176. doi: 10.1007/ DCR.0b013e3181b9db7b.
19. Ramage JR, Gooretzki PE, Manfredi R et al. Consensus guidelines for the management of patiens with digestive neuroendocrine tumours: well-differentiated colon and rectum tumour/ carcinoma. Neuroendocrinology 2008; 87(1): 31 – 39.
20. Oberg K. Neuroendocrine gastrointestinal tumours. Ann Oncol 1996; 7(5): 453 – 463.
21. Matsumoto T, Iida M, Suekane H et al. Endoscopic ultrasonography in rectal carcinoid tumors: contribution to selection of therapy. Gastrointest Endosc 1991; 37(5): 539 – 542.
Labels
Paediatric gastroenterology Gastroenterology and hepatology SurgeryArticle was published in
Gastroenterology and Hepatology
2016 Issue 3
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole vs. Tramadol in Postoperative Analgesia
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Spasmolytic Effect of Metamizole
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Digestive endoscopy and endotherapy
- Renaissance of cholangiopancreatoscopy and new ways of intraductal endoscopic therapy
- Therapeutic endosonography – current position
- Endoscopic management of sigmoid volvulus
- Neuroendocrine neoplasms in gastroenterologist practice
- First submucosal endoscopic tunnelling resection of a subepithelial tumour (GIST) in the Czech Republic
- Lymphoma mimicking GIST
- Colon stenosis of unexplained etiology
- Utility of a panel of gene mutations and amplifications for estimation of prognosis in patients with gastric cancer
- Recommendation of surgical treatment in patientswith inflammatory bowel diseases – part 3: ulcerative colitis, indications for surgery
- The 38th Czech and Slovak Endoscopic Days
- 15th Czech-Slovak IBD symposium and IBD work ing days, Hořovice 2016
- The selection from international journals
- The Mutaflor® – Escherichia coli (Nissle 1917), serotype O6:K5:H1 – the best researched probiotic available
- Severe (complicated) hepatitis A in Cotonou (Benin) concerning an incompletely vaccinated Spanish expatriate
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Colon stenosis of unexplained etiology
- The Mutaflor® – Escherichia coli (Nissle 1917), serotype O6:K5:H1 – the best researched probiotic available
- Endoscopic management of sigmoid volvulus
- Neuroendocrine neoplasms in gastroenterologist practice
