Primární extragonadální germinální nádory u mužů Analýza souboru z let 1994–2008
Primary extragonadal germ cell tumours in men - analysis of patients treated from 1994 to 2008 in a single institution.
Patients with extragonadal germ cell tumours have poor prognosis because of the relative chemoresistance of these tumours and often advanced stage with multiple organ dissemination at diagnosis. The optimal treatment strategy for extragonadal germ cell tumours is unclear. We have retrospectively analysed 19 men with germ cell tumours originating in the mediastinum or the retroperitoneum. Median overall survival of our patients was 25.9 months. Seven of the 19 patients (37 %) are alive, including 2 who are still undergoing treatment and 5 (26 %) who are alive and free of disease. Our results imply that, despite worse prognosis of these patients as compared to the outcome in patients with a testicular primary, long-term disease-free survival is possible even if complete remission is not achieved by first-line treatment.
Key words:
extragonadal, germ cell, tumour, chemotherapy.
Authors:
T. Büchler; M. Foldyna; J. Nepomucká; M. Kupec; Z. Donátová; P. Kubánková; E. Voršilková; D. Kordíková; J. Mendelová; J. Abrahámová
Authors‘ workplace:
Fakultní Thomayerova nemocnice a 1. lékařská fakulta Univerzity Karlovy, Praha
; Primář: Prof. MUDr. Jitka Abrahámová, DrSc.
; Onkologické oddělení
Published in:
Prakt. Lék. 2008; 88(10): 578-581
Category:
Of different specialties
Overview
Pacienti s extragonadálními germinálními nádory mají nepříznivou prognózu pro relativní chemorezistenci těchto nádorů a často velmi pokročilé stádium s mnohočetnou orgánovou diseminací již v době diagnózy. Optimální terapie primárních extragonadálních nádorů zatím nebyla definována. V retrospektivní studii jsme analyzovali charakteristiku a výsledky terapie 19 mužů s primárním extragonadálním germinálním tumorem retroperitonea nebo mediastina. Medián celkového přežívání pacientů z našeho souboru je 25,9 měsíce. Celkem přežívá 7/19 pacientů (37 %). Dva ze sedmi přežívajících pacientů pokračují v terapii, pět (26 %) je bez příznaků aktivní malignity. Z našich výsledků vyplývá, že navzdory relativně nepříznivé prognóze, lze u pacientů s extragonadálními germinálními nádory dosáhnout trvalou remisi, a to i tehdy, když léčbou 1. linie není dosaženo kompletní remise.
Klíčová slova:
extragonadální, germinální, nádor, chemoterapie.
Úvod
Primární extragonadální nádory jsou zřídkavě se vyskytující malignitou a tvoří asi 2 až 5 % všech germinálních nádorů u mužů. Nejčastěji vznikají v retroperitoneu, mediastinu nebo v pineální žláze. Pacienti s extragonadálními nádory mají podstatně horší prognózu než pacienti s testikulárními germinálními nádory. Podílí se na tom jak relativní chemorezistence těchto nádorů, tak pozdní diagnóza, často ve velmi pokročilém stádiu s mnohočetnou orgánovou diseminací. Pokud dojde k relapsu extragonadálního germinálního tumoru, záchranná chemoterapie je většinou neúčinná (1).
Příčiny a patogeneze extragonadálních germinálních nádorů nebyly objasněny. V současnosti je obecně přijímaná teorie, že tyto nádory vznikají ze pluripotentních zárodečných buněk, které se buď fyziologicky nachází v orgánech jako jsou játra, thymus či mozek, anebo zůstávají v strukturách střední čáry při poruše migrace kmenových buněk v embryonálním období (2). Je možné, že část extragonadálních nádorů vzniká v zárodečním epitelu gonád, ale po metastatickém rozšíření nádorových buněk do retroperitonea nebo mediastina dojde k zániku primárního testikulárního nádoru.
Histologie extragonadálních nádorů odpovídá germinálním nádorům varlat. Zatímco však asi 45 % testikulárních nádorů tvoří seminomy a 55 % neseminomové nádory, u extragonadálních nádorů je podíl seminomů jen přibližně 15 %.
Společnou vlastností testikulárních a extragonadálních neseminomů je sekrece nádorových markerů alfafetoprotein (AFP) a choriogonadotropin (HCG) a častá přítomnost izochromozomu i(12p) (3). Existuje asociace mezi mediastinálními neseminomovými nádory a Klinefelterovým syndromem či hematologickými malignitami (4). Pacienti s extragonadálními nádory mají relativně vysoký výskyt preinvazivních neoplastických změn zárodečného epitelu testes, tzv. intratubulární germinální neoplazie (5, 6).
Systém TNM neposkytuje návod na stanovení stádia extragonadálních germinálních nádorů a prognostické faktory pro extragonadální nádory se neshodují s parametry v systému IGCCC, který se používá pro germinální nádory varlat.
V naší studií jsme vyhledali a retrospektivně analyzovali muže s extragonadálními germinálními nádory diagnostikované a léčené na našem oddělení od roku 1994. Cílem bylo stanovit význam vybraných vstupních parametrů před léčbou, zhodnotit účinnost léčby a posoudit efektivitu zobrazovacích a biochemických vyšetření po léčbě.
Pacienti a metody
Pacienti
Pacienti s extragonadálními germinálními nádory mediastina nebo retroperitonea byli identifikováni pomocí údajů v přírůstkové knize a v elektronické klinické databázi. V zájmu homogenity souboru byli zařazení jen muži s primárně mediastinálním nebo retroperitoneálním germinálním tumorem. Všichni zařazení pacienti absolvovali cílené ultrazvukové vyšetření na testes, testikulární biopsií, nebo měli orchiektomií. Pacienti, kteří byli vstupně diagnostikováni s primárním extragonadálním nádorem, ale následná vyšetření prokázala jistý nebo pravděpodobný testikulární původ nádoru, byli ze souboru vyloučeni.
Terapie a sledování pacientů
Standardní léčbou první linie byla chemoterapie režimem na bázi cisplatina-etopsid-bleomycin (BEP). Při operabilním reziduálním nádoru byla provedena retroperitoneální nodální disekce (RPLND). Pokud byl nádor inoperabilní, byla při perzistenci podávána chemoterapie 2. linie, nejčastěji režimem vinorelbin-ifosfamid-cisplatina (VeIP), u pacientů v dobrém klinickém stavu a s nádorovou odpovědí na chemoterapii 1. linie byla do léčby zařazena vysokodávkovaná chemoterapie režimem karboplatina-etopsid-cyklofosfamid (CARBOPEC) a autologní transplantace kostní dřeně. Standardním režimem 3. line byla chemoterapie paclitaxel-gemcitabin (PAGE). U vybraných pacientů byla alternativou k resekci nádorového rezidua cílená radioterapie.
Onkomarkery AFP, HCG a laktátdehydrogenáza (LDH) byly hodnoceny před zahájením chemoterapie, před každým cyklem terapie, po ukončení plánované chemoterapeutické série a v případě dispenzarizace 2–4x ročně. Vyšetření CT bylo prováděno před zahájením chemoterapie, po ukončení každé chemoterapeutické série a 1–4x ročně během dispenzarizace, a při klinickém nebo biochemickém podezření na relaps. Vyšetření pozitronovou emisní tomografií (PET) jsme indikovali u pacientů s inoperabilním nádorovým reziduem, pokud se dosáhla negativizace markerů, a při podezření na relaps.
Hodnocení klinické odpovědi
Kompletní odpověď (CR) byla definována jako normalizace všech morfologických a biochemických změn, včetně výsledku vyšetření PET. Částečná odpověď (PR) byla definována jako více než 50% redukce součtu ploch nádorových mas v transverzálním průřezu. Osobitně byly hodnoceny podskupiny pacientů s PR podle CT a negativizací onkomarkerů (M-PR) a negativitou PET (PET-PR). Progrese (PD) byla diagnostikována v případě zvětšení ploch nádorových mas v transverzálním průřezu o 25 % nebo více, anebo objevení nového nádorového ložiska.
Celkové přežívání bylo hodnoceno do úmrtí, anebo do posledního kontaktu s pacientem. Přežívání pacientů bylo hodnoceno pomocí Kaplan-Meierovy metody, srovnání mezi podskupinami, definovány podle známých nebo předpokládaných rizikových faktorů, bylo provedeno metodou log-rank test. Pokud došlo k úmrtí při nepřítomnosti nádoru, data byla k datu úmrtí pro potřebu statistické analýzy censurována.

Výsledky
Vstupní charakteristika pacientů
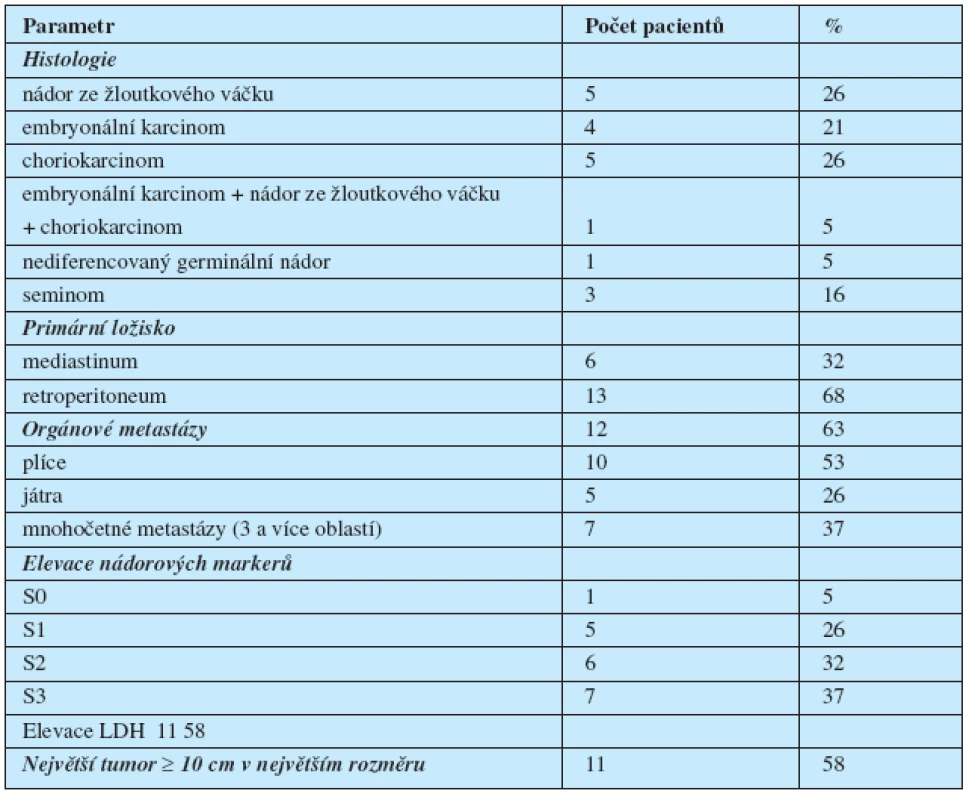
Nalezli jsme 19 pacientů s jednoznačnou diagnózou extragonadálního germinálního nádoru. Z nich 15 (79 %) mělo nádor neseminomového typu a 4 (21 %) nádor seminomového typu. U 6 pacientů (31 %) bylo primární ložisko v mediastinu a u 13 pacientů (69 %) v retroperitoneu.
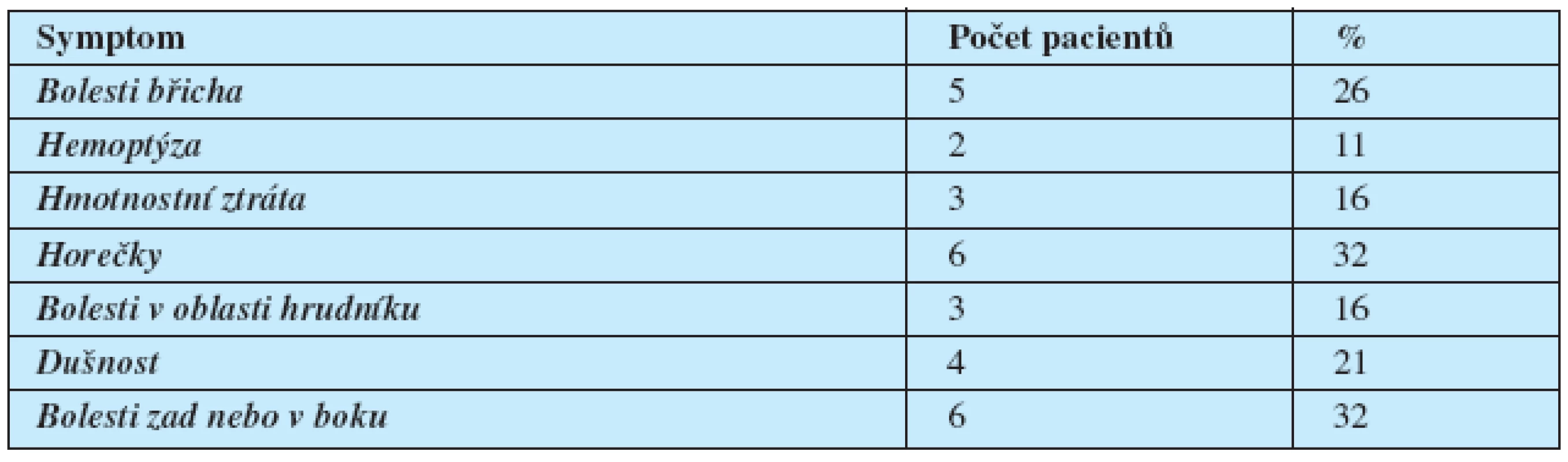
Medián věku byl 36 let (rozsah 19–52 let). Systémové symptomy svědčící pro velký celkový objem tumoru (ztráta hmotnosti, horečky, chřipkové symptomy) byly přítomné u 7 pacientů. Žádný z pacientů neměl vstupně metastázy do CNS.
Další vstupní charakteristiky souboru jsou uvedené v tabulce 1 a 2.
Výsledky léčby
Všichni pacienti absolvovali primární léčbu chemoterapií na bázi platinového cytostatika – 18 pacientů v režimu BEP a 1 pacient v režimu PVB. Čtyři z 18 pacientů léčených kombinací BEP dostali v rámci léčby první linie ještě jinou doplňkovou chemoterapií – 1x PAGE, 1x cisplatina-vinblastin-bleomycin (PVB), 1x vysokodávkovaný metotrexát, 1x vysokodávkovaná chemoterapie CARBOPEC.
Po chemoterapii 1. linie byl jen jeden pacient v kompletní remisi (později však dochází k relapsu), dva pacienti zemřeli na progresi v průběhu chemoterapie 1. linie, 16 pacientů dosáhlo parciální remisi (6 pacientů M-PR, z toho 3 pacienti měli také PET-PR, u 10 pacientů k úplné normalizaci onkomarkerů nedošlo).
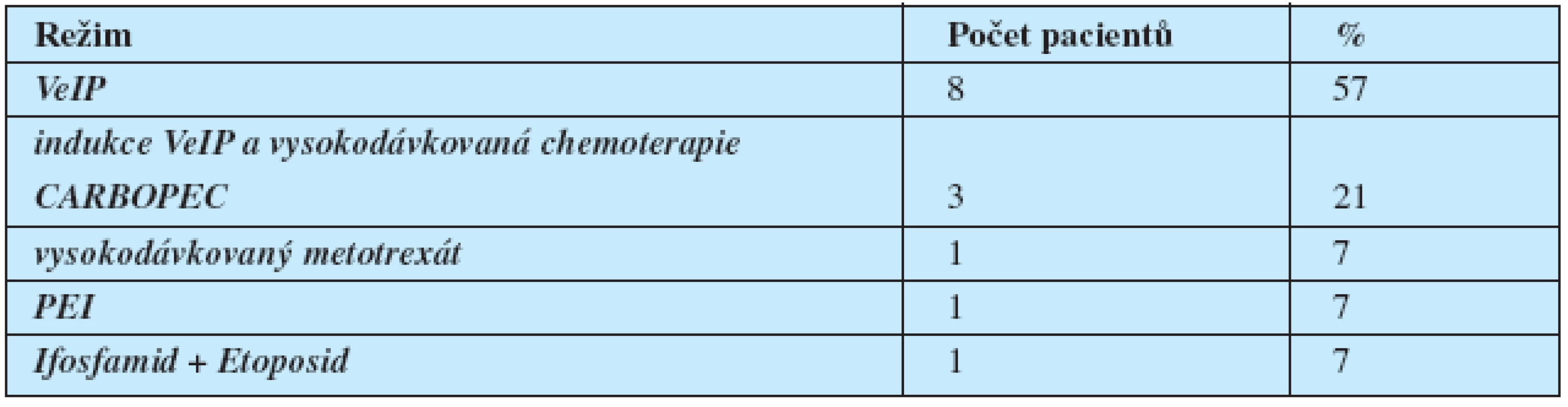
U 14 pacientů byla podána chemoterapie 2. linie, důvodem pro její podání byla u 9 pacientů M + PR, u 2 pacientů inoperabilní reziduální nádorová masa při negativitě markerů (jeden pacient měl vstupně marker-negativní seminom, a druhý relativně nízkou vstupní hladinu markerů vzhledem k vstupnímu rozsahu nemoci, takže negativita markerů byla relativně málo výpovědná), u 1 pacienta progrese z CR, u jednoho pacienta progrese z M-PR a u 1 pacienta nález viabilního nádoru při RPLND.
Celkem byla RPLND provedena u 5 pacientů – u jednoho pacienta se seminomem pro reziduální retroperitoneální masu po chemoterapii (výsledek: nekróza) a u 4 pacientů s neseminomovým nádorem při PR po léčbě 2. linie (u všech byla prokázána viabilní malignita a následně byli léčení další chemoterapií). Celkem tři pacienti s nedostatečnou odpovědí na léčbu 1. linie s perzistující elevací onkomarkerů byli vyléčeni záchrannou chemoterapií a přežívají bez známek nádoru.
Hodnocení přežívání a prognostických faktorů
Střední doba sledování pro přežívající pacienty je v současnosti 38 měsíců (6–95 měsíců). Medián celkového přežívání pacientů z našeho souboru je 25,9 měsíce. Celkem přežívá 7/19 pacientů (37 %). Dva z osmi přežívajících pacientů pokračují v systémové terapii, pět (26 %) je bez příznaků aktivní malignity. V našem souboru jsme nezaznamenali výskyt sekundární malignity. Jeden pacient zemřel v kompletní remisi nádoru na pozdní následky krvácení do mozku. Nejdéle přežívající pacienti jsou v kompletní remisi více než 8 let po diagnóze.
Ve statistické analýze jsme hodnotili následující známé nebo předpokládané prognostické faktory:
- věk,
- přítomnost systémových symptomů,
- mediastinální versus retroperitoneální tumor,
- seminom versus neseminom,
- vstupní elevace LDH,
- S stádium,
- přítomnost metastáz do jater.
Kromě seminomové histologie (příznivá prognóza, p=0,02) ani jeden z těchto parametrů nepredikoval statisticky signifikantně výsledek léčby a přežívání. Důvodem pro negativní výsledky statistické analýzy je nejspíše relativně malý počet pacientů v souboru, odůvodněný velmi nízkou incidencí extragonadálního germinálního nádoru. Významně lepší přežívání dosáhli pacienti, u kterých se podařilo dosáhnout léčbou negativizace PET (51 versus 21 měsíců, p=0,016) a normalizaci onkomarkerů (40 versus 11 měsíců, p=0,006).
Diskuse
Naše studie charakterizuje skupinu 19 mužů s primárním mediastinálním nebo retroperitoneálním germinálním nádorem a hodnotí výsledky jejich léčby.
Primární extragonadální germinální nádory jsou vzácné a mnoho publikovaných studí analyzuje malé kohorty pacientů, které navíc někdy zahrnují i pacienty s pineálními nádory, kterých léčba je odlišná, a pediatrické pacienty.
Zatím největší retrospektivní studie byla publikovaná v roce 2002 a obsahovala 635 pacientů z 11 nemocnic, kteří byly léčeni v období od 1975 do 1996 (3). Tato studie prokázala výrazně lepší prognózu seminomových extragonadálních nádorů ve srovnání s neseminomy. Nejhorší prognózu měli pacienti s neseminomovými nádory mediastina. Pravděpodobnost přežití pacientů s retroperitoneálním neseminomovým nádorem byla horší, než přežívání metastatických testikulárních seminomů, ale lepší než prognóza mediastinálních nádorů.
Nezávislé prognostické parametry pro extragonadální germinální nádory se nekryjí s prognostickými faktory testikulárních nádorů podle klasifikace IGCCC (7). S horším přežíváním koreluje neseminomová histologie, mediastinální primární tumor, přítomnost metastáz do CNS, přítomnost metastáz do jater, přítomnost metastáz do kostí a elevace HCG (odrážející přítomnost choriokarcinomové složky) (3). Je zajímavé, že celkové přežívání pacientu s neseminomovými nádory v této studii bylo významně vyšší než v menších publikovaných sériích (8) i v našem souboru. Domníváme se, že příčinou je pokročilejší stádium nádorů v naší skupině pacientů, například 66 % našich pacientů s neseminomovou histologií mělo vstupně metastázy do plic (v studii Bokemeyera 37 %) a 33 % metastázy do jater (ve srovnání se 16 %).
Není známo, zda strategie léčby pro testikulární nádory jsou optimální i v léčbě nádorů extragonadálních, zejména neseminomů. Podle předběžných výsledků může vysokodávkovaná chemoterapie aplikovaná v 1. linií zvýšit procento dlouhodobě přežívajících pacientů (9). Vysokodávkovaná chemoterapie v 2. linii podle analýzy Evropské transplantační skupiny EBMT dosahuje remisí až u 43 % s retroperitoneálními germinálnímí nádory, ale pouze u 14 % pacientů s mediastinálními nádory (10).
U části našich pacientů bylo ke sledování odpovědi na léčbu využíváno vyšetření PET. Zdá se, že PET dokáže spolehlivě identifikovat viabilní nádor seminomového typu (11). U neseminomových germinálních nádorů se zatím úloha PET nepotvrdila a procento falešně pozitivních i falešně negativních výsledků je vysoké (12), když publikované studie nehodnotí dostatečný počet pacientů. Další možná aplikace PET je pro časnou detekci pacientů s rezistencí na podávanou chemoterapii (13). Většina publikovaných studií zkoumajících využití PET u germinálních nádorů byla limitována malým počtem pacientů a krátkou dobou sledování, a proto PET zatím nemá pevné místo v jejich diagnostice a sledování. Studie provedené za účelem časného zjištění relapsu, charakterizace reziduálních tumorů a hodnocení predikativního významu vyšetření PET po chemoterapii přinesly protichůdné výsledky (14). Naše analýza skupiny pacientů s extragonadálními germinálními nádory svědčí pro využitelnost metody PET pro predikci dlouhodobého přežívaní pacientů po systémové chemoterapii.
Z našich výsledků vyplývá, že navzdory relativně nepříznivé prognóze lze u pacientů s extragonadálními germinálními nádory dosáhnout trvalou remisi, a to i tehdy, když léčbou 1. linie není dosaženo kompletní remise. Zásadnější zlepšení léčebných výsledků u pacientů nově diagnostikovaných i s relapsem však může přinést jen mezinárodní spolupráce v rámci multicentrických studií.
MUDr. Tomáš Büchler, Ph.D.
Onkologické oddělení
Fakultní Thomayerova nemocnice
Vídeňská 800
140 59 Praha 4
E-mail: tomas.buchler@ftn.cz
Sources
1. Abrahámová, J. Extragonadální germinální nádory. In: Abrahámová J., Povýšil C., Dušek L. a kol. Nádory varlat. Praha: Grada 2008.
2. Oosterhuis, J.W., Stoop, H., Honecker, F., Looijenga, L.H. Why human extragonadal germ cell tumours occur in the midline of the body: old concepts, new perspectives. Int. J. Androl. 2007, 30, 4, p. 256-263.
3. Bokemeyer, C., Nichols, C.R., Droz, J.P. et al. Extragonadal germ cell tumors of the mediastinum and retroperitoneum: results from an international analysis. J. Clin. Oncol. 2002, 20, 7, p. 1864-1873.
4. Hartmann, J.T., Nichols, C.R., Droz, J.P. et al. Prognostic variables for response and outcome in patients with extragonadal germ-cell tumors. Ann. Oncol. 2002, 13, 7, p. 1017-1128.
5. Daugaard, G., Rørth, M., von der Maase, H., Skakkebaek, N.E. Management of extragonadal germ-cell tumors and the significance of bilateral testicular biopsies. Ann. Oncol. 1992, 3, 4, p. 283-289.
6. Buchler, T., Freeman, A., Harland, S. Contralateral intratubular germ cell neoplasia in a patient with testicular cancer. Nat. Clin. Pract. Urol 2008, 5, 5, p. 284-288.
7. International Germ Cell Cancer Collaborative Group. International Germ Cell Consensus Classification: a prognostic factor-based staging system for metastatic germ cell cancers. J. Clin. Oncol. 1997, 15, 2, p. 594-603.
8. Hsu, Y.J., Pai, L., Chen, Y.C. et al. Extragonadal germ cell tumors in Taiwan: an analysis of treatment results of 59 patients. Cancer 2002, 95, 4, p. 766-774.
9. Kumano, M., Miyake, H., Hara, I. et al. First-line high-dose chemotherapy combined with peripheral blood stem cell transplantation for patients with advanced extragonadal germ cell tumors. Int. J. Urol. 2007, 14, 4, p. 336-338.
10. De Giorgi, U., Demirer, T., Wandt, H. et al. Second-line high-dose chemotherapy in patients with mediastinal and retroperitoneal primary non-seminomatous germ cell tumors: the EBMT experience. Ann. Oncol. 2005, 16, 1, p.146-151.
11. De Santis, M., Pont, J. The role of positron emission tomography in germ cell cancer. World J. Urol. 2004, 22, 1, p. 41-46.
12. Karapetis, C.S., Strickland, A.H., Yip, D. et al. Use of fluorodeoxyglucose positron emission tomography scans in patients with advanced germ cell tumour following chemotherapy: single-centre experience with long-term follow up. Intern. Med. J. 2003, 33, 9-10, p. 427-435.
13. Bokemeyer, C., Kollmannsberger, C., Oechsle, K. et al. Early prediction of treatment response to high-dose salvage chemotherapy in patients with relapsed germ cell cancer using [(18)F]FDG PET. Br. J. Cancer 2002, 86, 4, p. 506-511.
14. Hain, S.F. Positron emission tomography in uro-oncology. Cancer Imaging 2005, 5, 1, p. 1-7.
Labels
General practitioner for children and adolescents General practitioner for adultsArticle was published in
General Practitioner

2008 Issue 10
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Memantine Eases Daily Life for Patients and Caregivers
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
-
All articles in this issue
- Mentalizace
- Základní obecná klasifikační schémata dětských zlomenin
- Primární extragonadální germinální nádory u mužů Analýza souboru z let 1994–2008
- Syndrom Guillain-Barré Specifika intenzivní péče, možnosti terapeutického využití plazmaferézy a naše zkušenosti
- Historie a současnost registrace vrozených vad v České republice
- Netypický tumor nosohltanu ve vyšším věku – angiofibrom nosohltanu?
- Komunitní pneumonie
- General Practitioner
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Syndrom Guillain-Barré Specifika intenzivní péče, možnosti terapeutického využití plazmaferézy a naše zkušenosti
- Základní obecná klasifikační schémata dětských zlomenin
- Mentalizace
- Netypický tumor nosohltanu ve vyšším věku – angiofibrom nosohltanu?
