Příspěvek k laboratorním metodám likvidace protinádorových léčiv
A contribution to laboratory methods of destruction of anti-tumour pharmaceuticals
Methods suitable for the decontamination and destruction of selected anti-cancer drugs with possible genotoxic effects on hospital staff coming into contact with those drugs during their preparation, application or during contact with contaminated hospital wastes have been reviewed. These methods, developed in co-operation with our laboratories and verified by International Agency for Research on Cancer, are applicable to the following anti-cancer drugs: amsacrine, azathioprine, carmustine, chlorozotocine, cis-platin, cyclofosfamide, daunorubicin, dichlormethotrexat, doxorubicin, ifosfamid, lomustine, melphalan, 6-merkaptopurine, methotrexat, semustine, streptozotocine, 6-thioguanine, thiotepa, vincristine, and vinblastine. For their application on structurally similar anti-cancer drugs, it is necessary to first verify their chemical and biological effectiveness.
Key words:
Anti-tumour drugs, destruction, decontamination.
Authors:
J. Barek 1; V. Bencko 2; J. Novotný 3; J. Zima 1
Authors‘ workplace:
Přírodovědecká fakulta UK, Praha
katedra analytické chemie, UNESCO, laboratoř elektrochemie životního prostředí
Vedoucí katedry: prof. RNDr. Jiří Barek, CSc.
1; Univerzita Karlova v Praze, 1. LF a VFN, Ústav hygieny a epidemiologie
Přednosta: prof. MUDr. Vladimír Bencko, DrSc.
2; Onkologická klinika 1. LF UK a VFN, Praha
Přednosta: doc. MUDr. Luboš Petruželka, CSc.
3
Published in:
Prakt. Lék. 2008; 88(5): 255-258
Category:
Reviews
Overview
Je podán přehled metod likvidace vybraných protinádorových léčiv s možným genotoxickým působením na pracovníky, kteří jsou těmto látkám vystaveni během jejich přípravy, při podávání pacientům, či jsou v kontaktu s kontaminovaným odpadem. Tyto metody, které byly vypracovány a ověřeny v rámci projektů IARC, na nichž se podílela i naše pracoviště, jsou použitelné pro likvidaci následujících protinádorových léčiv: amsacrin, azathioprin, carmustin, chlorozotocin, cis-platina, cyklofosfamid, daunorubicin, dichlormethotrexat, doxorubicin, ifosfamid, lomustin, melphalan, 6-merkaptopurin, methotrexat, semustin, streptozotocin, 6-thioguanin, thiotepa, vincristin, vinblastin. Při jejich rozšíření na strukturně příbuzná protinádorová léčiva je třeba vždy předem ověřit jejich chemickou i biologickou účinnost.
Klíčová slova:
protinádorová léčiva, destrukce, dekontaminace.
Úvod
Rakovina patří k nejobávanějším nemocem naší civilizace. Proto je značný zájem odborné i laické veřejnosti soustředěn na problematiku vývoje a využití nejrůznějších typů protinádorových léčiv. Kromě své nezastupitelné role při léčení různých typů nádorových onemocnění mají však tyto látky i mnoho účinků nežádoucích pro zdraví pracovníků, kteří jsou těmto látkám vystaveni během jejich přípravy, při podávání pacientům, či jsou v kontaktu s kontaminovaným odpadem (4). Styk s chemickým karcinogenem vždy představuje určité ohrožení příslušného pracovníka. Toto riziko lze snížit jednak přísným dodržováním zásad pro práci s chemickými karcinogeny (8) a jednak vývojem a správným používáním metod pro likvidaci chemických karcinogenů či protinádorových léčiv (5). Cílem tohoto sdělení je podat přehled metod použitelných k likvidaci protinádorových léčiv s genotoxickými účinky, na jejichž vývoji se v rámci projektu koordinovaného Mezinárodní agenturou pro výzkum rakoviny (International Agency for Research on Cancer – IARC)) v Lyonu podílela i naše pracoviště.
Přehled metod likvidace protinádorových léčiv
Chemické metody použitelné k účinné likvidaci protinádorových léčiv jsou založeny na jejich konverzi na biologicky neškodné produkty nejčastěji na základě jejich hlubší chemické oxidace, redukce, či kyselé nebo alkalické hydrolýzy. Při jejich vývoji, na kterém se naše pracoviště úspěšně podílela, byl dodržován následující postup:
- Nejprve byla provedena podrobná rešerše týkající se biologických a chemických vlastností likvidované látky a metod jejího stanovení.
- Druhým krokem byl vývoj metod destrukce a analytických metod pro sledování jejich chemické účinnosti.
- Třetím krokem bylo ověření biologické účinnosti u metod chemicky účinných.
- Závěrem byl vypracován návrh standardních operačních postupů pro jednotlivé typy dekontaminace (tuhé látky, roztoky ve vodě, v různých typech organických rozpouštědel, dekontaminace povrchů, laboratorního skla, apod.).
Mezi dosud zkoumané metody likvidace protinádorových léčiv patří:
- a) Oxidace manganistanem draselným v kyselém či zásaditém prostředí. Její výhodou je jednoduchost provedení a poměrně široká použitelnost. Při této metodě však vadí oxidovatelné příměsi. Navíc je dvojmocný mangan slabě mutagenní, což komplikuje testy dokazující biologickou nezávadnost produktů provedené dekontaminace.
- b) Oxidace chlornanem sodným. Její výhodou je jednoduchost, možnost dekontaminace textilních materiálů a poměrně široká použitelnost.
- c) Oxidace peroxidem vodíku. Její nevýhodou je pouze omezená použitelnost.
- d) Kyselá či alkalická hydrolýza. Rovněž její nevýhodou je složitost provedení a omezená použitelnost.
- e) Oxidace Fentonovým činidlem. Její nevýhodou je složitější provedení a nebezpečí bouřlivého průběhu.
- f) Fotolýza.
Její výhodou je poměrně jednoduché praktické provedení a možnost kontinuálního provedení. Je však potřebná příslušná fotolytická cela.
Inspirací pro další vývoj metod použitelných k likvidaci a dekontaminaci protinádorových léčiv mohou být v tomto případě metody používané k laboratorní destrukci a dekontaminaci různých typů chemických karcinogenů, např. aflatoxinů, polycyklických aromatických uhlovodíků, N-nitrosaminů a N-nitrosamidů, hydrazinů či aromatických aminů (1).
Efektivní metodou likvidace protinádorových léčiv a jimi kontaminovaných materiálů je pochopitelně účinné spalování ve speciálních spalovnách nebezpečného odpadu. Tento typ likvidace je však použitelný pouze pro odpady a nelze ho použít např. k dekontaminaci pracovních povrchů, laboratorního skla, nemocničního prádla, apod.
Účinnost či způsob provedení likvidace příslušného protinádorového léčiva závisí nejen na struktuře likvidovaného léčiva, ale také na formě, v níž je třeba léčivo zlikvidovat. Je pochopitelné, že se budou lišit postupy pro likvidace prošlých preparátů ve formě tuhé substance, injekčních roztoků obsahujících další látky, které mohou reagovat s dekontaminačním činidlem, vodných roztoků, kontaminovaných povrchů či nemocničního prádla, moči kontaminované podávanými léčivy, atd. Pro řadu výše uvedených případů jednoduché a snadno použitelné postupy likvidace protinádorových léčiv dosud nebyly popsány a jejich vývoji a ověření bude třeba věnovat značnou pozornost.
Přesto, že nedílnou součástí standardních operačních postupů pro likvidaci protinádorových léčiv by měly být i validované analytické metody použitelné ke kontrole účinnosti provedené dekontaminace, nelze asi realisticky očekávat jejich běžnou aplikaci v nemocničním prostředí. Některé z těchto analytických metod lze nalézt např. v přehledu (3), řada dalších článků zabývajících se stanovením protinádorových léčiv je k dispozici u autorů tohoto přehledu.
V dalším textu budou stručně popsány možnosti jednoduché chemické likvidace vybraných protinádorových léčiv. Z dále diskutovaných protinádorových léčiv patří melphalan a cyklofosfamid mezi prokázané, doxorubicin, carmustin, lomustin a cis-platina mezi pravděpodobné a ostatní mezi podezřelé humánní karcinogeny.
Mezinárodní agentura pro výzkum rakoviny (International Agency for Research on Cancer – IARC) v Lyonu ve své rozsáhlé studii (5) testovala celkem 15 navržených metod, u nichž byla v kolaborativní studii sledována jak jejich chemická účinnost, tak i případná mutagenita vznikajících produktů destrukce.
V případě doxorubicinu a daunorubicinu se neosvědčila oxidace chlornanem sodným, která vedla k mutagenním produktům. Oxidace manganistanem draselným není vhodná pro větší množství doxorubicinu, který poskytuje slabě mutagenní produkty. Naproti tomu v případě daunorubicinu lze tuto metodu použít k likvidaci tuhé látky, vodných roztoků, prošlých farmaceutických preparátů, roztoků v těkavých organických rozpouštědlech a v dimethylsulfoxidu. Metoda je rovněž použitelná k dekontaminaci laboratorního skla a laboratorních povrchů kontaminovaných rozsypanou pevnou látkou či rozlitým roztokem v těkavém organickém rozpouštědle. Oxidace manganistanem draselným bohužel není vhodná k dekontaminaci nemocničního prádla. Výsledky studie (6) však dokazují účinnost fotochemické likvidace těchto derivátů antrachinonu.
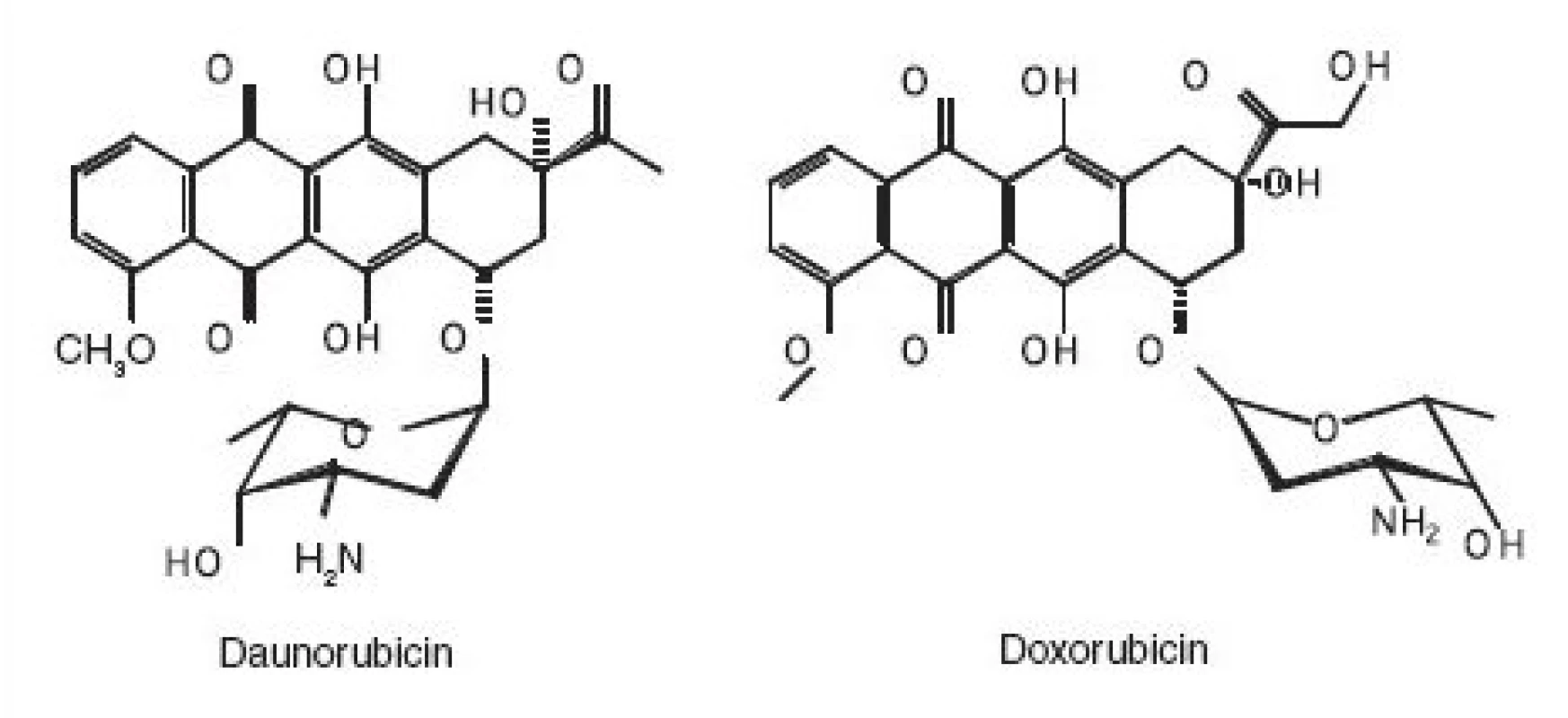
K likvidaci methotrexatu a dichlormethotrexatu lze použít oxidaci manganistanem draselným v prostředí kyseliny sírové. Pro methotrexat je použitelná i oxidace vodným roztokem manganistanu draselného či chlornanu sodného.
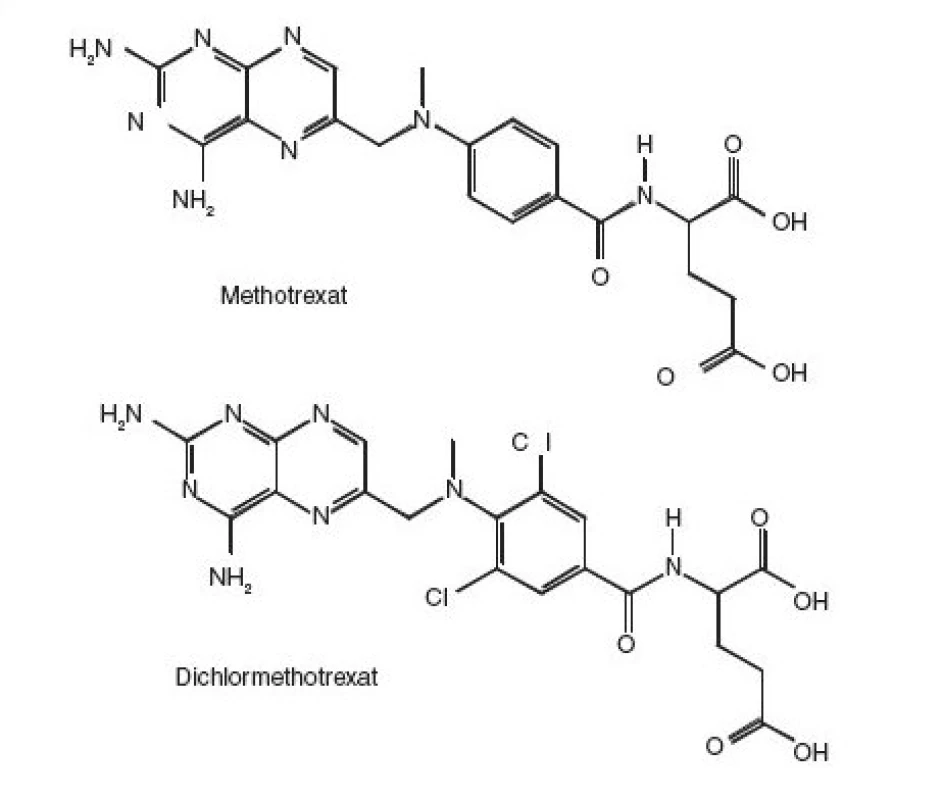
Všechny tyto metody jsou po příslušné modifikaci použitelné k likvidaci tuhých látek, jejich vodných roztoků, roztoků v těkavých organických rozpouštědlech a k dekontaminaci laboratorního skla a povrchů znečištěných tuhou látkou či jejich roztokem ve vodě nebo těkavém organickém rozpouštědle.
K likvidaci roztoků v dimethylformamidu či dimethylsulfoxidu lze použít pouze oxidace manganistanem draselným v prostředí kyseliny sírové. I zde chybí jednoduchá a účinná metoda dekontaminace nemocničního prádla.
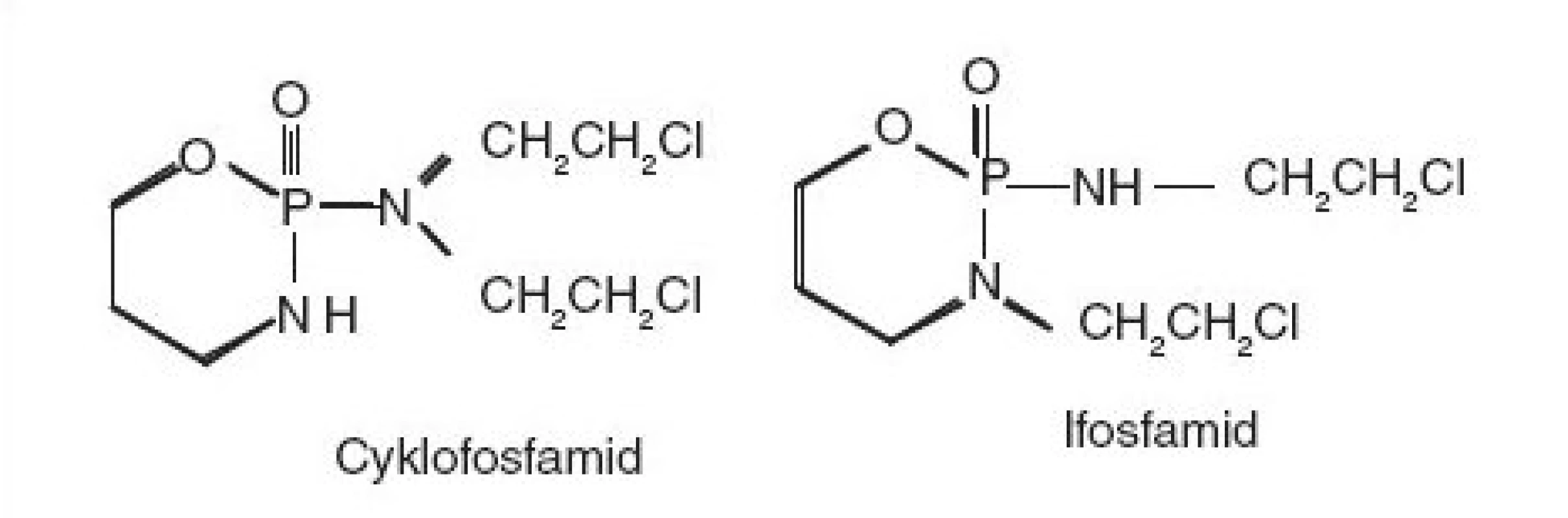
Cyklofosfamid a ifosfamid lze zlikvidovat alkalickou hydrolýzou v přítomnosti dimethylformamidu. Kyselá hydrolýza následovaná přídavkem thiosíranu sodného je použitelná pouze pro cyklofosfamid, neboť v případě ifosfamidu vznikají mutagenní produkty, stejně jako při oxidaci obou látek manganistanem draselným v přítomnosti kyseliny sírové. Metoda založená na alkalické hydrolýze byla opět modifikována pro likvidaci tuhých látek, roztoků v různých typech rozpouštědel a pro dekontaminaci laboratorního skla a povrchů.
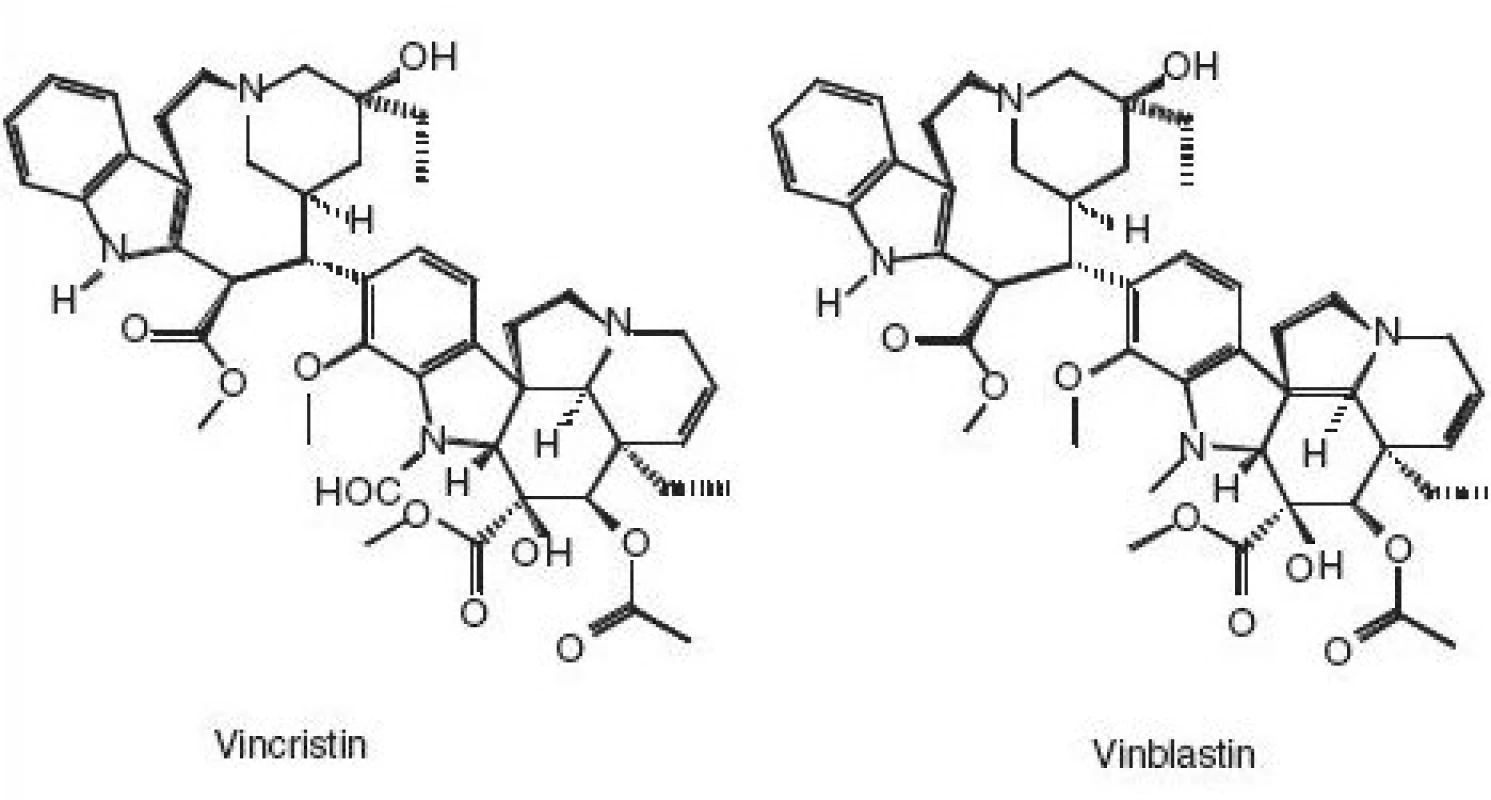
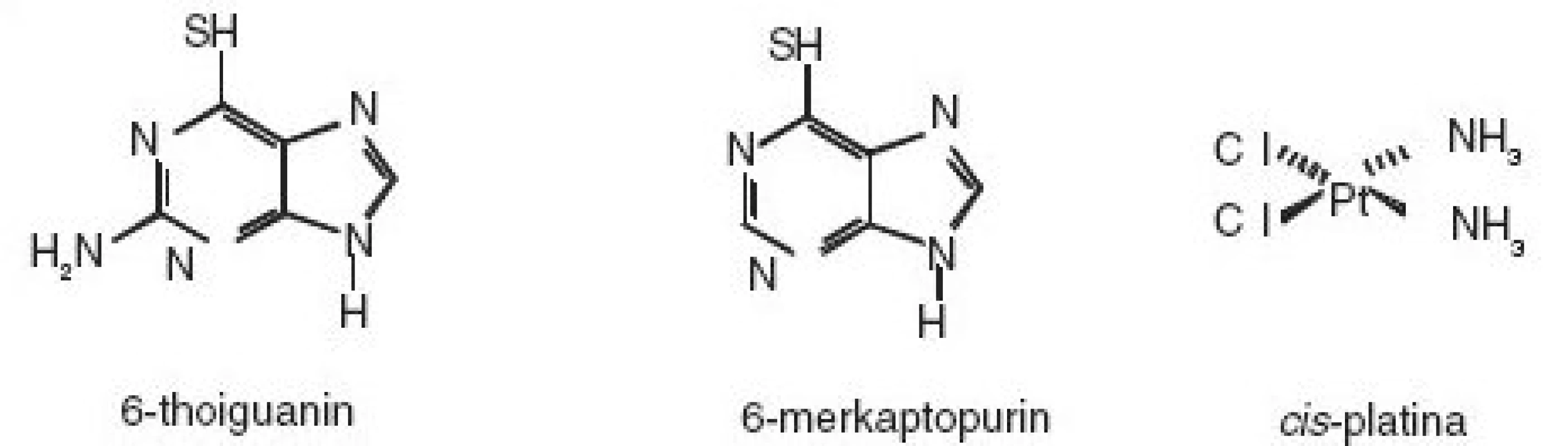
Oxidace vincristinu a vinblastinu manganistanem draselným v prostředí kyseliny sírové rovněž poskytuje biologicky nezávadné produkty a lze jí modifikovat pro různé typy likvidace či dekontaminace. V podstatě totéž platí i o 6-thioguaninu a 6-merkaptopurinu.
K likvidaci cis-platiny je zřejmě nejvhodnější její redukce práškovým zinkem v kyselém prostředí, která zároveň poskytuje teoretickou možnost recyklace použité platiny.
Streptozotocin, chlorozotocin a lomustin lze likvidovat reakcí s bromovodíkem v prostředí bezvodé kyseliny octové, v případě carmustinu a semustinu však vzniklé produkty vykazují mutagenní aktivitu.
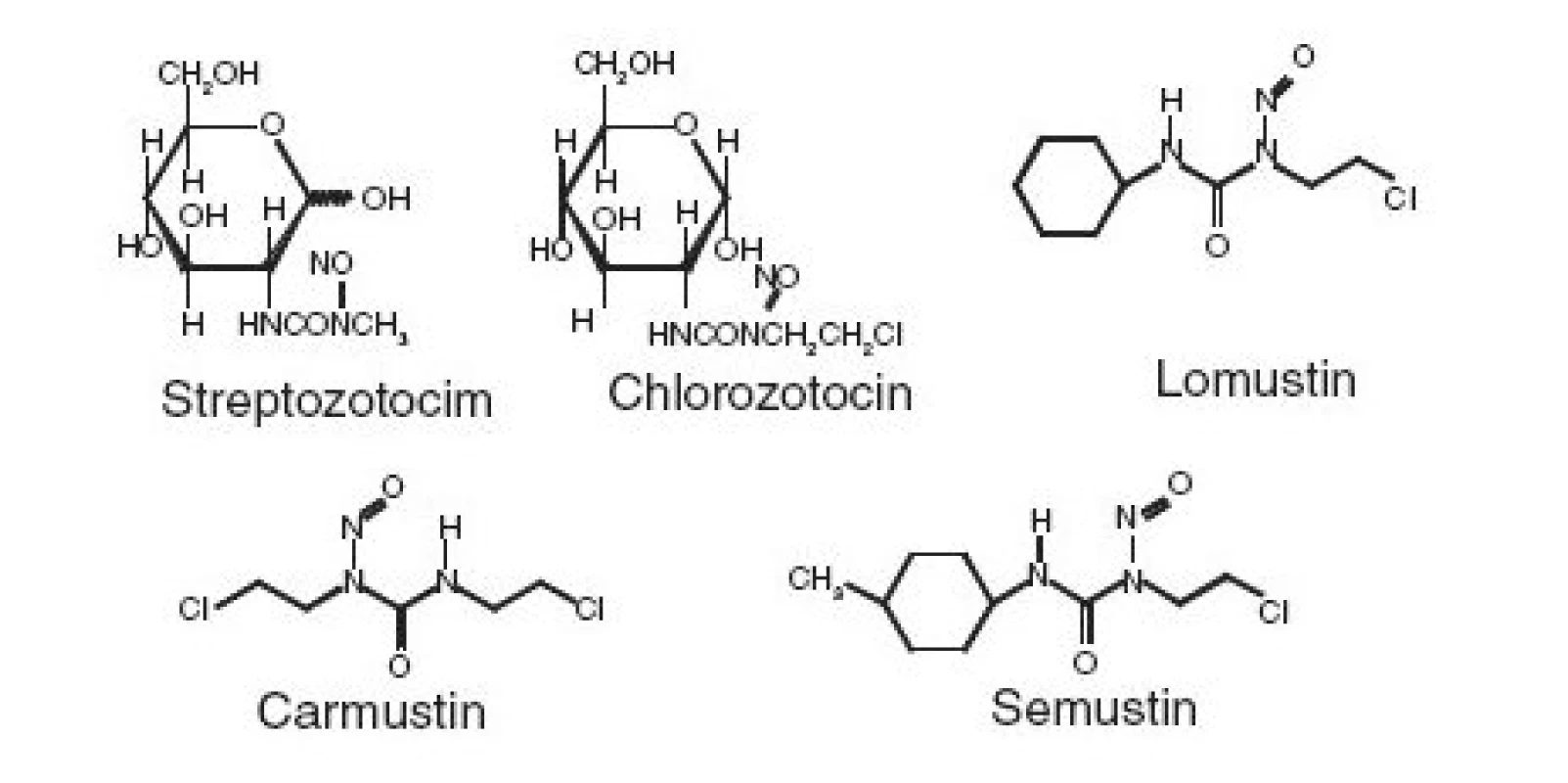
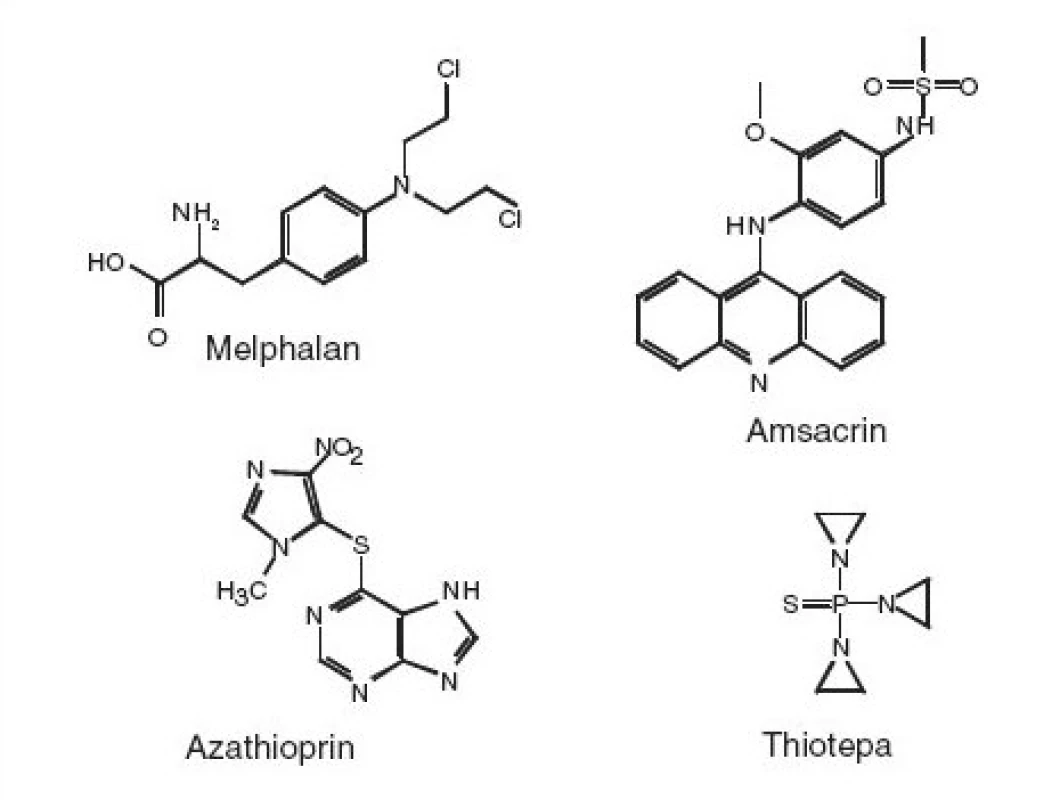
Oxidace manganistanem draselným v prostředí kyseliny sírové je použitelná pouze k likvidaci Streptozotocinu, ostatní látky poskytují mutagenní produkty. V úvahu připadá dosud nestudovaná kombinace chemické redukce a oxidace, která se osvědčila např. při chemické likvidaci nitrovaných polycyklických aromatických uhlovodíků. Melphalan poskytuje při oxidaci manganistanem draselným v kyselém prostředí mutagenní produkty. proto je nutné oxidaci provádět v alkalickém prostředí.
V případě amsacrinu a azathioprinu se osvědčila oxidace chlornanem sodným či Fentonovým činidlem (2, 7). tytéž metody jsou použitelné i k likvidaci thiotepy, kdy lze navíc použít i její oxidaci peroxidem vodíku (2).
Závěr
Závěrem je třeba upozornit, že jak chemická účinnost uváděných metod likvidace protinádorových léčiv, tak i biologická nezávadnost vznikajících produktů byla ověřena pouze na citovaných látkách. Přestože na základě strukturní analogie lze očekávat jejich širší použitelnost i na strukturně příbuzná protinádorová léčiva, je pro tato nová léčiva vždy třeba jejich chemickou i biologickou účinnost ověřit. Při použití metod založených na oxidaci manganistanem je nutno připomenout, že s tímto oxidačním činidlem mohou reagovat i další složky dekontaminovaného materiálu. Existuje tudíž nebezpečí, že manganistan bude spotřebován při bočných reakcích, takže dekontaminace nebude plně účinná. Za velmi perspektivní považujeme možnost fotochemické likvidace řady protinádorových léčiv, která dosud nebyla detailně prozkoumána. Totéž v ještě větší míře platí o možnostech elektrochemické likvidace řady protinádorových léčiv, které bychom rádi věnovali pozornost v souvislosti s vývojem elektroanalytických metod stanovení stopových množství těchto významných léčiv.
Poděkování
Vývoj analytických metod použitelných ke sledování účinnosti likvidace protinádorových léčiv byl finančně podporován Ministerstvem školství, mládeže a tělovýchovy (projekt LC 06035 a MSM 0021620857).
Prof. RNDr. Jiří Barek, CSc.
Katedra analytické chemie PřF UK
Albertov 6
128 43 Praha 2
E-mail: barek@natur.cuni.cz
Sources
1. Barek, J. Laboratorní metody destrukce chemických karcinogenů. Chemické Listy, 1986, 80, s. 904-917.
2. Barek, J., Cvačka, J., Zima, J. et al. Chemical degradation of wastes of antineoplastic agents Amsacrine, Azathioprine, Asparaginase and Thiotepa. Ann. Occup. Hyg. 1986, 42, p. 259-266.
3. Barek, J., Mejstřík, V., Zima, J. Dekontaminace laboratoří pracujících s chemickými karcinogeny a analytické monitorování účinnosti destrukce těchto látek. Chemické Listy 1993, 87, s. 322-331.
4. Bencko, V., Kapek, J. Vinš, O. Hospital waste treatment and disposal in the General University Hospital – current situation and future challenges. Indoor Built Environ 2003, 12, p. 99-104.
5. Castegnaro, M., Adams J., Armour , M.A., Barek, J. et al. Laboratory decontamination and destruction of chemical carcinogens in laboratory wastes: some antineoplastic agents. IARC Scientific Publication No. 73. Lyon: IARC, 1985.
6. Jemelková, Z. Sledování účinnosti fotochemické destrukce Doxorubicinu. Bakalářská práce, Přírodovědecká fakulta Univerzity Karlovy v Praze. Praha: 2002.
7. Lanová, D. Spektrofotometrické sledování destrukce protinádorových léčiv Azathioprinu a Amsacrinu. Bakalářská práce. Přírodovědecká fakulta Univerzity Karlovy v Praze. Praha: 1997.
8. Montesano, R. Handling of chemical carcinogens in the laboratory-problems of safety. IARC Scientific Publication No. 33. Lyon: IARC, 1979.
Labels
General practitioner for children and adolescents General practitioner for adultsArticle was published in
General Practitioner

2008 Issue 5
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Hope Awakens with Early Diagnosis of Parkinson's Disease Based on Skin Odor
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Memantine Eases Daily Life for Patients and Caregivers
-
All articles in this issue
- Výživa dětí ve věku 1–3 roky
- Socioekonomická pozice v různých obdobích obdobích života a depresivní symptomy u mužů a žen v České republice
- Vliv dopravních emisí na imunitu člověka
- Odhady absolutního kardiovaskulárního rizika v České republice
- Historie, současné problémy a šance v prevenci nozokomiálních nákaz
- Virové hepatitidy – znalosti studentů zdravotnických oborů
- Příspěvek ke zdravotním aspektům expozice výfukovým plynům
- Příspěvek k laboratorním metodám likvidace protinádorových léčiv
- Závislost na tabáku: prevence, diagnostika a léčba v ordinaci praktického lékaře
- Pozdní účinky xenobiotik 1. Mechanismus účinku a jejich výskyt v prostředí
- Násilí jako znepokojivý fenomén současného zdravotnictví
- General Practitioner
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Pozdní účinky xenobiotik 1. Mechanismus účinku a jejich výskyt v prostředí
- Historie, současné problémy a šance v prevenci nozokomiálních nákaz
- Násilí jako znepokojivý fenomén současného zdravotnictví
- Závislost na tabáku: prevence, diagnostika a léčba v ordinaci praktického lékaře
