Gluténová enteropatia
Gluten enteropathy
Celiac disease is a chronic disease characterized by an immune response to gluten in genetically predisposed patients. Its severe complications may not only increase morbidity and shorten the life of the patient, but also substantially reduce patient quality of life. Through early diagnosis and careful dietary measures it is possible to achieve a resolution of clinical symptoms in a substantial proportion of patients and the incidence of serious complications of the disease can be reduced.
Although the pathogenesis and treatment of the disease is known, and a methodical approach to the diagnosis of celiac disease has been developed and accepted by several professional societies, there are still a large number of patients that escape diagnosis and not only in childhood but mostly in adulthood. It is necessary to bear in mind the wide range of clinical manifestations of celiac disease, which is the result of a complex interaction of various environmental, genetic and immune factors.
Although examination of circulating auto-antibodies in the serum is within the diagnostic algorithm prior to biopsy, especially in the diagnosis of atypical forms, its specificity and sensitivity is not always adequate. It is obvious that the application of targeted screening can help discover new, especially atypical forms of celiac disease, but some will nevertheless remain undiagnosed.
Key words:
celiac disease, gluten, malabsorption, tissue transglutaminase, gluten-free diet, atypical presentations of celiac disease.
Authors:
Z. Mináriková; Z. Bartošová; K. Letková; S. Oravec
Authors‘ workplace:
Prednosta: doc. MUDr. Ľudovít Gašpar, CSc.
; II. interná klinika LFUK a UNB Bratislava, Slovensko
Published in:
Prakt. Lék. 2012; 92(2): 77-84
Category:
Reviews
Overview
Celiakia je chronické ochorenie, charakterizované imunitnou odpoveďou na lepok u geneticky predisponovaných pacientov. Svojimi závažnými komplikáciami môže nielen zvyšovať chorobnosť a skracovať život pacienta, ale aj podstatne znižovať jeho kvalitu. Včasným stanovením diagnózy a dôsledným dodržiavaním diétnych opatrení je možné u podstatnej časti pacientov dosiahnuť ústup klinickej symptomatológie a znížiť výskyt závažných komplikácií choroby.
Napriek tomu, že patogenéza a liečba ochorenia je viac menej známa a bol vypracovaný metodický postup diagnostiky celiakie akceptovaný viacerými odbornými spoločnosťami, uniká stále časť pacientov diagnóze v populácii detí, ale najmä u dospelých. Je nutné mať na pamäti široké spektrum klinických manifestácií celiakie, ktoré je výsledkom komplexnej súhry rozličných environmentálnych, genetických a imunitných faktorov.
Vyšetrenie cirkulujúcich autoprotilátok v sére, ktoré v cielenom diagnostickom algoritme predchádza biopsii, uplatňované obzvlášť v diagnostike atypických foriem, nemá svojou výpovednou hodnotou vždy dostatočnú špecifitu a senzitivitu. Je zrejmé, že aplikáciou cieleného skríningu dôjde nesporne k odhaleniu nových, predovšetkým atypických foriem celiakie, ale časť ostane aj naďalej nediagnostikovaná.
Kľúčové slová:
celiakia, glutén, malabsorbcia, tkanivová transglutamináza, bezlepková diéta, atypické prejavy celiakie.
Úvod
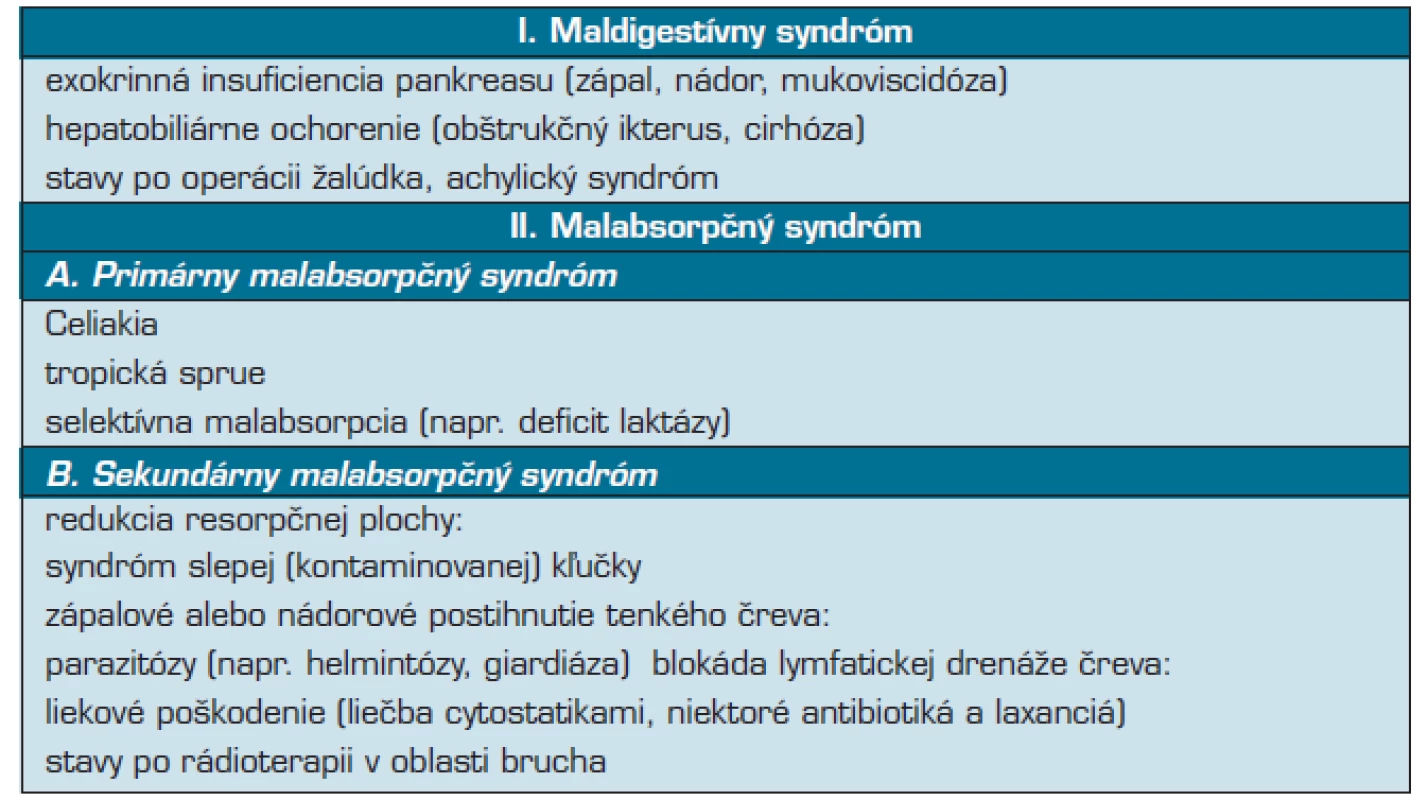
Glutén-senzitívna enteropatia (GE), celiakia (celiac disease, CD), je stav, kedy u geneticky predisponovaných jedincov dochádza k imunitnej reakcii na prolamíny, ako je napríklad gliadínová frakcia gluténu u pšenice či podobné proteíny v jačmeni, raži a (pravdepodobne) aj v ovsi s následným autoimúnnym zápalovým postihnutím tenkého čreva, najmä jejuna. (5, 10, 19, 23, 38). Je jednou z najčastejších enteropatií spôsobujúcich primárny malabsorbčný syndróm. Pacienti s týmto ochorením môžu mať rôzne non-gastrointestinálne prejavy, a preto sa často ocitnúť v ambulanciách rôznych lekárov (14).
Diagnostika celiakie je dôležitá z viacerých dôvodov (5, 10, 19, 23, 38):
- Ide o časté ochorenie, ktoré sa vyskytuje v pomere 1 : 200 až 1 : 300 obyvateľov západných krajín; pomer diagnostikovaných k nediagnostikovaným sa pohybuje okolo 1 : 7 (9); (k januáru 2008 bo1a na Slovensku prevalencia podľa diagnostikovaných pacientov 1 : 677 (26);
- ochorenie predstavuje zvýšené riziko nádorových ochorení.
Patogenéza
Potenciálnym spúšťacím faktorom patologickej imunologickej odpovede na gliadínové peptidy môže byť aj adenovírus 12, nakoľko niektoré aminokyselinové sekvencie jeho peptidového obalu sú homológne s niektorými sekvenciami alfa-gliadínu. Okrem infekcií, predovšetkým črevných, riziko vzniku celiakie pravdepodobne zvyšuje kratšia doba dojčenia a zaradenie gluténu do stravy pred ukončením 4. mesiaca života (26). Mechanizmus črevnej imunitne sprostredkovanej odpovede zahŕňa na HLA II-DQ2 (u viac ako 90 % pacientov) alebo HLA II-DQ8 viazané T-bunkové interakcie v lamina propria a taktiež imunitné reakcie v črevnom epiteli (10,14,26). Negativita HLA-DQ2/DQ8 vylučuje možnosť celiakie s 99% istotou, čo sa využíva v prípade diagnostických pochybností (26).
Na aberantnej imunitnej odpovedi sa podieľajú tak mechanizmy humorálnej, ako aj bunkovej imunity. Gliadín, ktorého deamináciou pomocou tkanivovej transglutaminázy v enterocyte dochádza k tvorbe nových peptidov viažucich sa na antigén HLA II-DQ2 na povrchu antigén prezentujúcich buniek, vyvoláva u geneticky vnímavých jedincov patologickú imunitnú reakciu s trvalou tvorbou autoprotilátok (19, 9, 15, 19, 22, 38).
Prezentáciou peptidov pomocným T-lymfocytom, sa iniciuje tvorba protilátok, s ktorými gliadín tvorí aj imunitné komplexy, s následnou agregáciou cytotoxických T-lymfocytov (19, 10). Stimulované T-lymfocyty spúšťajú kaskádu zápalovej reakcie a uvoľňujú prozápalové cytokíny. Dochádza k nekontrolovanému procesu, ktorého výsledkom je devastácia jejuna a atrofický zápal (19, 10, 9). Klonálna expanzia intraepitelového lymfocytu pri refraktérnej chorobe je asociovaná so vznikom T-bunkového lymfómu (14).
Protilátky proti gliadínu však nemajú hlavnú úlohu v patogenéze celiakie. Pre celiakiu sú patognomické protilátky proti endomýziu, respektíve tkanivovej transglutamináze (tTG) (19, 10, 26); tTG je intracytozolový enzým, kódovaný na 6. chromozóme, ktorý sa normálne uvoľňuje pri poranení. Stabilizuje tvorbu priečnych väzieb v granulačnom tkanive (10, 9, 22, 38), čím dochádza k ohraničeniu poškodenej oblasti, a okolité tkanivo je chránené pred ďalším poškodením.
K zvýšenej expresii tTG dochádza pri apoptóze, naopak jeho funkcia je poškodená pri raste niektorých tumorov (43). Aj priamy toxický efekt gliadínu na črevnú mukózu vedie k uvoľneniu transglutaminázy z cytozolu mezenchymálnych buniek lamina propria a mononukleárov. Gliadín obsahuje asi 40 % glutamínu zo všetkých jeho aminokyselín a je potencionálnym substrátom pre tTG. (43).
Tvorba priečnych väzieb medzi gliadínom vedie k tvorbe gliadin-gliadin a gliadin-tTG komplexov, a tým k tvorbe antigénových neoepitopov. Tieto neoepitopy môžu iniciovať imunitnú reakciu u vnímavých jedincov, v konečnom dôsledku proti gliadínu ako aj proti tTG (10, 43, 22, 38).
Je pravdepodobné, že väzba na rôzne gény mimo HLA systém hrá úlohu pri tvorbe fenotypu ochorenia. Uplatňujú sa aj hereditárne vplyvy. Podľa niektorých štúdií ide u celiakie o autozomálne dominantný typ dedičnosti s neúplnou penetranciou (19). Na druhej strane, nejde o úplne typické autoimúnne ochorenie, nakoľko po vymiznutí antigénu zo stravy sa strácajú protilátky proti gliadínu ako aj AtTG a poškodenie sliznice je reverzibilné bez následných fibrotických zmien a jaziev (43).
Klinický nález
Symptómy celiakie zodpovedajú malabsorbčnému syndrómu. Existuje množstvo chorých s nekompletným obrazom ochorenia, atypickými príznakmi, ktorí bývajú častejšie diagnostikovaní na začiatku dospelosti alebo neskôr (10, 19). Klinické prejavy sú rozmanité a závislé aj od veku, v ktorom sa prejavia (9). Klasický gastrointestinálny malabsorbčný syndróm, charakterizovaný
- hnačkou,
- steatoreou,
- chudnutím,
- nechutenstvom,
- únavou,
- slabosťou,
- anémiou
sa môže vyskytnúť u ťažkých foriem, väčšinou ale majú pacienti miernejšie príznaky ako
- bolesti brucha,
- nadúvanie,
- poruchy trávenia, alebo
- non-gastrointestinálne príznaky (10, 40).
Ochorenie sa väčšinou diagnostikuje buď v rannom detstve (medzi 9–24. mesiacom), alebo v tretej, respektíve štvrtej dekáde života (40). V detskom veku ide zvyčajne o rozsiahle poškodenie tenkého čreva, predovšetkým jejuna.
Pri kompletnom vyjadrení ochorenia sa u detí prvé príznaky v zmysle
- hnačiek,
- neprospievania,
- zastavenia rastu,
- distenzie bruška, a
- ochabnutia svalovej hmoty
prejavia v dobe zavádzania obilnín do stravy, alebo v druhom a treťom roku života (9, 39). Býva prítomná
- zvýšená dráždivosť,
- anorexia,
- vracanie,
- bledosť (39), a tiež
- nápadne páchnuca, mastná stolica s vysokým obsahom tuku svetlej až sivej farby (9).
Môžu sa objaviť známky
- dehydratácie a minerálovej dysbalancie,
- metabolickej acidózy,
- výnimočne ťažkej hypoproteinémie s periférnymi edémami.
Ak sa objaví hypotenzia, tachykardia a adynamia, hovoríme o celiakálnej kríze.
Takýto obraz je v súčasnosti zriedkavý u dospelých aj u detí (9, 39). V rámci prevencie sa za významný ochranný faktor vo vzťahu ku vzniku celiakie v detskom veku považuje materské mlieko (26).
V dospelom veku sa celiakia väčšinou manifestuje atypicky, jej klinické prejavy bývajú veľmi pestré (9, 28). V bežnej praxi sa stretávame väčšinou len s menšou časťou pacientov s klinicky aktívnou chorobou a zreteľnými príznakmi, zatiaľ čo pacienti s nevýraznými alebo atypickými ťažkosťami častokrát unikajú.
Kompletne vyjadrený malabsorbčný syndróm je raritný (9, 28). Veľa dospelých pacientov je dlho vedených pod diagnózou funkčnej črevnej dyspepsie (9, 32, 42). Podľa niektorých autorov až 30 % dospelých pacientov s neskôr diagnostikovanou celiakiou spĺňa Rímske kritériá II pre diagnózu dráždivého čreva (9).
Skríningové sérologické štúdie z viacerých kontinentov ukazujú, že približne 0,5–1 % jednotlivcov v týchto populáciách môže mať nediagnostikovanú celiakiu. Prevalencia je ešte vyššia u príbuzných pacientov (40). Výskyt celiakie u prvostupňových príbuzných je okolo 10–15 %, u druhostupňových 2,6 až 5,5 % (26). Je pozoruhodné, že v niektorých štúdiách je prevalencia nedetekovanej celiakie u detí a dospelých veľmi podobná (približne 1 %). Prečo sa u niektorých dospelých vyvinú príznaky neskôr, nie je známe, ale môže ísť dôsledok neskorších udalostí v kontrole imunologickej tolerancie (40).
Atypické prejavy gluténovej enteropatie
Dnes je už známe, že adultná forma ochorenia sa častejšie manifestuje extraintestinálne. Problematická je práve diagnostika atypických foriem (24). Klinické prejavy v dospelosti, majú svoj morfologický korelát v segmentárnom, alebo ložiskovom poškodení proximálnych častí jejuna, a ich obraz teda závisí od stupňa a predovšetkým na rozsahu črevného postihnutia. Nález odpovedá aj štádiu choroby:
- rôzny stupeň zníženia výživy,
- hypotrofie svalstva,
- bledosť,
- suchá pokožka,
- lámavé nechty,
- slizničné zmeny (stomatitis, glossitis, konjunktivitis).
Hnačka nie je v týchto prípadoch typickým prejavom, alebo je jej výskyt len ojedinelý a na detekciu malabsorbcie sú potrebné ďalšie testy (10). Môžu sa vyskytovať aj krvácavé prejavy, hypoproteinemické edémy dolných končatín. Klinická manifestácia je však vo vyššom veku väčšinou oligo-symptomatická, monosymptomatická alebo úplne atypická (9).
Nevysvetliteľná anémia, deficit železa alebo kyseliny listovej, môže byť jediným príznakom (19, 10, 40). V dospelosti je práve sideropenická mikrocytová anémia častým, a dá sa povedať aj „typickým“ prejavom celiakie (9). U pacientov s únavovým syndrómom a v minulosti, alebo súčasnosti diagnostikovanou mikrocytovou anémiou, je vyššia prevalencia zatiaľ nediagnostikovanej celiakie (40).
Makrocytová anémia z nedostatku kyseliny listovej ako aj vitamínu B12 je vzácna, v prípade deficitu kyseliny listovej býva skôr normocytová anémia v dôsledku kombinovaného deficitu železa a folátov (9, 17).
Prejavy metabolickej osteopatie, osteoporóza sú ďalšími z príznakov (9, 10, 19, 40). Osteoporóza a osteomalácia, vzniká v dôsledku malabsorpcie a deficitu vápnika a vitamínu D (28). Prvým príznakom choroby môže byť aj symptomatická hypokalcémia (6).
U pacientov s celiakiou je mierne zvýšené rizikom zlomenín v porovnaní s bežnou populáciou, a je preukázateľná výrazne nižšia hodnota kostnej denzity v porovnaní s rovnako starou zdravou populáciou (9, 40).
Častým laboratórnym nálezom býva hypertransamylazémia, zvýšenie pečeňových enzýmov. Koincidujúce autoimunitne podmienené pečeňové ochorenia, akým je
- autoimúnna hepatitída,
- primárna biliárna cirhóza, alebo
- primárna sklerotizujúca cholangoitída,
môžu byť ďalšou príčinou tohto laboratórneho nálezu (9).
Vyskytujú sa
- psychické (depresívne stavy),
- neurologické ťažkosti (epilepsia, polyneuropatia),
- gynekologické poruchy,
- neplodnosť (1, 10, 19, 40).
Problémy s plodnosťou, sexuálna dysfunkcia a pôrodné komplikácie boli častejšie pozorované u pacientok s neliečenou celiakiou. Reprodukčné poruchy môžu byť spôsobené endokrinnými zmenami spôsobenými selektívnym nedostatkom živín (31). Uvádza sa asociácia ochorenia so zvýšeným výskytom potratov, predčasným pôrodom a narodením detí s nízkou pôrodnou hmotnosťou, respektíve vnútromaternicovou rastovou retardáciou (40). Na druhej strane pri porovnaní plodnosti žien s diagnostikovanou celiakiou so skupinou žien z bežnej populácie, nebol nájdený rozdiel u týchto skupín (37).
Celiakia diagnostikovaná predkoncepčne nebola asociovaná s nepriaznivými účinkami na plod (21). Keďže v súčasnej dobe je možná včasná diagnóza a liečba tohto ochorenia, malo by sa v rámci predkoncepčnej diagnostiky a liečby pacientov s poruchami reprodukcie uvažovať aj o celiakii. (31).
Medzi ďalšie klinické prejavy pri atypickej celiakii patrí aj nízky vzrast, alebo defekty zubnej skloviny (10). Predpokladá sa, že asi u 10 % adolescentov s malým vzrastom je príčinou nespoznaná celiakia. U týchto osôb býva príčinou znížená produkcia rastového hormónu (9) (tab. 1).
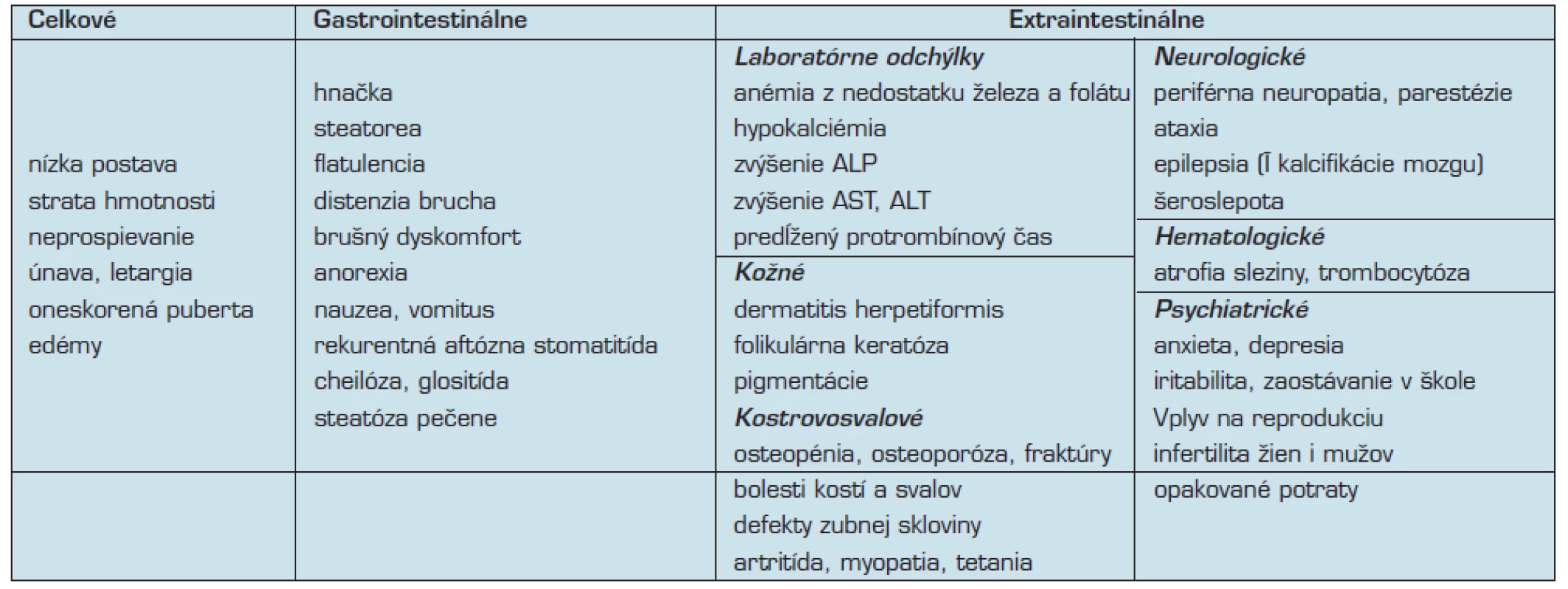
Jedným z možných vysvetlení výskytu oligo-symptomatických foriem je, že došlo k významným pokrokom v diagnostike, jej dostupnosti, v rozvoji diagnostických serologických markerov a v používaní endoskopických metód biopsie. Preto je viac pacientov možné vyšetriť a následne diagnostikovať skôr, ako sa vyvinie úplný obraz ochorenia (40). Uvádza sa, že asi 25 % pacientov je diagnostikovaných medzi 45–50. rokom života (10), respektíve 20 % dospelých pacientov s celiakiou je diagnostikovaných až po šesťdesiatom roku života (9, 26). Na to je potrebné myslieť aj u geriatrických pacientov (26).
Asi u 1/4 chorých je pri podrobnej anamnéze možné odhaliť príznaky už v detstve. V detskom veku je výskyt ochorenia u oboch pohlaví rovnaký, zatiaľ čo v dospelosti je dvakrát častejší u žien (40). Nie je výnimočné, že sa choroba prvýkrát prejaví v priebehu gravidity, alebo v šestonedelí (9).
Rozoznávame tieto klinické formy celiakie:
- typická (klasická),
- atypická (subklinická),
- tichá,
- latentná, a
- potenciálna (19, 26) (tab. 2).
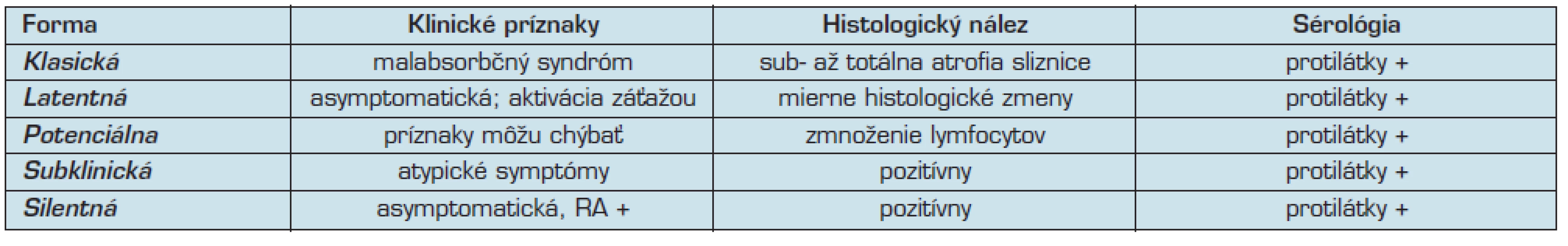
Pacienti s asymptomatickou celiakiou majú preukázateľné histologické zmeny na proximálnom tenkom čreve, pozitívne sérologické testy, ale nie sú prítomné žiadne črevné ani extraintestinálne príznaky. Pri podrobnejšom pohľade je u týchto osôb možné nájsť nižšiu fyzickú výkonnosť, ľahšiu unaviteľnosť, väčšiu tendenciu k depresiám, niekedy nachádzame sideropéniu bez anémie, nižšie hodnoty denzity kostného minerálu. Aj u týchto pacientov sú dlhodobé komplikácie rovnako časté (9, 12).
Dermatitis herpetiformis Dühring (DH)
Gluténová enteropatia (GE) sa môže prejaviť ako herpetiformná dermatitída. Nejde o pridruženú chorobu ani komplikáciu celiakie, ale o rovnocennú formu manifestácie, s rovnakou patogenézou, liečbou, prognózou i možnými komplikáciami. Ide o bulózne kožné ochorenie s charakteristickou kožnou manifestáciou (9).
Väčšina pacientov nemá žiadne ťažkosti interného charakteru, fyzikálny nález je väčšinou v norme. Histologicky sú prítomné depozitá IgA v nepostihnutých častiach kože. Poškodenie čreva preukázateľné takmer vo všetkých prípadoch, je väčšinou ložiskové v oblasti proximálneho jejuna (9, 10, 19).
Obidve formy, celiakia ako aj herpetiformná dermatitíta, sú celkom nezávislé, môžu sa vyskytovať aj súčasne.
Ochorenia vyskytujúce sa s celiakiou
Častý je spoločný výskyt GE s ďalšími, pridruženými chorobami. WGO (World Gastroenterology Organization, Svetová gastroenterologická organizáca) uvádza okrem prvo a druhostupňových príbuzných pacientov s celiakiou nasledovné skupiny so zvýšeným rizikom celiakie:
- pacienti s Downovým syndrómom,
- pacienti s autoimúnnou tyreoiditídou,
- pacienti s chronickou hepatitídou,
- pacienti s diabetom 1. typu,
- pacienti s lymfocytovou kolitídou,
- pacienti s chronickým únavovým syndrómom,
- pacienti so syndrómom dráždivého čreva (26).
U pacientov s autoimúnnou tyreoiditídou bol pozorovaný výskyt celiakie u 7 až 10 % prípadov (9).
Súčasný výskyt celiakie a diabetes mellitus typ 1. v populácii taktiež poukazuje na ich spoločný genetický pôvod. Biologické mechanizmy, akým je autoimunitne sprostredkované poškodenie tkaniva a intolerancia antigénov v diéte, sa môžu podieľať na etiologických mechanizmoch obidvoch ochorení (34).
Diabetes mellitus typ 1 je spojený s výskytom celiakie u 5–7 % prípadov (9).
Ďalšími sú pacienti so Sjögrenovým syndrómom, IgA deficienciou a inými pečeňovými alebo pľúcnymi ochoreniami (9, 10, 34) (tab. 3).
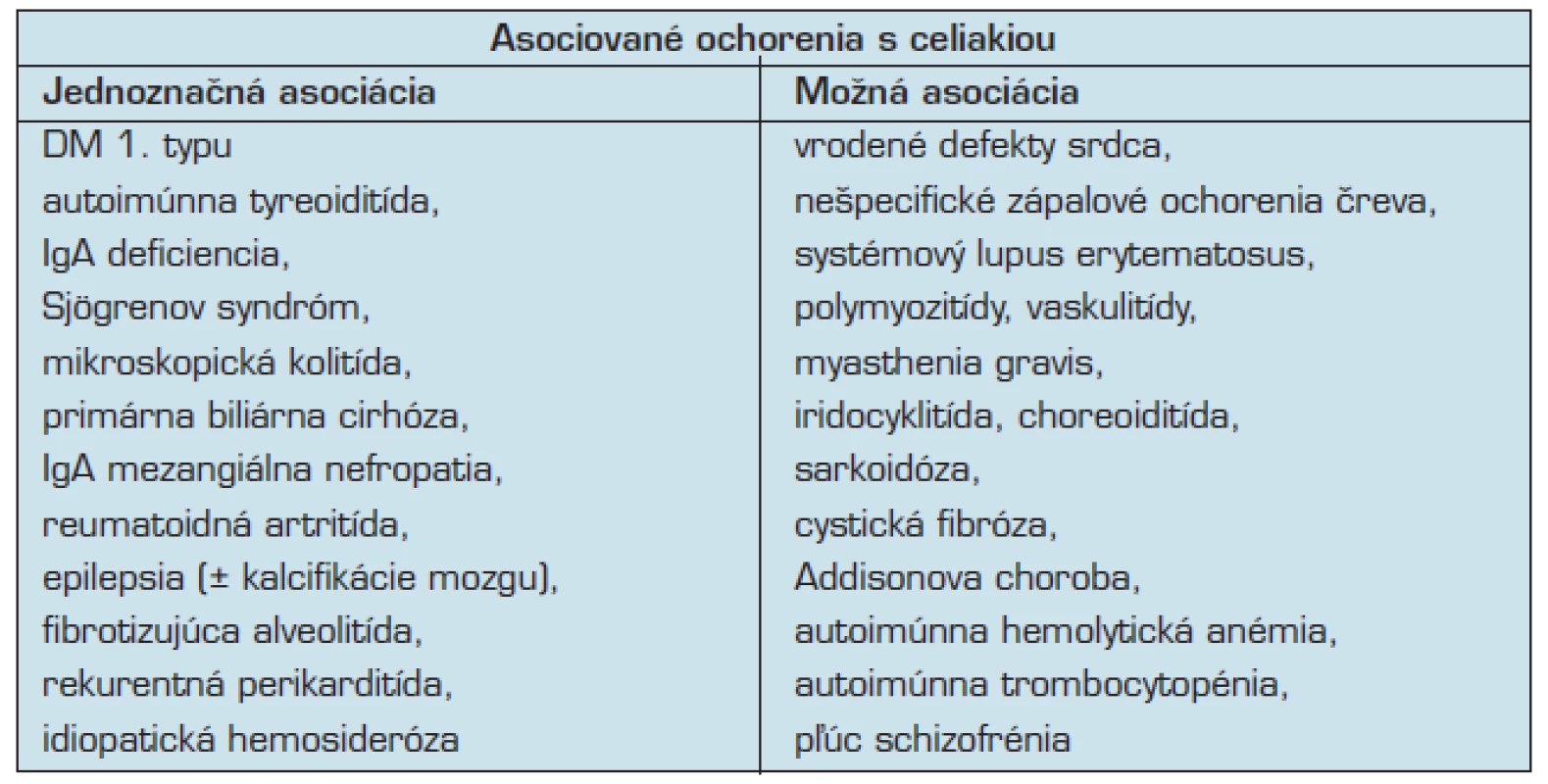
Diagnostika
Veľmi dôležitým je posúdenie klinického obrazu ako aj rizikových faktorov ochorenia. Z tohto hľadiska je dôležité brať v úvahu, že subjektívne ťažkosti pacienta môžu byť veľmi rôzne, nie sú zriedkavosťou monosymptomatické formy ochorenia a rôzne ťažkosti nemusia byť vyjadrené v rovnakom čase. Popri dôkladnej anamnéze a fyzikálnom vyšetrení pacienta má pre stanovenie diagnózy celiakie kľúčový význam vyšetrenie špecifických protilátok v krvi a histologické vyšetrenie črevnej sliznice.
Laboratórny nález
Z bežných vyšetrení je u pacienta potrebné vyšetriť krvný obraz a protrombínový čas (pátranie po anémii, trombocytóze, koagulačnej poruche). V obraze základných biochemických parametrov sa môže vyskytovať
- hypokalémia,
- hypomagnezémia a hypokalcémia,
- znížené hladiny celkových proteínov a albumínu,
- hyposiderémia,
- zvýšené aminotransferázy (v typickom prípade ALT > AST).
Alkalická fosfatáza (ALP) v sére môže byť zvýšená, zvyčajne na vrub kostného izoenzýmu. Môžeme zistiť zníženú hladinu kyseliny listovej, vitamínu B12 prípadne železa. Dôležité je vylúčenie infekčnej etiológie hnačky (26).
V rámci diagnostiky ako aj sledovania účinnosti terapie CD sa uplatňuje stanovenie
- antigliadínových protilátok (AGA),
- antiretikulinových protilátok (ARA),
- protilátok proti endomýziu, spojivovému tkanivu v hladkých svaloch (AEA),
- protilátok proti tkanivovej transglutamináze (AtTG) (9, 10, 19, 31, 43).
Stanovenie protilátok proti gliadínu má v triede IgA veľmi dobrú špecificitu a v triede IgG prijateľnú senzitivitu.
AGA-IgG sú menej špecifické, nakoľko bývajú pozitívne aj pri veľkom množstve organických ochorení tenkého čreva, pri parazitárnych infekciách, intolerancii proteínov kravského mlieka, alebo u Crohnovej choroby (9, 10, 39, 43). Vyššiu spoľahlivosť a citlivosť majú antiendomyziálne protilátky (9).
V bežnej klinickej praxi sa v prvom rade odporúča vyšetrenie protilátok proti tkanivovej transglutamináze, so súčasným vyšetrením protilátok proti endomýziu, pre dosiahnutie lepšej záchytnosti (26). Testy môžu byť falošne negatívne u pacientov s IgA deficitom, ako aj u detí do dvoch rokov života, preto je potrebné súčasné vyšetrenie hladiny celkového IgA (9, 26).
Napriek špecificite a senzitivite AGA IgA a AGA IgG a tiež ARA IgA sa tieto dostali na okraj klinického záujmu pre ich nízku pozitívnu prediktívnu hodnotu (26). Stanovenie protilátok proti tkanivovej transglutamináze sa zdá byť aj najvýhodnejším screeningovým testom (9, 43). Falošne pozitívne AtTG-IgA bývajú pri pokročilých chorobách pečene či kongestívnom zlyhaní srdca. Aj preto je potrebné vždy diagnózu potvrdiť histologicky (26).
Metódy stanovenia sérových autoprotilátok predstavujú možnosť rýchleho a predovšetkým menej invazívneho skríningu, napriek tomu sa upustilo od jeho celoplošnej realizácie. Dôvodov neuplatnenia celoplošného skríningu je niekoľko. Jedná sa najmä o otázky nedostatočnej špecificity a senzitivity jednotlivých autoprotilátok, kolísanie ich hodnôt a negativitu aj pri pozitívnom bioptickom náleze, eventuálne pozitivitu v kontexte s preinfiltratívnou léziou (24).
Podľa niektorých autorov je stupeň pozitivity antiendomyziálnych protilátok (AEA) závislý na stupni poškodenia sliznice tenkého čreva (24, 29, 30). Týka sa to aj pozitivity tkanivovej transglutaminázy (t-TG) (3, 11).
Iné práce dokumentujú naopak negativitu protilátok aj pri aktívne prebiehajúcom ochorení. Pri atypických formách však môže byť ochorenie aktívne aj pri minimálnych slizničných zmenách (24). Bolo dokumentované, že mechanizmom apoptózy sa u latentnej celiakie T-lymfocyty eliminujú, preto môže byť morfológia sliznice tenkého čreva aj normálna (20). Pozitivita autoprotilátok teda môže jednak viac kopírovať intenzitu histologických zmien sliznice tenkého čreva a jednak pri fokálnom poškodení menšej intenzity môžu byť jej hodnoty nízke, alebo aj negatívne. Toto vnáša do problematiky algoritmu diagnostiky nejasnosti a je predpoklad, že značná časť pacientov ostane aj po opakovanom skríningu nediagnostikovaná (24).
Podľa domácich, ale i zahraničných údajov by prvým krokom v skríningu mala byť kombinácia metodík stanovenia protilátok k t-TG, eventuálne stanovenia protilátok proti endomýziu. Sľubnejšou metodikou by mohlo byť stanovenie protilátok v triede IgG proti deaminovanému gliadinu (24, 27, 35, 41).
Endoskopia
Celiakia je charakterizovaná poškodením tenkého čreva so stratou absorpčných klkov a hyperpláziou krýpt, čo v konečnom dôsledku vedie k prejavom malabsorbčného syndrómu. Dlhotrvajúce neliečené ochorenie je popri nutričnom deficite spojené so zvýšeným rizikom malignity, špeciálne vznikom črevného T-bunkového lymfómu (43).
Definitívnu diagnózu celiakie môžeme stanoviť len histologickým vyšetrením bioptickej vzorky z dolnej časti sliznice tenkého čreva od Vaterovej papily (26). Makroskopický nález pri endoskopii môže značne varírovať v závislosti od závažnosti ochorenia. Latentné ochorenie je zvyčajne charakterizované nie veľkými zmenami sliznice s normálnymi semicirkulárnymi riasami. S pokročilou chorobou majú riasy až vrúbkovaný charakter. Pri ťažkom poškodení je ich výška aj počet znížený, alebo môžu úplne chýbať (10, 26).
Chýbanie alebo zníženie Kerkringových rias, príznak mozaikovitého reliéfu sliznice, vrúbkovanie rias a viditeľné cievy sliznice sú najnápadnejším endoskopickým znakom celiakie s 94% senzitivitou a špecificitou a 84% pozitívnou prediktívnou hodnotou (9). Pri tomto ochorení ide o difúzne postihnutie jejuna, ale zmeny sa môžu týkať celého tenkého čreva, alebo môžu mať ložiskový charakter (19).
U niektorých pacientov s histologickým dôkazom ťažkého poškodenia sliznice môže mať sliznica pri endoskopickom vyšetrení aj normálny vzhľad (10).
Patologickoanatomický nález
Štandardné histologické vyšetrenie biopsie sliznice odobratej z proximálnej časti tenkého čreva je najspoľahlivejšou metódou diagnostiky celiakie. Väčšina pacientov je diagnostikovaných z biopsie odobratej z oblasti D2 alebo D3 duodena (9). Histologické zmeny varírujú tak ako aj klinický obraz. Tieto morfologické nálezy sa hodnotia histologickým skórovaním (gradingom).
Podľa Marsha (tab. 4), hodnotíme (10, 26):
- zvýšenie počtu intraepitelových lymfocytov (zvýšenie je definované ako >40 lymfocytov na 100 povrchových enterocytov, alebo z enterocytov z hornej časti krýpt; v 70–90 % ide o CD8+ T-lymfocyty),
- zvýšenú celularitu lamina propria (plazmatické bunky, lymfocyty, eozinofily, neutrofily),
- poškodenie enterocytov,
- atrofiu klkov/hyperpláziu Lieberkühnových krýpt.
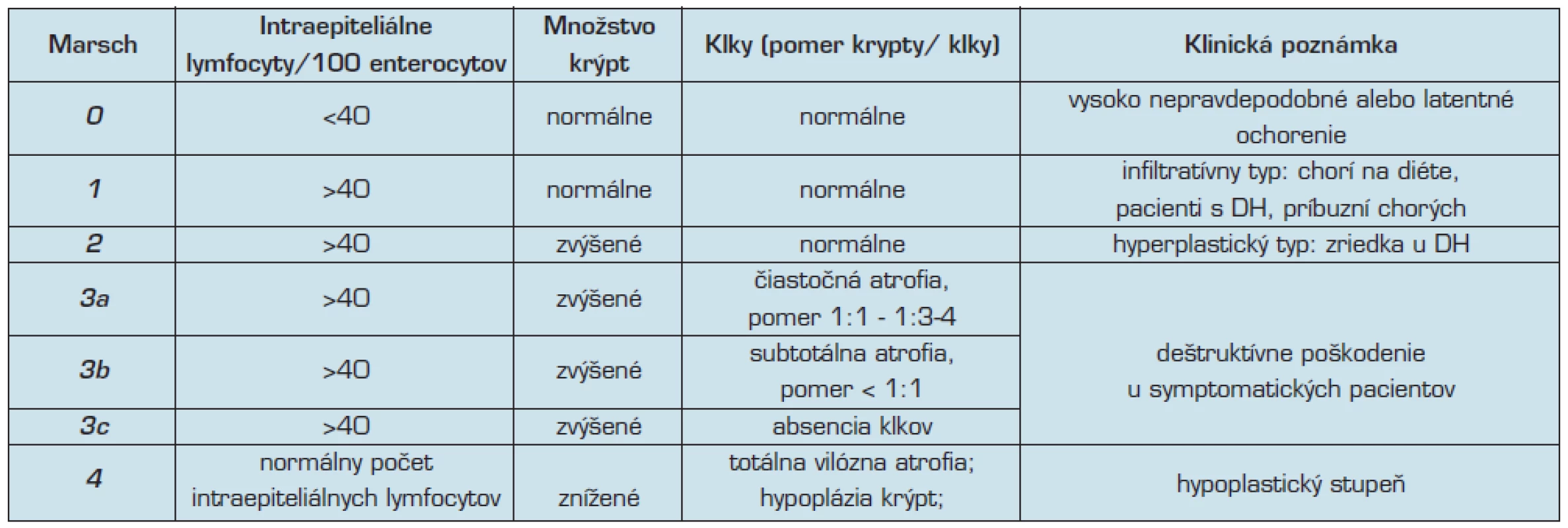
Histochemicky sú prítomné početné enzymatické poruchy. Zvýšený počet intraepiteliálnych lymfocytov, ktoré vykazujú povrchové znaky CD8 je dôležitým znakom celiakie. Ich monoklonálny charakter a strata znakov CD8 môže poukazovať na vznik T-lymfómu (9).
Diagnózu celiakie potvrdzuje reakcia na bezlepkovú diétu v zmysle znižovania titra autoprotilátok a so zlepšovaním histologického nálezu, respektíve jeho úplnou úpravou. Histologická remisia ochorenia trvá aj niekoľko rokov a jej vznik trvá dlhšiu dobu u dospelých ako u detí (10).
Zobrazujúce vyšetrenia
Pre diagnostiku nekomplikovanej celiakie sú zobrazovacie rentgenologické vyšetrenia tenkého čreva (CT enterografia, RTG enteroklýza) len málo prínosné. Je možné preukázať druhotné funkčné poruchy ako
- segmentárnu dilatáciu črevných kľučiek,
- flokuláciu kontrastnej látky,
- vyhladený reliéf, alebo
- zhrubnutie kontúr sliznice v ťažších prípadoch.
Zásadný význam majú pri vyšetrovaní pacientov s refraktérnou chorobou alebo pri podozrení na komplikácie v podobe ulceróznej jejunitídy, respektíve lymfómu (9). Využívajú sa prevažne v diferenciálnej diagnostike, za účelom vylúčenia iných ochorení (tab. 5). V rámci pátrania po osteoporóze je potrebné vykonať denzitometrické vyšetrenie (26).
Liečba
Jediným kauzálnym liečebných opatrením je trvalá a úplná bezlepková diéta, čiže úplné a celoživotné vynechanie potravín s obsahom lepku (18). U väčšiny pacientov diétne opatrenia vedú k normalizácii klinického, laboratórneho aj enterobioptického nálezu, a to v rôzne dlhom čase od zavedenia bezlepkovej diéty. Asi u 70 % pacientov sa popisuje klinické zlepšenie už po 14 dňoch od začiatku liečby. Predchádzajúce trvanie expozície gluténu významne ovplyvňuje prognózu ochorenia, či už ide o úpravu slizničných zmien, ako aj manifestácie pridružených ochorení a výskyt závažných komplikácií celiakie (24). Všeobecne sa doporučuje vylúčiť zo stravy
- pšenicu,
- raž,
- jačmeň, ako aj
- ovos.
Vylúčenie ovsa zo stravy nie je však úplne jednoznačné (18).
Podľa FDA (Food and drug administration; Správa pre potraviny a liečivá) v USA sa za bezlepkové potraviny považujú tie, ktoré neobsahujú ani stopové množstvo lepku. Pôvodne povolená hodnota menej ako 0,02 % hmotnosti potraviny je považovaná za hodnotu pre potraviny s nízkym obsahom lepku. Nie je presne známe, akú koncentráciu lepku je možné ponechať a od akej dávky pôsobí u predisponovaných jedincov toxicky (9). Podľa doporučenia MZSR bezlepkové výrobky môžu obsahovať maximálne 20 ppm (ppm = parts per million), čo znamená obsah 20 mg lepku/100 g (26). Zdá sa, že zrno ovsa nie je pre pacientov toxické, otázkou je v akom množstve a či aspoň na začiatku liečby nie je vhodné túto obilninu vynechať (9).
Aveníny, peptidy obsiahnuté v ovsi, majú niektoré aminokyseliny podobne usporiadané ako v gliadine, čiže z prísne bezlepkovej diéty by mali byť vyradené (19).
U pacientov s dlhodobou kompenzáciou celiakie sa zdá byť prísun ovsenej múky v dávke 50–70 g denne počas 6–12 mesiacov pre črevo netoxický. Na začiatku liečby je vhodné vynechať aj mastné jedlá a mliečne výrobky, vzhľadom na súčasný deficit laktázy v postihnutej črevnej sliznici (9, 24). Väčšinou stačí vynechať jedlá, kde laktóza nie je skvasená. Vhodnou potravinou je
- kukuričná, ryžová, sójová múka, sója,
- ryža,
- zemiaky,
- pohánka,
- amarant,
- kukurica,
- cirok,
- fazuľa,
- orechy,
- kukuričný aj zemiakový škrob,
- ovocie,
- zelenina,
- mäso,
- vajcia, a
- iné produkty bez obsahu lepku (19, 26).
Na začiatku terapie je indikovaná aj substitučná terapia vitamínmi, železom a kalciom, eventuálne bisfosfonátmi (19, 9, 26).
Zavedenie bezlepkovej diéty je pomerne náročné z dietologického hľadiska a je nemalou záťažou aj pre domácnosť a bežný praktický život pacienta. Vyžaduje zvýšené finančné nároky a hoci sú definované vhodné potraviny, napriek tomu môže byť aj dnes dodržiavanie bezlepkovej diéty problémom. Hlavnou príčinou je určite neinformovanosť majiteľov prevádzok, alebo ich pracovníkov, či výrobcov potravín, alebo nepresné označovanie potravín.
Lepok je pre celiatikov škodlivý už v stopovom množstve, ak sa konzumuje pravidelne. Okrem múky ho môžu obsahovať rôzne potravinové prísady, stabilizátory a emulgátory alebo zvyškové peptidy obsiahnuté v odlepkovaných škroboch. Lepok obsahujú jačmenné enzýmy používané pri výrobe ryžového a niektorých druhov sójového mlieka, ako aj sójovej omáčky, plesňové syry (chlieb použitý na zavedenie plesne), múka, ktorá sa pridáva do korenia alebo horčice počas mletia, pivo, niektoré liehoviny, destilovaný biely ocot, väčšina práškov do pečiva a podobne. (inf.zdroj: Slovenská spoločnosť celiatikov)
Komplikácie
Refraktérna sprue:
Týka sa pacientov, u ktorých po viac ako 6 mesačnej diéte nedošlo ku zlepšeniu klinického stavu a histologického nálezu (10). Ide v podstate o tri skupiny pacientov.
Prvou sú pacienti, ktorí buď nevedome nedodržujú správne bezlepkovú diétu, alebo ide o non-compliance pacienta.
Do druhej skupiny patria stavy, ktoré sú buď komplikáciou dlhodobého priebehu celiakie, alebo celiakiu napodobňujú. V týchto prípadoch diéta nevedie k zlepšeniu stavu. Zaraďujeme sem refraktérnu celiakiu I. typu, ktorá dobre odpovedá na podávanie kortikoidov a imunosupresív.
Treťou skupinou je refraktérna celiakia II. typu., tzv. kryptogénny lymfóm, ktorá vedie ku komplikáciám v podobe T-lymfómu tenkého čreva (10,9). Pacienti ktorí vôbec nezareagujú na bezlepkovú diétu, celiakiu pravdepodobne nemajú. Patologické nálezy pri refraktérnej sprue zahŕňajú zosilnenie subepiteliálnej kolagénovej vrstvy, redukciu slizničnej vrstvy, mononukleárnu infiltráciu pod kryptami, respektíve prítomnosť lymfómu (10).
Zriedkavo sa vyskytuje celiakálna kríza, ktorú charakterizuje vystupňovanie klinickej symptomatológie (26).
T-lymfóm tenkého čreva
je agresívny nádor, ktorý môže vznikať de novo s atrofiou sliznice v okolí nádoru alebo difúzne, a tým viesť k obrazu celiakie, ktorá neodpovedá na liečbu (9). Objavuje sa aj u pacientov s dlhodobou anamnézou nepoznanej celiakie, najmä u pacientov s diagnostikovanou celiakiou v dospelosti v krátkom trvaní, javiacou známky refraktérnej sprue (9, 10). Na histologickom podklade typickom pre celiakiu vznikajú lymfoepitelové lézie (10, 22).
Monoklonálna proliferácia T-klonu buniek infiltruje stenu tenkého čreva so vznikom vredov a stenóz (9). Neoplastická progresia, charakterizovaná ulceróznou jejunitídou, môže dávať vznik ďalším komplikáciám ako je perforácia, alebo fistuly čreva. V konečnom dôsledku vzniká lymfóm s masami nádoru v stene tenkého čreva, obštrukciou a krvácaním.
Klinický priebeh je typicky krátky (7, 9, 10, 25). Možnosť rozvoja malígneho lymfómu môže serologicky signalizovať výrazný vzostup IgA (19). Typicky sú postihnutí muži okolo 60. roku života (9).
U pacientov s celiakiou je zvýšená incidencia nádorov aj mimo gastrointestinálneho traktu (19). V porovnaní s kontrolnou populáciou bolo pozorované zvýšené riziko vzniku
- skvamocelulárneho karcinómu pažeráka,
- primárneho adenokarcinómu tenkého čreva, a
- zvýšenie rizika pre vývoj non-Hodgkinovho lymfómu, najmä črevného typu T-bunkového lymfómu spomínaného vyššie (10).
Posledné štúdie naznačujú len mierne zvýšenie relatívneho a absolútneho rizika malignity a úmrtnosti u pacientov s celiakiou. Väčšinou bolo riziko zvýšené v prvom roku po stanovení diagnózy, čo naznačuje, že u liečených celiatikov je riziko vzniku rakoviny a skrátenia života nízke v porovnaní s ostatnou populáciou (40). Neliečená celiakia je spojená so výskytom závažných komplikácií z dlhodobého hľadiska. Prísna bezlepková diéta však eliminuje riziko vzniku týchto malignít (10).
Zaujímavosťou je v prípade niektorých štúdií pozorovaný pokles rizika vzniku rakoviny prsníka, ale príčiny tohto pozorovania nie sú úplne zrejmé (4, 40). Iná štúdia hovorí o zníženom riziku kardiovaskulárnych ochorení v dôsledku zaznamenanej nižšej hodnoty body mass indexu, nižšieho tlaku krvi, a nižších hodnôt cholesterolu v sére pacientov s nepoznanou celiakiou (40).
Diferenciálna diagnostika
Zahŕňa diferenciálne diagnostický proces malabsorbčného syndrómu (19). Kombinácia serologických, histologických a klinických nálezov pri odpovedi na bezlepkovú diétu potvrdí diagnózu celiakie u väčšiny pacientov. V rámci bioptických nálezov sú niektoré stavy, ktoré môžu napodobniť celiakiu. Ide napríklad o autoimúnnu enteropatiu s poškodením krýpt, tzv. kolagénová sprue. Raritné ochorenie s fatálnym priebehom a autoimúnnou enteropatiou, ktorá je klinicky a histologicky neodlíšiteľná od kolagénovej kolitídy, ktorá sa tiež môže vyskytovať pri celiakii. Liečba je symptomatická, môžu sa použiť imunosupresíva, avšak s neistým efektom. Rozdielom je neprítomnosť antiendomyziálnych a pozitivita antienterocytárnych protilátok (9,10,26).
Tropická sprue je ochorenie spôsobené trvalou kontamináciou tenkého čreva koliformnými patogénmi (9). Predpokladá sa pôsobenie infekcie, parazitov ako aj vitamínového deficitu, prípadne toxínov obsiahnutých v potravinách alebo klímy (19).
Diagnostika je založená na geografickej väzbe ochorenia a neprítomnosti autoprotilátok (9,10). V obraze ochorenia sú
- hnačky,
- teplota,
- chudnutie,
- únava,
- klinické prejavy malabsorbcie, a
- častá je megaloblastová anémia pri deficite vitamínu B12 (19). V liečbe odpovedá na podávanie antibiotík, nutná je substitúcia vitamínov (9, 10, 19). V rámci diferenciálne diagnostikého procesu u pacientov so syndrómom dráždivého čreva (IBS Irritable bowel syndrom) je dôležité myslieť práve na celiakiu (32, 42). Nie je zdriedkavý súčasný výskyt IBS s inými funkčnými GI syndrómami, ale práve aj organickými poruchami (celiakia: 3,6 % vs 0,7 % v kontrolnej skupine) (16).
Z rôznych imunodeficientných stavov napríklad pri nedostatku alebo chýbaní plazmatických buniek, dochádza k lymfoidnej nodulárnej hyperplázii. Ďalej sú to:
- infekčné enteritídy,
- intolerancia potravinových bielkovín,
- vývoj lymfómu,
- a iné (10) (tab. 5).
Záver
Celiakia predstavuje chronické ochorenie, ktorého priebeh závisí od dôslednosti dodržiavania diétneho režimu (19). Svojimi závažnými komplikáciami môže nielen zvyšovať chorobnosť a skracovať život pacienta, ale aj podstatne znižovať jeho kvalitu. Včasným stanovením diagnózy a neodkladným zavedením dôsledných diétnych opatrení je možné u podstatnej časti pacientov dosiahnuť ústup klinickej symptomatológie a znížiť výskyt závažných komplikácií choroby (26).
Prakticky už od roku 1888 stále platí, že diéta je najúčinnejším liečebným prostriedkom, aj keď sa pracuje na iných formách alternatívnej terapie (24). Z klinického hľadiska je typický ústup príznakov po nasadení diéty a naopak zhoršenie pri expozícii lepku, pričom aj jeho malé množstvo je schopné navodiť relaps. Relaps ochorenia môže privodiť aj nešpecifická záťaž, ako je infekcia, psychická trauma, alebo pôrod (19).
Široké spektrum klinických manifestácií celiakie je výsledkom komplexnej súhry rozličných environmentálnych, genetických a imunitných faktorov (26). Je preto nutné na toto ochorenie myslieť aj pri iných ako typických prejavoch, ako aj u pacientov vo vyššom veku.
Pre včasnú diagnostiku celiakie je vhodný skríning rizikových skupín (19). U vysoko podozrivých prípadov je okrem sérologického vyšetrenia, aj pri jeho negatívnom výsledku, potrebné dokončiť diagnostiku kompletne, vrátane bioptického vyšetrenia ako aj diferenciálnej diagnostiky CD-like enteropatií. Je zrejmé, že aplikáciou cieleného skríningu, nesporne dôjde k odhaleniu nových, predovšetkým atypických foriem celiakie, ale časť ostane aj napriek tomu nediagnostikovaná (24).
V neposlednom rade treba spomenúť, že napriek známemu patogénu a vysokej incidencii ochorenia, aj v dnešnej modernej spoločnosti pociťuje pacient sociálne obmedzenia, čo vyplýva väčšinou z nevedomosti okolia. Nezanedbateľné sú aj ekonomické dopady ochorenia.
MUDr. Mgr. Zuzana Mináriková
II. interná klinika LFUK a UNB
Mickiewiczova 13
Bratislava 813 69
Slovensko
E-mail: minarik.susan@gmail.com
Sources
1. Ambrosetto, G., Antonini, L., Tassinari, C.A. Occipital lobe seizures related to clinically asymptomatic celiac disease in adulthood. Epilepsia 1992, 33, p. 476-481.
2. Bardella, M.T., Minoli, G., Radaelli, F. et al. Re-evaluation of duodenal endoscopic markers in the diagnosis of celiac disease. Gastrointest. Endosc. 2000, 51, p. 714-716.
3. Bruce, S.E., Bjarnason, I., Peters, T.J. Jejunal transglutaminase - demonstration of activity, enzyme-kinetics, substrate-specificity and levels in patients with celiac-disease. Clin. Sci. 1984, 66, p. 64.
4. Card, T.R, West, J., Holmes G.K. Risk of malignancy in diagnosed coeliac disease: a 24-year prospective, population-based, cohort study. Aliment. Pharmacol. Ther. 2004, 20, p. 769-775.
5. Case records of the Massachusetts General Hospital (Case 5-2001). N. Engl. J. Med. 2001, 344, p. 510-517.
6. Rakover, Y., Hager, H., Nussinson, E., Luboshitzky, R. Celiac disease as a cause of transient hypocalcemia and hypovitaminosis D in a 13 year-old girl. J. Pediatr. Endocrinol. Metab. 1994, 7, p.53-56.
7. Daum, S., Hummel, M., Weiss, D. et al. Refractory sprue syndrome with clonal intraepithelial lymphocytes evolving into overt enteropathy-type intestinal T-cell lymphoma. Digestion 2000, 62, p. 60-65.
8. Di Sabatino, A., Ciccocioppo, R., Daló, S. et al. Intraepithelial and lamina propria lymphocytes show distinct patterns of apoptosis whereas both populations are active in Fas based cytotoxicity in coeliac disease. Gut 2001, 49, p. 380-386.
9. Dítě, P., Lukáš, M., Lata, J. a kol. Celiakie. In Češka R., Dítě P., Štulc T., Tesař V. a kol. Interna, Praha: Triton 2010, s. 391-394. ISBN 978-80-7387-423-0.
10. Donald, A.A. Celiac disease: a progress report. Mod. Pathol. 2003,16, p. 342-346.
11. Donaldson, M.R., Book, L.S., Leiferman, K.M. et al. Strongly positive tissue transglutaminase antibodies are associated with Marsh 3 histopathology in adult and pediatric celiacdisease. J. Clin. Gastroenterol. 2008, 42, p. 256-260.
12. Fassano, A., Catassi, C. Current approaches to diagnosis and treatment of celiac disease: an evolving spectrum. Gastroenterol. 2001, 120, p. 636-651.
13. Greco, L., Romino, R., Coto, I. et al. The first large populationbased twin study of celiac disease. Gut 2002, 50, p. 624-628.
14. Green. P.H.R., Bana. J. Coeliac disease, Lancet 2003, 362, p. 383-391.
15. Godkin. A., Jewell. D. The pathogenesis of celiac disease. Gastroenterol.1998, 115, p. 206-210.
16. Halpert, A.D. Importance of early diagnosis in patients with irritable bowel syndrome. Postgraduate Medicine 2010, 122, p. 102-110.
17. Harper, J.W., Holleran, S.F., Ramakrishnan, R. et al. Anemia in celiac disease is multifactorial in etiology. Am. J. Hematol. 2007, 82, p. 996-1000.
18. Janutuinen, E.K., Pikkarainen, P.H., Kemppainen, T.A. et al. A comparison of diets with and without oats in adults with celiac disease. N. Engl. J. Med. 1995, 333, p. 1033-1037.
19. Jirásek, V. Celiakální sprue, gluténová enteropatie. In Klener P. a kol. Vnitřní lékařství. Praha: Galén a Karolinum 2006, 3. vyd., s. 591-592. ISBN 80-7262-430-X (Galén), ISBN 80-246-1252-6 (Karolinum).
20. Lísová, S., Ehrmann, J., Kolek A. a kol. Imunohistochemická studie mechanismů apoptózy a proliferace ve sliznici tenkého střeva u celiakální sprue. Česk-Slov Patol. 2005, 41, s. 85-93.
21. Ludvigsson, J.F., Montgomery, S.M., Ekbom, A. Celiac disease and risk of adverse fetal outcome: a population-based cohort study. Gastroenterol. 2005,129, p.454-463.
22. Maki, M. Tissue transglutaminase as the autoantigen of coeliac disease. Gut 1997, 41, p. 565-566.
23. Maki, M., Collin, P. Coeliac disease. Lancet 1997, 349, p. 1755-1759.
24. Makovický, P., Rimárová, K. Význam a možnosti skríningu v diagnostike celiakie. Vnitř. Lék. 2011, 57, s. 183-187.
25. O’Malley, D.P., Gulley, M.L., Banks P.M. Enteropathy-type T-cell lymphoma: its relationship to refractory celiac disease. Pathol. Case Rev. 2002, 7, p. 110-116.
26. Pekárková, B., Pekárek, B., Kabátová, J. Štandardný diagnostický a terapeutický postup: 46. Metodický list racionálnej farmakoterapie: Racionálna diagnostika a liečba celiakie: Metodický list Ústrednej komisie racionálnej farmakoterapie a liekovej politiky MZ SR, Herba 2009, r. 13, č. 1-2.
27. Prince, H.E. Evaluation of the INOVA diagnostics enzyme-linked immunosorbent assay kits for measuring serum immunoglobulin G (IgG) and IgA to deamined gliadin peptides. Clin. Vaccine Immunol. 2006, 13, p. 150-151.
28. Riches, Ph.L., McRorie, E., Fraser, W.D. et al. Osteoporosis associated with neutralizing autoantibodies against osteoprotegerin. N. Engl. J. Med. 2009, 361, 15, p. 1459-1465.
29. Rostami, K., Kerckhaert, J., Tiemessen, R. et al. Sensitivity of antiendomysium and antigliadin antibodies in untreated celiac disease: Disappointing in clinical practice. Amer. J. Gastroenterol. 1999, 94, p. 888-893.
30. Rostami, K., Kerckhaert, J., Tiemessen R. et al. The realtionship between anti-endomysium antibodies and villous atrophy in coeliac disease using both monkey and human substrate. Eur. J. Gastroenterol. Hepatol. 1999, 11, p. 439-442.
31. Rostami, K., Steegers, E.A.P., Wong, W.Y. et al. Coeliac disease and reproductive disorders: a neglected association. Eur. J. Obstet. Gynecol. Reprod. Biol. 2001, 96, p. 146-149.
32. Sanders, D.S., Carter, M.J., Hurlstone D.P. et al. Association of adult coeliac disease with irritable bowel syndrome: a casecontrol study in patients fulfilling ROME II criteria referred to secondary care. Lancet 2001, 358, p. 1504-1508.
33. Shah, V.H., Rotterdam, H., Kolter, D.P. et al. All that scallops is not celiac disease. Gastrointest. Endosc. 2000, 51, p. 717-720.
34. Smyth, D.J., Plagnol, V., Walker, N.M. et al. Shared and distinct genetic variants in type 1 diabetes and celiac disease. N. Engl. J. Med. 2008, 359, p. 2767-2777.
35. Sugai, E., Moreno, M.L., Hwang, H.J. et al. Celiac disease serology in patients with different pretest probabilities: is biopsy avoidable? World J. Gastroenterol. 2010, 16, p. 3144–3152.
36. Šašinka, M. Poruchy resorbcie. Celiakia. In Šašinka M., Šagát T., et al. Pediatria. Košice: Satus 1998, s. 386-388. ISBN 80-967963-0-5, 9.
37. Tata, L.J., Card, T.R., Logan, R.F. et al. Fertility and pregnancy-related events in women with celiac disease: a population-based cohort study. Gastroenterol. 2005, 128, p. 849-855.
38. Trier, J.S. Diagnosis of celiac sprue. Gastroenterol. 1998, 115, p.211-216.
39. Tursi, A., Brandimarte, G., Giorgetti, G. et al. Low prevalence of antigliadin and anti-endomysium antibodies in subclinical/ silent celiac disease. Am. J. Gastroenterol. 2001, 96, p. 1507-1510.
40. van Hee, D.A., West, J. Recent advances in clinical practice: Recent advances in coeliac disease. Gut 2006, 55, p. 1037-1046.
41. Vermeersch, P., Richter, T., Hauer A.C. et al. Use of likelihood ratios improves clinical interpretation of IgG and IgA anti-DGP antibody testing for celiac disease in adults and children. Clin. Biochem. 2010, 411, p. 13-17.
42. Wahnschaffe, U., Ullrich, R., Riechen, E.O., Schulzke J.D. Celiac disease-like abnormalities in a subgroup of patients with irritable bowel syndrome. Gastroenterol. 2001, 121, p. 1329-1338.
43. Walburga, D., Ehnis, T., Bauer M. et al. Identification of tissue transglutaminase as the autoantigen of celiac disease. Nat. Med. 1997, 3, p. 797-801.
Labels
General practitioner for children and adolescents General practitioner for adultsArticle was published in
General Practitioner

2012 Issue 2
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Hope Awakens with Early Diagnosis of Parkinson's Disease Based on Skin Odor
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Memantine Eases Daily Life for Patients and Caregivers
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
-
All articles in this issue
- Základy kognitivní, afektivní a sociální neurovědy; XIV. Kulturní neurověda
- Charakteristika akutních otrav v seniorském věku, Zkušenosti Toxikologického informačního střediska v Praze
- Gluténová enteropatia
- Primární prevence v ordinaci praktického lékaře pro dospělé
- Použití epidemiologických dat při odhadu rizika karcinogenity a princip předběžné bezpečnosti
- Primární péče v České republice v letech 2005–2010
- Stresové situace lékaře jako pacienta: komunikace, vyšetření, zkušenost, etika
- Elektronická dokumentace pro ošetřovatelskou diagnostiku v domácí péči
- Podprahové vnímání, medicína a návykové nemoci
- Hodnocení potřeb terminálně nemocných v domácí péči: pilotní studie
- General Practitioner
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Gluténová enteropatia
- Podprahové vnímání, medicína a návykové nemoci
- Primární prevence v ordinaci praktického lékaře pro dospělé
- Elektronická dokumentace pro ošetřovatelskou diagnostiku v domácí péči
