Vývoj operativy onemocnění jater a žlučových cest
The development of surgical treatment in liver and biliary tract diseases
Introduction:
Surgical liver and biliary tract diseases remain to be among the most serious and the incidence of illnesses requiring surgical treatment has been increasing. It is therefore essential to consider the new possibilities of oncological and miniinvasive care, including ablation treatment, and to evaluate their importance and integration in the treatment system.
Material and methods:
The article presents a retrospective analysis of three consecutive sets of patients from 1991–2011. Our monitoring focused primarily on bile duct lesions and on primary and secondary tumours of the liver. Assessments included the extent and method of the operation, neoadjuvant and adjuvant care, complications, lethality, and survival rate.
Results:
Our study confirmed that the number of surgically treated secondary tumours (colorectal carcinoma metastases) rose by 9% as a result of downstaging (i.e., the combination of chemotherapy and oncological treatment or RFA) and the use of embolization via the portal vein and sequential resections. With no fundamental changes recorded in hepatocellular carcinoma treatment, resection or transplantation still appears to be the only curative treatment method. One-year survival is minimal without these procedures. We recorded a slight increase in the incidence of cholangiocarcinoma from 6 to 10.3%. The results of extrahepatic and hepatic form resections range from 0 to 90%, depending on the stage of the disease. Biliary duct lesions are treated more frequently at the time of laparoscopic surgery; they are diagnosed later or when stenosis has already developed, and hepaticojejunoanastomosis is the most widely applied procedure in treating the lesions. The authors indicate the ablation methods in hepatic and bile duct tumour treatment only when resection treatment is not possible.
Conclusion:
Surgical resection treatment in malignant diseases of the liver and biliary tract remains the primary treatment method with a high curative potential. Neoadjuvant combined treatment increases the eligibility of patients for such surgical procedures. In biliary tract lesions, we also regard the surgical approach as dominant. The overview of results for individual periods implies the necessity of interdisciplinary care in order to achieve better results in surgical management.
Key words:
liver and bile duct surgery – hepatocellular carcinoma – cholangiocarcinoma – bile duct lesion – downstaging
:
Z. Krška; J. Šváb; J. Ulrych
:
I. chirurgická klinika 1. LF UK a VFN v Praze, přednosta: prof. MUDr. Z. Krška, CSc.
:
Rozhl. Chir., 2012, roč. 91, č. 9, s. 464-468.
:
Original articles
Úvod:
Chirurgická onemocnění jater a žlučových cest patří stále k nejzávažnějším a incidence onemocnění vyžadujících chirurgickou léčbu vzrůstá. S novými možnostmi onkologické a miniinvazivní péče, včetně ablační, je nutno zhodnotit jejich význam a zapojení do systému léčby.
Materiál a metodika:
Článek podává retrospektivní analýzu tří následujících souborů z období 1991–2011. Ve studiích jsme sledovali především léze žlučových cest, primární a sekundární nádory jater. Předmětem hodnocení byly mj. rozsah a způsob operace, neoadjuvantní a adjuvatní péče, komplikace, letalita a dlouhodobost přežití.
Výsledky:
Studií bylo potvrzeno zvýšení počtu operovaných sekundárních nádorů (metastáz kolorektálního karcinomu) o 9 % v důsledku downstagingu (kombinace chemoterapie a onkologické léčby či RFA) a využití embolizace cestou vena portae a etapovitých resekcí. Bez zásadních změn u hepatocelulárního karcinomu se resekce či transplantace stále jeví jedinými kurativními metodami léčby. Roční přežití bez těchto výkonů je zcela minimální. Zaznamenali jsme mírný vzestup výskytu cholangiokarcinomu z 6 na 10,3 %. Výsledky resekcí extrahepatické a hepatické formy v závislosti na stadiu kolísají od 0–90 %. V našem souboru v době zavedení laparoskopické chirurgie došlo ke zvýšení počtu ošetřených pro poranění žlučových cest, diagnostikovaných s časovým odstupem nebo jako již s vytvořenou stenózou. V ošetření lézí převažovala hepatikojejunoanastomóza.
Ablační metody u tumorů jater a žlučovodů autoři indikují až při nemožnosti provést resekční léčbu.
Závěr:
Chirurgická resekční léčba zůstává u maligních onemocnění jater a žlučových cest základním způsobem léčby s vysokým kurativním potenciálem. Neoadjuvantní kombinovaná léčba umožňuje zvýšit počet indikací k chirurgickému výkonu. U lézí žlučových cest považujeme chirurgický přístup rovněž za dominantní. Z přehledu výsledků jednotlivých období vyplývá nutnost mezioborové péče ke zlepšení výsledků chirurgické péče.
Klíčová slova:
chirurgie jater a žlučových cest – hepatocelulární karcinom – cholangiokarcinom – poranění žlučových cest – downstaging
ÚVOD
Chirurgická onemocnění jater a žlučových cest patří stále k nejzávažnějším a jejich počet neklesá. V souvislosti s rozvojem diagnostiky a léčby je i zde možno zaznamenat určité změny, třebaže ani v této lokalitě nedošlo především v onkochirurgii k očekávanému průlomu ve výsledcích [1–44]. Na základě porovnání dat chirurgické, onkologické, radiologické a další léčby nádorových onemocnění jater, a to ve třech obdobích (1991–2001, 2002–2006 a dále období let 2007–2011), jsou prezentovány některé posuny a vývoj chirurgické strategie léčby těchto onemocnění. Rovněž je demonstrován přehled výsledků operací žlučových cest pro jejich nádory či iatrogenní léze. Je uveden přehled a schéma komplexní onkochirurgické strategie léčby, určované v posledních obdobích vždy komplexním multioborovým indikačním seminářem. Cílem porovnání jednotlivých období bylo zjistit, zda, kdy a za jakých podmínek dochází ke zlepšování výsledků chirurgické léčby.
MATERIÁL A METODIKA
Retrospektivní analýza výsledků chirurgické léčby onemocnění jater a žlučových cest v letech 1991–2011, celkem tedy 21 let. Výsledky prvního období (1991–2001) a druhého (2002–2006) byly, včetně zde citované další retrospektivy, opakovaně publikovány a přednášeny. Posledním je třetí období, 2007–2011, které je zpracováno ne zcela kompletně, především stran dlouholetého přežití, kdy hodnocené intervaly ještě u části pacientů běží [2–4, 7–12, 15, 16, 18–22, 24, 26, 28, 30, 32, 38, 39, 41, 42, 44].
VÝSLEDKY
Základní přehled výsledků je vzhledem k mimořádnému objemu dat uveden ve dvou tabulkách a komentovaném přehledu výsledků.
Přehled výsledků a základní komentář
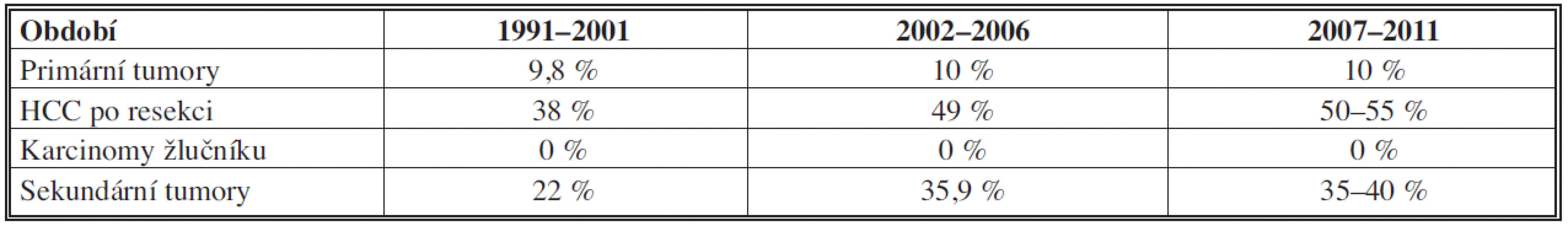
Ve všech obdobích tvoří podíl hepatocelulárního karcinomu (HCC) v primárních tumorech 86 % (z toho 89 % v cirhóze). Se solitární formou jsme se u tohoto tumoru setkali v 69 %, multilokulární v 30 %, difúzní v 1 %. Ke klasifikaci byl užíván nověji Barcelonský stagingový systém (BCLC) [42]. K operaci byli indikováni únosní nemocní, kdykoliv byl nádor radikálně odstranitelný a nebyli indikováni k transplantaci. U resekčních výkonů dochází v souborech jen k mírnému, statisticky obtížně zhodnotitelnému růstu počtu pětiletého přežití oproti druhému období, zřejmě díky multimodální terapii (viz Tab. 2). Paliativní léčba HCC zahrnovala chemoembolizaci či ablační metody a biologickou léčbu.
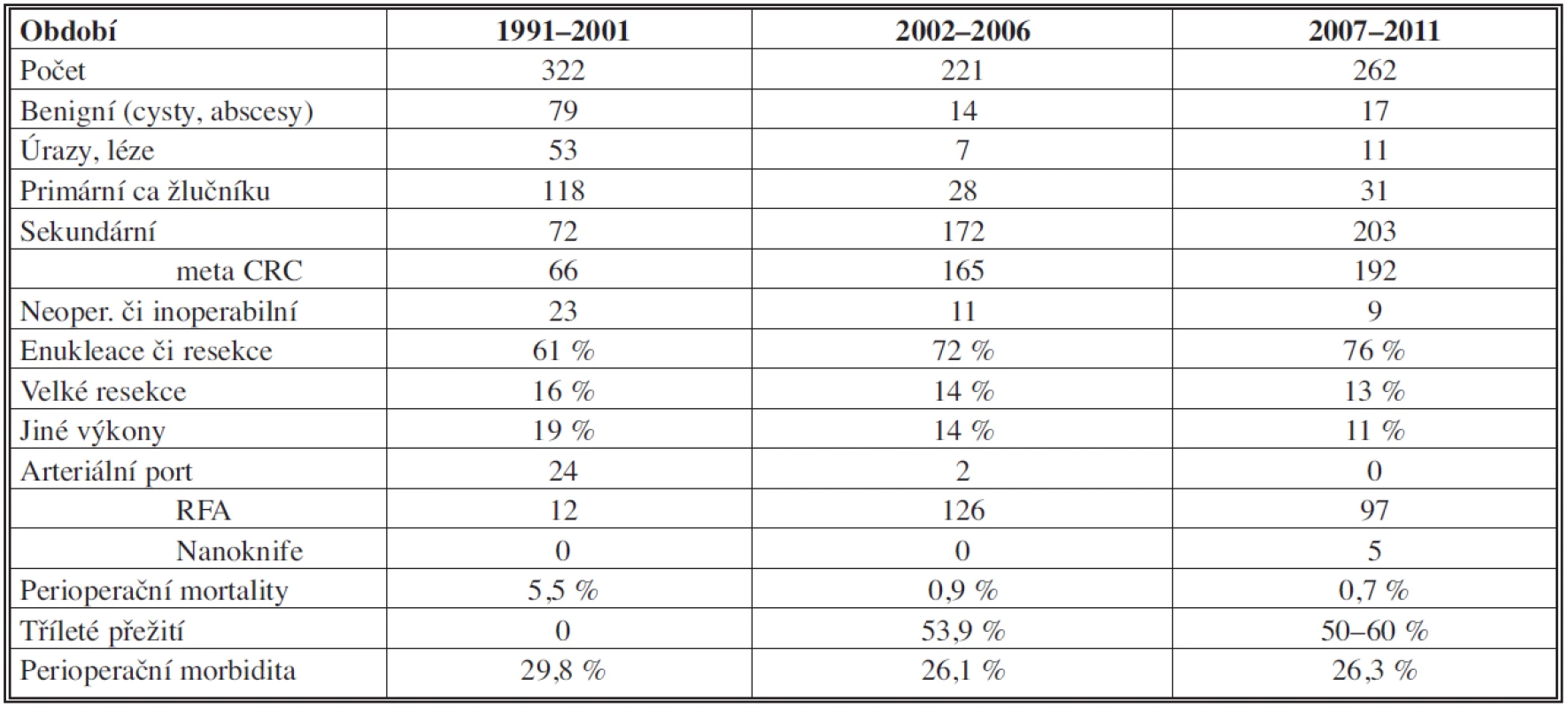
Klesl počet neoperovaných (přehodnoceni před výkonem) či neoperabilních z 23 na 9, tj. ze 7 % na 3 %. Přežití plně korelovalo se stadiem postižení jater jak tumorem, tak cirhózou, když tato byla přítomná v 92,6 %. Bez resekce jen 2 pacienti přežívali 1 rok.
Nepozorovali jsme výraznější vzestup počtů karcinomu žlučníku, jeho operativa je zahrnuta v resekčních výkonech.
Podíl cholangiocelulárního karcinomu (CHCC) se mírně zvyšuje z 6 % na 10,3 %. Nalezli jsme zásadní rozdíl pětiletého přežití mezi stadii – u prvního stadia bylo 90 %, u druhého 62 %, třetího 29 % a čtvrtého 0 %.
Nejčastější operovanou sekundaritou byly metastázy kolorektálního karcinomu (mCRC).
Zvýšení jejich resekability bylo mezi obdobími celkově o 9 %, a to opět zásluhou neoadjuvantní terapie, etapovitých resekcí a embolizací větví vena portae. RFA byla využita v downstagingu či u neresekabilních tumorů. Obdobně byl využit i nanoknife (IRE.)
Bez resekce bylo u primárních a sekundárních maligních nádorů pětileté přežití ve všech obdobích 0 % (dohledatelnost 86,7 %).
Operace žlučových cest
Z dlouhodobé evidence operací žlučníku a žlučových cest vyplývá, že od roku 1971 do roku 2010 bylo provedeno celkem 15 345 elektivních cholecystektomií (CHCE), 3588 akutních CHCE a 1219 CHCE jako součást jiného výkonu (analyzovány v dalším článku) a 1017 revizí žlučových cest. Dále bylo provedeno 311 operací poranění žlučových cest, z toho 164 plastik na T drénu a 147 lézí bylo řešeno hepatikojejunoanastomózou (HJA). Reoperace, nejčastěji po HJA, proběhly u 18 % pacientů v období do roku 2000, v období následném s rozvojem možností intervenčních perkutánních metod klesly na 5 %. K dvojnásobnému vzestupu HJA došlo oproti předchozímu období od devadesátých let.
Počty výkonů z důvodu poranění žlučových cest a papily při endoskopickém výkonu mají setrvale klesající tendenci. V období 1991–2000 to byl postupný sestup z 5,3 na 2,1 %, následně 2001–2006 na 0,7 % až na 0,3 % v letech 2007–2011.
Nádory distálních částí choledochu jsou zahrnuty v článku Posuny v chirurgii pankreatu (Rozhl Chir, 2012;91(5):262-6).
Z dalších nádorů to byly extrahepatické CHCC, kdy bylo téměř 88 % Klatskinových tumorů demonstrováno v pokročilém III. či IV. stadiu (Bismuth-Corlette klasifikace). Resekabilita byla minimální zvláště u centrálních typů bez možnosti chirurgické intervence, s adekvátním přežíváním. Přežití delší než 2 roky po hilární resekci s resekcí jater pozorujeme u 52 %.
DISKUZE
Ve vývoji chirurgie jater vidíme jasný trend ke zvyšování operativy sekundárních tumorů jater, především metastáz kolorektálního karcinomu. Jedná se o celosvětový trend s potvrzenými výsledky [2–8] a pro významný efekt společné onkologické a chirurgické léčby svědčí prodlužování přežití [7–9]. Na zvyšování počtu resekcí se podílí právě i v našem souboru – v souladu s literaturou – onkologický downstaging a etapové resekce [4–9]. Dominantním postupem v posledních letech byla i v našich souborech při současném výskytu metastázy a sekundárního nádoru primární resekce nádoru a odložené odstranění metastázy po onkoterapii (72 %). Současná resekce je indikována ve 27 %, ojediněle byl využit přístup metastasis surgery first ve zvyklé indikaci [5–8]. Laparoskopický přístup (kromě diagnostiky) jsme použili u lézí při plánovaném výkonu na periferních segmentech vpravo, či na levém jaterním laloku (celkově 18 %). V souborech lze pozorovat i jistý pokles velkých jaterních resekcí, a to jednak z důvodu snahy o parenchym šetřící resekce a zčásti i z důvodu reprofilizace traumacenter. Všeobecně v devadesátých letech byla tendence k provádění větších výkonů, než je tomu v dnešní době. Toto vše se podílí (spolu s vybudováním moderního zázemí intenzivní péče) i na poklesu letality v následných obdobích.
U mCRC má vždy přednost chirurgická léčba (resekce). V případě downstagingu byla a je používána kombinace chemoterapie a biologické léčby. Do roku 2006 to byl 14 dní FOLFOX či FOLFIRI + Avastin, nyní FOLFOX či FOLFIRI + Erbitux. Operace po Avastinu následovala v odstupu 6 týdnů (je antiangiogenní), po erbituxu v kratším odstupu. V další léčbě, i když je toto diskutováno [9–12], u většiny byla podána chemoterapie, při které došlo primárně efektivně k downstagingu, ale bez biologické léčby.
Z primárních tumorů je v souborech všech období nejčastěji zastoupen HCC. Jeho diagnostika, klasifikace, indikační kritéria k nabídce na transplantaci byla modifikována dle postupného vývoje [13–21].
Onkologická léčba jako adjuvantní nebo neaodjuvantní nebyla u primárních tumorů podána. U pokročilých, neresekabilních stavů (nádorový trombus v portálním řečišti, přítomnost mimojaterního onemocnění (metastázy do regionálních uzlin – N1 nebo vzdálené metastázy M1) pak byla podána při relativně dobrém stavu po TACE (transarteriální chemoembolizace jater) léčba Sorafenibem (Nexavar) [17, 18, 21].
Resekce jater a transplantace jater jsou nadále metodami dávajícími nejlepší šance léčby HCC [15, 20, 22]. I vlastní výsledky potvrdily, že adjuvantní léčba prolonguje disease free interval [21]. Pokles primárních tumorů v indikacích je dán odchodem části indikující hepatologické skupiny na jiné pracoviště.
RFA je využívána u primárních i sekundárních nádorů ve zvyklých indikacích [5, 6, 13, 14] pod CT či sono kontrolou vzácněji otevřenou či laparoskopickou cestou.
I když některá literární sdělení ukazují na porovnatelnost operace a RFA u malých tumorů [20], tuto indikaci k RFA zatím neakceptujeme, resekce má přednost. Do výbavy kliniky byla zařazena i IRE (nanoknife 6/2011), byla provedena i kombinovaná destrukce IRE a RFA (1/2012). Hodnocení IRE však vyžaduje soubor a čas, je proto mimo rozsah sdělení.
V souladu s literaturou [23–25] pozorujeme vzestup Klatskinových tumorů, oproti předchozím obdobím však statisticky hůře zhodnotitelný pro oddělení části indikující skupiny a nedostupnost řady starších údajů. Jedinou šanci na delší přežití skýtá chirurgická intervence (od resekce po transplantaci) [23–26]. Klatskinovy tumory jsou také konzultovány i vzhledem k možné transplantaci jater, která vykazuje povzbudivé výsledky [25]. Klatskinův tumor byl řešen chirurgicky ve 12 %. Více než 90 % pacientů bylo totiž v pokročilém III. či IV. stadiu, což je opět potvrzení řady jiných studií [23, 24].
Obecně jsou pak výsledky léčby nádorů jater – jak perioperační, tak pooperační – srovnatelné s výsledky jiných velkých center [4, 10, 13, 26, 27].
Z přehledu operací žlučových cest vyplývá zásadní pokles operací choledocholithiasy, když nyní je již řadu let indikována k řešení pouze „obtížná, endoskopicky či LERV (příp. kombinací) neřešitelná litiasa“, což odpovídá i literárním sdělením [28–32].
Přehled výsledků ošetření lézí žlučových cest umožňuje porovnat období přechodu laparotomické elektivní chirurgie žlučníku k laparoskopické, kdy se zvýšil výskyt těžších lézí, s korektní diagnózou stanovenou více než v 60 % případů až v odstupu od operace – opět v souladu s literárními sděleními [28–35]. Dominantním řešením je hepatikojejunoanastomóza [28, 30, 31].
Nádory distálních žlučových cest jsou zahrnuty v resekčních výkonech na játrech. Zde tvoří jednoznačně skupinu s nejkratším mediánem přežití. Nádory terminálního choledochu jsou obsaženy ve sdělení o nádorech pankreatu a duodena, zde naopak svým pětiletým přežíváním (25,3 %) patří k příznivějším (viz článek Posuny v chirurgii pankreatu (Rozhl Chir, 2012;91(5):262-6).
Primární sklerotizující cholangoitida (SC) či sekundární SC byla řešena celkem 8krát, izolovanými resekcemi. V případě difúzního postižení byla vždy konzultována možnost transplantace.
ZÁVĚR
Přehled výsledků dokumentuje určitý vývoj a systematizaci péče v chirurgii jater a žlučových cest. Resekční výkony stále představují nejlepší kurativní možnost jak u primárních tumorů jater, tak u sekundárních – především mCRC, a dále u nádorů žlučových cest. Chemoterapie a biologická léčba nabízejí možnost downstagingu (podobně jako RFA) a v případě adjuvantního či léčebného použití pak prodlužuje disease free interval s diskutabilním prodloužením přežití. Včasná diagnostika maligních lézí jater a žlučových cest umožňuje výraznější přežití, u pozdních diagnóz nepřináší ani současný kombinovaný léčebný přístup přelomové výsledky v přežívání. Zásadní je pak chirurgický výkon u lézí žlučových cest, kde je dominantní využití HJA, zvláště u rozsáhlejších lézí. Pro významnou část onemocnění jater a žlučových cest platí zásadní nutnost využití komplexního indikačního semináře.
Prof. MUDr. Zdeněk Krška, CSc.
I. chirurgická klinika 1. LF UK a VFN, U Nemocnice 2
128 08 Praha 2
e-mail: krskaz@vfn.cz
Sources
1. Llovet JM, Bru C, Bruix J. Prognosis of hepatocellular carcinoma: the BCLC staging classification. Seminář Liver Dis 1999;19 : 329–328.
2. Primrose JN. Surgery for colorectal liver metastases. Br J Cancer 2010,27;102(9):1313–8.
3. Tanaka K, Ichikawa Y, Endo I. Liver resection for advanced or aggressive colorectal cancer metastases in the era of effective chemotherapy: a review. Int J Clin Oncol 2011;16(5):452–63.
4. Maroulis I, Karavias DD, Karavias D. General principles of hepatectomy in colorectal liver metastases. Tech Coloproctol 2011;15Suppl1:S13–6.
5. Fusai G, Davidson BR. Strategies to increase the resectability of liver metastases from colorectal cancer. Dig Surg 2003;20 (6):481–96.
6. Shimada H, Tanaka K, Matsuo K, Togo S.Treatment for multiple bilobar liver metastases of colorectal cancer. Langenbecks Arch Surg 2006;391(2):130–42.
7. Nikfarjam M, Shereef S, Kimchi ET et al. Survival outcomes of patients with colorectal liver metastases following hepatic resection or ablation in the era of effective chemotherapy. Ann Surg Oncol 2009;16(7):1860–7.
8. Scoggins CR, Campbell ML, Landry CS et al. Preoperative chemotherapy does not increase morbidity or mortality of hepatic resection for colorectal cancer metastases. Ann Surg Oncol 2009;16(1):35–41.
9. Chaudhury P, Hassanain M, Bouganim N et al. Perioperative chemotherapy with bevacizumab and liver resection for colorectal cancer liver metastasis. HPB (Oxford) 2010;12(1):37–42.
10. Hebbar M, Pruvot, FR, Romano O et al. Integration of neoadjuvant and adjuvant chemotherapy in patients with resectable liver metastases from colorectal cancer. Cancer Treat Rev 2009; 35(8):668–75.
11. Chemotherapy of metastatic colorectal cancer. Prescrire Int. 2010; 19(109):219–24.
12. García-Foncillas J, Díaz-Rubio E. Progress in metastatic colorectal cancer: growing role of cetuximab to optimize clinical outcome. Clin Transl Oncol 2010;12(8):533–42.HCC
13. Llovet JM. Updated treatment approach to hepatocellular carcinoma. J Gastroenterol 2005;40 : 225–235.
14. Brůha R et al. Diagnostika a léčba hepatocelulárního karcinomu. Vnitř Lék 2005;12 : 140–1408.
15. Belghiti J. Resection and liver transplantation for HCC. J Gastroenterol 2009;44,Suppl19 : 132–135.
16. Bruix J, Herman M. Management of hepatocellular carcinoma: an update. Hepatology 2011;53 : 1020–1022.
17. Forner A, Hessheimer AJ, Isabel Real M, Bruix J. Treatment of hepatocellular carcinoma. Crit Rev Oncol Hematol 2006; 60(2):89–98.
18. El-Serag HB, Marrero JA, Rudolph L, Reddy KR. Diagnosis and treatment of hepatocellular carcinoma. Gastroenterology 2008; 134(6):1752–63.
19. Masuzaki R, Omata, M. Treatment of hepatocellular carcinoma. Indian J Gastroenterol 2008;27(3):113–22.
20. Lau WY, Lai EC. Hepatocellular carcinoma: current management and recent advances. Hepatobiliary Pancreat Dis Int 2008;7 (3):237–57.
21. Samuel M, Chow PK, Chan Shih-Yen E et al. Neoadjuvant and adjuvant therapy for surgical resection of hepatocellular carcinoma. Cochrane Database Syst Rev 2009;21(1):CD001199.
22. Petrowsky H, Hong JC. Current surgical management of hilar and intrahepatic cholangiocarcinoma: the role of resection and orthotopic liver transplantation.Transplant Proc 2009;41(10): 4023–35.
23. Dinant S et al. Improved outcome of resection of hilar cholangiocarcinoma (Klatskin tumor) Ann Surg Oncol 2006;13,6 : 872–880.
24. Van Gulik TM et al. Original article: New surgical approaches to the Klatskin tumour. Aliment Pharmacol Ther 2007;26,Suppl2 : 127–32.
25. Zheng SS et al. Orthotopic liver transplantation for patiens with Klatskin tumor. Hepatobiliary pancreat Dis Int 2005;4,1 : 28–31.
26. Friman S. Cholangiocarcinoma – current treatment options Scandinavian Journal of Surgery 2011;100 : 30–34.
27. Lamesch P, Weimann A, Hauss J et al. Surgical treatment of intrahepatic cholangiocarcinoma Chirurgie 1997;122(2):88–91.
28. Lau WY, Lai EC, Lau SH. Management of bile duct injury after laparoscopic cholecystectomy: a review. ANZ J Surg 2010;80(1-2):75–81.
29. Mirza DF, Narsimhan KL, Ferraz Neto BH et al. Bile duct injury following laparoscopic cholecystectomy: referral pattern and management. Br J Surg 1997;84(6):786–90.
30. de SantibáĖes E, Ardiles V, Pekolj J. Complex bile duct injuries: management. HPB (Oxford) 2008;10(1):4–12.
31. Ahrendt SA, Pitt HA. Surgical therapy of iatrogenic lesions of biliary tract. World J Surg 2001;25(10):1360–5.
32. Mercado MA, Domínguez I. Classification and management of bile duct injuries. World J Gastrointest Surg 2011;27,3(4):43–8.
33. Svab J, Peskova M. Latrogenic injuries of the bile ducts in laparoscopic cholecystectomia. Rozhl Chir 1996;75,1 : 41–46.
34. Svab J et al. Reoperation in iatrogenic injuries in the biliary tract. Bratisl Lek listy 1996;97,12 : 734–736.
35. Svab J, Peskova M, Krska Z. Prevention, diagnosis and surgical treatment of injuries of the biliary tract due laparoscopic cholecystectomy.Treatment of papilla injurie cause by invasive endoscopy. Rozhl Chir 200;84,4 : 182–190.
36. Balas V, Peskova M, Svab J. Reoperation on the biliary tract and its preventive. Rozhl Chir 1981;60,3 : 148-53.
37. Paul O, Vítek P, Peskova M, Andrýsek O. Surgical and technical aspects of regional chemotherapy by means of an arterial catheter port, Cas Lek Ces 1995;134,14 : 435–439.
38. McWiliams et al. Percutaneous ablation of hepatocellular carcinoma: current status. J Vasc Interv Radiol 2010;21 : 204–213.
39. Nakagohri T, Kinoshita T, Konishi M et al. Surgical outcome and prognostic factors in intrahepatic cholangiocarcinoma. World J Surg 2008;32(12):2675-80.
40. Hemming AW, Reed AI, Fujita S et al. Surgical management of hilar cholangiocarcinoma. Ann Surg 2005;241(5):693–9;discussion 699–702.
41. Pessaux P, Chenard MP, Bachellier P et al. Consequences of chemotherapy on resection of colorectal liver metastases. J Visc Surg 2010;147(4):e193–201.
42. Folprecht G, Gruenberger T, Bechstein WO et al. Tumour response and secondary resectability of colorectal liver metastases following neoadjuvant chemotherapy with cetuximab: the CELIM randomised phase 2 trial. Lancet Oncol 2010;11(1):38–47.
43. Pešková M, Šváb J, Hořejš J et al. Možnosti ovlivnění metastatických nádorů jater. Sb Lek 2002;103(2):167–71.
44. Krška Z, Šváb J, Ulrych J. Nádory jater – možnosti chirurgické léčby. Staškovy dny, 2009, předn + Sborník.
Labels
Surgery Orthopaedics Trauma surgeryArticle was published in
Perspectives in Surgery

2012 Issue 9
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
-
All articles in this issue
- Abdominal complications in patients with implanted mechanical cardiac support
- The development of surgical treatment in liver and biliary tract diseases
- SILS appendectomy for acute appendicitis – two-year experience
- Pharmacological influencing of abdominal aortic aneurysm model – animal experimental study, primary results
- Diverticulum of the greater curvature of the stomach as a cause of anaemisation
- A giant gastrointestinal stromal tumour – a case report
- Perspectives in Surgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- A giant gastrointestinal stromal tumour – a case report
- Diverticulum of the greater curvature of the stomach as a cause of anaemisation
- The development of surgical treatment in liver and biliary tract diseases
- SILS appendectomy for acute appendicitis – two-year experience
