-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
Vyšlo v časopise: Anest. intenziv. Med., 21, 2010, č. 6, s. 351-373
Mladá Boleslav 16.–18. 2. 2010
Synopse – 2. část
IX. INTERAKCE UPV A ORGÁNOVÝCH FUNKCÍ
1. Hyperkapnická acidóza – nové pohledy
Matějovič M., Chvojka J., Sýkora R., Beneš J., Raděj J., Kroužecký A., Karvunidis T., Novák I.
JIP I. interní kliniky, Fakultní nemocnice v Plzni, Univerzita Karlova v Praze, Lékařská fakulta v Plzni
Oxid uhličitý (CO2) je vedlejším produktem buněčného dýchání všech aerobních forem života. Parciální tlak CO2 je určován rovnováhou mezi jeho produkcí a eliminací. Hyperkapnie je obvykle v klinické praxi považována za nežádoucí a její přítomnost vede kliniky k opatřením směřujícím k dosažení normálních hodnot. Odhalení škodlivého vlivu umělé plicní ventilace velkými dechovými objemy u pacientů s ARDS nás naučilo tolerance k hyperkapnii (permisivní hyperkapnie) a ukázalo, že může být pacienty dobře tolerována či dokonce protektivní. Recentní výsledky výzkumu dokonce poukazují na příznivou úlohu hyperkapnie v patogenezi zánětu či tkáňové oxygenace a poškození. Koncept permisivní hyperkapnie tak dostává nový rozměr a objevuje se paradigma terapeutické hyperkapnie. Ta je spojena s řadou (dosud nedostatečně popsaných) buněčných a molekulárních změn, které mohou být využity v prevenci a léčbě akutního tkáňového poškození, vyvolaného např. ischemicko-reperfuzním traumatem, krvácením či sepsí. Vedle ostatních fyziologicky se vyskytujících plynů s terapeutickým potenciálem (NO, CO, O2, H2S) se CO2 dostává do popředí vědeckého zájmu u kriticky nemocných. Z klinického pohledu je významnou předností jeho snadné monitorování a nízká cena exogenního zdroje. I když koncept terapeutické hyperkapnie nemůže být pro praxi doporučen mimo rámec permisivní hyperkapnie u ARDS, poskytuje jeho studium významné informace v oblasti buněčné fyziologie za akutních patologických stavů.
Podpořeno výzkumným záměrem MSM 0021620819 Náhrada a podpora funkce některých životně důležitých orgánů.
2. Variabilita HR a TK během ventilace
Zvoníček V.
Anesteziologicko-resuscitační klinika, FN u sv. Anny v Brně, Lékařská fakulta Masarykovy univerzity, Brno
Termín variabilita tepové frekvence: Tepová frekvence je běžně chápána jako počet tepů za minutu, během jednotlivého hodnocení klinikem je chápana jako statická veličina. K vysvětlení pojmů variabilita tepové frekvence (heart rate variability, HRV) je třeba si představit tepovou frekvenci jako sérii časových intervalů mezi jednotlivými tepy. Časový interval mezi jednotlivými tepy hodnotíme na křivce EKG jako interval mezi dvěma sousedními vlnami R, uváděno jako RR interval. Každému RR intervalu lze přiřadit tepovou frekvenci (60s/RR). Znázorněním trvání jednotlivých RR nebo k RR přiřazených tepových frekvencí v čase získáme křivku variability tepové frekvence.
Jak variabilitu hodnotit? Pohledem na křivku variability můžeme zhodnotit jen vyšší či menší variabilitu, stanovit průměr není jednoduché, běžným posouzením trendu nepochopíme skryté pravidelnosti a procesy v měnlivém signálu. K vyhodnocení variability je používána metodologie z techniky, fyziky a matematiky, používané pojmy jsou často vzdálené medicíně. Nejjednodušším popisem je časová analýza (time domain analysis), kdy se vypočítá variabilita jako např. standardní odchylka následujících RR (SDANN) v určitém čase. Ve studiích je často užívána frekvenční analýza (frequency domain analysis) založena na Fourierově transformaci. Křivka variability HR je chápána jako součet sinusoid určitých frekvencí. Amplituda každé sinusové a kosinusové křivky určuje příspěvek na variabilitě, frekvenční analýza znázorňuje příspěvek jednotlivých frekvencí na variabilitě. Tímto způsobem je analyzován relativní příspěvek různých frekvencí na celkové variaci v dané datové řadě. Druhá mocnina příspěvku každé frekvence představuje výkon (power) na dané frekvenci. Vyhodnocením spektrální křivky v určitých pásmech frekvencí získáme kvantitativní data, která již můžeme srovnávat mezi jedinci či skupinami. Na základě konvence jsou vyhodnocovány následující frekvence: very low frequency (VLF; frekvence ≤ 0,04 Hz délka cyklu >25 s), low frequency, (LF; frekvence 0,04–0,15, cyklus 6–25 s) a high frequency (HF; frekvence 0,15–0,4 Hz, délka cyklu 2,5–6,0 s). Výkon v pásmu VLF je ovlivněn regulací teploty a humorálních systémů, v pásmu LF je citlivý na sympatickou a parasympatickou aktivitu a v HF je synchronizována s respiračním rytmem a je primárně ve vztahu k inervaci vagu. Poměr LF/HF odráží rovnováhu sympatiku a parasympatiku. Vedle frekvenční analýzy je používána celá řada jiných metod hodnocení variability, často velmi komplikovaných: power law analysis, detrended fluctuation analysis-ultifractal analysis a hodnocení entropie.
Vznik variability, variabilita a dýchání, baroreflex: Krevní tlak je ovlivněn dýcháním mechanicky a reflexně. Při spontánním dýchání dochází při nádechu ke zvýšení návratu krve do srdce a k vzestupu srdečního výdeje na základě zejména Starlingova mechanismu. Změny výdeje vedou k změně tlakových parametrů nejprve v plicní a následně v systémové cirkulaci. Tímto způsobem mechanicky dýchání ovlivňuje aktivitu baroreceptorů (nízkotlakých a vysokotlakých), informace z baroreceptorů ovlivní aktuální tonus sympatiku. Baroreceptorový reflex odpovídá na zvýšení tlaku snížením aktivity sympatiku a zvýšením aktivity parasympatiku, což vede k poklesu periferní rezistence, srdeční frekvence a snížení systolického objemu, a tedy k celkovému poklesu TK. Naopak snížení systémového tlaku vyvolá pokles aktivity vysokotlakých baroreceptorů, což vede ke zvýšení aktivity sympatiku a poklesu aktivity parasympatiku, a tím k vzestupu tlaku. Předpokládá se, že baroreceptory zasahují do regulace tlaku každých 10 sekund (vnitřní frekvence baroreceptorů 0,1 Hz). Zpoždění (fázový posun) je interval, kdy vzestup tlaku vyvolá reflexní zpomalení srdeční frekvence, za fyziologických podmínek je 1,8 s. Vedle baroreceptoru se na regulaci tlaku během dýchání podílí i aktivace síňových mechanismů regulace krevního tlaku (Bainbridgeův reflex). V neposlední řadě dýchání (frekvence a dechový objem) ovlivňuje tlak přímým vlivem dechového centra na kardio - a vazomotorické centrum v oblasti mozkového kmene a prodloužené míchy. Kombinace výše uvedených faktorů je odpovědná za kolísání tlaku (Traubeho-Heringovy vlny) a tepové frekvence (respirační sinusová dysrytmie) s dýcháním.
Variability v nemoci: Variabilita tepové frekvence je změněna během nemoci, stupeň alterace koreluje s tíží onemocnění. HRV ovlivňuje hypovolémie, srdeční selhání, hypertenze, onemocnění koronárních tepen, ischemická choroba srdeční, dále renální selhání, diabetes mellitus a další. Anestezie významně ovlivňuje variabilitu, např. nedávno byla publikována redukce LF/HF během intravenózní anestezie, výkon v HF poklesl v závislosti na nocicepci. Obecně vede anestezie k poklesu LF/HF. Očekáváně byla popsána u mozkové smrti významná redukce variability tlaku.
Variabilita u kriticky nemocných: Klinický výzkum variability tepové frekvence byl zpočátku doménou kardiologie. Vzhledem k technickým možnostem a způsobu monitorování není divu, že práce zkoumající HRV se objevily záhy i v intenzivní medicíně. V následujícím textu uvádím jen některé příklady výsledků hodnocení HRV u kriticky nemocných pacientů. Kardiální rozpojení (cardiac uncoupling) bylo nezávislým prediktorem smrti a bylo pozorováno častěji u zánětu, infekcí a multiorgánových selhání u traumatických pacientů. (Kardiální rozpojení bylo v této studii definováno jako procento 5minutových intervalů se standardní odchylkou HR 0,3–0,6 tepů/min).
U neurochirurgických pacientů bylo snížení LF/HF spojeno se špatnou prognózou. Obdobně tomu bylo i u dětí s akutní traumatem mozku. V další studii na neselektovaných pacientech na JIP signalizoval pokles výkonu ve VLF a LF fatální výsledek. Nedávno byl pokles variability HR (počítané různými metodami) pozorován již před klinickou diagnózou a léčbou sepse. Obdobně snížení LF u pacientů v sepsi predikovalo nástup multiorgánové dysfunkce. Sepse může být rozhodující faktorem, který vede k poklesu poměru LF/HF. U 3154 traumatických pacientů byla retrospektivně vyhodnocena variabilita HR během 24 hodin po přijetí metodou multiscale entropy (MSE). MSE byla nezávislý prediktor úmrtí.
Obecně lze říci, že u kriticky nemocných je pokles variability HR spojen se špatnou prognózou, s rozvojem a tíži multiorgánového selhání a sepse.
Variabilita RR a dechová frekvence: Změna dechové frekvence zvyšuje výkon HRV ve frekvencích spojených s dýcháním, což potvrdil Pöyhönen. Pokles dechové frekvence z 12/min (0,2 Hz) na 8 min (0,13 Hz) změnil HRV spektrální výkon z HF (0,15–0,5 Hz) do LF (0,04–0,15 Hz) pásma. Významný příspěvek ke vztahu dechové frekvence a variability prezentovali autoři Ústavu přístrojové techniky Akademie věd České republiky, Brno. Na 4 skupinách pacientů (mladí a starší dobrovolníci, pacienti s onemocněním koronárních tepen a pacienti s implantovaným defibrilátorem) provedli kontinuální měření systolického tlaku a RR intervalu za striktně standardizovaných podmínek. Měření byla provedena během spontánní ventilace, při řízené frekvenci 6 dechů (0,10 Hz) a 20 dechů za minutu (0,33 Hz). LF variabilita během dýchání s pomalou frekvencí 6 dechů/min byla větší než při dýchání frekvencí 20/min. Zvýšení LF variability však nebylo pozorován u skupiny pacientů s defibrilátorem. V našem probíhajícím výzkumu na Anesteziologicko-resuscitační klinice FN u sv. Anny provádíme měření variability HR u pacientu s umělou plicní ventilací (UPV) za účelem zjištěním vlivu samotné dechové frekvence na variabilitu.
Nelineární dynamika, komplexní systémy, decomplexification: V souvislosti s variabilitou proměnných se hovoří obecně o nelineární dynamice (nonlinear dynamics). Dynamika se vztahuje k systému, který se mění v čase, např. tlak, pulz, teplotní křivka, hodinová diuréza apod. Lineární systém je poměrný a osciluje jednoduše kolem průměrné hodnoty; nelineární systém osciluje složitě, průměrnou hodnotu lze vyjádřit jen výkonem v určitých frekvenčních pásmech. Normální fyziologie je charakterizovaná nepravidelnými oscilacemi, vedle tepové frekvence oscilují např.: časový interval mezi spontánními dechy, sekrece hormonů, tělesná teplota apod. Jednoduchá analýza, např. signálů vitálních funkcí, ukáže jen obecný trend, neodhalí však strukturu variability v pozadí. K tomu je nutná formální analýza signálů (a dostatečná frekvence sběru dat) – viz výše. Ztráta variability, decomplexification, se objevuje fyziologicky ve stáří a patologicky v kritické nemoci. Zotavení z kritické nemoci je charakterizováno znovuobnovením nepravidelnosti ve fyziologických časových řadách. Zdá se paradoxní, že podpůrné terapie jsou založené spíše na monotónním programu. Například během řízené UPV mají ventilační cykly fixní časový interval, enterální výživa je podávána stejnou rychlostí celý den, inzulin je podáván konstantní rychlostí atd. Ve studii Bokera u pacientů podstupujících operaci abdominálního aneurysmatu byla použita variabilní ventilace s různými respiračními frekvencemi (DF). Různé kombinace frekvence a reciproční změny dechového objemu (TV) generoval počítač, celkem bylo použito 367 kombinací DF a TV, počítačový program byl sestaven na základě biologické variabilní ventilace podle Mutche. Proti kontrolní skupině ventilovaných fixní frekvenci měli pacienti s variabilní („noisy“) ventilací lepší výměnu plynů a vyšší poddajnost respiračního systému. Objevuje se také hypotéza, že systémová odpověď na trauma, šok nebo sepsi by měla být posuzována jako složitý nelineární systém.
Zajímavá aplikace variability: Bylo publikováno využití variability v prevenci hypotenze po spinální anestezii pro plánovaný porod císařským řezem. Rodičkám, které měly iniciálně poměr LF/HF větší než 2,5, byla podána infuze vazopresorů nebo koloidy s cílem snížit LF/HF pod 2,5. Ve srovnání s kontrolní skupinou tato metoda zabránila hypotenzi u 17–19 pacientů z 20 pacientů.
Závěr: Variabilita tepové frekvence je relativně málo známy nástroj, který může sloužit k hlubšímu pochopení hemodynamiky a složitých multiorgánových vztahů. U kriticky nemocných je nižší variabilita spojena s rozvojem sepse, multiorgánovou dysfunkcí a horší prognózou. Některé další aspekty variability jsou předmětem výzkumu, prozatím není hodnocení variability tepové frekvence běžně používáno u kriticky nemocných.
Literatura u autora.
Práce vznikla s podporou Grantu IGA MZ ČR, NS10105-3/2008.
3. Interakce IPPV a hemodynamiky
Balík M.
KARIM VFN, Praha
Za normálních okolností u spontánně ventilujících dochází v inspiriu ke zvýšení systémového venózního návratu a zúžení dolní duté žíly (IVC), kterou si lze představit jako rezervoár krve. Zvyšuje se enddiastolický tlak a objem v pravé komoře (PK) a průtok krve do plic. Klesá plnění LS a LK, klesá i tepový objem levé komory (SV) a systolický tlak klesne obvykle o méně než 10 %. V exspiriu dochází k přesunu krve z plic do levé síně (LS), zvýšení enddiastolických tlaků a objemů v levé komoře (LK) a zvýšení SV. Tento fyziologický cyklus může být zachován při spontánním režimu UPV, nebo i u dobře rekrutovaných plic ventilovaných mandatorně v oblasti blízké „fyziologické“ FRC a vitální kapacity a objemy mezi 6–8 ml/kg bez vysokých tlaků v hrudníku. Pokud budeme ventilovat pacienta s relativně „normálním srdcem“, který má sinusový rytmus, budou hlavními proměnnými preload pacienta a dechový objem. Pokud bude pacient hypovolemický, nebo budeme ventilovat nefyziologickými objemy nad 8 ml/kg (bez extrémních vzestupů tlaků v hrudníku), dojde v inspiriu k větším poklesům SV a pokles TKs o více než 10 % hodnotíme jako pulsus paradoxus. Reakcí je buď doplnění tekutin, nebo korekce špatně nastavené UPV. Tento jev má zásadní dopad na stanovení SV v klinické praxi, kdy bychom měli při hypovolémii a variaci SV průměrovat více naměřených tepových objemů (minimálně 3 u sinusového rytmu). Variabilita SV v rámci dechového cyklu však zárověň informuje o preload pacienta a funguje velmi dobře jako dynamický ukazatel preload a prediktor odpovědi na volumexpanzi. Při hodnocení této variability SV však musíme na JIP uvažovat o více faktorech, protože realita intenzivní medicíny je obvykle jiná než fyziologie. Při pohledu na monitor (IBP, EtCO2, EKG…) bychom měli znát následující proměnné předtím, než stanovíme diagnózu „nízký preload“ a započneme s volumexpanzí.
Stav levé komory: U pacientů se zvýšenými LVEDP vede zavedení IPPV k poklesu LVEDP a afterload levé komory, což se v inspiriu projeví jako vzestup tepového objemu „dUp effect“ na křivce arteriálního tlaku, který může být falešně pozitivní pro diagnózu hypovolémie. Pacient může být přitom kardiak se zcela opačnou potřebou úpravy preload, než je volumexpanze.
Stav pravé komory: Pravostranný kompromis a/nebo agresivní ventilace vedou v inspiriu ke zhoršení výdeje pravé komory, která neplní plicní řečiště adekvátně. To se může projevit jako „dDown effect“ na křivce arteriálního tlaku, který může být falešně pozitivní pro diagnózu hypovolémie. Volumexpanzi je potřeba titrovat podle jiných ukazatelů, hrozí nebezpečí dilatace PK a pravostranného selhání.
Ztráta perikardiálního rezervního objemu (tamponáda, konstrikce), nebo veliký fluidotorax nebo pneumotorax: Kompartmentalizace hrudníku se zvýšením tlaků zvýrazní paralelní interdependenci obou srdečních komor. V inspiriu dojde ke zvýšení průtoků pravým srdcem a poklesům průtoků levým srdcem. To se projeví podobně jako při hypovolémii poklesem SV a přítomností pulsus paradoxus na arteriální křivce. Volumexpanze zastře tento diagnostický prvek a je vhodnější až po terapeutické drenáži perikardu nebo hrudníku.
Vliv velikosti a variace dechového objemu: Recentní práce ukazují, že konstantní dechový objem v mandatorním režimu mezi 6–8 ml/kg je dostačující pro správnou interpretaci v klinické praxi. Lze očekávat falešnou negativitu, respektive dg. euvolémie u Vt < 6 ml/kg, falešnou pozitivitu pro „hypovolémii“ u Vt ≥10 ml/kg. Problém může nastat u variací Vt u spontánních dech režimů, kde je vhodné zařadit manévr s elevací dolních končetin a odečítat interakci IPPV-hemodynamika před a během elevace DK (40 ° na 3–4 minuty).
Vliv variace tepového objemu (supraventrikulární arytmie) a/nebo variace dechového objemu (viz výše): Diagnostika je založena na pasivní elevaci dolních končetin (viz výše). Například pacient s fibrilací síní na PSV je diagnostikovatelný validně podle variace SV jen pomocí těchto manévrů.
Počet dechových cyklů, který by měl být sledován je ideálně 5, často monitorované 3 cykly nemusí stačit.
Souhrn: Interakci hemodynamiky a umělé plicní ventilace nelze dobře interpretovat v klinické praxi bez znalosti funkce obou srdečních komor, perikardu, pleurálních prostor, stupně plicního recruitmentu a nastavení ventilátoru.
X. INOVATIVNÍ POSTUPY
1. The Hayek RTX cuirass ventilator – a novel and revolutionary method of noninvasive ventilation
Hayek W.
United Hayek Industries (Medical) Ltd., London, U.K.
The Hayek RTX respirator is a biphasic external cuirass ventilator that supports both inspiration and expiration at various cycle rates and pressures, as well as allowing for the application of vibration (high frequency) and cough modes. With this respirator, the duration and pressure can be altered in both the inspiratory and expiratory phases.
Institution of Biphasic Cuirass Ventilation (BCV) for various applications, as well as the methods and protocols for use of BCV are described; as an aid to weaning from invasive positive pressure ventilation; for the avoidance of intubation in the ICU; and in severe cases of ARDS allowing for the reduction of invasive positive pressure peep in order to increase cardiac output. Further explained are the uses of BCV with the Hayek RTX respirator as an alternative to both ITU Bipap and Cpap, as a method to resolve bronchial atelectasis and for re-inflation of lobular collapse. Finally, the use of the Hayek RTX as a tool for the management of sputum retention is described.
2. Volumetrická kapnografie
Dostál P.
Klinika anesteziologie, resuscitace a intenzivní medicíny, Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové, Fakultní nemocnice Hradec Králové
Kapnometrie a její grafická podoba kapnografie se v posledních dvou dekádách stala prakticky rutinní součástí péče o nemocné se závažnou poruchou plicních funkcí. Při konvenční kapnografii je tenze oxidu uhličitého vyjádřena v čase známou kapnografickou křivkou. Takzvaná volumetrická kapnografie představuje techniku, při které je simultánně měřena tenze oxidu uhličitého a průtoku plynů dýchacími cestami nemocného v čase. Při tomto způsobu analýzy je tenze CO2 vyjádřena jako funkce dechového objemu. Ve fázi I dochází k výdechu plynu, který tvoří anatomický a funkční prostor. Ve fázi II dochází postupně ke zvyšování tenze CO2 a ve fází III je již vydechován alveolární plyn, křivka v této fázi má již pouze minimálně vzestupný trend (plicní sklípky s vysokým poměrem V/Q jsou vydechnuty nejdříve a naopak plicní sklípky s nízkým poměrem V/Q nejpozději). Je dosaženo plató, pouze s minimálním vzestupem tenze CO2. Při homogenní distribuci ventilace má křivka téměř pravoúhlý tvar, naopak při nehomogenní distribuci jsou přechody mezi jednotlivými fázemi pozvolné a není dosaženo plató. Proti konvenční kapnografické křivce je základní odlišností volumometrické kapnografie možnost získat informace o velikosti mrtvého prostoru a některých dalších kalkulovaných ukazatelů.
Mrtvý prostor
Mrtvý prostor (VD) je součtem objemu dýchacích cest (VDaw) a objemu neventilovaných alveolů (VDalv). Instrumentální mrtvý prostor okruhu ventilátoru je součástí mrtvého objemu dýchacích cest. Tento mrtvý prostor je považován za tzv. fyziologický mrtvý prostor a je obvykle vyjadřován ventilátory jako podíl velikosti dechového objemu. Použití volumetrické kapnografie umožňuje měřit mrtvý prostor bez znalosti arteriální tenze CO2 a měření může být při použití odpovídajícího vybavení kontinuální (breath by breath). Naopak při znalosti poměru VD/VT a znalosti EtCO2 je možná validní predikce hodnoty PaCO2. Nevýhodou metod analýzy volumetrické kapnografie je nutnost spolehlivého odlišení fáze II a fáze III kapnografické křivky (metoda podle Fowlera, 1975). Toto odlišení může být u nemocných s vysoce nehomogenní distribucí ventilace (např. exacerbace chronické obstrukční plicní nemoci) obtížné až nemožné. Byly vyvinuty nové způsoby stanovení velkosti mrtvého prostoru (např. modifikovaná metody podle Langley), které umožňují lépe automatizovat matematickou kalkulaci velkosti mrtvého prostoru, nebo alespoň parametr zastupující tento údaj – např. parametr VAE/VD – tzv. frakce alveolárního ejekčního objemu.
Exhalace oxidu uhličitého a plicní recruitment
Při aplikaci exspiračního přetlaku (PEEP) dochází u nemocných s ALI/ ARDS k provzdušnění nových plicních oblastí a současně k nadměrné distenzi jiných plicních oblasti, o přínosu použití PEEP rozhoduje poměr mezi těmito procesy. Plicní recruitment snižuje gradient mezi PaCO2 a EtCO2. Publikované práce provedené na nemocných s ALI/ARDS ukazují, že u těchto nemocných je ve srovnání s kontrolní skupinou vyšší mrtvý prostor a nižší alveolární ejekční objem, ale že zvýšení PEEP neovlivnilo ukazatele zjištěné volumetrickou kapnografií. Novější práce a experimentální studie však ukazují, že u subjektů, u kterých PEEP vedl ke zlepšení oxygenační funkce plic, došlo současně ke snížení mrtvého prostoru. Z výsledků je zřejmé, že efekt závisí na typu plicního poškození, stupni plicního poškození, jeho trvání a úrovni použité hodnoty PEEP. Recentní studie provedená na souboru nemocných podstupujících elektivní operační výkon ukazuje, že hodnocení compliance respiračního systému a velikosti mrtvého prostoru může být užitečné k predikci tzv. optimální úrovně PEEP (nejnižší hodnota PEEP s nejvyšší plicní poddajností a současně s nejnižší velikostí mrtvého prostoru). Diskriminační hodnota uvedených parametrů byla patrná při dekrementální titraci PEEP po provedení otevíracího manévru. Možnost optimalizace hodnoty PEEP byla také popsána podle směrnice III. fáze kapnografické křivky, tzv. Phase III slope – S(III), kdy při optimální hodnotě PEEP byla tato část kapnografické křivky nejméně strmá.
Detekce a monitorování alterací plicní perfuze
Použití volumetrické kapnofrafie bylo zkoumáno v řadě studií u nemocných s podezřením a plicní embolii. Negativní nález D-dimerů s normální velikost mrtvého prostoru při volumetrické kapnografii mají vysokou negativní predikční schopnost při podezření na plicní embolii. U nemocných s pozitivním nálezem D-dimerů mají některé parametry, jako např. pozdní frakce mrtvého prostoru, pravděpodobně lepší prediktivní schopnosti než stanovení PaCO2-EtCO2 gradientu. Použití volumetrické kapnografie je také považováno za excelentní techniku monitorování efektu trombolytické terapie.
Prognostický význam volumetrické kapnografie
Provedené studie ukazují, že velikost mrtvého prostoru má prognostický význam u nemocných s ALI/ARDS. Přetrvávající elevace VD/VT charakterizuje nemocné s nepříznivým klinickým výsledkem. Prognostický význam má také stanovení trendu VAE/VT v prvních 48 h od zahájení umělé plicní ventilace.
3. Intervenční Lung-Assist
Stibor B.
JIP, Landesklinikum Baden, Baden bei Wien, Rakousko
Princip protektivní plicní ventilace s použitím nízkých dechových objemů a vyšším PEEP je znám již řadu let. Přesto se u nejtěžších forem akutního respiračního selhání (ALI, ARDS) nevyhneme takovému nastavení ventilačního režimu, které nutně vede k traumatizaci plicní tkáně (ventilator associated lung injury, VALI). Intervenční Lung-Assist (iLA), někdy též nazývané pumpless extracorporeal lung-assist (pECLA) nebo arterio-venous CO2 removal (AVCO2R), je nová metoda umožňující extrakorporálně odstraňovat CO2 z arteriální krve pacienta a částečně i zlepšovat její oxygenaci. To následně umožní redukci agresivity plicní ventilace a nastavení parametrů někdy označovaných jako ultra-protektivní plicní ventilace. Principem metody je průtok krve přes semipermeabilní membránu, která je z jedné strany omývána krví pacienta a ze strany druhé čistým kyslíkem. Membrána, která je propustná pro molekuly CO2 a O2, ale ne pro krevní plasmu, umožňuje výměnu krevních plynů, především difuzi oxidu uhličitého. Ten je ze systému vymýván přiváděným 100% kyslíkem, který částečně i difunduje do krve a podílí se na zlepšení oxygenace. Jedná se o arterio-venózní systém, který sestává z arteriální kanyly (a. femoralis), venózní kanyly (v. femoralis) a vlastního membránového oxygenátoru o rozměrech cca 14 x 14 cm. Vzhledem k minimálnímu odporu celého systému je průtok krve zajištěn srdečním výdejem pacienta, MAP by měl být minimálně 65 mm Hg. K účinnému odstraňování CO2 stačí 5–10 % srdečního výdeje a přítok čistého O2 minimálně 5 l/min. Při nasazení iLA se nejdříve postupně, asi po 20 minutách, zvyšuje průtok čistého kyslíku a zároveň se snižuje agresivita ventilace postupným snižováním minutového objemu. Pravidelné kontroly krevních plynů jsou samozřejmostí. Ke kanylaci femorálních cév se používají speciální armované kanyly, většinou o síle 13F (arteriální) a 15 F (venózní). Preferuje se bilaterální kanylace (a. femoralis na jedné a v. femoralis na druhé straně), je možná i kanylace unilaterální (a. i v. femoralis na jedné straně). Kanyly jsou nízkoodporové, nedají se zalomit a jejich konstrukce umožňuje snadnou „one-step“ dilataci. Aby se zabránilo srážení krve v systému, je nutné – podobně jako u renálních eliminačních technik – provádět antikoagulační terapii (nejčastěji heparinem) s udržováním aPTT nad 55 s. Obecně je indikací pro nasazení iLA těžké akutní respirační selhání, především jeho hyperkapnická forma. Těžké formy ARDS či ALI, pacienti s dekompenzovanou COPD (ať ventilovaní nebo s hrozící nutností intubace a umělé plicní ventilace), pacienti dlouhodobě ventilodependentní s prolongovaným či neúspěšným weaningem. Mezi kontraindikace patří heparinem indukovaná trombocytopenie (HIT), šokové stavy jakékoliv etiologie s nízkým středním arteriálním tlakem (MAP), těžká forma ischemické choroby dolních končetin (ICHDK) a anatomicky nepříznivé poměry (vnitřní průměr femorální artérie menší než 5,1 mm). Nejzávažnější komplikací je ischémie dolní končetiny, kde je zavedena arteriální kanyla. Použitím speciálních nízkoodporových kanyl nové konstrukce o malém průměru se však toto riziko pohybuje mezi 1 až 2 %. Někdy dochází k prolongovanému arteriálnímu krvácení po odstranění kanyly, které se však snadno dá ošetřit chirurgicky. Po nasazení iLA je vidět promptní snížení hyperkapnie a i částečná úprava hypoxémie. To následně umožní úpravu nastavení ventilátoru do režimu „ultra“ -protektivní ventilace s cílovými parametry df 6–8/min, Vtmax. 4 ml/kg. Při zlepšování plicních funkcí se iLA ponechává v provozu, usnadňuje weaning a umožňuje časnější extubaci pacienta. V poslední době se použití iLA úspěšně rozšiřuje i pacientů s primárně hyperkapnickým ventilačním selháním (např. pacienti s těžkou formou CHOPN), u nichž časné nasazení zajistí účinnou eliminaci CO2 a v mnoha případech umožní vyhnout se intubaci a invazivní ventilaci. Kombinace s neinvazivní ventilací (NIV) je u těchto pacientů samozřejmostí. Opakovaně byla metoda použita jako bridging k transplantaci plic. V současné době se počet nasazení iLA blíží 5000. V krátké budoucnosti se očekává uvedení na trh i iLA s použitím pumpy. Tím by se odstranilo hlavní riziko jejího použití a sice obava z ischémie dolní končetiny.
Použití metody intervenční Lung-Assist umožní výrazné snížení agresivity plicní ventilace a tím i nežádoucích účinků s ní spojených. Plíce tím získá potřebný čas k reparaci svých funkcí („time to heal“). To mnohdy umožňuje zvládnutí kritických stavů, které byly do nedávné doby infaustní.
4. Rehabilitace pacienta na ventilátoru
Maňák J.
Interní JIP GMK, FN Hradec Králové
Zatímco primárním úkolem intenzivní medicíny je záchrana života nebo dokonce návrat lidského jedince zpět do života (reanimace, resuscitace), rehabilitace bývá tradičně chápána jako aktivita nalézající své místo až po dokončení život a zdraví zachraňujících dějů v období, kdy již zachráněnému životu je nutno vrátit také zbytek jeho předchozích schopností a sil, v období rekonvalescence.
Toto tradiční, posloupné chápání vytváří stále pevný myšlenkový rámec, v němž jsou zasazeny jak moderní, tak tradiční součásti péče o kriticky nemocné. S rozvojem intenzivní medicíny se však stále častěji upíná pozornost k jejím dlouhodobým výsledkům, ke kvalitě života přeživších pacientů, k délce jejich léčby, k efektivitě celého procesu, vzniku komplikací způsobených léčbou a jejich řetězení u dlouhodobě kriticky nemocných a v neposlední řadě i k ekonomickým aspektům. Součástí tohoto vývoje je i postupná změna chápání významu jednotlivých postupů a nacházení jejich nových uplatnění. Rehabilitace kriticky nemocných je toho dobrým příkladem.
Kritický stav i jeho léčba s sebou přinášejí některé následky, v jejichž řešení nachází léčebná rehabilitace stále větší uplatnění – kromě rehabilitace cílené na plicní funkce se jedná především o svalovou slabost kriticky nemocných a o neurokognitivní poruchy. Nově jsou však rehabilitační postupy užívány i k jejich prevenci, což ve svém důsledku mění celý přístup k léčbě kriticky nemocného. Svalová slabost kriticky nemocných pravděpodobně vzniká již velmi záhy po začátku onemocnění. Geneze slabosti je multifaktoriální. V nejčasnějších stadiích se jedná o funkční změny zprostředkované zejména mediátory zánětu, zatímco později se na dalším rozvoji morfologických změn ve svalech a nervech podílí i inaktivita, hyperkatabolismus, devastace kontraktilního aparátu kosterních svalů při aktivaci ubikvitin proteazomové cesty, kumulativní energetický deficit i některé medikamentózní vlivy (svalová relaxancia, kortikoidy). Klinický syndrom svalové slabosti kriticky nemocných bývá taxonomicky rozdělován na polyneuropatii a myopatii kriticky nemocných, často se však jedná o kombinaci obou jednotek. Následkem postižení motorických funkcí je slabost dýchacího svalstva se zhoršením toalety dýchacích cest a ventilační insuficiencí, prodloužením doby umělé plicní ventilace, zvýšenou druhotnou nemocností na infekční komplikace, nebezpečí vzniku dekubitů a hluboké žilní trombózy, celkově zvýšená mortalita, délka pobytu na JIP i v nemocnici, někdy trvalý neurologický deficit a zvýšené náklady na léčbu.
Delirium je u kriticky nemocných přítomno až v 80 %, část delirantních stavů se klinicky projevuje hypoaktivitou a zůstává proto často nediagnostikována. Delirium je častější u nemocných, jimž byla podávána sedativa a analgetika. Přítomnost deliria je asociována s trojnásobně vyšší mortalitou, delší dobou hospitalizace a vyššími náklady na léčbu. Delirium proběhlé v kritickém stavu bývá spojováno s následnou chronickou kognitivní dysfunkcí, která bývá prokazatelná až u 78 % nemocných rok po propuštění. Následky tohoto postižení snižují kvalitu života propuštěných nemocných, možnosti jejich pracovního uplatnění, vedou k závislosti pacientů na další osobě a zvyšují náklady na péči o tyto pacienty. Podstatná část nemocných trpí dlouhodobě také depresemi, úzkostí a posttraumatickou stresovou poruchou. Klasická pulmonální rehabilitace sestává z dílčích technik, jako je polohování, manuální hyperinflace, poklepové a vibrační masáže a odsávání sekretů. Ačkoliv jsou tyto techniky dlouho známy a široce používány, u většiny z nich chybí jednoznačně uznávaná standardizace, jakož i větší studie o jejich účinnosti s ohledem na významné klinické výstupy, jako je morbidita a mortalita, délka pobytu apod. Výjimku tvoří zvýšená poloha hlavy jako prevence aspirace žaludečního obsahu. Mobilizace nemocných je dlouhodobou součástí rehabilitační péče včetně nemocných na ventilátoru. Její smysl spočívá v udržení rozsahu kloubních pohybů, zvýšení prokrvení tkání, zvýšení ventilace plic, prevence žilní trombózy. Prakticky je prováděna postupně formou pasivních cvičení, cvičení s dopomocí, posazováním nemocných v lůžku a mimo ně, nácvikem stoje, chůze na místě i v chodítku.
Postupy rehabilitační medicíny na jednotkách intenzivní péče jsou často extrapolacemi z jiných populací pacientů a nebývají dostatečně validovány pro kriticky nemocné, nebo byly studovány na malých souborech. Vyjádření Evropské společnosti intenzivní medicíny o rehabilitaci kriticky nemocných jsou proto velmi obecná a doporučení jsou většinou zařazena do kategorií C a D. Rehabilitační medicína však odráží i nové trendy v kritické péči. Současné technické pokroky ve ventilačních postupech umožňují stále větší podíl spontánní ventilace nemocného, a tím se snižuje potřeba hluboké sedace, svalová relaxancia bývají užívána stále vzácněji. Bylo navíc prokázáno, že denní přerušení sedace vede ke zkrácení doby umělé plicní ventilace, kratšímu pobytu na JIP a nižšímu výskytu psychických změn. Vyšší stupeň sedace je asociován s výskytem deliria, následných kognitivních poruch a posttraumatické stresové poruchy.
V nedávné době bylo publikováno několik studií, které možná předznamenávají změnu v dosavadní koncepci intenzivní péče. Jsou to studie kombinující několik samostatně úspěšných strategií s časnou rehabilitací. Martin prokázal dobrou korelaci svalové síly horních končetin s úspěchem při odpojování dlouhodobě ventilovaných pacientů, u nichž byla využita strategie intenzivní rehabilitace končetinových a posturálních svalů společně s tréninkem síly nádechu. Autoři uvádějí zkrácení doby umělé ventilace o 7 dní na každý nabytý bod svalového testu. Denní přerušení sedace spojené s testem spontánní ventilace vedlo v práci Girarda et al. ke zkrácení doby umělé ventilace, doby na JIP i v nemocnici. Časná intenzivní rehabilitace nemocných s akutním respiračním selháním prováděná plošně u všech nemocných, kteří neměli taxativně vyjmenované kontraindikace, vedla ke zkrácení doby do opuštění lůžka a zkrácení pobytu na JIP bez vlivu na počet komplikací nebo mortalitu. Za kontraindikace byly považovány hypoxie se saturací periferní krve kyslíkem pod 88 %, hypotenze s MAP < 65 mm Hg, nově nasazené katecholaminy, nový infarkt myokardu, nové arytmie, nutnost zvýšení PEEP a přechod z podpůrné na řízenou ventilaci. Bezpečnost a praktickou proveditelnost časné rehabilitace prokázala studie P. Baileyové, kdy byla časná mobilizace nemocných zahajována, jakmile byly vysazeny katecholaminy a nemocný reagoval na oslovení, PEEP byl menší než 10 mm Hg a FiO2 menší než 0,6. Autoři zaznamenali pouze klinicky nezávažné nežádoucí účinky tohoto postupu v četnosti méně než 1 % prováděných aktivit. Automaticky (tj. bez nutnosti ordinace lékaře) prováděná rehabilitace, spojená s denním přerušením sedace a aktivním cvičením, vedla k signifikantnímu zlepšení motorických schopností pacientů na JIP, zkrátila dobu jejich připojení k ventilátoru, téměř na polovinu, snížila výskyt deliria a paréz získaných na JIP.
Přes veškerou skepsi z množství velkých studií s negativním výsledkem, která v současnosti v intenzivní medicíně panuje, se zdá, že právě zde se odehrává posun paradigmatu celé intenzivní péče. Nevzniká aplikací jednoho preparátu nebo postupu, nýbrž kombinací dílčích strategií, které však mění charakter nemocných v intenzivní péči. Tyto strategie směřují k rychlému ukončování sedace, zapojování spontánní motoriky nemocných včetně spontánní dechové aktivity, zachování komunikace s nemocným a jeho reorientaci a v zachování nebo co nejrychlejším návratu fyzických i psychických schopností. V tomto posunu od nemocných sedovaných, popř. relaxovaných a řízeně ventilovaných, k pacientům při vědomí, aktivně se podílejícím na léčbě sehrávají postupy léčebné rehabilitace klíčovou úlohu.
Práce byla podpořena výzkumným záměrem MSM 0021620819 (Náhrada a podpora funkce některých životně důležitých orgánů).
Literatura u autora.
XI. DÝCHACÍ CESTY
1. Postextubační obstrukce a kortikoidy: kdy, komu a jak
Raděj J., Kroužecký A., Chvojka J., Karvunidis T., Novák I., Matějovič M.
JIP I. interní kliniky, Fakultní nemocnice v Plzni, Univerzita Karlova v Praze, Lékařská fakulta v Plzni
Odpojení pacienta od umělé plicní ventilace je jeden z důležitých i kritických okamžiků v intenzivní péči. Selhání extubace může mít negativní dopad na další průběh onemocnění a může být i nezávislým faktorem zvyšujícím mortalitu kriticky nemocných. Jednou z příčin neúspěchu je postextubační obstrukce horních cest dýchacích způsobená otokem. Klinicky zřetelný stridor, eventuálně respirační distress je základem diagnostiky, jiné objektivní měření nelze použít. Incidence postextubačního otoku se napříč provedenými studiemi různí od 0,6 do cca 37 % a zdaleka nepředstavuje incidenci následující nutné reintubace. Žádnou zobrazovací metodou nelze s jistotou zjistit otok glottis či subglotického prostoru před plánovanou extubací. Lze však vytipovat rizikového pacienta. Základem je tzv. cuff-leak test, kdy zjišťujeme únik vdechované směsi plynu za ventilace pozitivním přetlakem při vypuštění těsnicí manžety endotracheální kanyly kvalitativně (zvukový fenomén) či kvantitativně (pozitivita testu při rozdílu měřeného inspiračního a exspiračního dechového objemu nižším než 110 ml v absolutní hodnotě či méně než 25 % v relativní). Pozitivní prediktivní hodnotu testu kladně hodnotila metaanalýza 11 studií uveřejněná v r. 2009, negativní prediktivní hodnota tohoto testu byla ale nízká. Možné rizikové faktory lze vysledovat v jednotlivých studiích: ženské pohlaví, traumatická intubace, předchozí selhání extubace, délka UPV delší než 6 dnů a další.
Kortikoterapie má fyziologické předpoklady prevence vývoje postextubačního otoku. Do roku 2007 byla publikována řada studií různé kvality, značně heterogenních provedením i výsledkem. Ve prospěch kortikoidů svědčilo zjištění prospektivní, randomizované, dvojitě zaslepené, placebem kontrolované francouzské multicentrické studie na 698 pacientech, kdy preventivní podání 20 mg methylprednisolonu každé 4 hodiny během doby 12 hodin před plánovanou extubací vedlo k poklesu incidence postextubačního otoku o 22 % vs 3 % (p < 0,0001), stejně tak k signifikantnímu poklesu v počtu reintubací celkových i v souvislosti s otokem. V posledních dvou letech bylo potom provedeno několik metaanalýz, které měly odpovědět na otázku, zda kortikoidy jsou účinným nástrojem prevence postextubačního stridoru i nutnosti reintubace. Řadu uzavírá Jaberova práce uveřejněná v srpnu 2009, která upozorňuje na nejednotnost v závěrech předchozích metaanalýz se snahou napravit některé jejich nedostatky. Hodnotila 1846 dospělých kriticky nemocných pacientů ventilovaných déle než 24 hodin v 7 relativně dobře vedených studiích. Zjistila statisticky významný pokles v incidenci postextubačního stridoru u podskupiny rizikových pacientů vybraných cuff-leak testem, ne ve skupině neselektované. Pokles počtu nutných reintubací byl signifikantní i v neselektované skupině nemocných, významnější redukce byla evidentní u rizikových pacientů. Byla provedena subanalýza také z časového hlediska, ve skupině časného podání kortikosteriodu (4–24 hodin před extubací) významně ubylo nutnosti reintubace, nikoli u pozdního podání (méně než 2 hodiny před extubací). Tato práce doporučuje podání kortikoidů minimálně 4 hodiny před plánovanou extubací u rizikových pacientů identifikovaných cuff-leak testem. Závěrem se shoduje s aktualizovanou verzí jiné metaanalýzy, Khenani a Markovitze publikované v červenci 2009.
Cílem analyzovaných studií nebyla morbidita ani mortalita nemocných, nesledovali ani nežádoucí účinky steriodů. Odpovědi proto bohužel nemůžeme hledat ani v metaanalýzách. Značně heterogenní je ve zmiňovaných studiích vedle časového intervalu také použití druhu kortikosteroidu a dávkování. Doporučení lze vyvozovat jen rámcově: několikeré podání léku 12–24 hodin před extubací, ne později než 4 hodiny (např. methylprednisolon i. v. 20–40 mg po 4–6 hodinách v průběhu 12–24 hodin před extubací). Je nutné plánování extubace či její odložení po úspěšném testu spontánní ventilace u rizikového pacienta.
Závěr: Podání kortikosteroidů časně před plánovanou extubací u rizikových pacientů vytipovaných cuff-leak testem pravděpodobně snižuje incidenci postextubačního stridoru a nutné reintubace. Není jasný vliv na morbiditu a mortalitu nemocných. V této indikaci nebyly zjišťovány nežádoucí účinky steroidů. Nejedná se o silné ani závazné doporučení. Na místě je ověření kvalitně vedenou jasně designovanou studií či alespoň konsensuální stanovisko odborných společností.
Práce vznikla za podpory MSM 0021620819 Náhrada a podpora funkce některých životně důležitých orgánů.
2. Alternativy klasické translaryngeální intubace
Hanousek J.
Department of Anaesthesia and Intensive Care, North
Devon District Hospital, Barnstaple, U.K.
Tracheální intubace pomocí standardního laryngoskopu vyžaduje téměř napřímení optických os orální, faryngeální a tracheální do jedné přímky. To není vždy z rozličných důvodů snadné. Důvodem může být nezkušenost operatéra, nevyhovující vybavení a okolní prostředí, a zejména anatomické či patologické faktory na straně pacienta. Alternativní způsoby klasické tracheální intubace lze rozdělit do tří skupin: supralaryngeální prostředky, video – asistované prostředky a invazivní řešení. Ve skupině supralaryngeálních technik jednoznačně patří na čelní místo zajištění dýchacích cest pomocí laryngeální masky (LM). Nejvhodnějším prostředkem je zde intubační LM (ILMA, Fastrach). V případě její nedostupnosti nebo nevhodnosti je dalším dobrým řešením LM s kanálem umožňujícím zavedení gastrické sondy (ProSeal, LMA Supreme), jež umožňuje vyšší inspirační tlaky se zmenšeným rizikem komplikací způsobených insuflací žaludku. V nouzi je ale každá LM dobrá a obvykle umožní zahájení ventilace, stabilizaci pacienta a přípravu na intubaci. V poslední době se objevil nový typ LM (iGel), jejíž manžeta není naplněna vzduchem, ale termoplastickým elastomerem, který se přizpůsobí anatomii dýchacích cest, a podle úvodních srovnávacích studií úspěšně odolává inspiračním tlakům až 28 cm vodního sloupce. I tato LM je vybavena kanálem pro gastrickou sondu.
Druhou skupinu alternativních intubačních postupů představují nepřímé optické laryngoskopy. Rychlý rozvoj fibro-optické technologie a digitálního obrazu umožnil umístění zdroje světla a konce optického vlákna nebo miniaturní kamery na distální konec lžíce laryngoskopu, takže operatér nemusí dosáhnout napřímení optických os k tomu, aby na obrazovce viděl vstup do hrtanu. Hlavní výhoda použití těchto moderních pomůcek spočívá v intubaci za obtížných podmínek jako při traumatu krční páteře, při morbidní obezitě či při intubaci méně zkušeným operátorem. Problém se někdy přesouvá z vizualizace na zavedení rourky do hrtanu, jež může být obtížná či nemožná i v případě, že operatér má dobrý náhled na obrazovce nebo v kukátku optického laryngoskopu. Pomůcky v této skupině lze rozdělit na laryngoskopy s kanálem pro tracheální rourku, který usnadňuje zavedení rourky mezi hlasivky pod přímou kontrolou zraku (Airtraq, Pentax Airway Scope), na nástroje bez kanálu (GlideScope, McGrath) a na optické stylety (Bonfil, Shikaniho optický stylet, StyletScope).
Airtraq je jednorázový laryngoskop s bočním kanálem pro laryngeální rourku. V porovnání s klasickými laryngoskopy a jinými videolaryngoskopy dosahuje pravděpodobně nejrychlejší úspěšné intubace za snížené stimulace sympatiku. Osvědčil se i u morbidně obézních pacientů, a to i u pacientů, které nebylo možné zaintubovat klasicky. Tento nástroj je levný, snadno přenosný, vyrábí se v celém spektru velikostí a je velmi úspěšný i v méně zkušených rukou. Navíc je k němu možno pořídit bezdrátovou LCD obrazovku, jež dále usnadňuje intubaci a výuku. Také Pentax Airway Scope se prosazuje v obtížných podmínkách jako např. při intubaci, kdy se operátor nemůže dostat za hlavu pacienta, jako při zaklínění těla po haváriích.
Hlavními zástupci bezkanálových videolaryngoskopů jsou McGrath a GlideScope. Oba výrobky disponují výměnnou lžící laryngoskopu na jedno použití, McGrath je však snadněji přenosný. U těchto bezkanálových laryngoskopů je doporučeno zavést do rourky běžný stylet a rourku ohnout v úhlu 60–90 stupňů.
Optické stylety lze rozdělit na rigidní (Bonfil) a tvarovatelné (Shikani). Rigidní stylety lze zavádět mezi hlasové vazy samy o sobě, často retromolárně, zatímco tvarovatelné stylety je doporučeno ohnout a používat společně se standardním laryngoskopem, jímž se odtáhne jazyk a vytvoří prostor pro zavedení styletu.
V rukou většiny anesteziologů je tradičně metodou první invazivní volby koniopunkce. Ideálním prostředkem je speciální krikothyroideální kanyla jako je QuickTrach. Vnitřní průměr kanyly QuickTrach (4 mm) dovoluje dostatečnou nouzovou ventilaci včetně exhalace. Kanyly menšího průměru jako Ravussin, Melker či improvizované prostředky jako velké intravenózní kanyly (14 G) mají dvě omezení: vzhledem ke kalibru kanyly je pro dostatečnou oxygenaci třeba mít k dispozici tryskovou ventilaci, a pro výdech pacienta je nutná průchodnost horních cest dýchacích. V případě selhání pokusu o oxygenaci koniopunkcí je nutno přistoupit ke koniotomii, proto v posledních letech mnozí argumentují pro provedení koniotomie jako první volby invazivního přístupu.
Současná nabídka nových systémů pro zajištění dýchacích cest nabízí celou řadu atraktivních řešení obtížných situací. Třebaže se jedná o pomůcky, jejichž použití je snadné a intuitivní, nelze očekávat úspěch při jejich prvním použití až v kritické situaci či časové tísni. Dostatečná zkušenost s novými prostředky a zachování chladné hlavy jsou důležitější než technické parametry nových pomůcek.
3. Možnosti invazivní bronchologie u kriticky nemocných pacientů
Votruba J., Šťastný B.
Centrum plicní endoskopie Nemocnice Na Homolce, Praha, Česká republika
Invazivní bronchologie je terapeutická modalita používaná u kriticky nemocných pacientů dosti vzácně. U pečlivě selektovaných pacientů však může přinést výrazné zlepšení ventilačních parametrů a v řadě případů umožní pacienta úspěšně vyvést z resuscitační péče.
Sdělení se zabývá následující problematickou:
1. Řešení benigních stenóz velkých dýchacích cest.
2. Odstraňování cizích těles.
3. Řešení hemoptýzy.
4. Rekanalizační výkony u ventilovaných pacientů:
přímá dilatace lumen bronchu tubusem/dilatátorem,
– mechanické odstranění endobronchiálních granulací koncem tubusu,
Nd-YAG laser,
kryoterapie,
elektrokauterizace,
balonková dilatace,
silikonové stenty,
autoexpanzivní stent.
5. Řešení tracheo-, či bronchoezofageálních a bronchopleurálních píštělí.
6. Endoskopická volumredukce u invazivně, či neinvazivně ventilovaných pacientů.
Jsou uvedena mezinárodní doporučení pro léčbu a videodokumentace jednotivých léčebných postupů.
4. Mechanical insufflation/exsufflation (CoughAssistTM) v klinické praxi
Rosický M.
Anestesi och Intensivvårdavdelning (ICU), Kungälv Sjukhus, Sverige
Úvod: Schopnost řádně eliminovat sekret z dýchacích cest (DC) je nezbytným předpokladem efektivní ventilace za fyziologických i patologických podmínek. Nezávislými, ale synergistickými mechanismy mobilizace sekretu jsou mukociliární clearance a kašel. Úloha kašle prudce stoupá za různých patologických situací, kdy je jeho funkce nezbytná k uvolnění sekretu především z horních DC. Nutnými předpoklady k účinnému cyklu kašle jsou průchodné DC s funkční glottis a schopnost pacienta vyvinout adekvátní cough peak-flow (CPF) mezi 360–620 l/min. s exspiračním tlakem (P-exp) mezi 80–200 cm H2O. Ke klinicky významnému snížení funkce kašle dochází při poklesu CPF pod 270 l/min nebo maximálně dosažitelného P-exp pod 60 cm H2O. Nejčastější příčinou v rutinní praxi je, vedle tracheostomie a CNS poruch, nízká výkonnost respiračních svalů neumožňující dosáhnout hlubokého nádechu s účinným CPF. Etiologicky se jedná o různé stavy, jako např. nervosvalová onemocnění (NMD), spinální trauma (SCI), kachexie atd.
Metoda: Principem CoughAssist je prohloubené inspirium k docílení optimální expanze plic rychle následované aktivním exspiriem při asistovaném podtlaku, zvyšujícím exspirační peak-flow. Typické nastavení je P-insuf. 15–40 cm H2O a T-insuf. 2–3 s; P-exsuf. 30–45 cm H2O, T-exsuf. 2–3 s. Nejčastějším rozhraním k pacientovi je vhodná obličejová maska či stávající tracheostomie. Předpokladem pro maximální efekt je aktivní spolupráce pacienta. Uvolněný sekret do ústní dutiny je mobilizován pacientem nebo odstraněn mechanicky. Přístroj pracuje v automatickém i manuálním mode. Monitorovány jsou inspirační i exspirační tlaky. Kontraindikacemi jsou zejména pneumotorax, barotrauma, pokročilá fáze CHOPN, 〈ICP, akutní plicní edém. Omezené jsou zkušenosti a doporučení u akutních stavů (např. ARDS/ALI). Metoda je neinvazivní, vhodná i pro domácí péči obsluhovanou laiky. Lze ji aplikovat samostatně nebo jako doplněk klasického mechanického odsávání.
Závěr: CoughAssist je bezpečná, dobře dokumentovaná a tolerovaná metoda ke zlepšení toalety DC, vhodná pro nemocniční i domácí péči. Klinicky nejlepší výsledky jsou zaznamenány u pacientů s NMD, SCI, kdy aplikace CoughAssist signifikantně snižuje incidenci pneumonií, rehospitalizací či nutnosti provedení tracheostomie.
5. Možnosti zajištění dýchacích cest v ultraextrémních podmínkách na oběžné dráze
Herold I.
ARO, Oblastní nemocnice Mladá Boleslav
Extrémní situací zajištění dýchacích cest je nečekaný vznik kritického stavu v situaci astronautů na oběžné dráze – dnes během letů na mezinárodní vesmírné stanici (ISS) nebo v raketoplánu (STS). Specifičností situace je prostředí mikrogravitace, omezená dostupnost vybavení vhodnými zdravotnickými prostředky a časová náročnost rozhodnutí o transportu zpět na Zem. I v optimálním případě při nutnosti rychlého návratu z ISS prostřednictvím již zadokované STS, je nutno počítat s časem pro návrat minimálně 24 hodin. Návrat z ISS ruskou lodí by byl komplikován nutností použití skafandru a přetížení 5–9 G a při započtení času na dopravu po přistání v neobydlených částech Ruska je nutno počítat s celkovou dobou transportu až 72 hodin.
Výcvik posádky: Astronauti, kteří byli dříve připravování pro lety na ISS jako zdravotníci-nelékaři (CMO – Crew Medical Officers), absolvovali 40 hodin teoretického a praktického výcviku zahrnujícího 1 hodinu věnovanou zajištění dýchacích cest, zavádění vzduchovodu, dýchání vakem, laryngoskopii a intubaci. V průběhu kurzu byl opakován nácvik na resuscitačním fantomu a opakován při 2 dalších inovačních kurzech. Nezdravotníci měli jako součást výcviku praktický nácvik první pomoci a možnost vyzkoušet si během školení intubaci i v praxi. Po ukončení výcviku ale možnost dalšího průběžného udržování získaných dovedností již nebyla. Dodnes nejsou k dispozici praktické zkušeností z řešení kritických situací v reálném mikrogravitačním prostředí se zajišťováním dýchacích cest, ani s farmakologickou přípravou k intubaci a udržováním sedace po ní. Rovněž nelze předpokládat, že by opakované nácviky intubace na modelech mohly reálně vést v kritické situaci k úspěchu. Dovednosti získané nácvikem na fantomu nelze většinou s úspěchem použít v reálné situaci (zkušenosti s LMA).
Specifické požadavky v prostředí mikrogravitace: požadavky na zajištění dýchacích cest v mikrogravitačním prostředí:
Jednoduchý nácvik (dostačující hodinový nácvik a jedenkrát ročně „refresh“ kurz).
Úspěšnost při použití i při difficult airways (alespoň 85% úspěšnost).
Compliance s obecnými doporučením ASA (použitelností v netypických podmínkách – naslepo, v abnormální poloze, s plným žaludkem).
Umožňuje použití inspiračních tlaků < 25 cm H2O, eliminace rizika GE refluxu.
Možnost intratracheálního podání léků.
Použitelnost až 72 hodin (dnešní limit zahrnující i čas transport z místa přistání k místu definitní pomoci).
Minimální nároky na farmakologickou přípravu k zajištění dýchacích cest a následné sedace.
Použitelnost v podmínkách měnících se atmosférických tlaků – jak při poklesu pod tlak v kabině (< 14,7 psia, např. v modulu Soyuzu na 10,1–10,9 psia), tak v HBO.
Použitelnost v extrémních výškových kategoriích u různých ras a pohlaví (148–190 cm).
Standardní připojení k ventilátoru (15 mm OD).
Možnost odsávání z DC i z orofaryngu.
Výsledky testů: Při teoretickém hodnocení 9 parametrů 1–3 body, je se standardní intubací (27 bodů) plně srovnatelná jen ILMA (24 bodů), následuje PLMA (21 bodů), a pak teprve ostatní techniky (LMA, Combitube a COPA, 18 bodů). Komerčně dostupné a prakticky používané techniky byly hodnoceny podle referencí v literatuře a testovány během parabolického letu v simulovaném mikrogravitačním prostředí (standardní intubace vs ILMA) po předchozím 3hodinovém tréninku. Klasická laryngoskopie vyžaduje přizpůsobení orientace těla intubujícího a modelu. V praktickém provozu operačního sálu nedosahují absolventi aeronautického nácviku úspěšnosti lepší než 50%. Nácviky pouze na modelech bez možnosti udržovat získanou dovednost v praxi jsou nedostatečné. Kombi rourka, COPA ani LMA nesplňují požadavky kladené na zajištění DC v mikrogravitačním prostoru. ILMA je vzhledem k možnosti pozdější intubace zřejmě nejlepší. Důležitou úlohu může hrát i typ později použité intubační rourky (objem manžety, materiál).
Závěr: Při intubaci v mikrogravitačních podmínkách je rozhodující stabilizace pozice intubujícího a pacienta. ILMA má určité výhody před ostatními pomůckami. Rozhodující v budoucnosti bude rychlost, snadnost a spolehlivost zavedení pomůcky, možnost fixace, zachování přístupu k dutině ústní a stabilita během zpětného transportu při přetížení.
XII. POSTGRADUÁLNÍ KURZ
1. Racionální kyslíková léčba u akutních stavů
Praktická doporučení pro oxygenoterapii v nemocnicích
Herold I.
ARO, Oblastní nemocnice Mladá Boleslav
Léčebné podání kyslíku musí splňovat standardní požadavky na podání léku. Kyslík musí být registrován, splňovat technické i zdravotnické normy, být označen, přepravován a uskladněn podle příslušných norem. Jeho aplikace, jako u jiných léků, se řídí indikačními kritérii a při jeho preskripci je třeba určit dávkování (%, l/min), způsob podání, případně další adjustaci (zvlhčování, mikronebulizace). Kyslíková léčba má být indikována a řízena monitorováním (SpO2, PaO2). Specifikem kyslíkové léčby je nově určení cílové hodnoty oxygenace a titrace dávky (rozmezí SpO2 94–98 %, respektive 88–92 % podle základního onemocnění). Kyslíková léčba má svá rizika a možné vedlejší účinky (hyperoxémie, hyperkapnie). U vybraných skupin rizikových pacientů je třeba dbát na postupné a plynulé ukončení jeho podání (weaning). Kyslíková léčba je všeobecně stále ještě vnímána na řadě pracovišť jako pouhý doplněk léčby a její preskripci není věnována náležitá pozornost. British Thoracic Society přijala v roce 2008 dokument „Doporučení pro kyslíkovou léčbu dospělých pacientů v akutních stavech“. Základní principy kyslíkové léčby jsou racionální, univerzálně akceptovatelné a je třeba s nimi seznámit širší odbornou veřejnost. Technické prostředky k aplikaci kyslíkové léčby a jejímu monitorování jsou u nás dostupné.
Kyslíková léčba: Kyslík není lékem dušnosti, ale hypoxémie. Cílem léčby je dosáhnout optimální hodnoty saturace hemoglobinu kyslíkem (SaO2). Oxygenoterapie by měla vést k úpravě oxémie k normě (SaO2 94–98 %), s výjimkou stavů spojených s rizikem hyperkapnického respiračního selhání, případně v paliativní terminální péči, kde jsou cílové hodnoty oxémie subnormální (u pacientů s rizikem hyperkapnie SaO2 88–92 %). Dušnost bez hypoxémie na kyslíkovou léčbu většinou nereaguje. Obdobně při metabolických poruchách acidobazické rovnováhy (ketoacidóza, urémie) hypoxémie nebývá přítomná a kyslíková léčba nepřináší úlevu. Naopak při anémii nebo intoxikaci CO ani normooxémie změřená pulzním oxymetrem (SpO2) nevylučuje tkáňovou dysoxii a pouze vyšetření ABR pomůže určit příčinu. Kyslíková léčba je při intoxikaci CO i při normální hodnotě SpO2 plně indikovaná.
Monitorování oxygenace a fyziologické meze oxémie
Pulzní oxymetrie: Zavedení pulzní oxymetrie znamenalo pravděpodobně největší změnu v monitorování pacientů v posledních několika desetiletích, zvýšilo bezpečnost pacientů a rozšířilo dostupnost relativně velmi účinného, bezpečného, neinvazivního a levného monitorování nejen do všech oddělení nemocnic, ale i do přednemocniční a domácí péče. Pulzní oxymetrie je považována za tzv. 5. životní funkci a měla by být měřena nejen u všech pacientů s dušností (k objektivizaci možné hypoxémie jako její příčiny), ale i u jiných akutních stavů, které mohou, ale nemusí být provázeny hypoxémií. Hypoxémii nelze bezpečně identifikovat klinicky podle stupně cyanózy (např. vliv anémie, polycytémie, stagnační hypoxie), ale na druhé straně lze na její přítomnost usuzovat i nepřímo podle alterace ostatních fyziologických funkcí (alterace vědomí, zrychlená dechová a tepová frekvence, hypertenze). SpO2 je součástí modifikovaného EWS (Early Warning Signs, mEWS), kdy hodnoty > 3 včas varují, že hrozí vznik kritické situace. Nenahrazuje pochopitelně vyšetření acidobazické rovnováhy, protože nepřináší informaci o přítomnosti acidémie nebo hyperkapnie. V kombinaci s odběrem arterializovaného vzorku (např. z ušního lalůčku) ale umožňuje i bez arteriálního odběru získat poměrně přesné hodnoty pH, PaCO2 a SpO2. Její dostupnost by měla být zajištěna všude, kde je kyslíková léčba používána.
Hodnoty SpO2 a SaO2 těsně korelují; průměrné hodnoty SaO2 (± 2 SD) u osob < 70 let jsou 94–98 % (vsedě u hladiny moře), s věkem postupně hodnota klesá a u osob > 65 let je 92,7–98,3 %, což odpovídá PaO2 9,02–14,76 kPa
SpO2 > 92 % vylučuje hypoxémii (senzitivita 100%, specificita 86%); z důvodu bezpečnosti a možné chyby měření ± 4 % se v doporučeních uvádí jako dolní fyziologická mez 94 %, takže ani při negativní odchylce měření – 4 % se pacient neocitne v hypoxickém pásmu.
Dobrovolníci tolerují pokles SaO2 na 70 %, Severinghaus dokonce v laboratoři testující spolehlivost pulzních oxymetrů vystavil dobrovolníky při dýchání hypoxemické směsi krátkodobě hodnotám 55 % bez větší újmy.
Akutní hypoxémie ohrožuje jinak zdravé pacienty hypoxií tkání již při hodnotách SaO2 < 80 % (PaO2 < 6 kPa), ale při akutním nebo chronickém onemocnění je riziko hypoxie již při PaO2
nad hranicí 6kPa .Ve vyšších nadmořských výškách SaO2 klesá, ale lidský organismus se na pobyt postupně adaptuje. V adaptaci na poměry ve velkých nadmořských výskách existují i etnické rozdíly, např. ve stejné nadmořské výšce (4 000 m) jsou u obyvatel And hodnoty SaO2 88,2 %, v Tibetu 90,6 %. K poklesu hodnot SaO2 může dojít i při letu dopravními letadly ve vysokých letových hladinách. U zdravých osob klesá SaO2 z 97 % při startu od hladiny moře až na 93 % (SD 85–98 %) , u nemocných s CHOPN z 96 % až na 90 %, a při chůzi po palubě až na 87 %. Nemocní s kardiálním a respiračním onemocněním mohou vnímat během letu hypoxémii jako nespecifický diskomfort (palpitace, úzkost, oprese).
Existuje noční variabilita SaO2 a zejména u starších osob jsou častější poklesy k nižším hodnotám. Intermitentní měření spících pacientů nemusí postihnout desaturační epizody, k nimž dochází.
Běžné typy monitorů SpO2 mohou ukazovat nepřesné hodnoty v souvislosti:
– s tmavší pigmentací kůže (etnické a rasové rozdíly byly pozorovány jak v USA, tak v Asii); – u pacientů s tmavou pletí v pásmu těžké hypoxie (SaO2 60–80 %) ukazují měřené hodnoty SpO2 falešně vyšší hodnoty (až o 4 %);
– s přítomností barviv na kůži a nehtech (zbytky mekonia, lak na nehty, barvy na vlasy, barva při snímání otisků prstů);
– s pohybovými artefakty;
– s akrální hypoperfuzí;
– s místem umístění snímače SpO2 (prst, ušní lalůček, prsty na noze): V rychlosti detekce hypoxémie existují mezi místy měření významné rozdíly (latence v detekci přes 60 sec při umístění) na prstech nohy;
Nová technologie pulzní oxymetrie (Signal Extraction Technology, Massimo SET) využívající jiné emisní spektrum a metodu Discrete Saturation Transformation (DST) Algorithm umožňuje snížit na minimum pohybové artefakty a téměř eliminovat problém periferní hypoperfuze, zejména v nejnižších věkových kategoriích.
Tkáňová oxymetrie (NIRS)
Nová technologie využívající metodu „near infrared“ spektroskopie; emitující a snímající diody jsou umístěny nad tenarem a měří kontinuálně oxygenaci tenarového svalstva (poměr oxyHb/OxyHb a deoxyHb).
Výběr místa je dán minimálním vlivem BMI na tloušťku tukové vrstvy na tenaru; metoda není ovlivněna pulzatilní složkou a není zkreslena hypotenzí.
Součástí techniky je arteriální okluzní test manžetou tonometru; strmost poklesu StO2 po inflaci manžety je funkcí spotřeby kyslíku ve svalu, strmost vzestupné části křivky po uvolnění okluze je funkčním (endoteliálním) indexem mikrocirkulace. Poslední studie potvrzují korelaci StO2 a ScvO2 u pacientů na urgentním příjmu i na JIP.
Monitorování ScvO2/SvO2
Doporučení monitorování parametru kyslíkové spotřeby ScVO2/SvO2 je součástí doporučení léčby sepse (Surviving Sepsis Campaign 2008) s cílovými hodnotami ScvO2 ≥ 70% a SvO2 ≥ 65%.
Měření ScvO2 ze zavedeného CŽK je méně invazivní než SvO2 z plícnicového katétru.
Poměr ScVO2/SvO2 stoupá při snížení kyslíkové spotřeby (sedace, hypotermie, UPV), naopak klesá při stresu, hypertermii, svalovém třesu; ΔScvO2/SvO2 je ovlivněna extrakcí kyslíku v oblasti splanchniku.
Nízká hodnota ScvO2 má vliv na outcome pacientů po rozsáhlých chirurgických výkonech (cut-off 64,4 %), jiná práce uvádí optimální cut-off dokonce 73 %.
Supranormální hodnoty ScvO2 ≥ 80 % jsou rovněž spojeny se zvýšenou mortalitou (při kardiogenním šoku) a korelují s hyperlaktatémií.
Titrace intenzity kyslíkové léčby má být prováděna podle závažnosti stavu a povahy základního onemocnění:
1. Kritické stavy (vyžadují vysoké FiO2 i bez okamžité znalosti SpO2)
Jak?
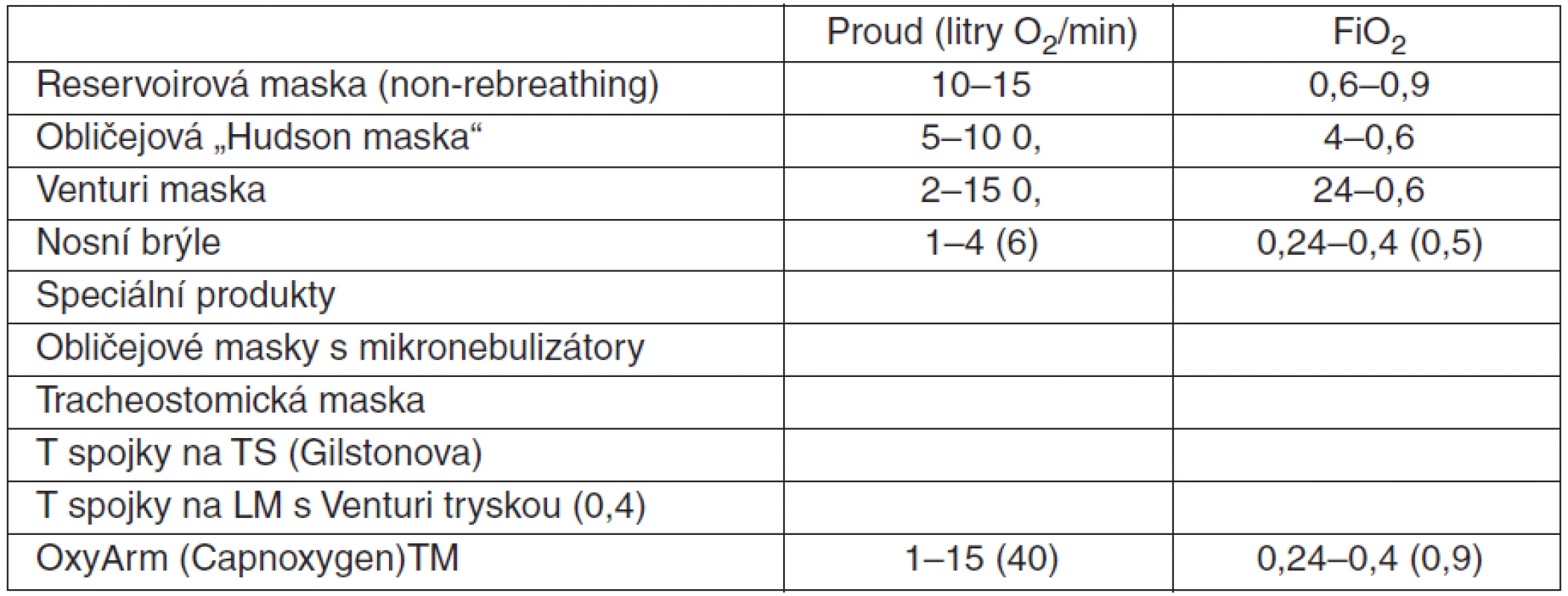
Reservoirovou maskou (non-rebreathing), s příkonem 15 l O2/min.
Po stabilizaci stavu postupná redukce FiO2 k cílové hodnotě SpO2 94–98 % (88–92 % u CHOPN).
Kdy?
Zástava oběhu, KPR, sepse, trauma , šok, anafylaxe, kraniotrauma, intoxikace CO.
2. Středně závažné stavy (vyžadují kyslíkovou léčbu při hypoxémii), zejména akutní respirační selhání I. (hypoxemické) nebo II. typu (s hyperkapnií).
Jak?
Nosní brýle 2–6 l O2/min (nebo obličejová maska 5–10 l O2/min) k dosažení SpO2 94 %.
Venturi maska s možností přesně titrované frakce podle typu trysky a příkonu kyslíku (tab. 1).
Reservoirová maska 10–15 l O2/min při SpO2 < 85 % (není-li riziko hyperkapnie).
Při riziku hyperkapnie (CHOPN a dalších stavů – viz dále) titrovat léčbu k SpO2 88–92 %, kontrola krevních plynů po 30–60 min, při hyperkapnii NIV nebo IPPV.
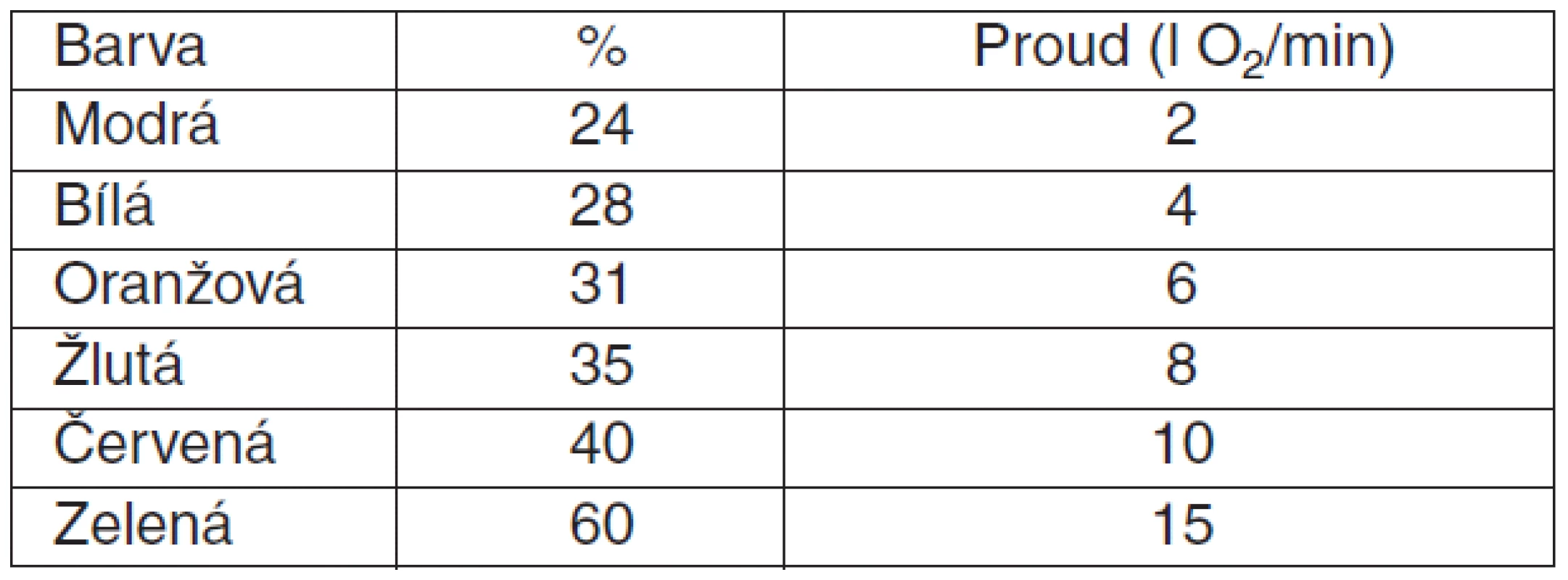
Barvy trysek, % O2 a doporučený příkon (zvýšit při tachypnoi > 30 d/min )
Specifické situace a indikace oxygenoterapie
Akutní kardiální selhání (O2 nebo CPAP nebo NIV při hyperkapnii, IPPV při šoku).
Pooperační dušnost (podle vyvolávající příčiny O2, dekurarizace, antagonizace opioidů).
Intersticiální plicní onemocnění (fibróza).
Srpkovitá anémie (O2 při hypoxémii).
PNO (je-li provázen hypoxémií, je nutná drenáž; není-li nutná, pak oxygenoterapie k SpO2 100% urychluje spontánní resorpci).
Fluidotorax (je-li provázen hypoxémií evakuace výpotku i oxygenoterapie).
Plicní embolie (lehčí formy nejsou provázeny hypoxémií) – oxygenoterapie při hypoxémii.
Anémie nebývá provázena hypoxémií (kauzální léčba).
3. Stavy s rizikem hyperkapnie vyžadující řízenou léčbu kyslíkem s nižší frakcí O2 (akutní respirační selhání II. typu).
Rizika kyslíkové léčby u pacientů s rizikem hyperkapnie
V/Q nepoměr (inhibice HPV), snížený ventilační drive, aborpční atelektázy.
Haldaneův efekt (nižší pufrační kapacita OxyHb), vyšsí denzita kyslíku.
Rebound hypoxémie při náhlém ukončení oxygenoterapie.
Jak?
Kritický stav: reservoirová maska, ruční dýchací vak, UPV.
Hyperkapnie bez acidózy (pH > 7,35, PaCO2 > 6 kPa): oxygenoterapie cílové hodnotě SpO2 88–92 % Venturi maskou (28 % nebo 24 %).
Normokapnie: oxygenoterapie k cílové hodnotě SpO2 94–98 % (kontrola ABR po 30–60´).
Hyperkapnická acidoza (pH < 7,35, PaCO2 >6 kPa): NIV/IPPV.
Kdy?
CHOPN, chronická nervosvalová onemocnění, kyfoskolióza , cystická fibróza.
4. Akutní stavy vyžadující monitorování SpO2 (oxygenoterapii jen při hypoxémii)
Jak?
Nosní brýle 2–6 l O2/min, obličejová maska 5–10 l O2/min s cílovou hodnotou 94–98 % (88‑92 %), při SpO2 < 85 % reservoirová maska při riziku hyperkapnie (viz bod 3).
Kdy?
Při hypoxémii; žádný nebo neprokazatelný benefit při normoxémii.
Jednoznačně neprokázaný nebo potenciálně negativní účinek oxygenoterapie (hyperoxémie) (je-li kyslíková léčba indikována bez hypoxémie)
AIM a akutní koronární syndrom (velmi diskutovaná kategorie, není-li provázena hypoxémií, je riziko reperfuzního poranění a zhoršení ischémie).
Cévní mozková příhoda (horší outcome po roce ve skupině lehčích a středně těžkých ischemických inzultů).
Oxygenoterapie při porodu (možnost adverzního vlivu na plod – oxygenoterapie jen při hypoxémii matky).
Hyperventilační tetanie, panická úzkost – kyslíková léčba nepřináší úlevu, ventilace „do sáčku“ je riskantní.
Intoxikace (podat antidota, CAVE vyšší FiO2 u aspirace kyselého obsahu).
Paraquat (ventilace hypoxemickou směsí s FiO2 0,14) a bleomycin.
Metabolická acidóza – kyslíková léčba bez efektu
Chronická nervosvalová onemocnění (indikována spíše NIV/IPPV).
Pozn.: Mechanismem adverzního účinku hyperoxémie může být vznik reaktivních kyslíkových radikálů, reperfuzní poranění a opožděná manifestace klinických projevů zhoršování klinického stavu).
Hyperoxémie – indikace a možné výhody
Intoxikace CO – při FiO2 1 je poločas COHB zkrácen z 4–5 hod na 40 min.
Urychlení spontánní resorpce pneumotoraxu, jenž nevyžaduje hrudní drenáž.
Iniciální fáze KPCR (v poresuscitační fázi potenciální benefit FiO2 0,3 (NSE), u resuscitovaných novorozenců uvádí Cochrane database 2007 několik studií s dobrým efektem resuscitace vzduchem).
Kritické stavy s cílem zlepšit dodávku kyslíku tkáním (nikoliv maximalizovat dodávku kyslíku).
Snížení ranných infekcí u resekčních výkonů v kolorektální chirurgii krátkodobou hyperoxémií (FiO2 0,8 vs 0,3).
Vliv na hojení diabetické nohy a snížení počtu amputací po 1 roce (neprůkazný efekt).
Clusterové bolesti hlavy (60 % pacientů udává úlevu).
Snížení PONV (nejasný mechanismus).
Ukončení oxygenoterapie a kyslíkový weaning
Po stabilizaci stavu a zlepšení klinických parametrů (mEWS) a úpravě SpO2 do horních pásem doporučeného rozmezí (94–98 % nebo 88–92 %) je možné plynulé snižování dávky kyslíku (příkonu O2 a/nebo koncentrace) během 4–8hod.
Ukončení oxygenoterapie při plynulém weaningu je možné:
– kyslíkovými brýlemi příkonem 2 l O2/min (1l/O2/min);
– Venturi tryskou 24 % 2 l O2/min.
Po ukončení kyslíkové léčby a při spontánním dýchání FiO2 0,21 je doporučena kontrola SpO2 po 5 min a pak za hodinu.
6. Technické prostředky pro kyslíkovou léčbu
Technické prostředky uvádí tabulka 2.
7. Zvlhčení směsi
Není nutné:
při krátkodobé léčbě s vysokým průtokem směsi < 24 h;
pro léčbu nízkými průtoky, není-li pocit diskomfortu ze suché směsi;
alternativou je nebulizace fyziologického roztoku;
u trachestomovaných pacientů u krátkých transportů pacientů.
Studené (probublávací) vs parní:
studené jsou neúčinné, potenciálně zdrojem infekce;
parní zvlhčovače (teplota 32–36 °C) se 100% vlhkostí zlepšují clearance vazkého hlenu, ale klinické studie prokazující jejich přednost nejsou k dispozici;
krátkodobou alternativou nebulizace fyziologického roztoku.
Mikronebulizace bronchodilatancií:
generace polydisperzního aerosolu, většinou 4–10 µ;
pohon kyslíkem 6 l O2/min (není-li riziko hyperkapnie);
pohon vzduchem nebo elektrickým kompresorem, je-li riziko hyperkapnie;
± suplementace brýlemi 1–6 l O2/min;
riziko hyperkapnie u CHOPN nastává již po 15´ kyslíkové léčby vysokým FiO2;
kyslíkové nebulizátory s FiO2 0,6 omezit maximálně na 6 min;
pohon elektrickým kompresorem nebo vzduchem ± kyslík nosními brýlemi 1–4 l O2/min (SpO2 88–92 %).
2. Algoritmy obtížného zajištění dýchacích cest
Hanousek J.
Department of Anaesthesia and Intensive Care, North Devon District Hospital, Barnstaple, U.K.
Zajištění dýchacích cest je prvořadým úkolem anesteziologa na operačním sále či mimo. Znalost algoritmů a alternativních způsobů zajištění dýchacích cest napomáhá řešení složitých situací. Skutečným problémem by mělo být pouze urgentní nebo neočekávané obtížné zajištění dýchacích cest. V ostatních situacích lze předem připravit bezpečný způsob, jako např. inhalační úvod, fibro-optická intubace v lokální anestezii nebo tracheostomie v LA. Prvním důležitým krokem je tedy rozpoznání potenciálních obtíží. Dále se budeme věnovat pouze obtížné/nemožné intubaci za neodkladných podmínek. Algoritmus podle Difficult Airway Society je rozdělen do 4 kroků.
Úvodní intubace – po prvním neúspěšném pokusu o laryngoskopii/intubaci je třeba povolat pomoc, omezit se na 3–4 pokusy o intubaci, zamezit hypoxii a návratu vědomí pacienta. Před každým novým pokusem o intubaci je třeba změnit alespoň jednu složku techniky intubace: polohu hlavy, typ laryngoskopu, použití zavaděče, bužie, nasazení/odejmutí Sellickova hmatu či zevní laterální manipulace hrtanu. Již v této fázi je moudré zvážit nasazení alternativních pomůcek jako jsou videolaryngoskopy či optické stylety.
Sekundární intubace je intubace alternativním způsobem, např. skrze intubační laryngeální masku (LM), poslepu nazálně či alernativními pomůckami jako videolaryngoskopy či optickými stylety, které mohou významně napomoci s intubací. Ačkoli je práce s videolaryngoskopy často velice snadná a intuitivní, nejedná se o pomůcky, jež zachrání situaci při prvním použití daným operátorem v kritické situaci. Je-li ventilace a oxygenace možná pomocí LM, je třeba zvážit, zda případná rizika opakovaných pokusů o intubaci nepřevažují hodnotu endotracheální intubace v dané situaci. I v této fázi je nutno pokračovat s oxygenací, anestezií a relaxací pacienta, nezapomínat na kardiovaskulární stabilitu.
Zajištění oxygenace a ventilace nastupuje po selhání předchozích dvou kroků. Nejbezpečnější je návrat k ventilaci maskou a vakem, případně pomocí vzduchovodu a druhé osoby (2 ruce na masce). Pacienta bychom měli takto vyvést z anestezie nebo přechodně zajistit dýchací cesty pomocí LM či jiným supralaryngeálním prostředkem.
Situace selhání intubace i ventilace vyžaduje rychlé jednání. Je třeba se rozhodnout mezi koniopunkcí a koniotomií. V rukou většiny anesteziologů je tradičně metodou první volby koniopunkce. Ideálním prostředkem je speciální krikotyroideální kanyla jako je QuickTrach. Vnitřní průměr kanyly QuickTrach (4 mm) dovoluje dostatečnou nouzovou ventilaci včetně exhalace. Kanyly menšího průměru, jako Ravussin, Melker, či improvizované prostředky, jako velké intravenózní kanyly (14 G), mají dvě omezení: vzhledem ke kalibru kanyly je pro dostatečnou oxygenaci třeba mít k dispozici tryskovou ventilaci a pro výdech pacienta je nutná průchodnost horních cest dýchacích. V případě selhání pokusu o oxygenaci koniopunkcí je nutno přistoupit ke koniotomii, proto jsou v posledních letech mnozí pro provedení koniotomie jako první volby invazivního přístupu.
V rukou zkušených operátorů lze obvykle dosáhnout zajištění dýchacích cest tradičními prostředky, tj. laryngoskopem (případně s rovnou laryngoskopickou lžící – Miller či Henderson, nebo McCoy) a bužijí. Současná nabídka nových systémů pro zajištění dýchacích cest nabízí celou řadu atraktivních řešení obtížných situací díky zdokonalení LM, rozvoji optických vláken a použití digitálních mikrokamer. Mezi ně patří intubační a ProSeal LM, video-asistované laryngeální masky, videolaryngoskopy (Airtraq, Pentax Airway Scope), flexibilní a rigidní optické stylety (Bonfil, Shikani), tryskové ventilátory a kanyly (Manujet, Quicktrach, Ravussin, Melker, Patil). Zásadnější než konkrétní prostředky pro obtížnou intubaci je včasné rozpoznání rozvíjejících se obtíží, znalost algoritmů pro řešení selhání intubace a logické rozhodování v krizi.
3. Fibrooptická bronchoskopie – tips and tricks
Bartáková H.
Klinika anesteziologie, resuscitace a intenzivní medicíny, Všeobecná fakultní nemocnice a II. interní klinika, Fakultní nemocnice Královské Vinohrady, Praha
Flexibilní bronchoskopie (BSK) je na odděleních anestezie, resuscitace a intenzivní medicíny využívána jednak k asistenci při intubaci a tracheotomii, jednak jako diagnostická a terapeutická metoda. Jako intubační technika je BSK často využívána až jako alternativní způsob intubace při selhání běžných postupů. Za těchto okolností je riziko selhání intubace „po BSK“ relativně vysoké, vhodné je při nepříznivých intubačních poměrech použít BSK jako primární způsob vizualizace dýchacích cest. Kontrola pozice biluminální endotracheální rourky ultratenkým BSK je velmi doporučována, neboť až ve více než 70 % se prokáže špatná pozice. BSK je užitečnou metodou při perkutánní dilatační tracheotomii, při níž lze kontrolovat místo vpichu, polohu tracheotomické kanyly a případný rozsah poranění trachey. Naprostá většina pacientů na lůžkových odděleních ARO je z příčin plicních či mimoplicních mechanicky ventilována. V kontextu intenzivní péče jsou veškeré kontraindikace BSK relativní. Vždy je třeba individuálně zvážit, zda provedení BSK závažnou situaci pacienta zlepší, nebo naopak zvrátí nepříznivým směrem. Riziko komplikací je redukováno přípravou pacienta spočívající především v analgosedaci, případně i relaxaci, preoxygenaci, použití vhodné endotracheální rourky, minimalizací úniku vzduchu z ventilačního okruhu, úpravou ventilačního režimu.
U 75 % ventilovaných pacientů je BSK indikována pro atelaktázy k odstranění hlenových zátek. Diagnostika pneumonií pomocí odběru sekretů z dolních dýchacích cest je další častou indikací k BSK u pacientů na UPV. V současnosti je BSK odběr sekretů a jejich kvantitativní zpracování upřednostňován u pacientů s ventilátorovou pneumonií pro možnost časnější deeskalace antibiotik. Z diagnostických důvodů je dále BSK indikována u pacientů s hemoptýzou, suspekcí na aspiraci cizího tělesa, nádor průdušek, intersticiální plicní proces, ezofagotracheální/bronchiální, respektive pleurobronchiální píštěl. Na našem oddělení bronchoskopujeme všechny pacienty intubované v terénu nebo za obtížných okolností na jiném oddělení. Až v 50 % nacházíme známky aspirace patologických sekretů, potravy či krve. Z terapeutických výkonů se jedná – kromě již zmiňované toalety dýchacích cest – o ošetření hemoptýzy (adstringencia, hemostyptika, balonkové katétry, obturátory, elektrokoagulace pomocí koagulačních klíštěk), extrakci cizích těles, obturace pleurobronchiální píštěle. Pro osud ventilovaných pacientů s endobronchiální či tracheální stenózou mohou být život zachraňující i intervenční metody, jako je implantace stentu, která umožní úspěšné odpojení pacienta od ventilátoru. Domníváme se, že vzhledem k širokému využití BSK na jednotkách intenzivní péče a lůžkových ARO je vhodné, aby základy BSK techniky ovládali intenzivisté a anesteziologové, kteří v situacích vyžadujících dovednost pracovat se speciálními nástroji a technikami mohou požádat o pomoc zkušeného bronchologa.
4. Perkutánní dilatační tracheostomie – tips and tricks
Otáhal M.
KARIM, VFN, Praha, Česká republika
Perkutánní nebo někdy punkční dilatační tracheostomie (PDTS) je výkon, který stále častěji provádí sami lékaři-intenzivisté na JIP, kdy při správném provedení je to výkon jednoduchý a rychlý, přinášející benefit našim pacientům, ale jako každý jiný výkon má svoje limitace, rizika a komplikace. Správné provedení i následná péče je zásadní pro minimalizaci těchto rizik a komplikací.
Historie provedení tracheostomie (TS) jako zajištění dýchacích cest sahá hluboko před náš letopočet, kdy první zmínky jsou již v hindské učebnici medicíny „Rig Veda“ 1500 let př. n. l., 800 l př. n. l. Homer popisuje punkci trachey mečem, první lékařsky provedenou tracheotomii popisuje A. M. Brasavolo v roce 1546. Provedení perkutánní tracheotomie pomocí speciálního trokaru je poprvé publikováno Sheldonem v JAMA v r. 1957. Následně v r.1969 popisuje Toye perkutánní TS pomocí Seldingerovy techniky a v roce 1985 P. Ciaglia první dilatační perkutánní tracheotomii, kterou v r. 1989 modifikuje Paul použitím bronchoskopu. A v roce 1990 publikuje Griggs techniku TS využívající upravený Howard-Kellyho peán.
Mnoho studií bylo následně publikováno ve snaze najít rozdíly mezi chirurgickým provedením a punkčním dilatačním provedením, i mezi jednotlivými technikami, hlavně mezi metodou podle Ciagliho následně modifikovanou použitím postupně se rozšiřujícího dilatátoru – Blue Rhino a metodou podle Griggse, které patří mezi nejčastěji používané. PDTS vs klasická chirurgicky provedená TS vede k signifikatní redukci ranných infekcí, v ostatních komplikacích (krvácení, mortalitě, stenózy) není signifikatní rozdíl. TS provedené chirurgicky na operačním sále jsou, vzhledem k transportu, zatíženy vyšší mortalitou i krvácením. U PDTS je vyšší riziko dekanylací a následných komplikací při rekanylacích. Ve srovnání s chirurgickým přístupem je PDTS metodou volby provedení TS u pacientů v intenzivní péči. Mezi jednotlivými technikami provedení není signifikantních rozdílů v komplikacích, i když ze zkušenosti je metoda BlueRhino jednodušší na provedení.
Komplikace PDTS můžeme dělit na peroperační, časné do 7dnů a pozdní. Mezi peroperační patří krvácení, aspirace, poruchy ventilace a hemodynamická nestabilita během výkonu. Časnými komplikacemi jsou dislokace/dekanylace, infekce rány, podkožní emfyzém, poranění jícnu. Pozdními komplikacemi jsou tvorba granulomu, poruchy polykání, tracheo-kutánní nebo tracheo-ezofageální píštěl a stenózy. Stenózy, které se vyskytují cca v 1–2 %, mají multifaktoriální příčinu vzniku, kdy prostenotický potenciál mají: překročení doporučených tlaků v manžetě kanyly, angulace a nesprávné polohování, opakované rekanylace a samozřejmě technika a místo provedení. Punkce v subglotické oblasti, hlavně mezi krikoidální chrupavkou a prvním tracheálním prstencem (původně popsané Ciagliou), jsou zatíženy vyšší pravděpodobností vzniku stenóz. Punkce mezi 3. a 4. chrupavkou trachey je nejbezpečnější i pro vznik krvácivých komplikací.
Časné provedení TS, tj. do 7dnů od intubace, signifikantně zkracuje dobu pobytu na UPV u pacientů, kde je předpoklad umělé plicní ventilace delší než jeden týden. Některé studie uvádějí nižší incidenci VAP, zkrácení celkové doby pobytu na JIP. Při velmi časném provedení PDTS (2. den) i signifikantní redukci VAP, délky na UPV, délky pobytu na JIP i mortality.
Technika provedení je zásadní pro minimalizaci rizik a komplikací PDTS. SONO vyšetření před provedením výkonu je zásadní pro verifikaci anatomických struktur, hlavně pozici velkých cév a istmu štítné žlázy a mělo by být provedeno před každou PDTS, i když v literatuře pro toto nejsou jasné důkazy. Po polohování pacienta provedené SONO vyšetření s barevným dopplerovským mapováním může přispět i k optimalizaci místa přístupu vzhledem k cévní zásobení v místě přístupu, vždy by měly být identifikovány a. carotis, v. jug.int., suprasternálně velké cévy, oblouk aorty. Můžeme změřit šířku trachey i hloubku uložení a eventuálně vybrat patřičnou kanylu. Použití bronchoskopu při optimalizaci punkčního místa do trachey nevede podle literatury ke snížení počtu komplikací a zvyšuje personální náročnost provedení PDTS. V případě poškození bronchoskopu je i finančně velice náročné.
Modifikovaná technika přístupu, kdy je z min. řezu postupně provedena šetrná tupá preparace až na tracheu, může identifikovat i anatomické struktury, které by pouhou punkční technikou mohly být poraněny. Drobné cévy lze podvázat nebo ošetřit elektrokoagulací, silnější podvázat. Použití elektrokoagulace je výhodou hlavně u pacientů, kteří musí být na antikoagulační či antiagregační terapii, speciálním případem jsou pacienti s hemato-onkologickými malignitami či po transplantaci kostní dřeně, kdy je častá nejenom porucha koagulace, ale i trombocytopenie a trombocytopatie. Tento modifikovaný přístup je časově i odborně náročnější, ale minimalizuje vznik komplikací, hlavně krvácivých (v našem souboru < 1,5 %). Punkce trachey pod přímou palpací optimalizuje místo punkce, kdy se dá např. istmus dislokovat kraniálním, či méně často kaudálním směrem, a zcela eliminuje potřebu bronchoskopické kontroly. Vlastní provedení tracheotomie (lacerace), ať již pomocí H.K. dilatačního peánu nebo vzestupným dilatátorem BlueRhino nemá zásadního rozdílu, BlueRhino je méně náročné na zkušenosti operatéra. V případě hlubokého uložení trachey je výhodou primo výměna kanyly za delší, např. RÜSCH, vždy po vodiči. Po zavedení kanyly by před zahájením UPV mělo být provedeno odsátí z trachey. Následná kontrola ventilace EtCO2 monitorováním je nejvýhodnější. Po provedené TS je výhodou bronchoskopie k toaletě DC, eventuálně i k optimalizaci polohy kanyly v případě k. RÜSCH.
Mimo krvácení je nejčastější, a velice závažnou, časnou pooperační komplikací PDTS akcidentální dekanylace/špatná pozice. V tomto případě nesmí být prováděny pokusy o zasunutí kanyly zpět, protože to skoro vždy vede ke špatné pozici a při pokusu o ventilaci k rozvoji podkožního emfyzému s možností až pneumomediastina, kdy je i následná OTI někdy velice obtížná. Při špatné pozici/dekanylaci během prvních 48–72 h je nutná okamžitá OTI a následné znovuzavedení TS kanyly vodiči po palpační identifikaci tracheotomie. S delším odstupem je již kanál TS preformovaný a znovuzavedení či výměna kanyly není problematické. Následná péče o TS s pravidelnou kontrolou tlaku v manžetě a vyvarování se angulací a tahu za TS je prevencí možných stenóz.
5. Léčba ventilátorové pneumonie – spolupráce intenzivisty a mikrobiologa
Chytra I.1, Bergerová T.2
1Anesteziologicko-resuscitační klinika, Fakultní nemocnice v Plzni, Univerzita Karlova v Praze, Lékařská fakulta v Plzni
2Ústav mikrobiologie, Fakultní nemocnice v Plzni
Ventilátorová pneumonie (VAP) je nejčastější infekcí v intenzivní péči. Postihuje 5–50 % ventilovaných nemocných, několikanásobně zvyšuje riziko úmrtí, prodlužuje délku umělé plicní ventilace i délku hospitalizace a zvyšuje náklady na léčbu. Riziko neadekvátní antibiotické léčby s nepříznivým ovlivněním mortality spolu s nárůstem rezistence prokázala řada studií. Nejlepší strategií ke zlepšení adekvátnosti antibiotické léčby a současně minimalizaci rozvoje rezistence je pravděpodobně aktivní spolupráce intenzivisty a mikrobiologa. Základní podmínkou úspěšné léčby VAP je již správné stanovení diagnózy. Spolupráce intenzivisty a mikrobiologa začíná v okamžiku vzniku podezření na diagnózu VAP, nejčastěji při současném nálezu infiltrátu na RTG plic spolu s alespoň dvěma ze tří klinických symptomů (teplota > 38 °C, leukocytóza nebo leukopenie, hnisavé sputum). Důvodné podezření při splnění výše uvedených nálezů je kritériem pro zahájení podrobnější diagnostiky VAP a podání antibiotické léčby. Po zvážení rizikových faktorů pro etiologii VAP vyvolanou rezistentními patogeny je zahájena empirická antibiotická léčba podle lokálních guidelines, na jejichž koncipování by se měl podílet mikrobiolog znající nejen epidemiologickou situaci dané jednotky intenzivní péče, ale většinou i celého zdravotnického zařízení, eventuálně regionu. Před aplikací antibiotické léčby je nezbytné získat materiál z dolních cest dýchacích a odebrat hemokultury. Již v této fázi je vhodné s mikrobiologem konzultovat možnost využití rychlých diagnostických testů k získání alespoň předběžné informace o původci VAP.
Mikroskopické vyšetření je rychlé, levné a snadno dostupné. Standardně je prováděno barvení podle Grama. Mikrobiolog hodnotí přítomnost hlenových vláken a polymorfonukleárů pro stanovení přítomnosti a aktivity zánětu (neplatí pro neutropenické nemocné). Nepřítomnost polymorfonukleárů pravděpodobnost diagnózy významně snižuje. Mikrobiologický nález může identifikovat přítomnost grampozitivních bakterií (nejčastěji stafylokoky, pneumokoky a streptokoky), gramnegativních bakterií (hemofily, branhamely, enterobakterie a další gramnegativní tyčinky). Hodnocení je semikvantitativní. Přítomnost velkého množství dlaždicových epitelií může svědčit pro nevalidní odběr materiálu, nicméně jejich nález, často společně s bakteriální flórou dutiny ústní, není krátce po intubaci výjimkou. Diagnózu infekce významně podporuje nález intracelulárních bakterií. V barvení podle Grama lze zachytit především grampozitivní bakterie, gramnegativní bakterie jsou intracelulárně nezřetelné, lépe je lze prokázat v barvení podle Giemsy, které se však standardně neprovádí. Legionely se mikroskopicky prokazují jen obtížně. Grampozitivně se barví i kandidy, houbová vlákna se nebarví (aspergily) a nemusejí být zřetelná. Pro jejich průkaz se používají jiné techniky. Konzultace mikroskopického nálezu s mikrobiologem může poskytnout důležité informace a zásadně ovlivnit již empirickou antibiotickou léčbu.
Kultivační nález včetně citlivosti je obvykle dostupný do 48–72 hodin. U materiálu získaného z dolních cest dýchacích je prováděna rutinně kultivace zaměřená na běžné patogeny, po domluvě s mikrobiologem je možno provést kultivaci speciální (legionely, mykobakteria). Vyšetření lze provést a hodnotit kvalitativně, semikvantitativně a v případě potřeby i kvantitativně. Odlišení kolonizace a infekce je mnohdy obtížné, a tak vzájemná konzultace s posouzením klinického stavu pacienta, zánětlivých laboratorních parametrů spolu s kultivačním nálezem, může rozhodování mezi kolonizací a infekcí usnadnit. Negativní kultivační nález má silnou negativní predikční hodnotu (94%), nevylučuje však virovou nebo legionelovou etiologii.
Na virovou etiologii při stanovení diagnózy VAP není často pomýšleno, je však pravděpodobně častější, než je v obecném povědomí. Nejčastějšími původci jsou cytomegalovirus (CMV), virus herpes (HSV), RS viry a v poslední době především virus chřipky. Virologická kultivace je možná, trvá však několik dnů. Výhodnější je diagnostika pomocí PCR (polymerase chain reaction), která je užívána především pro nekultivovatelné či obtížně a pomalu rostoucí bakterie a viry (legionelly, mykobakteria, chlamydie, mykoplasmata, viry). Tam, kde lze, je optimální spojení PCR s kultivací.
Postavení metod molekulární biologie v rutinní diagnostice bakteriálních infekcí není však dosud definitivně ujasněno. Přes jednoznačnou výhodu, spočívající v rychlosti diagnostiky, je užití „multiplexové“ PCR metody spojeno s řadou omezení a možností falešně negativních i falešně pozitivních nálezů. Falešně negativní nálezy mohou být následkem variability DNA patogenů ovlivňující vazbu na primární testovací sondu. Navíc bývá senzitivita pro-koaguláza negativní stafylokoky a streptokoky výrobcem arteficiálně limitována zavedením kontaminačního prahu. Falešně pozitivní nálezy mohou být následkem amplifikace volné DNA uvolněné z mrtvých bakterií a kvasinek. Důsledkem je riziko zbytečné antibiotické léčby, nebo zbytečná aplikace širokospektrých antibiotik, protože testy PCR nezahrnují vyšetření citlivosti. Průkaz nebo vyloučení infekce pomocí PCR není spolehlivé a vždy je nutno výsledky posuzovat v souvislostech s klinikou a doplňujícími vyšetřeními.
Přestože je rychlé vyšetření PCR vysoce sofistikovanou metodou, postrádá standardizaci a je zatíženo rizikem kontaminace. Je třeba dalších prospektivních studií, aby definitivně prokázaly přínos a ekonomickou efektivitu multiplexové PCR diagnostiky v klinické praxi.
Rychlou diagnostickou mikrobiologickou metodou je průkaz antigenů v moči, který je užíván pro diagnostiku pneumokokové a legionelové pneumonie. Umožňuje však pouze průkaz Legionella pneumophila sérotypu 1, která je nejvirulentnější, a bývá nejčastěji původcem legionelové pneumonie. Nicméně nozokomiální legionely jsou často jiného sérotypu a jsou prokazatelné především kultivačně a eventuálně PCR.
Diagnostické metody založené na hodnocení vzestupu koncentrace specifických protilátek jsou pomalé, protilátková odezva bývá průkazná za 7–14 i více dní po začátku onemocnění, u legionel i týdny. Pro průkaz etiologie VAP jsou nevhodné.
Průkaz citlivosti či rezistence je základním východiskem pro antibiotickou léčbu. Výsledky kultivace a citlivosti patogenu zodpovědného za rozvoj VAP umožňují posouzení adekvátnosti empirické antibiotické léčby, mohou být podkladem pro de-eskalaci antibiotické léčby nebo pro její změnu, v případě že iniciální léčba byla nesprávná.
Přes zdánlivě jednoduché rozhodnutí o další léčbě VAP při znalosti citlivosti patogenu nemusí být volba antibiotika adekvátní a konzultace mikrobiologa je doporučena. Dokladem toho je studie, která demonstrovala, že přes znalost výsledků kultivace a citlivosti byla neadekvátní volba antibiotika ošetřujícím lékařem častější než při iniciální empirické léčbě. Přínos konzultace s mikrobiologem při rozhodování o antibiotické léčbě u nemocných v intenzivní péči prokázala celá řada studií. K hlavním pozitivům konzultačního servisu patří vedle významného zvýšení adekvátnosti antibiotické léčby zkrácení doby antibiotické léčby, častější deeskalace iniciální širokospektré empirické léčby, zkrácení doby umělé plicní ventilace, zkrácení délky hospitalizace v intenzivní i nemocniční péči, snížení mortality a úspora nákladů bez zhoršení kvality poskytované péče. Kromě přehledu o epidemiologické situaci a stavu rezistence ve zdravotnickém zařízení jsou zpravidla vědomosti mikrobiologa o farmakokinetických a farmakodynamických vlastnostech antibiotik hlubší; rovněž informovanost mikrobiologa o nových dostupných antibiotikách, jejich indikacích a úskalí jejich aplikace je poněkud podrobnější než povědomí intenzivisty. Doporučení mikrobiologa bývá většinou akceptováno, vždy však záleží na konkrétní situaci, individuálním přístupu, vzájemné důvěře a erudici obou konzultantů. Nerespektování doporučení mikrobiologa ke změně antibiotické léčby po získání kultivačních nálezů v nezvykle vysoké míře (42,4 %) demonstrovala práce Gomeze.
Konzultační servis není využíván jen pro volbu diagnostických metod a pro konzultaci empirické a cílené léčby, ale i po celou dobu trvání VAP a antibiotické léčby. Při pravidelné surveillance umožňuje pružně a adekvátně reagovat na změny bakteriálních nálezů a konzultovat změny nebo iniciovat ukončení antibiotické léčby. Vlastní praktická realizace konzultací je individuální, v našich podmínkách se osvědčil režim denní telefonické konzultace s osobní konzultací jedenkrát týdně u lůžka nemocného.
Aby spolupráce intenzivisty a mikrobiologa byla opravdu přínosná, je nutný oboustranně aktivní přístup, vzájemný respekt, obecná znalost možností mikrobiologických diagnostických metod na straně intenzivisty a dostatek klinických údajů poskytnutých mikrobiologovi. Mikrobiolog by měl být seznámen s novinkami v diagnostice i mimo svůj obor, především s terapeutickými i ošetřovatelskými postupy, které mohou mimo jiné ovlivnit i výsledky mikrobiologického vyšetření (dekontaminační postupy, antibakteriální katétry,…). Důležité je vytvoření pracovních podmínek ze strany zaměstnavatele, neboť konzultace pro všechna pracoviště fakultní nemocnice představují v současné době jeden pracovní úvazek mikrobiologa. Nedostatek ochoty k aktivní spolupráci může být vedle osobní pohodlnosti způsoben právě pracovním vytížením. Pro získání času na skutečně kvalitní konzultace (především u lůžka nemocného) a na jejich písemný záznam v dokumentaci, je možno hledat rezervy v reorganizaci laboratorní práce a zrychlení a zkvalitnění in vitro diagnostiky. Další úsporu času by přineslo omezení nevýtěžných a nevhodných vyšetření, což však často naráží na stereotypy kliniků i laboratorních pracovníků.
Úroveň konzultací mezi intenzivistou a mikrobiologem v jednotlivých zdravotnických zařízeních je rozdílná a vychází většinou ze zvyklostí pracoviště. Význam konzultací se však postupně dostává stále více do povědomí obou specializací a snad i managementu zdravotnických zařízení. Lze očekávat, že v budoucnu se stane standardem každého pracoviště. Přínos konzultací bude vždy záležet na ochotě spolupracovat a na kvalitě předávaných informací mezi oběma konzultanty.
Práce byla podpořena výzkumným záměrem MSM 0021620819.
6. ALI/ARDS – co dělat vždy a co jen někdy?
Černý V.
Klinika anesteziologie, resuscitace a intenzivní medicíny, Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové, Fakultní nemocnice Hradec Králové
Syndrom ARDS je provázen trvale vysokou mortalitou i přes existující dostupnost a rozvoj technik podpor plicních i ostatních orgánových funkcí. Populace pacientů s ARDS představuje mimořádně nehomogenní skupinu nemocných, často s velmi odlišnou vyvolávající příčinou a univerzální terapie typu „one size does fit all“ neexistuje. Každý pacient, kde uvádíme v diagnostickém souhrnu ARDS, by měl mít současně uvedenu vyvolávající příčinu nebo základní onemocnění, ke kterému rozvoj ARDS vztahujeme. Před formulováním konkrétního léčebného plánu u pacienta s ARDS bychom měli hledat odpověď na otázky:
Je to opravdu ARDS? Splňuje pacient kritéria pro ARDS? (Akutní vznik bilaterálních infiltrátů na RTG plic v kombinaci s hypoxémií při absenci známek levostranného srdečního selhání.)
Jaký byl vyvolávající inzult? Infekční nebo neinfekční?
Jde spíše o plicní nebo neplicní etiologii ARDS?
Co dělat vždy?
Identifikace vyvolávajícího inzultu a jeho kontrola:
– velmi včasná léčba infekce (nezapomínat na atypické patogeny a viry),
– kontrola neinfekčního inzultu (např. stabilizace zlomenin),
– „avoiding persisting small insults“.
Postupy ke zlepšení oxygenační funkce plic:
– minimalizace tkáňového otoku,
– optimalizace IAP.
Minimalizace dalšího poškození plic (allow lung to heal):
– co „nejmenší možný“ dechový objem,
– „moderate“ PEEP,
– eliminace farmak s potenciálem zhoršení plicních funkcí (např. amiodaron).
Podpora reparace plicních funkcí:
– minimalizace tkáňového otoku,
– inhalační betamimetika.
Co dělat jen někdy (co a kdy?)
Optimalizace PEEP.
Kortikoidy (nelepšící se trvající závažná oxygenační dysfunkce za předpokladu adekvátní antiinfekční terapie).
Rescue postupy podle možností oddělení:
– pronační poloha,
– HFVO,
– ECMO,
– surfaktant,
– prevence fibrózy.
Vybrané postupy/otázky – jak se k nim stavět podle EBM?
Existuje reálné klinické riziko plynoucí z použití vysokého FIO2?
Lze preferovat nějaký ventilační režim?
Krystaloidy nebo koloidy pro „fluid challenge“ u ARDS?
Kdy svalová relaxace?
Nepoužíváme speciální ARDS nutrici – non lege artis postup?
ARDS – up to date 2010 („future trends“)
Statiny.
Kmenové buňky.
Hypertonické roztoky NaCl.
Podpora reparace.
Key points v léčbě ARDS
Kontrola infekce/vyvolávajícího inzultu.
Minimalizace otoku plic (pečlivá bilance tekutin, diuretika).
Dostatečně vysoký PEEP.
Udržovat dechové objemy a tlaky „v blízkosti tzv. bezpečných hodnot“.
Nelepšící se ARDS
Mám příčinu ARDS pod kontrolou?
Hledat a odstraňovat „small persisting insults“.
Kortikoidy při nelepšící se oxygenační dysfunkci a nutnosti používat ventilaci s parametry mimo obecně přijímané bezpečné limity (tlak, obejm, FiO2).
7. Chronická obstrukční plicní nemoc v intenzivní péči – up to date 2010
Pařízková R.
Klinika anesteziologie, resuscitace a intenzivní medicíny, Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové, Fakultní nemocnice Hradec Králové
Úvod
Chronická obstrukční plicní nemoc (CHOPN, COPD) je považována za čtvrtou nejčastější příčinu chronické morbidity a mortality v USA. V České republice je četnost onemocnění 8%, úmrtnost činí 10–14/100 000 obyvatel, CHOPN je 3. nejčastější příčinou úmrtí. Častější výskyt je pozorován u mužů, v zemích s vyšším výskytem kouření, ve vyšším věku. Hospitalizační mortalita je 3–4%, u nemocných přijatých na JIP je úmrtnost 24%, v 50 % jsou propuštění nemocní rehospitalizováni do 6 měsíců. Prevence a strategie péče o pacienty s COPD byla vypracována skupinou odborníků s názvem The Global Iniciative for Chronic Obstructive Lung Disease (GOLD)v roce 2004 a posléze upravena v roce 2006 s publikací v roce 2007, k dalším úpravám dosud nedošlo.
Definice
CHOPN je onemocnění charakterizované obstrukcí průtoku vdechované směsi dýchacími cestami, která není plně reverzibilní. Tato obstrukce je obvykle progresivní a je spojená s abnormální zánětlivou odpovědí plic na inhalované škodliviny (pevné částice, plyny).
Klasifikace CHOPN podle závažnosti
podle modifikované klasifikace GOLD v roce 2006 jsou nově rozeznávány 4 stupně poškození plic na základě provedeného funkčního vyšetření plic (podle Kašáka, Praktický lékař 2007) – tabulka 1.
Tabulka 1. Klasifikace CHOPN podle tíže 
FVC – usilovná vitální kapacita, FEV1 – usilovně vydechnutý objem za 1 sekundu, hodnota FEV1 je udávána po bronchodilatacích, NH – náležitá hodnota, PH – plicní hypertenze, CP – cor pulmonale, RI – chronická respirační insuficience Patogeneze
Na patogenezi vzniku CHOPN se podílejí následující faktory:
chronický nespecifický zánět v dýchacích cestách, parenchymu plic a plicním cévním řečišti;
dysbalance v systému proteáz a antiproteáz (vznik emfyzému);
oxidativní stress.
Chronický zánět s aktivací zánětlivých buněk (makrofágy, T lymfocyty – zvláště CD8+, neutrofily), produkcí prozánětlivých mediátorů expresí adhezivních molekul vede v bronších k opakovanému poškození a opětovné reparaci bronchiální stěny s její strukturální remodelací, současně dochází k změnám v plicní vaskulatuře. Zde dochází ke ztluštění cévní stěny prozánětlivými buňkami, ukládání elastických a kolagenních fibril, klesá produkce oxidu dusnatého a rozvíjí se plicní hypertenze.
Ovlivnění plíce-srdce
Nemocní s CHOPN ve většině případů nemají izolované poškození plic, ale téměř vždy je toto onemocnění provázeno kardiálním postižením. Práce Funka (2008) prokazuje levostrannou diastolickou dysfunkci u nemocných se stabilním CHOPN včetně nemocných bez přítomnosti plicní hypertenze, což se dosud nepřepokládalo. Mechanismus změny je mnohočetný, nejvíce se na něm podílí komorová diastolická interdependence mezikomorového septa.
Nemocní s CHOPN mají vyšší výskyt kardiovaskulárních onemocnění včetně koronárního řečiště (prevalence až 36,6 %) (Mapel 2005), což je podmíněno jednak společným rizikovým faktorem kouřením a dále chronickým zánětlivým procesem (CHOPN bývá nazýváno jako chronický systémová zánětlivý syndrom), který se šíří z plicní tkáně do organismu. Právě šíření a udržování chronického zánětu je považováno za hlavní patofyziologický mechanismus častého výskytu obou onemocnění souběžně se stejnými klinickými příznaky. V klinické praxi je tento fakt důležitý a nedoceněný – opakovaně jsou pacienti nesprávně diagnostikováni a léčeni. Kardiologická léčba betablokátory a statiny má zřejmě i protektivní efekt na snížení exacerbace a mortality pacientů s CHOPN (Mancini 2006, van Gestel 2008), kdy statiny snižují systémovou zánětlivou odpověď. Překvapivě i terapie dlouhodobými anticholinergními látkami vede k redukci kardiovaskulární morbidity a mortality, přestože přesný mechanismus tohoto jevu není znám (Celli 2009). Selcuk (2010), prokazuje zhoršený průtok koronárními arteriemi u nemocných s COPD i přes zdánlivý normální angiografický nález.
Každého nemocného s CHOPN je v klinické praxi nutné považovat za pacienta s kardiální dysfunkcí.
Novinky v terapii CHOPN
Při úpravě postupu GOLD skupiny bylo dosaženo v terapii pouze minimálních úprav, nadále jsou sledovány především účinky inhalačních bronchodilatancií na krátkodobý (symptomatologii) a dlouhodobý (mortalita) klinický efekt. Výsledky recentních studií prokazují bezpečnost a účinnost dlouhodobě působících bronchodilatancií, zvláště pak jejich kombinací. Kombinace s inhalačními kortikoidy jsou dnes metodou volby pro aditivní až synergický efekt. Systémové podání kortikoidů není součástí chronické terapie, pouze u nemocných s exacerbací CHOPN je jistě nutné tuto léčbu nasadit po omezenou dobu (7–10 dnů). Prevence rizika infekčních onemocnění je na místě – očkování proti chřipce, nyní i proti pandemickým kmenům je jednoznačně doporučováno.
Časná diagnostika exacerbace z důvodu infekce dýchacích cest je jednou ze zásadních strategií léčby, neboť oddálení podání antibiotik vede ke zvýšení smrtnosti pacientů. Jedním z časných a citlivých markerů je stanovení hladiny prokalcitoninu kvantitativní metodou, kde tzv. cut-off hladina se pohybuje v minimálních hladinách 0,1 μg/l (Daubin 2009). V naší běžné klinické praxi jsou hladiny kolem 0,5 a méně považovány za negativní, řada prací dokazuje, že tyto cut-off hodnoty jsou mnohem nižší.
Nové terapeutické cíle
Farmakologická léčba se v posledních letech zaměřila na ovlivnění symptomatologie a funkční kapacity plic. Dlouhodobě účinná betamimetika (LABA) a muskarinoví antagonisté (LAMA) jsou efektivní bronchodilatans u pacientů s CHOPN. Pokud jsou podávány v kombinaci, jejich účinek na zlepšení funkční kapacity plic je signifikantně vyšší (vanNoord 2005). Tyto poznatky podpořily koncept kombinace LABA/LAMA jako „superbronchodilatátorů“. Jiný přístup představuje duální farmakon, které má obojí účinek v jedné molekule – M-3-agonista a beta-2-agonista (MABA). Cílem je výroba nové molekuly, která bude mít výrazný protizánětlivý efekt s ovlivněním progrese onemocnění. Tento tzv. „nesteroidní protizánětlivý“ přístup je usilovně rozvíjen. Hypotézu podporuje i fakt, že dochází ke zvýšení efektu kombinací inhalačního kortikosteroidu s LABA oproti terapii pouze jednou látkou (Bourbeau 2007).
Obnovení citlivosti na steroidy je potencionálním terapeutickým cílem a zcela novým trendem. Histone deacetyláz-2 (HDAC-2), která je odpovědná za citlivost k glukokortikoidům je u nemocných s CHOPN v dýchacích cestách významně snížená, zvýšením její exprese a aktivity by mohlo dojít k obnovení citlivosti na léčebně podávané kortikoidy.
V experimentu a výzkumu jsou zkoumány další látky, které ovlivňujíc senzitivitu receptorů na kortikoidy a v případě zánětu jsou alterovány.
Další výzkum je i nadále zaměřován na stanovení vlivu zlepšení nutričního stavu nemocných s CHOPN. Kachektiční a malnutričtí nemocní mají horší prognózu, nicméně ovlivnění stavu výživy a tím zlepšení klinického výsledku je sporné, zvláště u nemocných v intenzivní péči. Kachexie zásadně ovlivňuje stav plicních funkcí a vysoká plasmatická hladina prozánětlivých mediátorů koreluje se ztrátou tělesné hmotnosti a progresí kachexie. Recentní práce (Dilektasli 2009) ukazuje na možnost ovlivnění plicních funkcí suplementací esenciálních aminokyselin a zlepšením stavu výživy.
Terapie deprese a anxiety, která se ve vysoké incidenci vyskytuje u nemocných s CHOPN je důležitou součástí managementu, nevede pouze ke zvýšení komfortu nemocného, ale především může zintenzivnit jeho a aktivitu při rehabilitaci, odpojování od ventilátoru apod.
Literatura u autorky.
8. Akutní těžké astma – up to date 2009
Sedlák V.
Plicní klinika FN Hradec Králové, Česká republika
Asthma bronchiale je chronické zánětlivé onemocnění s variabilní obstrukcí dýchacích cest. Období dobré kontroly astmatu mohou být komplikovány epizodami exacerbací, které se projevují postupně se zhoršující dušností, kašlem, pískáním při dýchání a dalšími projevy snížením výdechového proudu vzduchu. Tato zhoršení jsou způsobena nejčastěji respiračními virovými infekty (až u 40 %), nadměrnou expozicí spouštěčům astmatu – alergenům, dále jde o vlivy klimatických změn, emoční stres, znečištění ovzduší, polékové zhoršení astmatu. V dnešní době máme k dispozici široké spektrum efektivních protizánětlivých léků, které až u 95 % pacientů dokáží účinně dosáhnout dobré nebo úplně kontroly astmatu. Akutní astma tvoří jen 1,3 % návštěv na pohotovosti (USA, 2006). Počet úmrtí na astma klesl za posledních 15 let o polovinu, asi 10 % astmatiků přijatých do nemocnice potřebuje intenzivní péči, umělá plicní ventilace je nutná jen u 3–8 % těchto nemocných.
Určité skupiny pacientů mohou trpět častými exacerbacemi nebo exacerbacemi se život ohrožujícím průběhem (téměř smrtelné astma). Jde o nemocné, kteří mají v anamnéze náhlou těžkou exacerbaci, umělou plicní ventilaci pro astma, pobyt na JIP pro astma, četné hospitalizace nebo ošetření na pohotovosti pro astma a pacienty s těžkými formami astmatu.
Akutní těžké astma je stav těžké bronchiální obstrukce s hyperinflací plic. Rizikem respiračního selhání jsou ohroženi pacienti s hypoxií pod 90 %, PaO2 pod 60 mm Hg, PaCO2 nad 45 mm Hg, pacienti, kteří zapojují akcesorní dýchací svaly. Varovnou známkou je pulsus paradoxus, fyzikálně tichý hrudník, ortopnoe, cyanóza a nadměrné pocení, zmatenost, porucha vědomí, hypotenze, bradykardie, PEF pod 60 % náležitých hodnot.
Patofyziologicky při akutním těžkém astmatu dochází následkem bronchospasmu k abnormální distribuci ventilace a perfuze a poruše výměny dýchacích plynů. Snížení výdechového proudu vede k nedostatečnému výdechu vzduchu a k fenoménu hyperinflace plic. Rezervy elastického napětí plic nestačí k výdechu vzduchu přes zúžené dýchací cesty, a proto jsou zapojovány pomocné výdechové svaly, nastupuje únava dechových svalů. Hyperinflace vede ke zhoršené venózní náplni srdce a snížení srdečního výdeje. Laboratorně je kritickým bodem stav, kdy se hypokapnie změní v normokapnii, která je varující známkou hrozícího respiračního selhání.
Cílem léčby je udržení oxygenace, snížení bronchiální obstrukce, snížení otoků dýchacích cest a tvorby hlenových zátek, obecně i podpora ventilace. Ověřené léčebné postupy se opírají o podání kyslíku, krátkodobě-působících beta-2-mimetik, kortikosteroidů, magnézia. Jsou dokumentovány zkušenosti s řadou dalších léků a léčebných postupů s různými výsledky (aminofyllin, ipratropium, adrenalin, inhibitory leukotrienových receptorů, Heliox, neinvazivní a invazivní ventilace).
Zvlhčený kyslík by měl být podáván s cílem dosažení saturace nad 92 % kyslíkovými brýlemi nebo maskou, optimálně lze kombinovat podání kyslíku inhalační maskou, která při průtoku nad 6 l/min umožňuje efektivní nebulizaci bronchodilatancií. Podání 100% kyslíku není doporučováno, jsou důkazy o riziku progrese hyperkapnie a zhoršení PEF.
Metodou volby jsou krátkodobě působící beta-2-mimetika (SABA), které působí do 5 minut od inhalace a efekt trvá 6 hodin (salbutamol). Cesty podání jsou rovnocenně účinné, lze zvolit podání dosovaného aerosolu přes spacer nebo cestou inhalační masky s kyslíkem. Je vhodné začít s podáním dávky 3 vdechů každých 20 minut. Jsou důkazy o vhodné kombinaci s anticholinergikem ipratropium, které poskytuje účinnější bronchodilataci než podání obou léků zvlášť, zejména u akutního astmatu, kde úvodní léčba SABA v monoterapii selhává. Intravenózní podání SABA není u akutního astmatu účinné a není doporučováno. Podání adrenalinu i. v. je vymezeno pouze jako záchrana pro situaci těžkého astmatu s hypotenzí při těžké dynamické hyperinflaci, data o efektivitě a rizicích inhalačního podání nejsou k dispozici.
Kortikosteroidy snižují zánět a tvorbu sekretu v dýchacích cestách a v bronchiální hladké svalovině zvyšují počet beta-2-receptorů a jejich citlivost vůči beta-2-mimetikům. Efekt léčby se však projeví až po 6–12 hodinách od podání. Podle současných důkazů (Cochrane Review) je proto rovnocenné podání těchto léků buď intravenózně, nebo perorálně; některé práce však naznačují rychlejší nástup účinku u i. v. podání u pacientů s těžkými příznaky. Indikací je nezlepšení astmatu po použití SABA. Smysl má podání jen nízkých dávek (40 mg methylprednisolon nebo do 400 mg hydrokortison) 1–2krát denně do doby, než dojde ke zlepšení PEF nad 70 % n. h. Vyšší dávky steroidů vedou ke kumulaci vedlejších účinků, zejména steroidní myopatie, která je problémem u ventilovaných pacientů, zejména v kombinaci s použitím myorelaxancií.
Magnézium i. v. je velmi efektivní léčebný postup u akutního astmatu prostřednictvím inhibice spasmu bronchiální hladké svaloviny. Je popisován inhibiční efekt na uvolnění histaminu a acetylcholinu z mastocytů a nervových zakončení dýchacích cest. Jedna 2gramová i. v. dávka magnézia zlepšuje plicní funkce u akutního těžkého astmatu oproti placebu, nejlepší odezvu mají nejtěžší pacienti. Efekt podání magnézia v nebulizaci dosud nebyl potvrzen.
Heliox (směs hélia a kyslíku) příznivě ovlivňuje dechovou práci, řada menších studií prokazovala pozitivní efekt na zlepšení plicních funkcí u nejtěžších pacientů. Cochrane Review z 9/2009 analýzou 10 studií neprokázala klinicky významný benefit Helioxu pro akutní těžké astma. Britská hrudní společnost jeho použití nedoporučuje, NHLBI umožňuje jedinou indikaci u život ohrožující exacerbace s trvajícími symptomy i po 1 hodině léčby.
Inhibitory leukotrienů byly u akutního těžkého astmatu zkoušeny v i. v. formě, v současnosti není rutinní podávání doporučeno, lék není dostupný v ČR.
Aminofyllin není v poslední době doporučován vůbec. Cochrane Review neprokázala žádný prospěch, naopak je jistý vyšší výskyt nežádoucích účinků léku. Jeho použití není doporučováno jinak než jako ultimum refugium u refrakterních pacientů na umělé plicní ventilaci s nutností monitorování sérové hladiny.
Antibiotika jsou vhodná jen u pacientů s jasnými známkami respiračního infektu s horečkou a purulentní expektorací či velmi silným podezřením na bakteriální meningitidu. Mukolytika také nejsou doporučena, mohou zhoršovat kašel a bronchiální obstrukci. Sedativa a hypnotika jsou kontraindikována.
Neinvazivní ventilační podpora (NIV) není u těžkého astmatu dosud rutinně doporučována pro nedostatek důkazů o benefitu. Je k dispozici jediná randomizovaná studie (Soroksky et. Al. Chest 2003), která prokázala zlepšení plicních funkcí a snížení potřeby přijetí do nemocnice. Meduri (Chest 1996) publikoval práci se 17 pacienty s akutním těžkým astmatem léčených NIV, jen ve 2 případech byla nutná intubace. Problémem NIV u astmatu je riziko zhoršení retence hlenů, obvykle zhoršená schopnost koordinace tachypnoického pacienta s NIV. Poslední analýza Cochrane Rev naznačuje slibné výsledky této léčby do budoucna.
Umělá plicní ventilace je indikována pro pacienty se zhoršeným stavem vědomí, těžkým vyčerpáním nebo zástavou dechu. Je vhodné intubovat semi-elektivně, před zástavou dechu, protože intubace bývá u akutního těžkého astmatu obtížná. Při použití nejčastěji používaných látek k indukci (propofol, thiopental) je nutné pečlivě zvažovat dávku pro potenciální hemodynamické nepříznivé důsledky. Pacienti s akutním těžkým astmatem a respiračním selháním jsou často dehydratovaní, indukce vede ke ztrátě sympatomimetického tonusu, a nízký srdeční výdej při zvýšeném iPEEP může vést k oběhovému selhání. Vhodnou premedikací před intubací tak může být ketamin v dávce 1‑2 mg/kg i. v. během 2 minut, protože má sympatomimetické a bronchodilatační účinky. Použití neuromuskulární blokády může krátkodobě zlepšit mechaniku ventilace, v kombinaci s kortikoidy však může vést k polyneuropatii kriticky nemocných, a proto by měla být svalová relaxace používána co nejkratší dobu.
Ventilační strategie u akutního těžkého astmatu musí respektovat přítomnost dynamické hyperinflace (iPEEP) a rizika barotraumatu. Někteří autoři doporučují po intubaci krátce ventilovat pacienta přes ambuvak 4–5 vdechů za minutu. Tento postup může bránit nárůstu hyperinflace a umožňuje sledovat změnu bronchiálního spasmu po podané léčbě. Cílem umělé plicní ventilace je udržení oxygenace, minimalizace dynamické hyperinflace, vyhnout se barotraumatu a permisivní hyperkapnii. Je vhodné použití menších tlaků a nižší dechové frekvence, lze tolerovat mírnou respirační acidózu. Důležité je poskytnout dostatečný prostor pro výdechu snížením dechové frekvence nebo prodloužením doby výdechu (I : E, 1 : 2). Tlakově řízená ventilace může vést k variabilním dechovým objemům při měnících se odporech dýchacích cest a riziku hypoventilace, proto někteří autoři doporučují objemově řízenou ventilaci. Je nutné pokračovat v podávání beta-2-mimetik do okruhu umělé plicní ventilace a zajistit adekvátní zvlhčení vdechované směsi.
Přestože se v poslední době snižuje počet hospitalizací pro astma, počet přijatých pacientů na jednotky intenzivní péče se v posledních 15 letech výrazněji nezměnil. Z pohledu intenzivisty tedy představuje akutní těžké astma i nadále vážný klinický problém.
9. Význam rehabilitace a její vliv na orgánové funkce u ventilovaných pacientů
Polák J.
KARIM, Hradec Králové
Naše sdělení se zabývá problematikou rehabilitace u pacientů na odděleních intenzivní péče se zaměřením na pacienty s ventilační podporou. Všeobecně se předpokládá, že terapeutická rehabilitace působí preventivně proti poklesu funkční zdatnosti a snižuje mortalitu. O vlivu rehabilitace u kriticky nemocných pacientů je známo poměrně málo a dosud nejsou k dispozici žádné studie vztahu rehabilitace a konečného klinického výsledku pacienta.
Dlouhodobá hospitalizace a především imobilizace způsobuje u všech pacientů, a u kriticky nemocných zvláště, závažné somatické a psychické změny. Jedná se o svalovou slabost, kontraktury, vznik dekubitů a osteoporózy, riziko plicních a močových infekcí atd. Na druhé straně tito pacienti trpí depresí, úzkostí, apatií apod.
Mezi prostředky léčebné rehabilitace patří polohování, dechová gymnastika, pasivní a aktivní cvičení, měkké a mobilizační techniky, stimulační metody, termoterapie, elektrostimulace a další.
Na našem oddělení máme k dispozici přístroj motoped umožňující jak aktivní, tak i pasivní cvičení ventilovaného pacienta s různou intenzitou zátěže. Cílem začínající studie je posoudit vliv této zátěže na orgánové funkce pacientů a v delším horizontu i na jejich konečný klinický stav. Konkrétní výsledky studie budeme schopni posoudit až s určitým časovým odstupem.
10. Praktické poznámky k pronační poloze (kdy, komu a jak)
Stibor B., Schwameis F.
JIP, Landesklinikum Baden, Baden bei Wien, Rakousko
Pronační poloha zlepšuje ventilaci dorzálních (do té doby) dependentních plicních partií, zvyšuje homogenizaci plicní tkáně, zmenšuje ventilačně-perfuzní nepoměr a tím prokazatelně zlepšuje oxygenaci pacienta. I když doposud nebyl jednoznačně prokázán pokles mortality, jde o jednoduchou, účinnou a levnou metodu, která u 60–80 % pacientů se závažnou formou akutního respiračního selhání během velmi krátké doby po uvedení do polohy na břiše výrazně zvyšuje hodnoty PaO2, případně normalizuje i hodnoty pH. To následně umožní snížit agresivitu ventilačního režimu, zejména špičkových tlaků a inspirační frakci kyslíku, někdy i o desítky procent během několika hodin od uvedení pacienta do polohy na břiše.
O pronační poloze je vhodné uvažovat tehdy, pokud i přes dodržení zásad protektivní plicní ventilace (ventilace nízkými objemy cca 6 ml/kg ideální tělesné hmotnosti, vyššími hodnotami PEEP) je nutné pro zajištění oxygenace použít FiO2 0,60 a vyšší. Přítomnost atelektatických areálů v dorzálních plicních partiích na CT hrudníku predikuje pozitivní přínos pronační polohy u těchto pacientů. Podle názorů autorů při vyšších hodnotách FiO2 a vysokých inspiračních tlacích již výhody z pronační polohy převažují nad jejími riziky.
Předpokladem pro úspěšné zvládnutí pronace je zkušený a zaškolený ošetřovatelský tým. Samotné otočení pacientů do pronace je poté poměrně jednoduché. Elegantní variantou úplné polohy na břiše (180°) je tzv. přetočená poloha na boku (135°). Provádí se snadněji, je při ní zachován přístup k dutině ústní i např. možnost kontroly stavu zornic.
Na pracovišti autorů ji provádějí standardně tři střední zdravotničtí pracovníci, u subtilních pacientů někdy stačí dva, naopak u pacientů s nadváhou je třeba čtyř. Na základě mnohaletých zkušeností je během otáčení sice vyžadována přítomnost lékaře na JIP, ale nikoliv jeho bezprostřední spoluúčast. Celkově tato procedura zabere přibližně 15 minut. Během posledních 5 let nedošlo ani jednou k arteficiální extubaci pacienta, jednou došlo k nechtěnému vytažení arteriální linky. Ročně je pronační poloha použita asi u 20–25 pacientů.
Je třeba zajistit dostatečnou délku, eventuálně prodloužení infuzních linek, umístění ventilátoru tak, aby byla dostatečná délka hadic dýchacího okruhu. Je důležité dbát na dekompresi břišní oblasti pomocí polštářů kvůli zajištění dostatečného prostoru pro exkurze břišní stěny při inspiriu. Zvláštní pozornost je třeba věnovat poloze hlavy a zabránit jakémukoliv tlaku na oči. Pravidelně dochází hydrostatickým tlakem k edémům očních víček a obličejových partií, které v supinní poloze opět rychle odezní. V pronační poloze je většinou třeba prohloubit analgosedaci. Pokud je pacient před pronační polohou plně enterálně živen, snižujeme po přetočení preventivně množství výživy na cca 25 ml/hod. Při dobré toleranci zvyšujeme množství enterální výživy během 24–48 hodin na původní množství. Při intoleranci přecházíme na kombinovanou či plně parenterální výživu. Podávání prokinetik je standardem.
Mnohokrát se v různých studiích diskutovalo o optimálním časovém protokolu provádění pronace. V denní klinické praxi je však většinou nutno (vzhledem k potřebě přítomnosti více osob během otáčení) rytmus pronace přizpůsobit chodu konkrétního oddělení. Kriticky nemocné, u nichž dochází k výraznému zlepšení oxygenace, ponecháváme v pronaci přibližně 12 hodin, poté jsou přetočeni na záda, provedena rutinní toaleta, eventuálně zavedení nových invazivních vstupů, a poté znovu uvedeni do polohy na břiše. Tento rytmus znamená, že přibližně 20–22 hodin denně je pacient v pronační poloze. Pacienty nonrespondenty, kteří ani po 24 hodinách z pronační polohy neprofitují, vracíme a nadále ponecháváme v poloze na zádech. Pronační polohu ukončujeme při postupném zlepšování plicních funkcí. V průměru je pronace u jednotlivého pacienta používána po dobu 7–9 dnů.
Vedlejším pozitivním efektem – kromě vlivu na oxygenaci – je tzv. drenážní poloha plic. Pravidelně v poloze na břiše dochází k mobilizaci sekretu z plicní tkáně a dýchacích cest, které jsou následně odsáty buď necíleně, nebo bronchoskopicky. Bronchofibroskopie v pronaci je překvapivě snadná, orientace neztížená, pouze sekret je díky gravitaci lokalizován na protilehlých stěnách dýchacích cest, než je obvyklé.
Taktéž provádění kontinuálních renálních eliminačních technik bývá málokdy spojeno s obtížemi v poloze na břiše. Pokud se tak stane, tak podle odhadu autorů spíše při zavedení dialyzační kanyly ve v. subclavia než ve v. jugularis. Sám úmysl použít pronaci však není apriori důvodem ke změně cévního vstupu. Poloha na břiše je kompatibilní i s dalšími lékařskými či ošetřovatelskými technikami jako např. vakuovým odsáváním ran (V.A.C. systém) nebo mimotělní CO2 eliminací (interventional lung assist, iLA).
Závěrem se dá říci, že pronační poloha je účinná metoda vedoucí k výraznému zlepšení oxygenace. Její provádění zaškoleným a zkušeným týmem je rutinní, bezpečné a spojené s minimálním rizikem komplikací.
11. TRALI u ventilovaného pacienta na JIP – výskyt, hemovigilance a diagnostika
Herold I.
ARO, Oblastní nemocnice Mladá Boleslav
Hemoterapie na JIP jako rizikový faktor: Krevní deriváty byly v posledních velkých observačních studií v USA a Evropě (ABC, CRIT, SOAP) použity u 33–49 % pacientů léčených na JIP. V CRIT studii z USA (2000–2001) pozorovali autoři u transfundovaných pacientů vyšší mortalitu, vysvětlovanou mimo jiné i použitím nedeleukotizované krve. Restriktivní přístup k indikaci hemoterapie erytrocytárními koncentráty (RBC) s indikačním prahem < 70 g/l vedl v kanadské prospektivní TRICC studii k poklesu mortality a snížení výskytu respiračních komplikací (plicní edém, ARDS). V evropské prevalenční studii SOAP (2003), jíž se účastnila i řada našich pracovišť, bylo podání krevních derivátů (33 % RBC, 6,5 % FFP a 1,5 %) naopak provázeno snížením kumulativního rizika. Pracoviště v západní Evropě používala tehdy již převážně deleukotizovanou krev.
Hemovigilance a nová rizika krevních derivátů: Hemovigilanční sledování z USA, UK, skandinávských zemí a dalších států ukazují od konce 90. let pokles tradičních komplikací provázejících krevní převody (infekční komplikace, hemolytické reakce, administrativní chyby) a vzestup výskytu potransfuzního ALI (TRALI). Kumulativní výskyt TRALI v britském SHOT hemovigilančním programu (Serious Hazards Of Transfusion) uvádí v období let 1996–2008 236 případů TRALI z 5374 hlášení (4,4 %). Obdobné počty v přepočtu na počet obyvatel uvádějí i skandinávské země. Definice TRALI byla přijata v roce 2005. Hlášení TRALI v ČR pro ÚZIS jsou zahrnuta v ročních výkazech oboru hematologie a krevní transfuze. Dosud jsou u nás hlášeny pouze ojedinělé případy.
TRALI – definice, mechanismy vzniku: V prospektivní studii sledoval Popovsky na Mayo Clinic v roce 1965 výskyt respiračních komplikací po krevních převodech u 31 pacientů. Označil je jako TRALI a odhadl výskyt na 1 : 5000. Ve většině případů zjistil přítomnost antileukocytárních nebo antilymfocytárních protilátek v krvi dárce/dárkyň. Symptomatologie byla často chudá a považována za projev základního onemocnění nebo hemolýzy. Upozornil prvně na „under reporting“. Gajic z Mayo Clinic (2004) sledoval rizikové faktory u ventilovaných pacientů na JIP asociované s nově vzniklým ALI až během UPV. Podání krevních derivátů patřilo mezi hlavní rizikové faktory (OR 3,11) vzniku ALI. Definice TRALI je výsledkem konsenzuálního panelu NHBLI (2005). Zahrnuje standardní kritéria ALI/ARDS podle AECC, časový limit vzniku komplikace po podání krevního derivátu (do 6 hod) a vyloučení jiného běžného spouštěcího faktoru ALI. Pro situace, kdy nelze vyloučit vliv přidružených faktorů, doporučil panel používat pojem „possible” TRALI. Ten se spolu s „probable“ TRALI objevuje v posledních hemovigilančních hlášeních z UK. V ČR jsou počty hlášení stále velmi nízké (zcela ojedinělé) a neodpovídají realitě a „under-reporting“ spíše potvrzují.
Klinická symptomatologie u méně závažných stavů (u neventilovaných pacientů) zahrnuje v souvislosti s podáním krevního derivátu náhlý vznik dušnosti a plicního edému. Bývá provázena vzestupem teploty o 1–2 oC. Mortalita je nízká (6–10%). Mechanismus vzniku ALI je převážně imunogenní s aktivací komplementu (nejčastěji antileukocytárními protilátkami v krevním derivátu dárce), ale existují i neimunogenní mechanismy (lipidovými produkty – lipofosfatidylcholinem ve starších konzervách) a priming leukocytů (např. hypoxií, sepsí) podle Gattinoniho „second hit“ teorie. TRALI vyvolané imunogenním mechanismem častěji vyžadují UPV a mívají vyšší mortalitu. V 90 % imunogenních TRALI jde o reakci vyvolanou anti-HLA I, HLA II, HNA, IgA protilátkami, v 10 % je reakce vyvolána přítomností protilátek v krvi příjemce. Většina prací ukázala na souvislost TRALI s výskytem anti-HLA protilátek v krvi dárkyň, které mají za sebou graviditu (hladina stoupá s počtem gravidit) a jde o důsledek fetální imunizace. TRALI může vyvolat jakýkoliv krevní derivát, ale za rizikové jsou podle SHOT považovány především FFP a trombokoncentráty (riziko 1 ku 58 000 až 1 ku 63 000). U produktů s nižším obsahem plasmy, jako jsou kryoprecipitát nebo erytrocytární masa (RBC), je incidence řádově nižší (1 : 300 000 až 1 : 523 000).
Diferenciální diagnostika: TRALI se odlišuje od klasického ALI/ARDS přechodným charakterem hypoxémie (48 až 96 hod); perzistence infiltrátů delší > 7 dnů bývá méně častá (20 %) a mortalita TRALI je nižší (5–10%). Pouze u 70 % pacientů s TRALI je nutná UPV. Definice nezahrnuje stavy, kdy již před transfuzí byla splněna kritéria ALI a transfuze vedla k dalšímu zhoršení stavu. Časové 6hodinové okno je dostatečné, protože jen 9 % případů s TRALI se projeví až mezi 6.–24. hod.
TACO (Transfusion Associated Circulatory Overload), s nímž lze TRALI zaměnit, je uváděn v < 1 % hemovigilančních hlášeních. Vyskytuje se až u 10 % seniorů po náhradách velkých kloubů. Klinické známky oběhového přetížení bývají přítomny již dříve a podání transfuze pouze vyvolá manifestní plicní edém. Rychlé podání diuretik vede ke snížení cirkulujícího objemu a zlepšení klinického stavu. U pacientu se zhoršenou výkonností kardiovaskulárního systému je vhodná pomalejší rychlost transfuze (1 ml/kg/hod) a preventivní podání diuretik.
Léčba a prevence TRALI: Léčbou TRALI je oxygenoterapie a jen 72 % pacientů vyžaduje UPV. Prevencí vzniku je přísná indikace podání krevních derivátů a zlepšení jejich kvality. Vyřazení žen po proběhlém těhotenství z programu na zpracování krve pro plasmu zavedla řada zemí západní Evropy. Vedlo to k podstatnému snížení výskytu TRALI. Americká asociace krevních bank doporučila tento postup zavést od listopadu roku 2008. Další možností je screening protilátek – oba postupy ale vedou ke snížení množství dostupné plasmy. V Norsku byl zaveden systém ošetření plasmy detergenčním solvens, jenž eliminovalo TRALI. Do přístupu jednotlivých zemí k tomuto problému se promítají bohužel i komerční hlediska, neboť velkým zpracovatelům jde především o udržení velkého dárcovského poolu. Přísná kritéria definice TRALI spolu s administrativními barierami jsou příčinou falešně nízkého počtů hlášení; vedou k celkové ignoranci závažného medicínského problému. Anesteziologové a intenzivisté by měli na možnost TRALI myslet i u ventilovaných pacientů při zhoršení respiračních symptomů po podání krve a hlásit i podezření na TRALI.
12. Hemodynamické monitorování ventilovaného pacienta
Stibor B., Schwameis F.
JIP, Landesklinikum Baden, Baden bei Wien, Rakousko
Dosažení intravazální normovolémie a hemodynamické stability je nezbytným předpokladem pro adekvátní zásobení tkání kyslíkem a tím úspěšné léčby kritických stavů. Fyzikální vyšetření ventilovaného pacienta a posouzení parametrů jako je teplota, barva či turgor kůže, diuréza či kapilární návrat, tvoří sice základ každého zhodnocení klinického stavu, ale samo o sobě neposkytuje dostatečné informace o stavu jeho makrocirkulace. Klinické symptomy hypovolémie, jako je hypotenze či kompenzační tachykardie, nastupují teprve při ztrátách intravaskulárního objemu převyšujících 20 %. Navíc parametry jako tepová frekvence či krevní tlak jsou významně ovlivněny různými medikamenty, a proto je jejich výpovědní hodnota o stavu kardiovaskulárního aparátu omezená. Opakovaně bylo prokázáno, že adekvátní tekutinová terapie spolu s inotropní, vazopresorickou či vazodilatační léčbou snižuje mortalitu pacientů v kritickém stavu. Pro tuto cílenou terapii je nezbytné rozšířené hemodynamické monitorování, jež je adekvátní klinickému stavu pacienta.
Přesto v současné době neexistuje jednoznačný konsenzus o způsobu a rozsahu hemodynamického monitorování kriticky nemocných. K dispozici je několik metod, které se liší svým principem, invazivitou, spolehlivostí, výpovědní hodnotou, náročností na personál i finančními náklady. Některé metody svými změřenými či kalkulovanými parametry vypovídají i o stavu plicních funkcí. U pacientů na umělé plicní ventilaci je stav hemodynamiky ovlivňován, většinou negativně, i změnami tlakových poměrů uvnitř hrudníku.
V klinické praxi často používané intravazálně změřené tlakové hodnoty, jako je CVP, MAD či PAOP, poměrně špatně korelují s plnicími objemy srdečních oddílů a jejich použití pro hodnocení stavu náplně krevního řečiště či k řízení volumoterapie je problematické. Podle nových poznatků umožňuje měření volumometrických parametrů, jako je intratorakální krevní objem (ITBI), globální enddiastolický objem (GEDV), enddiastolický objem pravé komory (RVEDV) a dalších, lepší predikci hemodynamického stavu pacienta a hodí se více k cílené volumoterapii. Takzvané statické parametry mohou zpětně monitorovat, zda pacient na objemovou terapii reagoval zvýšením preoladu či nikoliv. V klinické praxi je však třeba předpovědět, jestli by pacient na podané tekutiny reagoval pozitivně (respondenti) či nikoliv (nonrespondenti); tzn. zda-li může být zvýšením srdeční náplně (preloadu) a tím zvýšeného enddiastolického napětí srdečních vláken dosaženo zvýšení srdečního výdeje ve smyslu Frank-Starlingova mechanismu – princip „fluid responsiveness“. To je závislé samozřejmě i na tom, ve které části Frank-Starlingovy křivky se vlákna nacházejí a na stavu srdeční funkce (normální vs snížená kontraktilita). V tomto kontextu stále více získává na významu monitorování dynamických parametrů, jako je stroke volume variation (SVV) a pulse pressure variation (PPV), které dokáží predikovat potřebu volumoterapie, inotropik či vazopresorů. Obecně hodnoty variací nad 10 % svědčí o hypovolémii a pravděpodobné pozitivní reakci na zvýšenou volumoterapii. Je nutno zdůraznit, že validní hodnoty získáme pouze za splnění dvou podmínek: řízené ventilace pacienta a pravidelného, nejlépe sinusového rytmu. Hodnoty SVV a PPV naopak nejsou vhodné k monitorování hypervolémie. Optimální je monitorování jak statických, tak i dynamických parametrů předtížení. Rozšíření monitorování o hodnoty saturace smíšené žilní krve (SvO2) či saturace v horní duté žíle (ScvO2) informují o nabídce a spotřebě kyslíku.
Swan-Ganzův plicnicový katetr (PAC) představuje klasické invazivní monitorévání, které bylo několik desetiletí používáno za zlatý standard. O jeho postavení v rámci současného hemodynamického monitorování se neustále diskutuje. Předností je exaktní měření intrakardiálních tlaků a také tlaků v a. pulmonalis. Mezi nevýhody patří zejména invazivita, riziko katétrové infekce, trombózy, arytmií a poškození srdce či plicní tkáně a v neposlední řadě i finanční náklady, což vedlo např. v USA k redukci používání o 65 %. V kardiochirurgii se přesto stále ještě jedná o nejčastěji používaný způsob monitorování.
Méně invazivní metody měření srdečního výdeje využívají nejčastěji metodu pulse countour analýzy, tedy analýzy plochy pod křivkou arteriálního krevního tlaku (systémy PiCCO, LiDCO, Vigileo). První dva jmenované systémy pro zvýšení přesnosti měření provádějí i transpulmonální kalibraci – ať už pomocí termodiluce (PiCCO), nebo lithia jako dilučního indikátoru (LiDCO). Na pracovišti autorů je nejvíce využíván systém PiCCO (pulse contour continuous cardiac output, PULSION Medical Systems). Mezi hlavní výhody patří – kromě kontinuálního měření srdečního výdeje – i stanovení parametrů preloadu (GEDV, ITBI) a predikce odpovědi na volumoterapii (SVV, PPV). Velkou předností je nejen možnost měření extravaskulární plicní vody (ELWI), ale i možnost rozlišení původu jejího zvýšení pomocí indexu plicní vaskulární permeability (PVPI), kdy hodnoty 1,0–3,0 svědčí pro hypervolémii či kardiální plicní edém; hodnoty nad 3,0 svědčí pro zánětlivé postižení plic. Tyto hodnoty vykazují překvapivě velmi dobrou korelaci s klinickým stavem pacienta. Ve vztahu hemodynamického sledování a umělé plicní ventilace je třeba zdůraznit i ovlivnění hodnot SVV a PPV. Při ventilaci většími dechovými objemy je SVV signifikantně vyšší než při použití normálních či nižších dechových objemů. PICCO systém je nejstarší a nejlépe validovaný systém využívající pulse countour analýzu ke stanovení srdečního výdeje a vykazuje velmi dobrou korelaci s hodnotami získanými promocí PAC.
Systém LiDCOTM používá jako diluční indikátor lithium, sloužící k intermitentní kalibraci systému a následně kontinuálně hodnotí srdeční výdej z plochy pod křivkou. Mezi nevýhody patří nutnost intravenózní aplikace lithia, naopak nepotřebuje speciální arteriální kanylu. Nová verze LiDCOTMrapid nevyžaduje kalibraci a srdeční výdej hodnotí z analýzy arteriální křivky a srovnání s databází několika desítek tisíc měření.
Na podobném principu pracuje i systém Vigileo, jenž nepotřebuje zavedení centrálního žilního katétru. Měření je však při chybějící transpulmonální kalibraci ovlivněno artefakty arteriální křivky i poruchami srdečního rytmu. Navíc první softwarové verze (1 a 2) vykazovaly málo validní výsledky. Možnost stanovení EVLW či PVPI zde chybí.
Existují i další metody hemodynamického monitorování, které však nejsou příliš rozšířené, respektive jejich přesnost nebyla prokázána dostatečně průkaznými studiemi. Ultrasonografické vyšetření je bed-side metoda, vyžaduje však kvalifikovaný personál a je zatížena subjektivní chybou vyšetřujícího. Použití bioimpedance také čeká na svoje definitivní zařazení do spektra možných metod.
Většina pacientů v kritickém stavu na umělé plicní ventilaci vyžaduje pro správnou léčbu adekvátní hemodynamické monitorování. Důležitý je však nejen výběr metody, ale i správná interpretace získaných výsledků, vždy s přihlédnutím k obrazu získanému klinickým vyšetřením pacienta.
13. Terminální weaning
Pařízková R.
Klinika anesteziologie, resuscitace a intenzivní medicíny, Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové, Fakultní nemocnice Hradec Králové, Česká republika
Každý pacient má právo na náležitou úroveň odborné zdravotní péče v souladu se aktuálně dostupnými poznatky lékařské vědy. Současné možnosti resuscitační péče jsou schopny zabezpečit přežití a návrat do života nemocným s reverzibilním selháním orgánových funkcí. Všeobecně přijatým cílem intenzivní péče je vždy zachování života a zdraví pacienta, tzn. odstranění příčiny, jež způsobuje zhoršení zdravotního stavu a poskytování postupů orgánové podpory či náhrady u nemocných se zvratným (nebo předpokládaným zvratným) orgánovým selháním, tj. snaha „udržovat život, ale nikoliv prodlužovat umírání“. V případě, kdy nelze tyto cíle naplnit, je nutné poskytnout pacientovi péči, která vyloučí bolest, diskomfort a strádání, umožní zachování lidské důstojnosti a uspokojování fyzických, psychických, sociálních a duchovních potřeb. Cílem ukončení umělé plicní ventilace jako marné a neúčelné léčby není v žádném případě urychlení procesu umírání, ale vysazení té součásti terapie, která nemá své medicínské odůvodnění a kdy útrapy, stres, bolest, diskomfort a strádání spojené s pokračováním ventilační podpory nejsou vyváženy jejím přínosem z hlediska ovlivnění jednoznačně nepříznivé prognózy u nemocného s ireverzibilně narušenou integritou orgánových funkcí, u umírajícího nemocného.
Terminologie
Terminální weaning (terminální odpojování od ventilátoru) – stupňovité snižování ventilační podpory různého rozsahu a různé rychlosti. V literatuře jsou uváděny v souvislosti s pojmem terminal weaning dva odlišné pojmy: terminální odpojování (stupňovité snižování ventilační podpory při ponechání arteficiálního zajištění dýchacích cest) a tzv. terminální extubace, která je považována řadou autorů za extrémní podobu ukončování umělé plicní ventilace.
Paliativní léčba – léčba, jejímž cílem je zabránění bolesti, strádání či diskomfortu nevyléčitelně nemocného, umírajícího pacienta.
Marná a neúčelná léčba – léčba, která nevede k záchraně života, uchování zdraví či udržení kvality života. Marná a neúčelná léčba není v zájmu pacienta, nemůže mu pomoci a zatěžuje jej zbytečným strádáním či rizikem komplikací.
Nezahajování léčby – léčebný postup, který nemůže zastavit postup choroby, navrátit zdraví nebo odvrátit smrt pacienta, není indikován, a není proto zahajován. Takový postup by byl léčbou marnou či neúčelnou. Nepřijetí pacienta v konečné fázi jeho onemocnění na pracoviště intenzivní medicíny, kdy již nelze zastavit postup choroby, navrátit zdraví či odvrátit smrt patří mezi opatření nezahajování léčby.
Nepokračování léčby – při nemožnosti zastavit postup choroby, navrátit zdraví nebo odvrátit smrt není ve stávající marné a neúčelné léčbě pokračováno a tato je ukončena (např. vysazení farmakologické podpory oběhu, ukončení hemodialýzy, ukončení ventilační podpory).
Základní východiska
Jakékoliv rozhodování v průběhu poskytované zdravotní péče musí být v souladu s existujícími právními předpisy a musí být založeno na odborném a kvalifikovaném posouzení zdravotního stavu pacienta, musí bezvýhradně respektovat základní etické principy medicíny.
Jakýkoliv léčebný postup, kde není odůvodněný předpoklad, že bude mít příznivý účinek na zdravotní stav pacienta, nebo povede k záchraně života, a kde rizika komplikací, bolesti, diskomfortu a strádání převažují nad reálným klinickým přínosem zvoleného postupu, je nutno považovat za léčbu, která není „ku prospěchu a v nejlepším zájmu pacienta“ a lze ji označit za tzv. marnou a neúčelnou léčbu.
Terminální weaning je součástí postupů orgánové podpory stejně jako podpora oběhu katecholaminy, eliminační techniky apod.
Nezahájení nebo nepokračování marné a neúčelné léčby u pacientů v terminálním stadiu neléčitelného onemocnění a/nebo s ireverzibilní poruchou integrity orgánových funkcí, kteří nereagují na použité léčebné postupy, je v souladu s etickými principy medicíny a existujícími právními předpisy České republiky.
Přes výše uvedená východiska je rozhodnutí o ukončování ventilační podpory pro některé lékaře (na rozdíl např. od ukončení podávání katecholaminů či jiných postupů orgánové podpory u umírajících nemocných) považováno za jeden z nejvíce stresujících momentů v péči o nemocné v terminálních stavech a je obtížně přijatelné. Vždy je nutný přísný, pečlivý a individuální přístup se zohledněním všech medicínských aspektů zdravotního stavu nemocného.
Doporučení pro praxi
V klinické praxi neznamená postup nepokračování ventilační podpory nutnou součást marné a neúčelné léčby, ventilační podpora není součástí paliativní léčby.
Doporučení pro klinickou praxi:
Indikace pokračování/nepokračování ventilační podpory, rozhodnutí (zodpovědnost).
Vždy přítomnost lékaře (indikace, stanovení postupu, cílů péče/léčby, monitorování).
Udržení volných dýchacích cest.
Kontrola sekrece, zvlhčování.
Nutnost oxygenoterapie?
Monitorování s cílem detekce projevů eventuálního diskomfortu (TF, EKG, skórovací schémata).
Absence pocitu dušnosti, diskomfortu a bolesti, pocitu žízně, hladu.
Připravenost zdravotnického personálu a rodiny na eventuální změny fyziologických funkcí.
Záznam v dokumentaci.
Zajištění péče v tichém prostředí, důraz na zachování lidské důstojnosti, přítomnost rodiny a blízkých.
Zajištění klidu a soukromí, minimální rušení zdravotnickým personálem.
Úprava alarmů (akustické alarmy!).
Stanovení vlastního postupu terminálního weaningu (FiO2, PEEP, DF, podpora dechového objemu).
Odpojení od ventilátoru, extubace? (nejinvazivnější způsob).
Literatura u autorky.
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článek Chladná hlava nad zlatoČlánek Trombocyty v sepsiČlánek Zápis z jednání výboru ČSIMČlánek JMENNÝ REJSTŘÍKČlánek VĚCNÝ REJSTŘÍKČlánek Výborová schůze ČSARIM
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2010 Číslo 6- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
-
Všetky články tohto čísla
- Chladná hlava nad zlato
- Srovnání spokojenosti pacientů po celkové a regionální anestezii u operačních náhrad kyčelních a kolenních kloubů
- Nemocniční používání terapeutické mírné hypotermie u pacientů přežívajících po srdeční zástavě – nárůst v České republice (PRE-COOL 2: Hospital Survey 2008)
- Katétrová vysokofrekvenčná ventilácia pľúc pri tracheostómii podľa Fantoniho
- Dynamika neurofilamenta pNF-H jako prediktor mortality u dětí s poraněním mozku
- Septický šok při fatálně probíhající stafylokokové pneumonii: význam Pantonova-Valentinova leukocidinu – kazuistika
- Trombocyty v sepsi
- 6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
- In memoriam doc. MUDr. Václav Trávníček, CSc. (1924–2010)
- Statistika oboru anesteziologie a resuscitace
- Výborová schůze ČSARIM
- Seznam akcí pořádaných v roce 2010 společností ČSARIM nebo pod její záštitou
- Zápis z jednání výboru ČSIM
- Česká resuscitační rada – nová organizace založena s podporou ČSARIM a ČSIM
- JMENNÝ REJSTŘÍK
- VĚCNÝ REJSTŘÍK
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Septický šok při fatálně probíhající stafylokokové pneumonii: význam Pantonova-Valentinova leukocidinu – kazuistika
- Srovnání spokojenosti pacientů po celkové a regionální anestezii u operačních náhrad kyčelních a kolenních kloubů
- Trombocyty v sepsi
- Katétrová vysokofrekvenčná ventilácia pľúc pri tracheostómii podľa Fantoniho
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy