-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Současné postupy v porodnické anestezii I. – peroperační péče u císařského řezu
Current Practice in obstetric anaesthesia I. – peri-operative care in Caesarean Section
The aim of the following series of articles about Caesarean Section is to provide a contemporary view of the most important procedures in anaesthesia for Caesarean Section and to open up some as yet possibly controversial topics. This review is based mainly on the current literature and summarizes the consensus views of Expert Group for Obstetric Anaesthesia and Analgesia (ESPA), who work as an expert committee of ČSARIM. One of the main ESPA’s goals is the presentation and moderation of current topics in obstetric anaesthesia in Anesteziologie & intenzivní medicína, the most read medical Czech journal of our specialty. The first step then is this four-part series „Current practice in obstetric anaesthesia“ with the objective to summarize current trends, and also to comment and ‘translate’ the contents to the Czech hospital environment and practice. In this first part the topics of choice are anaesthesia for Caesarean delivery, oxygen therapy, thrombo-prophylaxis, hypotension, severe hypertension and administration of oxytocin.
Keywords:
Caesarean section – anaesthetic care – choice of anaesthesia – oxygen therapy – hypertension – hypotension – thrombo-embolic prophylaxis – oxytocin administration
Autoři: Bláha Jan 1,2; Nosková Pavlína 1,2; Klozová Radka 1,3; Seidlová Dagmar 1,4; Štourač Petr 1,5; Pařízek Antonín 6
Působiště autorů: Expertní skupina porodnické anestezie a analgezie ČSARIM 1; Klinika anesteziologie, resuscitace a intenzivní medicíny, 1. lékařská fakulta Univerzity Karlovy v Praze a Všeobecná fakultní nemocnice v Praze 2; Klinika anesteziologie a resuscitace, 2. lékařská fakulta Univerzity Karlovy v Praze a Fakultní nemocnice v Motole 3; II. anesteziologicko-resuscitační oddělení Fakultní nemocnice Brno 4; Klinika anesteziologie, resuscitace a intenzivní medicíny, Lékařská fakulta Masarykovy univerzity a Fakultní nemocnice Brno 5; Gynekologicko-porodnická klinika, 1. lékařská fakulta Univerzity Karlovy v Praze a Všeobecná fakultní nemocnice v Praze 6
Vyšlo v časopise: Anest. intenziv. Med., 24, 2013, č. 2, s. 91-101
Kategorie: Postgraduální vzdělávání
Souhrn
Cílem následující série článků o císařském řezu je zprostředkovat současný pohled na nejdůležitější anesteziologické postupy u císařského řezu a otevřít některá, zatím možná kontroverzní témata. Tento pohled vychází jak ze současné odborné literatury, tak ale především shrnuje i konsenzuální názory Expertní skupiny porodnické anestezie a analgezie (ESPAA), která pracuje jako odborná komise výboru ČSARIM. ESPAA si jako jeden z hlavních cílů dala právě prezentování a moderování aktuálních témat porodnické anestezie v Anesteziologii & intenzivní medicíně, v současnosti nerozšířenějšího českého odborného média našeho oboru. Prvním krokem je pak čtyřdílný seriál „Současné postupy v porodnické anestezii“ se snahou nejen shrnout aktuální trendy, ale i s komentářem a přesahem do českého nemocničního prostředí a praxe. V této první části jsou diskutovány otázky volby anestezie k císařskému řezu, oxygenoterapie, tromboprofylaxe, hypotenze, závažné hypertenze a podávání oxytocinu.
Klíčová slova:
císařský řez – anesteziologická péče – volba anestezie – oxygenoterapie – hypertenze – hypotenze – profylaxe trombembolie – aplikace oxytocinuÚVOD
Anesteziology i porodníky je císařský řez (SC) v dnešní klinické praxi považován za zcela rutinní operační výkon. Přesto, anebo možná právě proto, jsou ale některé běžně používané postupy již spíše zdůvodněny historickými mýty než současnou evidencí. Už vlastní název této operace – císařský řez – je většinou mylně dáván do souvislosti s římským imperátorem Juliem Caesarem, který se přitom prokazatelně abdominálně nenarodil. Původ názvu je totiž v latinském slově caedo, caedere, tj. řezat, přičemž děti takto narozené byly nazývány caesones [1]. Cílem této série článků o císařském řezu je zprostředkovat současný pohled na nejdůležitější anesteziologické postupy u císařského řezu, i otevřít některá, zatím možná kontroverzní témata. Tento v textu vyjádřený pohled vychází jak ze současné odborné literatury, tak ale shrnuje i konsenzuální názory a zkušenosti Expertní skupiny pro porodnickou anestezii a analgezii (ESPAA), kterou autoři v roce 2011 pod záštitou ČSARIM zformovali.
VOLBA ANESTEZIE
Nepočítáme-li nekonvenční či nouzové anesteziologické metody, jako je hypnóza, akupunktura či lokální infiltrační anestezie, přichází v úvahu buď celková anestezie (CA), nebo některý ze způsobů regionální (v tomto případě neuroaxiální) anestezie (RA) – epidurální (EDA), spinální (sub-arachnoidální, SAB) či kombinovaná spinální-epidurální (CSE). Celosvětovým trendem je vzestup neuroaxiálních technik. Data z projektu OBAAMA 2011 (OBstetric Anaesthesia and Analgesia Month Attributes) ukazují, že i v České republice tvoří neuroaxiální blokáda více než polovinu všech anestezií u SC, z toho ve třech čtvrtinách byla podána spinální anestezie [2, 3]. Důvodem je nejen zkvalitnění neuroaxiálních technik jako takových, ale současně i jejich rozšíření do dříve dominantních indikací celkové anestezie, jako jsou placenta praevia, těžká preeklampsie apod. [4, 5]. Obecně je tak dnes široce akceptován názor, že neuroaxiální metody mají mít v porodnictví pokud možno vždy přednost před celkovou anestezií. Otázkou však je proč. Tradiční zdůvodnění, totiž vysoké riziko celkové anestezie pro adaptaci novorozence či bezpečnost matky, není dnes již zcela přesné.
Z hlediska matky bývá riziko celkové ve srovnání s neuroaxiální anestezií u císařského řezu historicky spojováno především s vyšší mortalitou, a to díky vyššímu riziku neúspěšné intubace s nezajištěním dýchání či aspirací během úvodu do celkové anestezie [6–9]. To ale v posledních letech zcela neplatí. Jestliže na počátku 90. let minulého století byla mateřská mortalita spojená s celkovou anestezií u císařského řezu téměř 17krát vyšší než při neuroaxiální anestezii, tak od přelomu tisíciletí již rozdíl není signifikantní [10]. Nezměnilo se sice nijak riziko obtížné intubace, to je stále 10krát vyšší než v běžné populaci [6–9], ale změnilo se vybavení a schopnost anesteziologů tuto situaci řešit bez závažných následků. Při metaanalýze studií srovnávajících celkovou a neuroaxiální anestezii jsou dnes jako prokazatelné medicínské výhody neuroaxiální anestezie identifikovány pouze menší krevní ztráty a menší pooperační třes. Nebyl již ale nalezen signifikantní rozdíl v mateřské mortalitě [11]. Je však nutno zdůraznit, že díky výraznému rozšíření neuroaxiální anestezie nebyla celková anestezie pravděpodobně v mnoha případech podána právě těm rodičkám, u kterých by jinak při úvodu do celkové anestezie, což je onen kritický moment, došlo k závažným komplikacím. Při retrospektivním charakteru většiny publikovaných dat musíme proto toto srovnání bezpečnosti obou metod brát s určitou rezervou.
Nejednoznačně zodpovězenou otázkou je vliv anestezie na plod. Podle většiny v poslední době publikovaných dat, včetně Cochrane database, již není významný rozdíl ve vlivu jednotlivých typů anestezie na adaptaci v termínu narozeného novorozence [11–14]. V rozporu s tím je ale například australská studie, do které bylo zařazeno více než 50 000 císařských řezů, a v níž celková anestezie měla signifikantně větší vliv na zhoršenou adaptaci novorozenců než anestezie regionální [15]. Stejně tak i v italské studii vyšla horší časná adaptace novorozence (Apgar skóre v 1. minutě < 7) po celkové anestezii ve srovnání se spinální [16].
Většina dostupných dat o vlivu typu anestezie na plod pochází z termínových gravidit. O vlivuanestezie na nezralé plody, a především těžce nezralé plody (tj. gestační stáří plodu < 32 týdnů) víme jen málo a je to stále otázkou kontroverze. V klinické praxi se častěji setkáváme s horší poporodní adaptací těchto novorozenců po celkové anestezii než po neuroaxiálních technikách. Předpokládáme, že to nejspíše souvisí s celkově nižší hmotností novorozence (a tedy větším vlivem podaných anestetik matce), nezralým metabolismem (nezralými detoxikačními schopnostmi) a nezralými plícemi. Studie Laudenbacha et al. ale ukázala, že signifikantně významnější negativní vliv na plod než anestezie celková či epidurální měla spinální anestezie [17]. Na podkladě patofyziologie je nejpravděpodobnějším vysvětlením vliv nedostatečné uteroplacentární perfuze při hypotenzi matky, která je u spinální anestezie významně častější než u jiného typu anestezie [18, 19].
Z hlediska matky by u plánovaného císařského řezu, a při nepřítomnosti kontraindikací jednotlivých anesteziologických technik, měla volba typu anestezie dnes záležet především na rodičce a její preferenci. Při stejné bezpečnosti celkové i regionální anestezie u císařského řezu tak v podstatě mají rozhodující vliv na volbu anestezie spíše důvody „emocionální“ než medicínské.
V akutních stavech má být volba typu anestezie především racionální a anesteziolog by neměl příliš podléhat často vysoké úrovni stresu na porodním sále ze strany porodníků. Není výjimečným jevem, že aniž by došlo k významnému zhoršení stavu plodu u řadu hodin nepostupujícího porodu, je najednou rozhodnutí o operačním ukončení porodu provázeno iracionální urgencí. Je častým a mylným názorem, že podání celkové anestezie je vždy tou nejrychlejší anesteziologickou metodou. Podáním spinální anestezie či především přidáním do již zavedeného epidurálního katétru k porodní analgezii (tzv „top-up“ anestezie) lze dosáhnout v podstatě srovnatelného času vybavení plodu (tzv. decision-to-delivery interval) jako při podání celkové anestezie [20, 23]. Nutnou podmínkou je ale pochopitelně vzájemná důvěra mezi porodníky a anesteziology, dobrá spolupráce rodičky i zkušenost a zručnost celého anesteziologického týmu.
Z hlediska plodu nejsou závěry pro volbu ideální anestezie k císařskému řezu jednoznačné (tab. 1). Při srovnávání vlivů jednotlivých typů anestezie na plod je potřeba si uvědomit, že větší vliv na adaptaci novorozence než podaný typ anestezie může mít především hypotenze matky či jeho případná hypoxie před vlastním císařským řezem.
Tab. 1. Volba anesteziologické techniky podle časového faktoru u rodičky bez již zavedeného epidurálního katétru 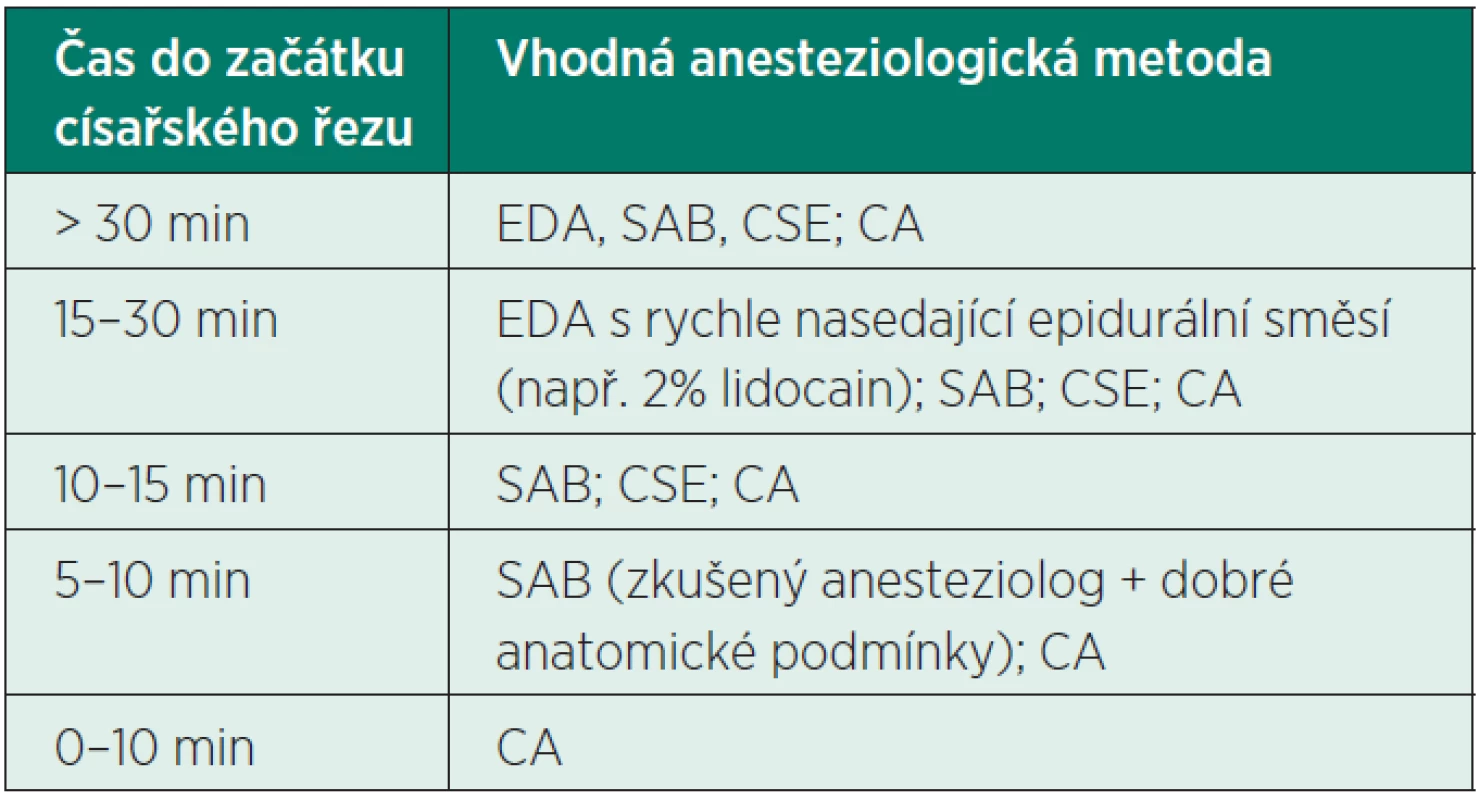
OXYGENOTERAPIE
Tradiční anesteziologické pravidlo na porodním sále říká, že každé rodičce podstupující císařský řez by měl být podáván kyslík. V případě celkové anestezie je toto pravidlo naprosto nezpochybnitelné a všechny rodičky by před úvodem do CA měly dostat masku s vysokým FiO2. Cílem je denitrogenace plic (nikoli zlepšení aktuální saturace!) a prodloužení časového intervalu do začátku desaturace při apnoické intubaci. Ženy na konci těhotenství mají fyziologicky zvýšený metabolismus a až o 35–40 % vyšší konsumpci kyslíku a současně o 20 % nižší plicní funkční reziduální kapacitu (FRC). Ta se navíc může ještě o dalších 25 % snížit při položení rodičky na záda. Negativní změny FRC může prohloubit i porodní bolest a celkové vyčerpání. Desaturace krve a rozvoj kritické hypoxie tak nastává u rodičky, a samozřejmě i plodu, nesrovnatelně rychleji než u netěhotných pacientek [24–26]. Tato denitrogenace by proto měla být provedena vždy, protože jinak je matka (i plod) vystavena zbytečně zvýšenému riziku hypoxie při úvodu do celkové anestezie. Obě metody denitrogenace, jak inhalace kyslíku lehkou obličejovou maskou po dobu 3–5 minut s příkonem 6–8 l O2/min, tak 4 hluboké nádechy těsnou obličejovou maskou se 100% FiO2 , jsou srovnatelné [24, 27]. S druhou variantou, tj. těsnou obličejovou maskou, je ale spojena vyšší stresová zátěž rodičky. Při použití těsné obličejové masky je lepší variantou 8 než 4 hluboké nádechy [43]. Čtyřmi nádechy těsnou obličejovou maskou se 100% FiO2 dosáhneme sice stejné PaO2, ale již ne stejnou protekci proti rychlé desaturaci hemoglobinu, a to díky rozdílné rezervě O2 v tkáních [42].
Naproti tomu rutinní perioperační oxygenoterapie (FiO2 0,4–0,5) lehkou obličejovou maskou v průběhu císařského řezu v regionální anestezii je postup kontroverzní. Podle současných dat je totiž rutinní oxygenoterapie nejenže zbytečná a neefektivní, ale může mít dokonce naopak negativní důsledky pro plod [28–30]. Nadměrná dodávka kyslíku sebou totiž přináší i zvýšenou tvorbu reaktivních forem kyslíku včetně volných kyslíkových radikálů vyvolávajících peroxidaci lipidů, alteraci enzymatických buněčných funkcí a poškození buněčné DNA. U citlivých jedinců může vést k placentární vazokonstrikci a fetální acidóze [31, 32], či ažk neonatální retinopatii a/nebo bronchopulmonální dysplazii. Riziko se týká především předtermínových plodů, protože termínový plod se s touto zátěží dokáže pomocí kompenzačně zvýšených antioxidantů (enzymatických inaktivátorů i scavengerů) vcelku vypořádat [33]. Výjimkou, kdy je podání kyslíku u regionální anestezie vhodné, je emergentní (nikoli akutní) císařský řez. Obzvláště u rodičky s kontrakcemi, kde zvýšená mateřská konsumpce kyslíku při kontrakci dále exacerbuje fetální hypoxii, může zvýšená dodávka kyslíku přechodně zlepšit fetální oxygenaci a snad i zlepšit hypoxii plodu.
PROFYLAXE TROMBEMBOLICKÉ NEMOCI
Trombembolická nemoc (TEN) patří ve vyspělých zemích k nejčastější příčině mateřské mortality a tvoří okolo 10 % všech úmrtí ve spojení s porodem [34–37]. Hlavní příčinou 5–10násobně zvýšeného rizika trombembolie v těhotenství oproti netěhotným [37–40] je fyziologický hyperkoagulační stav, který má chránit ženu při porodu či potratu proti nadměrné krevní ztrátě [41–44]. Zjednodušeně řečeno, těhotenství se vyznačuje vystupňovanou tvorbou fibrinu a současně sníženou fibrinolýzou. I přes to, že v těhotenství je riziko TEN několikanásobně zvýšené, naprostá většina těhotných žen preventivní antikoagulaci nepotřebuje. Výjimkou jsou těhotné ženy s deficitem proteinu C, proteinu S a antitrombinu, získané mateřské trombofilie (např. syndrom antifosfolipidových protilátek) a především homozygotní formy mutace faktoru II a V (Leidenská mutace), které až 10násobně zvyšují v těhotenství riziko TEN, při kombinaci obou je riziko dokonce až 70násobně vyšší! Naopak mutace metylentetrahydrofolátreduktázy (MTHFR) není dnes již dávána do souvislostí se zvýšeným rizikem TEN, a to ani její homozygotní forma [45–48]. V euro-americké populaci se vrozené trombofilie vyskytují přibližně u 15 % populace. Přestože podle současných dat vzniká TEN v těhotenství až v 50 % všech případů na podkladě trombofilie, komplikuje TEN pouze okolo 0,1 % těhotenství. Dokonce i absolutní riziko TEN u těhotných žen s trombofilií se pohybuje pouze okolo 1–2 %, s převahou výskytu postpartálně [47, 49, 50].
Plošně je tromboprofylaxe v těhotenství doporučována pouze v případě císařského řezu, přičemž aplikace nízkomolekulárního heparinu (LMWH – low molecular weight heparins) je v těhotenství preferována před aplikací nefrakcionovaného heparinu (UFH) [46, 51]. Dostatečný profylaktický efekt standardních dávek LMWH je ale v těhotenství nejistý. Podstatným problémem je totiž fakt, že doporučované profylaktické dávkování LMWH je pouze převzato od dávkovacích schémat vytvořených a vyzkoušených pro chirurgické a ortopedické pacienty, tj. není přizpůsobeno fyziologicky odlišnému těhotenství. Přitom je jasné, že těhotné ženy se od průměrného chirurgického či ortopedického pacienta zcela zásadně liší nejen svým věkem, a tím i výskytem přidružených onemocnění a ostatních komplikací, ale především se právě odlišují fyziologickým posunem koagulační rovnováhy na stranu hyperkoagulace i současně zrychleným metabolismem LMWH. Současná doporučení tromboprofylaxe u těhotných žen jsou tak postavena především na kazuistikách, konsenzuálních stanoviscích a studiích provedených na netěhotné populaci, nikoli na podkladě dostatečně velkých randomizovaných studií.
Ve většině evropských zemí je obecně perioperační tromboprofylaxe k císařskému řezu zahajována již předoperačně, nejčastěji 8–12 hodin před začátkem vlastního výkonu. Důvodem předoperačního zahájení tromboprofylaxe je předpoklad, že tromby se začínají formovat už per-operačně, a proto by pacientky měly být chráněny již v tomto období. Aby se současně snížilo riziko peroperačního krvácení a bylo umožněno použití neuroaxiálních anesteziologických technik, jsou LMWH obvykle aplikovány večer před operačním výkonem. Přitom má tento postup dnes již obecně poměrně chabé vědecké odůvodnění. Studie, do které bylo zařazeno 1472 pacientů podstupujících náhradu kyčelního kloubu, neprokázala žádný rozdíl ve výskytu TEN při aplikaci LMWH (dalteparin) 2 hodiny před výkonem ve srovnání s aplikací 4 hodiny po výkonu [52]. Stejně tak metaanalýza aplikace LMWH 12 hodin před operací versus až pooperačně ukázala, že předoperační aplikace LMWH nesnižuje riziko TEN proti pooperační aplikaci [53]. Tomu již odpovídají i některá současná doporučení [54–56]. Guidelines americké ACCP (American College of Chest Physicians) již nepožadují obecně předoperační tromboprofylaktické podání LMWH, ale společně až s pooperační aplikací to uvádějí pouze jako jednu z možností. Pro pacienty podstupující velké ortopedické výkony má toto doporučení dokonce nejvyšší možný stupeň významnosti, tj. doporučení úrovně 1A [54]. Stejně tak i současná německá multioborová doporučení týkající se tromboprofylaxe, na kterých se podílelo celkem 25 německých odborných společností včetně anesteziologické a intenzivistické, gynekologicko-porodnické, hematologické a společnosti pro trombózu a hemostázu, odkazují na předoperační aplikaci LMWH pouze jako na možnost, nikoli na požadavek [56]. Až s pooperační aplikací LMWH jsou navíc spojeny i výhody nižšího rizika peroperačního krvácení a snížení rizika spinálního hematomu při aplikaci neuroaxiální blokády [54]. Jaký je v porodnictví opravdu vztah rizika předoperačního podávání LMWH versus až pooperačně není známo. Při změněné farmakokinetice i farmakodynamice LMWH v těhotenství, a tím při jeho zkráceném účinku, lze odůvodněně předpokládat, že úvodní dávka LMWH aplikovaná v čase 12 hodin před císařským řezem nemá na vlastní profylaxi vůbec žádný vliv, protože do začátku výkonu je beze zbytku eliminována. Na perioperační tromboprofylaxi se tak podílí stejně až dávka následující, tj. pooperační. Odpovídají tomu i klinické zkušenosti, kdy neregistrujeme zvýšený výskyt TEN u akutních císařských řezů, u nichž je profylaxe aplikována až po výkonu. Vezmeme-li současně v úvahu výše uvedená data srovnávající riziko TEN při předoperační a pooperační aplikaci LMWH spolu s farmakokinetickými a farmakodynamickými změnami v těhotenství, je podle všeho předoperační profylaxe LMWH v případě císařského řezu zbytečná, a tedy neindikovaná.
Neopodstatněnost předoperační tromboprofylaxe u císařského řezu podtrhují i současné názory, zpochybňující univerzální nutnost farmakologické profylaxe u všech těhotných žen podstupujících císařský řez. Recentní data ukazují, že pravděpodobně díky časné mobilizaci pacientek je dnes výskyt TEN po císařském řezu asi výrazně nižší, než se předpokládá. Ve studii sledující výskyt žilní trombózy po císařském řezu byly sonografické známky DVT zaznamenány pouze u 0,5 % žen [57], tj. méně než u obecně chirurgických pacientů. Císařský řez, a to včetně předtermínového, u nekomplikovaně probíhajícího těhotenství bez dalších rizikových faktorů, je dnes řadou expertů řazen mezi výkony s nízkým rizikem TEN, tj. bez nutné farmakologické profylaxe. Podmínkou je ale časná mobilizace rodiček. Tomu odpovídají i současná doporučení Royal College of Obstetricians and Gynaecologists a American College of Chest Physicians [47, 58, 59] – schéma 1.
Schéma 1. Zhodnocení a management rizika TEN po porodu Adaptováno z doporučení RCOG 2009 [58]. ![Schéma 1. Zhodnocení a management rizika TEN po porodu
Adaptováno z doporučení RCOG 2009 [58].](https://pl-master.mdcdn.cz/media/image/f416f91ca47b9170240d20fc7b67564b.jpg?version=1537797638)
HYPOTENZE
Hypotenze v případě rodičky znamená TKsyst < 100 mm Hg, nebo u rodičky s předcházející hypertenzí pokles TKsyst o 25 % a více [60]. Hypotenze matky vždy znamená hypoperfuzi placenty vedoucí k acidóze a hypoxii plodu s možným hypoxickým postižením. Etiologicky se nejčastěji jedná o hypotenzi při rychlé a výrazné krevní ztrátě, při rychlém nástupu účinku neuroaxiální blokády sympatiku s významnou vazodilatací, a/nebo v rámci supinního syndromu (syndrom aortokavální komprese). Vzhledem k takto poměrně jednoduché etiologii se většina případů poklesu krevního tlaku v době okolo porodu dá vcelku předpokládat. Jedním z prvních příznaků bývá náhlá nauzea (daná hypoperfuzí splanchniku), na jejímž základě lze hypotenzi rozpoznat mnohem rychleji než pomocí standardního monitorování TK.
Tradiční infuzní příprava (prehydratace) před císařským řezem v neuroaxiální anestezii bývá 1000–1500 ml krystaloidu jako prevence či snížení závažnosti hypotenze. Tato prehydratace nicméně není spolehlivým prostředkem prevence, sníží výskyt hypotenze pouze v řádu procent [61]. A to i v případě prehydratace koloidy, které mají v rámci tekutinového preloadu lepší efekt než krystaloidy [60, 62], ale mohou mít i částečný negativní efekt na koagulaci [63]. Přestože prehydratace sama o sobě nestačí, není ani zbytečná – už sám tekutinový preload zlepšuje uteroplacentární perfuzi [64]. V případě regionální anestezie je zcela adekvátní variantou prehydratace rychlá infuze krystaloidu/koloidu (20 ml/kg) zahájená v době aplikace lokálního anestetika. Tento tzv. co-load má stejný efekt jako podání krystaloidů předem (preload) [65–68]. Vysvětlením je, že pouze asi 10–20 % objemu podaných krystaloidů se udrží intravazálně, zbytek rychle unikne extravazálně do intersticia [69]. I když prehydratace snižuje četnost hypotenze při neuroaxiální anestezii, podání anestezie by nemělo být podmíněno podáním fixního tekutinového objemu, obzvláště v situaci akutního císařského řezu [61, 70]. Určitá opatrnost s intenzitou volumoterapie je nutná při preeklampsii (snížený koloidní tlak při hypoproteinémii může v následujících 6–12 hod vyvolat výrazné edémy, včetně plicního), a kardiální insuficienci (nebezpečí přetížení oběhu). Dalším rizikem je podání většího množství roztoků glukózy. Roztok 5% glukózy je zmetabolizován ihned na čistou bezsolutovou vodu (riziko edémů), podání 10% glukózy pak přináší nebezpečí vzniku hyperinzulinémie a následné hypoglykémie u novorozence. Podáván by neměl být ani fyziologický roztok, jednak pro iontovou nevyváženost, ale především pro potenciaci acidózy. Rizikovou kombinací je i současná intenzivní volumoterapie spolu s tokolýzou beta-adrenergními agonisty (riziko vzniku tokolytického plicního edému) [71].
Léčba hypotenze vzniklé blokádou sympatiku je založena na rychlém doplnění chybějícího intravazálního objemu (volumoterapie), a na podání vazopresorů. Terapie musí být především rychlá a důrazná, při protrahovaném trvání hypotenze hrozí významná hypoxie plodu. Vzhledem k patofyziologii hypotenze z vazodilatace je ve většině případů nejefektivnějším způsobem léčby kombinace volumoterapie se současným podáním vazopresorů [72, 73]. V případě spinální anestezie je pak dokonce vhodné podat vazopresory již profylakticky s aplikací lokálního anestetika tak, aby k rozvoji hypotenze vůbec nedošlo.
Vazopresorem volby u těhotných v našich podmínkách je efedrin (bolusy 5–15 mg i. v.), variantou je fenylefrin (bolusy 0,05–0,15 mg i. v.). Obě tyto látky minimálně snižují průtok placentou. Efekt efedrinu a fenylefrinu je v podstatě identický [74], fenylefrin však nevyvolává tachykardii matky (může naopak reflexně způsobit její bradykardii) a jeho užití je snad spojeno s nižší fetální acidózou. Teprve v případě, že hypotenze nereaguje na uvedené vazopresory, je indikováno podání noradrenalinu. Jinak téměř ideální čistý vazopresor noradrenalin totiž zvýšením periferní vazokonstrikce uterinních cév současně sníží i průtok placentou, a dále tak zhorší hypoxii plodu.
Pokud se nejedná o krvácení, ani vazodilataci po aplikaci neuroaxiální anestezie, je nejčastějším důvodem hypotenze těhotných žen nedostatečný srdeční preload při aortokavální kompresi z útlaku dolní duté žíly a aorty hmotností těhotné dělohy při poloze naznak. Prevencí vzniku tohoto stavu je poloha těhotné s náklonem trupu doleva o 10–15 ° pro sinistropozici uteru [75].
ZÁVAŽNÁ HYPERTENZE
Hypertenze matky s TK nad 160/110 mm Hg patří mezi emergentní stavy s nutností rychlé stabilizace zejména TKDIAST na hodnoty 90–100 mm Hg. Cílem léčby je prevence komplikací ze strany matky (nitrolební krvácení, srdeční selhání, abrupce placenty) při zachování dostatečné perfuze placenty. U těžké hypertenze proto zpočátku snižujeme TKSYST o 20–30 mm Hg a TKDIAST o 10–15 mm Hg. Cílové hodnoty TK u středně závažné až závažné formy hypertenze jsou TKSYST 140–160 mm Hg a TKDIAST 90–100 mm Hg [76].
Terapie hypertenze v předporodním období či na porodním sále je stejná u destabilizace chronické arteriální hypertenze i u gestační hypertenze či preeklampsie: alfametyldopa, betablokátory či blokátory kalciových kanálů. V intenzivní antihypertenzní terapii se dnes celosvětově preferuje labetalol, nebo dihydralazin [77, 78]. Dihydralazin již ale není považován za lék první volby – je spojen s větším výskytem nežádoucích účinků (častější nepredikovatelná hypotenze, častější porod císařským řezem, častější abrupce placenty) než labetalol [79–82], nicméně na řadě pracovišť je stále preferován. Alternativou obou může být zejména urapidil. Podávání inhibitorů ACE a blokátorů AT1 (sartanů) je v těhotenství kontraindikováno[83, 84]. U všech intravenózních preparátů je vysoké nebezpečí vzniku významné hypotenze a poškození plodu, proto při jejich aplikaci musí být rodička adekvátně monitorována v rámci periporodní intenzivní péče.
Lékem volby u těžké hypertenze (= TKSYST > 160 mm Hg a TKDIAST > 110 mm Hg) je labetalol. Labetalol (Trandate) je neselektivní betablokátor s alfa1-lytickým účinkem, rychle snižující arteriální tlak bez snižovaní uteroplacentárního průtoku. Nevede k reflexní tachykardii, bolestem hlavy či nauzei. Nástup účinku je 10–20 minut, trvání 6–8 hodin. Kontraindikací je srdeční selhání (astma bronchiale), bradykardie, AV blok 2./3. stupně, jaterní selhání. Určité opatrnosti je třeba při předchozím podání jiných betablokátorů (nejčastěji metoprololu; Vasocardin), a to i per os, s rizikem vzniku bradykardie. Iniciální dávka je bolus 20 mg i. v. během 1 minuty, pak se pokračuje kontinuální infuzí 1–2 mg/min do požadovaného efektu či maximální dávky 300 mg. V případě dobré kompenzace TK (tj. diastolický TK 90–110 mm Hg) se rychlost snižuje na 0,5 mg za min. Variantou kontinuální aplikace labetalolu je po úvodním bolusu 20 mg vždy po 15–30 minutách další bolusová dávka, která je oproti předchozí zdvojnásobena(tj. 40-80-160 mg i. v.), a to až do požadovaného efektu či celkové maximální dávky 300 mg.
Při nemožnosti podání labetalolu je variantou dihydralazin (Nepresol), přímo dilatující arterioly. Nástup účinku je 10–20 minut, trvání 6–8 hodin. Iniciální dávkou je bolus 2,5–5 mg i. v., pokud přetrvává TK > 160/110 mm Hg, podávají se po 20–30 minutách další bolusy do maxima 20 mg i. v.; nebo kontinuální infuzí 5–10 mg/hod; maximální denní dávka je 100 mg [82, 85]. Kontinuální infuze hydralazinu není v současné době ale příliš doporučována pro obtížnější nastavení efektivní léčby i vyšší riziko hypotenze a tísně plodu. Mezi nežádoucí účinky patří především bolesti hlavy, tachykardie, třes a nauzea.
Alternativou obou předchozích antihypertenziv je urapidil (Ebrantil) – alfa1-blokátor, v CNS aktivující 5HT1a receptory. Iniciální dávka je 25 mg i. v., po 5 minutách ji lze opakovat, dále kontinuální infuzí 5–30 mg/hod.
OXYTOCIN
Současná data nadále potvrzují, že oxytocin je pro prevenci děložní atonie u císařského řezu stále uterotonikem první volby. Je ale nutno vzít v úvahu, že jeho podání může být doprovázeno i celou řadou nežádoucích účinků. Patří sem především kardiovaskulární nestabilita (hypotenze, tachykardie, myokardiální ischémie a arytmie), nauzea/zvracení, bolesti hlavy a zarudnutí s návaly horka. Vzácněji, díky strukturální podobnosti s vazopresinem, mohou vyšší dávky oxytocinu vyvolat retenci vody, hyponatrémii, křeče i kóma [86]. Ačkoli ve srovnání s ostatními uterotoniky je oxytocin výrazně méně emetogenní, vyskytuje se po bolusovém podání 5 IU oxytocinu nauzea až u třetiny rodiček, zvracení pak u skoro 10 % [87]. Nejčastějším nežádoucím účinkem oxytocinu při jeho podání u císařského řezu je ale na dávce závislá hypotenze a tachykardie. Hypotenze je způsobena tranzientní (přechodnou?) relaxací cévního hladkého svalstva, pravděpodobně cestou kalcium-dependentní stimulace cyklu oxidu dusnatého. Hypotenzi navíc potencuje i přidaný stabilizátor chlorbutanol, který sám má středně významný negativní inotropní efekt [88].
Na rozdíl od účinků na systémové cévy může oxytocin vyvolat koronární vazokonstrikci. Nedávná studie ukázala významné změny ST-segmentu po podání 10 IU oxytocinu v průběhu císařského řezu ve spinální anestezii [89]. Stejně tak další studie pomocí holterovského monitorování prokázala statisticky významně více ST depresí u zdravých žen, kterým bylo v průběhu plánovaného císařského řezu ve spinální anestezii podáno 10 versus 5 IU oxytocinu [90]. Nicméně jiná studie s použitím stejné holterovské technologie klinicky významné změny či elevaci hladin ischemických markerů při císařském řezu neprokázala [91]. Extrémní pozornosti při podávání oxytocinu je tak třeba především u hypovolemických rodiček, kdy by jeho podání mělo být doprovázeno současnou volumoterapií i vazopresorickou podporou [92].
Kardiovaskulární účinky oxytocinu se mohou lišit v závislosti na dávce a způsobu podání. Pomalá infuze 5 IU oxytocinu vyvolá menší kardio-vaskulární nestabilitu než stejná dávka podaná bolusově, a to bez pozorovatelných rozdílů v uterotonickém účinku [93]. Nižší úvodní a případně opakovanou dávku podporuje i skutečnost, že hemodynamické změny po dalším bolusu oxytocinu již nejsou tak výrazné, jako po úvodní dávce [94]. Rychlost aplikace oxytocinu je významná u pacientek s vyšším rizikem plicního edému, např. u těžké preeklampsie. Oxytocin totiž vede k vyplavení atriálního i mozkového natriuretického peptidu, přičemž v pomalé infuzi je tento antidiuretický efekt slabší [95].
Současné doporučované schéma podávání oxytocinu k profylaxi děložní atonie doporučuje u zdravých rodiček s nízkým rizikem děložní atonie počáteční dávku 2–3 IU, aplikovanou pomalu intravenózně po dobu 30 sekund [96–98]. Vyšší dávky by měly být podávány ve formě infuze po dobu 3–5 minut nebo jako pomalý intravenózní bolus v kombinaci s vazopresorem k minimalizaci negativních hemodynamických účinků oxytocinu [99]. Pokud není uterotonická odpověď dostatečná, může být úvodní dávka opakována po 3–5 minutách. Dále by již měla následovat kontinuální infuze oxytocinu. U pacientek se závažným srdečním onemocněním (zejména s plicní hypertenzí) se doporučuje pomalé podávání ultranízkých dávek (0,1–0,5 IU) oxytocinu [100].
ZÁVĚR
Současná porodnická péče, a o to více péče o rodičky podstupující císařský řez, vyžaduje nejen detailní porozumění fyziologickým změnám v těhotenství, ale vyžaduje především týmový a multidisciplinární přístup. Situace se proti době nedávno minulé významně změnila v tom, že i díky asistované reprodukci stoupl nejen věk rodiček a počet vícečetných těhotenství, ale častěji se setkáváme i s tím spojeným větším množstvím přidružených onemocnění. Není dnes již výjimkou rodička s těžkým systémovým onemocněním či po orgánové transplantaci. Odráží to i celosvětově stoupající počet porodů císařským řezem. Je nasnadě, že viditelně lepších výsledků dosahují ty porodnice, kde se o rodičky starají kombinované porodnické týmy složené ze zkušených porodníků, anesteziologů, neonatologů a porodních asistentek. Porodní péče již není otázkou dostupnosti potřebného vybavení, ale otázkou zajištění bezpečného porodu právě pro komplikovaná těhotenství.
Poznámka redakce: Přehledový článek reprezentuje stanovisko ESPA k uvedené problematice a neprošel standardním recenzním řízením.
Do redakce došlo dne 22. 8. 2012.
Do tisku přijato dne 22. 12. 2012.
Adresa pro korespondenci:
MUDr. Jan Bláha, Ph.D.
KARIM 1. LF UK a VFN v Praze
U Nemocnice 2
128 08 Praha 2
e-mail: jan.blaha@lf1.cuni.cz
Zdroje
1. van Dongen, P. W. J. Caesarean Section – Etymology and Early History. South African Journal of Obstetrics and Gynaecology, 2009, 15, 2, p. 62–66.
2. Pařízek, A., Bláha, J., Dolenská, S., Nosková, P. Aktuální vývoj porodnické analgézie v ČR. In: XVII národní kongres ČSARIM: 10.9.2010, Zlín, 2010.
3. Štourač, P., Bláha, J., Klozová, R., Nosková, P., Seidlová, P. OBAAMA – jak je na tom současná česká porodnická anestezie. In: XIX kongres České společnosti anesteziologie, resuscitace a intenzivní medicíny. Hradec Králové, 2012.
4. Oppenheimer, L. Diagnosis and management of placenta previa. Journal of obstetrics and gynaecology Canada (JOGC) 2007, 29, 3, p. 261–273.
5. Visalyaputra, S., Rodanant, O., Somboonviboon, W., Tantivitayatan, K., Thienthong, S., Saengchote, W. Spinal versus epidural anesthesia for cesarean delivery in severe preeclampsia: a prospective randomized, multicenter study. Anesthesia and analgesia, 2005, 101, 3, p. 862–868, table of contents.
6. Rahman, K., Jenkins, J. G. Failed tracheal intubation in obstetrics: no more frequent but still managed badly. Anaesthesia, 2005, 60, 2, p. 168–171.
7. McDonnell, N. J., Paech, M. J., Clavisi, O. M., Scott, K. L. Difficult and failed intubation in obstetric anaesthesia: an observational study of airway management and complications associated with general anaesthesia for caesarean section. Int. J. Obstet. Anesth., 2009, 17, 4, p. 292–297.
8. Lyons, G., Akerman, N. Problems with general anaesthesia for Caesarean section. Minerva Anestesiol., 2005, 71, 1–2, p. 27–38.
9. Barnardo, P. D., Jenkins, J. G. Failed tracheal intubation in obstetrics: a 6-year review in a UK region. Anaesthesia, 2000, 55, 7, p. 690–694.
10. Hawkins, J. L. Anesthesia-related maternal mortality. Clin. Obstet. Gynecol., 2003, 46, 3, p. 679–687.
11. Afolabi, B. B., Lesi, F. E., Merah, N. A. Regional versus general anaesthesia for caesarean section. Cochrane Database Syst. Rev., 2006, 4, CD004350.
12. Reynolds, F., Seed, P. T. Anaesthesia for Caesarean section and neonatal acid-base status: a meta-analysis. Anaesthesia, 2005, 60, 7, p. 636–653.
13. Sigalas, J., Galazios, G., Tsikrikoni, I., Scordala, M., Vogiatjaki, T., Spanopoulou, P. I., Tsikouras, P. The influence of the mode of anaesthesia in the incidence of neonatal morbidity after an elective caesarean section. Clin. Exp. Obstet. Gynecol., 2006, 33, 1, p. 10–12.
14. Jain, K., Bhardwaj, N., Sharma, A., Kaur, J., Kumar, P. A randomised comparison of the effects of low-dose spinal or general anaesthesia on umbilical cord blood gases during caesarean delivery of growth-restricted foetuses with impaired Doppler flow. European journal of anaesthesiology, 2012.
15. Algert, C. S., Bowen, J. R., Giles, W. B., Knoblanche, G. E., Lain, S. J., Roberts, C. L. Regional block versus general anaesthesia for caesarean section and neonatal outcomes: a population--based study. BMC medicine, 2009, 7, p. 20.
16. Mancuso, A., De Vivo, A., Giacobbe, A., Priola, V., Maggio Savasta, L., Guzzo, M., De Vivo, D. General versus spinal anaesthesia for elective caesarean sections: effects on neonatal short--term outcome. A prospective randomised study. The journal of maternal-fetal & neonatal medicine : the official journal of the European Association of Perinatal Medicine, the Federation of Asia and Oceania Perinatal Societies, the International Society of Perinatal Obstet, 2010, 23, 10, p. 1114–1118.
17. Laudenbach, V., Mercier, F. J., Roze, J. C., Larroque, B., Ancel, P. Y., Kaminski, M., Breart, G., Diemunsch, P., Subtil, D., Lejus, C. et al. Anaesthesia mode for caesarean section and mortality in very preterm infants: an epidemiologic study in the EPIPAGE cohort. International journal of obstetric anesthesia, 2009, 18, 2, p. 142–149.
18. Liu, S. S., McDonald, S. B. Current issues in spinal anesthesia. Anesthesiology, 2001, 94, 5, p. 888–906.
19. Lee, A., Ngan Kee, W. D., Gin, T. A dose-response meta-analysis of prophylactic intravenous ephedrine for the prevention of hypotension during spinal anesthesia for elective cesarean delivery. Anesthesia and analgesia, 2004, 98, 2, p. 483–490, table of contents.
20. Popham, P., Buettner, A., Mendola, M. Anaesthesia for emergency caesarean section, 2000-2004, at the Royal Women‘s Hospital, Melbourne. Anaesth. Intensive Care, 2007, 35, 1, p. 74–79.
21. Kinsella, S. M., Girgirah, K., Scrutton, M. J. Rapid sequence spinal anaesthesia for category-1 urgency caesarean section:a case series. Anaesthesia, 2010, 65, 7, p. 664–669.
22. Dahl, V., Spreng, U. J. Anaesthesia for urgent (grade 1) caesarean section. Current opinion in anaesthesiology, 2009, 22, 3, p. 352–356.
23. Hillyard, S. G., Bate, T. E., Corcoran, T. B., Paech, M. J., O‘Sullivan, G. Extending epidural analgesia for emergency Caesarean section: a meta-analysis. British journal of anaesthesia, 2011, 107, 5, p. 668–678.
24. Tanoubi, I., Drolet, P., Donati, F. Optimizing preoxygenation in adults. Canadian journal of anaesthesia, 2009, 56, 6, p. 449–466.
25. Farmery, A. D., Roe, P. G. A model to describe the rate of oxyhaemoglobin desaturation during apnoea. British journal of anaesthesia, 1996, 76, 2, p. 284–291.
26. Benumof, J. L., Dagg, R., Benumof, R. Critical hemoglobin desaturation will occur before return to an unparalyzed state following 1 mg/kg intravenous succinylcholine. Anesthesiology, 1997, 87, 4, p. 979–982.
27. Tanoubi, I. Oxygenation before anesthesia (preoxygena-tion) in adults. In Anesthesiology Rounds, vol. 5. Department of Anesthesiology, University of Montreal, 2006.
28. Cogliano, M. S., Graham, A. C., Clark, V. A. Supplementary oxygen administration for elective Caesarean section under spinal anaesthesia. Anaesthesia, 2002, 57, 1, p. 66–69.
29. Khaw, K. S., Wang, C. C., Ngan Kee, W. D., Pang, C. P., Rogers, M. S. Effects of high inspired oxygen fraction during elective caesarean section under spinal anaesthesia on maternal and fetal oxygenation and lipid peroxidation. Br. J. Anaesth., 2002, 88, 1, p. 18–23.
30. Khaw, K. S., Ngan Kee, W. D. Fetal effects of maternal supplementary oxygen during Caesarean section. Curr. Opin. Anaesthesiol., 2004, 17, 4, p. 309–313.
31. Thorp, J. A., Trobough, T., Evans, R., Hedrick, J., Yeast, J. D. The effect of maternal oxygen administration during the second stage of labor on umbilical cord blood gas values: a randomized controlled prospective trial. Am. J. Obstet. Gynecol., 1995, 172, 2 Pt 1, p. 465–474.
32. Khazin, A. F., Hon, E. H., Hehre, F. W. Effects of maternal hyperoxia on the fetus. I. Oxygen tension. Am. J. Obstet. Gynecol., 1971, 109, 4, p. 628–637.
33. Buhimschi, I. A., Buhimschi, C. S., Pupkin, M., Weiner, C. P.Beneficial impact of term labor: nonenzymatic antioxidant reserve in the human fetus. Am. J. Obstet. Gynecol., 2003, 189, 1, p. 181–188.
34. Lyons, G. Saving mothers‘ lives: confidential enquiry into maternal and child health 2003-5. International journal of obstetric anesthesia, 2008, 17, 2, p. 103–105.
35. James, A. H. Prevention and management of venous thromboembolism in pregnancy. The American journal of medicine, 2007, 120, 10 Suppl 2, S26–34.
36. Kujovich, J. L. Hormones and pregnancy: thromboembolic risks for women. Br. J. Haematol., 2004, 126, 4, p. 443–454.
37. Heit, J. A., Kobbervig, C. E., James, A. H., Petterson, T. M., Bailey, K. R., Melton, L. J. 3rd Trends in the incidence of venous thrombo-embolism during pregnancy or postpartum: a 30-year population-based study. Annals of internal medicine, 2005, 143, 10, p. 697–706.
38. Pomp, E. R., Lenselink, A. M., Rosendaal, F. R., Doggen, C. J.Pregnancy, the postpartum period and prothrombotic defects: risk of venous thrombosis in the MEGA study. Journal of thrombosis and haemostasis (JTH), 2008, 6, 4, p. 632–637.
39. James, A. H. Pregnancy and thrombotic risk. Crit. Care Med., 2010, 38, 2 Suppl, S57–63.
40. Buhimschi, C. S., Buhimschi, I. A., Abdel-Razeq, S., Rosenberg, V. A., Thung, S. F., Zhao, G., Wang, E., Bhandari, V. Proteomic biomarkers of intra-amniotic inflammation: relationship with funisitis and early-onset sepsis in the premature neonate. Pediatric research, 2007, 61, 3, p. 318–324.
41. Mahieu, B., Jacobs, N., Mahieu, S., Naelaerts, K., Vertessen, F., Weyler, J., Jacquemyn, Y., Van der Planken, M. Haemostatic changes and acquired activated protein C resistance in normal pregnancy. Blood coagulation & fibrinolysis: an international journal in haemostasis and thrombosis, 2007, 18, 7, p. 685–688.
42. Brenner, B. Haemostatic changes in pregnancy. Thrombosis research, 2004, 114, 5–6, p. 409–414.
43. Johnson, R. F., Herman, N. L., Johnson, H. V., Arney, T. L., Paschall, R. L., Downing, J. W. Effects of fetal pH on local anesthetic transfer across the human placenta. Anesthesiology, 1996, 85, 3, p. 608–615.
44. Start, R. J., Greenberg, D. J., Herman, N. L. Use of a Wilson Convex Frame in removing „irretrievable“ epidural catheters. Anesthesia and analgesia, 1992, 75, 2, p. 305–306.
45. Widimský, J., Malý, J., Eliáš, P., Lang, O., Franc, P., Roz-točil, K. Doporučení diagnostiky, léčby a prevence plicní embolie. Vnitr. Lek., 2008, 54, Suppl 1, S25–S72.
46. Horlocker, T. T., Wedel, D. J., Rowlingson, J. C., Enneking, F. K., Kopp, S. L., Benzon, H. T., Brown, D. L., Heit, J. A., Mulroy, M. F., Rosenquist, R. W. et al. Regional anesthesia in the pa-tient receiving antithrombotic or thrombolytic therapy: American Society of Regional Anesthesia and Pain Medicine Evidence--Based Guidelines (Third Edition). Reg. Anesth. Pain Med., 2010, 35, 1, p. 64–101.
47. Marik, P. E. Venous thromboembolism in pregnancy. Clinics in chest medicine, 2010, 31, 4, p. 731–740.
48. Rosenberg, V. A., Lockwood, C. J. Thromboembolism in pregnancy. Obstetrics and gynecology clinics of North America, 2007, 34, 3, p. 481–500.
49. Kunar, M. A., Humphreys, G. W., Smith, K. J., Watson, D. G. When a reappearance is old news: visual marking survives occlusion. Journal of experimental psychology Human perception and performance, 2003, 29, 1, p. 185–198.
50. Kapoor, R., Davies, M., Blaker, P. A., Hall, S. M., Smith, K. J. Blockers of sodium and calcium entry protect axons from nitric oxide-mediated degeneration. Annals of neurology, 2003, 53, 2, p. 174–180.
51. Bates, S. M., Greer, I. A., Hirsh, J., Ginsberg, J. S. Use of antithrombotic agents during pregnancy: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest, 2004, 126, 3 Suppl., p. 627S–644S.
52. Hull, R. D., Pineo, G. F., MacIsaac, S. Low-molecular-weight heparin prophylaxis: preoperative versus postoperative initiation in patients undergoing elective hip surgery. Thrombosis research, 2001, 101, 1, p. V155–162.
53. Strebel, N., Prins, M., Agnelli, G., Buller, H. R. Preoperative or postoperative start of prophylaxis for venous thromboembolism with low-molecular-weight heparin in elective hip surgery? Archives of internal medicine, 2002, 162, 13, p. 1451–1456.
54. Geerts, W. H., Bergqvist, D., Pineo, G. F., Heit, J. A., Samama, C. M., Lassen, M. R., Colwell, C. W. Prevention of venous thromboembolism: American College of Chest Physicians Evidence--Based Clinical Practice Guidelines (8th Edition). Chest, 2008, 133, 6 Suppl., p. 381S–453S.
55. Huo, M. H., Spyropoulos, A. C. The eighth American college of chest physicians guidelines on venous thromboembolism prevention: implications for hospital prophylaxis strategies. J. Thromb. Thrombolysis, 2011, 31, 2, p. 196–208.
56. AWMF-Leitlinie Prophylaxe der venösen Thromboembolie (VTE). Dostupné na: http://www.awmf.org/leitlinien/detail/ll/003-001.html.
57. Sia, W. W., Powrie, R. O., Cooper, A. B., Larson, L., Phipps, M., Spencer, P., Sauve, N., Rosene-Montella, K. The incidence of deep vein thrombosis in women undergoing cesarean delivery. Thrombosis research, 2009, 123, 3, p. 550–555.
58. Bates, S. M., Greer, I. A., Pabinger, I., Sofaer, S., Hirsh, J. Venous thromboembolism, thrombophilia, antithrombotic therapy, and pregnancy: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest, 2008, 133, 6 Suppl., p. 844S–886S.
59. RCOG: Thrombosis and Embolism during Pregnancy and the Puerperium, Reducing the Risk (Green-top 37a).
60. Cyna, A. M., Andrew, M., Emmett, R. S., Middleton, P., Simmons, S. W. Techniques for preventing hypotension during spinal anaesthesia for caesarean section. Cochrane Database Syst. Rev., 2006, 4, CD002251.
61. Rout, C. C., Rocke, D. A., Levin, J., Gouws, E., Reddy, D. A reevaluation of the role of crystalloid preload in the prevention of hypotension associated with spinal anesthesia for elective Cesarean section. Anesthesiology, 1993, 79, 2, p. 262–269.
62. Wennberg, E., Frid, I., Haljamae, H., Wennergren, M., Kjellmer, I. Comparison of Ringer‘s acetate with 3% dextran 70 for volume loading before extradural caesarean section. Br. J. Anaesth., 1990, 65, 5, p. 654–660.
63. Butwick, A., Carvalho, B. The effect of colloid and crystalloid preloading on thromboelastography prior to Cesarean delivery. Can. J. Anaesth., 2007, 54, 3, p. 190–195.
64. Crino, J. P., Harris, A. P., Parisi, V. M., Johnson, T. R. Effect of rapid intravenous crystalloid infusion on uteroplacentalblood flow and placental implantation-site oxygen delivery in the pregnant ewe. Am. J. Obstet. Gynecol., 1993, 168, 5, p. 1603–1609.
65. Dyer, R. A., Farina, Z., Joubert, I. A., Du Toit, P., Meyer, M., Torr, G., Wells, K., James, M. F. Crystalloid preload versus rapid crystalloid administration after induction of spinal anaesthesia (coload) for elective caesarean section. Anaesth. Intensive Care, 2004, 32, 3, p. 351–357.
66. Teoh, W. H., Sia, A. T. Colloid preload versus coload for spinal anesthesia for cesarean delivery: the effects on maternal cardiac output. Anesthesia and analgesia, 2009, 108, 5, p. 1592–1598.
67. Carvalho, B., Mercier, F. J., Riley, E. T., Brummel, C.,Cohen, S. E. Hetastarch co-loading is as effective as pre-loading for the prevention of hypotension following spinal anesthesia for cesarean delivery. International journal of obstetric anesthesia, 2009, 18, 2, p. 150–155.
68. Siddik-Sayyid, S. M., Nasr, V. G., Taha, S. K., Zbeide, R. A., Shehade, J. M., Al Alami, A. A., Mokadem, F. H., Abdallah, F. W., Baraka, A. S., Aouad, M. T. A randomized trial comparing colloid preload to coload during spinal anesthesia for elective cesarean delivery. Anesthesia and analgesia, 2009, 109, 4, p. 1219–1224.
69. Ueyama, H., He, Y. L., Tanigami, H., Mashimo, T., Yoshiya, I.Effects of crystalloid and colloid preload on blood volume in the parturient undergoing spinal anesthesia for elective Cesarean section. Anesthesiology, 1999, 91, 6, p. 1571–1576.
70. Practice guidelines for obstetric anesthesia: an updated report by the American Society of Anesthesiologists Task Force on Obstetric Anesthesia. Anesthesiology, 2007, 106, 4, p. 843–863.
71. de La Chapelle, A., Benoit, S., Bouregba, M., Durand-Reville, M., Raucoules-Aime, M. The treatment of severe pulmonary edema induced by beta adrenergic agonist tocolytic therapywith continuous positive airway pressure delivered by face mask. Anesth. Analg., 2002, 94, 6, p. 1593–1594, table of contents.
72. Ngan Kee, W. D. Prevention of maternal hypotension after regional anaesthesia for caesarean section. Curr. Opin. Anaesthesiol., 2010, 23, 3, p. 304–309.
73. Ngan Kee, W. D., Khaw, K. S., Ng, F. F. Prevention of hypotension during spinal anesthesia for cesarean delivery: an effective technique using combination phenylephrine infusion and crystalloid cohydration. Anesthesiology, 2005, 103, 4, p. 744–750.
74. Wee, M. Y., Brown, H., Reynolds, F. The National Institute of Clinical Excellence (NICE) guidelines for caesarean sections: implications for the anaesthetist. Int. J. Obstet. Anesth., 2005, 14, 2, p. 147–158.
75. Bamber, J. H., Dresner, M. Aortocaval compression in pregnancy: the effect of changing the degree and direction of lateral tilt on maternal cardiac output. Anesth. Analg., 2003, 97, 1, p. 256–258, table of contents.
76. Magee, L. A., von Dadelszen, P. The management of severe hypertension. Seminars in perinatology, 2009, 33, 3, p. 138–142.
77. Magee, L. A., Lowe, S., Douglas, M. J., Kathirgamanathan, A.Therapeutics and anaesthesia. Best practice & research Clinical obstetrics & gynaecology, 2011, 25, 4, p. 477–490.
78. Vigil-De Gracia, P., Lasso, M., Ruiz, E., Vega-Malek, J. C., de Mena, F. T., Lopez, J. C. Severe hypertension in pregnancy: hydralazine or labetalol. A randomized clinical trial. European journal of obstetrics, gynecology, and reproductive biology, 2006, 128, 1–2, p. 157–162.
79. McCoy, S., Baldwin, K. Pharmacotherapeutic options for the treatment of preeclampsia. American journal of health-system pharmacy : AJHP : official journal of the American Society of Health-System Pharmacists, 2009, 66, 4, p. 337–344.
80. Podymow, T., August, P. Hypertension in pregnancy. Advan-ces in chronic kidney disease, 2007, 14, 2, p. 178–190.
81. Baggio, M. R., Martins, W. P., Calderon, A. C., Berezowski, A. T., Marcolin, A. C., Duarte, G., Cavalli, R. C. Changes in fetal and maternal Doppler parameters observed during acute severe hypertension treatment with hydralazine or labetalol: a randomized controlled trial. Ultrasound in medicine & biology, 2011, 37, 1, p. 53–58.
82. Magee, L. A., Abalos, E., von Dadelszen, P., Sibai, B., Easterling, T., Walkinshaw, S. How to manage hypertension in pregnancy effectively. British journal of clinical pharmacology, 2011, 72, 3, p. 394–401.
83. Chestnut, D. H. (ed.): Obstetric Anesthesia: Principles and Practice, 4 edn. Philadelphia: Mosby, Elsevier Inc., 2009.
84. Podymow, T., August, P. Antihypertensive drugs in pregnancy. Seminars in nephrology, 2011, 31, 1, p. 70–85.
85. Lowe, S. A., Brown, M. A., Dekker, G. A., Gatt, S., McLintock, C. K., McMahon, L. P., Mangos, G., Moore, M. P., Muller, P., Paech, M. et al. Guidelines for the management of hypertensive disorders of pregnancy 2008. The Australian & New Zealand journal of obstetrics & gynaecology, 2009, 49, 3, p. 242–246.
86. Bergum, D., Lonnee, H., Hakli, T. F. Oxytocin infusion: acute hyponatraemia, seizures and coma. Acta Anaesthesiol Scand, 2009, 53, 6, p. 826–827.
87. Dansereau, J., Joshi, A. K., Helewa, M. E., Doran, T. A., Lange, I. R., Luther, E. R., Farine, D., Schulz, M. L., Horbay, G. L., Griffin, P. et al. Double-blind comparison of carbetocin versus oxytocin in prevention of uterine atony after cesarean section. American journal of obstetrics and gynekology, 1999, 180, 3 Pt 1, p. 670–676.
88. Mukaddam-Daher, S., Yin, Y. L., Roy, J., Gutkowska, J., Cardinal, R. Negative inotropic and chronotropic effects of oxytocin. Hypertension, 2001, 38, 2, p. 292–296.
89. Svanstrom, M. C., Biber, B., Hanes, M., Johansson, G., Naslund, U., Balfors, E. M. Signs of myocardial ischaemia after injection of oxytocin: a randomized double-blind comparison of oxytocin and methylergometrine during Caesarean section. British journal of anaesthesia, 2008, 100, 5, p. 683–689.
90. Jonsson, M., Hanson, U., Lidell, C., Norden-Lindeberg, S. ST depression at caesarean section and the relation to oxytocin dose. A randomised controlled trial. BJOG : an international journal of obstetrics and gynaecology, 2010, 117, 1, p. 76–83.
91. Dogan, R., Birdane, A., Bilir, A., Ekemen, S., Tanriverdi, B. Frequency of electrocardiographic changes indicating myocardial ischemia during elective cesarean delivery with regional and general anesthesia: detection based on continuous Holter monitoring and serum markers of ischemia. Journal of clinical anesthesia, 2008, 20, 5, p. 347–351.
92. Dyer, R. A., Butwick, A. J., Carvalho, B. Oxytocin for labour and caesarean delivery: implications for the anaesthesiologist. Current opinion in anaesthesiology, 2011, 24, 3, p. 255–261.
93. Thomas, J. S., Koh, S. H., Cooper, G. M. Haemodynamic effects of oxytocin given as i.v. bolus or infusion on women undergoing Caesarean section. British journal of anaesthesia, 2007, 98, 1, p. 116–119.
94. Langesaeter, E., Rosseland, L. A., Stubhaug, A. Haemo-dynamic effects of repeated doses of oxytocin during Caesarean delivery in healthy parturients. British journal of anaesthesia, 2009, 103, 2, p. 260–262.
95. Abdul-Karim, R., Assali, N. S. Renal function in human pregnancy. V. Effects of oxytocin on renal hemodynamics and water and electrolyte excretion. The Journal of laboratory and clinical medicine, 1961, 57, p. 522–532.
96. Carvalho, J. C., Balki, M., Kingdom, J., Windrim, R. Oxytocin requirements at elective cesarean delivery: a dose-finding study. Obstetrics and gynekology, 2004, 104, 5 Pt 1, p. 1005–1010.
97. Butwick, A. J., Coleman, L., Cohen, S. E., Riley, E. T., Carvalho, B. Minimum effective bolus dose of oxytocin during elective Caesarean delivery. British journal of anaesthesia, 2010, 104, 3, p. 338–343.
98. Sartain, J. B., Barry, J. J., Howat, P. W., McCormack, D. I., Bryant, M. Intravenous oxytocin bolus of 2 units is superior to 5 units during elective Caesarean section. British journal of anaesthesia, 2008, 101, 6, p. 822–826.
99. Dyer, R. A., Reed, A. R., van Dyk, D., Arcache, M. J., Hodges, O., Lombard, C. J., Greenwood, J., James, M. F. Hemodynamic effects of ephedrine, phenylephrine, and the coadministration of phenylephrine with oxytocin during spinal anesthesia for elective cesarean delivery. Anesthesiology, 2009, 111, 4, p. 753–765.
100. Langesaeter, E., Dragsund, M., Rosseland, L. A. Regional anaesthesia for a Caesarean section in women with cardiac disease: a prospective study. Acta Anaesthesiol. Scand., 2010, 54, 1, p. 46–54.
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článek Anesteziologická problematika CT navigované ireverzibilní elektroporatizace(přístrojem NanoKnifeTM)Článek Portální biliopatieČlánek Doporučení pro použití infuzního podání inzulinu k léčbě hyperglykémie u nemocných v kritickém stavuČlánek Odpověď na dopisČlánek Kalendář nadcházejících akcíČlánek Z Newsletter č. 4
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2013 Číslo 2- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
-
Všetky články tohto čísla
- Porodnická analgezie z pohledu anesteziologa – zkušenosti z praxe ve Velké Británii
- Portální biliopatie
- Základní echokardiografické vyšetření hemodynamiky
- Fyziologie a patofyziologie stárnutí a stáří
- Barva moči – co bychom měli znát
- Doporučení pro použití infuzního podání inzulinu k léčbě hyperglykémie u nemocných v kritickém stavu
- XIX. kongres ČSARIM (Hradec Králové 13.–15. září 2012)
- Dostupnost transfuzních přípravků při neočekávaných masivních krevních ztrátách
- Odpověď na dopis
- Stanovisko Ústředí VZP ČR pro hodnocení umělé plicní ventilace jako podmínka pro vykazování OD resuscitační péče
- Kalendář nadcházejících akcí
- Z Newsletter č. 4
- Zápis z jednání výboru č. 1/2013
- Obstetric Anaesthesia and Analgesia Month Attributes – reálná zpráva o anesteziologické praxi na českých porodních odděleních
- Anesteziologická problematika CT navigované ireverzibilní elektroporatizace(přístrojem NanoKnifeTM)
- Expertní skupina porodnické anestezie a analgezie (ESPAA)
- Současné postupy v porodnické anestezii I. – peroperační péče u císařského řezu
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Barva moči – co bychom měli znát
- Současné postupy v porodnické anestezii I. – peroperační péče u císařského řezu
- Základní echokardiografické vyšetření hemodynamiky
- Fyziologie a patofyziologie stárnutí a stáří
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



