-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Preeklampsie, eklampsie, HELLP syndrom z pohledu anesteziologa
Pre-eclampsia, eclampsia and HELLP syndrome from the anaesthesiologist’s perspective
The text is a part of a series of articles by Expert Group of Obstetric Anesthesia and Analgesia (ESPAA) on current problems in obstetric anaesthesia. This article presents the current view of the treatment and anaesthesia practice and the consequences of pre-eclampsia, eclampsia and HELLP syndrome.
Keywords:
caesarean delivery – anaesthesia – pre-eclampsia – severe preeclampsia – eclampsia – HELLP syndrome
Autoři: Nosková Pavlína 1,2; Klozová Radka 1,3; Bláha Jan 1,2; Seidlová Dagmar 1,4; Štourač Petr 1,5
Působiště autorů: Expertní skupina porodnické anestezie a analgezie ČSARIM 1; Klinika anesteziologie, resuscitace a intenzivní medicíny, 1. lékařská fakulta Univerzity Karlovy v Prazea Všeobecná fakultní nemocnice v Praze 2; Klinika anesteziologie a resuscitace, 2. lékařská fakulta Univerzity Karlovy v Praze a Fakultní nemocnicev Motole 3; II. anesteziologicko-resuscitační oddělení Fakultní nemocnice Brno 4; Klinika anesteziologie, resuscitace a intenzivní medicíny, Lékařská fakulta Masarykovy univerzitya Fakultní nemocnice Brno 5
Vyšlo v časopise: Anest. intenziv. Med., 24, 2013, č. 5, s. 350-356
Kategorie: Expertní skupina porodnické anestezie a analgezie (ESPAA )
Souhrn
Text je součástí série článků Expertní skupiny porodnické anestezie a analgezie (ESPAA) zabývajících se aktuálními anesteziologickými problémy v porodnictví. Cílem článku je podat současný pohled na léčbu a vhodné anesteziologické postupy a konsekvenceu preeklampsie, eklampsie a HELLP syndromu.
Klíčová slova:
císařský řez – anestezie – preeklampsie – závažná preeklampsie – eklampsie – HELLP syndromeDEFINICE ONEMOCNĚNÍ
Preeklampsie je definována jako onemocnění vznikající po 20. týdnu gravidity, charakterizované hypertenzí a proteinurií. Před 20. týdnem gravidity se můžeme s hypertenzí, jako projevem preeklampsie setkat u hydatiformní moly nebo u neimunologického hydropsu plodu. Asi u 5 % žen dochází k manifestaci preeklampsie až v poporodním období, obvykle během 48 hodin po porodu [1, 2].
V diagnostice preeklampsie je třeba odlišit ostatní hypertenzní stavy, které se mohou v graviditě vyskytnout [3].
Eklampsie je záchvat tonicko-klonických křečí nebo bezvědomí během gravidity a časného šestinedělí u pacientek se známkami preeklampsie a při vyloučení neurologické příčiny.
HELLP (H – hemolysis, EL – elevated liver enzymes, LP – low platelets) syndrom je charakterizován hemolýzou, elevací jaterních enzymů a sníženým počtem trombocytů. Mezi porodníky stále nepanuje shoda, zda se jedná o samostatné onemocnění či o formu závažné preeklampsie. Nicméně ažu 15–20 % pacientek s HELLP syndromem se nevyskytuje hypertenze a proteinurie [3].
Chronická preexistující hypertenze (CHPH) je definována jako zvýšení krevního tlaku ≥ 140/90 mm Hg, které bylo přítomno už před těhotenstvím, nebo se objevilo před 20. týdnem gravidity.
Preeklampsie nasedající na CHPH je určena nově vzniklou proteinurií po 20. týdnu u žen s preexistující chronickou hypertenzí.
Gestační hypertenze představuje vzniklou hypertenzi po 20. týdnu bez známek proteinurie a dalších příznaků preeklampsie. K úpravě stavu dochází až do 12. týdne po porodu.
PATOFYZIOLOGIE A RIZIKOVÉ FAKTORY VZNIKU PREEKLAMPSIE
Preeklampsie patří mezi relativně běžné těhotenství komplikující stavy. Celosvětová incidence se pohybuje kolem 7,5 % všech těhotenství [4]. Pokud není od počátku správně diagnostikována a hlavně léčena, může se rozvinout v kritickou závažnou preeklampsii až eklampsii s rizikem zvýšené mateřské a novorozenecké mortality [5, 6]. Pacientky jsou ohroženy na životě hrozící abrupcí placenty, akutním renálním selháním, mozkovým krvácením, jaterním selháním, rupturou jater a disseminovanou intravaskulární koagulací (DIC). Ve světovém měřítku se preeklampsie podílí na 10–15 % mateřské mortality [7]. U novorozenců se předpokládají hlavně komplikace spojené s jejich nezralostí při předčasném porodu.
Patofyziologickým podkladem onemocnění jsou primárně změny endotelu cév placenty, které jsou zodpovědny za její hypoperfuzi s tvorbou antiangiogenních faktorů (solubilní fms – like tyrozin kináza, placentální růstový faktor) [8]. Tyto substance potom cirkulují v mateřském oběhu a způsobují systémovou dysfunkci endotelu, především v ledvinách [9].
Jako faktory, představující zvýšené riziko vzniku preeklampsie, byly na podkladě klinických studií identifikovány nuliparita, preeklampsie v minulém těhotenství, věk nad 40 let, věk pod 18 let, chronická hypertenze, chronické renální selhání, antifosfolipidový syndrom, trombofilie, vaskulitidy, diabetes melitus (i gestační), vyšší BMI, IUGR (intrauterinní růstová retardace), abrupce placenty, molla hydatidosa. Paradoxně kouření riziko vzniku preeklampsie snižuje [10].
Mechanismus vzniku eklamptických křečí není zcela jasný. Jedna z hypotéz hovoří o ztrátě autoregulace mozkových cév, která vede ke zvýšené perfuzi mozku spojené s vazogenním mozkovým edémem, a který následně vede ke sníženému průtoku krve mozkem. Další teorie je spojená s povšechným cévním vazospasmem, který je příčinou hypoperfuze a hypoxie postižených okrsků mozkové tkáně. Patologicko-anatomickým korelátem mohou být mnohočetné léze bílé a šedé hmoty mozkové [11].
DIAGNOSTICKÁ KRITÉRIA A DIFERENCIÁLNÍ DIAGNOSTIKA
Diagnostika preeklampsie bývá často velmi svízelná, projevy hypertenze a proteinurie mohou být variabilní [12]. Většina pacientek má mírnou preeklampsii (tab. 1), s mírnou proteinurií, doprovázenou periferními otoky. Při vyšším vzestupu krevního tlaku (≥ 160/110 mm Hg) a hlavně proteinurie > 5 g/24 hod, se již jedná o závažnou preeklampsii. Asi okolo 25 % žen s preeklampsií může mít alespoň jeden z těchto symptomů: perzistující silné bolesti hlavy, poruchy zraku (fotofobie, skotomy), bolesti břicha zejména v epigastriu, nauzeu, zvracení, oligurii, dyspnoi, retrosternální bolest a poruchy chování. V laboratorních nálezech může být přítomna hemokoncentrace, mikroangio-patická hemolytická anémie (elevace bilirubinu, přítomnost schistocytů, nízká hladina sérového haptoglobinu), trombocytopenie, elevace kreatininu a jaterních enzymů, proteinurie.
Tab. 1. Kritéria mírné vs. závažné preeklampsie 
V diferenciální diagnostice je třeba odlišit preeklampsii nasedající na preexistující chronickou hypertenzi, exacerbaci preexistujícího renálního onemocnění, antifosfolipidový syndrom, těhotenskou steatózu jater, hemolyticko-uremický syndrom (HUS), trombotickou trombocytopenickou purpuru (TTP) a akutní exacerbaci systémového lupus erythematodes (LE).
Laboratorní a klinická vyšetření
- Monitorování krevního tlaku (TK) v intervalech odpovídajících závažnosti hypertenze, tj. u velmi závažných forem je indikováno kontinuální invazivní monitorování arteriálního tlaku.
- Krevní obraz (trombocyty), kyselina močová, kreatinin, ionty, albumin, celková bílkovina, jaterní testy, glykémie, hemokoagulační vyšetření, laktátdehydrogenáza (LDH), hladiny magnezia a vápníku, clearance kreatininu, proteinurie kvantitativně, moč chemicky + sediment, (malonylaldehyd – nový marker, produkt peroxidace lipidů).
- Bilance tekutin v intervalech po 3 hodinách, u závažné preeklampsie hodinová diuréza.
- EKG, popř. oční pozadí.
V budoucnosti přichází v úvahu ke specifikaci diagnostiky preeklampsie měření hladin angiogenních faktorů, zatím však tato vyšetření nejsou dostupná [13, 14].
Indikace k ukončení těhotenství
Při neúspěšné konzervativní léčbě je nutné přistoupit k ukončení gravidity císařským řezem (SC). Hlavními indikacemi k tomu jsou přetrvávající silné bolesti hlavy, poruchy zraku, eklampsie, bolesti břicha (horní břišní kvadrant), elevace jaterních testů na dvojnásobek normy, přetrvávající těžká hypertenze přes maximální antihypertenzní terapii, oligurie pod 500 ml/24 hod, kreatinin nad 150 µg/l, trombocyty pod 100 000/mm3, abrupce placenty, patologické nálezy plodu (akutní hypoxie, IUGR).
Porod placenty vede k postupnému odeznění klinických příznaků. K mobilizaci tekutin ze třetího prostoru dochází typicky v průběhu 48 hodin po porodu [15]. Hypertenze se ještě může zhoršit do druhého týdne poporodního období, normalizace tlaku a kompletní úprava proteinurie nastává v průběhu až 4 týdnů.
ANESTEZIOLOGICKÝ MANAGEMENT
Pokud se uvažuje o operativním ukončení těhotenství, je třeba v anesteziologické rozvaze dodržovat následující principy (tab. 2).
Tab. 2. Volba anestezie k SC u preeklampsie 
Obecně je u preeklampsie z důvodu stabilizace oběhu preferována regionální anestezie [16], pokud to stav hemokoagulace dovolí. Rizikem CA je dále ještě zvýšené riziko obtížné intubace při edematózním prosáknutí oblasti hlavy a krku, a nebezpečí intrakraniálního krvácení při nekontrolované hypertenzi během úvodu do CA. Výhody a nevýhody jednotlivých metod uvádí tabulka 2.
Indikací celkové anestezie při závažné preeklampsii jsou především patologické hodnoty hemokoagulace (prodloužení INR, aPTT), trombocytopenie < 80 000/mm3, rozvoj HELLP syndromu s trombocytopenií a závažnou jaterní lézí, abrupce placenty a akutní hypoxie plodu. Snahou by mělo být dosažení cílového TK před úvodem do CA okolo 140/90 mm Hg (podrobněji viz [17]). Pokud není dostatek času k lepší korekci TK, je vhodné před úvodem do CA podat preventivní dávku labetalolu (bolus 10 mg). Alternativně lze podat remifentanil 1 µg/kg 30 vteřin před úvodem do CA k zajištění analgezie k intubaci a tím ke zlepšení hemodynamické stability během intubace a kožní incize. To je však možné na podkladě klinických studií pouze na pracovištích, kde je zajištěno vybavení pro resuscitaci novorozence [18–21].
Během operace je hlavní snahou stabilizace krevního tlaku, nejlépe pomocí labetalolu nebo hydralazinu, popř. urapidilu. U závažné preeklampsie je třeba dodržovat restrikční tekutinový režim, v případě běžných krevních ztrát je doporučován příjem tekutin maximálně 80 ml/hod. Důvodem je relativní intravaskulární deplece tekutin a riziko úniku tekutiny do třetího prostoru při sníženém onkotickém tlaku bílkovin. U závažné preeklampsie je nutno minimalizovat tekutinový příjem i během nástupu neuro-axiální blokády, kdy je doporučován bolus tekutin maximálně 500 ml krystaloidu a 250 ml koloidu. Prioritou ale samozřejmě je zabránění hypoperfuze placenty.
Součástí peroperační medikace je intravenózní podání magnezia, jako prevence vzniku eklamptických křečí a k zajištění stabilizace krevního tlaku. Magnezium je doporučováno jako lék první volby [22–25]. Doporučovaná dávka je bolus 4–6 g MgSO4 (10% nebo 20%) ve 100 ml FR během 10–20 minut, s následnou kontinuální aplikací v infuzi rychlostí 1–3 g/hod. Důležité je pokračovat v tomto podávání i v pooperačním období. Obavou některých porodníků bývá podávání magnezia v pooperačním období z důvodu tokolytického efektu, který by se mohl podílet na nebezpečí zvýšení pooperačního krvácení. Mírně zvýšené krvácení bylo popsáno pouze v jediné studii [25].
POOPERAČNÍ MANAGEMENT
Hlavním cílem pooperační péče je udržení TK v přijatelných hodnotách (140/90 mm Hg), a prevence křečí. Základním terapeutickým postupem v pooperační péči u pacientek s preeklampsií je proto kontinuální podávání magnezia. U mírné preeklamsie postačuje většinou 12hodinová aplikace [26], u závažné preeklampsie je nutná doba delší (viz dále).
Léčba hypertenze se řídí hlavně hodnotou diastolického krevního tlaku. Je-li TKDIA ≤ 110 mm Hg,zahajuje se monoterapie methyldopou p. o. 250 až 500 mg 1-0-1 až 2-0-2 tbl., při nedostatečném efektu kombinace s Ca blokátorem amlodipinem 5 mg 1-0-0 až 2-0-0 nebo s betablokátorem metoprololem 50 mg 1-0-1 až 2-0-2. Pokud je TKDIA ≥ 110 mm Hg,je nutné intravenózní podání labetalolu nebo dihydralazinu (tab. 3).
Tab. 3. Obecné principy anesteziologického postupu u preeklampsie 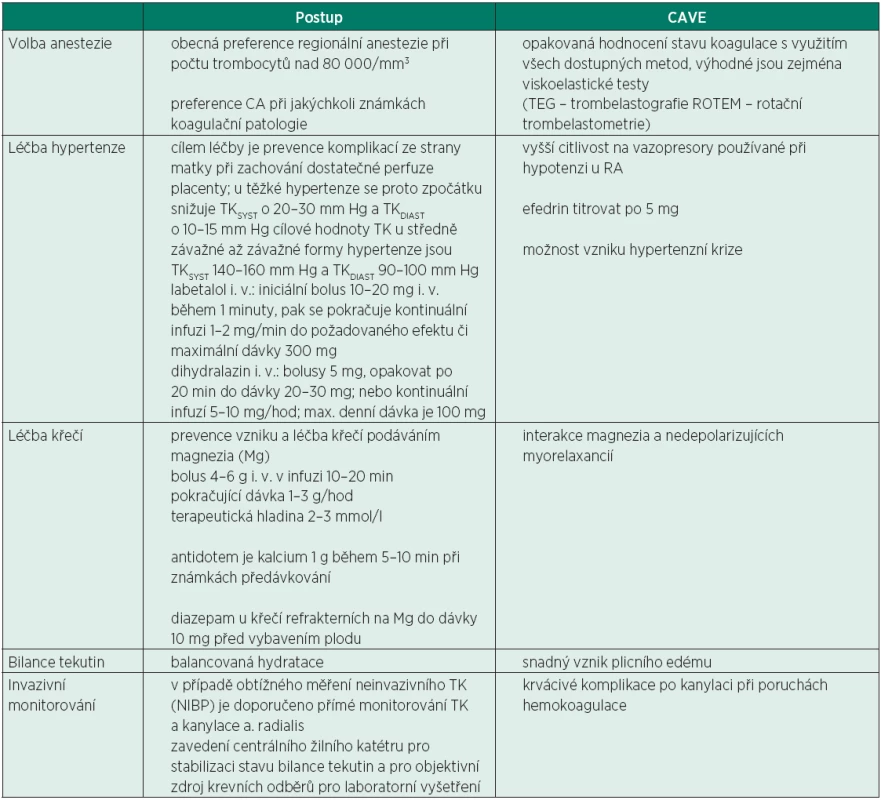
Ke standardnímu sledování patří kontrola laboratorních parametrů (krevní obraz, koagulace, celková bílkoviny a albumin), monitorováníe bilance tekutin a sledování otoků.
Předpokladem hemodynamické stability je kvalitní pooperační analgezie. V managementu pooperační analgezie se obecně v případě hepatopatie doporučuje vynechání nesteroidních antirevmatik. Při nedávném hodnocení rizika paracetamolu u pacientů s mírným až závažným jaterním poškozením Evropskou lékovou agenturou však nebylo zvýšené riziko hepatotoxicity paracetamolu u pacientů s jaterním poškozením jasně prokázáno [27]. Podávání NSA se u této skupiny pacientek jeví jako daleko rizikovější, proto primárním analgetikem i pro pacienty s preexistujícícm jaterním onemocněním zůstává paracetamol. Je ale potřeba zvýšené opatrnosti. Ta spočívá ve snížení dávek nebo prodloužení dávkovacího intervalu s dodržením maximální denní dávky pouze 2 g [27]. Závažná preeklampsie vyžaduje poporodní sledování minimálně 48 hod, prevenci křečí podáváním magnezia 1–3 g/hodinu je nutno zajistit 24–48 hodin po porodu. Maximální denní dávka magnezia je 30–40 g. U pacientek s renální insuficiencí (hodnota kreatininu nad 100 µmmol/l) se doporučuje bolusová dávka magnezia stejná jako u normální funkce ledvin, ale pokračovací kontinuální dávka je redukovaná na 1 g/hod. Pokud je hodnota kreatininu nad 200 µmol/l, aplikuje se pouze úvodní bolus a následná kontinuální infuze se nepodává. Současně s podáváním magnezia je vždy nutno monitorovat jeho případnou toxicitu, a to každé 4 hodiny hodnocením TK, patelárního reflexu, dechové frekvence, pulzní oxymetrií, hodinovou diurézou a laboratorní kontrolou hladin Mg (terapeutická hodnota Mg2+ je 2–3 mmol/l). Při známkách předávkování se jako antidotum podává kalcium 1 g během 5–10 minut. Do doby mobilizace tekutin se pokračuje v restrikčním tekutinovém režimu, tj. přívod tekutin činí maximálně okolo 80 ml/hod. [28].
Eklampsie
Eklampsie se klinicky projevuje jako závažná preeklampsie doprovázena záchvatem tonicko-klonických křečí. V našich podmínkách se nejčastěji vyskytuje u nesledovaných gravidit nebo u obtížně kompenzované závažné preeklampsie. Popisuje se i „eclampsia sine eclampsia“, což je rozvoj bezvědomí bez křečového stavu. Komplikace eklampsie zahrnují edém mozku, krvácení do CNS, děložní hypertonus s abrupcí placenty, DIC, kardiální selhání, hepatorenální selhání, ARDS, plicní edém, odchlípení sítnice. Vždy dochází k hypoxii plodu.
V diferenciální diagnostice je třeba odlišit především epilepsii, ale i epileptička může mít eklamptický zachvat (epilepsie – mydriáza a hyperreflexie vs. záchvat eklampsie – mióza a hyporeflexie). Dále je třeba vyloučit hypoglykemické kóma, konvulzivní stav ze zvýšeného nitrolebního tlaku, akutní pankreatitidu, předávkování kokainem či jinou drogou a otravy.
V první řadě je třeba léčit křečový stav. Lékem první volby je magnezium bolus 4–6 g i. v. ve 100 ml během 10–20 min, dále kontinuální infuze 1–2 g/hod. Při opakovaných křečích se podává další bolus 2 g MgSO4 během 10 min. Až lékem druhé volby je diazepam 2,5–5 mg nebo thiopental 25–50 mg i. v.
Postup léčby eklampsie uvádí tabulka 4.
Tab. 4. Léčebné ABCD u eklampsie 
Další postup je stejný jako u závažné preeklampsie, navíc je nutné dbát na zajištění průchodnosti dýchacích cest, prevenci aortokavální komprese a poranění matky během záchvatu. Pokud je indikováno operační ukončení císařským řezem, je vzhledem k neurologicky komplikovanému stavu preferována celková anestezie. Neuroaxiální blokádu lze podat pouze po stabilizaci stavu a při plném vědomí rodičky.
HELLP syndrom
HELLP syndrom představuje formu závažné preeklampsie a může se vyskytovat i bez ostatních známek preeklampsie. Incidence je 1 % všech gravidit a u 10–20 % závažných preeklampsií.
Nejčastější příčinou mortality v rámci tohoto syndromu je krvácení do CNS, zástava oběhu, DIC a ruptura jater. Patogeneze onemocnění je stále nejasná.
V klinickém obraze dominuje bolest epigastria, pravého hypogastria s propagací do pravé podklíčkové krajiny (n. phrenicus) nebo zad. Je přítomna nauzea, zvracení i bolest hlavy.
Alarmující je fakt, že až u 50 % případů HELLP syndromu nejsou klinické příznaky vyjádřeny. Hypertenze a proteinurie jsou přítomny v 85 % případů, ale je důležité, že v některých případech závažného HELLP syndromu také nemusí být přítomny [29].
Laboratorně nemoc potvrzuje trombocytopenie, ↑ ALT, ↑ AST, ↑ kyselina močová, ↑ LDH, ↑ přímý Hb. V mikroskopickém krevním nátěru jsou přítomny schistocyty.
Anesteziologický postup při SC je podobný jako u závažné preeklampsie, navíc je stav komplikován různě vyjádřenou trombocytopenií a možnost neuroaxiální blokády je tak právě počtem trombocytů omezena. Pokud je možná regionální blokáda, preferuje se subarachnoidální blokáda nebo jednorázová epidurální blokáda bez zavedení katétru. Důvodem je obtížné načasování extrakce katétru po operaci při postupující trombocytopenii. Antibiotika a analgetika jsou volena s ohledem na jaterní insuficienci. Substituce trombocytů k intubaci a SC je indikována při trombocytopenii pod 40 000/mm3 [29].
Ostatní peroperační a pooperační anesteziologický postup je shodný jako u závažné preeklampsie. V případě krvácivých komplikací se využívá k zamezení časové prodlevy maximální využití „bed side monitoringu“: Hemocue, TEG/ROTEM, orientační test srážení krve s trombinem. Nutností je včasné zajištění mražené plasmy a krevních derivátů včetně „trombo“ náplavů.
Diskutabilní je kortikoterapie u poklesu trombocytů pod 100 000/mm3, nejčastěji se používá dexametazon 2krát 10 mg á 12 hod, dále 5 mgá 12 hod do stabilizace laboratorních hodnot. Studie, které potvrzovaly zlepšení výsledků, však byly prováděné pouze na malých souborech pa-cientek [30–32]. Na druhé straně velké, randomizované studie nepotvrdily přínos kortikoterapie na zlepšení mateřského outcome, a tak je dnes tato indikace podávání kortikoidů značně diskutabilní [33–35].
ZÁVĚR
Neléčená preeklampsie může vyústit v život ohrožující stav. Je tedy nutné nepodcenit toto onemocnění a dodržovat doporučené standardy v léčbě. Často opomíjené bývá podávání magnezia v postačujících dávkách, zejména jeho kontinuální podávání dostatečně dlouhou dobu po ukončení gravidity. V případě HELLP syndromu je ještě více kladen důraz na dodržování bezpečnostních intervalů mezi aplikací LMWH a případnou regionální blokádou. Důvodem je větší riziko vzniku krvácivých příhod při současné trombocytopeniii.
Poznámka redakce: Přehledový článek reprezentuje stanovisko ESPA k uvedené problematice a neprošel standardním recenzním řízením.
Adresa pro korespondenci:
MUDr. Jan Bláha, Ph.D.
KARIM 1. LF UK a VFN v Praze
U Nemocnice 2
128 08 Praha 2
e-mail: jan.blaha@lf1.cuni.cz
Zdroje
1. Al-Safi, Z. et al. Delayed postpartum preeclampsia and eclampsia: demographics, clinical course, and complications. Obstet. Gynecol., 2011, 118 (5), p. 1102–1107.
2. Yancey, L. M. et al. Postpartum preeclampsia: emergency department presentation and management. J. Emerg. Med., 2011,40 (4), p. 380–384.
3. Helewa, M. E., et al. Report of the Canadian Hypertension Society Consensus Conference: 1. Definitions, evaluation and classification of hypertensive disorders in pregnancy. CMAJ, 1997, 157 (6), p. 715–725.
4. Wallis, A. B. et al. Secular trends in the rates of preeclampsia, eclampsia, and gestational hypertension. United States 1987–2004. Am. J. Hypertens., 2008, 21 (5), p. 521–526.
5. Hutcheon, J. A., Lisonkova, S., Joseph, K. S. Epidemiology of pre-eclampsia and the other hypertensive disorders of pregnancy. Best Pract. Res. Clin. Obstet. Gynaecol., 2011, 25 (4), p. 391–403.
6. Sibai, B. M. et al. What we have learned about preeclampsia. Semin. Perinatol., 2003, 27 (3), p. 239–246.
7. Duley, L. The global impact of pre-eclampsia and eclampsia. Semin. Perinatol., 2009, 33 (3): p. 130–137.
8. Meekins, J. W. et al. A study of placental bed spiral arteries and trophoblast invasion in normal and severe pre-eclamptic pregnancies. Br J Obstet Gynaecol, 1994. 101(8): p. 669-74.
9. Maynard, S. E., Karumanchi, S. A. Angiogenic factors and preeclampsia. Semin. Nephrol., 2011, 31 (1), p. 33–46.
10. Duckitt, K., Harrington, D. Risk factors for pre-eclampsia at antenatal booking: systematic review of controlled studies. BMJ, 2005, 330 (7491), p. 565.
11. Štourač, P. Eklampsie. In Pařízek A. Kritické stavy v porodnictví. Praha: Galén 2012, s. 79–81.
12. Sibai, B. M. Maternal and uteroplacental hemodynamics for the classification and prediction of preeclampsia. Hypertension, 2008, 52, 5, p. 805–806.
13. Verlohren, S., Stepan, H., Dechend, R. Angiogenic growth factors in the diagnosis and prediction of pre-eclampsia. Clin. Sci. (Lond)., 2012, 122, 2, p. 43–52.
14. Stepan, H. et al. Use of angiogenic factors (sFlt-1/PlGF ratio) to confirm the diagnosis of preeclampsia in clinical routine: first experience. Z Geburtshilfe Neonatol., 2010, 214, 6, p. 234–248.
15. Podymow, T., August, P. Postpartum course of gestational hypertension and preeclampsia. Hypertens. Pregnancy, 2010, 29, 3, p. 294–300.
16. Wallace, D. H. et al. Randomized comparison of general and regional anesthesia for cesarean delivery in pregnancies complicated by severe preeclampsia. Obstet. Gynecol., 1995, 86, 2, p. 193–199.
17. Bláha, J. et al. Současné postupy v porodnické anestezii I. – peroperační péče u císařského řezu. Anest. intenziv. Med., 2013, 24, 2, p. 91–101.
18. Yoo, K. Y. et al. A dose-response study of remifentanil for attenuation of the hypertensive response to laryngoscopy and tracheal intubation in severely preeclamptic women undergoing caesarean delivery under general anaesthesia. Int. J. Obstet. Anesth., 2013, 22, 1, p. 10–18.
19. Park, B. Y. et al. Dose-related attenuation of cardiovascular responses to tracheal intubation by intravenous remifentanil bolus in severe pre-eclamptic patients undergoing Caesarean delivery. Br. J. Anaesth., 2011, 106, 1, p. 82–87.
20. Yoo, K. Y. et al. Effects of remifentanil on cardiovascular and bispectral index responses to endotracheal intubation in severe pre-eclamptic patients undergoing Caesarean delivery under general anaesthesia. Br. J. Anaesth., 2009, 102, 6, p. 812–819.
21. Richa, F. et al. General anesthesia with remifentanil for Cesarean section in a patient with HELLP syndrome. Acta Anaesthesiol. Scand., 2005, 49, 3, p. 418–420.
22. Magee, L. A. et al. Diagnosis, evaluation, and management of the hypertensive disorders of pregnancy. J. Obstet. Gynaecol. Can., 2008, 30, 3 Suppl, p. S1–48.
23. Altman, D. et al. Do women with pre-eclampsia, and theirbabies, benefit from magnesium sulphate? The Magpie Trial: a randomised placebo-controlled trial. Lancet, 2002, 359, 9321, p. 1877–1890.
24. Lucas, M. J., Leveno, K. J., Cunningham, F. G. A comparison of magnesium sulfate with phenytoin for the prevention of eclampsia. N. Engl. J. Med., 1995, 333, 4, p. 201–205.
25. Belfort, M. A. et al. A comparison of magnesium sulfate and nimodipine for the prevention of eclampsia. N. Engl. J. Med., 2003, 348, 4, p. 304–311.
26. Ehrenberg, H. M., Mercer, B. M. Abbreviated postpartum magnesium sulfate therapy for women with mild preeclampsia: a randomized controlled trial. Obstet. Gynecol., 2006, 108, 4, p. 833–838.
27. Nežádoucí účinky léčiv – paracetamol, přehled účinnnosti a bezpečnosti. Informační zpravodaj Státního ústavu pro kontrolu léčiv, 2012, 5, 10, s. 2–3.
28. Preeclampsia a management, květen 2013. Dostupné z www: http://www.uptodate.com/contents/preeclampsia-management-and-prognosis?source=search_result&search=preeclampsia+management&selectedTitle=1~150.
29. Sibai, B. M. Diagnosis, controversies, and management of the syndrome of hemolysis, elevated liver enzymes, and low platelet count. Obstet. Gynecol., 2004, 103, 5 Pt, 1, p. 981–991.
30. O’Brien, J. M. et al. Maternal benefit of corticosteroid therapy in patients with HELLP (hemolysis, elevated liver enzymes, and low platelet count) syndrome: impact on the rate of regional anesthesia. Am. J. Obstet. Gynecol., 2002, 186, 3, p. 475–479.
31. Matchaba, P., Moodley, J. Corticosteroids for HELLP syndrome in pregnancy. Cochrane Database Syst. Rev., 2004, 1, p. CD002076.
32. Martin, J. N., Jr. et al. Maternal benefit of high-dose intravenous corticosteroid therapy for HELLP syndrome. Am. J. Obstet. Gynecol., 2003, 189, 3, p. 830–834.
33. Fonseca, J. E. et al. Dexamethasone treatment does not improve the outcome of women with HELLP syndrome: a double-blind, placebo-controlled, randomized clinical trial. Am. J. Obstet. Gynecol., 2005, 193, 5, p. 1591–1598.
34. Katz, L. et al. Postpartum dexamethasone for women with hemolysis, elevated liver enzymes, and low platelets (HELLP) syndrome: a double-blind, placebo-controlled, randomized clinical trial. Am. J. Obstet. Gynecol., 2008, 198, 3, p. 283 e1–8.
35. Woudstra, D. M. et al. Corticosteroids for HELLP (hemolysis, elevated liver enzymes, low platelets) syndrome in pregnancy. Cochrane Database Syst. Rev., 2010(9): p. CD008148.
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článek ErrataČlánek Výborová schůze ČSARIM
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2013 Číslo 5- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
-
Všetky články tohto čísla
- Programové prohlášení výboru České společnosti intenzivní medicíny na období 2013–2016
- Způsoby celkové anestezie a svalové relaxace v oblastní a fakultní nemocnici – tříměsíční bicentrická observační studie
- Alternativní mininvazivní přístupy při náhradě kalcifikované aortální chlopně
- Errata
- Využití kapilární elektroforézy pro stanovení kyseliny mravenčí v séru po intoxikaci metanolem – kazuistika
- Aplikace ultrazvuku u příjmu traumata nejasných šokových stavů (FAST)
- Syndrom multiorgánové dysfunkce
- Projekt Domácí umělá plicní ventilace
- Co to je chladová diuréza a proč nelze u hypotermických pacientů považovat „dostatečnou“ diurézu jako klinický ukazatel vylučující případnou hypovolémii/renální hypoperfuzi
- Stanovisko k používání syntetických koloidních roztoků na bázi hydroxyetyl škrobu
- Komentář k Guidelines for the early management of patients with acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association/American Stroke Association
- Preeklampsie, eklampsie, HELLP syndrom z pohledu anesteziologa
-
Skórovací schémata hodnocení sedace a výskytu deliria
I. Přehled skórovacích systémů hloubky sedace na JIP -
Skórovací schémata hodnocení sedace a výskytu deliria
II. Skórovací systémy pro hodnocení výskytu deliria na JIP - Výborová schůze ČSARIM
- Zápis z jednání výboru ČSIM č. 3/2013
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle-
Skórovací schémata hodnocení sedace a výskytu deliria
I. Přehled skórovacích systémů hloubky sedace na JIP - Syndrom multiorgánové dysfunkce
- Preeklampsie, eklampsie, HELLP syndrom z pohledu anesteziologa
- Aplikace ultrazvuku u příjmu traumata nejasných šokových stavů (FAST)
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



